Význam S100A4 proteinu v patogenezi revmatoidní artritidy
Authors:
L. Ošlejšková; L. Šenolt
Authors‘ workplace:
Revmatologický ústav, 1. lékařská fakulta, Univerzita Karlova, Praha
Published in:
Čes. Revmatol., 15, 2007, No. 3, p. 146-151.
Category:
Overview Reports
Overview
S100A4 patří do proteinové rodiny „S100“, která zahrnuje více než 25 nízkomolekulárních proteinů podílejících se na regulaci řady buněčných procesů. S100A4 se účastní regulace buněčné motility, proliferace, apoptózy, angiogeneze a remodelace extracelulární matrix. Funkce S100A4 je spojována s metastazováním a tento protein je navíc považován za významný prognostický marker některých nádorových onemocnění. Jeho přítomnost byla nově zjištěna také v proliferujících synoviálních fibroblastech u revmatoidní artritidy (RA). Zvýšená exprese S100A4 proteinu byla potvrzena také v synoviální tkáni pacientů s RA ve srovnání s kontrolní a artrotickou synoviální tkání. Protein byl v synoviální tkáni exprimován i v místech destrukce kloubní chrupavky. S100A4 je tvořen nejen synoviálními fibroblasty, ale i buňkami imunitního systému a endoteliálními buňkami cév. U RA byla zjištěna zvýšená koncentrace bioaktivního oligomeru S100A4 nejen lokálně v zánětlivé tkáni, ale také v plazmě a synoviální tekutině. U synoviálních fibroblastů byl podobně jako u tumorů pozorován vliv oligomeru S100A4 na produkci enzymů degradujících matrix – metaloproteináz a vliv na biologickou funkci tumor supresorového proteinu p53. Ze současných znalostí lze předpokládat, že zvýšené hladiny S100A4 mohou ovlivňovat agresivní chování fibroblastů a celkově tak mohou přispívat k patogenezi chronických autoimunitních zánětlivých onemocnění.
Klíčová slova:
revmatoidní artritida, S100A4, apoptóza, enzymy degradující matrix, synoviální fibroblasty
Úvod
S100 rodina je tvořena více než 25 nízkomolekulárními kyselými proteiny o molekulové hmotnosti 10–12 kDa. Poprvé byly identifikovány a popsány v hovězím mozku a na základě rozpustnosti ve 100% roztoku amonium sulfátu označeny jako S100 (1). Charakteristickým znakem S100 proteinů jsou dva strukturální motivy, tzv. EF- vazebné domény, které s různou afinitou váží kalcium (2). Vazba kalcia vede ke strukturálním změnám, díky nímž mohou S100 proteiny navázat cílovou molekulu (3). Vedle kalcia jsou to také ionty zinku a mědi, které svou vazbou ovlivňují strukturu a působení některých S100 proteinů (4).
S100 proteiny vykazují své biologické funkce jak v intracelulárním prostředí, tak extracelulárně. Zatímco uvnitř buněk jsou v převážné většině přítomny ve formě homodimerů a heterodimerů, v podmínkách extracelulárního prostředí se vyskytují jako oligomery nebo multimery. Popsány byly např. heterotetramery proteinů S100A8/S100A9 (5, 6), hexamery S100A12 proteinu (5, 7) nebo tetra- a multimery S100A4 proteinu (8). Většina S100 proteinů se vyskytuje intracelulárně a podílí se na regulaci řady buněčných procesů, mezi něž patří např. proliferace, apoptóza, buněčná motilita a remodelace extracelulární matrix (9). S100 proteiny uvolněné do extracelulárního prostředí se svým chováním podobají cytokinům. Některé z nich se účastní regulace buněčných dějů prostřednictvím receptoru RAGE (10, 11), avšak v současnosti se stávají předmětem výzkumu i další receptory, u kterých se předpokládá možná asociace s některými S100 proteiny (12).
Modifikovaná exprese S100 proteinů byla dokumentována u mnoha onemocnění jako jsou neurodegenerativní a kardiovaskulární onemocnění, zánětlivá onemocnění, diabetes mellitus, alergie či tumory (9). Ze všech dosud známých S100 proteinů tvoří poměrně velkou skupinu proteiny, jejichž zvýšená exprese je spojována s řadou nádorových onemocnění (S100A1, S100A4, S100A6, S100A7 a S100B). Kromě této skupiny byla uvnitř S100 rodiny identifikována trojice proteinů charakteristická účastí při aktivaci zánětu a imunitního procesu (S100A8, S100A9 a S100A12). Obecně se předpokládá, že v průběhu nádorového bujení hraje podstatnou úlohu aktivace zánětlivých buněk a imunitního systému (13). Z prací zabývajících se výzkumem S100 proteinů lze usuzovat, že tyto proteiny by mohly tvořit určitý spojovací článek mezi chronickým zánětem a tumory. Důkazem je např. S100A4 protein, který byl donedávna spojován pouze s některými nádory (14–16). Nejnovější poznatky však prokázaly jeho zvýšenou expresi u revmatoidní artritidy a vztah k patogenezi této chronické autoimunitní choroby (8, 17, 18). Cílem této práce je shrnout a diskutovat současné poznatky o S100A4 proteinu ve vztahu k tumorům a zánětu.
Obecná charakteristika S100A4 proteinu
S100A4 (metastasin, pEL, p9Ka, FspI, CAPL, calvasculin) je termolabilní kyselý protein o molekulové hmotnosti 11-kD původně izolovaný u myší jako gen tvořený metastatickými buňkami adenokarcinomu mléčné žlázy (19). Přítomnost S100A4 byla potvrzena v zanedbatelném množství také ve zdravé tkáni, avšak jeho fyziologická funkce nebyla dosud plně objasněna (20, 21).
U myší je známo, že intracelulární S100A4 může být tvořen buňkami hladkých svalů, epiteliálními buňkami, endoteliálními buňkami krevních cév, hnědou tukovou tkání, buňkami jater, parietálními buňkami žaludku, neurony a některými imunitními buňkami ve slezině, brzlíku a kostní dřeni (21, 22). Bylo zjištěno, že S100A4 je tvořen makrofágy, dendritickými buňkami, žírnými buňkami (mastocyty), neutrofily, určitými typy T-lymfocytů, pericyty a také synoviálními fibroblasty ve stadiu chronického zánětu (8). Funkční protein může vytvářet homodimery (S100A4/S100A4), heterodimery (S100A4/S100A1) a nebo oligomery či multimery (24, 25). Regulace buněčných procesů se účastní prostřednictvím vazby na cílové molekuly jako jsou nesvalový myosin II (26) a liprin β1 (27), které hrají důležitou roli v buněčné adhezi a motilitě. Neméně významná je vazba S100A4 na tumor supresorový protein p53 a následná regulace programované buněčné smrti – apoptózy (20, 26, 28, 29). Dále byl prokázán vliv extracelulárního S100A4 na angiogenezi (32) a na produkci proteolytických enzymů, které se podílejí na remodelaci extracelulární matrix (18, 33). Extracelulární S100A4 může stimulovat růst neuritu primárních hipokampálních neuronů (30) a migraci astrocytických tumorových buněk (31). Byla pozorována také negativní regulace mineralizace extracelulární matrix (34).
Význam S100A4 ve vztahu k nádorovým onemocněním
Tvorba tumorů a šíření metastáz je rozsáhlý a komplexní proces, kterého se účastní množství regulačních molekul. Jednou z nich je S100A4 protein, jehož vztah k metastázám a tumorům byl podrobně studován jak u transgenních myší (16), tak u člověka (14, 15).
Intracelulární S100A4 se váže na cytoskeletální struktury a reguluje tak motilitu nádorových buněk. U metastatických buněk bylo zjištěno, že interakce S100A4 s těžkým řetězcem nesvalového myosinu vede ke změnám dynamiky myosinu (35, 36). Podobně, interakce mezi S100A4 a nesvalovým tropomyosinem má za následek rozklad aktinových filament (20).
Dalším předpokladem pro tvorbu metastáz je oddělení buněk z nádoru, vstup do krevního řečiště a adheze k okolním buňkám a matrix. To se děje za účasti adhezivních molekul jako jsou například laminin a E-cadherin. U myších i lidských tumorů byla prokázána inverzní korelace mezi expresí S100A4 a transmembránovým glykoproteinem E-cadherinem. Bylo zjištěno, že invazivní chování nádorových buněk exprimujících S100A4 by mohlo být navozeno utlumením exprese E-cadherinu (37, 38). In vivo pokusy odhalily specifickou vazbu S100A4 na transmembránový protein liprin β1, který je jedním z článků signální kaskády regulující buněčnou adhezi (27).
Podrobně studován byl také vztah mezi S100A4 a tumor supresorovým proteinem p53, jenž je považován za jeden z nejvýznamnějších faktorů regulujících buněčný cyklus. Narozdíl od normálního (wild) typu p53, jehož množství je v nemutovaných buňkách nízké, dochází v transformovaných a nádorových buňkách k jeho signifikantnímu nárůstu.V buňkách exprimujících S100A4 bylo zjištěno zvýšené množství proteinu p53 (39). Experimenty na buněčných liniích produkujících normální protein p53 ukázaly, že indukce S100A4 v těchto buněčných liniích má vliv na expresi genů regulovaných p53 proteinem, jako jsou například p21/WAF a bax (28). Zvýšení apoptózy vlivem vazby proteinu S100A4 na p53 může vést ke ztrátě funkce normálního typu p53, což se může projevit nadbytkem mutovaného p53 a vývojem agresivního buněčného fenotypu v počátcích nádorové progrese (28). U myší s inaktivovaným genem pro S100A4, které byly vystaveny gama záření, byla pozorována redukce apoptózy (40). Experimenty na myších tumorech prokázaly pozitivní vliv extracelulárního S100A4 na přežívání nádorových buněk způsobené snížením exprese bax. Nebyl potvrzen rozdílný efekt dimerů a oligomerů S100A4 na expresi bax a překvapivě nebyl pozorován žádný vliv S100A4 na expresi p21/waf (41).
Další podmínkou pro růst nádoru a metastazování je angiogeneze. Ta je ovlivňována S100A4 proteinem prostřednictvím regulace exprese trombospondinu 1 (42) a enzymů degradujících matrix – např. MMPs (28, 33, 41, 43). Experimenty založené na stimulaci endotelových buněk oligomerní formou S100A4 proteinu odhalily sníženou expresi genu pro trombospondin 1 (28, 41). Pokusy in vitro dále ukázaly, že S100A4 oligomer indukuje chemotaktickou motilitu endotelových buněk a tak může přispívat k angiogenezi. In vivo indukuje S100A4 neovaskularizaci rohovky (41). Vztah S100A4 k MMPs byl potvrzen u endoteliálních buněk, u nichž byla po stimulaci extracelulárním S100A4 detekována zvýšená exprese MMP-13. Naopak snížení hladiny mRNA MMP-2, MMP-14 a TIMP-1 následovalo po snížení exprese S100A4 u buněčné linie metastazujících buněk (44). Podobné výsledky byly dokumentovány i pro MMP-9 (45). Poznatky o roli S100A4 v progresi nádorových onemocnění nashromážděné za poslední desetiletí dokazují, že S100A4 má nezanedbatelný podíl na agresivním a invazivním chování nádorových buněk a tvorbě metastáz (46).
Význam S100A4 v patogenezi revmatoidní artritidy
Revmatoidní artritida (RA) je chronické zánětlivé onemocnění, charakterizované infiltrací kloubní tkáně zánětlivými buňkami, hypertrofií synoviální membrány a progresivními erozemi kostí a chrupavky. Přehledné práce z poslední doby shrnují význam synoviálních fibroblastů v patogenezi RA (47, 48).
U proliferujících synoviálních fibroblastů od pacientů s RA byla prokázána zvýšená exprese některých genů, mimo jiné i S100A4 (49). Narozdíl od zdravé kontrolní tkáně byla S100A4 mRNA zjištěna v RA synoviální tkáni. S100A4 mRNA byla exprimována v intersticiu i povrchové synoviální intimně. Nám se podařilo prokázat zvýšené množství S100A4 proteinu v synoviální tkáni, ale také v synoviální tekutině i plazmě pacientů s RA oproti jedincům s osteoartrózou (8, 18) (obr. 1). Odlišnosti byly zjištěny také ve formě S100A4 vyskytujícího se v plazmě a synoviální tekutině. Zatímco u pacientů s RA byl S100A4 přítomen ve formě bioaktivních oligomerů, u pacientů s OA se většina S100A4 vyskytovala ve formě dimerů. Narozdíl od některých dalších S100 proteinů aktivně se účastnících zánětlivých procesů (S100A7, S100A8, S100A9 a S100A12) je S100A4 exprimován většinou buněk synoviální tkáně – synoviálními fibroblasty, imunitními buňkami i buňkami cévního endotelu.
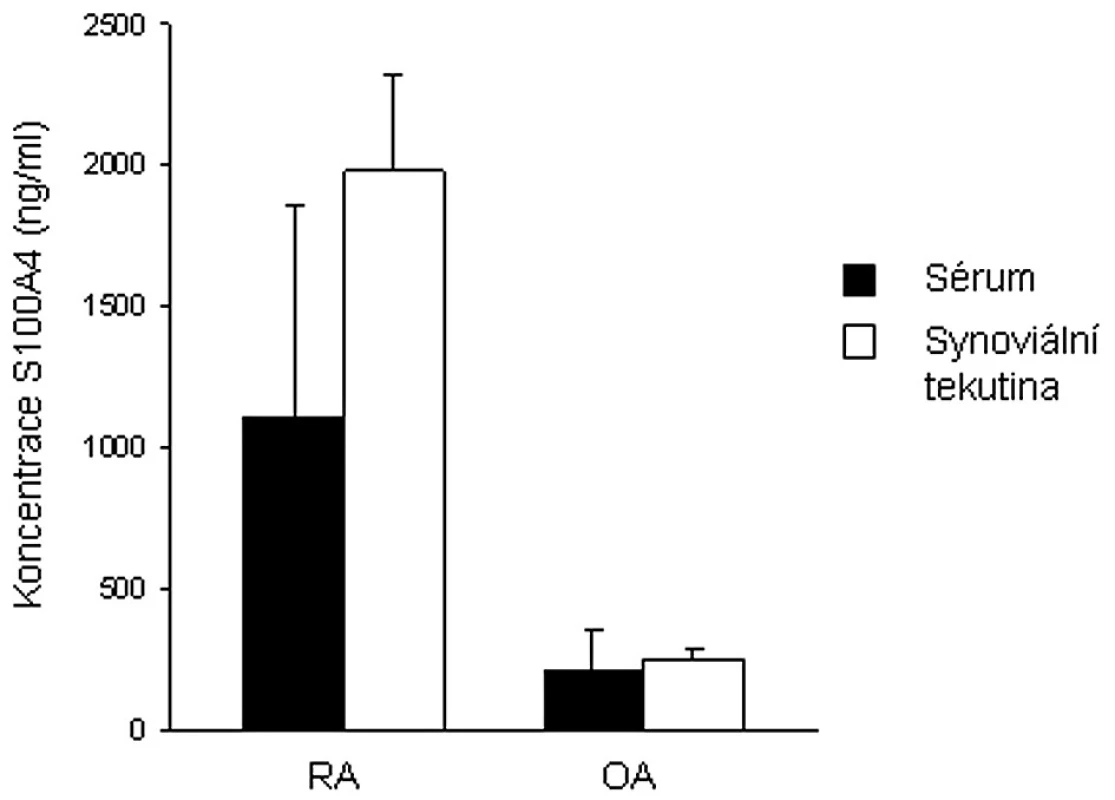
U synoviálních fibroblastů, podobně jako u buněk nádorového typu, stimuluje extracelulární S100A4 tvorbu některých MMPs. Zvýšená exprese byla potvrzena pro MMP-1, MMP-3, MMP-9 a MMP-13 (18). V místech RA synoviální tkáně byla pozorována zvýšená exprese proteinu p53 oproti OA synoviální tkáni (8). Extracelulární S100A4 oligomer navodil stabilizaci tumor supresorového proteinu p53, jeho fosforylaci v místě aminokyseliny Ser37 a tím transkripci cílových genů proteinu p53 (bcl-2, p21/WAF a HDM2), které se podílejí na regulaci buněčné proliferace a apoptózy (8). Přesná úloha proteinu S100A4 a jeho bližší vliv na apoptózu či proliferaci buněk synoviální tkáně musí být ještě blíže prozkoumán.
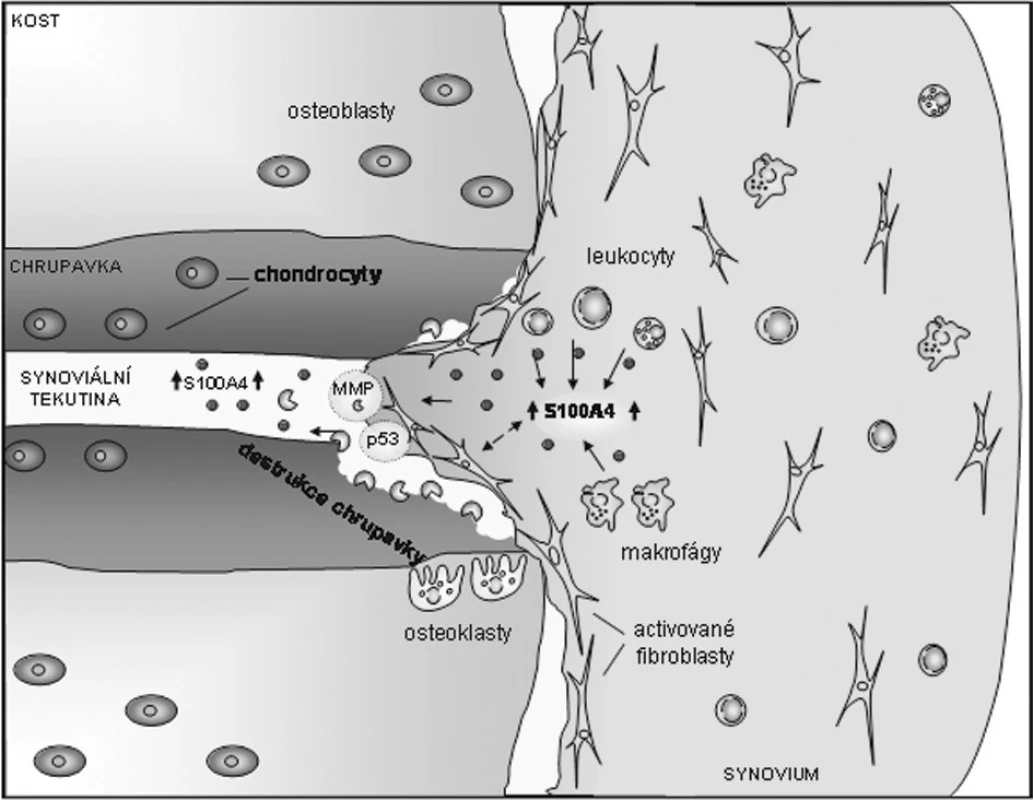
Na základě současných znalostí o S100A4 a jeho vztahu k RA lze konstatovat, že se S100A4 vyskytuje ve zvýšeném množství nejen lokálně v místě zánětu, ale také systémově v krevním oběhu. S100A4 je exprimován synoviálními fibroblasty a zánětlivými buňkami v místech destrukce kloubní chrupavky, kde může fungovat jako důležitý prvek regulující buněčnou apoptózu, proliferaci a produkci MMPs (obr. 2). Jedna z nejnovějších prací zaměřených na S100A4 prokázala pomocí imunohistochemických barvení a imunoblottingu přítomnost S100A4 v artrotické chrupavce a lidských chondrocytech, zatímco u normální tkáně a buněk nebyl S100A4 přítomen. U chondrocytů bylo navíc potvrzeno, že extracelulární S100A4 stimuluje produkci MMP-13 a na přenosu signálu se účastnil receptor pro pokročilé glykační produkty (RAGE). S100A4 indukovaná aktivace RAGE měla za následek aktivaci NF-κB a produkci reaktivních kyslíkových radikálů (50).
Závěr
Za poslední desetiletí byl zaznamenán velký pokrok ve studiu biologického významu S100A4 proteinu ve vztahu k progresi nádorových onemocnění. Nejedna práce byla věnována interakcím S100A4 s jeho cílovými molekulami a následné aktivaci buněčných signálních drah ovlivňujících remodelaci extracelulární matrix, adhezivní chování a motilitu buněk, angiogenezi, buněčnou proliferaci a apoptózu.
Důležitým poznatkem bylo nalezení spojitosti mezi metastatickou aktivitou nádorových buněk a invazivním chováním synoviálních fibroblastů u RA. Podobně jako v případě nádorů byla objevena zvýšená hladina S100A4 v synoviální tkáni a tělních tekutinách u pacientů s RA. In vitro studie navíc prokázaly vliv S100A4 na zvýšenou produkci matrix degradujících enzymů a dokumentovaly ovlivnění tumor supresorového proteinu p53, což může mít významné postavení při aktivaci chronického zánětu. Pro přesné pochopení role S100A4 v zánětlivých procesech vedoucích k synoviální hyperplazii a zánětu je třeba dalších studií.
Poděkování
Tato práce byla podpořena grantem IGA MZ ČR – NR/9082-4.
Mgr. Lucie Ošlejšková
Revmatologický ústav
Na Slupi 4
128 50 Praha 2
e-mail: seno@revma.cz
Sources
1. Moore, B. W. A soluble protein characteristic of the nervous system. Biochem Biophys Res Commun 1965;19: 739–44.
2. Isobe T, Okuyama T. The amino-acid sequence of S-100 protein (PAP I-b protein) and its relation to the calcium-binding proteins. Eur J Biochem 1978;89:379–88.
3. Santamaria-Kisiel L, Rintala-Dempsey AC, Shaw GS. Calcium-dependent and-independent interactions of the S100 protein family. Biochem J 2006;396:201–14.
4. Heizmann CW, Cox JA. New perspectives on S100 proteins: a multi-functional Ca(2+)-, Zn(2+)- and Cu(2+)-binding protein family. Biometals 1998;11:383–97.
5. Strupat K, Rogniaux H, Van Dorsselaer A, Roth J, Vogl T. Calcium-induced noncovalently linked tetramers of MRP8 and MRP14 are confirmed by electrospray ionisation-mass analysis. J Am Soc Mass Spectrom 2000;11:780–788.
6. Vogl T, Leukert N, Barczyk K, Strupat K, Roth J. 2006. Biophysical characterization of S100A8 and S100A9 in the absence and presence of bivalent cations. Biochem Biophys Acta 1763:1298–306.
7. Moroz OV, Antson AA, Dodson EJ, et al. The structure of S100A12 in a hexameric form and its proposed role in receptor signalling. Acta Crystallogr D Biol Crystallogr 2002;58:407–13.
8. Klingelhofer J, Senolt L, Baslund B, et al. Up-regulation of metastasis-promoting S100A4 (Mts 1) in Rheumatoid Arthritis: putative involvement in the pathogenesis of RA. Arthritis Rheum 2007 Mar; 56:779–89.
9. Donato R. Intracellular and extracellular roles of S100 proteins. Microsc Res Tech 2003;60:540–51.
10. Huttunen HJ, Kuja-Panula J, Sorci G, Agneletti AL, Donato R, Rauvala H. 2000. Coregulation of neurite outgrowth and cell survival by amphoterin and S100 proteins through RAGE activation. J Biol Chem 275: 40096–40105.
11. Hofmann MA, Drury S, Fu C, Qu W, Taguchi A, Lu Y, et al. RAGE mediates a novel proinflammatory axis: a central cell surface receptor for S100/calgranulin polypeptides. Cell 1999;97:889–901.
12. Robinson MJ, Tessier P, Poulsom R, Hogg N. The S100 family heterodimer, MRP-8/14, binds with high affinity to heparin and heparan sulfate glycosaminoglycans on endothelial cells. J Biol Chem 2002;277: 3658–65.
13. Marx J. Inflammation and cancer: the link grows stronger. Science 2004;306:966–8.
14. Lee WY, Su WC, Lin PW, Guo HR, Chang TW, Chen HH. Expression of S100A4 and Met: potential predictors for metastasis and survival in early stage breast cancer. Oncology 2004;66:429–38.
15. Gupta S, Hussain T, MacLennan GT, Fu P, Patel J, Mukhtar H. Differential expression of S100A2 and S100A4 during progression of human prostate adenocarcinoma. J Clin Oncol 2003;21:106–12.
16. Ambartsumian NS, Grigorian MS, Larsen IF, Karlstrom O, Sidenius N, Rygaard J, et al. Metastasis of mammary carcinomas in GRS/A hybrid mice transgenic for the mts1 gene. Oncogene 1996; 13: 1621–30.
17. Senolt L, Grigorian M, Lukanidin E, et al. S100A4 (Mts1): is there any relation to the pathogenesis of rheumatoid arthritis? Autoimmun Rev 2006;5:129–31.
18. Senolt L, Grigorian M, Lukanidin E, Simmen B, Michel BA, Pavelka K, et al. S100A4 is expressed at site of invasion in rheumatoid arthritis synovium and modulates production of matrix metalloproteinases. Ann Rheum Dis 2006;65:1645–8.
19. Ebralidze A, Tulchinsky E, Grigorian M, et al. Isolation and characterization of a gene specifically expressed in different metastatic cells and whose deduced gene product has a high degree of homology to a Ca2+-binding protein family. Genes Dev 1989;3: 1086–93.
20. Takenaga K, Nakamura Y, Sakiyama S, Hasegawa Y, Sato K, Endo H. Binding of pEL98 protein, an S100-related calcium-binding protein, to nonmuscle tropomyosin. J Cell Biol 1994;124:757–68.
21. Gibbs FE, Barraclough R, Platt-Higgins A,et al. Immunocytochemical distribution of the calcium-binding protein p9Ka in normal rat tissues: variation in the cellular location in different tissues. J Histochem Cytochem 1995;43:169–80.
22. Grigorian M, Tulchinsky E, Burrone O, Tarabykina S, Georgiev G, Lukanidin E. Modulation of mts1 expression in mouse and human normal and tumor cells. Electrophoresis 1994;15:463–8.
23. Mazzucchelli L. Protein S100A4: too long overlooked by pathologists? Am J Pathol 2002;160:7–13.
24. Wang G, Rudland PS, White MR, Barraclough R. Interaction in vivo and in vitro of the metastasis-inducing S100 protein, S100A4 (p9Ka) with S100A1. J Biol Chem 2000;275:11141–6.
25. Tarabykina S, Kriajevska M, Scott DJ, Hill TJ, Lafitte D,et al. Heterocomplex formation between metastasis-related protein S100A4 (Mts1) and S100A1 as revealed by the yeast two-hybrid system. FEBS Lett 2000;475:187–91.
26. Kriajevska MV, Cardenas MN, Grigorian MS, Ambartsumian NS, Georgiev GP and Lukanidin EM. Non-muscle myosin heavy chain as a possible target for protein encoded by metastasis-related mts-1 gene. J Biol Chem 1994;269:19679–82.
27. Kriajevska M, Fischer-Larsen M, Moertz E, et al. Liprin beta 1, a member of the family of LAR transmembrane tyrosine phosphatase-interacting proteins, is a new target for the metastasis-associated protein S100A4 (Mts1). J Biol Chem 2002;277:5229–35.
28. Grigorian M, Andresen S, Tulchinsky E, Kriajevska M, Carlberg C, Kruse C, Cohn M, Ambartsumian N, Christensen A, Selivanova G, Lukanidin E. Tumor suppressor p53 protein is a new target for the metastasis-associated Mts1/S100A4 protein: functional consequences of their interaction. J Biol Chem 2001;276: 22699–708.
29. Davies BR, Davies MP, Gibbs FE, Barraclough R, Rudland PS. Induction of the metastatic phenotype by transfection of a benign rat mammary epithelial cell line with the gene for p9Ka, a rat calcium-binding protein, but not with the oncogene EJ-ras-1. Oncogene 1993;8:999–1008.
30. Novitskaya V, Grigorian M, Kriajevska M, Tarabykina S, Bronstein I, Berezin V, Bock E, Lukanidin E. Oligomeric forms of the metastasis-related Mts1 (S100A4) protein stimulate neuronal differentiation in cultures of rat hippocampal neurons J Biol Chem 2000;275: 41278-86.
31. Belot N, Pochet R, Heizmann CW, Kiss R, Decaestecker C. Extracellular S100A4 stimulates the migration rate of astrocytic tumor cells by modifying the organization of their actin cytoskeleton. Biochim Biophys Acta 2002;1600:74–83.
32. Ambartsumian N, Klingelhofer J, Grigorian M, Christensen C, Kriajevska M, Tulchinsky E, Georgiev G, Berezin V, Bock E, Rygaard J, Cao R, Cao Y, Lukanidin E. The metastasis-associated Mts1(S100A4) protein could act as an angiogenic factor. Oncogene 2001;20: 4685–95.
33. Schmidt-Hansen B., ÖrnĆs D., Grigorian M., Tulchinsky E, Lukanidin E, Ambartsumian N. Extracellular S100A4 (mts1) stimulates invasive growth of mouse endothelial cells and modulates MMP-13 matrix metalloproteinase activity. Oncogene 2004;23:5487–95.
34. Duarte WR, Shibata T, Takenaga K, et al. S100A4: a novel negative regulator of mineralization and osteoblast differentiation. J Bone Miner Res 2003;18:493–501.
35. Kriajevska M, Tarabykina S, Bronstein I, et al. Metastasis-associated Mts1 (S100A4) protein modulates protein kinase C phosphorylation of the heavy chain of nonmuscle myosin. J Biol Chem 1998;273:9852–6.
36. Kriajevska M, Bronstein IB, Scott DJ, et al. Metastasis-associated protein Mts1 (S100A4) inhibits CK2-mediated phosphorylation and self-assembly of the heavy chain of nonmuscle myosin Biochim Biophys Acta 2000;1498: 252–63.
37. Kimura K, Endo Y, Yonemura Y, et al. Clinical significance of S100A4 and E-cadherin-related adhesion molecules in non-small cell lung cancer. Int J Oncol 2000;16: 1125–31.
38. Keirsebilck A, Bonne S, Bruyneel E, et al. E-cadherin and metastasin (mts-1/S100A4) expression levels are inversely regulated in two tumor cell families. Cancer Res 1998;58:4587–91.
39. Parker C, Lakshmi MS, Piura B, Sherbet GV. Metastasis-associated mts1 gene expression correlates with increased p53 detection in the B16 murine melanoma. DNA Cell Biol 1994;13:343–51.
40. EL Naaman C, Grum-Schwensen B, Mansouri A, et al. Cancer predisposition in mice deficient for the metastasis-associated Mts1(S100A4) gene. Oncogene 2004;23: 3670 –80.
41. Schmidt-Hansen B, Klingelhöfer J, Grum-Schwensen B, Christensen A, Andresen A, Kruse C, Ambartsumian N, Lukanidin E, Grigorian M. Functional significance of S100A4 (Mts1) in tumor-stroma interplay. J Biol Chem 2004;279:24498–504.
42. Roberts DD. Regulation of tumor growth and metastasis by thrombospondin-1. FASEB J 1996;10:1183–91.
43. Michael S. Pepper. Role of the Matrix Metalloproteinase and Plasminogen Activator–Plasmin Systems in Angiogenesis. Arterioscler Thromb Vasc Biol 2001;21:1104–17.
44. Bjornland K, Winberg JO, Odegaard OT, et al. S100A4 involvement in metastasis: deregulation of matrix metalloproteinases and tissue inhibitors of matrix metalloproteinases in osteosarcoma cells transfected with an anti-S100A4 ribozyme. Cancer Res 1999;59:4702–8.
45. Saleem M, Kweon MH, Johnson JJ, et al. S100A4 accelerates tumorigenesis and invasion of human prostate cancer through the transcriptional regulation of matrix metalloproteinase 9. Proc Natl Acad Sci U S A. 2006;103: 14825–30.
46. Helfman DM, Kim EJ, Lukanidin E, Grigorian M. The metastasis associated protein S100A4: role in tumour progression and metastasis. Br J Cancer 2005;92:1955–8.
47. Stanczyk J, Ospelt C, Gay RE, Gay S. Synovial cell activation. Curr Opin Rheumatol. 2006;18:262–7.
48. Huber LC, Distler O, Tarner I, Gay RE, Gay S, Pap T. Synovial fibroblasts: key players in rheumatoid arthritis. Rheumatology (Oxford). 2006;45:669–75.
49. Masuda K, Masuda R, Neidhart M, Simmen BR, et al. Molecular profile of synovial fibroblasts in rheumatoid arthritis depends on the stage of proliferation. Arthritis Res 2002; 4(5):R8.
50. Yammani RR, Carlson CS, Bresnick AR, Loeser RF. Increase in production of matrix metalloproteinase 13 by human articular chondrocytes due to stimulation with S100A4: Role of the receptor for advanced glycation end products. Arthritis Rheum 2006;54:2901–11.
Labels
Dermatology & STDs Paediatric rheumatology RheumatologyArticle was published in
Czech Rheumatology

2007 Issue 3
Most read in this issue
- Artroskopická synovektomie zápěstí
- Rizikové faktory maligní lymfoproliferace u Sjögrenova syndromu
- Možnosti časné detekce závažných kardiovaskulárních projevů SLE
- Význam S100A4 proteinu v patogenezi revmatoidní artritidy
