-
Medical journals
- Career
Obezita a asistovaná reprodukce
Authors: M. Maděrka
Authors‘ workplace: Repromeda s. r. o., Brno
Published in: Ceska Gynekol 2023; 88(3): 200-208
Category:
doi: https://doi.org/10.48095/cccg2023200Overview
Světová zdravotnická organizace definuje obezitu jako abnormální nebo nadměrné hromadění tuku, které poškozuje zdraví. Obezita a nadváha mají negativní vliv nejen na celkové zdraví, ale do značné míry také na reprodukční zdraví. Obezita je spojena se sníženou plodností, častějšími těhotenskými ztrátami a dalšími těhotenskými komplikacemi. Vzhledem k pandemii obezity bude stále větší podíl žen vyhledávajících lékařskou pomoc pro neplodnost trpět nadváhou nebo obezitou. Obezita se podílí na patogenezi syndromu polycystických vaječníků (PCOS – polycystic ovary syndrome) a přibližně 40–70 % pacientek s PCOS má nadváhu nebo obezitu. Riziko potratu je zvýšené u žen s obezitou, které otěhotní po in vitro fertilizaci, a to bez ohledu na to, zda jsou použity vlastní oocyty, či oocyty darované. U mužů je souvislost mezi obezitou a sníženou plodností prozkoumána méně než u žen. Mezi mechanizmy, kterými může obezita ovlivnit spermatogenezi, patří tepelné účinky, hyperestrogenizmus, hypogonadotropní hypogonadizmus, diabetes mellitus, sexuální dysfunkce a epigenetické poruchy spermií. Obezita žen i mužů ovlivňuje negativně výsledky asistované reprodukce. Ženy s nadváhou či obezitou by měly být informovány o celkových zdravotních i porodnických rizicích a o nižší úspěšnosti léčby neplodnosti metodami asistované reprodukce.
Klíčová slova:
obezita – asistovaná reprodukce – neplodnost – nadváha – in vitro fertilizace – syndrom polycystických vaječníků
Úvod
Nadměrný kalorický příjem je základní příčinou obezity. Globálně je zaznamenán nárůst spotřeby energeticky bohatých potravin a snížení fyzické aktivity [1]. Mezi zdravotní důsledky této nerovnováhy patří kardiovaskulární onemocnění, diabetes mellitus, muskuloskeletální poruchy, spánková apnoe a zvýšené riziko některých malignit, jako je karcinom prsu, karcinom endometria a kolorektální karcinom [2,3]. Odhaduje se, že u mladých dospělých index tělesné hmotnosti (BMI – body mass index) > 45 kg/m2 snižuje očekávanou délku života o 5–20 let [4].
Obezita a nadváha mají negativní vliv nejen na celkové zdraví, ale do značné míry také na reprodukční zdraví. Existuje vysoká prevalence obézních žen v neplodné populaci a četné studie poukazují na souvislost mezi obezitou a neplodností. Již v roce 1934 byla zjištěna souvislost mezi obezitou a neplodností, když Irving Stein a Michael Leventhal popsali triádu skládající se z obezity, hirsutizmu a neplodnosti – tzv. Steinův-Leventhalův syndrom [5]. Obezita vyvolává hormonální prostředí sestávající z inzulinové rezistence, hyperinzulinemie, nízké hladiny globulinu vázajícího pohlavní hormony (SHBG – sex hormone binding globulin), zvýšené hladiny androgenů, zvýšené periferní přeměny androgenů na estrogeny, zvýšené hladiny růstového faktoru podobného inzulinu 1 (ILGF-1 – insulin-like growth factor 1) a zvýšené hladiny leptinu [6]. Kombinovaný účinek těchto změn způsobuje hypotalamickou dysfunkci, aberantní sekreci gonadotropinů, sníženou folikulogenezi a nižší hladiny progesteronu v luteální fázi menstruačního cyklu [7–9]. V důsledku toho je nepravidelná menstruace častější u žen s obezitou a frekvence se zvyšuje se zvyšující se mírou obezity [10,11].
Obezita je spojena se sníženou plodností, častějšími těhotenskými ztrátami a dalšími těhotenskými komplikacemi. Obézní pacientky hůře reagují na léčbu klomifen citrátem, vyžadují vyšší dávky gonadotropinů během ovariální stimulace, mají nižší počty získaných oocytů, což negativně ovlivňuje pravděpodobnost klinické gravidity i počtu porodů živého plodu (LBR – live birth rate). Studie z roku 2003 prokázala, že je vyšší počet spontánních potratů i u obézních žen, u nichž byly při léčbě využity darované oocyty [12].
BMI vyjadřuje vztah mezi tělesnou hmotností a tělesnou výškou. Normální hodnota BMI se pohybuje v rozmezí 18,5–25 kg/m2 (tab. 1). Hodnoty < 18,5 kg/m2 signalizují podváhu či podvýživu, hodnoty > 25 kg/m2 signalizují nadváhu, hodnoty > 30 kg/m2 znamenají již obezitu. BMI lze vypočítat jako poměr hmotnosti v kilogramech a druhé mocniny výšky v metrech [13].
Table 1. Index tělesné hmotnosti (BMI).
Tab. 1. Body mass index (BMI).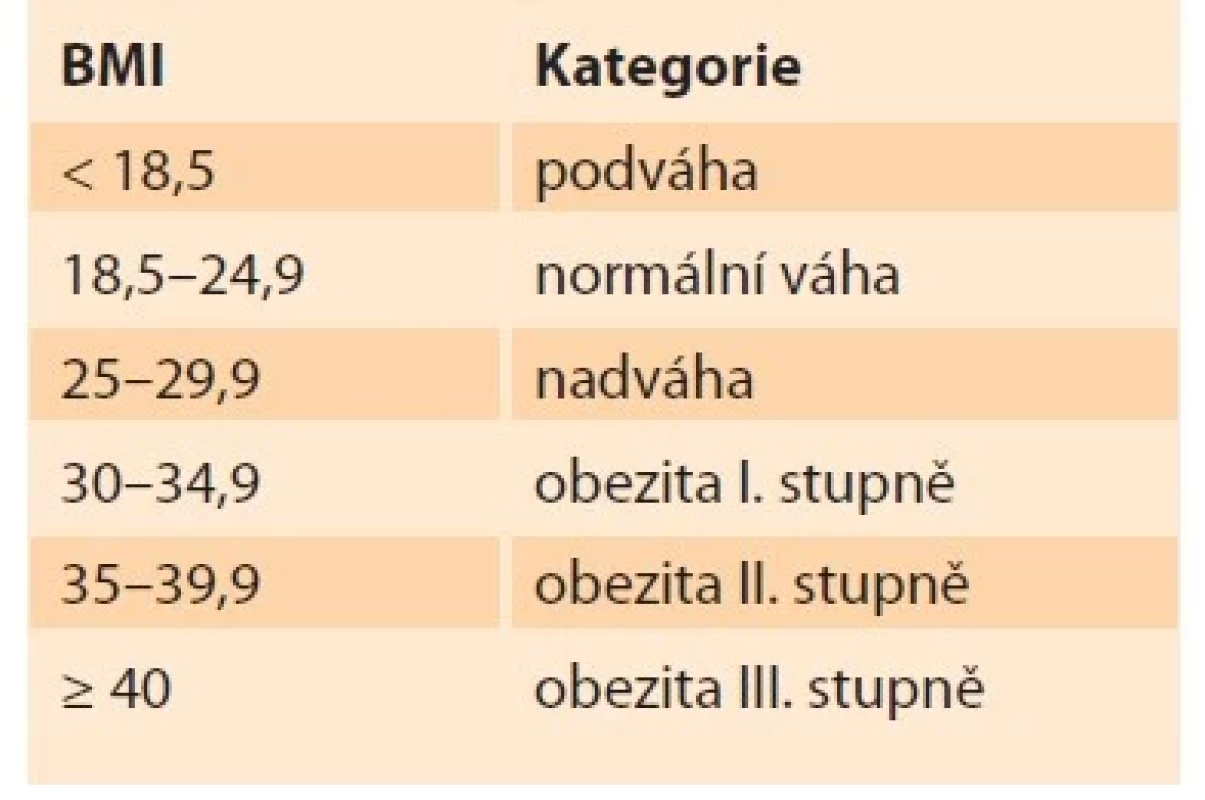
Vzhledem k celosvětové epidemii obezity bude stále větší podíl žen vyhledávajících lékařskou pomoc pro neplodnost mít nadváhu nebo obezitu. Doporučené postupy, které upravují přístup k léčbě neplodnosti u žen s nadváhou a obezitou, se celosvětově liší. Např. na Novém Zélandu jsou z léčby neplodnosti vyloučeny ženy s BMI > 32 kg/m2. Téměř všechny kliniky ve Spojeném království mají horní limit BMI pro přístup k metodám asistované reprodukce v rozmezí 35–40 kg/m2 [14–16].
Obezita je spojena s větším rizikem nepříznivých zdravotních následků napříč celým reprodukčním spektrem, jako je vyšší míra neplodnosti, časné i pozdní těhotenské ztráty, mrtvě rozené plody i úmrtí novorozenců, vrozené vývojové vady a další těhotenské komplikace. Nedávná zjištění naznačují, že obezita adolescentek je spojena s trojnásobně zvýšeným rizikem celoživotní nulliparity a se čtyřnásobně zvýšeným rizikem celoživotní nulligravidity [17].
Syndrom polycystických vaječníků
Obezita se podílí na patogenezi syndromu polycystických vaječníků (PCOS – polycystic ovary syndrome) [18,19]. Přibližně 40–70 % pacientek s PCOS má nadváhu nebo obezitu [18–20]. Většina obézních žen s neplodností a s příznaky spojenými s nadbytkem androgenů je postižena PCOS, jehož prevalence se udává v západních zemích 5–7 % [21]. U kavkazských žen s PCOS závažnost metabolických i klinických příznaků pozitivně koreluje s BMI [22]. Existují také důkazy, že ženy s PCOS s normální hmotností mají abdominální fenotyp distribuce tuku [23]. Obezita působí jako zesilovač inzulinové rezistence a hyperinzulinemie, břišní fenotyp tuto situaci dále zhoršuje. Obezita proto hraje svou specifickou patofyziologickou roli ve vývoji PCOS [6]. PCOS může také zvyšovat riziko obezity snížením bazálního metabolizmu a poruchou regulace chuti k jídlu [24–26].
Carlo Alviggi studoval korelaci mezi ultrazvukovým nálezem PCOS pacientek s inzulinovou rezistencí. Byly zaznamenány antropometrické, biochemické a klinické údaje. Ženy byly rozděleny do dvou skupin na základě specifických parametrů transvaginálního ultrazvuku. Skupinu A tvořily pacientky s více než polovinou folikulů o průměru mezi 5 a 9 mm, ultrasonograficky stanoveným poměrem stroma/celková plocha ovaria > 0,34 a tzv. necklace sign antrálních folikulů. Skupinu B tvořily pacientky s více než polovinou antrálních folikulů o průměru mezi 2 a 4 mm, ultrasonograficky stanoveným poměrem stroma/celková plocha ovaria ≤ 0,34, bez „necklace sign“, ale s antrálními folikuly difuzně rozmístěnými. Byla hodnocena souvislost mezi těmito ultrazvukovými vzory a přítomností inzulinové rezistence. Bylo zařazeno 78 pacientek: 33 s ultrazvukovým obrazem A a 45 s obrazem B. Obraz B měl senzitivitu 88 % a specificitu 78 % v predikci žen s PCOS s inzulinovou rezistencí. Mezi těmito dvěma skupinami nebyly žádné rozdíly ve věku, hladinách sérového gonadotropinu nebo androgenů. BMI, poměr pasu k bokům a inzulinová rezistence byly významně vyšší ve skupině B než ve skupině A (p < 0,05). Naopak hladiny SHBG a objem vaječníků byly významně vyšší ve skupině A (p < 0,05). Inzulinová rezistence byla častější ve skupině B než ve skupině A (36/41, 87,8 % vs. 7/32, 21,8 %; p < 0,05). Tyto výsledky naznačují, že inzulinová rezistence a s ní častěji se vyskytující obezita by mohla být spojena se specifickým ultrazvukovým obrazem u pacientek s PCOS [27].
Existují tedy zřejmě dva různé podtypy PCOS: „reprodukční“ skupina, jež je charakterizována vyššími hladinami luteinizačního hormonu (LH) a SHBG s relativně nízkým BMI a nízkými hladinami inzulinu, a „metabolická“ skupina vyznačující se vyšším BMI, vyššími hladinami glukózy a inzulinu s nižšími hladinami SHBG a LH. U těchto skupin byl dokonce prokázán genetický podklad. Byly identifikovány alely ve čtyřech lokusech, které byly asociovány s „reprodukční skupinou“, a jeden lokus, který byl významně asociován s „metabolickou“ skupinou [28].
Poruchy menstruačního cyklu a neplodnost
Obezita je 4krát častější u žen s poruchou menstruačního cyklu ve srovnání se ženami s normálním menstruačním cyklem [29]. Dostupné poznatky podporují myšlenku, že androgenní alterace a jejich rovnováha s estrogenem představují nejdůležitější mechanizmus odpovědný za vývoj neplodnosti u obézních žen. SHBG je protein, který váže testosteron a dihydrotestosteron s vysokou afinitou a estrogeny s nižší afinitou. Stupeň obezity je nepřímo úměrný hladinám SHBG a také distribuce tělesného tuku dále ovlivňuje koncentraci SHBG. Ženy s centrálním typem obezity mají nižší koncentraci SHBG než ženy s periferní obezitou, proto bývá procento volné frakce testosteronu vyšší u žen s centrální obezitou. Kromě toho je tuková tkáň místem aktivní produkce androgenů, přeměny androgenů na estrogeny a interkonverze androgenu na estrogen, která do značné míry závisí na množství tuku. Zvýšená produkce androgenů a snížená vazba androgenů na SHBG přispívá k hyperandrogenizmu, což vede k anovulaci prostřednictvím inhibice zrání folikulů [8].
Bylo prokázáno, že hormony regulující energetický metabolizmus mají různý vliv na reprodukci. Je znám vliv inzulinu a ILGF na reprodukční procesy, jako je ovariální steroidogeneze, folikulogeneze a ovulace. Inzulinová rezistence hraje klíčovou roli v patogenezi PCOS a léky zvyšující citlivost na inzulin jsou nyní široce používány k indukci ovulace a zlepšení plodnosti těchto žen [30]. Kromě inzulinu plní funkci regulátorů chuti k jídlu a energetické homeostázy také hormony leptin, ghrelin, adiponektin, resistin a peptid YY3–36 [31,32]. Úzký vztah mezi energetickým metabolizmem, stavem výživy a reprodukční fyziologií naznačuje, že poruchy nebo alterace ve stavu výživy (obezita, malnutrice, mentální anorexie atd.) a metabolické poruchy mohou narušit komplexní souhru gonadotropinů a gonadálních hormonů, které jsou nezbytné pro plodnost. Bylo prokázáno, že leptin hraje integrální roli v normální fyziologii reprodukčního systému s komplexními interakcemi na všech úrovních osy hypotalamus-hypofýza-ovarium. Observační studie prokázaly, že přebytek, nedostatek nebo rezistence k leptinu mohou být spojeny s abnormální reprodukční funkcí. Zvýšená tělesná hmotnost a tuková tkáň podstatně narušují menstruační cyklus, a tím i plodnost. U obézních žen samotný úbytek hmotnosti zlepšuje inzulinovou rezistenci a podporuje plodnost [31,32]. Kromě toho bylo prokázáno, že exprese leptinu, ghrelinu a jejich receptorů v různých reprodukčních orgánech a tkáních, jako je ovarium, varle, endometrium, embryo a placenta, hraje důležitou roli v různých fázích vývoje a implantace embrya [33].
Riziko potratu
Riziko potratu je zvýšené u žen s obezitou, které otěhotní po in vitro fertilizaci (IVF), a to bez ohledu na to, zda jsou použity vlastní oocyty, či oocyty darované. Zvýšené riziko potratu je i u obézních žen, které otěhotní spontánně [34]. U žen s opakovanými potraty může být souvislost s obezitou ještě větší. Dvě studie naznačují, že u obézních žen s opakovanými potraty je pravděpodobnost dalšího těhotenství s následným potratem zvýšena 3krát až 4krát [35,36]. V další studii byla prokázána souvislost obezity se signifikantním vzestupem selhání implantace embrya při použití vlastních oocytů, při použití darovaných oocytů toto prokázáno nebylo. U těhotných žen mladších 35 let, které využily vlastní oocyty, bylo prokázáno nižší LBR při zvyšujícím se BMI. Počet potratů byl výrazně vyšší u žen s obezitou ve srovnání s ženami s normální hmotností. Ženy s obezitou mají vyšší míru potratů po přenosu euploidního embrya než ženy s normální hmotností [17].
Léčba neplodnosti
Studie týkající se dopadu ženské obezity na výsledky IVF od Společnosti pro technologii asistované reprodukce (SART – Society for Assisted Reproductive Technology) zahrnovala 239 127 cyklů IVF od roku 2008 do roku 2010. Zahrnovala více než 6 000 cyklů u žen s BMI 30–40 kg/m2 a téměř 1 000 cyklů u žen s BMI > 40 kg/m2. Docházelo k mírnému poklesu počtu získaných oocytů a počtu vysoce kvalitních embryí se stoupajícím BMI. Implantace, klinická těhotenství a LBR klesaly s rostoucí závažností obezity. Celková pravděpodobnost živě narozeného dítěte na začátku cyklu poklesla z 31,4 % u žen s normálním BMI na 28 % u žen s obezitou I. a II. stupně, na 24,3 % u žen s BMI 40–44,5 kg/m2 a na 21,2 % u žen s BMI > 50 kg/m2 [37]. Většina studií prokazuje, že zvýšení BMI je spojeno se zvýšenou potřebou léků k vyvolání ovulace. K vyvolání ovulace u žen s nejvyšší hmotností byly zapotřebí velké dávky klomifen citrátu – až 200 mg denně [38]. Podobné trendy byly také pozorovány u dávek gonadotropinů nutných k vyvolání ovulace [39].
V Argentině byla provedena studie, do které bylo zahrnuto 394 pacientek a byla studována asociace mezi BMI a početím. Bylo prokázáno, že obezita je spojena s nižší pravděpodobností otěhotnění metodami asistované reprodukce. Ve skupině pacientek, které otěhotněly, bylo 14 % z nich obézních. Ve skupině pacientek, které neotěhotněly, bylo obézních 21 %. Byl zde potvrzen statisticky významný rozdíl (p < 0,01) v BMI, počtu získaných oocytů, počtu fertilizovaných oocytů a v celkovém počtu transferů. Bylo prokázáno, že pravděpodobnost početí metodami asistované reprodukce je nižší u pacientek obézních oproti pacientkám neobézním, kdy každý pokles stupně BMI zvýšil statisticky významně pravděpodobnost početí [40].
V jiné studii shrnuli aktuální důkazy o tom, zda existuje nějaká asociace mezi počtem komplikací po asistované reprodukci a hodnotou BMI. Nebyl nalezen vliv nadváhy nebo obezity na ovariální hyperstimulační syndrom (OHSS – ovarian hyperstimulation syndrome), vícečetná či ektopická těhotenství. Byl prokázán mírně negativní vliv na LBR u žen s nadváhou a obezitou. Závažné komplikace, jako je infekce, krvácení, tromboembolie nebo dokonce mortalita, nebyly ve vztahu k BMI potvrzeny [41].
Obavy ohledně rizik pro matku či plod vedou k výzvám k omezení přístupu k léčbě neplodnosti u žen se zvýšeným BMI [14]. Situaci navíc komplikuje narůstající počet obézních žen. Odepření léčby neplodnosti obézním ženám je eticky velmi problematická a kontroverzní otázka. Přestože obézní ženy čelí vyššímu riziku porodnických komplikací, jejich absolutní riziko zůstává nízké. Kromě toho riziko komplikací u nich jasně nepřevyšuje riziko komplikací, s nimiž se setkáváme u jiných, již existujících zdravotních stavů, jako je diabetes mellitus, hypertenze či epilepsie. Při absenci jednoduchých, bezpečných a účinných strategií, které by pacientkám s obezitou spolehlivě pomohly zhubnout včas, je tedy těžké obhajovat univerzální limit BMI [16].
Obezita u mužů
U mužů je souvislost mezi obezitou a sníženou plodností prozkoumána méně než u žen. Mezi mechanizmy, kterými může obezita ovlivnit spermatogenezi, patří tepelné účinky, hyperestrogenizmus, hypogonadotropní hypogonadizmus, diabetes mellitus, sexuální dysfunkce a epigenetické poruchy spermií. Kromě okamžitých účinků, které obezita má na muže, existují důkazy, že negativní účinky mohou být přenášeny na potomky prostřednictvím epigenetických změn DNA zárodečných buněk [42–44]. Kombinace inzulinové rezistence, sníženého SHBG a zvýšené periferní přeměny androgenů na estrogeny může narušit uvolňování gonadotropinů [45–47]. Přes tyto změny přináší výzkum týkající se vztahu mezi mužskou obezitou a parametry spermiogramu rozporuplné výsledky [48]. Některé kohortové studie uvádějí souvislost mezi mužskou obezitou a oligospermií, zatímco jiné žádnou takovou souvislost nenalezly [47,49–53]. Podobně smíšené jsou údaje týkající se dopadu obezity na fragmentaci DNA spermií, přičemž některé studie naznačují negativní účinek, zatímco jiné neuvádějí žádné rozdíly [54–59]. I když je tedy zřejmé, že obézní páry mají vyšší výskyt neplodnosti, zůstává nejasné, do jaké míry k této souvislosti přispívají změny v kvalitě spermií [60]. Naproti tomu literatura jasně ukazuje, že obézní muži mají vyšší výskyt erektilní dysfunkce [61,62]. Přibližně 79 % mužů, kteří uvádějí, že mají erektilní dysfunkci, je obézních. Vztah mezi obezitou a erektilní dysfunkcí je multifaktoriální, ale předpokládá se, že pramení ze snížené hladiny testosteronu a zvýšených prozánětlivých faktorů (tumor necrosis factor alfa a interleukin 6) [63,64]. Tyto zánětlivé látky vedou k vaskulární endoteliální dysfunkci, což má za následek erektilní dysfunkci. Nedostatek testosteronu může vést k sexuální dysfunkci mnoha způsoby, především prostřednictvím sníženého libida [65].
Diabetes je spojen s obezitou a může negativně ovlivnit androgenní osu. Obézní muž s diabetem vykazuje centrální i periferní inzulinovou rezistenci, což vede ke snížení syntézy SHBG v játrech. Snížení SHBG umožňuje, aby větší část testosteronu zůstala volná, což zesiluje negativní zpětnovazební účinek estradiolu prostřednictvím aromatizace [66]. Tudíž obézní muži s diabetem mají další down-regulaci androgenní osy. Zdá se tedy, že míra plodnosti a kvalita spermatu jsou u mužů s diabetem sníženy [67].
Spánková apnoe postihuje 4 % dospělých mužů, přičemž dvě třetiny těchto mužů jsou obézní. Spánková apnoe, běžná u obézních mužů, může snížit hladinu testosteronu. Noční apnoické příhody charakteristické pro spánkovou apnoe vedou k fragmentaci spánku. To zase snižuje noční produkci LH a dále snižuje hladinu cirkulujícího testosteronu [68,69]. Kromě toho, nehumánní zvířecí modely ukazují, že intermitentní hypoxie může ovlivnit genovou expresi, motilitu spermií a plodnost [70].
Předpokládá se, že akumulace toxických látek souvisejících s obezitou, zejména endokrinních disruptorů, narušuje jak mužskou endokrinní osu, tak i spermatogenezi. K tomu přispívá rozpustnost mnoha těchto toxinů v tucích, vinou čehož jsou obézní muži vnímavější k jejich účinku [71,72]. Poškození termoregulačních mechanizmů šourku a varlat nadbytkem tukové tkáně vede k poruše spermatogeneze. Obézní muži mají zvýšený tuk v dolní části břicha, stehenní tuk a tuk v šourku, které fungují jako izolant pro varlata, což vede ke zvýšené teplotě varlat. To negativně ovlivňuje syntézu testosteronu i spermatogenezi [73,74].
Zdá se, že také mužská obezita, nikoli jen ženská, ovlivňuje klinická těhotenství, potraty a LBR [37,54]. Campbell et al prokázali, že obézní muži podstupující léčbu metodami asistované reprodukce mají statisticky významný pokles LBR ve srovnání s muži s normální hmotností [54]. Epigenetika nám poskytuje vysvětlení, jak mohou vlivy zevního prostředí ovlivnit genom bez mutace DNA. Epigenetické změny zahrnují tři hlavní kategorie:
• metylace DNA;
• složení jaderného proteinu (modifikace a lokalizace histonů);
• expresní profily nekódující RNA [75].
Tyto změny řídí nebo přinejmenším ovlivňují vzorce genové exprese v buňce. Plasticita je charakteristickým znakem epigenetických změn jak v somatických tkáních, tak v zárodečné linii. Epigenetické změny mohou být snadno ovlivněny různými „modifikátory“, jako je např. strava, BMI, fyzická aktivita, stárnutí, vystavení různým toxinům a environmentálním vlivům [44]. K transgenerační nebo mezigenerační dědičnosti dochází, když jsou indukované epigenetické změny v gametách přeneseny na následující generace. Tato epigenetická dědičnost může teoreticky vést k fenotypovým změnám u potomků. Na základě epidemiologických důkazů bylo zjištěno, že vývoj potomků ovlivňuje mnoho typů environmentálních problémů kladených na rodiče, jako je hlad, specifická strava, toxiny a jiné [76]. V jedné studii byly např. zjištěny u novorozenců změny v metylaci DNA v genu pro ILGF-2, jejichž otcové jsou obézní [77].
Všechny tyto výsledky naznačují, že obezita je schopna ovlivnit funkci spermií, embryogenezi a dokonce i zdraví potomků. Mužská obezita je významný problém, který narostl do epidemických rozměrů. Obézní muži jsou častěji neplodní. Ačkoli příčina není přesně známa, pravděpodobně jde o kombinaci endokrinních poruch vyvolaných obezitou a jejich škodlivých účinků na spermatogenezi. Nedávné epigenetické důkazy naznačují, že mužská obezita v době početí může být přímo přenesena na jejich potomky.
Léčba obezity
Redukce hmotnosti by měla být prvním krokem u neplodných obézních žen, a to ještě před zahájením léčby podáním léků indukujících ovulaci nebo metodami asistované reprodukce. Snížení tělesného tuku by mělo vést ke zlepšení menstruačního cyklu, plodnosti a snížení metabolických rizik. Snížení tělesné hmotnosti o 2–5 % bylo spojeno s obnovením ovulace, snížením břišního tuku o 11 %, snížením obvodu pasu o 4 cm a zvýšením citlivosti na inzulin o 71 % [78]. Ztráta hmotnosti vede ke zvýšení SHBG, snížení testosteronu, vyšší míře početí a ke snížení počtu potratů. Protože centrální obezita je spojena s poruchami menstruace a s neplodností, je velmi důležitý především úbytek břišního tuku. K překonání obezity existují různé strategie. Mezi ně patří dietní opatření, fyzická aktivita, změna chování, farmakologická a chirurgická léčba. Problémem je dlouhodobé dodržování doporučení a udržení úbytku hmotnosti [79]. Bates a Whitworth jako první prokázali snížení plazmatických androgenů při dietě a s tím spojený návrat menstruačního cyklu [80]. Nedílnou součástí každého programu na hubnutí by mělo být cvičení. Cvičení zvyšuje citlivost na inzulin, a to jak přímým působením na svalový metabolizmus, tak i nepřímo tím, že pomáhá při hubnutí [81,82].
Farmakoterapie obezity je primárně zaměřena na redukci hmotnosti, dlouhodobé udržení této redukce a snížení rizik z obezity vyplývajících. Jedná se o látky, které snižují chuť k jídlu, snižují vstřebávání tuků nebo zvyšují energetický výdej. Navzdory rychlému vývoji těchto léčiv je nadále nutné považovat za základní kameny léčby dietní opatření, cvičení a úpravu životního stylu [83]. Například Orlistat je selektivní inhibitor absorpce tuku. Působí v trávicím traktu vazbou na žaludeční a pankreatické lipázy a zabraňuje vstřebávání nejméně 30 % tuku z potravy. Mezi vedlejší účinky však patří plynatost, mastná stolice, nutkání na stolici a křeče v břiše [84]. Liraglutid je zase analogem lidského glukagonu podobného peptidu-1. Liraglutid vede ke snížení hmotnosti snížením chuti k jídlu. Nejčastějšími nežádoucími účinky jsou nauzea, průjem a hypoglykemie stimulací sekrece inzulinu a inhibicí glukagonu. Liraglutid v dávce 1,2–3 mg subkutánně denně vedl k většímu úbytku hmotnosti (4,8–7,2 kg po 20 týdnech) než Orlistat 120 mg perorálně 3krát denně (4,1 kg po 20 týdnech) [85]. Dalším lékem, u kterého je také prokázán vliv na snížení hmotnosti, je metformin [86].
U žen s morbidní obezitou, u nichž selhávají jiné intervence, může být k léčbě obezity indikován chirurgický zákrok. Bariatrická chirurgie je účinná terapie morbidní obezity. Bariatrické operace jsou buď restriktivní, omezující množství přijímané potravy, malabsorpční, omezující množství absorbovaných živin, nebo kombinace obojího [87]. Morbidně obézní pacientky uvažující o takové operaci musí splňovat přísná kritéria a musí být posouzeny multidisciplinárním týmem. Eid et al hodnotili výsledky 24 žen s PCOS, které podstoupily bariatrickou operaci od roku 1997 do roku 2001. U všech těchto žen se obnovil normální menstruační cyklus průměrně 3,4 ± 2,1 měsíce po operaci. Z toho pět žen po operaci spontánně otěhotnělo bez použití klomifen citrátu [88]. Tietelman et al zaznamenali efekt bariatrické operace u 98 pacientek, které před operací neměly ovulaci. Celkem 70 pacientek (71,4 %) začalo po operaci normálně menstruovat. U pacientek, které znovu získaly ovulaci, došlo k většímu úbytku hmotnosti než u pacientek, které zůstaly bez ovulace [89].
Anovulace vedoucí k poruchám menstruačního cyklu je častým problémem u morbidně obézních žen. Poruchy menstruačního cyklu mohou zcela vymizet po bariatrické operaci. Žaludeční bypass a následný úbytek hmotnosti má za následek výrazné zlepšení poruch menstruace a neplodnosti související s PCOS. Neplodnost způsobená anovulací u morbidně obézních žen by měla být potenciálně považována za další indikaci k bariatrické operaci, pokud jiná jednodušší opatření selžou. Dlouhodobé komplikace zahrnují nedostatek vitaminů ve 20–50 % případů. Chirurgické komplikace (vnitřní střevní herniace) související s předchozím bariatrickým výkonem mohou ovlivnit 1 % těhotenství [90]. Neexistují žádné prospektivní randomizované studie zabývající se dobou do početí po bariatrické operaci. Přesto se doporučuje, pro obavy z dopadu rychlého úbytku hmotnosti a nedostatků vitaminů na matku a plod, odložení těhotenství o 1–2 roky po bariatrické operaci [91–93]. Nicméně retrospektivní studie porovnávající 104 těhotenství počatých < 1 rok po bariatrické operaci s 385 těhotenstvími počatými > 1 rok po bariatrické operaci nezjistila žádné rozdíly mezi těmito dvěma skupinami ohledně bariatrických komplikací souvisejících s těhotenstvím nebo perinatální následky [94]. Podobně dánská studie zahrnující 158 žen, které otěhotněly během prvního roku po operaci bypassu žaludku, a 128 žen, které otěhotněly po 1 roce, nezjistila žádné rozdíly v porodnických nebo novorozeneckých výsledcích mezi těmito dvěma skupinami [95].
Diskuze
Obezita žen i mužů ovlivňuje negativně plodnost a výsledky asistované reprodukce. Mezi mechanizmy, kterými zvýšené BMI ovlivňuje reprodukci, patří snížení ovariální odpovědi na gonadotropiny, poruchy menstruačního cyklu a ovulace. Tyto problémy však lze snadno překonat adekvátní ovariální stimulací. Metwally et al publikovali, že obezita je spojena s nižší kvalitou oocytů a embryí [96], zatímco jiní autoři jako Bellver et al tvrdí, že pro toto tvrzení neexistuje dostatek důkazů. Dalším faktorem, který může ovlivňovat výsledky léčby, je také horší viditelnost při ultrazvukovém vyšetření, např. při samotném embryotransferu. Endokrinní a metabolické prostředí může ovlivnit kvalitu oocytů, a tím i vývoj embrya, a následnou implantaci a výsledek těhotenství. Dalším vysvětlením nižší míry otěhotnění spojeného s obezitou je zhoršené prostředí dělohy v důsledku narušené funkce endometria [97]. U obézních žen může mít negativní dopad na receptivitu endometria např. jejich hyperestrogenní stav. Dokonce i studie omezené na obézní ženy využívající darované oocyty, což eliminuje potenciální vliv vyššího věku a nižší kvality embryí, prokázaly významné snížení počtu implantací embryí a vyšší počet potratů [98]. Obezita je chronický zánětlivý stav se zvýšenou expresí prozánětlivých faktorů a sníženou expresí protizánětlivých faktorů [99]. U žen, které počaly pomocí metod asistované reprodukce, může obezita dále zesilovat zánětlivou reakci a zvýšit riziko nepříznivých výsledků reprodukce, vč. potratu či porodu mrtvého plodu [100]. Zánět a dyslipidemie v časné fázi těhotenství jsou nezávisle asociovány s předčasným porodem [101,102]. Zdravotní přínosy odkládání těhotenství k dosažení úbytku hmotnosti musí být v rovnováze s rizikem poklesu plodnosti se zvyšujícím se věkem.
Závěr
Obezita je rizikovým faktorem spojeným s poklesem pravděpodobnosti úspěchu narození živého dítěte metodami asistované reprodukce. Jsou zapotřebí další studie k vysvětlení horších výsledků léčby u obézních pacientek, např. vliv obezity na kvalitu oocytů a embryí. Obézní pacientky by měly být poučeny o důležitosti redukce hmotnosti před léčbou, aby se zvýšila pravděpodobnost úspěchu léčby [17]. Ženy s nadváhou či obezitou by měly být informovány o celkových zdravotních i porodnických rizicích a o nižší úspěšnosti léčby neplodnosti metodami asistované reprodukce. Ideálně by mělo být dosaženo redukce hmotnosti před otěhotněním, což může být velmi obtížné zejména u starších žen. Ženy s obezitou mají vyšší míru potratů po přenosu euploidního embrya než ženy s normální hmotností, což naznačuje, že za tento výsledek jsou zodpovědné jiné mechanizmy než aneuploidie [34]. Špatné reprodukční výsledky u obézních žen, a to jak při spontánním početí, tak i při asistované reprodukci, mohou být výsledkem kombinace nižšího počtu implantací a těhotenství, vyššího počtu preklinických a klinických potratů a zvýšených komplikací v těhotenství pro matku i plod. To je způsobeno různými endokrinními a metabolickými poruchami, jako jsou účinky na metabolizmus steroidů a změny sekrece a účinku inzulinu a dalších hormonů, jako je leptin, resistin, ghrelin a adiponektin, které mohou ovlivnit růst folikulů, funkci žlutého tělíska, časný vývoj embrya, funkci trofoblastu a receptivitu endometria. Je tedy oprávněné doporučit redukci hmotnosti všem ženám, ať už se jedná o cyklus s vlastními, nebo darovanými oocyty (tab. 2) [16].
Table 2. Vliv obezity na reprodukci.
Tab. 2. Effect of obesity on reproduction.
ORCID autora
M. Maděrka 0000-0002-8626-479X
Doručeno/Submitted: 22. 2. 2023
Přijato/Accepted: 13. 4. 2023
MUDr. Martin Maděrka, Ph.D.
Repromeda s. r. o.
Biology Park Brno a. s.
Studentská 812/6
625 00 Brno
Sources
1. Vandevijvere S, Chow CC, Hall KD et al. Increased food energy supply as a major driver of the obesity epidemic: a global analysis. Bull World Health Organ 2015; 93 (7): 446–456. doi: 10.2471/BLT.14.150565.
2. Aune D, Sen A, Prasad M et al. BMI and all cause mortality: systematic review and non--linear dose-response meta-analysis of 230 cohort studies with 3.74 million deaths among 30.3 million participants. BMJ 2016; 353: i2156. doi: 10.1136/bmj.i2156.
3. Calle EE, Rodriguez C, Walker-Thurmond K et al. Overweight, obesity, and mortality from cancer in a prospectively studied cohort of U.S. adults. N Engl J Med 2003; 348 (17): 1625–1638. doi: 10.1056/NEJMoa021423.
4. Fontaine KR, Redden DT, Wang C et al. Years of life lost due to obesity. JAMA 2003; 289 (2): 187–193. doi: 10.1001/jama.289.2.187.
5. Stein IF, Leventhal ML. Amenorrhea associated with bilateral polycystic ovaries. Am J Obstet Gynecolo 1935; 29 (2): 181–191. doi: 10.1016/S0002-9378 (15) 30642-6.
6. Pasquali R, Gambineri A, Pagotto U. The impact of obesity on reproduction in women with polycystic ovary syndrome. BJOG 2006; 113 (10): 1148–1159. doi: 10.1111/j.1471-0528.2006. 00990.x.
7. Pasquali R, Gambineri A. Metabolic effects of obesity on reproduction. Reprod Biomed Online 2006; 12 (5): 542–551. doi: 10.1016/s1472-6483 (10) 61179-0.
8. Pasquali R, Pelusi C, Genghini S et al. Obesity and reproductive disorders in women. Hum Reprod Update 2003; 9 (4): 359–372. doi: 10.1093/humupd/dmg024.
9. Jain A, Polotsky AJ, Rochester D et al. Pulsatile luteinizing hormone amplitude and progesterone metabolite excretion are reduced in obese women. J Clin Endocrinol Metab 2007; 92 (7): 2468–2473. doi: 10.1210/jc.2006-2274.
10. Castillo-Martínez L, López-Alvarenga JC, Villa AR et al. Menstrual cycle length disorders in 18 - to 40-y-old obese women. Nutrition 2003; 19 (4): 317–320. doi: 10.1016/s0899-9007 (02) 00998-x.
11. Polotsky AJ, Hailpern SM, Skurnick JH et al. Association of adolescent obesity and lifetime nulliparity – the Study of Women’s Health Across the Nation (SWAN). Fertil Steril 2010; 93 (6): 2004–2011. doi: 10.1016/j.fertnstert.2008.12.059.
12. Bellver J, Rossal LP, Bosch E et al. Obesity and the risk of spontaneous abortion after oocyte donation. Fertil Steril 2003; 79 (5): 1136–1140. doi: 10.1016/s0015-0282 (03) 00176-6.
13. Weir CB, Jan A. BMI classification percentile and cut off points. In: StatPearls 2022. Treasure Island (FL): StatPearls Publishing 2023.
14. Gillett WR, Putt T, Farquhar CM. Prioritising for fertility treatments – the effect of excluding women with a high body mass index. BJOG 2006; 113 (10): 1218–1221. doi: 10.1111/j.1471-0528. 2006.00995.x.
15. Awartani KA, Nahas S, Al Hassan SH et al. Infertility treatment outcome in sub groups of obese population. Reprod Biol Endocrinol 2009; 7 : 52. doi: 10.1186/1477-7827-7-52.
16. Zachariah M, Fleming R, Acharya U. Management of obese women in assisted conception units: a UK survey. Hum Fertil (Camb) 2006; 9 (2): 101–105. doi: 10.1080/14647270500475214.
17. Luke B, Brown MB, Stern JE et al. Female obesity adversely affects assisted reproductive technology (ART) pregnancy and live birth rates. Hum Reprod 2011; 26 (1): 245–252. doi: 10.1093/humrep/deq306.
18. Yildiz BO, Knochenhauer ES, Azziz R. Impact of obesity on the risk for polycystic ovary syndrome. J Clin Endocrinol Metab 2008; 93 (1): 162–168. doi: 10.1210/jc.2007-1834.
19. Carmina E, Bucchieri S, Esposito A et al. Abdominal fat quantity and distribution in women with polycystic ovary syndrome and extent of its relation to insulin resistance. J Clin Endocrinol Metab 2007; 92 (7): 2500–2505. doi: 10.1210/jc.2006-2725.
20. Panidis D, Macut D, Tziomalos K et al. Prevalence of metabolic syndrome in women with polycystic ovary syndrome. Clin Endocrinol (Oxf) 2013; 78 (4): 586–592. doi: 10.1111/cen.12008.
21. Ehrmann DA. Polycystic ovary syndrome. N Engl J Med 2005; 352 (12): 1223–1236. doi: 10.1056/NEJMra041536.
22. Balen AH, Conway GS, Kaltsas G et al. Polycystic ovary syndrome: the spectrum of the disorder in 1741 patients. Hum Reprod 1995; 10 (8): 2107–2111. doi: 10.1093/oxfordjournals.humrep.a136243.
23. Norman RJ, Masters SC, Hague W et al. Metabolic approaches to the subclassification of polycystic ovary syndrome. Fertil Steril 1995; 63 (2): 329–335.
24. Georgopoulos NA, Saltamavros AD, Vervita V et al. Basal metabolic rate is decreased in women with polycystic ovary syndrome and biochemical hyperandrogenemia and is associated with insulin resistance. Fertil Steril 2009; 92 (1): 250–255. doi: 10.1016/j.fertnstert.2008.04.067.
25. Hirschberg AL, Naessén S, Stridsberg M et al. Impaired cholecystokinin secretion and disturbed appetite regulation in women with polycystic ovary syndrome. Gynecol Endocrinol 2004; 19 (2): 79–87. doi: 10.1080/09513590400002300.
26. Moran LJ, Noakes M, Clifton PM et al. Ghrelin and measures of satiety are altered in polycystic ovary syndrome but not differentially affected by diet composition. J Clin Endocrinol Metab 2004; 89 (7): 3337–3344. doi: 10.1210/ jc.2003-031583.
27. Alviggi C, Conforti A, De Rosa P et al. The distribution of stroma and antral follicles differs between insulin-resistance and hyperandrogenism-related polycystic ovarian syndrome. Front Endocrinol (Lausanne) 2017; 8 : 117. doi: 10.3389/fendo.2017.00117.
28. Dapas M, Lin FT, Nadkarni GN et al. Distinct subtypes of polycystic ovary syndrome with novel genetic associations: an unsupervised, phenotypic clustering analysis. PLoS Med 2020; 17 (6): e1003132. doi: 10.1371/journal.pmed.1003132.
29. Hartz AJ, Barboriak PN, Wong A et al. The association of obesity with infertility and related menstural abnormalities in women. Int J Obes 1979; 3 (1): 57–73.
30. Nestler JE, Stovall D, Akhter N et al. Strategies for the use of insulin-sensitizing drugs to treat infertility in women with polycystic ovary syndrome. Fertil Steril 2002; 77 (2): 209–215. doi: 10.1016/s0015-0282 (01) 02963-6.
31. Budak E, Fernández Sánchez M, Bellver J et al. Interactions of the hormones leptin, ghrelin, adiponectin, resistin, and PYY3-36 with the reproductive system. Fertil Steril 2006; 85 (6): 1563–1581. doi: 10.1016/j.fertnstert.2005.09.065.
32. Gosman GG, Katcher HI, Legro RS. Obesity and the role of gut and adipose hormones in female reproduction. Hum Reprod Update 2006; 12 (5): 585–601. doi: 10.1093/humupd/dml024.
33. Moschos S, Chan JL, Mantzoros CS. Leptin and reproduction: a review. Fertil Steril 2002; 77 (3): 433–444. doi: 10.1016/s0015-0282 (01) 03010-2.
34. Cozzolino M, García-Velasco JA, Meseguer M et al. Female obesity increases the risk of miscarriage of euploid embryos. Fertil Steril 2021; 115 (6): 1495–1502. doi: 10.1016/j.fertnstert.2020.09.139.
35. Lashen H, Fear K, Sturdee DW. Obesity is associated with increased risk of first trimester and recurrent miscarriage: matched case-control study. Hum Reprod 2004; 19 (7): 1644–1646. doi: 10.1093/humrep/deh277.
36. Metwally M, Saravelos SH, Ledger WL et al. Body mass index and risk of miscarriage in women with recurrent miscarriage. Fertil Steril 2010; 94 (1): 290–295. doi: 10.1016/j.fertn - stert.2009.03.021.
37. Provost MP, Acharya KS, Acharya CR et al. Pregnancy outcomes decline with increasing body mass index: analysis of 239,127 fresh autologous in vitro fertilization cycles from the 2008–2010 Society for Assisted Reproductive Technology registry. Fertil Steril 2016; 105 (3): 663–669. doi: 10.1016/j.fertnstert.2015.11.008.
38. Dickey RP, Taylor SN, Curole DN et al. Relationship of clomiphene dose and patient weight to successful treatment. Hum Reprod 1997; 12 (3): 449–453. doi: 10.1093/humrep/12.3.449.
39. Loh S, Wang JX, Matthews CD. The influence of body mass index, basal FSH and age on the response to gonadotrophin stimulation in non-polycystic ovarian syndrome patients. Hum Reprod 2002; 17 (5): 1207–1211. doi: 10.1093/humrep/17.5.1207.
40. Páez JC, Arreseygor VG, Zgrablich P. Obesity and the possibility of conceiving a child during assisted reproduction treatment: an Argentinian experience. JBRA Assist Reprod 2020; 24 (2): 115–117. doi: 10.5935/1518-0557.20190064.
41. Koning AM, Mutsaerts MA, Kuchenbecker WK et al. Complications and outcome of assisted reproduction technologies in overweight and obese women. Hum Reprod 2012; 27 (2): 457–467. doi: 10.1093/humrep/der416.
42. Fullston T, Ohlsson Teague EM et al. Paternal obesity initiates metabolic disturbances in two generations of mice with incomplete penetrance to the F2 generation and alters the transcriptional profile of testis and sperm microRNA content. FASEB J 2013; 27 (10): 4226–4243. doi: 10.1096/fj.12-224048.
43. McPherson NO, Fullston T, Bakos HW et al. Obese father’s metabolic state, adiposity, and reproductive capacity indicate son’s reproductive health. Fertil Steril 2014; 101 (3): 865–873. doi: 10.1016/j.fertnstert.2013.12.007.
44. Soubry A, Schildkraut JM, Murtha A at al. Paternal obesity is associated with IGF2 hypomethylation in newborns: results from a Newborn Epigenetics Study (NEST) cohort. BMC Med 2013; 11 : 29. doi: 10.1186/1741-7015-11-29.
45. Pasquali R. Obesity and androgens: facts and perspectives. Fertil Steril 2006; 85 (5): 1319–1340. doi: 10.1016/j.fertnstert.2005.10.054.
46. Practice Committee of the American Society for Reproductive Medicine. Electronic address: asrm@asrm.org, Practice Committee of the American Society for Reproductive Medicine. Obesity and reproduction: a committee opinion. Fertil Steril 2021; 116 (5): 1266–1285. doi: 10.1016/j.fertnstert.2021.08.018.
47. Jensen TK, Andersson AM, Jørgensen N et al. Body mass index in relation to semen quality and reproductive hormones among 1,558 Danish men. Fertil Steril 2004; 82 (4): 863–870. doi: 10.1016/j.fertnstert.2004.03.056.
48. Du Plessis SS, Cabler S, McAlister DA et al. The effect of obesity on sperm disorders and male infertility. Nat Rev Urol 2010; 7 (3): 153–161. doi: 10.1038/nrurol.2010.6.
49. Aggerholm AS, Thulstrup AM, Toft G et al. Is overweight a risk factor for reduced semen quality and altered serum sex hormone profile? Fertil Steril 2008; 90 (3): 619–626. doi: 10.1016/ j.fertnstert.2007.07.1292.
50. Chavarro JE, Toth TL, Wright DL et al. Body mass index in relation to semen quality, sperm DNA integrity, and serum reproductive hormone levels among men attending an infertility clinic. Fertil Steril 2010; 93 (7): 2222–2231. doi: 10.1016/j.fertnstert.2009.01.100.
51. Duits FH, van Wely M, van der Veen F et al. Healthy overweight male partners of subfertile couples should not worry about their semen quality. Fertil Steril 2010; 94 (4): 1356–1359. doi: 10.1016/j.fertnstert.2009.05.075.
52. Eskandar M, Al-Asmari M, Babu Chaduvula S et al. Impact of male obesity on semen quality and serum sex hormones. Adv Urol 2012; 2012 : 407601. doi: 10.1155/2012/407601.
53. Macdonald AA, Stewart AW, Farquhar CM. Body mass index in relation to semen quality and reproductive hormones in New Zealand men: a cross-sectional study in fertility clinics. Hum Reprod 2013; 28 (12): 3178–3187. doi: 10.1093/humrep/det379.
54. Campbell JM, Lane M, Owens JA et al. Paternal obesity negatively affects male fertility and assisted reproduction outcomes: a systematic review and meta-analysis. Reprod Biomed Online 2015; 31 (5): 593–604. doi: 10.1016/ j.rbmo.2015.07.012.
55. Dupont C, Faure C, Sermondade N et al. Obesity leads to higher risk of sperm DNA damage in infertile patients. Asian J Androl 2013; 15 (5): 622–625. doi: 10.1038/aja.2013.65.
56. Fariello RM, Pariz JR, Spaine DM et al. Association between obesity and alteration of sperm DNA integrity and mitochondrial activity. BJU Int 2012; 110 (6): 863–867. doi: 10.1111/j.1464-410X.2011.10813.x.
57. Bandel I, Bungum M, Richtoff J et al. No association between body mass index and sperm DNA integrity. Hum Reprod 2015; 30 (7): 1704–1713. doi: 10.1093/humrep/dev111.
58. Eisenberg ML, Kim S, Chen Z et al. The relationship between male BMI and waist circumference on semen quality: data from the LIFE study. Hum Reprod 2014; 29 (2): 193–200. doi: 10.1093/humrep/det428.
59. Rybar R, Kopecka V, Prinosilova P et al. Male obesity and age in relationship to semen parameters and sperm chromatin integrity. Andrologia 2011; 43 (4): 286–291. doi: 10.1111/j.1439-02 72.2010.01057.x.
60. Ramlau-Hansen CH, Thulstrup AM, Nohr EA et al. Subfecundity in overweight and obese couples. Hum Reprod 2007; 22 (6): 1634–1637. doi: 10.1093/humrep/dem035.
61. Kolotkin RL, Zunker C, Østbye T. Sexual functioning and obesity: a review. Obesity (Silver Spring) 2012; 20 (12): 2325–2333. doi: 10.1038/ oby.2012.104.
62. Han TS, Tajar A, O’Neill TW et al. Impaired quality of life and sexual function in overweight and obese men: the European Male Ageing Study. Eur J Endocrinol 2011; 164 (6): 1003–1011. doi: 10.1530/EJE-10-1129.
63. Burnett AL, Strong TD, Trock BJ et al. Biomarker measurements of endothelial function and oxidative stress after daily dosing of sildenafil in type 2 diabetic men with erectile dysfunction. J Urol 2009; 181 (1): 245–251. doi: 10.1016/j.juro.2008.09.005.
64. Araña Rosaínz M de J, Ojeda MO, Acosta JR et al. Imbalanced low-grade inflammation and endothelial activation in patients with type 2 diabetes mellitus and erectile dysfunction. J Sex Med 2011; 8 (7): 2017–2030. doi: 10.1111/j.1743-6109.2011.02277.x.
65. Kelleher S, Conway AJ, Handelsman DJ. Blood testosterone threshold for androgen deficiency symptoms. J Clin Endocrinol Metab 2004; 89 (8): 3813–3817. doi: 10.1210/jc.2004-0143.
66. Mokdad AH, Ford ES, Bowman BA et al. Prevalence of obesity, diabetes, and obesity-related health risk factors, 2001. JAMA 2003; 289 (1): 76–79. doi: 10.1001/jama.289.1.76.
67. Eisenberg ML, Sundaram R, Maisog J et al. Diabetes, medical comorbidities and couple fecundity. Hum Reprod 2016; 31 : 2369–2376. doi: 10.1093/humrep/dew200.
68. Luboshitzky R, Lavie L, Shen-Orr Z et al. Altered luteinizing hormone and testosterone secretion in middle-aged obese men with obstructive sleep apnea. Obes Res 2005; 13 (4): 780–786. doi: 10.1038/oby.2005.88.
69. Luboshitzky R, Zabari Z, Shen-Orr Z at al. Disruption of the nocturnal testosterone rhythm by sleep fragmentation in normal men. J Clin Endocrinol Metab 2001; 86 (3): 1134–1139. doi: 10.1210/jcem.86.3.7296.
70. Torres M, Laguna-Barraza R, Dalmases M et al. Male fertility is reduced by chronic intermittent hypoxia mimicking sleep apnea in mice. Sleep 2014; 37 (11): 1757–1765. doi: 10.5665/sleep.4166.
71. Magnusdottir EV, Thorsteinsson T, Thorsteins - dottir S et al. Persistent organochlorines, sedentary occupation, obesity and human male subfertility. Hum Reprod 2005; 20 (1): 208–215. doi: 10.1093/humrep/deh569.
72. Oliva A, Spira A, Multigner L. Contribution of environmental factors to the risk of male infertility. Hum Reprod 2001; 16 (8): 1768–1776. doi: 10.1093/humrep/16.8.1768.
73. Shafik A, Olfat S. Lipectomy in the treatment of scrotal lipomatosis. Br J Urol 1981; 53 (1): 55–61. doi: 10.1111/j.1464-410x.1981.tb031 29.x.
74. Jung A, Schill WB. Male infertility. Current life style could be responsible for infertility. MMW Fortschr Med 2000; 142 (37): 31–33.
75. Rajender S, Avery K, Agarwal A. Epigenetics, spermatogenesis and male infertility. Mutat Res 2011; 727 (3): 62–71. doi: 10.1016/j.mrrev.2011.04.002.
76. Nilsson EE, Skinner MK. Environmentally induced epigenetic transgenerational inheritance of disease susceptibility. Transl Res 2015; 165 (1): 12–17. doi: 10.1016/j.trsl.2014.02.003.
77. Soubry A, Schildkraut JM, Murtha A et al. Paternal obesity is associated with IGF2 hypomethylation in newborns: results from a Newborn Epigenetics Study (NEST) cohort. BMC Med 2013; 11 : 29. doi: 10.1186/1741-7015-11-29.
78. Huber-Buchholz MM, Carey DG, Norman RJ. Restoration of reproductive potential by lifestyle modification in obese polycystic ovary syndrome: role of insulin sensitivity and luteinizing hormone. J Clin Endocrinol Metab 1999; 84 (4): 1470–1474. doi: 10.1210/jcem.84.4. 5596.
79. Balen AH, Anderson RA. Impact of obesity on female reproductive health: British Fertility Society, Policy and Practice Guidelines. Hum Fertil (Camb) 2007; 10 (4): 195–206. doi: 10.1080/14647270701731290.
80. Bates GW, Whitworth NS. Effect of body weight reduction on plasma androgens in obese, infertile women. Fertil Steril 1982; 38 (4): 406–409.
81. Garrow JS, Summerbell CD. Meta-analysis: effect of exercise, with or without dieting, on the body composition of overweight subjects. Eur J Clin Nutr 1995; 49 (1): 1–10.
82. Skender ML, Goodrick GK, Del Junco DJ et al. Comparison of 2-year weight loss trends in behavioral treatments of obesity: diet, exercise, and combination interventions. J Am Diet Assoc 1996; 96 (4): 342–346. doi: 10.1016/S0002-822 3 (96) 00096-X.
83. Zain MM, Norman RJ. Impact of obesity on female fertility and fertility treatment. Womens Health (Lond) 2008; 4 (2): 183–194. doi: 10.2217/17455057.4.2.183.
84. Henness S, Perry CM. Orlistat: a review of its use in the management of obesity. Drugs 2006; 66 (12): 1625–1656. doi: 10.2165/00003495-20 0666120-00012.
85. Astrup A, Rössner S, Van Gaal L et al. Effects of liraglutide in the treatment of obesity: a randomised, double-blind, placebo-controlled study. Lancet 2009; 374 (9701): 1606–1616. doi: 10.1016/S0140-6736 (09) 61375-1.
86. Peirson L, Douketis J, Ciliska D et al. Treatment for overweight and obesity in adult populations: a systematic review and meta-analysis. CMAJ Open 2014; 2 (4): E306–E317. doi: 10.9778/cmajo.20140012.
87. Salameh JR. Bariatric surgery: past and present. Am J Med Sci 2006; 331 (4): 194–200. doi: 10.1097/00000441-200604000-00005.
88. Eid GM, Cottam DR, Velcu LM et al. Effective treatment of polycystic ovarian syndrome with Roux-en-Y gastric bypass. Surg Obes Relat Dis 2005; 1 (2): 77–80. doi: 10.1016/ j.soard.2005.02.008.
89. Teitelman M, Grotegut CA, Williams NN et al. The impact of bariatric surgery on menstrual patterns. Obes Surg 2006; 16 (11): 1457–1463. doi: 10.1381/096089206778870148.
90. Andreasen LA, Nilas L, Kjær MM. Operative complications during pregnancy after gastric bypass – a register-based cohort study. Obes Surg 2014; 24 (10): 1634–1638. doi: 10.1007/ s11695-014-1232-z.
91. Beard JH, Bell RL, Duffy AJ. Reproductive considerations and pregnancy after bariatric surgery: current evidence and recommendations. Obes Surg 2008; 18 (8): 1023–1027. doi: 10.1007/s11695-007-9389-3.
92. Monson M, Jackson M. Pregnancy after bariatric surgery. Clin Obstet Gynecol 2016; 59 (1): 158–171. doi: 10.1097/GRF.0000000000000178.
93. American Dietetic Association, American Society of Nutrition, Siega-Riz AM, King JC. Position of the American Dietetic Association and American Society for Nutrition: obesity, reproduction, and pregnancy outcomes. J Am Diet Assoc 2009; 109 (5): 918–927. doi: 10.1016/ j.jada.2009.03.020.
94. Sheiner E, Edri A, Balaban E et al. Pregnancy outcome of patients who conceive during or after the first year following bariatric surgery. Am J Obstet Gynecol 2011; 204 (1): 50.e1–50.e6. doi: 10.1016/j.ajog.2010.08.027.
95. Kjaer SK, van den Brule AJ, Paull G et al. Type specific persistence of high risk human papillomavirus (HPV) as indicator of high grade cervical squamous intraepithelial lesions in young women: population based prospective follow-up study. BMJ 2002; 325 (7364): 572. doi: 10.1136/bmj.325.7364.572.
96. Metwally M, Cutting R, Tipton A et al. Effect of increased body mass index on oocyte and embryo quality in IVF patients. Reprod Biomed Online 2007; 15 (5): 532–538. doi: 10.1016/s1472-6483 (10) 60385-9.
97. Bellver J, Rossal LP, Bosch E et al. Obesity and the risk of spontaneous abortion after oocyte donation. Fertil Steril 2003; 79 (5): 1136–1140. doi: 10.1016/s0015-0282 (03) 00176-6.
98. Bellver J, Melo MA, Bosch E et al. Obesity and poor reproductive outcome: the potential role of the endometrium. Fertil Steril 2007; 88 (2): 446–451. doi: 10.1016/j.fertnstert.2006.11.162.
99. Hotamisligil GS, Shargill NS, Spiegelman BM. Adipose expression of tumor necrosis factor-alpha: direct role in obesity-linked insulin resistance. Science 1993; 259 (5091): 87–91. doi: 10.1126/science.7678183.
100. Cnattingius S, Bergström R, Lipworth L et al. Prepregnancy weight and the risk of adverse pregnancy outcomes. N Engl J Med 1998; 338 (3): 147–152. doi: 10.1056/NEJM199801153380302.
101. Catov JM, Bodnar LM, Kip KE et al. Early pregnancy lipid concentrations and spontaneous preterm birth. Am J Obstet Gynecol 2007; 197 (6): 610.e1–610.e7. doi: 10.1016/ j.ajog.2007.04.024.
102. Catov JM, Bodnar LM, Ness RB et al. Inflammation and dyslipidemia related to risk of spontaneous preterm birth. Am J Epidemiol 2007; 166 (11): 1312–1319. doi: 10.1093/aje/kwm 273.
Labels
Paediatric gynaecology Gynaecology and obstetrics Reproduction medicine
Article was published inCzech Gynaecology

2023 Issue 3-
All articles in this issue
- Sentinel lymph node mapping in endometrial cancer – robotic vs. laparoscopic detection system
- Prenatal detection of copy number variants in fetuses with detected congenital devolpmental disordes, from 2015 to 2020 by Multiplex Ligation-Dependent Probe Amplification and microarray analysis
- Physiotherapy in a patient with diastasis of the rectus abdominis muscle after childbirth
- Thoracopagus conjoined twins
- Obesity and assisted reproduction
- Prevention of intrauterine adhesions
- Pelvic pain in women after childbirth and physiotherapy
- Use of antipsychotics during pregnancy and their impact on congenital malformations and early neonatal adaptation
- Prof. MUDr. Zdeněk Hájek, DrSc. – 80letý
- Kompetence lékaře po úspěšném absolvování kmenové zkoušky z oboru gynekologie a porodnictví
- The role of the systemic inflammatory index in determining the length of hospital stay in patients with hyperemesis gravidarum
- Sustainability, population and reproductive ethics
- Czech Gynaecology
- Journal archive
- Current issue
- Online only
- About the journal
Most read in this issue- Pelvic pain in women after childbirth and physiotherapy
- Physiotherapy in a patient with diastasis of the rectus abdominis muscle after childbirth
- Prevention of intrauterine adhesions
- Obesity and assisted reproduction
Login#ADS_BOTTOM_SCRIPTS#Forgotten passwordEnter the email address that you registered with. We will send you instructions on how to set a new password.
- Career


