-
Medical journals
- Career
Současné znalosti o fertilitu šetřící léčbě pacientek s karcinomem děložního hrdla
Authors: L. Fricová; J. Sláma
Authors‘ workplace: Gynekologicko-porodnická klinika 1. LF UK a VFN v Praze
Published in: Ceska Gynekol 2022; 87(5): 362-370
Category: Review Article
doi: https://doi.org/10.48095/cccg2022362Overview
Úvod: Karcinom děložního hrdla přímo ovlivňuje reprodukční funkce žen ve fertilním věku. Až třetina onemocnění je diagnostikována u žen mladších 45 let, které stále mohou mít otevřené reprodukční plány. V posledních letech se proto zvyšuje zájem o provádění fertilitu šetřící léčby (FST – fertility-sparing treatment), jejímž cílem je zachování fertility při dosažení stejné onkologické bezpečnosti jako u radikální chirurgické léčby. Cíl: Shrnout současné poznatky o FST u žen s časnými stadii karcinomu děložního hrdla. Metodika: Přehled publikované literatury na dané téma s využitím lékařských databází. Výsledky: FST je vyhrazena pro pacientky s HPV asociovaným karcinomem děložního hrdla do stadia IB s negativními uzlinami. K dispozici jsou konzervativní výkony (konizace a prostá vaginální trachelektomie) a radikální trachelektomie. Konzervativní postupy u nádorů ≤ 2 cm mají srovnatelné onkologické výsledky jako radikální léčba s výrazně nižší mírou perinatologických komplikací. V průměru 55 % pacientek po léčbě otěhotní a z nich v průměru 70 % porodí živého novorozence. Přibližně 38 % porodů je předčasných, nejčastěji po radikální trachelektomii. Nejčastější pooperační komplikací s přímým dopadem na plodnost je cervikální stenóza. Závěr: U vybrané skupiny pacientek s nádory ≤ 2 cm je FST bezpečný postup s dobrými perinatologickými výsledky. Zůstává však nejasné, zda je bezpečné nabízet tuto léčbu pacientkám s většími nádory. Použití neoadjuvantní chemoterapie následované konzervativní operací je slibný přístup, který však vyžaduje další ověření v klinických studiích.
Klíčová slova:
karcinom děložního hrdla – trachelektomie – fertilitu šetřící léčba – konizace
Úvod
Karcinom děložního hrdla je onkologické onemocnění, které přímo ovlivňuje reprodukční funkce žen ve fertilním věku. Až třetina případů je diagnostikována u žen do 45 let, které stále mohou mít otevřené reprodukční plány [1]. Podle posledních dat z Národního onkologického registru z roku 2018 byl v ČR diagnostikován invazivní karcinom děložního hrdla u 141 žen ve věku do 40 let a dalších 85 případů u žen ve věku do 45 let. Podíl karcinomů děložního hrdla v těchto věkových kategoriích tvořil 19,2 % (141/734), resp. 30,8 % (226/734) z celkového počtu 734 nově diagnostikovaných nádorů děložního hrdla [1].
Diskuze o budoucí graviditě by proto měla být u mladých žen s karcinomem děložního hrdla standardní součástí předoperační rozvahy. Ačkoli pacientek s invazivním karcinomem děložního hrdla v rozvinutých zemích díky efektivitě organizovaných screeningových programů obecně ubývá, vzhledem k trendu plánování gravidity ve vyšším věku naopak narůstá počet pacientek s karcinomem děložního hrdla a nerealizovanými nebo neuzavřenými reprodukčními plány [2].
Z tohoto důvodu v posledních letech vzrůstá zájem o fertilitu šetřící léčebné postupy (FST – fertility-sparing treatment) časných stadií karcinomu děložního hrdla. Cílem intenzivního klinického výzkumu je dosažení rovnováhy mezi onkologickou bezpečností příslušného léčebného postupu a udržením příznivých perinatologických výsledků. Článek uvádí přehled doposud publikovaných poznatků o jednotlivých léčebných postupech, jejich onkologických výsledcích a dopadech pro následnou fertilitu.
Základní podmínky pro FST
Standardním postupem u časných stadií invazivního karcinomu děložního hrdla je s výjimkou stadia IA1 bez lymfovaskulární invaze (LVSI – lymphovascular space invasion) provedení radikálního chirurgického operačního výkonu se stagingem spádových lymfatických uzlin nebo provedení radikální konkomitantní chemoradioterapie [3,4]. Obě modality však ve výsledku vedou k trvalé sterilitě, a připravují tak pacientky o možnost další reprodukce.
Alternativou pro ženy bez uzavřených reprodukčních plánů je realizace FST, jejímž výsledkem je zachování dostatečné funkční části děložního hrdla. Společným jmenovatelem všech fertilitu šetřících postupů je zachování fertility při adekvátní onkologické bezpečnosti [4]. Samotné zachování fertility v sobě nese nejen schopnost otěhotnět, ale rovněž donosit zdravé dítě s co nejmenším rizikem předčasného porodu. Výsledky onkologické bezpečnosti by měly být srovnatelné s výsledky radikální chirurgické léčby pro příslušné klinické stadium onemocnění.
Již v roce 1932 byla publikována rumunským lékařem Aburelem technika abdominální radikální trachelektomie. Snahy o graviditu po této operaci však nebyly úspěšné, a proto se od dalších pokusů o FST na dlouhou dobu upustilo, stejně jako od Aburelovy operační techniky [5,6]. K renezanci snah o FST došlo až s rozvojem minimálně invazivních technik v gynekologické onkologii. Jedním z nejdůležitějších průkopníků na poli FST byl francouzský gynekolog Daniel Dargent. Svou publikací z roku 1994 doložil příznivé onkologické i perinatologické výsledky po provedení radikální vaginální trachelektomie a laparoskopické pánevní lymfadenektomie u pacientek s HPV asociovanými nádory děložního hrdla s velikostí ≤ 2 cm [7].
Od té doby byla publikována řada prací, vč. několika metaanalýz, z nichž vyplývá, že pro příznivé výsledky FST je nezbytné dodržení několika základních podmínek. Kromě adekvátního věku pacientky a přání budoucí gravidity je možno FST zvažovat u pacientek s HPV asociovaným spinocelulárním karcinomem, adenokarcinomem nebo adenoskvamózním karcinomem ve stadiích IA–IB1 s negativními spádovými lymfatickými uzlinami. Přítomnost LVSI není kontraindikací výkonu, ale je spojována s vyšším rizikem recidivy. Provedení FST u pacientek s non-HPV asociovanými nádory není doporučeno, rovněž není běžně doporučováno provedení FST v případě, že nelze dosáhnout dostatečného (≥ 5 mm) zdravého resekčního okraje při současném zachování alespoň 10 mm reziduálního děložního hrdla. FST by měla být navíc rezervována pro tumory, které v největším rozměru nepřekračují 2 cm [4]. Léčba větších nádorů není kontraindikována, ale je považována za rizikový postup, a její provedení je vhodné zvažovat především v rámci klinických studií. Současná indikační kritéria k provedení FST jsou shrnuta v tab. 1.
Table 1. Vstupní kritéria k provedení FST.
Tab. 1. Entry criteria for FST.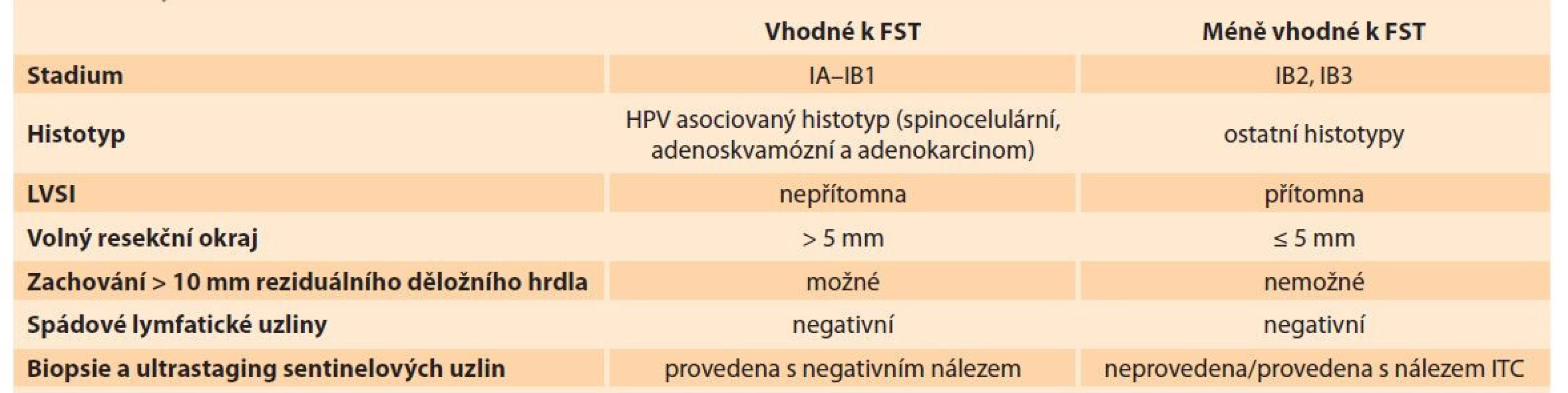
FST – fertilitu šetřící léčba, ITC – izolované nádorové buňky, LVSI – lymfangioinvaze Při úvaze o FST je k dispozici několik technicky rozdílných operačních postupů. S výjimkou stadia IA1 bez přítomnosti LVSI je obligatorní součástí operační léčby chirurgický staging regionálních lymfatických uzlin. U stadia IA1 s pozitivitou LVSI postačuje biopsie sentinelových uzlin (SLNB – sentinel lymph node biopsy), u všech vyšších stadií je nutná systematická pánevní lymfadenektomie a doplnění o SLNB je považováno za velmi vhodné. Díky mapování sentinelových uzlin a následné SLNB je možné identifikovat metastázy v netypických lokalizacích, provést detailní a nákladné ultrastagingové vyšetření omezeného počtu uzlin a detekovat jejich nízkoobjemové metastatické postižení (mikrometastázy a malé metastázy). Podle recentní literatury je na přítomnost mikrometastázy v lymfatických uzlinách potřeba nahlížet jako na významný nepříznivý prognostický faktor, který kontraindikuje možnost FST [8]. Kontroverze nadále vyvolává nález izolovaných nádorových buněk (ITC – isolated tumour cells), který je sice relativně vzácný, ale podle dat z dosud největšího souboru 528 chirurgicky léčených pacientek přináší velmi podobné riziko jako nález metastázy, a měl by proto být rovněž důvodem ke kontraindikaci FST [9].
Nejdůležitějšími indikačními kritérii na úrovní vlastního nádoru jsou jeho velikost, která by v největším rozměru neměla přesahovat 2 cm, stromální invaze, která by neměla přesahovat 1 cm, a podíl postiženého objemu děložního hrdla, který by neměl přesahovat 50 %. Pokud podle předoperačních vyšetření velikost nebo lokalizace nádoru nesplňují vhodná indikační kritéria, je možné zvážit provedení abdominální radikální trachelektomie, která umožňuje adaptovat radikalitu výkonu na parametriích identicky jako při radikální hysterektomii, nebo zvážit zařazení pacientek do klinické studie využívající experimentální postup s podáním neoadjuvantní chemoterapie (NACT – neoadjuvant chemotherapy). Jejím primárním cílem je zmenšením nádoru dosáhnout naplnění aktuálně akceptovaných kritérií bezpečnosti. V literatuře je popsána řada léčebných cytostatických režimů založených na platinovém derivátu. Nejlepších výsledků je dosaženo při kombinaci s taxany a/nebo s ifosfamidem. Uváděná parciální odpověď se pohybuje mezi 68 a 87 % [10] a kompletní klinickou odpověď lze zaznamenat u 5–48 % pacientek [16]. Lepších výsledků je rovněž dosaženo při využití dávkově „denzních“ režimů, kdy je chemoterapie aplikována v odstupu 10–12 dní [11].
Nedostatečná odpověď s reziduálním nálezem > 2 cm je spojena s významným onkologickým rizikem, a proto by takové pacientky měly být kontraindikovány pro FST a měly by podstoupit definitivní léčbu [12,13]. V případě dobré klinické odpovědi je naopak možno přistoupit k provedení FST.
Pro načasování podání NACT existují dva rozdílné klinické přístupy. Chemoterapie může být podána primárně a až v případě dobré klinické odpovědi následuje obvykle v jedné době provedení chirurgického stagingu spádových lymfatických uzlin a provedení operačního výkonu na děložním hrdle. Druhou alternativou je nejdříve provedení chirurgického stagingu spádových uzlin. Teprve v případě jejich negativity je podána NACT následovaná při dosažení léčebné odpovědi provedením chirurgického výkonu ve druhé době [4]. Třebaže je doloženo, že podání NACT nezlepšuje prognózu pacientek, a podle aktuálních evropských doporučených postupů proto není zařazeno do standardu léčebných protokolů, v případě eliminace nízkoobjemového metastatického postižení uzlin při primárním podání NACT může zvýšit počet pacientek, kterým je možno nabídnout FST [12]. V případě primárního provedení chirurgického stagingu lymfatických uzlin, budou pacientky s nízkoobjemovým metastatickým postižením rovnou kontraindikovány k pokračování FST. Pro časování NACT stále neexistuje jednoznačná shoda především v důsledku absence dostatečně validních dat. Přesto se zdá, že volba dvoukrokového managementu je z onkologického pohledu bezpečnějším postupem. Práce srovnávající oba postupy při radikální chirurgické léčbě doložila podstatně nižší frekvenci metastatického postižení uzlin v rameni s NACT, kde byla zjištěna u 8,1 % žen, zatímco v rameni s primárně radikální hysterektomií byla detekována u 25,6 % [12].
Kromě velikosti nádoru jsou definovány ještě další parametry spojené s nepříznivou prognózou nebo rizikem recidivy. Mezi ně patří nedostatečné nebo pozitivní chirurgické okraje, postižení parametrií a přítomnost LVSI. V multicentrické studii ConCerv, která sledovala bezpečnost konzervativního chirurgického výkonu u malých nádorů do 2 cm, byla přítomnost LVSI dokonce kontraindikací pro vstup do studie [14]. V případě nálezu některých rizikových faktorů je buď nutné zvolit definitivní léčbu, nebo o zvýšeném riziku recidivy pacientku důkladně poučit. Rizikové faktory recidivy a nepříznivé prognózy shrnuje tab. 2.
Table 2. Rizikové faktory pro recidivu a nepříznivou prognózu po FST.
Tab. 2. Risk factors for recurrence and poor prognosis after FST.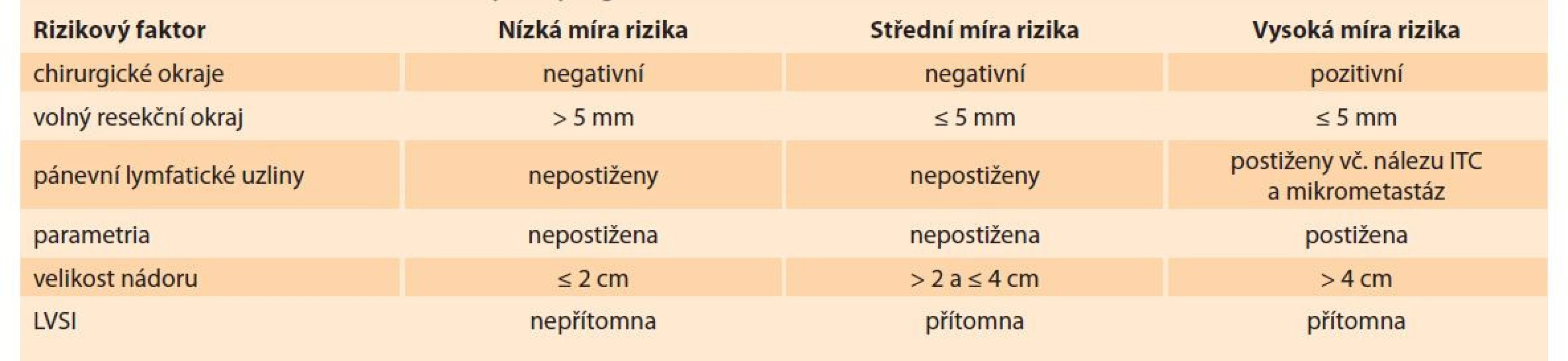
FST – fertilitu šetřící léčba, ITC – izolované nádorové buňky, LVSI – lymfangioinvaze Typy chirurgických výkonů při FST
Pro fertilitu šetřící výkony na děložním hrdle se využívají výkony s rozdílnou radikalitou. Nejkonzervativnějším výkonem je konizace následovaná prostou vaginální trachelektomií. Mezi radikální výkony patří radikální vaginální a radikální abdominální trachelektomie, která může být provedena laparotomicky, laparoskopicky nebo roboticky. Volba postupu by vždy měla vycházet ze snahy zajistit co nejlepší onkologický výsledek při ponechání dostatečné funkční reziduální části děložního hrdla [4].
1. Konizace děložního hrdla
Kuželovité vytnutí postižené části děložního hrdla je současně terapeutickým i diagnostickým postupem. Velikost konusu je vždy nutno individualizovat. Podstatnou roli v rozhodování hraje velikost a tvar děložního hrdla a kolposkopická charakteristika nálezu – rozsah, uložení a histologický typ konizované léze [15]. Výkon se nejčastěji provádí pomocí vysokofrekvenčních elektrochirurgických nástrojů. Od tradičního provedení konizace pomocí skalpelu s následnou suturou defektu se upouští pro vyšší počet pooperačních komplikací a následné obtíže při dispenzarizaci.
Konizace je adekvátním výkonem pro nádory stadia IA. V případě nádorů stadia IA1 bez LVSI navíc postačuje dosažení adekvátního zdravého resekčního okraje a dále již není nutné doplňovat staging spádových lymfatických uzlin [4]. U vyšších stadií je ale uzlinový staging indikován vždy. Konizace je řadou autorů považována za adekvátní výkon rovněž u nádorů stadia IB1 s velikostí ≤ 1 cm [4]. Podle dosud nepublikovaných dat multicentrické studie FERTISS je míra recidivy po konizaci identická i pro skupinu nádorů ≤ 2 cm [16]. Argumentem pro konzervativnější přístup nejsou jen významně lepší perinatologické výsledky, ale především předpoklad velmi nízkého (< 1 %) rizika postižení parametrií [17,18].
2. Prostá vaginální trachelektomie
Na rozdíl od konizace se při prosté vaginální trachelektomii odstraní celého portio vaginalis děložního hrdla, které je tak prakticky amputováno a ponechána je pouze jeho minimální část a portio supravaginalis. Výkon lze provést elektrofrekvenční jehlou nebo skalpelem a „neohrdlo“ je následně cirkulárně přišito k resekčnímu okraji linie řezu na pochvě [4]. Indikace pro provedení prosté trachelektomie se překrývají s indikací konizace a kromě zvyklosti pracoviště jsou zohledňovány rovněž identické rozhodovací faktory.
3. Radikální trachelektomie
Radikální trachelektomie zahrnuje kromě samotného výkonu odstranění části parametrií a proximální pochvy [19]. V řadě svých principů je blízká nebo totožná s radikální hysterektomií. Rozsah resekce části pochvy a parametrií závisí na pokročilosti procesu. Operaci je možno provést abdominálním nebo vaginálním přístupem, případně miniinvazivně s využitím laparoskopického nebo robotického přístupu. Rozhodující pro volbu operační techniky jsou charakteristiky tumoru, zkušenosti operatéra a technické vybavení pracoviště. Radikální trachelektomie je indikována pro pacientky ve stadiu T1b1 [3].
3.1 Vaginální radikální trachelektomie
Do nedávné doby byla vaginální radikální trachelektomie nejčastěji voleným přístupem při provádění FST [20]. Výkon začíná laparoskopickým stagingem pánevních uzlin následovaným vaginální radikální trachelektomií [5,21]. Může být realizován v jedné době nebo ve dvou dobách po získání informace o negativitě spádových lymfatik. Při vaginální části výkonu je snaha o uchování cévního zásobení z uterinní arterie vykoupena omezeným rozsahem resekce postranních a zadních parametrií. Z toho důvodu je optimální provádět operaci pouze ženám s nádory o velikosti maximálně 2 cm v největším rozměru. Onkologické výsledky se u nich neliší od provedení radikální hysterektomie [6]. V přehledové práci z roku 2016 podstoupila vaginální radikální trachelektomii téměř polovina pacientek (49 %, 1 355/2 777) [21]. V recentně prezentovaném souboru je ale již patrný významný příklon (56,5 %, 414/733) k méně radikálním operacím, třebaže doporučené postupy takový management zatím nepovažují za standardní [16].
3.2 Abdominální radikální trachelektomie
Podle přístupu je klasifikována na laparotomickou abdominální radikální trachelektomii a minimálně invazivní radikální trachelektomii s využitím robotického systému, laparoskopie nebo kombinace obou technik [21].
3.2.1 Laparotomická abdominální radikální trachelektomie
Z onkologického hlediska umožňuje nejlepší adaptaci radikality a s tím spojenou možnost dosažení maximálního operačního rozsahu. Výkon na parametriích je identický s postupem při radikální hysterektomii a umožňuje volbu všech typů radikality podle klasifikace Querleau-Morrow [22]. Teoreticky tak lze přizpůsobit radikalitu i pro FST u případů s méně vhodnou charakteristikou nádoru, především pro nádory > 2 cm. Po radikálním výkonu je oddělené děložní tělo s ponechanou proximální částí děložního hrdla cirkulárně našito na proximální okraj resekované pochvy [5]. Laparotomický operační přístup k radikální trachelektomii je oproti vaginálnímu významně lépe adaptovatelný a nevyžaduje dlouhou dobu učení, navíc je mezi jednotlivými operatéry i centry lépe reprodukovatelný [21]. Laparotomická abdominální trachelektomie je tradičně častěji prováděna v USA, zatímco v Evropě je častěji prováděna vaginální radikální trachelektomie. V review literatury z roku 2016 tvořil podíl radikální abdominální trachelektomie z laparotomického přístupu 26 % ze všech případů (735/2 777) [21] v recentním review z roku 2020 bylo zastoupení ještě vyšší a tvořilo 35 % hodnocených případů (1 060/3 044) [23].
3.2.2 Totální laparoskopická a robotická radikální trachelektomie a laparoskopicky asistovaná robotická trachelektomie
Nejméně často používanými výkony jsou minimálně invazivní trachelektomie. Reprezentují pouze asi 11 % všech FST. Vzhledem k absenci laparotomie mají ale nižší chirurgickou morbiditu. Na druhé straně jsou ale vyjadřovány obavy z horších onkologických výsledků. Ty vyplývají jednak z výsledků studie LACC, která doložila významně horší prognózu pacientek po radikální hysterektomii provedené laparoskopicky, a dále z důvodu ztíženého určení místa amputace děložního hrdla ve vztahu k úrovni nádoru při nemožnosti užití palpační verifikace lokalizace tumoru [24,25].
Onkologické výsledky
Onkologické výsledky FST jsou u pacientek s negativními lymfatickými uzlinami a HPV asociovanými nádory ≤ 2 cm v největším rozměru zcela srovnatelné s radikální hysterektomií. Ve studii srovnávající 137 žen s nádory ≤ 2 cm, které podstoupily vaginální radikální trachelektomii, s ženami, které podstoupily radikální hysterektomii, byla 5letá míra přežití bez recidivy u obou skupin podobná (95 vs. 100 %) [26]. Frekvence recidiv po FST pro nádory ≤ 2 cm se v literatuře pohybuje průměrně okolo 5 %. V souboru 21 prací, které zahrnovaly dohromady 1 364 žen operovaných vaginální radikální trachelektomií, byla zjištěna 4 % recidiv u pacientek s nádory ≤ 2 cm, ovšem u žen s nádory > 2 cm byly zastoupeny recidivy již v 17 % a k úmrtí na recidivu došlo u 2 % pacientek [27]. V jiné práci tvořily pacientky s nádory > 2 cm jen 10 % kohorty, ale reprezentovaly 50 % recidiv [28].
Multicentrická práce věnovaná výsledkům FST u pacientek s nádory > 4 cm dokumentovala snahu o FST u 40 pacientek z 11 studií. Úspěšná léčba byla ale jen u 26 žen (65 %). Všechny pacientky dostaly NACT na bázi platiny následovanou konizací, prostou nebo radikální trachelektomií. Kompletní patologická odpověď byla dosažena u 56 %, zatímco u dvou žen (7,7 %) došlo k recidivě. Všechny pacientky s recidivou byly léčeny NACT v režimu cisplatina/ifosfamid namísto dnes preferované kombinace cisplatiny a paklitaxelu, podstoupily neradikální operaci a v konečné histologii měly reziduální onemocnění. Přežití 4,5 let bez onemocnění bylo 92,3 % a 4,5leté celkové přežití bylo 100 % [29].
Výsledky léčby z jednoho z našich pracovišť dokládá recentní práce dokumentující soubor pacientek léčených FST od roku 1999 do roku 2018. Z celkem 91 zařazených žen úspěšně dokončilo léčbu 80 pacientek. U čtyř z nich došlo k lokální recidivě (5,0 %), ale žádná pacientka za sledované období (medián sledování 149 měsíců) nezemřela [20]. Multicentrická práce zahrnující data od 733 pacientek ze 44 center ve 13 zemích vč. ČR doložila 5,7% míru recidivy a 1,5% míru úmrtí na onemocnění u pacientek s nádory ≤ 2 cm. Navíc nebyl zjištěn žádný rozdíl mezi těmi, které podstoupily radikální nebo neradikální výkon na děložním hrdle, bez ohledu na přítomnost LVSI nebo podskupiny velikosti nádoru (≤ 1 cm a > 1 cm) [16]. V multiinstitucionální skupině 36 pacientek byla po konizaci ve stadiu IB1 diagnostikována pouze jedna recidiva (2,7 %) [30], v jiné skupině 43 pacientek rovněž s nádory ve stadiu IB1 léčených konizací kličkou byla zaznamenána míra recidivy 4,6 %, a to vždy s centrální lokalizací [31]. Alarmujícím zjištěním ve studii FERTISS byla 3krát vyšší míra recidivy u pacientek s tumory > 2 cm (19,4 vs. 5,7 %; p = 0,014). Míra recidivy u větších nádorů nesouvisela s typem chirurgického výkonu, typem nádoru ani s podáním NACT. Ze zjištěného vyplývá, že nejzásadnějšími rizikovými faktory pro vznik recidivy jsou velikost a histologický typ nádoru [16]. Nejčastější výskyt recidiv byl zaznamenán v oblasti děložního hrdla (53 %) a pánevních uzlin (22 %), a to bez ohledu na stadium a typ provedené operace [16]. Častá centrální lokalizace recidiv, která je doložena i dalšími studiemi [4,31,32], ale přináší možnost kurativní léčby. Terapeutické modality nabízející pacientkám kurativní léčbu v závislosti na druhu a lokalizaci recidivy představují výkony od záchovné operace na reziduálním hrdle umožňující další reprodukci až po definitivní léčbu s využitím chemoradioterapie nebo radikální hysterektomie.
Doposud nebylo pro pacientky po FST vytvořeno specifické doporučení pro pooperační sledování. Většina autorů proto přejímá stejný protokol sledování jako po radikální hysterektomii [33]. Proti tomuto schématu ale hovoří skutečnost, že u některých pacientek dojde k recidivě v období za více než 2 roky po operaci a také že dotaz na symptomy, gynekologické a fyzikální vyšetření nejsou k odhalení recidivy dostačující.
Vyhodnocení cytologického stěru po fertilitu šetřících výkonech je náročné a často vykazuje abnormality typu AGC-NOS (atypical glandular cells not otherwise specified – atypické žlázové buňky jinak blíže neurčené) [33], nezřídka z důvodu změněné anatomie po trachelektomii, kdy je odběr proveden z dolního děložního segmentu, což může vést k falešné interpretaci výsledků [4]. Sníženou výpovědní hodnotu může mít i stěr se zcela chybějícími endocervikálními buňkami z důvodu nemožnosti odběru pro stenózu hrdla. Převážný výskyt asymptomatických cervikálních recidiv dokládá důležitost pravidelného dlouhodobého sledování, které by mělo patřit do ambulancí zkušených kolposkopistů [16,34]. Podle recentních dat se jako nejpřesnější pro detekci recidivy ukazuje kombinace HPV testování, kolposkopie a expertního ultrazvukového vyšetření [4,16,33].
Perinatologické výsledky
Podle systematického přehledu literatury z roku 2016, který zahrnoval celkem 2 777 pacientek léčených některým z postupů FST, bylo zjištěno, že celková fertilita (tzv. pregnancy rate) po FST dosahovala 55 % (515/938). Uvedená hodnota je definována jako počet pacientek, které otěhotněly, z celkového počtu žen, které se o těhotenství snažily. Celkem 70 % (600/861) žen, které otěhotněly, porodilo živé dítě, ale více než třetina porodů byla předčasných. Přehled dat o perinatologických výsledcích po jednotlivých typech FST shrnuje tab. 3 [21]. Kromě schopnosti otěhotnět je klíčovým parametrem pro hodnocení výsledků FST schopnost donosit těhotenství a porodit zralý plod. Perinatologické výsledky jsou obvykle společně kalkulovány pro konizaci i prostou trachelektomii, protože pro oba výkony nedosahují významných odlišností. Hlavním rozdílem zůstává možnost spontánního vedení porodu u většiny pacientek po konizaci a naopak preference ukončení těhotenství císařským řezem u většiny pacientek po prosté trachelektomii [35]. Oběma metodami bylo podle systematického review ošetřeno 212 žen (8 %, 212/2 777) s tumorem o velikosti ≤ 2 cm. Těhotenství bylo dosaženo u 49 % operovaných pacientek, 7 % z nich pak potratilo v průběhu I. či II. trimestru. Podíl předčasně narozených dětí dosahoval pouze 15 % a dokonce jen 1 % porodů bylo v pásmu významné nezralosti do 28. týdne gravidity [27]. V porovnání s radikálními operačními technikami je podíl prematurity po konzervativních výkonech signifikantně nižší. Po radikální trachelektomii se pohybuje podíl prematurity od 39 % po vaginální radikální trachelektomii až k 57 % po abdominální radikální trachelektomii. Ještě významnější rozdíly se ale ukazují v případě porovnání frekvence porodů před 28. týdnem těhotenství, kdy po radikálních výkonech porodilo v průměru 5 % pacientek (2,2 % po radikální vaginální trachelektomii, 4,5 % po radikální abdominální trachelektomii a 8,1 % po miniinvazivně radikální trachelektomii) [27]. Po vaginální radikální trachelektomii je dokumentováno těhotenství u 37 % případů a u 3–19 % [36] je zakončeno potratem v průběhu I. nebo II. trimestru. K předčasnému porodu před 28. týdnem došlo u 2 % žen a u 39 % nastal porod do 36. týdne těhotenství [27]. Po abdominální radikální trachelektomii jsou onkologické výsledky vynikající, ale těhotenství úspěšně dosáhlo pouze 24 % žen a 5 % potratilo v průběhu I. či II. trimestru. Pregnancy rate zde bylo ze všech operačních přístupů nejnižší – pouze 44 %. Těhotenství po miniinvazivně radikální trachelektomii dosáhlo 24 % pacientek, shodně s hodnotami u laparotomického výkonu. Rovněž i podíl potratů v I. a II. trimestru činil 5 %. Pregnancy rate zde ale bylo vyšší a dosahovalo 65 % v porovnání s 44 % u laparotomického výkonu [27]. Zajímavým a současně poměrně alarmujícím faktem je, že část pacientek podstupuje FST, která může představovat onkologicky rizikový výkon, ale po jejím úspěšném realizování se nesnaží otěhotnět. V našem souboru se dlouhodobě nesnažilo dokonce 58 % pacientek i přes velmi důkladnou předoperační konzultaci [33].
Table 3. Perinatologické výsledky po různých typech FST [21].
Tab. 3. Perinatological results after different types of FST [21].![Perinatologické výsledky po různých typech FST [21].<br>
Tab. 3. Perinatological results after different types of FST [21].](https://www.prolekare.cz/media/cache/resolve/media_object_image_small/media/image_pdf/b14fa4f0d70b5054a45e8fd0ed5ff16c.jpg)
FST – fertilitu šetřící léčba
a hodnota vycházející z počtu pacientek s kompletními údaji, nikoliv z celé kohortySnížení fertility je po FST nejčastěji dáváno do souvislosti s cervikálním faktorem při pooperační stenóze děložního hrdla. Ačkoli bývá stenóza často asymptomatická, může kromě přímého negativního vlivu na fertilitu způsobit dysmenoreu, hematometru, hematosalpix nebo endometriózu [37]. Řešením této komplikace s dobrými krátkodobými výsledky je dilatace stenotického kanálu hrdla, problém ale nastává v případě poměrně častých recidiv stenózy, jejichž zvládání může být velmi obtížné. Důvodem jsou změněné anatomické poměry a změna polohy zevního ústí kanálu neocervixu. Stenóza se častěji vyskytuje po provedení profylaktické cerkláže (8 %) ve srovnání s pacientkami bez cerkláže (3 %). Po konzervativních výkonech je stenóza zaznamenávána asi u 3 % pacientek. Hodnota ale bude ještě nižší, protože u části pacientek je dávána do souvislosti s peroperačním provedením cerkláže. Po provedení radikální trachelektomie je stenóza hrdla popisovaná asi u 8 % pacientek a v případě současné cerkláže dále riziko narůstá [27]. Komplikace spojené s fertilitou mohou mít rovněž spojitost s postupy, které jsou součástí abdominální radikální trachelektomie. Podvaz uterinních arterií a poškození ovariálního cévního řečiště mohou vést k Ashermannovu syndromu a k předčasnému ovariálnímu selhání. Podobně může zhoršit motilitu a funkci vejcovodů nebo jejich obstrukci i extenzivní resekce parametrií [32]. Abdominální přístup navíc bývá spojován s častějším vznikem srůstů a zánětlivých komplikací [27]. Bylo rovněž prokázáno, že riziko předčasného porodu je významně vyšší u žen, které podstoupily více než jeden zákrok na děložním hrdle (13 vs. 4 %) a s rostoucí hloubkou excize (7–10 vs. 3 %) ve srovnání s běžnou populací [38]. Předpoklad, že jedním z hlavních faktorů, který vede k prematuritě, je nedostatečná kompetence zkráceného děložního hrdla, je řadou autorů rozporován. Přesto je součástí FST na některých pracovištích i rutinní provedení cerkláže, jejímž cílem je poskytnout děložnímu hrdlu mechanickou oporu a udržovat je uzavřené. Proti jejímu rutinnímu provádění ale hovoří skutečnost, že samotná cerkláž může přispívat ke zvýšenému riziku přestupu vaginální flóry skrze hrdlo na plodové obaly s následnou intrauterinní infekcí a předčasným odtokem vody plodové (PPROM – preterm prelabor rupture of membranes) [4,27]. Právě PPROM je nejčastější příčinou předčasného porodu u pacientek po FST [39]. Názor na používání cerkláže navíc není jednotný ani v průběhu gravidity, kde je některými autory prováděna preventivně a jinými až při dynamickém zkracování děložního hrdla.
Dosud nejsou k dispozici žádná data z randomizovaných studií, která by se přímo zabývala prenatálním a perinatálním managementem žen po FST [4]. Většinu dat je proto nutné aproximovat z informací o riziku pacientek po konizacích. Systematická přehledová práce věnovaná problematice managementu pacientek po FST v období před těhotenstvím a v jeho průběhu byla publikována českými autory a dokládá, že pacientky po FST profitují z pravidelné ultrazvukové cervikometrie a profylaktického podávání progesteronu vaginálně, které je započato nejpozději do konce I. trimestru v dávce 200 µg denně [35]. V literatuře je však využívána celá řada dalších podpůrných postupů zahrnujících rutinní screening a léčbu asymptomatické infekce dolního genitálního traktu, profylaktické podávání antibiotik, klid na lůžku nebo snížení fyzické aktivity [39]. Postupy k redukci rizika prematurity jsou navíc u jednotlivých operačních týmů značně odlišné a limitovaná vědecká data neumožňují dosažení takové úrovně znalostí, která by umožnila jejich standardizaci.
Závěr
Metoda FST představuje u pacientek s časným karcinomem děložního hrdla léčebný postup, který poskytuje naději na budoucí graviditu. Onkologické výsledky FST jsou u pacientek s negativními lymfatickými uzlinami a HPV asociovanými nádory ve stadiích IA–IB1 s velikostí ≤ 2 cm v největším rozměru excelentní. Pro FST se využívají výkony s rozdílnou radikalitou a volba postupu by vždy měla vycházet ze snahy zajistit co nejlepší onkologický výsledek při ponechání dostatečné funkční reziduální části děložního hrdla. Do nedávné doby byla nejčastěji voleným postupem vaginální radikální trachelektomie, v posledních letech je ale patrný významný příklon k méně radikálním operacím, třebaže doporučené postupy takový management zatím nepovažují za standardní.
Frekvence recidiv po FST pro nádory ≤ 2 cm se v literatuře pohybuje průměrně okolo 5 %. Nejzásadnějšími rizikovými faktory pro vznik recidivy jsou velikost tumoru > 2 cm a histologický typ. Mezi další rizikové faktory jsou řazeny nedostatečné nebo pozitivní chirurgické okraje, postižení parametrií a přítomnost LVSI. Třebaže dosud nebylo pro pacientky po FST vytvořeno doporučení pro pooperační sledování, je velmi důležité aktivně pátrat po možné recidivě, která by mohla být potenciálně kurabilní. Pro detekování recidivy je nejvýznamnější kombinace HPV testování, kolposkopie a expertního ultrazvuku.
Kromě schopnosti otěhotnět je klíčovým parametrem pro hodnocení výsledků FST schopnost donosit těhotenství a porodit zralý plod. Nejnižší pregnancy rate a současně nejvyšší podíl prematurity jsou doloženy u abdominální radikální trachelektomie.
Nadále zůstává i řada nedořešených témat spjatých s FST. Doposud nenastala shoda v načasování stagingu lymfatických uzlin v závislosti na aplikaci neoadjuvantní chemoterapie u pacientek nevhodných k primárnímu operačnímu řešení. Podobně panují nejasnosti i v problematice užití peroperační cerkláže a v rozsahu následného managementu prenatální péče vedoucí ke snížení rizika prematurity.
ORCID autorů
L. Fricová 0000-0002-0502-7419
J. Sláma 0000-0003-3827-1204
Doručeno/Submitted: 22. 6. 2022
Přijato/Accepted: 29. 6. 2022
prof. MUDr. Jiří Sláma, Ph.D.
Gynekologicko-porodnická klinika
1. LF UK a VFN v Praze
Apolinářská 18
128 51 Praha 2
Sources
1. Dušek L, Mužík J, Kubásek M et al. Epidemiologie zhoubných nádorů v České republice. 2022 [online]. Dostupné z: http: //www.svod.cz/?sec=analyzy.
2. Rob L, Charvát M, Robová H et al. Fertilitu zachovávající operace u časného stadia karcinomu děložního hrdla dnes a zítra. Ceska Gynekol 2006; 71 (4): 302–307.
3. Chovanec J, Náležinská M. Přehled diagnostiky a léčby karcinomu děložního hrdla. Onkologie 2014; 8 (6): 269–274.
4. Cibula D, Pötter R, Planchamp F et al. The European Society of Gynaecological Oncology/European Society for Radiotherapy and Oncology/European Society of Pathology guidelines for the management of patients with cervical cancer. Int J Gynecol Cancer 2018; 28 (4): 641–655. doi: 10.1097/IGC.0000000000001 216.
5. Cibula D, Ungár L, Svárovský J et al. Abdominální radikální trachelektomie – technika a zkušenosti. Ceska Gynekol 2005; 70 (2): 117–122.
6. Rob L, Skapa P, Robova H. Fertility-sparing surgery in patients with cervical cancer. Lancet Oncol 2011; 12 (2): 192–200. doi: 10.1016/S1470-2045 (10) 70084-X.
7. Dargent D, Martin X, Sacchetoni A et al. Laparoscopic vaginal radical trachelectomy: a treatment to perserve the fertility of cervical carcinoma patients. Cancer 2000; 88 (8): 1877–1882.
8. Kocian R, Slama J, Fischerova D et al. Micrometastases in sentinel lymph nodes represent a significant negative prognostic factor in early-stage cervical cancer: a single-institutional retrospective cohort study. Cancers (Basel) 2020; 12 (6): 1438. doi: 10.3390/cancers12061 438.
9. Cibula D, Dostálek L, Jarkovsky J et al. Post-recurrence survival in patients with cervical cancer. Gynecol Oncol 2022; 164 (2): 362–369. doi: 10.1016/j.ygyno.2021.12.018.
10. Li F, Gimbrere K, Gelber R et al. Outcome of pregnancy in survivors of Wilms‘ tumor. JAMA 1987; 257 (2): 216–219.
11. Rob L, Skapa P, Robova H. Fertility-sparing surgery in patiens with cervical cancer. Lancet Oncol 2011; 12 (2): 192–200. doi: 10.1016/S1470 - 2045 (10) 70084-X.
12. Hawkins M, Smith R. Pregnancy outcomes in childhood cancer survivors: probable effects of abdominal irradiation. Int J Cancer 1989; 43 (3): 399–402. doi: 10.1002/ijc.2910430309.
13. Pridjian G, Rich N, Montag A. Pregnancy hemoperitoneum and placenta percreta in a patient with previous pelvic irradiation and ovarian failure. Am J Obstet Gynecol 1990; 162 (5): 1205–1206. doi: 10.1016/0002-9378 (90) 90 018-3.
14. Schmeler K, Pareja R, Lopez Blanco A et al. ConCerv: a prospective trial of conservative surgery for low-risk early-stage cervical cancer. Int J Gynecol Cancer 2021; 31 (10): 1317–1325. doi: 10.1136/ijgc-2021-002921.
15. Freitag P. Jaká je adekvátní velikost konusu?. Prakt Gyn 2016; 20 (1): 12–14.
16. Sláma J, Runnebaum I, Scambia G et al. Fertility sparing surgery in cervical cancer patients outside controlled trials – a multicenter retrospective cohort trial (CEEGOG Cx-03; ENGOT-CX14). ESGO eAcademy 2021 : 343768
17. Kenney LB, Nicholson HS, Brasseux C et al. Birth defects in offspring of adult survivors of childhood acute lymphoblastic leukemia. A childrens cancer group/national institutes of health report. Cancer 1996; 78 (1): 169–176. doi: 10.1002/ (SICI) 1097-0142 (19960701) 78 : 1<169::: AID-CNCR23>3.0. CO; 2-X.
18. Signorello LB, Mulvihill JJ, Green DM et al. Stillbirth and neonatal death in relation to radiation exposure before conception: a retrospective cohort study. Lancet 2010; 376 (9741): 624–630. doi: 10.1016/S0140-6736 (10) 60752-0.
19. Dargent D, Martin X, Sacchetoni A et al. Laparoscopic vaginal radical trachelectomy: a treatment to preserve the fertility of cervical carcinoma patients. Cancer 2000; 88 (8): 1877–1882.
20. Hruda M, Robova H, Rob L et al. Twenty years of experience with less radical fertility-sparing surgery in early-stage cervical cancer: oncological outcomes. Gynecol Oncol 2021; 163 (1): 100–104. doi: 10.1016/j.ygyno.2021.07.031.
21. Bentivegna E, Maulard A, Pautier P et al. Fertility results and pregnancy outcomes after conservative treatment of cervical cancer: a systematic review of the literature. Fertil Steril 2016; 106 (5): 1195.e5–1211.e5. doi: 10.1016/ j.fertnstert.2016.06.032.
22. Sehnal B, Kmoníčková E, Sláma J et al. Současný FIGO staging karcinomu děložního hrdla a léčba jednotlivých stadií. Klin Onkol 2019; 32 (3): 224–231. doi: 10.14735/amko2019224.
23. Nezhat C, Roman RA, Rambhatla A et al. Reproductive and oncologic outcomes after fertility-sparing surgery for early stage cervical cancer: a systematic review. Fertil Steril 2020; 113 (4): 685–703. doi: 10.1016/j.fertnstert.2020.02. 003.
24. Ramirez P, Frumovitz M, Pareja R et al. Minimally invasive versus abdominal radical hysterectomy for cervical cancer. N Engl J Med 2018; 379 (20): 1895–1904. doi: 10.1056/NEJM oa1806395.
25. Nick AM, Frumovitz MM, Soliman PT et al. Fertility sparing surgery for treatment of early-stage cervical cancer: open vs. robotic radical trachelectomy. Gynecol Oncol 2012; 124 (2): 276–280. doi: 10.1016/j.ygyno.2011.09. 035.
26. Beiner M, Hauspy J, Rosen B et al. Radical vaginal trachelectomy vs. radical hysterectomy for small early stage cervical cancer: a matched case-control study. Gynecol Oncol 2008; 110 (2): 168–171. doi: 10.1016/j.ygyno.2008.04. 027.
27. Bentivegna E, Gouy S, Maulard A et al. Oncological outcomes after fertility-sparing surgery for cervical cancer: a systematic review. Lancet Oncol 2016; 17 (6): e240–e253. doi: 10.1016/S1470-2045 (16) 30032-8.
28. Plante M, Gregoire J, Renaud MC et al. The vaginal radical trachelectomy: an update of a series of 125 cases and 106 pregnancies. Gynecol Oncol 2011; 121 (2): 290–297. doi: 10.1016/ j.ygyno.2010.12.345.
29. Viveros-Carreño D, Rodriguez J, Rendon Pereira GJ et al. Fertility-sparing surgery after neo-adjuvant chemotherapy in women with cervical cancer larger than 4 cm: a systematic review. Int J Gynecol Cancer 2022; 32 (4): 486–493. doi: 10.1136/ijgc-2021-003297.
30. Maneo A, Sideri M, Scambia G et al. Simple conization and lymphadenectomy for the conservative treatment of stage IB1 cervical cancer. An Italian experience. Gynecol Oncol 2011; 123 (3): 557–560. doi: 10.1016/j.ygyno.2011.08.009.
31. Lindsay R, Burton K, Shanbhag S et al. Fertility conserving management of early cervical cancer: our experience of LLETZ and pelvic lymph node dissection. Int J Gynecol Cancer 2014; 24 (1): 118–123. doi: 10.1097/IGC.0000000000000 023.
32. Li X, Xia L, Chen X et al. Simple conization and pelvic lymphadenectomy in early-stage cervical cancer: a retrospective analysis and review of the literature. Gynecol Oncol 2020; 158 (2): 231–235. doi: 10.1016/j.ygyno.2020.05. 035.
33. Slama J, Fischerova D, Zikan M et al. Sensitivity of follow-up methods in patients after fertility-sparing surgery for cervical cancers. Int J Gynecol Cancer 2017; 27 (1): 147–153. doi: 10.1097/IGC.0000000000000835.
34. Tomao F, Maruccio M, Preti EP et al. Conization in early stage cervical cancer: pattern of recurrence in a 10-year single-institution experience. Int J Gynecol Cancer 2017; 27 (5): 1001–1008. doi: 10.1097/IGC.0000000000000 991.
35. Šimják P, Cibula D, Pařízek A et al. Management of pregnancy after fertility-sparing surgery for cervical cancer. Acta Obstet Gynekol Scand 2020; 99 (7): 830–838. doi: 10.1111/aogs.13917.
36. Speiser D, Köhler C, Schneider A et al. Radical vaginal trachelectomy: a fertility-preserving procedure in early cervical cancer in young women. Dtsch Arztebl Int 2013; 110 (17): 289–295. doi: 10.3238/arztebl.2013.0289.
37. Selo-Ojeme D, Ind T, Shepherd J. Isthmic stenosis following radical trachelectomy. J Obstet Gynaecol 2002; 22 (3): 327–328. doi: 10. 1080/01443610252971302.
38. Kyrgiou M, Athanasiou A, Paraskevaidi M et al. Adverse obstetric outcomes after local treatment for cervical preinvasive and early invasive disease according to cone depth: systematic review and meta-analysis. BMJ 2016; 354: i3633. doi: 10.1136/bmj.i3633.
39. Šimják P, Pařízek A, Sláma J. Prenatální péče o těhotnou ženu po fertilitu-zachovávajícím výkonu pro karcinom děložního hrdla. Ceska Gynekol 2020; 85 (6): 422–429.
Labels
Paediatric gynaecology Gynaecology and obstetrics Reproduction medicine
Article was published inCzech Gynaecology

2022 Issue 5-
All articles in this issue
- Změna trendu operační léčby a stagingu lymfatických uzlin u karcinomu endometria – výsledky Onkogynekologického centra Gynekologicko-porodnické kliniky FN Brno a LF MU v letech 2012–2021
- Vliv manuální lymfodrenáže na lymfedém horní končetiny po operaci pro karcinom prsu
- Psoriáza vulvy
- Metastatické postižení inguinálních uzlin jako první příznak endometroidního karcinomu vejcovodu
- Idiopatická granulomatózna mastitída
- Trojčetná gravidita – etiologie a časná diagnostika
- Distální vaginální ageneze a diferenciální diagnostika dalších příčin hematokolpos
- Zachování fertility u onkologických pacientek
- Současné znalosti o fertilitu šetřící léčbě pacientek s karcinomem děložního hrdla
- Vzpomínka na MUDr. Alexandra Bartáka
- Estetrol – svěží vítr na poklidné hladině kontraceptiv z pohledu farmakologa
- Včasné zahájení embryotransferů po transplantaci dělohy v zájmu zkrácení podávání imunosupresivní léčby
- Czech Gynaecology
- Journal archive
- Current issue
- Online only
- About the journal
Most read in this issue- Idiopatická granulomatózna mastitída
- Distální vaginální ageneze a diferenciální diagnostika dalších příčin hematokolpos
- Vliv manuální lymfodrenáže na lymfedém horní končetiny po operaci pro karcinom prsu
- Estetrol – svěží vítr na poklidné hladině kontraceptiv z pohledu farmakologa
Login#ADS_BOTTOM_SCRIPTS#Forgotten passwordEnter the email address that you registered with. We will send you instructions on how to set a new password.
- Career

