-
Medical journals
- Career
Robotická paraaortální lymfadenektomie v onkogynekologii. Duální dokování daVinci S systému zvyšuje úspěšnost vysoké paraaortální lymfadenektomie u karcinomu endometria
Authors: R. Marek 1; P. Dzvinčuk 1; J. Hambálek 1; M. Maděrka 1; V. Jančeková 1; V. Kolářová 1; K. Langová 2; R. Pilka 1
Authors‘ workplace: Gynekologicko-porodnická klinika FN a LF UP, Olomouc, přednosta prof. MUDr. R. Pilka, Ph. D. 1; Ústav lékařské biofyziky FN a LF UP, Olomouc, přednostka prof. MUDr. H. Kolářová, CSc. 2
Published in: Ceska Gynekol 2019; 84(1): 4-17
Category:
Overview
Cíl studie: Cílem této práce je poskytnout přehled minimálně invazivních přístupů k provedení suprapelvické lymfadenektomie a porovnat alternativní přístupy využívané při robotické transperitoneání paraaortální lymfadenektomii na souboru pacientek s klinicky časným stadiem karcinomu endometria, které podstoupily stagingovovu operaci.
Typ studie: Retrospektivní studie a přehled literatury.
Název a sídlo pracoviště: Porodnicko-gynekologická klinika FN a LF UP Olomouc.
Metodika: Do souboru byly retrospektivně zahrnuty pacientky s diagnózou karcinomu endometria klinicky časného stadia, které podstoupily stagingovou robotickou operaci v období od ledna 2016 do března 2018. U všech pacientek zahrnutých do souboru bylo primárně plánováno provedení kompletní systematické pánevní a suprapelvické lymfadenektomie. Soubor tvoří 70 pacientek, 39 podstoupilo robotickou operaci z jednorázově bočně dokovaného robotického systému, ve 28 případech bylo využito dvojího dokování. Hodnocenými parametry byly: počet pacientek s provedenou suprapelvickou lymfadenektomií, počet případů, u kterých bylo při paraaortální lymfadenektomii dosaženo úrovně levé renální žíly, počet získaných paraaortálních lymfatických uzlin a frekvence výskytu komplikací vzniklých v důsledku odstranění lymfatických uzlin: výskyt lymfocyst, chylózního ascitu, lymfatických otoků.
Výsledky: Z celkového počtu 70 pacientek byla robotická operace provedena u 67 (96 %) pacientek. Ve třech případech (0,4 %) chirurg konvertoval operační přístup z laparoskopie na otevřenou chirurgii. U 39 případů (58 %) byl robotický systém dokován z bočního přístupu a ve 28 případech (42 %) jsme využili duálního dokování. Paraaortální lymfadenektomii bylo možno technicky provést ve 45 případech (67 %). U 16 pacientek (24 %) bylo dosaženo úrovně po levou renální žílu. U 19 nemocných (28 %) byly odstraněny lymfatické uzliny v různé úrovni mezi dolní mezenterickou arterií a levou renální žílou. Do výše arteria mesenterica inferior jako maximální horní hranice byl výkon proveden u 10 žen (15 %) (dolní paraaortální lymfadenektomie). Počet získaných paraaortálních uzlin byl v případě duálního dokování statisticky významně vyšší (4,9 ± 3,3 vs. 3,7 ± 4,9, p = 0,028) a taktéž provedení lymfadenektomie po úroveň levé renální žíly bylo v rameni duálního dokování statisticky významně častější (p < 0,0001). Frekvence komplikací v obou sledovaných souborech byla nízká a srovnání četností jejich výskytu bylo mezi nimi statisticky nevýznamné.
Závěr: Ve skupině duálního dokování byl shledán statisticky významně vyšší podíl kompletních suprapelvických lymfadenektomií, které byly spojeny se statisticky významně vyšším počtem získaných uzlin, a to bez statisticky významného prodloužení operačního času. Frekvence výskytu konverzí a komplikací v našem souboru byla velmi nízká.
Klíčová slova:
paraaortální lymfadenektomie – karcinom endometria – robotická chirurgie – transperitoneální přístup
ÚVOD
Základním předpokladem adekvátní léčby zhoubných nádorů je přesné stanovení stadia maligního onemocnění s vyhodnocením všech prognostických faktorů. Vyšetření spádových lymfatických uzlin, které jsou v případě epiteliálních karcinomů místem možného primárního šíření, je nedílnou součástí stagingu v onkogynekologii a jejich postižení odráží negativní prognózu nemocné. Dokladem této skutečnosti je kumulativní pětileté přežití. V případě pacientek s endometriálním karcinomem bez postižení lymfatických uzlin dosahuje 94 %, 75 % u žen s izolovaným metastatickým postižením pánevních lymfatických uzlin a 38 % v případě pozitivních pánevních i paraaortálních uzlin [25]. Je obecně akceptováno, že na základě chirurgicko-patologického stagingu jsou pacientky přesněji a racionálně indikovány k adjuvantní terapii než pouze na základě výsledků zobrazovacích metod [64]. Ani nejmodernější zobrazovací metody však nedosahují přesnosti chirurgického stagingu v detekci metastatického postižení lymfatických uzlin.
Dostupná literární data ukazují, že CT nebo magnetická rezonance selhává v detekci makroskopických metastáz lymfatických uzlin v rozmezí od 20 % do 50 % případů lokálně pokročilého karcinomu děložního hrdla a selhává v detekci většiny, ne-li všech, lymfatických uzlin s mikroskopickým metastatickým postižením [33, 48]. Lepších výsledků se dosahuje pozitivní emisní tomografií/CT s detekčním rozpětím od 38 % do 86 % [32, 56]. Podle závěrů srovnávacích studií bylo stanovení stadia podle PET/CT a CT správné pouze v polovině případů (přesnost 55 % vs. 57 %, PET/CT vs. CT). Obě metody odhalily pouze 50 % infiltrovaných retroperitoneálních uzlin (senzitivita 50 % vs. 42–47 %, PET/CT vs. CT) [12, 28]. Queiroz porovnával diagnostickou přesnost PET/MRI a PET/CT pro staging a restaging pokročilých gynekologických karcinomů, neprokázal rozdíl mezi těmito modalitami v detekci postižených lymfatických uzlin a oba přístupy shodně dosáhly senzitivity (72,7 % vs. 72,7 %) s vyšší specificitou ve prospěch PET/CT (100,0 % PET/CT vs. 91,7 % PET MRI) [55].
V případě ovariálního a tubárního karcinomu se chirurgický staging tradičně provádí v rozsahu kompletní pánevní a paraaortální lymfadenektomie již od roku 1970 především klasickým otevřeným přístupem [36]. Ačkoliv podle dostupných literárních dat nebyl prokázán signifikantní rozdíl ve frekvenci recidiv a mortality u laparoskopicky stážovaných pacientek [65], je laparoskopie jako metoda pro léčbu časných stadií možná, přesto však zůstává kontroverzním tématem.
V případě karcinomu děložního hrdla je riziko metastatického postižení paraaortálních lymfatických uzlin přímo úměrné rozsahu lokálního nálezu. V době diagnózy činí 6 % ve stadiu IB, 12 % ve stadiu IIA, 19 % ve stadiu IIB, 33 % ve stadiu IIIA, 29 % ve stadiu IIIB a 30 % ve stadiu IV. Proto je doporučován chirurgický staging paraaortálních (suprapelvických) uzlin před zahájením primární radioterapie [26]. Pozitivita paraaortálních lymfatických uzlin je důvodem k rozšíření ozařovaného pole a zlepšuje terapeutickou účinnost radioterapie. Odstranění pozitivních lymfatických uzlin, které musí být vystaveny adekvátní dávce radioterapie, může také zlepšit lokální kontrolu nemoci v důsledku redukce objemu nádoru [54]. Potish na svém souboru demonstroval, že přežití pacientek, které podstoupily radioterapii po předchozí retroperitoneální resekci bulky metastáz lymfatických uzlin bylo podobné jako přežití pacientek s mikroskopickými aortálními metastázami lymfatických uzlin [53]. Tyto informace dokládají význam odstranění makroskopicky zvětšených uzlin a mohou být obhajobou pro provedení paraaortální lymfadenektomie u lokálně pokročilých stadií.
Zlepšení přežívání u pacientek, kterým byly resekovány pozitivní suprapelvické uzliny před radioterapií, retrospektivně také hodnotila analýza III. fáze, tří GOG (GOG 85, GOG 120 a GOG 165) klinických studií a zahrnovala 585 žen ve stadiu IIB až IVA cervikálního karcinomu. Pacientky po paraaortální lymfadenektomii vykazovaly zlepšení ve čtyřletém intervalu do progrese PFS (48,9 % vs. 36,3 %) a celkového přežití (54,3 % vs. 40 %) ve srovnání s pacientkami, které podstoupily pouze radioterapii suprapelvické oblasti [21]. Některými autory původně doporučovaná systematická laparotomická paraaortální stagingová lymfadenektomie [10] byla provázena dramatickým zvýšením počtu komplikací spojených s radioterapií v důsledku pooperačních adhezí a omezené mobility střeva [63].
U pacientek s endometriálním karcinomem bylo od roku 1988 podle FIGO a následně od roku 2005 podle ACOG doporučováno provedení kompletní pánevní a suprapelvické lymfadenektomie [1, 9]. Data z japonské retrospektivní studie hodnotící efekt paraaortální lymfadenektomie na přežití pacientek s endometriálním karcinomem ukazují signifikantně delší OS (celkové přežívání) pacientek středního a vysokého rizika po provedení kombinované pánevní a paraaortální lymfadenektomie [61]. Nyní je odstranění lymfatických uzlin v kompletním stagingovém rozsahu doporučováno v případě nádoru endometria s vysokým rizikem postižení lymfatických uzlin (endometriální non-endometroidní karcinom typ 2, invaze ≥ 50 % tloušťky myometria, endometroidní adekarcinom G3, LVSI pozitivita, stadium ≥ IB) [7, 59].
Potřeba miniinvazivní chirurgie v suprapelvické oblasti retroperitonea byla generována nejen insuficiencí klinického stagingu v predikci metastáz lymfatických uzlin, nýbrž i komplikacemi vzniklými v důsledku adhezivního procesu v kombinaci s následnou radioterapií u žen operovaných klasickým laparotomickým přístupem za účelem stagingu pokročilého nádoru děložního hrdla [24]. Dále i potřebou minimalizovat frekvenci komplikací spojených s otevřenou operativou v případě pacientek s karcinomem endometria, které často trpí množstvím přidružených komorbidit a významnou obezitou. První laparoskopická transperitoneální paraaortální lymfadenektomie provedená na zvířecím modelu a publikovaná Herdem v roce 1992 se stala základem pro rozvoj této techniky v humánní medicíně [40].
Od doby prvních publikací o laparoskopické paraaortální lymfadenektomii bylo popsáno několik technik [11, 31]. Je využíván transperitoneální nebo extraperitoneální přístup. Každý z nich nabízí určité spektrum výhod nebo je zatížen různou mírou negativ a osvojení každé z těchto technik je rozdílně náročné. Oba chirurgické přístupy do retroperitonea k suprapelvické lymfadenektomii lze provést klasickou laparoskopickou metodou, eventuálně s využitím robotického systému. Extraperitoneální technika byla vytvořena s cílem učinit tradiční invazivní onkologickou operativu bezpečnější pro pacienta, eliminovat obtíže způsobené přítomnosti střev v operačním poli a redukovat možný pooperační adhezivní proces [2, 39]. Extraperitoneální přístup do retroperitonea poskytuje pouze velmi omezený anatomický prostor, který také limituje rozmístění trokarů k zajištění adekvátní práce v případě krvácivé komplikace [30]. U neobézních pacientů, z pohledů chirurgického provedení a onkologických výsledků v publikovaných souborech, nebyl pozorován rozdíl v transperitoneálním a extraperitoneálním provedení paraaortální lymfadenektomie [30]. Transperitoneální přístup podle některých autorů nabízí lepší ergonomii k provedení a umožňuje laparoskopický management operačních komplikací [30, 60].
Cílem této práce je poskytnout přehled minimálně invazivních technik využívaných k provedení suprapelvické lymfadenektomie v onkogynekologii a porovnat přístup jednoho a duálního dokování robotického systému při provádění transperitoneání paraaortální lymfadenektomie na souboru pacientek, které podstoupily stagingovou operaci pro klinicky časné stadium karcinomu endometria.
MATERIÁL A METODIKA
Tato studie je retrospektivní analýzou všech pacientek s klinicky časným stadiem (I–II) karcinomu endometria, které podstoupily robotický stagingový operační výkon, při němž byla provedena pánevní (PLND) a suprapelvická lymfadenektomie (PALND) v období dvou let 1/2016 až 3/2018 na Porodnicko-gynekologické klinice FN Olomouc. Tato analýza má za úkol porovnat dva přístupy v dokování robotického systému při provádění chirurgického stagingu v paraaortální oblasti, vyhodnotit jejich přínosy, limitace a negativa. Primárními výstupy byly: proveditelnost a frekvence realizace úplné paraaortální lymfadenektomie až do úrovně odstupu levé renální žíly, počet získaných suprapelvických uzlin. Sekundárními hodnocenými parametry byly: četnost konverzí z důvodu komplikací suprapelvického retroperitoneálního výkonu, délka hospitalizace, operační čas, frekvence komplikací spojených s lymfadenektomií a krevní ztráta.
Operační výkony byly prováděny třemi konzolovými chirurgy na robotickém systému da Vinci S (Intuitive Surgical Inc.), přičemž dva starší měli zkušenost s více než 100 provedenými robotickými operacemi. Data byla získána retrospektivně ze zdravotnické dokumentace a nemocničního informačního systému. V robotickém centru FN Olomouc se provádí staging pacientek s karcinomem těla děložního od roku 2009. V roce 2016 byl robotický systém da Vinci S dokován z boku operačního stolu při levé dolní končetině, následně od začátku roku 2017 byl tento typ operačního přístupu nahrazován dvojím dokování. V tomto případě je robotický systém umísťován po straně pacientky při dolní končetině a při rameni. V daném období bylo plánováno 70 pacientek k primární stagingové robotické operaci s histologicky verifikovaným karcinomem endometria k provedení PALN. Analyzovanými klinickými charakteristikami pacientů byly věk a BMI. Z intraoperačních parametrů byl sledován operační čas, měřený od kožního řezu po naložení posledního kožního stehu, velikost krevní ztráty stanovená měřením objemu odsáté krve, operatérem uváděná dosažená kraniální oblast provedené paraaortální lymfadenektomie. Z definitivní histopatologické zprávy byly hodnoceny počty získaných paraaortálních lymfatických uzlin. Komplikace v období do 30 dní byly hodnoceny podle klasifikačního systému Clavien-Dindo.
Kvantitativní veličiny byly vyjádřeny jako průměr, směrodatná odchylka (SD), medián, minimální a maximální hodnota, byly provedeny Shapirovy-Wilkovy testy normality. Dva nezávislé výběry byly porovnány podle typu distribuce dat t-testem nebo neparametrickým Mannovým-Whitneyovým U-testem. Kvalitativní data byla popsána pomocí absolutních a relativních četností a skupiny byly porovnány Fisherovým přesným testem. Vztah mezi BMI a počtem paraaortálních uzlin byl ověřen výpočtem Spearmanova korelačního koeficientu (r). Všechny testy byly provedeny na hladině signifikance 0,05, p-hodnoty nižší než 0,05 jsou zvýrazněny tučným písmem a rozdíly považujeme za statisticky významné. Významné rozdíly byly znázorněny krabicovými grafy (pro kvantitativní znaky) a skládanými sloupcovými grafy (pro kvalitativní veličiny). Ke statistickému zpracování byl použit statistický software IBM SPSS Statistics for Windows, Version 23.0. Armonk, NY: IBM Corp.
OPERAČNÍ VÝKON
V první polovině sledovaného období byly operační robotické stagingové výkony prováděny z bočního dokování da Vinci S systému po uvedení pacientky do litothomické polohy. V daném případě byl pacientský systém s operačními rameny umístěn po straně operačního stolu při levé dolní končetině pacientky, tak aby osa centrálního sloupu s pracovními rameny svírala s podélnou osou pacienta úhel 45 stupňů. První incize byla prováděna ve střední rovině nad pupkem ve vzdálenosti minimálně tři centimetry kraniálním směrem (24–28 cm nad symfýzou) pro 12mm trokar s kamerou. Tři 8mm pracovní porty pro operační nástroje byly umisťovány 3–5 cm směrem kaudálně a 8–10 cm laterálně od optického trokaru, dva vlevo a jeden vpravo; 16mm asistenční port byl umísťován vpravo mezi optický a pracovní trokar s minimální vzdáleností 5 cm (obr. 1).
Image 1. Rozmístění vstupu do břišní dutiny při jednoduchém bočním a centrálním umístění robotického systému (upraveno podle Intuitive Surgical)
C – optický troakar, A – asistenční troakar, 1 – monopolární nůžky, 2 – Maryland, bipolární, 3 – úchopový fenestrovaný grasper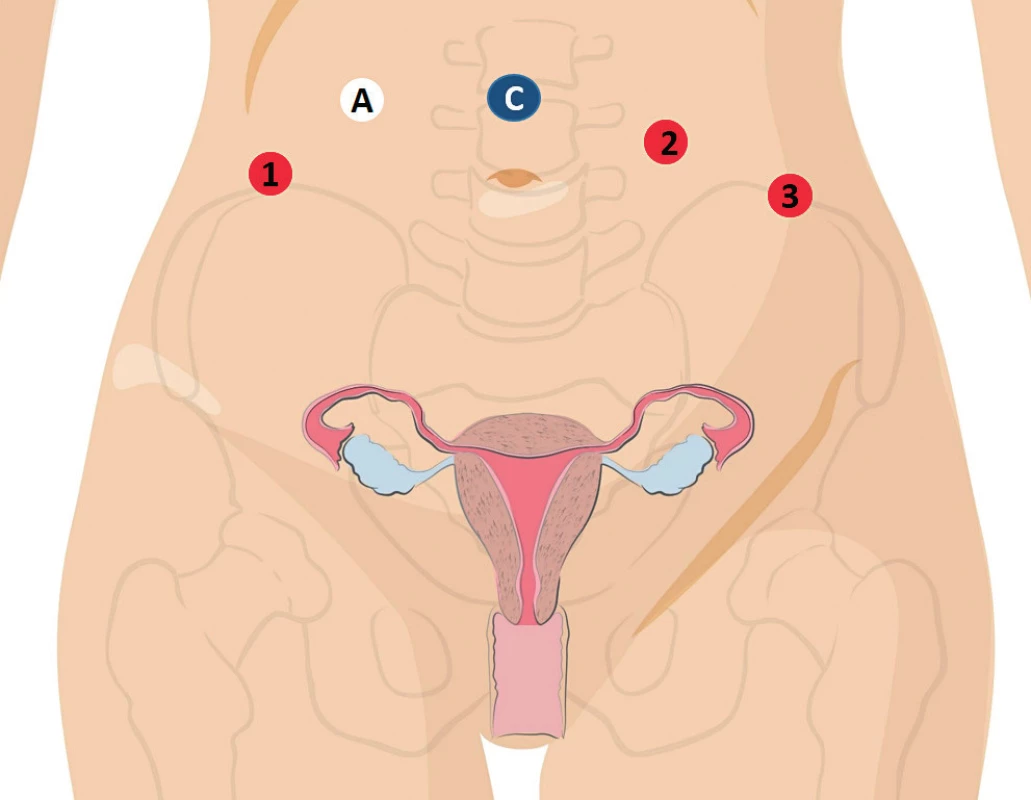
Od ledna 2017 začala být implementována metoda dvojího dokování robotického systému. V případě duálního dokování lze pracovat s jedním nebo dvěma trokary pro kameru. Využijeme-li pouze jeden trokar pro optiku, je umístěn ve střední čáře 3 cm kaudálně od pupku, dva pracovní porty jsou umístěny v jeho úrovni laterálně vzdáleny od optiky 7–8 cm, periferní trokary by měly být umístěny maximálně laterálně, minimálně však 12 cm od optického trokaru. Postranní trokar vpravo lze umístit v úrovni pupku maximálně laterálně. Toto rozmístění vstupu do břišní dutiny je technicky náročnější, a proto byl některými operatéry zaváděn další port pro optiku, který je lokalizován suprapubicky, přičemž primární optický byl umístěn v oblasti pupku. Ten se využívá pro výkon v pánvi a horní paraaortální oblasti. Kaudálně situovaný vstup pro optiku je výhodnější pro oblast společných ilických cév, bifurkace aorty a dolní paraaortální krajinu. Rozmístění pracovních a asistenčního trokarů je identické jako v předchozím případě (obr. 2 a 3).
Image 2. Duální dokování – rozmístění vstupů do břišní dutiny při využití jednoho vstupu pro optiku (upraveno podle Intuitive Surgical, H. Falconer) 
Image 3. Duální dokování – rozmístění vstupů do břišní dutiny při využití dvou vstupů pro optiku (upraveno podle Intuitive Surgical, H. Falconer) 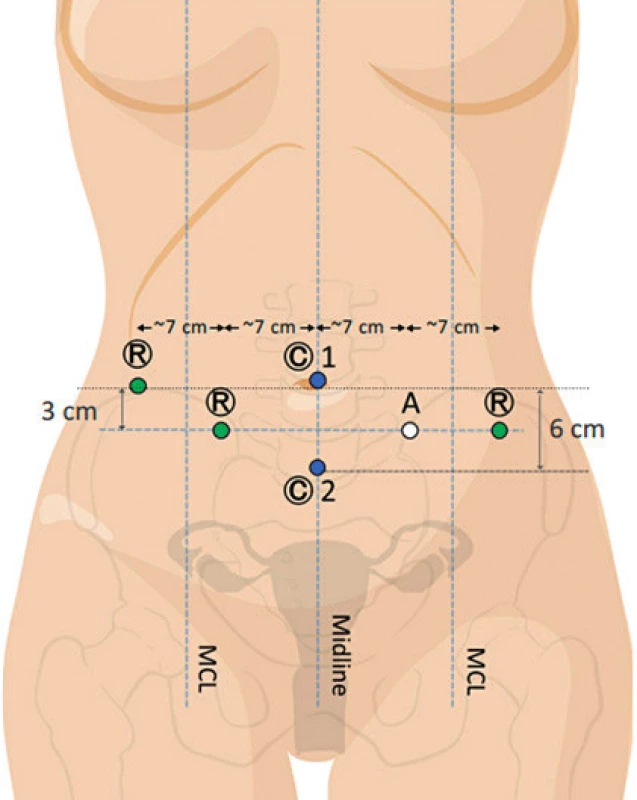
V případě duálního dokování probíhal operační výkon ve dvou na sebe navazujících fázích. Ve většině případů je operační výkon zahájen paraaortální lymfadenektomií, při které je pacientská konzola s pracovními rameny umístěna směrem od hlavy a zároveň po straně operačního stolu a s podélnou osou těla pacientky svírá úhel 45 stupňů. Po této fázi je robotický systém předokován otočením operačního stolu, eventuálně přesunutím pracovní konzoly s robotickým rameny o 90° k provedení výkonu v pánvi. V této fázi je umístění robota identické jako v případě bočního dokování (obr. 4).
Image 4. Duální dokování – změna robotického systému (upraveno podle Intuitive Surgical) 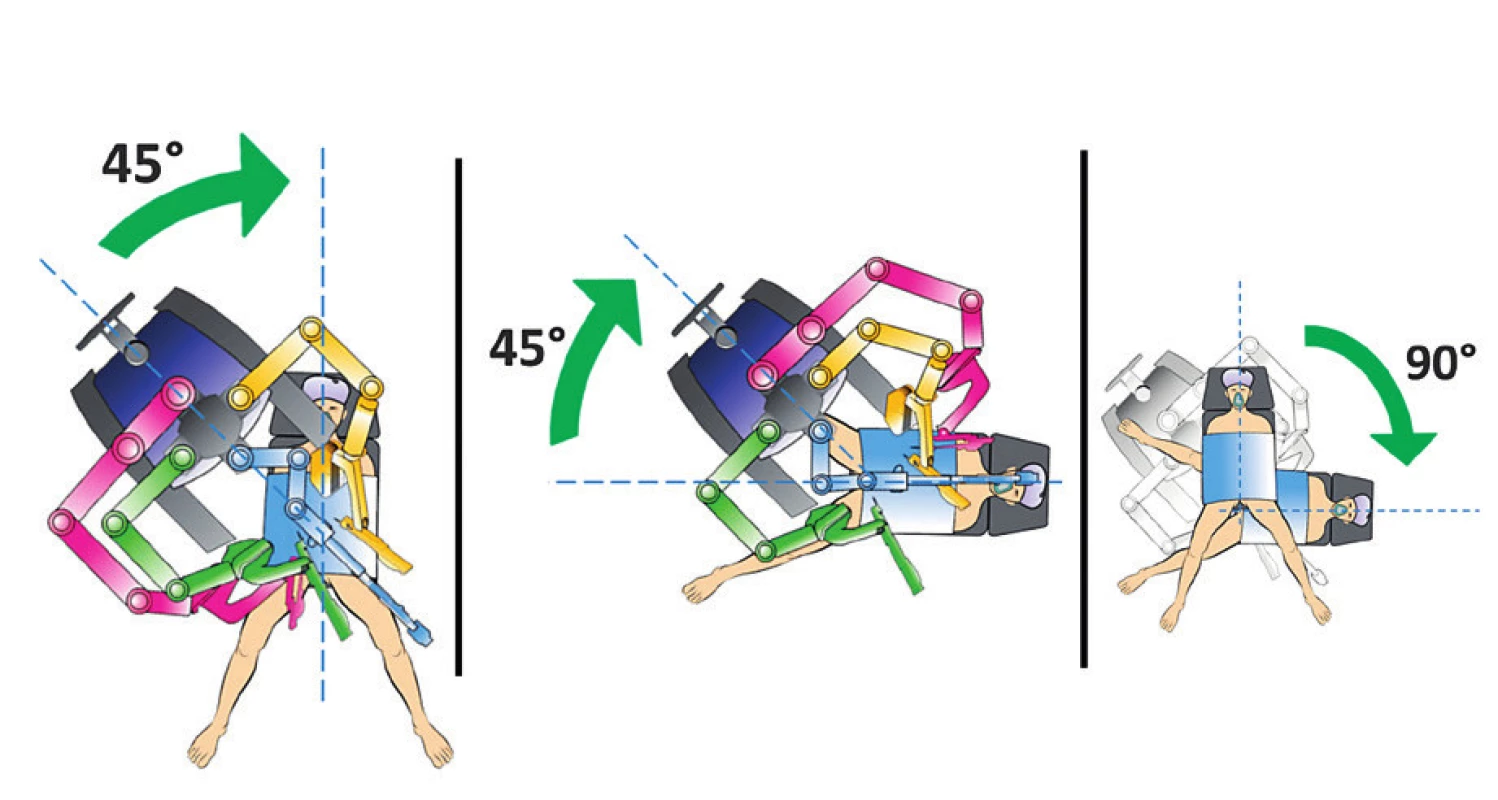
K zajištění adekvátní vizualizace a dostupnosti jednotlivých anatomických oblastí byla preferenčně využívaná 30° optika.
VÝSLEDKY
Do souboru bylo zahrnuto 70 pacientek, které byly primárně indikovány k provedení paraaortální lymfadenektomie jako součásti stagingového operačního výkonu spolu s pánevní lymfadenektomií, hysterektomií a oboustrannou adnexektomií. Ve třech případech po zahájení laparoskopie byla vynucena konverze na otevřený chirurgický přístup. K těm došlo ještě před dokováním robotického systému, a tedy nebyly v přímé příčinné souvislosti s operativou v suprapelvické oblasti retroperitonea. U dvou pacientek byl důvodem pokročilý nález, v jednom případě byla změna přístupu zvolena z anesteziologických důvodů, kterými byly ventilační komplikace po vytvoření kapnoperitonea. Robotický operační výkon podstoupilo celkem 67 pacientek, 39 (58 %) pacientek bylo operováno z bočního přístupu při jednorázovém dokování (single-side docking) a 28 žen (42 %) z bočního dvojitého dokování (dual-side docking).
Průměrný věk pacientek ve studované skupině byl 64 let, BMI 32,8 ± 8,4 kg/m2 u SSD a 30,6 ± 7,2 u DSD. Oba parametry se statisticky nelišily v obou podskupinách. Průměrný operační čas a jeho medián činil v případě bočního dokování 3,0 ± 1,2; 3,3 (0,2–5,1) hodin a 3,5 ± 1,4; 3,4 (0,2–6,4) hodin u duálního dokování, bez statistického rozdílu (0,172b), ale se sledovatelným trendem delšího operačního času u operací, kde byl robot dokován dvakrát. Nebyl sledován rozdíl krevní ztráty v žádném z obou porovnávaných souborů a v průměru tato ztráta nepřevyšovala 100 ml. U bočního dokování činila 100 ml (100–300 ml), u duálního dokování 79 ml (10–300 ml) (p = 0,9). Počty získaných lymfatických uzlin v oblasti pánve nebyly významně odlišné při využití různých přístupů v dokování [SSD 17,8 ± 9,4; 16 (0–50) vs. 17,7 ± 8,6; 15 (5–40), p = 0,990]. Nicméně průměrný počet získaných uzlin v suprapelvické oblasti u SSD byl 3,7 ± 4,9; 0 (0–18) a ve skupině duálního dokování činil 4,9 ± 3,3; 5 (0–12). Množství vytěžených paraaortálních uzlin při dvojím dokování bylo statisticky hodnoceno jako významně větší (p = 0,028) (tab. 1; graf 1).
Graph 1. Srovnání počtu získaných lymfatických uzlin v souborech single a dual docking 
Table 1. Charakteristika souborů (single docking a dual docking) 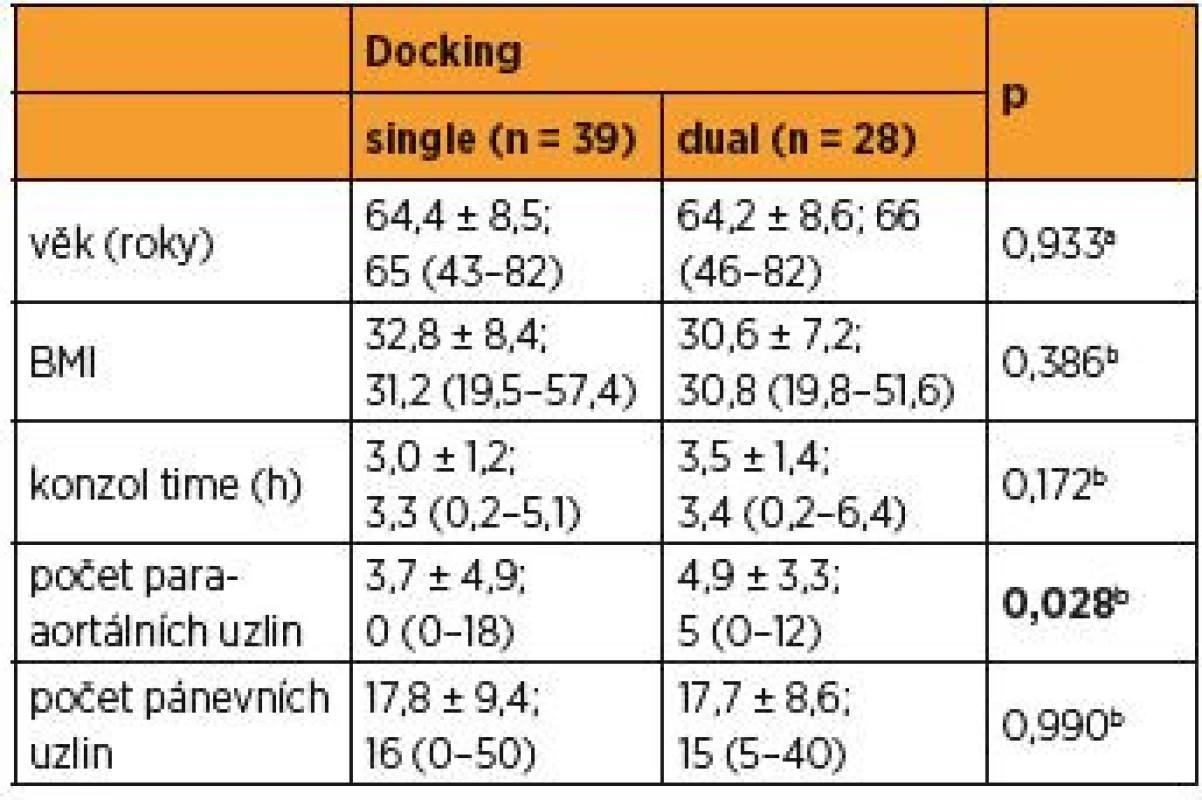
Data byla vyjádřena jako průměr ± SD; medián (minimum-maximum); n – počet pacientek; at-test; bMannův-Whitneyův U-test Počet případů, kdy byla robotickým systémem dosažena kraniální anatomická hranice suprapelvické lymfadenektomie, kterou je levostranná renální žíla, tvořil u jednorázového dokování 3 % (1), naproti tomu u dvojitého dokování došlo k statisticky častějšímu naplnění kompletní suprapelvické lymfadenektomie v 54 % (15), p < 0,0001c (tab. 2).
Table 2. Kraniální limity pro paraaortální lymfadenektomii v souborech single a dual docking 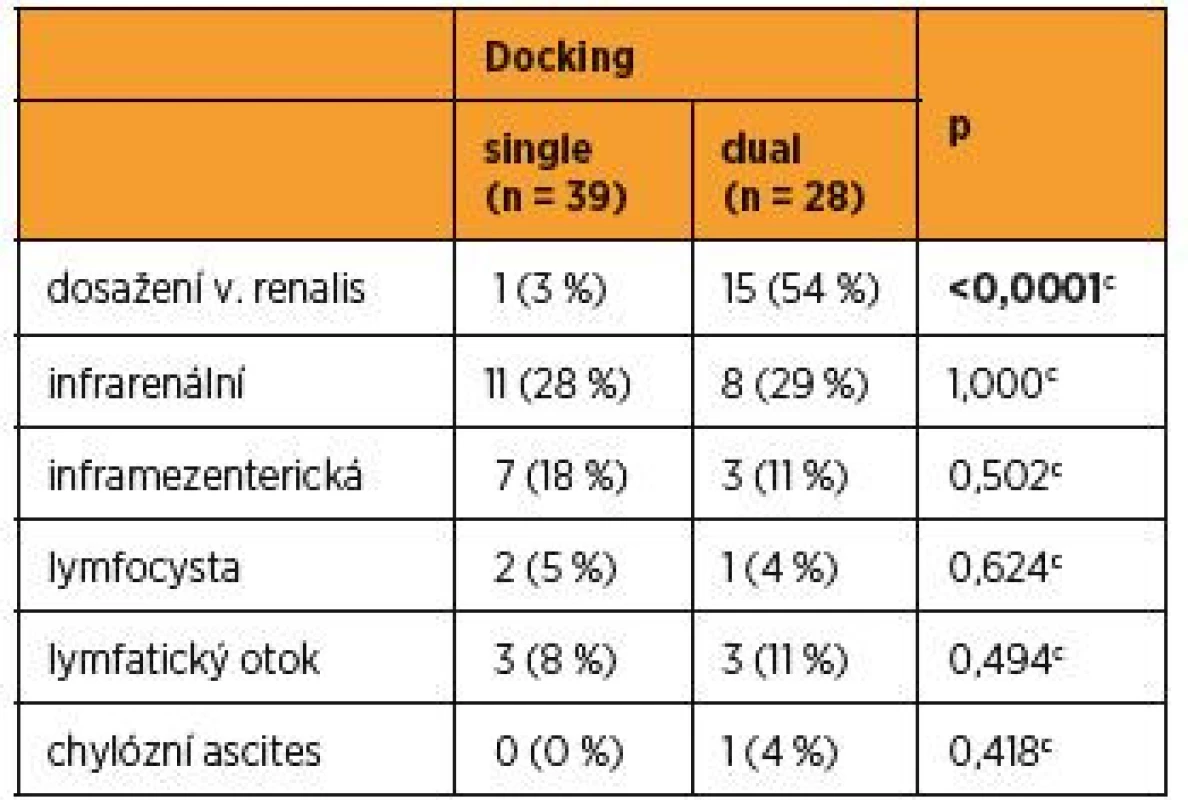
cFisherův přesný test; n – počet pacientek Při analýze celého souboru, v případech, kdy byl naplněn kompletní staging po levou renální žílu, byl počet získaných suprapelvických uzlin statisticky vyšší [6,1 ± 3,7; 6 (1–13) vs. 3,5 ± 4,3; 2 (0–18), p = 0,009b] (graf 2).
Graph 2. Počty získaných paraaortálních uzlin s ohledem na dosažení kraniálního limitu levé renální žíly 
Tento rozdíl však již nebyl v podskupině duálního dokování pozorován [5,7 ± 3,3; 6 (1–12) vs. 3,9 ± 3,1; 4 (0–8), p = 0,202b]. Korelační analýzou nebyla prokázána signifikantní korelace mezi BMI a počtem paraaortálních uzlin celého souboru, r = -0,217; p = 0,081. Snížená hladina statistické významnosti, která se blíží hranici 0,05, ukazuje na trend v datech a je odrazem nižšího počtu získaných paraaortálních uzlin u pacientek s vyššími hodnotami BMI (graf 3).
Graph 3. Korelace mezi BMI a počtem získaných paraaortálních uzlin
Korelační analýzou nebyla prokázána signifikantní korelace mezi BMI a počtem paraaortálních uzlin
r = -0,217; p = 0,081. Snížená hladina statistické významnosti, která se blíží hranici 0,05, ukazuje na trend v datech – u pacientek s vyššími hodnotami BMI byl získán nižší počet paraaortálních uzlin.
Situaci ukazuje bodový graf.
Při subanalýze v kohortě single docking a taktéž ani dual docking nebyla korelační analýzou prokázána signifikantní korelace mezi BMI a počtem paraaortálních uzlin (SSD r = -0,240; p = 0,141, DSD r = -0,102; p = 0,611) (tab. 3).
Table 3. Rozdíl v počtu získaných lymfatických uzlin při dosažení vena renalis sinistra a v situaci, kdy vena renalis dosažena nebyla 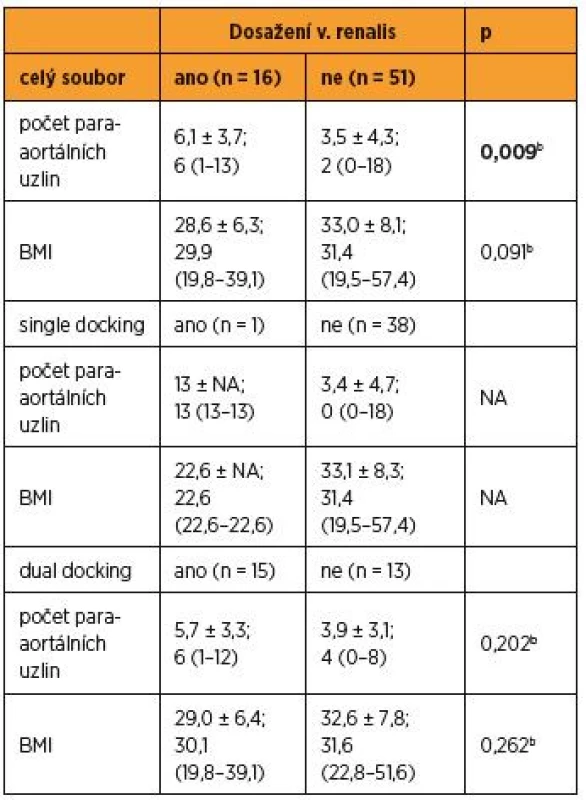
bMannův-Whitneyův U-test V naší skupině jsme nepozorovali žádnou peroperační komplikaci, která by byla v přímé příčinné souvislosti se suprapelvickou lymfadenektomií. Ve dvou případech bylo časné pooperační období komplikováno vznikem dvou vezikovaginálních píštělí a v jednom případě došlo k rozvoji náhlé příhody břišní v důsledku uskřinutí kličky tenkého střeva. Chylózní ascites s významnou klinickou symptomatologií byl zjištěn pouze v jednom případě z celého souboru. Pozdní komplikace, které mají příčinnou souvislost s odstraněním lymfatických uzlin, byly zjištěny u devíti pacientek. Jednalo se o tři případy lymfocyst lokalizovaných v oblasti pánve a šest případů lymfatických otoků. Při srovnání výskytu komplikací mezi kohortou SSD a DSD nebyl zjištěn významný statistický rozdíl.
DISKUSE
Rozsah provedení paraaortální lymfadenektomie (PALND) se liší mezi státy a jednotlivými centry. Tradičně bývá rozsah provedení výkonu paraaortální lymfadenektomie dělen do dvou úrovní. Kaudální hranicí je v obou případech bifurkace aorty na společné ilické arterie, kraniální hranicí je při tzv. dolní paraaortální lymfadenektomii arteria mesenterica inferior, jak doporučuje SGO – Society of Gynecological Oncology. Zatímco ESMO – European Society of Medical Oncology doporučuje tento výkon vymezovat kraniálním směrem těsně po oblast levé renální žíly, směrem laterálně vlevo hranici určuje gonadální ovarická žíla, laterálně vpravo pak pravý močovod a dorzálně musculus psoas. Disekce v oblasti retrokavální a retroaortální bývá prováděna výběrově [6, 8, 57]. Od doby prvních publikací o laparoskopické paraaortální lymfadenektomii bylo popsáno několik technik [11, 31]. Je využíván transperitoneální nebo extraperitoneální přístup. Každý z nich nabízí určité spektrum výhod nebo negativ a osvojení této techniky je u obou přístupů rozdílně náročné. Oba chirurgické přístupy do retroperitonea k získání suprapelvických lymfatických uzlin lze provést klasickou laparoskopickou metodou, eventuálně s využitím robotického systému.
Laparoskopická transperitoneální paraaortální lymfadenektomie v klasickém pojetí nebo s robotickou asistencí je technika využívaná u většiny operačních výkonů, zejména kombinovaných. V případě transperitoneální techniky chirurg čelí problémům se střevem limitujícím přístup do operačního pole, střevní kličky musí být odsouvány směrem do podbráničních prostorů a mohou být příčinou perioperačních obtíží a poranění. Tyto technické aspekty mohou v některých případech vést k omezení rozsahu výkonu pouze po úroveň arteria mesenterica inferior [52]. Lze to pozorovat i v našem souboru, ve kterém jako hlavní příčina limitující rozsah výkonu je nepřehlednost operačního pole způsobená kombinací viscerální obezity a omezení přístupu k cílovým strukturám retroperitonea střevními kličkami. V případě robotického výkonu prováděného jedním bočním dokováním systému se tyto limitující aspekty uplatňovaly ve zvýšené míře ve srovnání s přístupem duálního dokování. V případě robotické techniky je na rozdíl od klasické laparoskopie dosaženo adekvátní erudice operatéra v kratším časovém intervalu [3].
Výhody a přínosy minimálně invazivní chirurgie v onkogynekologické operativě, kterými jsou rychlejší návrat pacienta do běžného života, zkrácení doby hospitalizace, minimalizace bolesti, menší krevní ztráty a redukce počtu podaných krevních transfuzí, byly v literatuře opakovaně dokumentovány [51]. Čas potřebný k dosažení adekvátní erudice „learning curve“, délka operačního výkonu, nepříznivé faktory ze strany pacientek (obezita, přidružená onemocnění, předchozí chirurgické výkony v oblasti dutiny břišní nebo neschopnost tolerovat Trendelenburgovu polohu) jsou parametry, které naopak limitují rozšíření klasické laparoskopické operativy v případě náročných onkogynekologických výkonů [41, 44, 45, 58]. Dokladem toho je největší randomizovaná studie Gynecology Oncology Group (GOG) LAP2, provedená na 2616 ženách náhodně rozdělených k provedení plného chirurgického stagingu laparoskopickým a laparotomickým přístupem v poměru 2 : 1 a frekvencí konverzí 25,8 % [62]. Od roku 2005, kdy FDA (Úřad pro kontrolu léčiv a potravin) v Americe, schválil používání robotického systému pro gynekologickou chirurgii, se stala tato léčebná modalita široce využívanou gynekologickými onkology ve Spojených státech amerických pro léčbu a chirurgický staging děložních malignit. Rozvoj robotické chirurgie usnadnil implementaci minimálně invazivní chirurgie, umožnil pacientům využít její benefity a pomohl překonat limity konvenční laparoskopické techniky [5, 16].
Navzdory všem výhodám je robotická operativa zatížena mnoha limitacemi v případě nutnosti kombinované operativy v oblasti pánve a horních kvadrantů dutiny břišní. Příčinou je limitovaná mobilita dokovaného systému, omezení rozsahu pohybů po dosažení úhlu 90° optického nebo pracovního ramene a rovinou pacienta [43]. První tři generace da Vinci systému (Intuitive Surgical INC., Sunnyvale, CA) nebyly navrženy pro multikvadrantovou chirurgii [4, 18, 43], proto Da Vinci Standard, da Vinci S a da Vinci Si neumožňují přístup do celé dutiny břišní bez přemístění robotického systému (pacient cart) [43], stejně tak i nový systém da Vinci X. Tato nevýhoda mizí až s příchodem systému da Vinci Xi.
Byly popsány různé techniky k provedení roboticky asistované transperitoneální paraaortální lymfadenektomie: technika jednoho centrálního dokování (mezi dolními končetinami pacienta), jednoho bočního dokování (po straně pacienta, při dolní končetině), dvojího dokování s umístěním robota za pacientovou hlavou a mezi dolními končetinami a novější verze dvojího dokování, kdy se robot nachází při levém nebo pravém rameni a následně při dolní končetině [4, 18, 43]. U většiny pacientů lze v případě suprapelvické inframezenterické lymfadenektomie dostáhnout této oblasti a uzliny z ní odstranit s nastavením a dokováním pacientské konzoly robotického systému primárně navrženého pro pánevní chirurgii. Nicméně dosažení oblasti nad arteria mesenterica inferior až po levostrannou renální žílu není v případě uvedeného nastavení robotického systému ve většině případu možné, není kompletní, provádění lymfadenektomie v dané oblasti není bezpečné a počet získaných uzlin je nižší ve srovnání s výkonem, při kterém je paraaortální lymfadenektomie prováděna jako jediný výkon bez operace realizované v pánvi [15, 38]. Právě tato oblast infrarenálních lymfatických uzlin je místem nejčastějšího metastatického šíření epiteliálního ovariálního karcinomu [50] a výskytu pozitivních uzlin v případě absence metastáz v ipsilaterálních inframezenterických uzlinách u pacientek s endometriálním karcinomem [46].
V případě standardního dokování robotického systému pro onkogynekologický výkon, kdy je systém umístěn mezi abdukovanými dolními končetinami pacientky, je tímto přístupem z naší zkušenosti dostupná paraaortální oblast v různém rozsahu v závislosti na habitu pacientky a anatomických poměrech a provedení systematické suprapelvické lymfadenektomie je na základě našich výsledku limitováno a odrazem této skutečnosti je statisticky nižší počet paraaortálních uzlin získaných při single dokování. Navíc v důsledku umístění pacientské konzoly mohou vznikat omezení při asistenci s dělohou pomocí vaginálně zavedeného manipulátoru. Tato úskalí částečně obchází přesunutí robotického systému na stranu pacienta při jeho levé nebo pravé dolní končetině v závislosti na zvyklosti pracoviště a prostorových možnostech operačního sálu. K dosažení lepšího přístupu a provedení suprapelvické lymfadenektomie v plném a adekvátním rozsahu je některými autory doporučováno posunutí všech vstupů do dutiny břišní kraniálním směrem. F. Gucer na svém souboru deseti pacientek s lokálně pokročilým karcinomem děložního hrdla využívá právě tohoto kraniálním směrem posunutého rozmístění a optický trokar zavádí 2 cm pod processus xyfoideus. Medián odstraněných uzlin z paraaortální oblasti v tomto souboru je 25 (16–45), ve dvou případech z deseti pacientek pro provedení výkonu mezi arteria mesenterica inferior a levou renální žílou bylo nutno robotický systém přemístit do oblasti levého ramene pacientky a vytvořit nový vstup pro optiku v místě pupku [23].
Společnost Evropské robotické gynekologické chirurgie (SERGS) prezentovala velkou kohortu pacientek, které podstoupily roboticky asistovanou laparoskopickou paraaortální lymfadenektomii (n = 487). V této studii u pacientek, které podstoupily izolovanou transperitoneální paraaortální lymfadenektomii byl získán větší počet uzlin než ve skupině s provedenou hysterektomií, což je vysvětlováno v tomto případě potřebou pouze jednoho dokování [27]. Geppert, Persson et al. popisují dosažení kompletní suprapelvické lymfadenektomie po úroveň levé renální žíly v 70 % případů ze 140 pacientek s vysoce rizikovým endometriálním karcinomem a v případě neobézních pacientek operovaných zkušeným chirurgem bylo kompletního výkonu dosaženo v 88 % případů [20]. Stejnou technikou James et al. dosáhli lymfadenektomie po oblast levé renální žíly v 90 % případů [35].
Jinou možností řešení multikvadrantové limitace je dvojí dokování robotického systému – pacientské konzoly (patient cart). V roce 2010 byla publikována, na lidských kadaverech nově vyvinuta a následně na souboru 33 pacientek validována technika duálního dokování pro robotickou transperitonealní infrarenální aortální lymfadenekotomii [43]. V původním Magrinově provedení duálního dokování byl robotický systém s rameny prvně umístěn za hlavou pacientky a následně přesunut mezi dolní končetiny k provedení pánevní části operace. Tato technika však vyžaduje několik přídavných portů a rotaci stolu o 180° [43, 51].
V roce 2016 prezentoval H. Falconer retrospektivní studii s cílem vytvořit a standardizovat robustní metodu k provedení robotické transperitoneální suprapelvické lymfadenektomie s omezeným počtem vstupů do břišní dutiny a vysokou pravděpodobností dosažení infrarenální oblasti. V daném souboru z celkového počtu 76 pacientek indikovaných k PALND byl výkon úspěšně realizován v plánovaném rozsahu u 63 (83 %) pacientek s mediánem operační doby 228 minut (v rozmezí 181–371 minut) s mediánem 20 pánevních uzlin (6–42) a mediánem 16 paraaortálních uzlin (6–45) [14].
Zásadním rozdílem v provedení suprapelvické lymfadenektomie přístupem duálního dokování není pouze odlišné umístění pacientské konzoly robotického systému, které zajistí adekvátní a bezpečný přístup do oblasti aorty a dolní duté žíly, ale zcela odlišný přístup do retroperitonea. Na rozdíl od SSD (single side docking – jednoho bočního dokování), kdy je peritoneum otevřeno nad celou oblastí velkých cév až k duodenu jako u otevřené chirurgie, v případě DSD (double side docking – dvojitého bočního dokování) je lymfadenektomie zahájena malou incizí (3–4 cm) nad pravou arteria iliaca comunis v blízkosti aortální bifurkace. Následně je vypreparován prostor mezi peritoneem, které je nadzvedáváno nad abdominální aortou a dolní dutou žílou až po renální cévy. Filozofií tohoto přístupu je zachovat relativně malou incizi peritonea a vytvořit tunelovitý prostor v retroperitoneu „peritoneální stan“, který vytvoří dostatek místa pro manipulaci a zabrání překrývání operačního pole střevními kličkami [43, 51]. Velmi důležitým krokem je způsob přemístění kliček tenkého střeva z operačního pole. Pro fázi paraaortální lymfadenektomie je zcela zásadní před připojením robotického systému překlopit kličky tenkého střeva na mezenteriálním závěsu kraniálním směrem za pomoci laparoskopických nástrojů. Tímto manévrem je možné si zajistit volné operační pole, protože pouhé odtlačení a vysunutí střev vede v důsledku aktivní peristaltiky a volné mobility k jejich návratu do oblasti malé pánve a překrytí struktur retroperitonea. Po ukončení výkonu je však nutné obnovit jejich anatomickou pozici, a tím předejít pooperačním obtížím souvisejícím s obnovou střevní pasáže.
Paraaortální lymfadenektomie u obézních pacientek
Obezita je negativní specifický faktor, který zvyšuje riziko intraoperačních a pooperačních komplikací, riziko konverze laparoskopických výkonů, celkovou obtížnost operace a snižuje počet získaných lymfatických uzlin. Podle výsledků LAP2 (GOG) studie byly laparoskopické výkony v daném souboru zatíženy 57% frekvencí konverzí u pacientek s BMI více než 40 kg/m2 a pouze u 28 % pacientek v dané kohortě byl laparoskopický výkon úspěšně proveden v požadovaném rozsahu [62]. Z celonárodní americké databáze hospitalizovaných, zahrnující 1087 pacientů s BMI 40 kg/m2 a vyšším, kteří podstoupili chirurgický výkon v roce 2011, byla lymfadenektomie v jakékoli formě provedena u 34 % nemocných operovaných laparotomicky, u 30 % pacientů, kteří podstoupili robotickou operaci, a u 18 % operovaných laparoskopicky [29]. V letos publikované práci z finského univerzitního centra byla obezita hodnocena jako nejvýznamnější příčina dosažení kraniální úrovně pouze po IMA (p < 0,001 pro BMI > vs. < 33 kg/m2). Navíc, malá výška (≤ 162 cm) pacientek a přítomnost intraabdominálních adhezí negativně ovlivňují úspěšné dosažení vysoké PALND [42]. Taktéž v našem souboru byl pozorován trend k nižšímu počtu získaných uzlin v paraaortální oblasti u pacientek s vyšším BMI, avšak korelační analýzou mezi BMI a počty uzlin nebyla prokázána statisticky významná závislost.
Recentně byla Hubertem Fornalikem publikovaná retrospektivní kohortová studie 111 morbidně obézních pacientek (BMI více než 40 kg/m2) léčených pro karcinom endometria. Sedmdesát šest žen podstoupilo robotický staging a 35 laparotomický stagingový výkon. Tato práce dokládá možnost provedení adekvátního chirurgického stagingu (laparotomicky/roboticky) u takto specifické skupiny pacientek, je-li výkon prováděn komplexně zkušeným týmem a robotický výkon je realizován operatérem, který ročně provede 200 a více robotických výkonů. V daném souboru byla provedena pánevní lymfadenektomie u 96 % případů, paraaortální u 75 % případů s mediánem 15 získaných uzlin v pánvi a mediánem 12 uzlin v paraaortální krajině. Robotická chirurgie byla spojena s lepší kvalitou stagingu než otevřená chirurgie, ale zároveň s delší dobou výkonu o 56 % průměrné délky operace (čas na operačním sále 260 vs. 166 min., p < 0,001). Na základě těchto výsledků lze předpokládat, že komplikovaní pacienti podstupující delší minimálně invazivní výkon v Trendelenburgově pozici tolerují tento výkon lépe než ti, kteří podstoupí rychlou laparotomickou operaci [17]. Podle prací srovnávajících klasický laparoskopický a robotický přístup k paraaortální lymfadenektomii bylo procento konverzí nižší ve skupině roboticky asistované chirurgie [19, 58].
Komplikace endoskopické suprapelvické lymfadenektomie
Frekvence konverzí z dat získaných GOG LAP2 studií dosahovala 25 % u pacientek stážovaných pro karcinom děložního těla [62]. Takto vysoké procento selhání operačního přístupu je jednoznačným důkazem náročnosti tradiční laparoskopie [34]. V případě jiných studií, které hodnotily modalitu robotické chirurgie samostatně nebo ve srovnání s klasickou laparoskopií, je frekvence konverzí v robotické kohortě nízká, nebo se vůbec nevyskytují. V případě laparoskopických výkonů se četnost konverzí pohybovala od 1 % do 15 %, zejména u transperitoneálních suprapelvických výkonů [18, 20, 30, 37, 38, 49, 57]. Důvody konverzí byly nejčastěji cévní poranění, rozsáhlé adheze, poranění střeva a nemožnost zajistit adekvátní přístup do operačního pole retroperitonea [14, 18, 20, 27, 47]. Tato nízká četnost vynucených konverzí je patrná i v našem studovaném souboru, avšak v našem případě nikdy nebyla příčinou komplikace samotného výkonu. Incidence pooperačních komplikací ve studiích srovnávajících robotiku s otevřenou chirurgií byla u skupiny morbidně obézních žen nižší než ve skupině otevřené chirurgie (14,5 % vs. 28,6 % v tomto pořadí), rozdíl však nebyl statisticky významný (p = 0,12). Pacientky operované laparotomicky měly vyšší riziko ileu, střevní obstrukce, vyšší riziko respirační insuficience [17]. Nejčastější specifickou pooperační komplikací minimálně invazivní extenzivní lymfadenektomie je tvorba lymfocyst, lymfatických otoků a relativně vzácný chylózní ascites. Ty se vyskytovaly v jednotlivých souborech bez statisticky významného rozdílu mezi robotickým a klasickým laparoskopickým přístupem (17,6 % vs. 8,4 %) [13]. Intraoperačně vzniklé komplikace nejsou časté a jsou pozorovány s četností okolo 1 %, nejčastěji se jedná o cévní poranění (aorty, dolní duté žíly) nebo krvácení z arteria mesenterica inferior vznikající při excesivní trakci na vytvořený „peritoneální stan“ [22], poranění střeva nebo močového ústrojí [18, 20, 27, 43, 47] (tab. 4).
Table 4. Srovnání výskytu komplikací při paraaortální lymfadenektomii v literatuře 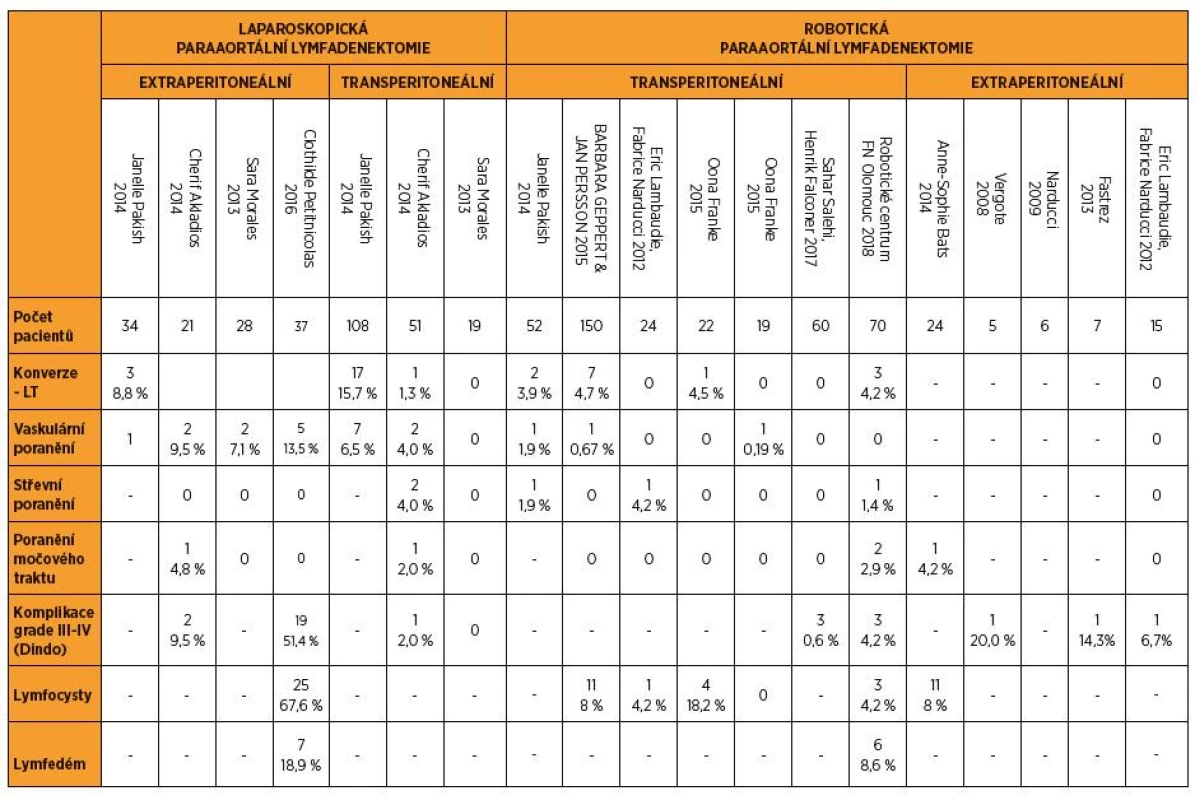
ZÁVĚR
Robotická chirurgie si definitivně získala místo v oblasti gynekologické operativy. Komplexní, dostatečně zkušený tým zajišťující péči a realizaci robotického operačního výkonu s dostatečným počtem daných výkonů za rok a expertní chirurg jsou bez pochyby asociovány s úspěšným provedením operace v požadovaném rozsahu. Výsledky různých studií podporují předpoklad, že duální dokování využívané za účelem provedení kombinovaného multikvadrantového výkonu s paraaortální lymfadenektomií přispívá ke zlepšení disekce paraaortálních uzlin. Tato strategie mininvazivní chirurgie je technicky proveditelná s minimální morbiditou, minimálním prodloužením operačního času ve srovnání s přístupem jednorázového připojení robotického systému a je spojena s krátkou dobou, během které je získána adekvátní erudice této techniky. Podle našich zkušeností lze pomocí duálního dokování provést paraaortální lymfadenektomii bezpečněji, případně řešit patologie vyžadující operování v horní i dolní polovině dutiny břišní během jednoho operačního výkonu.
Tato pilotní retrospektivní studie potvrzuje předpoklad, že duální dokování zvyšuje pravděpodobnost provedení kompletní suprapelvické lymfadenektomie, přispívá k dosažení vyššího počtu získaných lymfatických uzlin, a to bez statisticky významného prodloužení operačního času ve srovnání s klasickým robotickým přístupem. Frekvence výskytu konverzí v našem souboru byla velmi nízká, nikdy jejím důvodem nebyl výkon v retroperitoneu. Rovněž četnost komplikací byla nízka a srovnatelná s výsledky jiných studií.
MUDr. Radim Marek
Porodnicko-gynekologická klinika
FN a LF UP
I. P. Pavlova 6
775 20 Olomouc
e-mail: radim.marek@seznam.cz
Sources
1 . ACOG practice bulletin, clinical management guidelines for obstetrician-gynecologists, number 65, August 2005: management of endometrial cancer. Obstet Gynecol, 2005, 106(2), p. 413–425.
2. Andou, M. Extraperitoneal endoscopic total retroperitoneal lymphadenectomy: no bowel surgery. J Minim Invasive Gynecol, 2016, 23(4), p. 475.
3. Bats, AS., Mimouni, M., Bensaid, C., et al. Robotic extraperitoneal paraaortic lymphadenectomy in gynecological cancers: feasibility, safety, and short-term outcomes of isolated and combined procedures. Int J Gynecol Cancer, 2014, 24(8), p. 1486–1492.
4. Boggess, JF., Gehrig, PA., Cantrell, L., et al. A comparative study of 3 surgical methods for hysterectomy with staging for endometrial cancer: robotic assistance, laparoscopy, laparotomy. Am J Obstet Gynecol, 2008, 199(4), p. 360.e1–9.
5. Brudie, LA., Backes, FJ., Ahmad, S., et al. Analysis of disease recurrence and survival for women with uterine malignancies undergoing robotic surgery. Gynecol Oncol, 2013, 128(2), p. 309–315.
6. Burke, WM., Orr, J., Leitao, M., et al. Endometrial cancer: a review and current management strategies: part I. Gynecol Oncol, 2014, 134(2), p. 385–392.
7. Colombo, N., Creutzberg, C., Amant, F., et al. ESMO-ESGO-ESTRO Consensus Conference on Endometrial Cancer: Diagnosis, Treatment and Follow-up. Int J Gynecol Cancer, 2016, 26(1), p. 2–30.
8. Colombo, N., Preti, E., Landoni, F., et al. Endometrial cancer: ESMO Clinical Practice Guidelines for diagnosis, treatment and follow-up. Ann Oncol, 2013, 24, Suppl. 6, p. vi33–38.
9. Creasman, WT., Odicino, F., Maisonneuve, P., et al. Carcinoma of the corpus uteri. FIGO 26th Annual Report on the results of treatment in gynecological cancer. Int J Gynaecol Obstet, 2006, 95, Suppl 1, p. S105–143.
10. Cunningham, MJ., Dunton, CJ., Corn, B., et al. Extended-field radiation therapy in early-stage cervical carcinoma: survival and complications. Gynecol Oncol, 1991, 43(1), p. 51–54.
11. Dargent, D., Ansquer, Y., Mathevet, P. Technical development and results of left extraperitoneal laparoscopic paraaortic lymphadenectomy for cervical cancer. Gynecol Oncol, 2000, 77(1), p. 87–92.
12. Dauwen, H., Van Calster, B., Deroose, CM., et al. PET/CT in the staging of patients with a pelvic mass suspicious for ovarian cancer. Gynecol Oncol, 2013, 131(3), p. 694–700.
13. Diaz-Feijoo, B., Gil-Ibanez, B., Perez-Benavente, A., et al. Comparison of robotic-assisted vs conventional laparoscopy for extraperitoneal paraaortic lymphadenectomy. Gynecol Oncol, 2014, 132(1), p. 98–101.
14. Ekdahl, L., Salehi, S., Falconer, H. Improving double docking for robot-assisted para-aortic lymphadenectomy in endometrial cancer staging: technique and surgical outcomes. J Minim Invasive Gynecol, 2016, 23(5), p. 818–824.
15. Fastrez, M., Vandromme, J., George, P., et al. Robot assisted laparoscopic transperitoneal para-aortic lymphadenectomy in the management of advanced cervical carcinoma. Eur J Obstet Gynecol Reprod Biol, 2009, 147(2), p. 226–229.
16. Fleming, ND., Ramirez, PT. Robotic surgery in gynecologic oncology. Curr Opin Oncol, 2012, 24(5), p. 547–553.
17. Fornalik, H., Zore, T., Fornalik, N., et al. Can Teamwork and High-Volume Experience Overcome Challenges of Lymphadenectomy in Morbidly Obese Patients (body mass index of 40 kg/m2 or greater) with Endometrial Cancer? A cohort study of robotics and laparotomy and review of literature. Int J Gynecol Cancer, 2018, 28(5), p. 959–966.
18. Franke, O., Narducci, F., Chereau-Ewald, E., et al. Role of a double docking to improve lymph node dissection: when robotically assisted laparoscopy for para-aortic lymphadenectomy is associated to a pelvic procedure. Int J Gynecol Cancer, 2015, 25(2), p. 331–336.
19. Gehrig, PA., Cantrell, LA., Shafer, A., et al. What is the optimal minimally invasive surgical procedure for endometrial cancer staging in the obese and morbidly obese woman? Gynecol Oncol, 2008, 111(1), p. 41–45.
20. Geppert, B., Persson, J. Robotic infrarenal paraaortic and pelvic nodal staging for endometrial cancer: feasibility and lymphatic complications. Acta Obstet Gynecol Scand, 2015, 94(10), p. 1074–1081.
21. Gold, MA., Tian, C., Whitney, CW., et al. Surgical versus radiographic determination of para-aortic lymph node metastases before chemoradiation for locally advanced cervical carcinoma: a Gynecologic Oncology Group Study. Cancer, 2008, 112(9), p. 1954–1963.
22. Gorostidi, M., Larreategui, J., Bernal, T., et al. Robotic retroperitoneal paraaortic lymphadenectomy at Donostia University Hospital. J Minim Invasive Gynecol, 2014, 21(3), p. 480–485.
23. Gucer, F., Misirlioglu, S., Ceydeli, N., et al. Robot-assisted laparoscopic transperitoneal infrarenal lymphadenectomy in patients with locally advanced cervical cancer by single docking: Do we need a backup procedure? J Robot Surg, 2018, 12(1), p. 49–58.
24. Herd, J., Fowler, JM., Shenson, D., et al. Laparoscopic para-aortic lymph node sampling: development of a technique. Gynecol Oncol, 1992, 44(3), p. 271–276.
25. Hirahatake, K., Hareyama, H., Sakuragi, N., et al. A clinical and pathologic study on para-aortic lymph node metastasis in endometrial carcinoma. J Surg Oncol, 1997, 65(2), p. 82–87.
26. Hoskins, WJ., Perez, C., Young, R, et al. (eds). Gynecologic tumors. In De Vita, VT. Cancer principles and practice of oncology, 1989, p. 1099–1161.
27. Hudry, D., Ahmad, S., Zanagnolo, V., et al. Robotically assisted para-aortic lymphadenectomy: surgical results: a cohort study of 487 patients. Int J Gynecol Cancer, 2015, 25(3), p. 504–511.
28. Hynninen, J., Auranen, A., Carpen, O., et al. FDG PET/CT in staging of advanced epithelial ovarian cancer: frequency of supradiaphragmatic lymph node metastasis challenges the traditional pattern of disease spread. Gynecol Oncol, 2012, 126(1), p. 64–68.
29. Chan, JK., Gardner, AB., Taylor, K., et al. Robotic versus laparoscopic versus open surgery in morbidly obese endometrial cancer patients – a comparative analysis of total charges and complication rates. Gynecol Oncol, 2015, 139(2), p. 300–305.
30. Cherif Akladios, P., Ronzino, V., Schrot-Sanyan, S., et al. Comparison between transperitoneal and extraperitoneal laparoscopic para-aortic lymphadenectomy in gynecologic malignancies. J Minim Invasive Gynecol, 2015, 22(2), p. 268–274.
31. Childers, JM., Hatch, K., Surwit, EA. The role of laparoscopic lymphadenectomy in the management of cervical carcinoma. Gynecol Oncol, 1992, 47(1), p. 38–43.
32. Choi, HJ., Roh, JW., Seo, SS., et al. Comparison of the accuracy of magnetic resonance imaging and positron emission tomography/computed tomography in the presurgical detection of lymph node metastases in patients with uterine cervical carcinoma: a prospective study. Cancer, 2006, 106(4), p. 914–922.
33. Chu, KK., Chang, SD., Chen, FP., et al. Laparoscopic surgical staging in cervical cancer–preliminary experience among Chinese. Gynecol Oncol, 1997, 64(1), p. 49–53.
34. Jacob, KA., Zanagnolo, V., Magrina, JF., et al. Robotic transperitoneal infrarenal aortic lymphadenectomy for gynecologic malignancy: a left lateral approach. J Laparoendosc Adv Surg Tech A, 2011, 21(8), p. 733–736.
35. James, JA., Rakowski, JA., Jeppson, CN., et al. Robotic transperitoneal infra-renal aortic lymphadenectomy in early-stage endometrial cancer. Gynecol Oncol, 2015, 136(2), p. 285–292.
36. Joint, A., Reporting, CfCSa.E.R. Manual for surgical staging of cancer, 1977, p. 1–173.
37. Kim, TJ., Yoon, G., Lee, YY., et al. Robotic high para-aortic lymph node dissection with high port placement using same port for pelvic surgery in gynecologic cancer patients. J Gynecol Oncol, 2015, 26(3), p. 222–226.
38. Lambaudie, E., Narducci, F., Leblanc, E., et al. Robotically assisted laparoscopy for paraaortic lymphadenectomy: technical description and results of an initial experience. Surg Endosc, 2012, 26(9), p. 2430–2435.
39. LaPolla, JP., SJ., Gaddis, O., Morrow, CP. The influence of surgical staging on the evaluation and treatment of patients with cervical carcinoma. Gynecol Oncol, 1986(24), p. 194–206.
40. Leiserowitz, G. Survival of endometrial cancer patients after laparoscopically assisted vaginal hysterectomy or total abdominal hysterectomy: analysis of risk factors. Gynecol Oncol, 2007, p. 104.
41. Lim, PC, Kang, E., Park, DH. Learning curve and surgical outcome for robotic-assisted hysterectomy with lymphadenectomy: case-matched controlled comparison with laparoscopy and laparotomy for treatment of endometrial cancer. J Minim Invasive Gynecol, 2010, 17(6), p. 739–748.
42. Maenpaa, MM., Nieminen, K., Tomas, EI., et al. Robotic-assisted infrarenal para-aortic lymphadenectomy in gynecological cancers: technique and surgical outcomes. Int J Gynecol Cancer, 2018, 28(5), p. 951–958.
43. Magrina, JF., Long, JB., Kho, RM., et al. Robotic transperitoneal infrarenal aortic lymphadenectomy: technique and results. Int J Gynecol Cancer, 2010, 20(1), p. 184–187.
44. Magrina, JF., Mutone, NF., Weaver, AL., et al. Laparoscopic lymphadenectomy and vaginal or laparoscopic hysterectomy with bilateral salpingo-oophorectomy for endometrial cancer: morbidity and survival. Am J Obstet Gynecol, 1999, 181(2), p. 376–381.
45. Malur, S., Possover, M., Michels, W., et al. Laparoscopic-assisted vaginal versus abdominal surgery in patients with endometrial cancer–a prospective randomized trial. Gynecol Oncol, 2001, 80(2), p. 239–244.
46. Mariani, A., Dowdy, SC., Cliby, WA., et al. Prospective assessment of lymphatic dissemination in endometrial cancer: a paradigm shift in surgical staging. Gynecol Oncol 2008, 109(1), p. 11–18.
47. Menderes, G., Azodi, M., Clark, L., et al. Impact of body mass index on surgical outcomes and analysis of disease recurrence for patients with endometrial cancer undergoing robotic-assisted staging. Int J Gynecol Cancer, 2014, 24(6), p. 1118–1125.
48. Odunsi, KO., Lele, S., Ghamande, S., et al. The impact of pre-therapy extraperitoneal surgical staging on the evaluation and treatment of patients with locally advanced cervical cancer. Eur J Gynaecol Oncol, 2001, 22(5), p. 325–330.
49. Pakish, J., Soliman, PT., Frumovitz, M., et al. A comparison of extraperitoneal versus transperitoneal laparoscopic or robotic para-aortic lymphadenectomy for staging of endometrial carcinoma. Gynecol Oncol, 2014, 132(2), p. 366–371.
50. Pereira, A., Magrina, JF., Rey, V., et al. Pelvic and aortic lymphnode metastasis in epithelial ovarian cancer. Gynecol Oncol, 2007, 105(3), p. 604–608.
51. Ponce, J., Barahona, M., Pla, MJ., et al. Robotic transperitoneal infrarenal para-aortic lymphadenectomy with double docking: technique, learning curve, and perioperative outcomes. J Minim Invasive Gynecol, 2016, 23(4), p. 622–627.
52. Possover, MKN., Plaul, K., Khune-Heid, R., Schneider, A. Laparoscopic para-aortic and pelvic lymphadenectomy: experience with 150 patients and review of the literature. Gynecol Oncol, 1998, 71, p. 19–28.
53. Potish, RA., Downey, GO., Adcock, LL., et al. The role of surgical debulking in cancer of the uterine cervix. Int J Radiat Oncol Biol Phys, 1989, 17(5), p. 979–984.
54. Potish, RA., Twiggs, LB., Adcock, LL., et al. The utility and limitations of decision theory in the utilization of surgical staging and extended field radiotherapy in cervical cancer. Obstet Gynecol Surv, 1984, 39(9), p. 555–562.
55. Queiroz, MA., Kubik-Huch, RA., Hauser, N., et al. PET/MRI and PET/CT in advanced gynaecological tumours: initial experience and comparison. Eur Radiol, 2015, 25(8), p. 2222–2230.
56. Roh, JW., Seo, SS., Lee, S., et al. Role of positron emission tomography in pretreatment lymph node staging of uterine cervical cancer: a prospective surgicopathologic correlation study. Eur J Cancer, 2005, 41(14), p. 2086–2092.
57. Salehi, S., Avall-Lundqvist, E., Legerstam, B., et al. Robot-assisted laparoscopy versus laparotomy for infrarenal paraaortic lymphadenectomy in women with high-risk endometrial cancer: a randomised controlled trial. Eur J Cancer, 2017, 79, p. 81–89.
58. Seamon, LG., Cohn, DE., Henretta, MS., et al. Minimally invasive comprehensive surgical staging for endometrial cancer: Robotics or laparoscopy? Gynecol Oncol, 2009, 113(1), p. 36–41.
59. Soliman, PT., Frumovitz, M., Spannuth, W., et al. Lymphadenectomy during endometrial cancer staging: practice patterns among gynecologic oncologists. Gynecol Oncol, 2010, 119(2), p. 291–294.
60. Supe, AN., Kulkarni, GV., Supe, PA. Ergonomics in laparoscopic surgery. J Minim Access Surg, 2010, 6(2), p. 31–36.
61. Todo, Y., Kato, H., Kaneuchi, M., et al. Survival effect of para-aortic lymphadenectomy in endometrial cancer (SEPAL study): a retrospective cohort analysis. Lancet, 2010, 375(9721), p. 1165–1172.
62. Walker, JL., Piedmonte, MR., Spirtos, NM., et al. Laparoscopy compared with laparotomy for comprehensive surgical staging of uterine cancer: Gynecologic Oncology Group Study LAP2. J Clin Oncol, 2009, 27(32), p. 5331–5336.
63. Wharton, JT., Jones, HW., 3rd, Day, TG., Jr., et al. Preirradiation celiotomy and extended field irradiation for invasive carcinoma of the cervix. Obstet Gynecol, 1977, 49(3), p. 333–338.
64. Wisner, KP., Gupta, S., Ahmad, S., et al. Indications and techniques for robotic pelvic and para-aortic lymphadenectomy in gynecologic oncology. J Surg Oncol, 2015, 112(7), p. 782–789.
65. Xiong, W., Cao, LL., Jiang, LP., et al. [Clinical comparative analysis of comprehensive laparoscopic and laparotomic staging of early-stage epithelial ovarian cancer]. Zhonghua Fu Chan Ke Za Zhi, 2017, 52(2), p. 103–109.
Labels
Paediatric gynaecology Gynaecology and obstetrics Reproduction medicine
Article was published inCzech Gynaecology

2019 Issue 1-
All articles in this issue
- Robotická paraaortální lymfadenektomie v onkogynekologii. Duální dokování daVinci S systému zvyšuje úspěšnost vysoké paraaortální lymfadenektomie u karcinomu endometria
- Porodní poranění análního sfinkteru – analýza vlastního souboru rodiček mezi lety 2015–2017
- Medicínské, eticko-morální a právní aspekty u operací Svědků Jehovových
- Kritéria pro výběr náhradní matky
- Psychosociální rizikové faktory akutního císařského řezu
- Role ultrazvuku ve stagingu zhoubného nádoru děložního hrdla (doporučení Evropské onkogynekologické, radiační a patologické společnosti)
- Děložní mikrobiom jako faktor receptivity endometria
- Cerclage – historie a současnost
- Endometrióza v těhotenství – diagnostika a management
- Diagnostika a moderní trendy v terapii poporodní deprese
- Močová inkontinence v těhotenství
- Fournierova gangréna spojená s léčbou diabetes mellitus glifloziny
- Devadesátiletí profesora Antonína Doležala
- Czech Gynaecology
- Journal archive
- Current issue
- Online only
- About the journal
Most read in this issue- Endometrióza v těhotenství – diagnostika a management
- Diagnostika a moderní trendy v terapii poporodní deprese
- Cerclage – historie a současnost
- Děložní mikrobiom jako faktor receptivity endometria
Login#ADS_BOTTOM_SCRIPTS#Forgotten passwordEnter the email address that you registered with. We will send you instructions on how to set a new password.
- Career

