-
Medical journals
- Career
Pilotní studie pro využití samoodběrové soupravy a molekulární diagnostiky HPV infekce pro skrínink karcinomu děložního čípku
Authors: H. Ondryášová; V. Koudelakova; J. Drábek; P. Vaněk; R. Slavkovský; M. Hajdúch
Authors‘ workplace: Ústav molekulární a translační medicíny, LF UP a FN, Klastr MedChemBio, Olomouc-Holice, vedoucí doc. MUDr. Marián Hajdúch, Ph. D.
Published in: Ceska Gynekol 2015; 80(6): 436-443
Overview
Cíle studie:
Získat prvotní zkušenosti s alternativním odběrem vzorku (samoodběrem) pro testování přítomnosti HPV za účelem skríninku karcinomu děložního čípku.Typ studie:
Původní práce.Název a sídlo pracoviště:
Ústav molekulární a translační medicíny, LF UP a FN Olomouc.Metodika:
Na základě předem projeveného zájmu o HPV vyšetření byly 215 ženám zaslány samoodběrové sady Evalyn® Brush. Cervikovaginální stěry obdržené poštou byly analyzovány v naší laboratoři na přítomnost HPV infekce systémem Cobas 4800 HPV (Roche) s následnou genotypizací pomocí PapilloCheck® HPV-Screening (Greiner Bio-One). Náhodně vybraným 60 ženám z našeho souboru byl společně se samodběrovou sadou zaslán dotazník zaměřený na jejich zkušenost se samoodběrem.Výsledky:
Z rozeslaných 215 samoodběrových sad bylo k analýze doručeno 174 (81 %) cervikovaginálních stěrů. Všechny vzorky byly odebrány správně a bylo možné je vyšetřit Cobas 4800 HPV testem. PapilloCheck® HPV-Screening systémem bylo možné za zisku validního výsledku vyšetřit 98 % vzorků (171/174).
Z vyšetřených 174 vzorků bylo 125 vzorků (72 %) HPV negativních, u 7 vzorků (4 %) byla detekována pouze přítomnost nízkorizikové HPV infekce a u 42 vzorků (24 %) jsme detekovali přítomnost vysokorizikové HPV infekce. Nejčastěji detekovanými vysoce rizikovými genotypy byly HPV 16 (11/42; 26 %) a HPV 53 (6/42; 14 %). V 10 případech byla detekována současná infekce několika hrHPV, v 5 z nich byla nalezena současně infekce lrHPV.
Z 60 odeslaných dotazníků bylo zasláno zpět 48 (80 %). Z této skupiny ohodnotilo svou zkušenost se samoodběrovou sadou jako dobrou až výbornou 47 (98 %) dotázaných žen. Návod k použití Evalyn® Brush byl považován za dobrý až vynikající všemi ženami (100 %). Všechny ženy také ohodnotily použití samoodběrové sady jako dobré až vynikající. Podle očekávání většina žen z našeho souboru (n = 42 [88 %]) dává přednost samoodběru před odběrem vzorku lékařem.Závěr:
Samoodběr cervikovaginálního stěru vede při použití dvou testovaných molekulárně genetických metod k validním výsledkům a byl českými ženami velmi dobře přijat. Zavedení samoodběru jako způsobu účasti na cervikálním skríninku by mohlo vést ke zvýšení návštěvnosti skríninkového programu karcinomu děložního čípku, a napomohlo by tak ke snížení incidence i mortality tohoto onemocnění v české populaci.Klíčová slova:
karcinom cervixu, skrínink cervikálního karcinomu, samoodběr, lidský papilomavirus, HPV, cytologie, PCRÚVOD
V současné době je celosvětově karcinom děložního čípku s 528 000 nově diagnostikovanými případy ročně sedmé nejčastější nádorové onemocnění a čtvrté nejčastější nádorové onemocnění u žen. Každý rok na toto onemocnění zemře 266 tisíc žen, což odpovídá 7,5 % ze všech úmrtí žen na nádorová onemocnění. V České republice byl karcinom cervixu v roce 2011 nově diagnostikován 1023 ženám a 399 žen na toto onemocnění zemřelo. Onemocnění postihuje především ženy v produktivním věku, přibližně 50 % incidence a 30 % mortality tvoří skupina žen mladších 50 let [11, 15, 23].
Zavedení cytologického screeningového programu, využívajícího tzv. Pap (Papanicolau) testu, popř. liquid-based cytology (LBC), vedlo v řadě zemí k dramatickému snížení incidence a mortality karcinomu děložního čípku [4, 19]. V České republice došlo během posledních 10 let k poklesu incidence karcinomu děložního hrdla o 14 % a poklesu úmrtnosti dokonce o 27 % [9]. Pomocí skríninku založeného na cytologickém vyšetření se podařilo především snížit incidenci spinocelulárního karcinomu cervixu (SCC), který představuje až 85 % všech cervikálních karcinomů. Incidenci adenokarcinomu, vzhledem k jeho lokalizaci, skrínink významně neovlivnil [1, 6]. Pravidelným preventivním cytologickým vyšetřením (každých 12 měsíců) lze docílit negativní prediktivní hodnoty 99,3 % a pozitivní prediktivní hodnoty 37,5 % [21].
Zásadním problémem skríninkového programu zůstává nízké pokrytí cílové populace žen (v ČR 55 % žen ve věku 25–59 let). Ženy, které preventivní vyšetření nepodstupují (45 %), se podílejí 50 procenty na diagnostikovaném karcinomu děložního hrdla [11, 24]. Přestože cytologický skrínink dosahuje specificity 96,3 %, jeho nevýhodou je nízká senzitivita (53 %) a značná subjektivita interpretace, vyžadující striktní kontrolu kvality cytologických laboratoří [9].
Pro vznik přednádorových i nádorových změn na děložním čípku je nezbytná infekce vysoce rizikovým genotypem HPV (hrHPV, jedná se o subtypy/genotypy HPV 16, 18, 31, 33, 35, 39, 45, 51, 52, 56, 58, 59 a 66) [8, 28]. HPV 16 a HPV 18 jsou genotypy s největším onkogenním potenciálem, způsobující až 70 % SCC a více než 90 % adenokarcinomů cervixu [7, 17]. Nespornou výhodou hrHPV diagnostiky je také nízké riziko (< 2 %) rozvoje závažného onkologického nálezu na děložním hrdle (CIN3+) pro hrHPV negativní ženy v následujících 5 letech [2].
Ačkoli řada studií prokázala vyšší senzitivitu (přibližně o 30 %) a nepatrně nižší specificitu (přibližně o 4 %) hrHPV diagnostiky pro detekci středně těžké cervikální intraepiteliální neoplazie a vyšších stadií neoplazie (CIN2+) než cytologie, a tím lepší ochranu proti cervikálnímu karcinomu, zůstává morfologické vyšetření cervikální cytologie nejpoužívanější metodou cervikálního skríninku [2, 3, 4, 9, 22].
Pro dosažení optimální ochrany žen před vznikem karcinomu děložního čípku je nezbytné se zaměřit na nejvíce rizikovou skupinu žen, a to ženy, které se skríninkového programu neúčastní. Jednou možností je adresné zvaní těchto žen k návštěvě gynekologa s následným hodnocením cytologie. Projekt adresného zvaní byl v České republice zaveden začátkem roku 2014. I přes mediální kampaň však zvýšil projekt adresného zvaní účast na cervikálním skríninkovém programu pouze o 8,1 %. Navýšení je nižší než v jiných evropských zemích, kde se účast zvýšila průměrně o 15,2 % (v jednotlivých studiích 4,5–26,2 %) [16, 25]. Řada studií naopak ukázala, že tyto ženy preferují možnost samoodběru. Nabídnutí samoodběrové sady ženám, které nechtějí navštívit gynekologa za účelem skríninku, vedlo k vyššímu procentu vyšetřených žen: až 39,1 % žen, které nenavštěvovaly skríninkový program, odeslalo vzorek odebraný samoodběrem na hrHPV testování, zatímco opětovné adresné zvaní přesvědčilo v jednotlivých studiích jen 9,1–35,5 % žen [28]. Navíc 89 % žen, jejichž samoodběr byl hrHPV pozitivní, následně navštívilo svého gynekologa a podstoupilo cytologické vyšetření, případně nový HPV test [13, 14]. Z publikovaných studií tedy vyplývá, že by zaslání samoodběrové sady ženám nenavštěvujícím skrínink mohlo výrazně zvýšit záchyt přednádorových/nádorových změn i v České republice a přinejmenším skupinu hrHPVpozitivních žen pak dostat do gynekologických ambulancí. O plošném zasílání samoodběrových sad se v ČR zatím neuvažuje, cíleně je nabízí Rakovina věc veřejná – nadace pro výzkum rakoviny (www.vecverejna.cz).
Cílem naší práce bylo ověřit potenciál samoodběru v kombinaci s molekulárním vyšetřením na HPV pro zvýšení účasti českých žen ve skríninkovém programu karcinomu děložního hrdla.
MATERIÁL A METODY
Ženám ve věku 19–75 let, které projevily zájem znát svůj HPV status a objednaly si HPV test prostřednictvím internetových stránek http://www.vecverejna-cz.eu/, byly rozeslány poštou samoodběrové sady Evalyn® Brush (Rovers Medical, Holandsko), které byly po odběru doručené poštou do Ústavu molekulární a translační medicíny LF UP k další analýze. Pilotní skupině 60 žen byl společně se samoodběrovou sadou zaslán dotazník zaměřený na jejich zkušenost a spokojenost s tímto typem odběru. U analyzované skupiny žen nejsou známy sociologické údaje ani informace o zdravotním stavu. Všechny ženy zařazené do studie podepsaly informovaný souhlas s účastí ve studii. Výzkumný projekt byl schválen etickou komisí Lékařské fakulty Univerzity Palackého a Fakultní nemocnice Olomouc.
Odebrané vzorky byly skladovány nasucho až do doručení do laboratoře, kde byly fixovány v Cobas® PCR Cell Collection médiu (Roche Diagnostics, Česká Republika). Všechny vzorky byly analyzovány na přítomnost HPV 16/18 a dalších 12 hrHPV systémem Cobas 4800 HPV Test (Roche Diagnostics, Česká Republika). Detekce HPV DNA pomocí Cobas 4800 HPV Test je založena na real-time PCR na přístroji Cobas z 480, které předchází automatizovaná izolace DNA na přístroji Cobas x 480 [20]. Genotypizace HPV byla provedena systémem PapilloCheck® HPV-Screening (Greiner Bio-One, Německo), který detekuje 18 hrHPV a 6 nízkorizikových HPV (lrHPV, tab. 1). PapilloCheck® HPV-Screening systém je založen na amplifikaci cílové sekvence virové DNA PCR reakcí s následným fluorescenčním značením a hybridizací na microarray. Zpracování a vyhodnocení microarray probíhá automaticky za pomoci CheckScanner™ a CheckReport™ Software [10]. Rozdělení HPV genotypů na hrHPV a lrHPV bylo zachováno dle klasifikace výrobců použitých detekčních metod. V případě neshody výsledků systému Cobas 4800 HPV Test a PapilloCheck® HPV-Screening jsme k potvrzení HPV statusu použili LMNX genotyping kit HPV GP (Diassay, Holandsko). Principem testu je amplifikace cílové sekvence virové DNA pomocí biotinylovaných GP5+/6+ primerů a následná hybridizace na sondy specifické pro jednotlivé genotypy, které jsou nanesené na částicích značených odlišnými fluorofory (RHA – Reverse Hybridisation Assay). Zpracování a vyhodnocení vzorků je plně automatizováno na sestavě přístrojů společnosti Luminex [12]. Ke všem testům jsme použili DNA připravenou automatem Cobas x 480. Výsledky byly následně statisticky zpracovány pomocí software R a Microsoft Excel.
Table 1. Srovnání základních charakteristik použitých detekčních metod. HrHPV podtypy detekované všemi třemi detekčními metodami jsou označeny tučným písmem 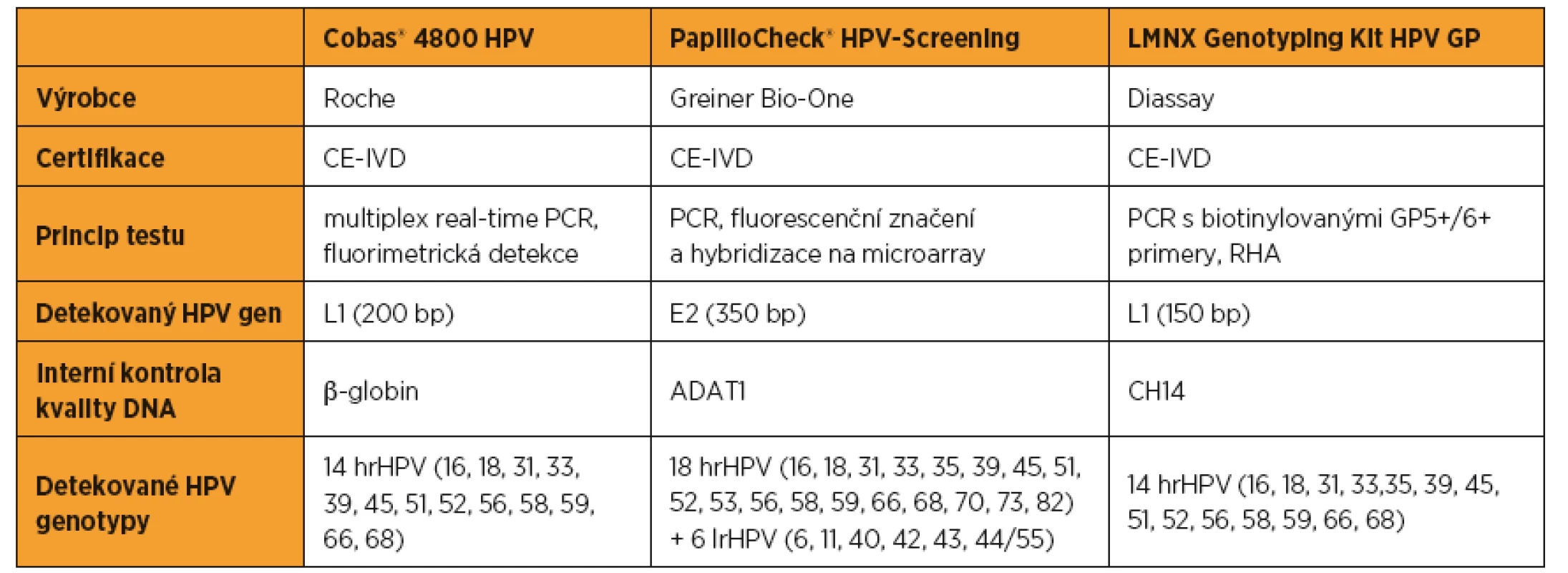
ADAT1 – adenosine deamináza; CE-IVD – Conformité Européenne, In Vitro Diagnostics; CH14 – chromozom 14; hrHPV – vysoce rizikové lidské papilomaviry; lrHPV – nízce rizikové lidské papilomaviry; PCR – polymerázová řetězová reakce; RHA – reverzní hybridizační assay. VÝSLEDKY
Výsledky HPV testování
Na začátku studie bylo poštou rozesláno 215 samoodběrových sad Evalyn Brush, z nichž bylo k analýze doručeno 174 (81 %) samoodběrem získaných cervikovaginálních stěrů. U všech vyšetřovaných vzorků poskytl samoodběr dostatečné množství buněk potřebných pro vyšetření systémem Cobas® 4800 HPV (amplifikace vnitřní kontroly), žádné vyšetření nebylo nutné z technických důvodů opakovat. Systémem PapilloCheck® HPV-Screening nebylo možné vyšetřit 2 % (3/174) vzorků (opakované selhání amplifikace vnitřní kontroly). Tyto vzorky byly stejně jako vzorky, u nichž výsledky testu systémem Cobas® 4800 HPV a PapilloCheck® HPV-Screening neshodovaly ve výsledku (7 %; 12/174), následně vyšetřeny pomocí LMNX genotyping kit HPV GP (tab. 2).
Table 2. Analýza HPV statusu, u nichž se výsledky testu systémem Cobas® 4800 HPV a PapilloCheck® HPV-Screening neshodovaly nebo analýza PapilloCheck® HPV-Screening selhala 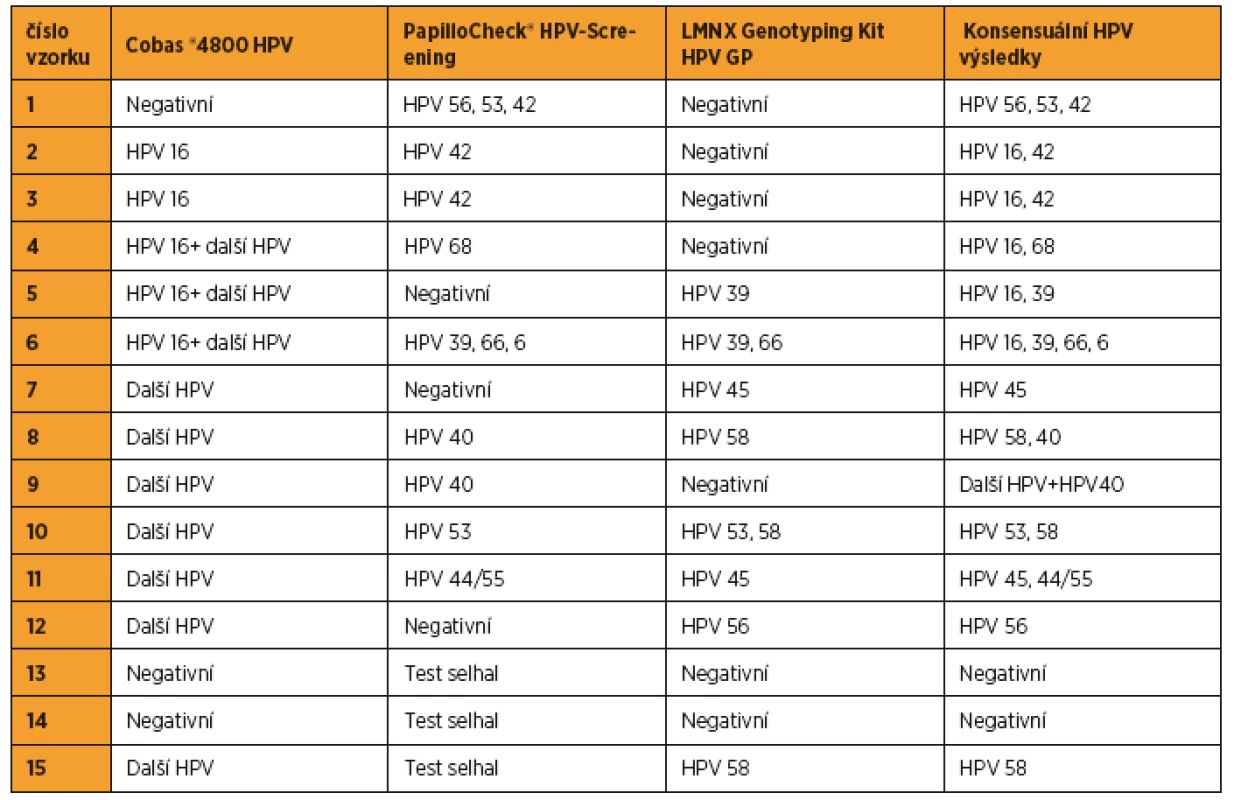
Další HPV+ zahrnuje HPV 31, 33, 39, 45, 51, 52, 56, 58, 59, 66 a 68. Konsenzuální HPV výsledek je založen na shodě výsledku dvou detekčních metod, v případě HPV genotypů detekovaných všemi třemi použitými metodami. Přítomnost HPV 53, 70, 73, 82 a lrHPV (HPV 6, 11, 40, 42, 43, 44/55) byla vyhodnocena pouze na základě analýzy systémem PapilloCheck® HPV-Screening. Z analyzovaných 174 cervikovaginálních stěrů bylo 125 (72 %) HPV negativních, u 4 vzorků (2 %) byla detekována přítomnost pouze lrHPV infekce a 45 vzorků (26 %) bylo hrHPV pozitivních. Nejčastěji detekovaným genotypem byl HPV 16 (15/45; 33 %). Přítomnost dalších genotypů je zobrazena na obrázku 1. Ve 13 případech byla detekována současná infekce několika hrHPV, v šesti z nich byla nalezena současně infekce lrHPV(tab. 3). Skupina hrHPV pozitivních žen měla o čtyři roky mladší věkový medián než hrHPV negativní (34 vs. 38, p = 0,011). S rostoucím věkem počet hrHPV pozitivních žen nesignifikantně klesal (p = 0,013).
Table 3. Detekované HPV koinfekce u 20/49 HPV pozitivních vzorků 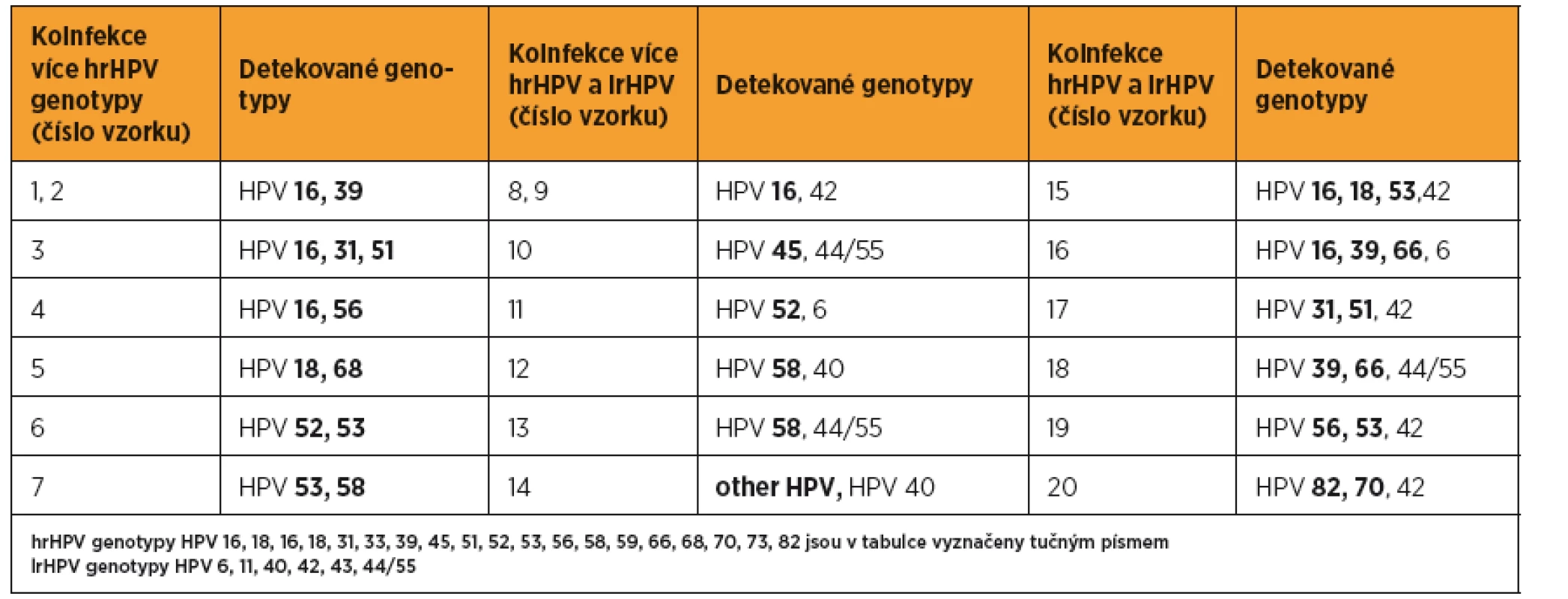
Image 1. Zastoupení jednotlivých HPV genotypů u 49 HPV pozitivních vzorků (modře – počet případů infekce 1 HPV genotypem, červeně – počet případů HPV koinfekce) 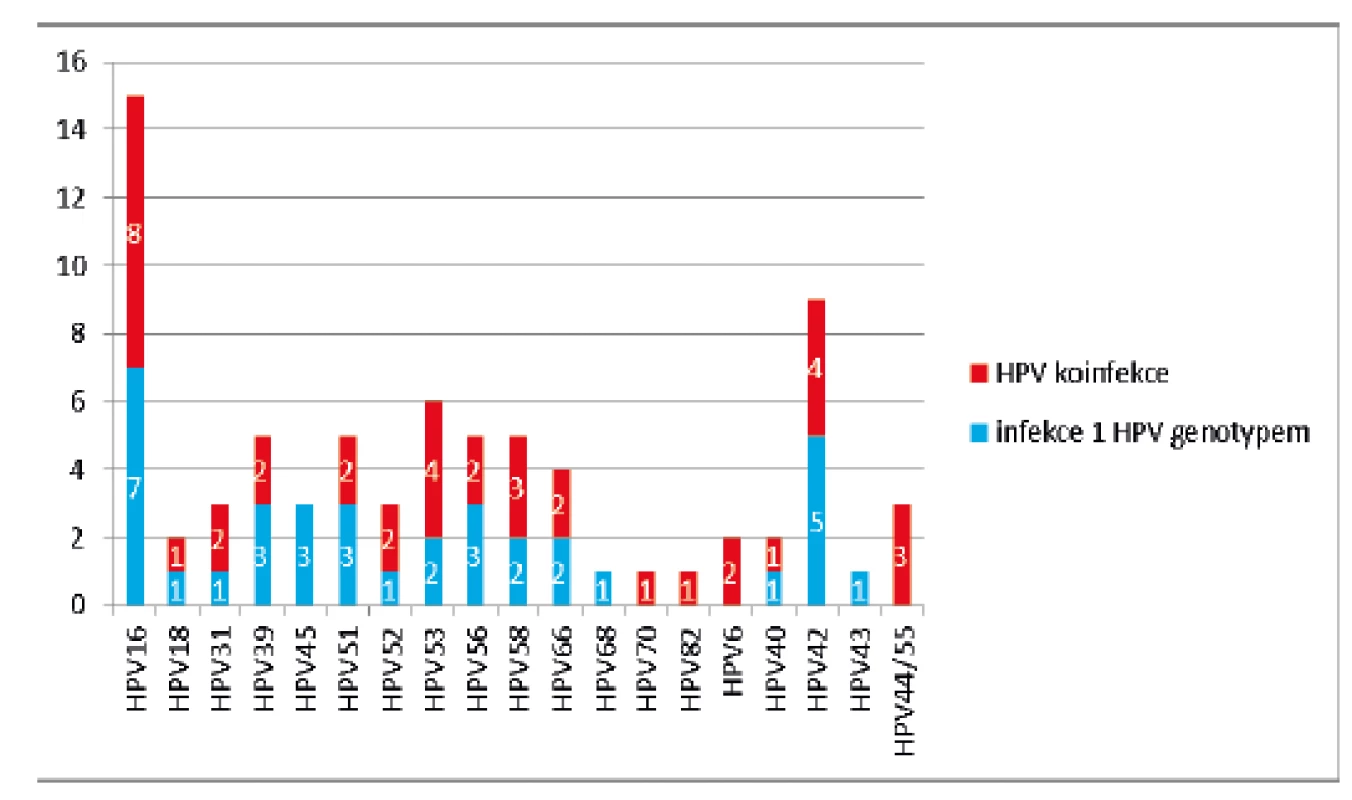
hrHPV genotypy HPV 16, 18, 31, 33, 39, 45, 51, 52, 53, 56, 58, 59, 66, 68, 70, 73, 82, lrHPV genotypy HPV 6, 11, 40, 42, 43, 44/55 Hodnocení spokojenosti se samoodběrovou sadou
Ze 60 odeslaných dotazníků bylo zasláno zpět 48 (80 %) vyplněných formulářů. Výsledky dotazníkového šetření jsou znázorněny v obrázku 2. Svou zkušenost se samoodběrovou sadou ohodnotilo jako dobrou až výbornou 47/48 (98 %) dotázaných žen. Návod k použití byl považován za dobrý až vynikající všemi ženami (100 %). Všechny ženy také ohodnotily pohodlnost použití samoodběrové sady jako dobrou až vynikající. Většina žen (42/48; 88 %) dává přednost samoodběru před odběrem vzorku lékařem, pouze 10 % (5/48) hodnotí samoodběr a odběr lékařem stejně.
Image 2. Výsledky dotazníkového šetření 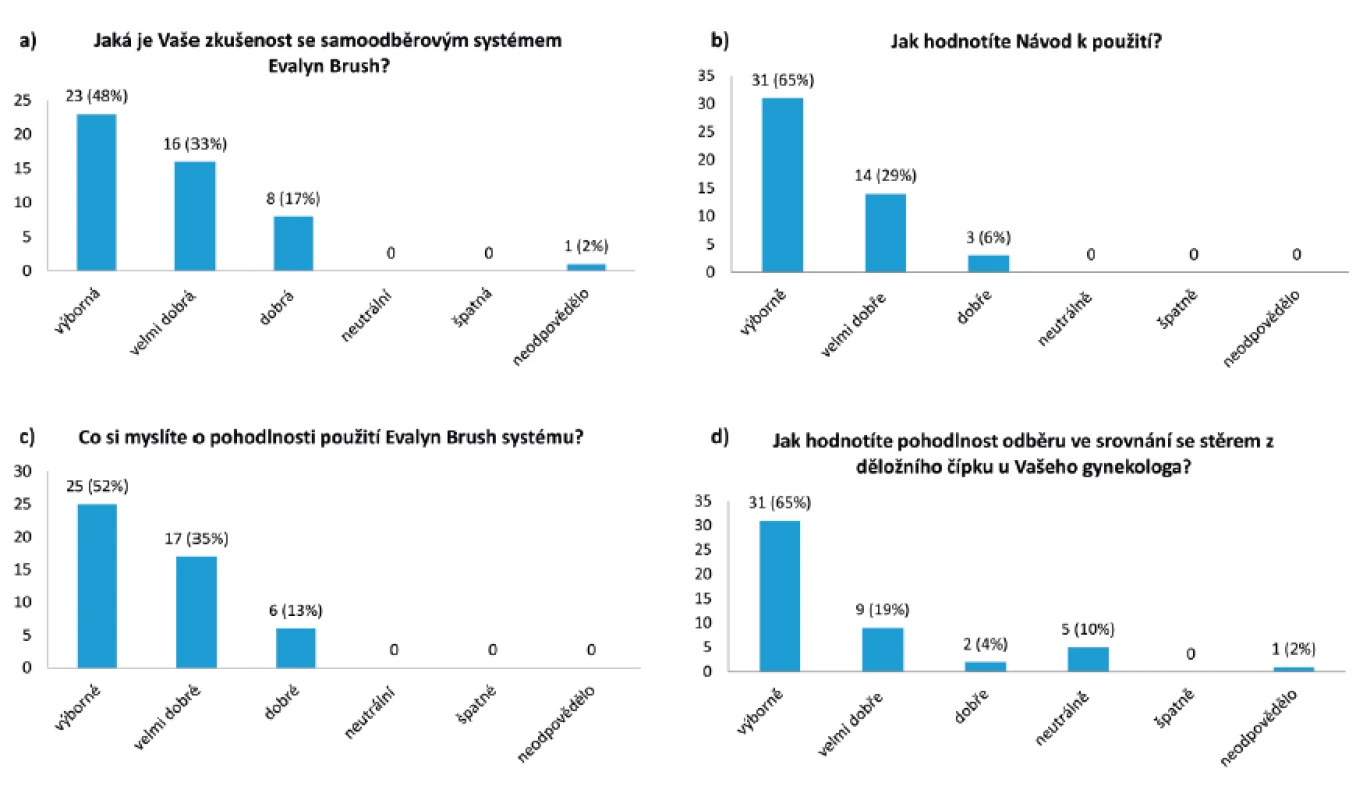
a) Hodnocení zkušenosti žen se samoodběrovou sadou, b) Hodnocení návodu k použití, c) Hodnocení pohodlnosti použití samoodběrové sady, d) Hodnocení pohodlnosti samoodběru ve srovnání s odběrem vzorku u gynekologa DISKUSE
Získání validního výsledku při testu systémem Cobas® 4800 HPV u všech 174 analyzovaných vzorků potvrzuje, že množství a kvalita odebraného materiálu samoodběrovou sadou jsou pro hrHPV vyšetření dostatečné.
V námi studované skupině vzorků jsme detekovali hrHPV DNA u 24 % vzorků, což je více než dvakrát vyšší hodnota, než uvádějí nejrozsáhlejší studie žen (n = 27 792 a n = 26 145), které nenavštěvují cervikální screening (10 % a 8 %) [13, 14]. Naopak podobně vysoké zastoupení (27,4 %) hrHPV pozitivních žen bylo pozorováno ve studiích zaměřených na ženy se zvýšeným rizikem hrHPV infekce (ženy s cervikální dysplazií, HIV pozitivní ženy a pacientky kolposkopických klinik) [18]. Náš vysoký záchyt hrHPV může být způsoben nereprezentativností výběru. Větší zájem zjistit svůj HPV status pomocí samoodběru mohou mít ženy, které již trpí HPV-asociovaným onemocněním nebo z jiných důvodů spadají do skupiny se zvýšeným rizikem HPV infekce (zejména rizikové sexuální chování).
Nicméně celkově vysoké procento pozitivních vzorků je v souladu s nedávno publikovanou studií HPV pozitivních vzorků [26] a ukazuje na mimořádně vysokou prevalenci hrHPV v populaci českých žen ve srovnání s jinými evropskými zeměmi (obr. 3).
Image 3. Prevalence výskytu HPV v Evropě – vážený průměr 121 studií publikovaných v letech 1996–2014, kumulativně sesbíraných ve studii Bruni et al. 2015 [5] ![Prevalence výskytu HPV v Evropě – vážený průměr 121 studií publikovaných v letech 1996–2014, kumulativně sesbíraných ve studii Bruni et al. 2015 [5]](https://www.prolekare.cz/media/cache/resolve/media_object_image_small/media/image/719a6ac05d0a8b6c3ffbc87619a751e2.png)
Možnost samoodběru cervikovaginálního stěru pro HPV test byla ženami velmi dobře přijata. Ženy ocenily především pohodlnost a jednoduchost použití sady. Většina dotázaných žen upřednostnila samoodběr před odběrem vzorku lékařem. Pouze dvě dotazované ženy (2/48; 4 %) by po vyzkoušení samoodběru upřednostnily odběr cervikálního stěru gynekologem. Naše výsledky na českých ženách jsou v rozporu se studií van Baars et al. z roku 2012, kdy nizozemské ženy nejčastěji upřednostňovaly odběr vzorku lékařem, protože se jim zdá spolehlivější a nemusí mít obavy z nesprávně provedeného odběru. Pozorovaný rozdíl lze vysvětlit například podstatně menším souborem jedinců v našem souboru, ale potenciálně i různým přístupem lékařů k pacientce nebo selekcí aktivnější skupiny žen v našem souboru. Získané výsledky se nicméně shodují s daty ze stejné studie, která také sledovala spokojenost žen se samoodběrem pomocí Evalyn® Brush [27].
U vzorků odebraných lékařem a samoodběrem je podle literatury dosahována vysoká míra shody v detekci hrHPV (pro Evalyn® Brush 86,6%) [18, 27]. Naše studie svým designem neumožňuje shodu mezi samoodběrem a odběrem provedeným gynekologem zhodnotit, nicméně můžeme potvrdit excelentní vyšetřitelnost všech odebraných vzorků, což svědčí o spolehlivosti provedeného samoodběru.
Přes pozitivní výsledky naší pilotní studie nemůžeme své nálezy generalizovat a kvantifikovat potenciální přínos samoodběru ke skríninku karcinomu cervixu v našich podmínkách. Abychom byli schopni odhadnout, jaký efekt by měla možnost samoodběru, bylo by nezbytné cíleně zaslat samoodběrovou sadu skupině žen, které se skríninku neúčastní, případně nereagovaly ani na adresné vyzvání k preventivnímu vyšetření. Provedení takové studie a případná implementace samoodběru do skríningového algoritmu v České republice může být jednou z efektivních cest, jak snížit výskyt tohoto onemocnění v populaci.
ZÁVĚR
Samoodběr cervikovaginálního stěru umožňuje získat validní výsledky HPV genotypizace. Samoodběrový kit Evalyn® Brush byl českými ženami dobře přijat (návratnost testu k analýze činila 81 %; ženy byly s odběrem spokojeny). Kombinace samoodběru s hrHPV diagnostikou pro ženy, které se zatím skríninku neúčastní, by mohla vést ke zvýšení pokrytí cílové populace a záchytu časných stadií cervikálního karcinomu.
Práce na tomto projektu byla financována z prostředků vnitřní grantové agentury Univerzity Palackého v Olomouci (IGA_LF_2014_009), Ministerstva školství, mládeže a tělovýchovy České republiky (CZ.1.05/3.1.00/14.0307; CZ.1.07/2.3.00/30.0041; LO1304), Ministerstva průmyslu České republiky (OPPI 5.1 SPK02/052) a Technologické agentury České republiky (TE02000058).
doc. MUDr. Marián Hajdúch, Ph.D.
Ústav molekulární a translační medicíny
LF UP a FN
Hněvotínská 5
779 00 Olomouc
e-mail: marian.hajduch@upol.cz
Sources
1. Anttila, A., Pukkala, E., Söderman, B., et al. Effect of organised screening on cervical cancer incidence and mortality in Finland, 1963–1995: recent increase in cervical cancer incidence. Int J Cancer, 1999, 83, p. 59–65.
2. Arbyn, M., Ronco, G., Anttila, A., et al. Evidence regarding human papillomavirus testing in secondary prevention of cervical cancer. Vaccine, 2012, 30 Suppl 5, p. F88–F99.
3. Arbyn, M., de Sanjosé, S., Saraiya, M., et al. EUROGIN 2011 roadmap on prevention and treatment of HPV-related disease. Int J Cancer, 2012, 131, p. 1969–1982.
4. Arbyn, M., Raifu, AO., Weiderpass, E., et al. Trends of cervical cancer mortality in the member states of the European Union. Eur J Cancer, 2009, 45, p. 2640–2648.
5. Bruni, L., Barrionuevo-Rosas, L., Albero, G., et al. Human papillomavirus and related diseases in the world. Summary report 2015-04-08. Information Centre on HPV and Cancer (HPV Information Centre) 2015.
6. Bulk, S., Visser, O., Rozendaal, L., et al. Cervical cancer in the Netherlands 1989–1998: Decrease of squamous cell carcinoma in older women, increase of adenocarcinoma in younger women. Int J Cancer, 2005, 113, p. 1005–1009.
7. Castellsagué, X., Díaz, M., de Sanjosé, S., et al. Worldwide human papillomavirus etiology of cervical adenocarcinoma and its cofactors: implications for screening and prevention. J National Cancer Institute, 2006, 98, p. 303–315.
8. Cogliano, V., Baan, R., Straif, K., et al. Carcinogenicity of human papillomaviruses. Lancet Oncol, 2005, 6, p. 204.
9. Cuzick, J., Clavel, C., Petry, K., et al. Overview of the European and North American studies on HPV testing in primary cervical cancer screening. Int J Cancer, 2006, 119, p. 1095–1101.
10. Dalstein, V., Merlin, S., Bali, C., et al. Analytical evaluation of the PapilloCheck test, a new commercial DNA chip for detection and genotyping of human papillomavirus. J Virol Methods, 2009, 156, p. 77–83.
11. Duskova, J., Bekova, A., Dvorak, V., et al. Results of the Czech National Cervical Cancer screening programme. Klin Onkol, 2014, 27, Suppl. 2, p. 79–86.
12. Geraets, DT., Cuschieri, K., de Koning, MN., et al. Clinical evaluation of a GP5+/6+-based luminex assay having full high-risk human papillomavirus genotyping capability and an internal control. J Clin Microbiol, 2014, 52, p. 3996–4002.
13. Gok, M., Heideman, DA., van Kemenade, FJ., et al. HPV testing on self collected cervicovaginal lavage specimens as screening method for women who do not attend cervical screening: cohort study. BMJ, 2010, 340, p. c1040.
14. Gok, M., van Kemenade, FJ., Heideman, DA., et al. Experience with high-risk human papillomavirus testing on vaginal brush-based self-samples of non-attendees of the cervical screening program. Int J Cancer, 2012, 130, p. 1128–1135.
15. http: and globocan.iarc.fr/. 18-5-0015. (GENERIC). Ref Type: Report.
16. Majek, O., Dvorak, V., Dusek, L., et al. Cervarix.cz – Program cervikálního screeningu v České republice. Int J Lab Hematol, 6-5-2015. (GENERIC). Ref Type: Online Source.
17. Munoz, N., Bosch, FX., Castellsagué, X., et al. Against which human papillomavirus types shall we vaccinate and screen? The international perspective. Int J Cancer, 2004, 111, p. 278–285.
18. Petignat, P., Faltin, DL., Bruchim, I., et al. Are self-collected samples comparable to physician-collected cervical specimens for human papillomavirus DNA testing? A systematic review and meta-analysis. Gynecol Oncol, 2007, 105, p. 530–535.
19. Peto, J., Gilham, C., Fletcher, O., Matthews, FE. The cervical cancer epidemic that screening has prevented in the UK. Lancet, 2004, 364, p. 249–256.
20. Preisler, S., Rebolj, M., Untermann, A., et al. Prevalence of human papillomavirus in 5,072 consecutive cervical SurePath samples evaluated with the Roche cobas HPV real-time PCR assay. PloS One, 2013, 8, p. e59765.
21. Rijkaart, DC., Berkhof, J., van Kemenade, FJ., et al. Evaluation of 14 triage strategies for HPV DNA-positive women in population-based cervical screening. Int J Cancer, 2012, 130, p. 602–610.
22. Rijkaart, DC., Berkhof, J., Rozendaal, L., et al. Human papillomavirus testing for the detection of high-grade cervical intraepithelial neoplasia and cancer: final results of the POBASCAM randomised controlled trial. Lancet Oncol, 2012, 13, p. 78–88.
23. Ronco, G., Giorgi-Rossi, P., Carozzi, F., et al. Efficacy of human papillomavirus testing for the detection of invasive cervical cancers and cervical intraepithelial neoplasia: a randomised controlled trial. Lancet Oncol, 2010, 11, p. 249–257.
24. Rossi, PG., Marsili, LM., Camilloni, L., et al. The effect of self-sampled HPV testing on participation to cervical cancer screening in Italy: a randomised controlled trial (ISRCTN96071600). Brit J Cancer, 2011, 104, p. 248–254.
25. Snijders, PJ., Verhoef, VM., Arbyn, M., et al. High-risk HPV testing on self-sampled versus clinician-collected specimens: A review on the clinical accuracy and impact on population attendance in cervical cancer screening. Int J Cancer, 2013, 132, p. 2223–2236.
26. Tachezy, R., Smahelova, J., Kaspirkova, J., Salakova, M. Human papillomavirus type-specific prevalence in the cervical cancer screening population of Czech women. PloS One, 2013, 8, p. e79156.
27. van Baars, R., Bosgraaf, RP., ter Harmsel, BW., et al. Dry storage and transport of a cervicovaginal self-sample by use of the evalyn brush, providing reliable human papillomavirus detection combined with comfort for women. J Clin Microbiol, 2012, 50, p. 3937–3943.
28. Walboomers, JM., Jacobs, MV., Manos, MM., et al. Human papillomavirus is a necessary cause of invasive cervical cancer worldwide. J Pathol, 1999, 189, p. 12–19.
Labels
Paediatric gynaecology Gynaecology and obstetrics Reproduction medicine
Article was published inCzech Gynaecology

2015 Issue 6-
All articles in this issue
- Nonavalentní HPV vakcína – nová generace očkování proti HPV
- Spontánní antepartální RhD aloimunizace
- Prognostický význam Pgp, MRP1 a MRP3 u pacientek s karcinomem ovaria
- Cytologicko-energetický princip vyšetřování plodové vody po předčasném předtermínovém odtoku – dosavadní zkušenosti a perspektivy
- Trombofília v tehotenstve
- Spokojenost žen s perinatální péčí v Kraji Vysočina za období říjen 2013 až září 2014
- Pilotní studie pro využití samoodběrové soupravy a molekulární diagnostiky HPV infekce pro skrínink karcinomu děložního čípku
- Hypertyreóza v graviditě, méně častá porucha štítné žlázy komplikující těhotenství – kazuistika
- Těžký ovariální hyperstimulační syndrom – kazuistika
- Farmakologické ukončení gravidity mifepristonem a misoprostolem – zhodnocení úspěšnosti, komplikací a spokojenosti pacientek
- Czech Gynaecology
- Journal archive
- Current issue
- Online only
- About the journal
Most read in this issue- Farmakologické ukončení gravidity mifepristonem a misoprostolem – zhodnocení úspěšnosti, komplikací a spokojenosti pacientek
- Těžký ovariální hyperstimulační syndrom – kazuistika
- Trombofília v tehotenstve
- Hypertyreóza v graviditě, méně častá porucha štítné žlázy komplikující těhotenství – kazuistika
Login#ADS_BOTTOM_SCRIPTS#Forgotten passwordEnter the email address that you registered with. We will send you instructions on how to set a new password.
- Career

