-
Medical journals
- Career
Volba zobrazovací metody v onkogynekologii
Authors: D. Fischerová 1; Andrea Burgetová 2
Authors‘ workplace: Gynekologicko-porodnická klinika 1. LF UK a VFN, Praha, přednosta prof. MUDr. A. Martan, DrSc. 1; Radiologická klinika 1. LF UK a VFN, Praha, přednosta prof. MUDr. J. Daneš, CSc. 2
Published in: Ceska Gynekol 2014; 79(6): 425-435
Overview
Přehledový článek porovnává přínos a limitace dostupných moderních zobrazovacích metod ve stanovení nádorového rozsevu v pánvi, břišní dutině a extraabdominálně v době první diagnózy a recidivy onemocnění. Transvaginální ultrazvuk má srovnatelnou přesnost s magnetickou rezonancí v detekci gynekologických nádorů a ve stanovení jejich šíření v pánvi. Transabdominální ultrazvuk dovede navíc přesně zobrazit intra - a retroperitoneální rozsev v břišní dutině. Ultrazvukové vyšetření v onkogynekologii nevyžaduje přípravu pacientky, lačnění, podání kontrastních látek, nepřináší radiační, časovou nebo finanční zátěž a nemá známé kontraindikace vyšetření. Podmínkou je však zkušenost vyšetřujícího, kvalitní ultrazvukové vybavení a vyhovující akustické podmínky. Proto optimální metodou pro zobrazení břišní dutiny a retroperitonea zůstává v mnoha případech počítačová abdominopelvická tomografie s podáním kontrastní látky. V případě kontraindikace počítačové tomografie je magnetická rezonance vhodnou alternativní metodou pro zobrazení břišní dutiny. V případě podezření na extraabdominální rozsev nádoru je vhodné doplnit počítačovou tomografii hrudníku s podáním kontrastní látky nebo pozitronovou emisní tomografii kombinovanou s počítačovou tomografií. Pozitronová emisní tomografie kombinovaná s počítačovou tomografií detekuje lépe vzdálené metastázy, a je proto metodou volby v případě podezření na recidivu onemocnění, zvláště pokud jsou výsledky konvenčních zobrazovacích metod negativní anebo pokud plánujeme chirurgické odstranění recidivujícího nádoru.
Klíčová slova:
ultrazvuk, staging, počítačová tomografie, magnetická rezonance, pozitronová emisní tomografie, onkogynekologieÚVOD
V současné době jsou moderní zobrazovací metody neodmyslitelnou součástí diagnostiky a plánování onkologické péče. Srovnání výhod a nevýhod moderních zobrazovacích metod je uvedeno v tabulce 1 [13].
Table 1. Srovnání jednotlivých zobrazovacích metod v onkogynekologii 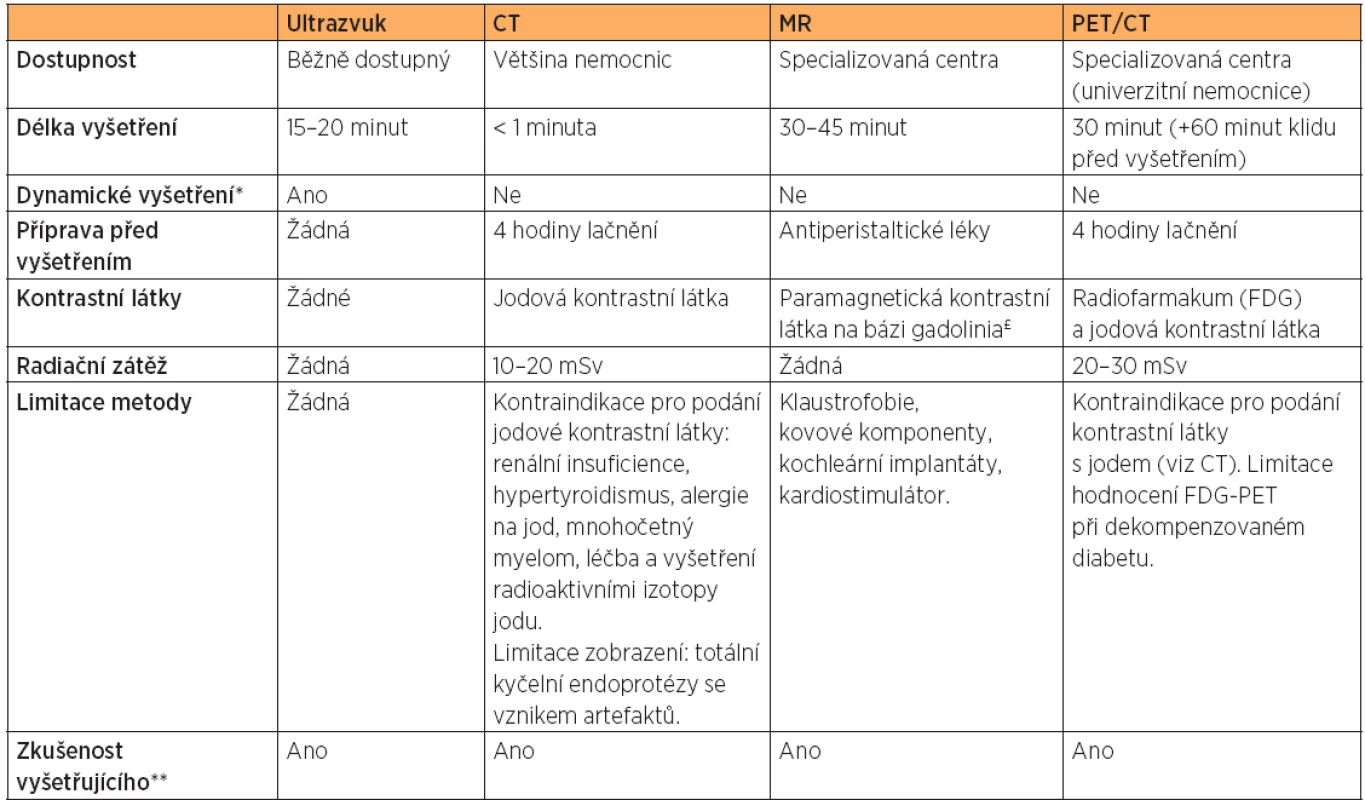
* Ultrazvuk umožní dynamické vyšetření se zhodnocením bolestivosti během vyšetření, sonopalpaci jednotlivých struktur a hodnocení jejich posunlivosti či naopak fixaci (tzv. klouzavý efekt)[33]. ** Výsledek vyšetření závisí nejen na zkušenosti vyšetřujícího, ale také na na úzké spoluprácí s onkogynekologickým centrem se znalostí požadovaných informací, který onkogynekolog/onkochirurg od vyšetření očekává. £ U pacientek s renální insuficiencí musí být přísně zvážen přínos aplikace paramagnetických kontrastních látek na bázi gadolinia, vzhledem k popsanému riziku vzniku nefrogenní systémové fibrózy[13]. CT – počítačová tomografie, MR – magnetická rezonance, PET/CT – pozitronová emisní tomografie s CT, FDG, 18F-fluoro-deoxyglukóza. Ultrazvukové vyšetření (UZ) je založeno na intenzitě zpětně odraženého mechanického podélného vlnění od struktur prostředí, kterými prošlo. Ultrazvukové vyšetření je běžně dostupným vyšetřením v gynekologii, nemá známá rizika či kontraindikace pro pacientku, nevyžaduje speciální přípravu, lačnění nebo aplikaci kontrastních látek. Ultrazvuk lze také využít k navigaci minimálně invazivních diagnostických (biopsie silnou jehlou) nebo léčebných výkonů (zavedení permanentního katétru k punkci ascitu, drenáž lymfocyst aj.) [7, 39, 40]. Cena ultrazvukového vyšetření je mnohonásobně nižší než vyšetření počítačovou tomografií, pozitronovou emisní tomografií nebo magnetickou rezonancí. Technický vývoj v ultrazvuku umožňuje vysoké tkáňové rozlišení a výsledek vyšetření závisí stejně jako u všech zobrazovacích metod na kvalitě vyšetřujícího.
Počítačová tomografie (CT) je založena na rentgenové tomografické technice, kdy detektory zaznamenávají úbytek záření pohlceného tělem pacienta, který leží mezi rengentkou (zdroj záření) a detektorem. CT vyšetření je obecně dostupnější a levnější metodou než magnetická rezonance nebo pozitronová emisní tomografie kombinovaná s počítačovou tomografií. Velkou předností je krátký čas skenování velkého objemu vyšetřované části. Nevýhodou CT proti ultrazvuku nebo magnetické rezonanci je menší tkáňový kontrast spojený s horším rozlišením anatomických změn. Další nevýhodou je nutnost podání intravenózních a perorálních jodových kontrastních látek a lačnění před vyšetřením. Kontrastní látky během CT vyšetření slouží k lepšímu zobrazení anatomických struktur a orgánů či k zobrazení jejich funkce (ledviny). Hodnocení postkontrastních fází (arte-riální, venózní) se využívá například v diferenciální diagnostice fokálních jaterních lézí nebo v detekci solidních komponent anebo papilarit v adnexálních lézích nebo v peritoneálních implantátech. Relativní kontraindikace podání jodové kontrastní látky jsou uvedeny v tabulce 1. Největší nevýhodou je radiační zátěž pacientky, která je poměrně významná. Vyšetření je proto kontraindikováno u těhotných žen a není ani vhodné u dětí a adolescentů. CT vyšetření může, podobně jako ultrazvuk, navigovat cílené biopsie nádoru.
Magnetická rezonance (MR) je založena na změně MR signálu v postižených tkáních. Přidání paramagnetické kontrastní látky umožní rozlišení normální a abnormální tkáně na základě změn relaxačních časů tkání a jejich signální intenzity. V onkogynekologii využíváme nejen morfologické zobrazení nádoru v T1 a T2 vážených obrazech, ale i funkční zobrazení nádoru. K funkčním metodám magnetické rezonance se řadí dynamické postkontrastní vyšetření (dynamic-contrast enhanced, DCE-MRI) a difuzně vážené obrazy (diffusion-weigted imaging, DWI). Dynamické postkontrastní vyšetření umožňuje po intravenózním podání kontrastní látky sledovat v čase kinetiku sycení nádoru a okolních struktur. Difuzně vážené obrazy jsou založeny na rozdílné difuzi molekul vody v nádoru, poskytují informace o buněčnosti nádoru a integritě buněčných membrán. Výhodou MR proti CT je vysoký tkáňový kontrast měkkých tkání. Další výhodou MR je, že pacientku nezatěžuje ionizujícím zářením. Nevýhodou je aplikace kontrastní látky s paramagnetickými vlastnostmi s rizikem nežádoucí reakce (tab. 1). Další limitací je vyšší cena a menší dostupnost vyšetření, zvláště celotělového zobrazení MR. Absolutní kontraindikací je přítomnost implantovaných elektrických a elektromagnetických přístrojů a komponent (cévní svorky, srdeční chlopně, stenty, intravaskulární spirály). Relativní kontraindikací je klaustrofobie. Vyšetření může být hůře tolerováno pro hluk a délku vyšetření.
Pozitronová emisní tomografie kombinovaná s počítačovou tomografií (PET/CT) je založená na kombinaci funkčního a morfologického zobrazení léze. Hybridní PET/CT skenery umožní detekci záření pocházejícího z radiofarmak podaných pacientce (nejčastěji z FDG, 2-[18F]fluoro-2-deoxy-D-glukózy), s možností současné přesné lokalizace ložisek se zvýšenou akumulací radiofarmaka. Limitací je cena a dostupnost vyšetření, nutnost lačnění a kompenzace diabetu, nezbytné intravenózní podání radiofarmaka a jodové kontrastní látky, ionizující záření, klaustrofobie nebo neklid u pacientky, které neumožní pacientce v klidu ležet 30 minut během vyšetření.
VOLBA ZOBRAZOVACÍ METODY V RÁMCI DIAGNOSTIKY A STAGINGU V ONKOGYNEKOLOGII
Zobrazení pánve
Pro zobrazení detailní pánevní anatomie jsou vhodné dvě moderní zobrazovací metody – ultrazvuk a magnetická rezonance.
Ultrazvukové vyšetření s využitím vnitřní (endoluminální) sondy s vysokým rozlišením umožní detailní zobrazení všech pánevních struktur (obr. 1). Ultrazvuková vnitřní sonda může být zavedena transvaginálně nebo transrektálně (obr. 2). Transrektální přístup je preferovaný u nádorů děložního hrdla pro riziko silnějšího krvácení z nádoru při zavedení sondy do pochvy nebo při nemožnosti provedení transvaginálního vyšetření (virgo pacientka, stenóza pochvy po brachyterapii a jiné). Přesnost ultrazvukového vyšetření v rámci diagnostiky a stanovení lokálního rozsahu gynekologického nádoru v pánvi je srovnatelná s magnetickou rezonancí (obr. 3) [12]. Jednotlivým nádorům se budou podrobně věnovat následující přehledové články v tomto čísle České gynekologie [9–11].
Image 1. Pánevní anatomie zobrazená během transvaginálního nebo transrektálního vyšetření, včetně detailu stěny močového měchýře a rekta 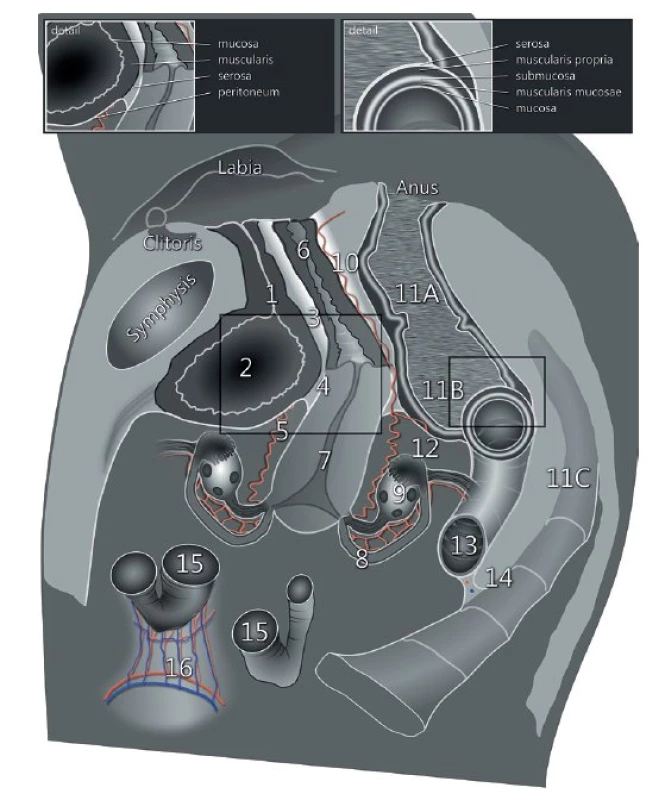
V sagitálním řezu: 1 – uretra, 2 – močový měchýř, 3 – uretro-vaginální prostor, 4 – veziko vaginální prostor, 5 – veziko-uterinní exkavace, 6 – pochva, 7 – děloha, 8 – vejcovod, 9 – ovarium, 10 – rekto-vaginální prostor, 11 – rektum (11A – subperitoneální část, 11B – intraperitoneální část, 11C – mezorektum), 12 – Douglasův prostor [rekto-uterinní exkavace], 13 – sigmoideum, 14 – mezokolon sigmoidea, 15 – tenké střevo [ileum], 16 – mezenterium tenkého střeva (radix mesenterii) Image 2. Ultrazvukové vyšetření pánevní anatomie 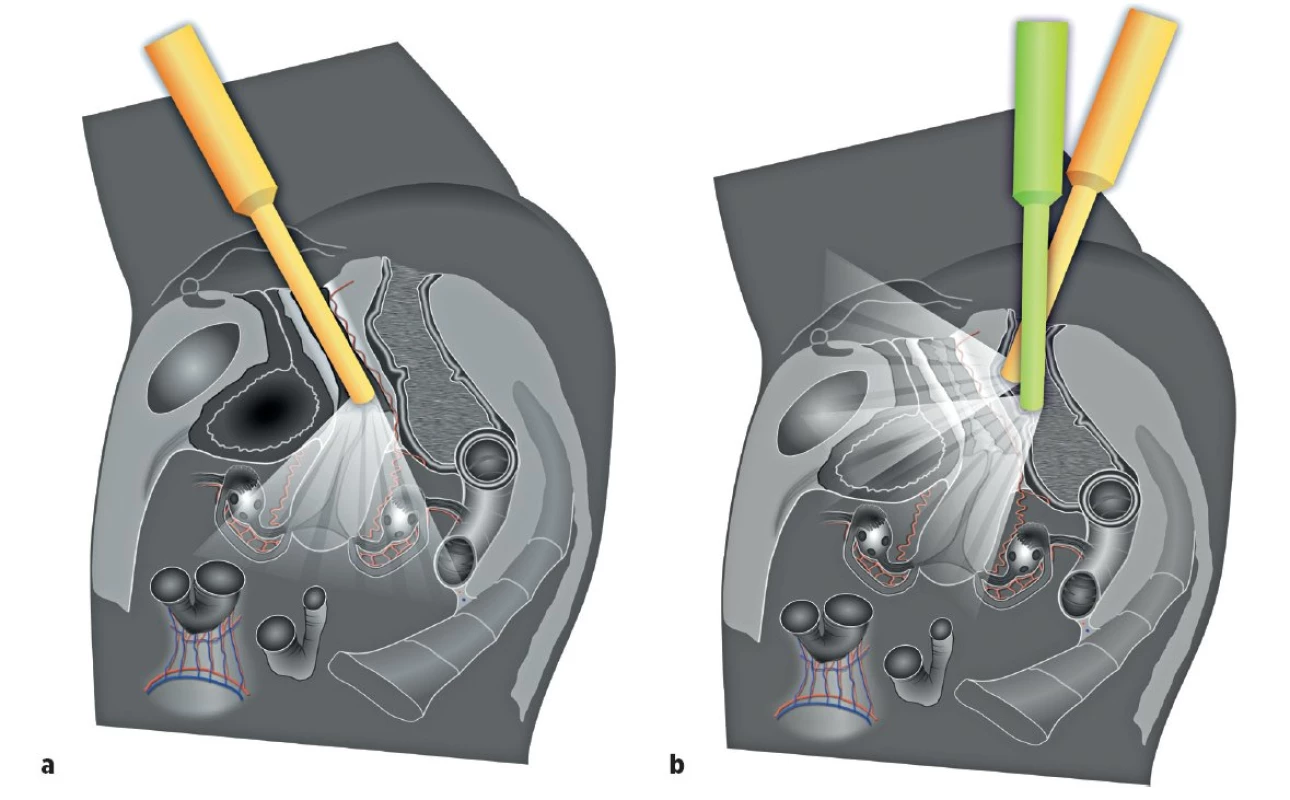
Transvaginálně zavedená endoluminální sonda (a), transrektálně zavedená endoluminální sonda (b) Image 3. Multilokulární-solidní ovariální karcinom infiltrující svalovou vrstvu (muscularis propria) sigmoidea 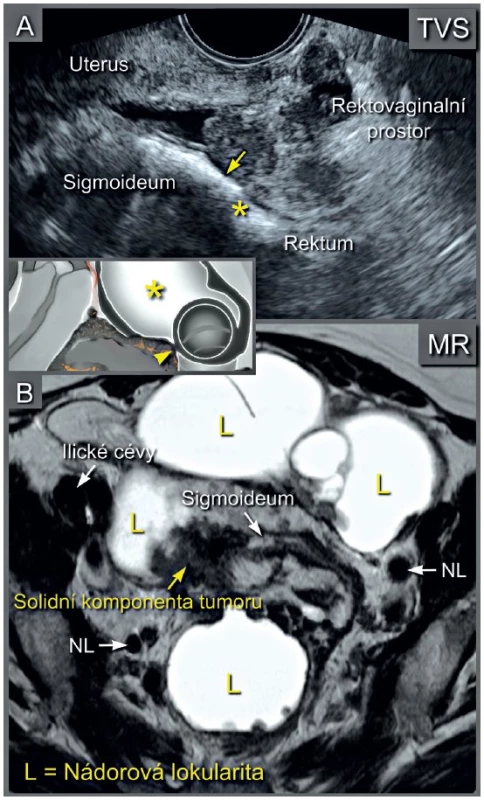
Transvaginální ultrazvukové vyšetření v sagitálním řezu s korespondujícím schematickým zobrazením nádorové infiltrace do hypoechogenní svalové vrstvy střeva (žlutá šipka) (a). Hvězdička odpovídá plynu ve střevě. Magnetická rezonance v axiálním řezu zobrazuje solidní složku nádoru vrůstající do stěny sigmoidea (b). MR pánve není běžně dostupným vyšetřením a má známé kontraindikace pro pacientku (tab. 1) [13]. Vzhledem k jejímu vysokému tkáňovému rozlišení v pánvi zůstává vhodnou metodou pro obtížné případy (například pro stanovení operability nádoru, který prorůstá do pánevní stěny, svalů pánevního dna, cévních struktur a pánevního kostěného kruhu).
Zobrazení rozsahu nádoru v břišní dutině
Ultrazvukové transabdominální vyšetření s využitím konvexní a lineární ultrazvukové sondy umožní zobrazení: (1) břišních parenchymatózních orgánů, (2) parietálního, viscerálního a mezenteriálního peritonea včetně omenta, (3) tříselných, retroperitoneálních a viscerálních uzlin (obr. 4). Navíc je možné zobrazit periferní uzliny v oblasti supraklavikulární anebo axilární, které mohou být postiženy v případě šíření nádoru, zvláště z ovaria nebo děložního hrdla (obr. 5). Transabdominální sonografie umožní přesně stanovit rozsah onemocnění v břišní dutině, pokud je provedena erudovaným sonografistou a jsou dostatečné akustické podmínky (obr. 6) [34].
Image 4. Postup u transabdominálního ultrazvuku 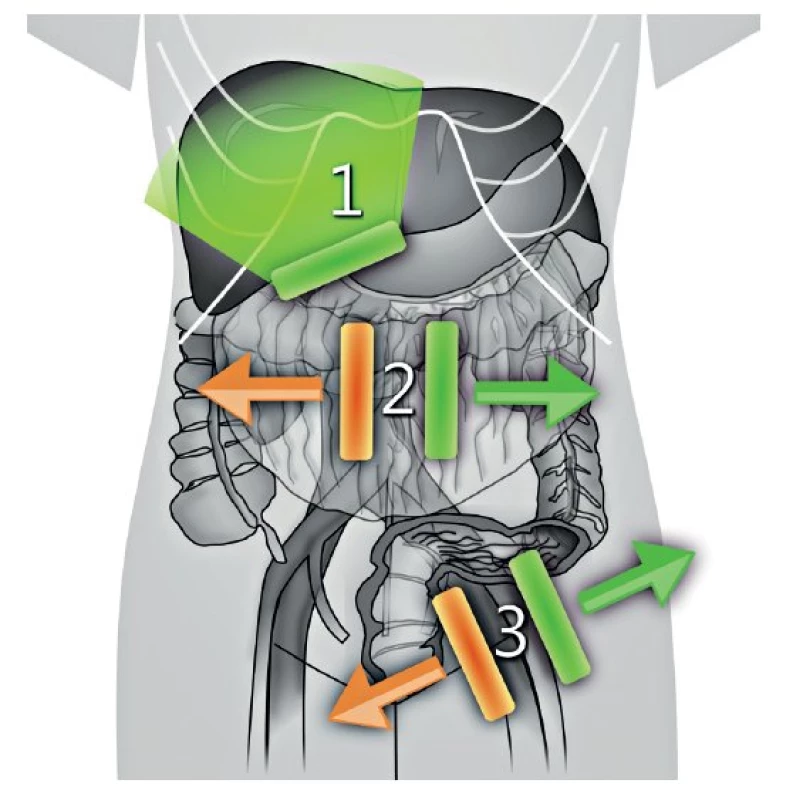
1 – zobrazení parenchymatózních orgánů, 2 – zobrazení peritoneálních povrchů včetně omenta, 3 – detekce tříselné, retroperitoneální a viscerální lymfadenopatie Image 5. Metastatické postižení supraklavikulárních (skalenových) uzlin 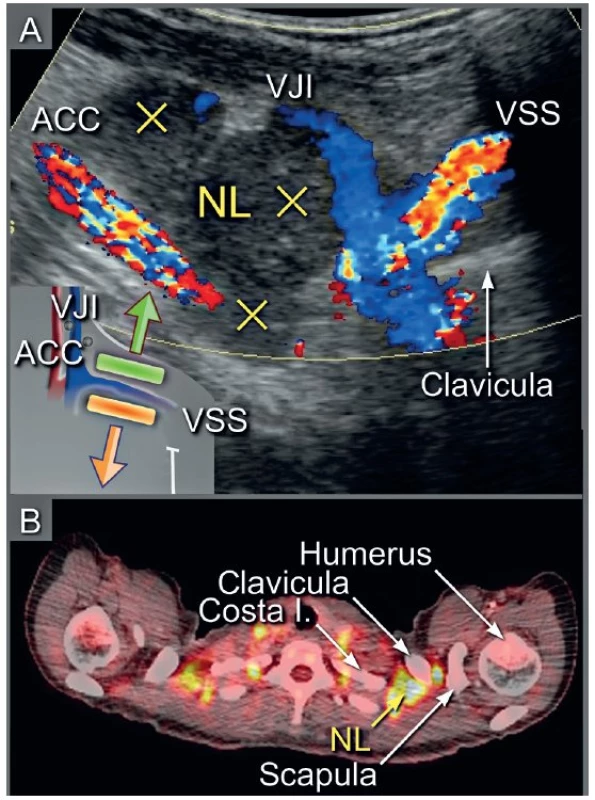
Ultrazvuk v šikmém řezu s odpovídajícím schematickým zobrazením (a), PET/CT v axiální rovině (b). Křížky jsou označeny infiltrované uzliny nad klíční kostí. NL – nodi lymphatici, ACC – arteria carotis communis, VJI – vena jugularis interna, VSS – vena subclavia sinistra. Image 6. Metastatické postižení abdominálních retroperitoneálních uzlin 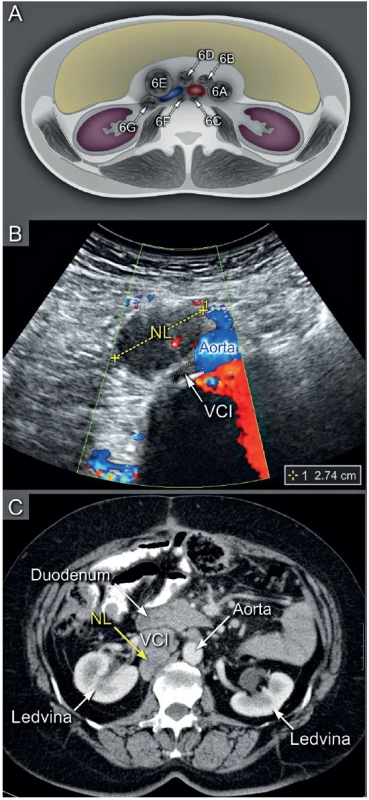
Schéma zobrazuje popis uložení uzlin kolem aorty a dolní duté žíly (6A – paraortálně, 6B – preaortálně, 6C – retroaortálně, 6D – interaortokaválně, 6E – prekaválně, 6F – retrokaválně, 6G – parakaválně) (a). Transabdominální ultrazvuk v příčném řezu s nálezem prekavální infiltrované lymfatické uzliny (b). Počítačová tomografie v axiálním řezu demonstruje retrokavální infiltrovanou uzlinu uloženou kraniálněji (c). VCI – vena cava inferior. CT pánve a břicha s podáním kontrastní látky je vhodnou alternativou pro zobrazení nádorového rozsevu, pokud není dostatečná ultrazvuková erudice, není vyhovující kvalita ultrazvukového přístroje a jeho vybavení a/nebo nejsou vhodné akustické podmínky (obézní pacientka, stav po opakovaných laparotomiích s těžkými adhezivními změnami apod.). Srovnatelné rozlišení trans-abdominální sonografie a CT s podáním kontrastní látky je demonstrováno v obr. 6 a obr. 7. CT vyšetření přináší pacientce rizika spojená s radiační zátěží a podáním kontrastní látky (tab. 1). Pokud je CT vyšetření kontraindikováno, pak je možné využít magnetickou rezonanci s podobnou přesností v zobrazení vnitřních orgánů, peritonea a lymfatických uzlin [14, 32, 36].
Image 7. Nádorové nodularity v mezenteriu tenkého střeva 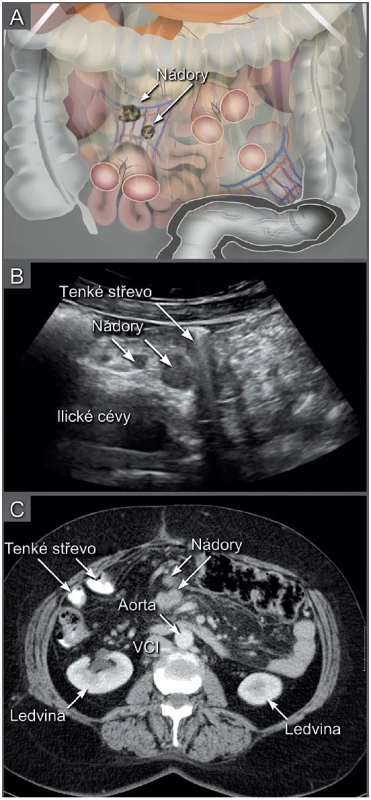
Schematické zobrazení uložení nádorových nodularit (a). Transabdominální ultrazvuk v šikmém řezu zobrazuje nádorové nodularity v mezenteriu, které mohou být identifikovány ultrazvukem při sledování vstupu mezenteriálních cév do radixu mezenteria (b). Počítačová tomografie s podáním kontrastní látky v axiálním řezu u identické pacientky (c). VCI – vena cava inferior. PET/CT zobrazí akumulaci radiofarmaka v nádoru a jeho metastatických ložiscích v celotělovém PET obraze a současně umožní popsat jejich anatomický korelát v CT obraze [13]. Nyní jsou publikovány dvě reprezentativní práce (Dauwenová a kol., Hynninová a kol.), které byly provedeny v onkogynekologických centrech s vysokou operační erudicí [6, 20]. Tyto studie porovnávaly přesnost CT a PET/CT s histologickým nálezem u pacientek s ovariálním karcinomem [6, 20]. Vzhledem k provedení systematického stagingu s odběrem biopsií ze standardních lokalizací během operace [2], byly histologicky zachyceny i mikroskopické metastázy. Proto srovnání přesnosti zobrazovacích metod s provedeným operačním stagingem v obou pracích vedlo k horším výsledkům zobrazovacích metod ve stagingu ve srovnání se staršími pracemi z této oblasti. Stanovení stadia onemocnění podle PET/CT a CT bylo správné pouze v polovině případů (přesnost 55 % vs. 57 %, PET/CT vs. CT) [6, 20]. Obě metody zachytily jen 50 % infiltrovaných retroperitoneálních uzlin (senzitivita 50 % vs. 42–47 %, PET/CT vs. CT) a podobné výsledky byly získány v detekci peritoneálního rozsevu v břišní dutině (senzitivita 51 % vs. 41 %, PET/CT vs. CT) [6, 20]. Tyto výsledky podporují jednoznačný význam chirurgického stagingu v onkogynekologii s cílem stanovit stadium onemocnění a získat potřebné informace k rozhodnutí o typu následné péče s ohledem na prognostické faktory onemocnění.
Zobrazení rozsahu nádoru extraabdominálně
Podle doporučení FIGO (International Fede-ration of Gynecology and Obstetrics) je rentgenové vyšetření hrudníku dostatečným vyšetřením pro zobrazení možného metastatického rozsevu v plicích a na pleuře v případech, kdy není podezření na extraabdominální šíření nádoru [2]. Podezření na extraabdominální šíření je například při nálezu suprarenální lymfadenopatie, fluidotoraxu a/nebo v přítomnosti ascitu se současnou brániční karcinomatózou. Studie s využitím moderních zobrazovacích metod ve stagingu pokročilého ovariálního karcinomu doložily častější výskyt nádorově infiltrovaných supradiafragmatických uzlin, než se předpokládalo, a to zvláště u pacientek s brániční karcinomatózou doprovázenou velkým množstvím ascitu [1, 6, 19]. Nádorové buňky se šířily lymfatickým systémem přes bránici do kardiofrenických a následně do parasternálních uzlin [19].
CT hrudníku s podáním kontrastní látky, pokud je provedeno a hodnoceno zkušeným radiologem v oboru onkogynekologie, může mít podobnou přesnost jako PET/CT v detekci extra-abdominálních metastáz [6].
PET/CT ve srovnání se samotným provedením CT má doložený přínos v detekci vzdálených metastáz a v případě nejistého nálezu v oblasti lymfatických uzlin (infra - a supradiafragmatických) [22, 28, 37, 38]. Odlišné výsledky přinesly již zmíněné studie Dauwenové a kol. a Hynninenové a kol., které popsaly podobné výsledky PET/CT a CT v hodnocení retroperitonea, viz výše [6, 20]. Studie Dauwenové a kol. neprokázala ani přínos PET/CT ve srovnání s CT v hodnocení extraabdominálního rozsevu, zvláště v detekci infiltrovaných supradiafragmatických uzlin [6]. V této studii byly obě metody stejně senzitivní (67 %). Histologická verifikace suspektních supradiafragmatických uzlin byla možná u čtyř z devíti pacientek, u těchto čtyř pacientek bylo nádorové postižení histologicky potvrzeno. Hynninenová a kol. popsali vyšší přesnost PET/CT v záchytu supradiafragmatických uzlin (senzitivita PET/CT vs. CT, 67 % vs. 33 %) [19]. V této studii bylo možné pouze u 4 ze 30 pacientek suspektní supradiafragmatické metastázy histologicky ověřit, což bylo významnou limitací studie (v celkem čtyřech provedených biopsiích bylo potvrzeno nádorové postižení) [19]. Tyto studie demonstrují, že zatím není jednoznačně doložena a definována role PET/CT ve stagingu. CT vyšetření s podáním kontrastní látky zůstává standardním vyšetřením pro stanovení rozsahu onemocnění (stagingu) v onkogynekologii [4, 5, 15, 23, 25].
Celotělová MR je slibnou metodou ve stanovení rozsahu pokročilého nádorového onemocnění v pánvi, břišní dutině a extraabdominálně. Vyžaduje však možnost celotělového zobrazení, které není běžné dostupné, a kombinaci morfologického zobrazení nádorových lézí v T1 a T2 vážených obrazech a funkčního zobrazení. Podle recentní studie Michielsenové a kol., ve které autoři kombinovali morfologické a funkční vyšetření s difuzně váženými obrazy v rámci celotělové magnetické rezonance u zhoubného nádoru ovarií, byly výsledky magnetické rezonance srovnatelné s PET/CT při stanovení retroperitoneální lymfadenopatie a vzdálených metastáz. Magnetická rezonance byla signifikantně lepší v detekci peritoneálního rozsevu než PET/CT (p < 0,00001). Magnetická rezonance dosáhla 91% senzitivity a 91% přesnosti v záchytu peritoneálních metastáz [24]. Magnetická rezonance lépe zachytila viscerální karcinomatózu na močovém měchýři, parietální karcinomatózu na pánevních stěnách a v Douglasově prostoru, viscerální a mezenteriální karcinomatózu na tenkém a tlustém střevě (obr. 8) [24]. Tyto slibné výsledky souvisely s vysokým tkáňovým rozlišením magnetické rezonance na přístroji 3T (Tesla), který umožnil přesnější rozlišení v pánvi. Výhodou bylo také využití přirozeného kontrastu patologických lézí na základě difuzně vážených obrazů s koeficientem difuze 1000 (b1000) v kombinaci s postkontrastními obrazy a s možností potlačení tuku pro odlišení karcinomatózy na střevním povrchu. Důležitá byla také perorální příprava střev před vyšetřením a intravenózní aplikace spazmolytika (butylskopolaminium-bromid, Buscopan) ke snížení střevní peristaltiky.
Image 8. Pokročilý ovariální karcinom s nádorovým rozsevem po břišním peritoneu 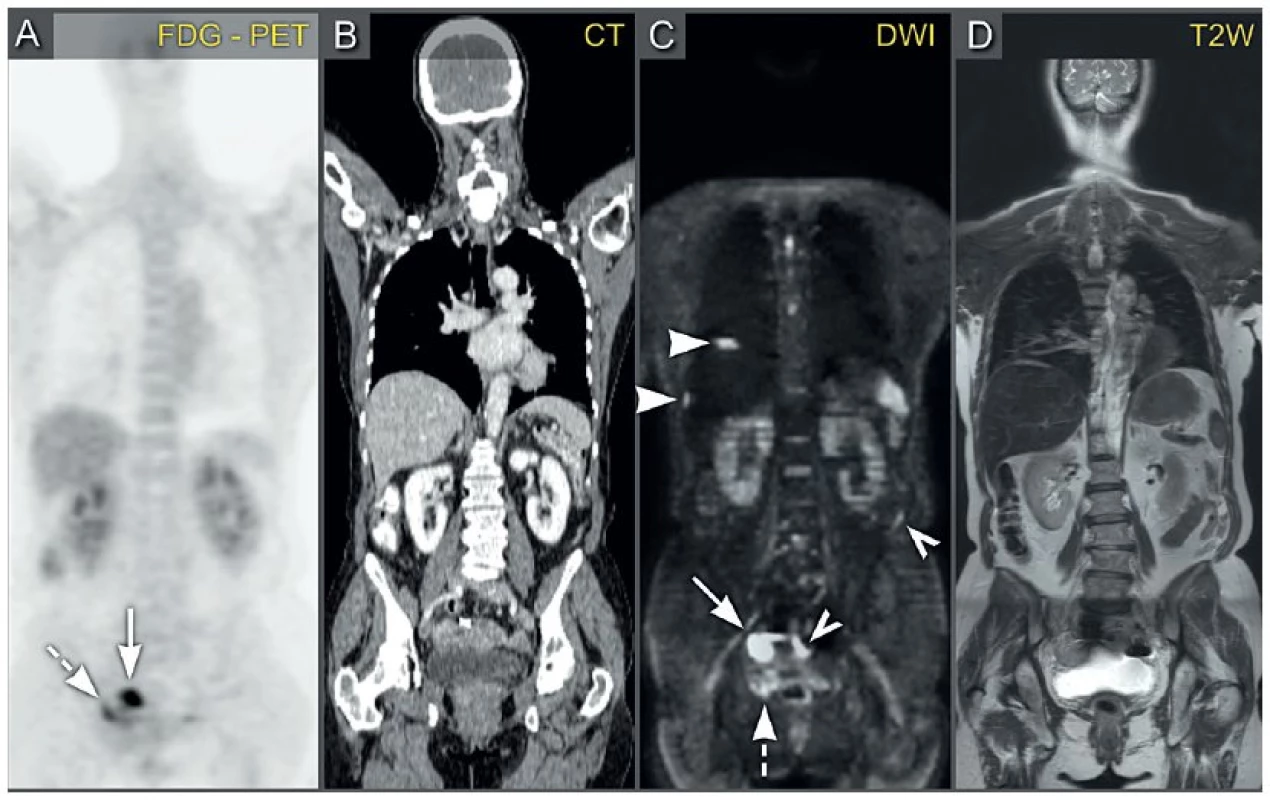
Pozitronová emisní tomografie (a) kombinovaná s počítačovou tomografií s podáním kontrastní látky (b) zobrazuje hypermetabolické ložisko v pravém ovariu (plná šipka) a hypermetabolické ložisko na peritoneu vpravo na močovém měchýři (čerchovaná šipka). Celotělová magnetická rezonance s difuzně váženými obrazy (c) a s T2 váženými obrazy (d) potvrzuje přítomnost restrikce difuze v pravém ovariu (plná šipka) a peritoneální implantační metastázu na pravé straně močového měchýře (čerchovaná šipka). Navíc, DWI ve srovnání s PET/CT zachytil peritoneální implantáty uložené perihepatálně (hroty šipek) a viscerálně na seróze laterální stěny sestupného tračníku a sigmoidea (obrysy šipek). Obrazová dokumentace byla laskavě poskytnuta prof. V. Vandecaveyem, PhD. z Radiologické kliniky, Univerzitní Nemocnice Leuven, Belgie. FDG-PET – pozitronová emisní tomografie s podáním [18F]fluoro-2-deoxy-D-glukózy, CT – počítačová tomografie, DWI – magnetická rezonance s difúzně váženými obrazy, T2W – magnetická rezonance s T2 váženými obrazy. VYUŽÍTÍ ZOBRAZOVACÍCH METOD V RÁMCI SLEDOVÁNÍ PACIENTKY PO UKONČENÉ ONKOLOGICKÉ LÉČBĚ
Sledování onkogynekologických pacientek po ukončené léčbě je založeno na pravidelných gynekologických kontrolách, které slouží nejen k detekci recidivy onemocnění, ale také ke sledování a léčbě nežádoucích účinků onkologické léčby. Zobrazovací metody jsou obvykle indikovány až v případě podezření na přítomnost recidivujícího onemocnění.
Ultrazvukové vyšetření je nejdůležitější vstupní zobrazovací metodou [12]. Ultrazvuk je metodou volby pro sledování pacientek ve vysokém riziku recidivy, zvláště po léčbě zachovávající fertilitu [27].
CT pánve, břicha a plic s podáním kontrastní látky zůstává základní restagingovou zobrazovací metodou recidivujícího onemocnění [15].
PET/CT je metodou volby v případech, kdy je podezření na recidivu onemocnění a konvenční zobrazovací metody (nejčastěji ultrazvuk nebo CT) nádor nezobrazily a/nebo v případech, kdy plánujeme záchrannou operaci pro recidivu onemocnění (salvage surgery) [15, 26]. Na základě kombinace funkčního a morfologického zobrazení zachytí PET/CT více nádorových ložisek, a tím přesněji odliší lokalizovanou a generalizovanou recidivu a optimalizuje výběr kandidátek k cytoredukční operaci [3, 17, 29, 35]. Navíc funkční zobrazení lépe posoudí, zda se nejedná pouze o změny způsobné předchozí léčbou, kdy jizevnatá tkáň, tuková nekróza, reaktivní zvětšení uzlin a jiné pooperační změny méně akumulují FDG ve srovnání s viabilní nádorovou tkání. Tím se dále snižuje počet neadekvátních operací pro recidivu onemocnění. Pokud PET/CT vyšetření navázalo na konvenční zobrazení (ultrazvuk, CT, MR), došlo ke změně léčebného managementu u pacientky s recidivujícím onemocněním až v 60 % [16, 30]. Na druhou stranu by PET/CT mělo být indikováno, pouze pokud jeho výsledek ovlivní léčebný postup.
MR v rámci diagnostiky recidivujícího onemocnění využíváme méně často. Většinou využíváme MR pánve v případech posouzení operability u lokálně pokročilé recidivy onemocnění se šířením do pánevní stěny, kostí, svalů, cév. Navíc kombinace T1 a T2 vážených obrazů s funkčním zobrazením (dynamické post-kontrastní vyšetření a difuzně vážené obrazy) umožní, podobně jako PET/CT, lépe odlišit pozánětlivé a pooperační změny od časné recidivy [12].
VYUŽÍTÍ ZOBRAZOVACÍCH METOD V NAVIGACI CÍLENÉ BIOPSIE
Zobrazovací metody (ultrazvuk a CT) umožní spolehlivou navigaci bioptického výkonu a získání histologické diagnózy nádoru minimálně invazivní cestou. Metoda se využívá zvláště u primárně in-operabilních ovariálních nádorů, při podezření na nádorový rozsev na podkladě non-gynekologického nádoru (např. nádory žaludku, pankreatu nebo prsu mohou napodobovat svým rozsevem primární pokročilý ovariální karcinom) anebopři nejistotě o recidivě nádorového onemocnění u pacientky. Také pacientky s anamnézou vícečetného nádorového onemocnění profitují z biopsie, která umožní spolehlivě odlišit typ recidivujícího nádoru [7, 8, 40].
Biopsie silnou jehlou pod ultrazvukovou kontrolou může být provedena transvaginálně, transrektálně a/nebo transabdominálně (obr. 9). Výkon je možné provést v jednom sezení po ukončení stagingového ultrazvukového vyšetření. Výkon nevyžaduje speciální přípravu pacientky ani lačnění, před výkonem je nutné pouze vyloučit vyšší riziko krvácení. Výkon je proveden, pokud je hladina trombocytů > 10 × 109/l a INR (international normalised ratio) < 1,4. Odběr biopsie se provádí ambulantně a bez nutnosti celkové anestezie. Výsledek biopsie je ve většině případů dostupný do 48 hodin po výkonu. Tento postup umožní získat v 95 % případů adekvátní (reprezentativní) vzorek pro histologické zpracování. Histologické vyšetření z biopsie silnou jehlou je přesné v 98 % případů. Riziko komplikací (krvácení z bioptované léze s operační revizí) je méně než 1 % [7, 39].
Image 9. Biopsie silnou jehlou navigovaná ultrazvukem 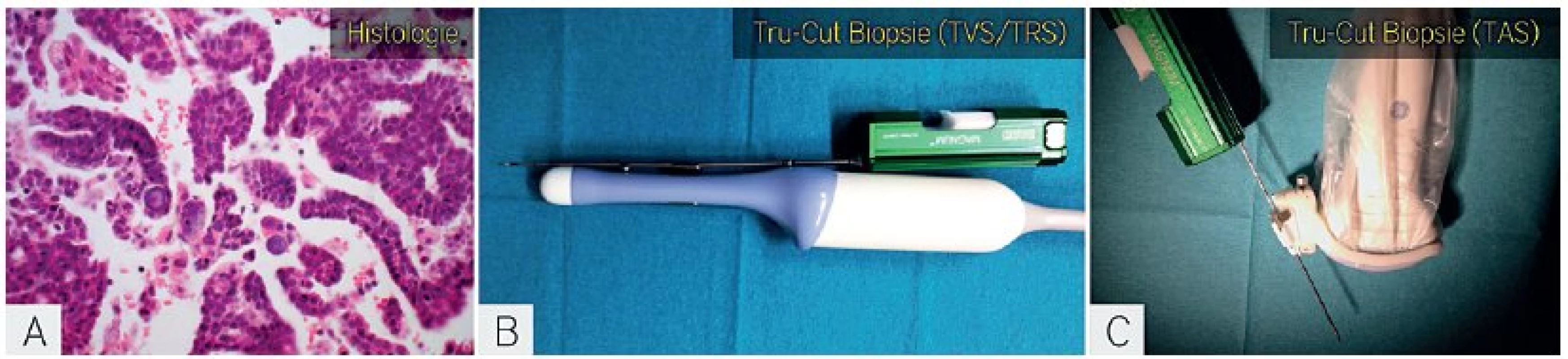
Histologický vzorek z biopsie silnou jehlou (a). Odběr biopsie transvaginálním přístupem, kdy je zavaděč jehly o průměru 14 až 18 G upevněn na endovaginální sondu (b). Odběr biopsie transabdominálním přístupem, kdy je zavaděč jehly upevněn na abdominální konvexní sondu. Endovaginální i abdominální sonda jsou sterilně kryty a jehla je vložena do automatického bioptického zařízení s možností nastavení hloubky biopsie. G-gauge. CT navigace biopsie nádoru přináší rizika spojená s CT vyšetřením, včetně nutné přípravy pacientky (orální jodová kontrastní látka, lačnění) [31]. Proto CT vyšetření k navigaci biopsie silnou jehlou využíváme pouze v případě nepříznivě uložených ložisek (obr. 10).
Image 10. Biopsie silnou jehlou navigovaná počítačovou tomografií 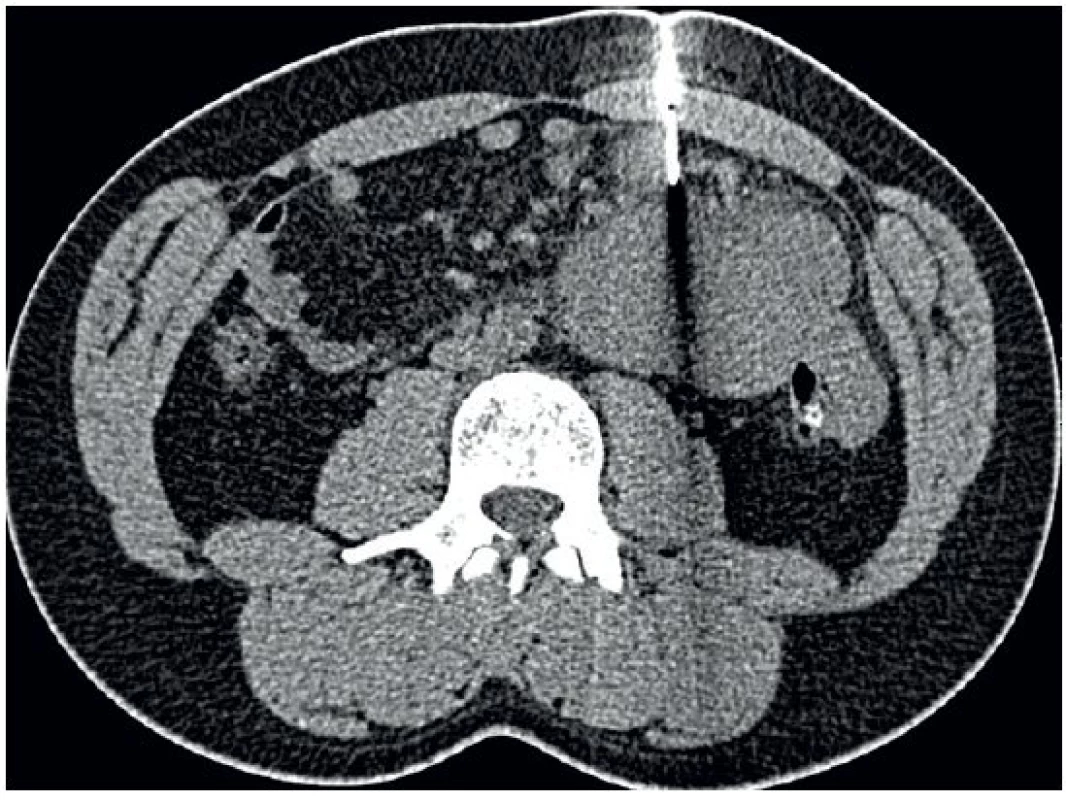
Biopsie silnou jehlou z objemné masy v mezenteriu ve středním až levém mezogastriu. VÝHLED DO BUDOUCNA
Slibnou metodou pro zobrazení pánve a celotělový staging se do budoucnosti jeví integrované PET/MR vyšetření (PET/MR). Při synchronním sběru dat využívá kombinované PET/MR vyšetření výhod obou modalit. V případě MR je to vysoký kontrast a vysoké tkáňové rozlišení pro identifikaci strukturálních změn a možnost funkčního vyšetření (DCE-MRI, DWI), PET umožňuje stanovení glykolytické (metabolické) aktivity tumoru po podání FDG a detekci vzdálených metastáz. V porovnání s PET/CT je výhodou, že je metoda zatížena až o 70 % menší radiační dávkou, což je dáno eliminací komponenty CT. Navíc MR poskytuje více biologických a funkčních informací než CT. Kombinovaná PET/MR má již za sebou období experimentálního užití a začíná se uplatňovat v klinické praxi. Limitací jsou v současné době vysoké náklady na pořízení přístroje, a tedy omezená dostupnost a cena vyšetření. Dále jsou to kontraindikace uvedené u jednotlivých metod (MR a PET).
Uplatnění integrované PET/MR se nabízí u maligních tumorů hrdla (namísto PET/CT a diagnostické MR). Další vhodnou indikací pro PET/MR vyšetření je restaging u pacientek s recidivou onemocnění. Recentně byla publikována práce, která doložila velký diagnostický přínos celotělového PET/MR vyšetření u pacientek s podezřením na recidivu gynekologické malignity [18]. Studie srovnávala přesnost kombinované PET/MR a samotné celotělové MR s operačním nálezem u 34 pacientek (16 s ovariálním karcinomem a 18 s cervikálním karcinomem). PET/MR identifikovala 98,9 %, zatímco samotná celotělová MR 88,8 % maligních lézí. Navíc PET/MR umožnila lepší kontrast maligních lézí, čímž signifikantně zvýšila diagnostickou spolehlivost vyšetření ve srovnání s celotělovou MR (p < 0,001).
Je pravděpodobné, že s implementací této kombinované metody do klinické praxe se postupně budou měnit i diagnostické protokoly v onkogynekologickém zobrazení.
SHRNUTÍ PRO VOLBU VHODNÉ ZOBRAZOVACÍ METODY V ONKOGYNEKOLOGII
V současné době umožní kombinace transvaginálního a transabdominálního ultrazvuku přesné stanovení přítomnosti nádorového onemocnění v děložním hrdle, těle a ovariích a umožní spolehlivé zobrazení rozsahu onemocnění v pánvi a břišní dutině. Podmínkou je zkušený sonografista se znalostí problematiky onkogynekologie. Počítačová tomografie břicha s podáním kontrastní látky zůstává metodou volby pro stanovení stagingu zhoubného nádoru v břišní dutině, zvláště pokud jsou přítomny limitace transabdominální sonografie. V případě podezření na extraabdominální šíření nádoru je možné využít CT hrudníku nebo PET/CT. Magnetickou rezonanci využíváme v onkogynekologii v obtížných případech. V rámci diagnostiky gynekologických nádorů je indikována magnetická rezonance výjimečně, a to v případě sonograficky obtížně zobrazitelných primárních nádorů. Ve stagingu gynekologických nádorů je magnetická rezonance pánve doplněna v případě lokálně pokročilých nádorů se šířením do pánevní stěny a magnetická rezonance břicha je indikována, pokud je kontraindikováno CT vyšetření.
Při podezření na recidivu onemocnění zůstává základní vstupní zobrazovací metodou ultrazvukové vyšetření pánve a břišní dutiny. CT vyšetření hrudníku, břicha a pánve s podáním kontrastní látky je vhodnou restagingovou metodou v případě recidivujícího onemocnění [15, 25]. PET/CT je metodou volby, pokud je podezření na recidivu onemocnění a výsledek ultrazvukového vyšetření nebo CT vyšetření je negativní a/nebo pokud plánujeme operační řešení recidivy. MR využíváme v rámci stanovení recidivy onemocnění ve stejné indikaci jako ve stagingu (tab. 2). Do budoucna se slibnou metodou jeví kombinované PET/MR vyšetření.
Table 2. Indikace zobrazovací metody v onkogynekologii 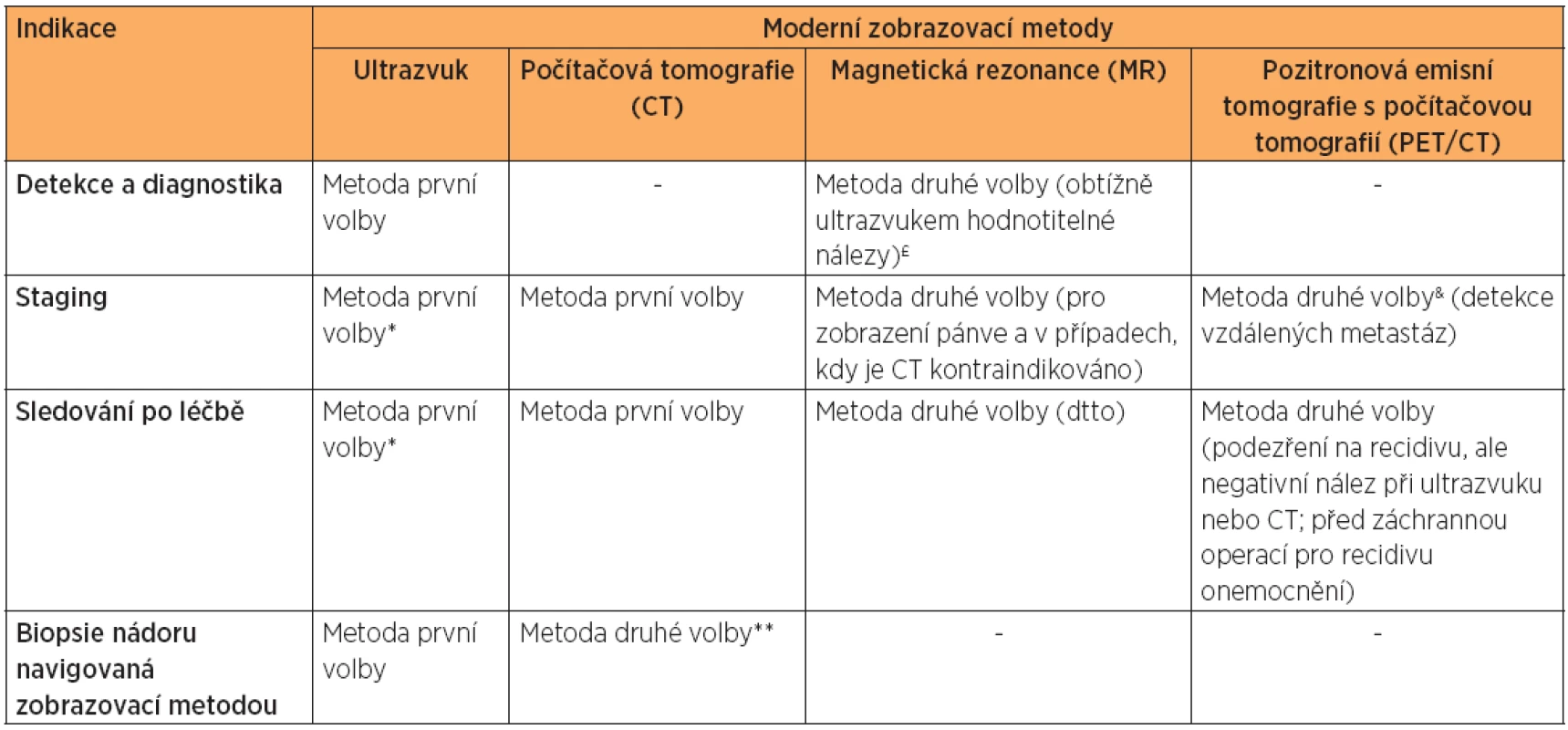
* Ultrazvuk je metoda volby ve stagingu a sledování onkologické pacientky po ukončené léčbě, pokud je přítomen erudovaný sonografista a vyhovující akustické podmínky. Je metodou volby pro sledování pacientek po operaci se zachováním fertility. ** Ultrazvukem navigovaná biopsie nádoru nebo jeho metastáz je lépe tolerovaná pacientkou [7]. Biopsie nádoru pod CT kontrolou je indikovaná v případech hůře dostupných nádorových lézí v břišní dutině [31]. £ MR zvyšuje specificitu hodnocení nádorové ovariální léze [21]. Pokud je ovariální léze hodnocena zkušeným sonografistou, žádná data nedoložila přínos dodatečného MR vyšetření. & PET/CT je indikováno, pokud je suspekce na generalizované onemocnění s extraabdominálním šířením nebo v případě nejistého nálezu při hodnocení lymfatických uzlin. Jeho výhody ve srovnání s vyšetřením CT s kontrastní látkou však nejsou dosud jednoznačně doloženy. ZÁVĚR
V centrech, kde pracuje erudovaný sonografista s onkogynekologickým vzděláním, se stal ultrazvuk nenahraditelnou vstupní metodou v diagnostice nádorů děložního hrdla, těla a ovarií a ve stanovení jejich šíření v pánvi a břišní dutině. Další moderní zobrazovací metody jsou voleny komplementárně. Na základě znalosti jejich výhod a limitací je možné vybrat vhodnou metodu s optimálním zobrazením oblasti zájmu, ve které mělo ultrazvukové vyšetření limitace. Komplementární metody jsou indikované pouze v případech, kdy jejich výsledky mohou změnit plánovanou léčebnou strategii. Závěrem je třeba připomenout, že neexistuje žádná zobrazovací metoda, která je schopna svojí přesností nahradit systematický chirurgický staging.
Práce byla podpořena Univerzitou Karlovou v Praze (projekt UNCE 204024 a PRVOUK-P27/LF1/1), grantem Ministerstva zdravotnictví RVO-VFN64165 a grantem Interní grantové agentury Ministerstva zdravotnictví NT 13070.
MUDr. Daniela Fischerová, Ph.D.
Onkogynekologické centrum
Gynekologicko-porodnická klinika
VFN a 1. LF UK
Apolinářská 18
128 51 Praha 2
e-mail: daniela.fischerova@seznam.cz
Sources
1. Bats, AS., Hugonnet, F., Huchon, C., et al. Prognostic significance of mediastinal 18F-FDG uptake in PET/CT in advanced ovarian cancer. Eur J Nucl Med Mol Imaging, 2012, 39, 3, p. 474–480.
2. Benedet, JL., Bender, H., Jones, H. 3rd, et al. FIGO staging classifications and clinical practice guidelines in the management of gynecologic cancers. FIGO Committee on Gynecologic Oncology. Int J Gynaecol Obstet, 2000, 70, 2, p. 209–262.
3. Bristow, RE., del Carmen, MG., Pannu, HK., et al. Clinically occult recurrent ovarian cancer: patient selection for secondary cytoreductive surgery using combined PET/CT. Gynecol Oncol, 2003, 90, 3, p. 519–528.
4. Colombo, N., Carinelli, S., Colombo, A., et al. Cervical cancer: ESMO Clinical Practice Guidelines for diagnosis, treatment and follow-up. Ann Oncol, 2012, 23, Suppl. 7, p. vii27–32.
5. Colombo, N., Preti, E., Landoni, F., et al. Endometrial cancer: ESMO Clinical Practice Guidelines for diagnosis, treatment and follow-up. Ann Oncol, 2013, 24, Suppl. 6, p. vi33–38.
6. Dauwen, H., Van Calster, B., Deroose, CM., et al. PET/CT in the staging of patients with a pelvic mass suspicious for ovarian cancer. Gynecol Oncol, 2013, 131, 3, p. 694–700.
7. Fischerova, D., Cibula, D., Dundr, P., et al. Ultrasound-guided tru-cut biopsy in the management of advanced abdomino-pelvic tumors. Int J Gynecol Cancer, 2008, 18, 4, p. 833–837.
8. Fischerova, D., Cibula, D., Zikan, M., et al. [Ultrasound-guided intervention in the treatment of abdomino-pelvic advanced tumors]. Ces Gynek, 2009, 74, 5, p. 329–334.
9. Fischerová, D. Doporučený diagnostický postup u ženy s ovariální cystou nebo nádorem. Čes Gynek, 2014, 79, 6, p. 477–486.
10. Fischerová, D. Zhoubný nádor děložního hrdla (předoperační stanovení rozsahu onemocnění – přehled výsledků nejnovějších ultrazvukových studií). Čes Gynek, 2014, 79, 6 p. 436–446.
11. Fischerova, D. Zhoubný nádor děložního těla – předoperační odlišení nádorů s nízkým a vysokým rizikem metastázování (přehled výsledků nejnovějších ultrazvukových studií). Ces Gynek, 2014, 79, 6, p. 456–465.
12. Fischerova, D., Burgetova, A. Imaging techniques for the evaluation of ovarian cancer. Best Pract Res Clin Obstet Gynaecol, 2014, 28, 5, p. 697–720.
13. Fischerová, D., Burgetová, A., Seidl, Z., Bělohlávek, O. Diagnostika. In Cibula, D., Petruželka, L. Onkogynekologie. Praha: Grada Publishing, 2009, s. 101–131.
14. Forstner, R., Hricak, H., Occhipinti, KA., et al. Ovarian cancer: staging with CT and MR imaging. Radiology, 1995, 197, 3, p. 619–626.
15. Forstner, R., Sala, E., Kinkel, K., et al. ESUR guidelines: ovarian cancer staging and follow-up. Eur Radiol, 2010, 20, 12, p. 2773–2780.
16. Fulham, MJ., Carter, J., Baldey, A., et al. The impact of PET-CT in suspected recurrent ovarian cancer: A prospective multi-centre study as part of the Australian PET Data Collection Project. Gynecol Oncol, 2009, 112, 3, p. 462–468.
17. Garcia-Velloso, MJ., Jurado, M., Ceamanos, C., et al. Diagnostic accuracy of FDG PET in the follow-up of platinum-sensitive epithelial ovarian carcinoma. Eur J Nucl Med Mol Imaging, 2007, 34, 9, p. 1396–1405.
18. Grueneisen, J., Beiderwellen, K., Heusch, P., et al. Simultaneous positron emission tomography/magnetic resonance imaging for whole-body staging in patients with recurrent gynecological malignancies of the pelvis: a comparison to whole-body magnetic resonance imaging alone. Invest Radiol, 2014.
19. Hynninen, J., Auranen, A., Carpen, O., et al. FDG PET/CT in staging of advanced epithelial ovarian cancer: frequency of supradiaphragmatic lymph node metastasis challenges the traditional pattern of disease spread. Gynecol Oncol, 2012, 126, 1, p. 64–68.
20. Hynninen, J., Kemppainen, J., Lavonius, M., et al. A prospective comparison of integrated FDG-PET/contrast-enhanced CT and contrast-enhanced CT for pretreatment imaging of advanced epithelial ovarian cancer. Gynecol Oncol, 2013, 131, 2, p. 389–394.
21. Iyer, VR., Lee, SI. MRI, CT, and PET/CT for ovarian cancer detection and adnexal lesion characterization. AJR Am J Roentgenol, 2010, 194, 2, p. 311–321.
22. Kitajima, K., Murakami, K., Yamasaki, E., et al. Diagnostic accuracy of integrated FDG-PET/contrast-enhanced CT in staging ovarian cancer: comparison with enhanced CT. Eur J Nucl Med Mol Imaging, 2008, 35, 10, p. 1912–1920.
23. Ledermann, JA., Raja, FA., Fotopoulou, C., et al. Newly diagnosed and relapsed epithelial ovarian carcinoma: ESMO Clinical Practice Guidelines for diagnosis, treatment and follow-up. Ann Oncol, 2013, 24, Suppl. 6, p. vi24–32.
24. Michielsen, K., Vergote, I., Op de Beeck, K., et al. Whole-body MRI with diffusion-weighted sequence for staging of patients with suspected ovarian cancer: a clinical feasibility study in comparison to CT and FDG-PET/CT. Eur Radiol, 2014, 24, 4, p. 889–901.
25. Mitchell, DG., Javitt, MC., Glanc, P., et al. ACR appropriateness criteria staging and follow-up of ovarian cancer. J Am Coll Radiol, 2013, 10, 11, p. 822–827.
26. Nogami, Y., Iida, M., Banno, K., et al. Application of FDG-PET in cervical cancer and endometrial cancer: utility and future prospects. Anticancer Res, 2014, 34, 2, p. 585–592.
27. Ovarian Cancer. In the National Comprehensive Cancer Network (NCCN) Guidelines, version 3. http://www.nccn.org/pro-fessionals/physician_gls/f_guidelines.asp. 2014.
28. Risum, S., Hogdall, C., Loft, A., et al. The diagnostic value of PET/CT for primary ovarian cancer – a prospective study. Gynecol Oncol, 2007, 105, 1, p. 145–149.
29. Risum, S., Hogdall, C., Markova, E., et al. Influence of 2-(18F) fluoro-2-deoxy-D-glucose positron emission tomography/computed tomography on recurrent ovarian cancer diagnosis and on selection of patients for secondary cytoreductive surgery. Int J Gynecol Cancer, 2009, 19, 4, p. 600–604.
30. Simcock, B., Neesham, D., Quinn, M., et al. The impact of PET/CT in the management of recurrent ovarian cancer. Gynecol Oncol, 2006, 103, 1, p. 271–276.
31. Spencer, JA., Anderson, K., Weston, M., et al. Image guided biopsy in the management of cancer of the ovary. Cancer Imaging, 2006, 6, p. 144–147.
32. Tempany, CM., Zou, KH., Silverman, SG., et al. Staging of advanced ovarian cancer: comparison of imaging modalities – report from the Radiological Diagnostic Oncology Group. Radiology, 2000, 215, 3, p. 761–767.
33. Testa, AC., Van Holsbeke, C., Mascilini, F., Timmerman, D. Dynamic and interactive gynecological ultrasound examination. Ultrasound Obstet Gynecol, 2009, 34, 2, p. 225–229.
34. Testa, AC., Ludovisi, M., Mascilini, F., et al. Ultrasound evaluation of intra-abdominal sites of disease to predict likelihood of suboptimal cytoreduction in advanced ovarian cancer: a prospective study. Ultrasound Obstet Gynecol, 2012, 39, 1, p. 99–105.
35. Thrall, MM., DeLoia, JA., Gallion, H., Avril, N. Clinical use of combined positron emission tomography and computed tomography (FDG-PET/CT) in recurrent ovarian cancer. Gynecol Oncol, 2007, 105, 1, p. 17–22.
36. Woodward, PJ., Hosseinzadeh, K., Saenger, JS. From the archives of the AFIP: radiologic staging of ovarian carcinoma with pathologic correlation. Radiographics, 2004, 24, 1, p. 225–246.
37. Yoshida, Y., Kurokawa, T., Kawahara, K., et al. Incremental benefits of FDG positron emission tomography over CT alone for the preoperative staging of ovarian cancer. AJR Am J Roentgenol, 2004, 182, 1, p. 227–233.
38. Yoshida, Y., Kurokawa, T., Tsujikawa, T., et al. Positron emission tomography in ovarian cancer: 18F-deoxy-glucose and 16alpha-18F-fluoro-17beta-estradiol PET. J Ovarian Res, 2009, 2, 1, p. 7.
39. Zikan, M., Fischerova, D., Pinkavova, I., et al. Ultrasound-guided tru-cut biopsy of abdominal and pelvic tumors in gynecology. Ultrasound Obstet Gynecol, 2010, 36, 6, p. 767–772.
40. Zikan, M., Fischerova, D., Slama, J., et al. [Ultrasound-guided minimally invasive interventions in gynecologic oncology]. Ces Gynek, 2011, 76, 4, p. 257–261.
Labels
Paediatric gynaecology Gynaecology and obstetrics Reproduction medicine
Article was published inCzech Gynaecology

2014 Issue 6-
All articles in this issue
- Staging zhoubného nádoru děložního hrdla (stanovení předoperačního rozsahu onemocnění) – přehled výsledků nejnovějších ultrazvukových studií
- Ultrazvukový staging karcinomu děložního hrdla – návrh standardního postupu
- Zhoubný nádor děložního těla – předoperační odlišení nádorů s nízkým a vysokým rizikem metastázování (přehled výsledků nejnovějších ultrazvukových studií)
- Ultrazvukový staging karcinomu endometria – doporučená metodika vyšetření
- Doporučený diagnostický postup u ženy s ovariální cystou nebo nádorem
- Volba vhodné bioptické metody u primárně inoperabilního nebo recidivujícího zhoubného nádoru a metodika bioptického odběru
- Význam screeningu v onkogynekologii
- Metody bezkrevní péče v gynekologii a onkogynekologii
- Volba zobrazovací metody v onkogynekologii
- Czech Gynaecology
- Journal archive
- Current issue
- Online only
- About the journal
Most read in this issue- Doporučený diagnostický postup u ženy s ovariální cystou nebo nádorem
- Ultrazvukový staging karcinomu endometria – doporučená metodika vyšetření
- Ultrazvukový staging karcinomu děložního hrdla – návrh standardního postupu
- Zhoubný nádor děložního těla – předoperační odlišení nádorů s nízkým a vysokým rizikem metastázování (přehled výsledků nejnovějších ultrazvukových studií)
Login#ADS_BOTTOM_SCRIPTS#Forgotten passwordEnter the email address that you registered with. We will send you instructions on how to set a new password.
- Career

