-
Medical journals
- Career
Staging zhoubného nádoru děložního hrdla (stanovení předoperačního rozsahu onemocnění) – přehled výsledků nejnovějších ultrazvukových studií
Authors: D. Fischerová
Authors‘ workplace: Gynekologicko-porodnická klinika 1. LF UK a VFN, Praha, přednosta prof. MUDr. A. Martan, DrSc.
Published in: Ceska Gynekol 2014; 79(6): 436-446
Overview
Pro plánování léčby zhoubného nádoru děložního hrdla je nezbytné předoperačně stanovit přítomnost a velikost reziduálního nádoru po biopsii, jeho uložení v děložním hrdle (topografii nádoru), stav parametrií a lymfatických uzlin. Podle současných dat je vyšetření ultrazvukem a magnetickou rezonancí srovnatelně přesné v zobrazení přítomnosti a lokálního rozsahu zhoubného nádoru děložního hrdla. Ve srovnání s magnetickou rezonancí nemá ultrazvukové vyšetření známé kontraindikace a je běžně dostupným vyšetřením. V současnosti neexistuje žádná moderní zobrazovací metoda, která by mohla spolehlivě detekovat infiltrované lymfatické uzliny u klinicky časných stadií onemocnění, jelikož se jedná často o mikrometastatické postižení v nezvětšených spádových uzlinách. Senzitivita ultrazvuku v záchytu infiltrovaných uzlin u klinicky časných stadií onemocnění se pohybuje kolem 40 %, ale jeho specificita je vysoká (96 %). Pro denní praxi to znamená, že negativní ultrazvukový nález v oblasti spádových lymfatických uzlin není spolehlivý a vyžaduje ověření stagingovou systematickou lymfadenektomií, zatímco pozitivní ultrazvukový nález infiltrované uzliny mění léčebnou strategii u většiny pacientek.
Klíčová slova:
cervikální karcinom, transrektální ultrazvuk, staging, lymfatické uzliny, individualizace léčbyÚVOD
Incidence zhoubného nádoru děložního hrdla se v České republice dlouhodobě pohybuje okolo 20 nových záchytů onemocnění na 100 000 žen (incidence 18,53, 994 žen/rok 2010) a odpovídá incidenci známé v méně rozvinutých zemích [2, 10]. I když se jedná o preventabilní onemocnění, ročně u nás v jeho důsledku umírá téměř 400 žen (mortalita 7,16/2010) [10]. Díky zavedení celorepublikového screeningového programu zaměřeného na detekci prekanceróz děložního hrdla je v posledních dvou letech patrný klesající trend incidence onemocnění. Paradoxem však zůstává, že se současně příliš nemění mortalita. Ta je podmíněna především nepřiměřeně vysokým zastoupením pokročilých stadií onemocnění v kohortě žen, které se ne-účastní screeningových kontrol. Na vině uvedeného faktu může být i absence adresného zvaní žen, patrná zejména ve věkové kategorii nad 45 let. Pozitivem je naopak úspěšné zavedení plošné profylaktické vakcinace proti původci karcinomu děložního hrdla, lidskému papilomaviru (HPV, human papillomavirus), která je nabízena a plně hrazena dívkám před zahájením pohlavního života od dovršení třináctého do čtrnáctého roku života (zákon č. 369/2011 Sb.). Míra proočkovanosti setrvale dosahuje těsně k úrovni 80 %. Profylaktická vakcína proti HPV16/18 by měla zabránit vzniku 2/3 cervikálních karcinomů [31].
Podle klasifikace WHO (World Health Orga-nization) jsou zhoubné nádory děložního hrdla rozděleny na spinocelulární karcinomy (70–80 %), adenokarcinomy (10–15 %) a jiné (neuroendokrinní, nediferencované karcinomy). Mezi nepříznivé prognostické parametry patří velikost nádoru, stadium onemocnění, hloubka stromální invaze, lymfatické a cévní šíření nádoru a jeho histotyp [7–9]. Nejdůležitějším prognostickým faktorem je přítomnost postižených lymfatických uzlin. Zatímco pětileté přežití pacientek ve stadiu onemocnění IB-IIA je 88–95 %, v případě postižení lymfatických uzlin (stadium onemocnění IIIB) činí pouze 51–78 % [26].
Základním léčebným postupem u časného stadia zhoubného nádoru děložního hrdla je radikální chirurgický výkon, primární chemoradioterapie je indikována u nádorů lokálně pokročilých a systémová chemoterapie je metodou volby u metastazujících nádorů [15]. U chirurgických výkonů je podobně jako u nádorů prsu odklon od příliš radikálních výkonů, které doprovází významná a kvalitu života limitující pooperační morbidita [5, 6]. Další příčinou vedoucí k významným nežádoucím projevům léčby (ileózní stavy, píštěle, invalidizující lymfedémy) je kombinace dvou léčebných modalit, tj.extenzivní chirurgie a následné radioterapie. Proto hlavní léčebnou snahou je individualizace léčby se zachováním onkologické bezpečnosti, ale s minimem nežádoucích účinků.
Podle doporučení Mezinárodní federace pro gynekologii a porodnictví (FIGO, International Federation of Gynecology and Obstetrics) by měl být v případě histologického ověření přítomnosti zhoubného nádoru děložního hrdla zahájen vstupní diagnostický algoritmus v rozsahu gynekologického vyšetření pacientky zkušeným vyšetřujícím v celkové anestezii, cystoskopie, rektoskopie, intravenózní vylučovací urografie a rentgenového vyšetření hrudníku (tab. 1) [4, 30]. Další vyšetření mají být volena pouze fakultativně a výsledky těchto vyšetření nemají ovlivnit klinicky stanovený staging onemocnění. Je mnoho relevantních studií dokládajících nepřesnost palpačního vyšetření v rámci určení lokálního rozsahu onemocnění [22]. Navíc existují méně zatěžující zobrazovací metody pro zhodnocení stavu dutého systému ledvin, než je intravenózní vylučovací urografie. Podobně i přínos cysto - nebo rektoskopie v rámci stagingu je minoritní, jelikož vyloučí či potvrdí pouze postižení sliznice močového měchýře a nebo rekta [1].
Table 1. Doporučený klinický (předoperační) staging dle FIGO 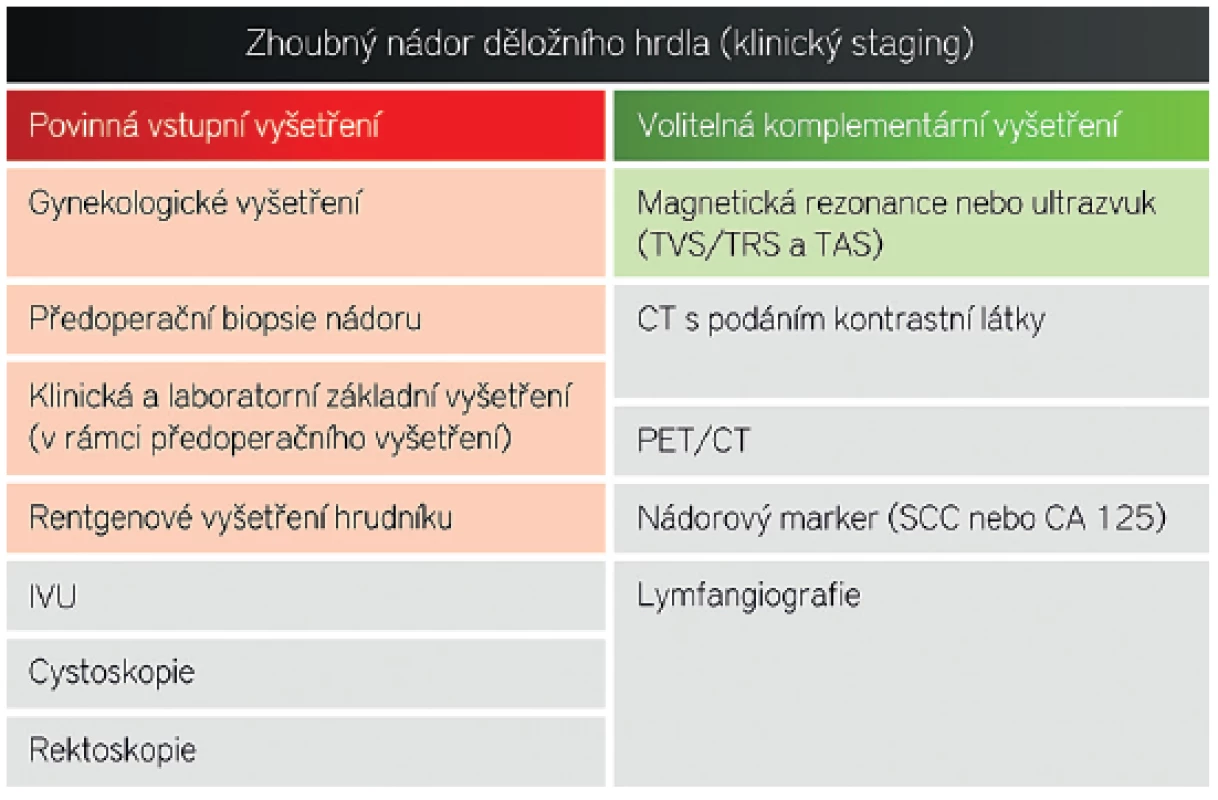
Doporučený postup dle FIGO (the International Federation of Gynecology and Obstetrics). Standardní vyšetření jsou označena červeně a vhodná stagingová moderní zobrazovací metoda je označena zeleně. Volba magnetické rezonance nebo ultrazvuku závisí na dostupnosti dané metody v onkogynekologickém centru. V případě podezření na extraabdominální šíření je vhodné doplnit CT nebo PET/CT. TVS – transvaginální sonografie, TRS – transrektální sonografie, TAS – transabdominální sonografie, CT – počítačová tomografie, PET/CT-pozitronová emisní tomografie kombinovaná s CT. Onkogynekolog pro plánování léčby potřebuje přesnou informaci o uložení nádoru (topografii nádoru) v děložním hrdle, přítomnosti infiltrovaných parametrií a stavu lymfatických uzlin (obr. 1) [14]. V roce 2009 Mezinárodní federace pro gynekologii a porodnictví provedla revizi klinického stagingu zhoubného nádoru děložního hrdla, v které doporučuje využití moderních zobrazovacích metod ve stanovení těchto významných prognostických parametrů [29].
Image 1. Předoperační stanovení rozsahu onemocnění a prognostických faktorů nezbytných pro plánování léčebné strategie 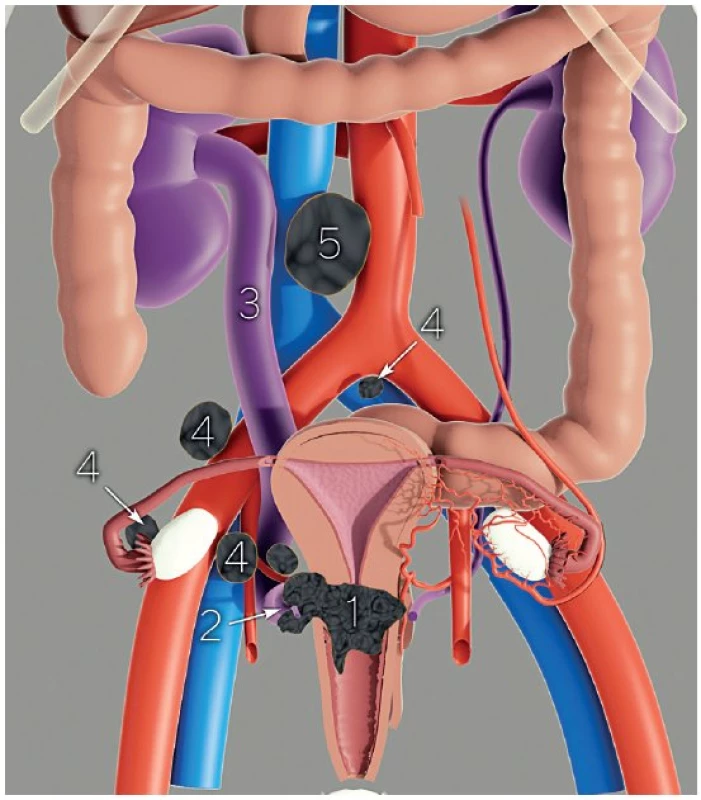
Velikost a uložení nádoru (topografie nádoru) v děložním hrdle (1), stav všech parametrií (předních, postranních i zadních, vpravo i vlevo) (2) s event. dilatací močového vývodného systému (3), přítomnost infiltrovaných pánevních (4) a paraortálních lymfatických uzlin (5) a další. Uvedené parametry mohou být stanoveny ultrazvukovým vyšetřením nebo magnetickou rezonancí. V případě časného stadia onemocnění je předoperačně doplněn skiagram hrudníku, v případě pokročilého onemocnění s rizikem vzdálených metastáz je vhodné doplnit vyšetření počítačovou tomografií (CT) s podáním kontrastní látky nebo pozitronovou emisní tomografií kombinovanou s CT (PET/CT) ke stanovení celkového rozsevu onemocnění (např. nadbrániční lymfadenopatie, postižení plic nebo skeletu aj.) (tab. 1). Magnetická rezonance, díky schopnosti vysokého tkáňového rozlišení v pánvi, se nabízí jako vhodná zobrazovací metoda pro stanovení rozsahu zhoubného nádoru děložního hrdla [3]. Na druhou stranu není magnetická rezonance běžně dostupným vyšetřením a má známé kontraindikace pro pacientku [19]. Její přesnost a využití závisí na přítomnosti zkušeného radiologa se znalostí onkogynekologie a léčebné strategie příslušného onkogynekologického centra. Proto data referující přesnost magnetické rezonance ve stagingu zhoubného nádoru děložního hrdla, která pocházela většinou z jednoho pracoviště, nebyla potvrzena v multicentrické studii organizované Americkou společností radiodiagnostiků (ACRIN, American College of Radiology Imaging Network) a Gynekologicko-onkologickou skupinou (GOG, Gynecologic Oncology Group) [21, 22, 27, 32].
Naopak ultrazvukové vyšetření může být provedeno přímo onkogynekologem s nejvyšší znalostí problematiky onemocnění. Vnitřní (endoluminální) sonda s vysokým tkáňovým rozlišením umožní detailní zobrazení všech pánevních struktur srovnatelně s magnetickou rezonancí, přičemž sonda může být zavedena transvaginálně nebo transrektálně (obr. 2). Transrektální přístup je preferovaný u nádorů děložního hrdla, vzhledem k riziku silnějšího krvácení z nádoru při zavedení sondy do pochvy. Navíc transrektální přístup garantuje lepší akustické podmínky pro zobrazení distální části děložního hrdla [23]. Současné provedení abdominální sonografie umožní stanovení rozsahu nádoru v břišní dutině (parenchymové orgány, peritoneum, lymfatické uzliny) [16]. V případě postižení paraaortálních uzlin je možné doplnit i vyšetření periferních supraklavikulárních uzlin lineární sondou (obr. 3). Vzhledem k dostupnosti ultrazvuku a jeho evidentním výhodám zbývalo doložit jeho roli ve stagingu zhoubného nádoru děložního hrdla. Výsledky současného výzkumu jsou náplní této přehledové práce.
Image 2. Ultrazvukové vyšetření lokálního rozsahu zhoubného nádoru děložního hrdla (vyšetření endoluminální sondou) 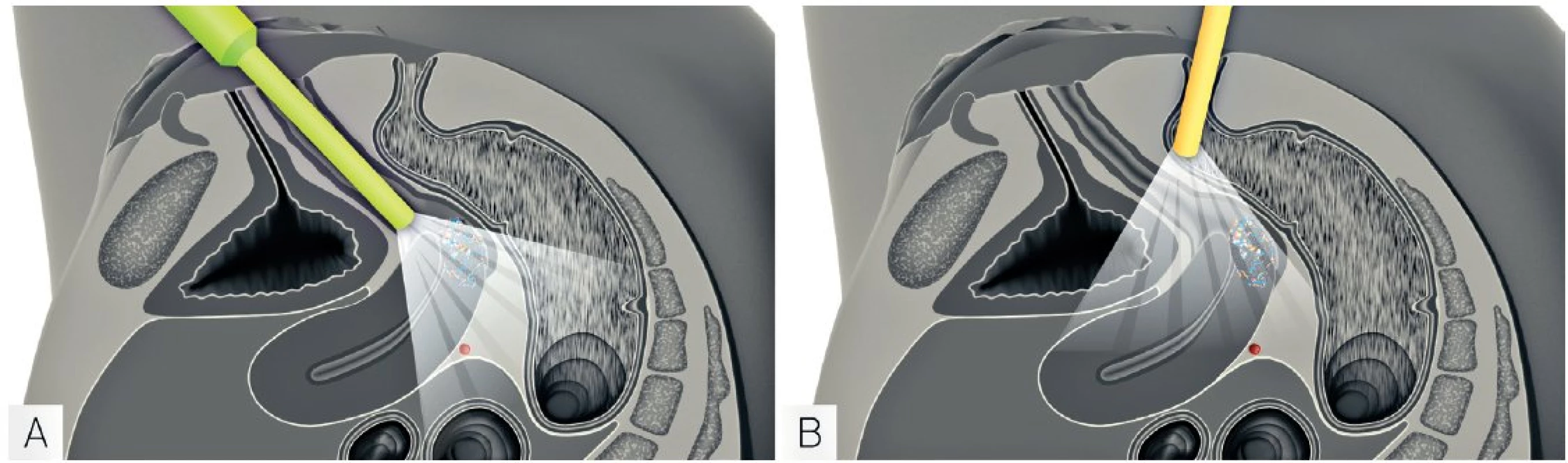
Transvaginální (A) a transrektální (B) zavedení vnitřní sondy s vysokým tkáňovým rozlišením. Transrektální vyšetření nevyžaduje žádnou přípravu pacientky ani speciální instrumentárium, jelikož je využívána identická sonda jako pro transvaginální vyšetření. Image 3. Ultrazvukové stanovení rozsahu zhoubného nádoru děložního hrdla v pánvi, břišní dutině a extraabdominálně (vyšetření konvexní a lineární sondou) 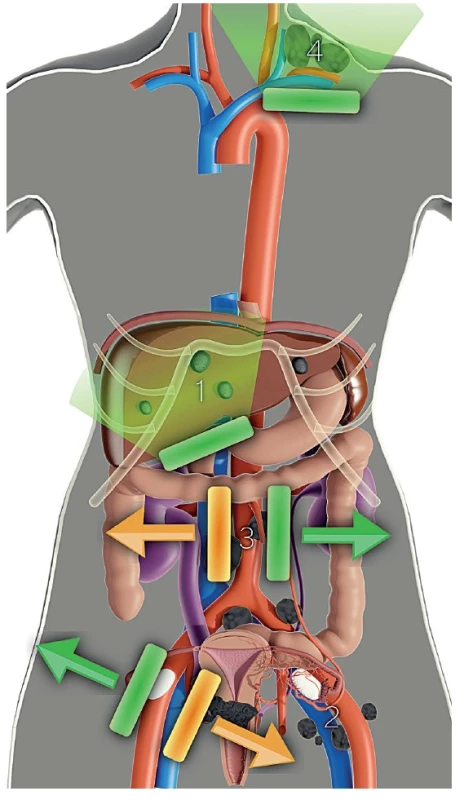
Vyšetření parenchymatózních orgánů a peritonea (1), pánevních (2), paraaortálních (3) a nadklíčkových (4) uzlin. STANOVENÍ LOKÁLNÍHO ROZSAHU ONEMOCNĚNÍ U ČASNÉHO STADIA ONEMOCNĚNÍ
Stěžejní prospektivní studie srovnávající diagnostickou přesnost ultrazvuku a magnetické rezonance v lokálním stagingu zhoubného nádoru děložního hrdla pochází z českého pracoviště [13]. Studie publikovaná v roce 2008 byla v té době jedinečná velikostí souboru (95 pacientek) i svým designem (prospektivní studie) a prokázala signifikantně vyšší spolehlivost ultrazvuku ve srovnání s magnetickou rezonancí v měření objemu nádoru, identifikaci reziduálního nádoru po předchozí biopsii (93,7 % vs. 83,2 %, p ≤ 0,006) a v měření malých nádorů ≤ 1 cm3 (90,5 % vs. 81 %, p ≤ 0,049). K dosažení těchto výsledků přispělo významné zlepšení technické kvality ultrazvukového přístroje a možnost ověřit přítomnost nádoru detekcí jeho bohaté cévní perfuze. Citlivý barevný Doppler zachytil vyšší perfuzi v nádoru u 98 % případů ve studii. Získaná data potvrdila i nesignifikantně vyšší přesnost ultrazvuku v hodnocení nádorové invaze v parametriích ve srovnání s magnetickou rezonancí (99 % vs. 95 %, p ≤ 0,219).
Slibná data byla potvrzena o rok později studií z italského pracoviště autorky Testy a kol. [33]. U vyšetřených 75 pacientek se zhoubným nádorem děložního hrdla ultrazvuk detekoval přítomnost nádoru, hlubokou stromální invazi nádoru, postižení parametrií a další sledované parametry s minimálně podobnou či větší přesností jako magnetická rezonance [33].
V roce 2010 byla publikována ultrazvuková práce autorky Epsteinové a kol. ze Švédska, která se zaměřila na sonomorfologické a dopplerovské známky u různých histotypů zhoubného nádoru děložního hrdla [11]. U obou nejčastějších histotypů zhoubného nádoru děložního hrdla (spinocelulární karcinom a adenokarcinom) byla shodně s českou studií [13] nalezena vysoká přítomnost novotvořených cév v nádoru detekovaná barevným dopplerovským mapováním, přičemž spinocelulární nádory byly často hypoechogenní (73 %), zatímco adenokarcinomy izoechogenní struktury (68 %) (obr. 4).
Image 4. Odlišení dlaždicobuněčného karcinomu a adenokarcinomu na základě změny echogenity nádoru 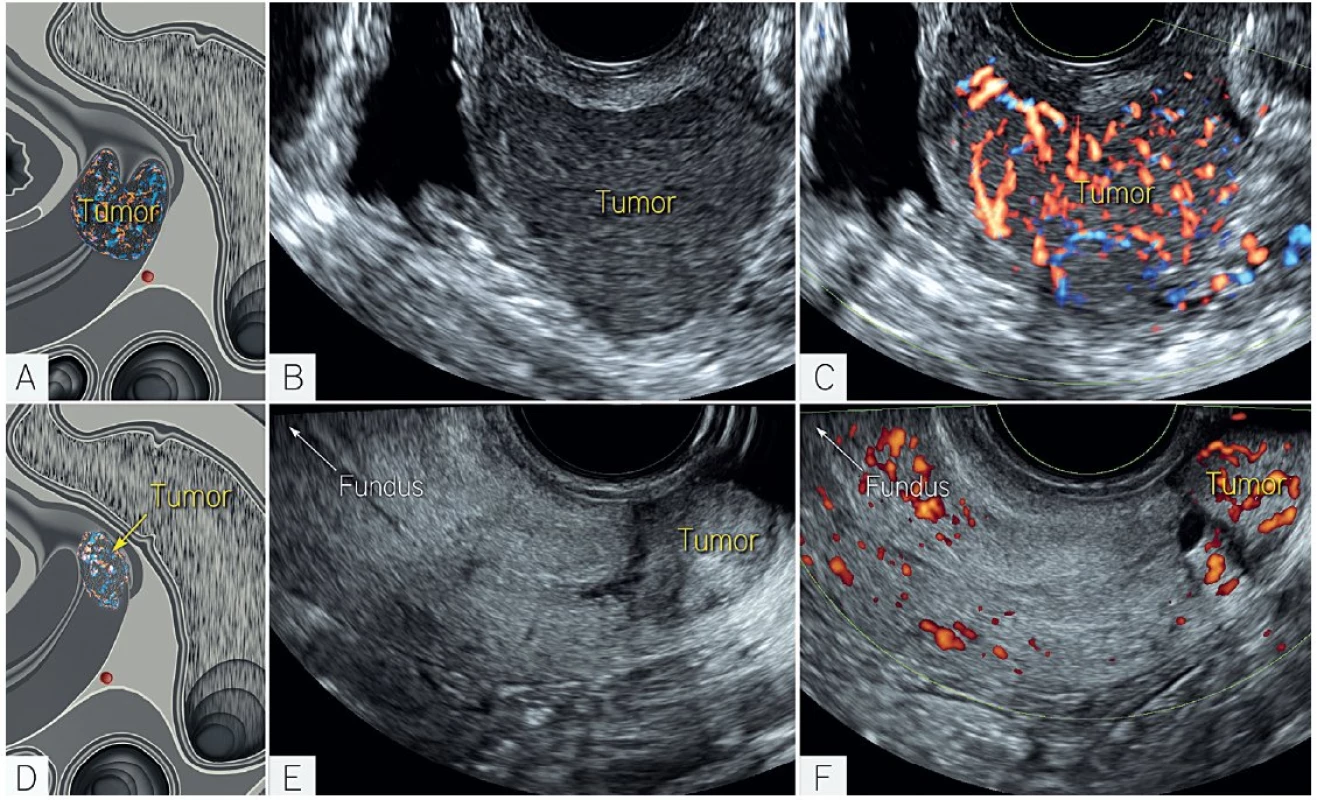
Dlaždicobuněčné nádory jsou často hypoechogenní a bohatě perfundované (schéma A), zatímco adenokarcinomy jsou izo- nebo hyperechogenní, také bohatě perfundované nádory (schéma D). Korespondující ultrazvukové zobrazení echogenity (B) a perfuze (C) ke schématu dlaždicobuněčného karcinomu (A). Korespondující ultrazvukové zobrazení echogenity (E) a perfuze ( F) ke schématu adenokarcinomu (D). Zájem o ultrazvuk u zhoubného nádoru děložního hrdla inicioval i téma práce postgraduálního studenta z Litevské univerzity A. Gaurilcika, jehož výsledky publikované v roce 2011 doložily dostatečnou přesnost ultrazvuku ve stanovení velikosti nádoru a hloubky stromální invaze (interclass correlation coefficient 0,74–0,92), menší přesnosti autor dosáhl ve stanovení minimální vzdálenosti nádoru od pericervikální fascie (ICC 0,51–0,58) [20].
Nezbytnou nutností pro vše-obecnou využitelnost ultrazvuku ve stagingu zhoubného nádoru děložního hrdla bylo ověření zachování jeho přesnosti v rámci multicentrické prospektivní studie. Evropská prospektivní multicentrická studie Epsteinové a kol. probíhala v letech 2007 až 2010, kdy bylo postupně vyšetřeno 182 pacientek s histologicky verifikovaným zhoubným nádorem děložního hrdla v časném stadiu onemocnění [12]. Ve studii se účastnily čtyři evropská onkogynekologická centra (Praha, Česká republika; Řím, Itálie; Malmö, Švédsko; Kaunas, Litva) a pa-cientky byly vyšetřeny podle přesně definovaného protokolu [12]. Cílem studie bylo porovnat přínos ultrazvuku a magnetické rezonance ve stanovení rozsahu časného stadia zhoubného nádoru děložního hrdla. Výsledky studie publikované v roce 2013 jsou prezentovány v tabulce 2. Diagnostická shoda mezi ultrazvukovým a patologickým nálezem byla signifikantně lepší v detekci rezi-duálního nádoru a parametriální invaze, než byla nalezena pro magnetickou rezonanci (p < 0,001). Překvapujícím zjištěním bylo zachování diagnostické přesnosti ultrazvuku v detekci reziduálního nádoru po provedené konizaci, kdy bývá obtížné odlišit reparativní a pozánětlivé změny po konizaci od reziduálního nádoru. Uvedené studie ukázaly srovnatelné výsledky ultrazvukového vyšetření a magnetické rezonance ve stanovení přítomnosti a lokálního rozsahu zhoubného nádoru děložního hrdla (obr. 5) a přispěly k implementaci ultrazvuku do stagingového vyšetřujícího algoritmu u tohoto typu onemocnění.
Table 2. Srovnání přesnosti ultrazvuku a magnetické rezonance 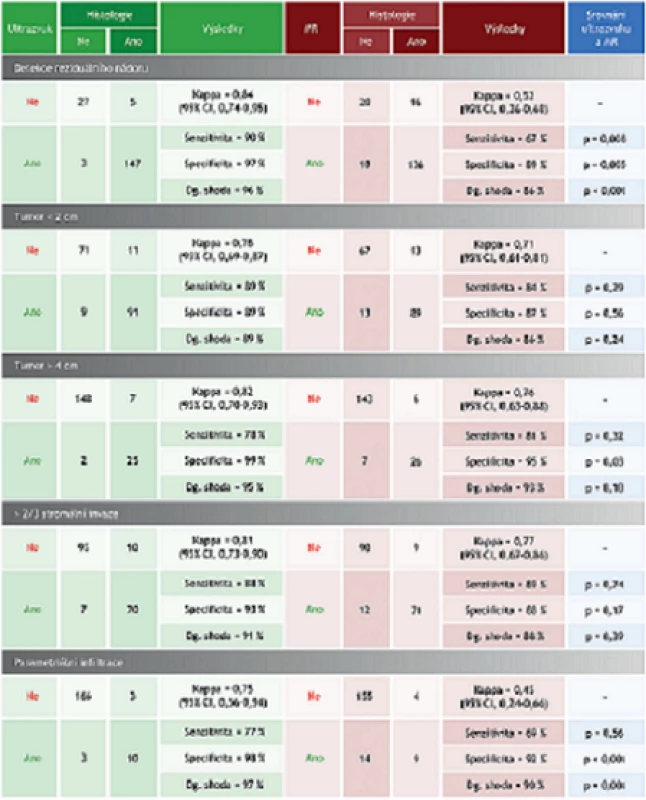
Tabulka prezentuje výsledky Evropské multicentrické studie autorky Epsteinové a kol. MR – magnetická rezonance. Dg. shoda – diagnostická shoda. Image 5. Zobrazení velkého dlaždicobuněčného karcinomu ultrazvukem a magnetickou rezonancí 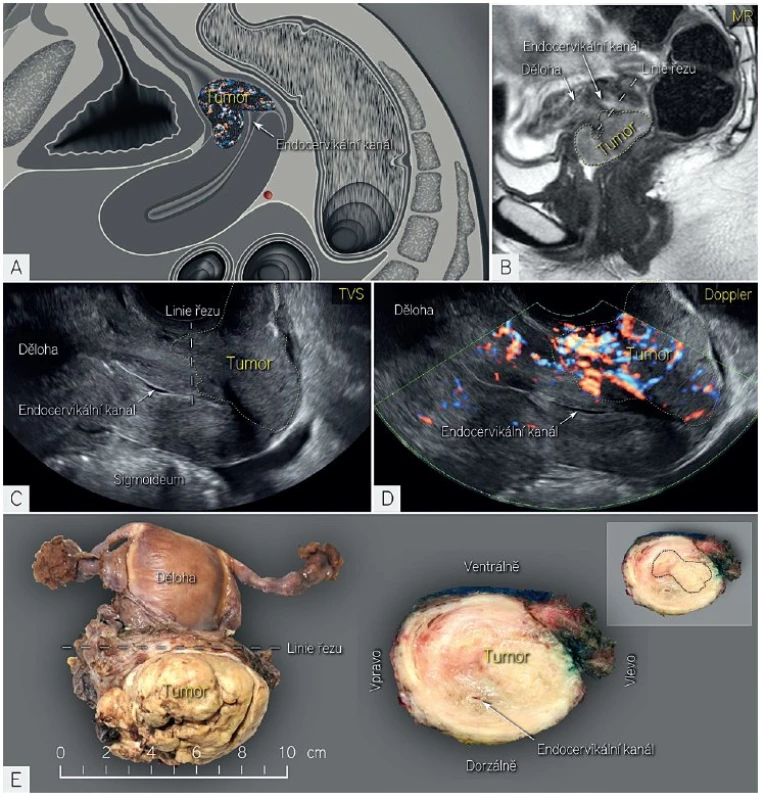
Schéma nádoru, který se exofyticky vyklenuje do pochvy, infiltruje přední část děložního hrdla, ale neprorůstá endocervikálním kanálem do zadní části hrdla (A). Korespondující nález v magnetické rezonanci (T2-vážené sekvence) (B), v ultrazvukovém vyšetření (C, D) a při patologickém vyšetření preparátu (E). Řez preparátem je proveden v místě označeném ‚linie řezu‘ v magnetické rezonanci a ultrazvuku. Podle řezu je zřejmé, že nádor rostl v přední porci děložního hrdla téměř do úrovně vnitřní branky. TVS-transvaginální sonografie. ULTRAZVUKOVÉ STANOVENÍ PARAMETRŮ PRO INDIVIDUALIZACI OPERAČNÍ LÉČBY
Kromě stanovení lokálního rozsahu onemocnění bylo nutné ověřit, zda ultrazvuk také dovede spolehlivě určit parametry nezbytné pro individualizaci operační léčby (obr. 6). Podle druhé prospektivní studie z českého pracoviště na 99 pacientkách s časným stadiem cervikálního karcinomu byla testována role ultrazvuku v plánování radikality resekce parametrií na základě měření volného okraje nádoru od pericervikální fascie s doloženou přesností 87,5 %, senzitivitou 91,3 % a specificitou 86,2 %, pozitivní a negativní prediktivní hodnotou 70,0 % a 96,6 % [17]. V této studii byla také měřena vzdálenost volného okraje nádoru od vnitřní branky pro možnost plánování fertilitu zachovávající léčby s doloženou přesností 94,3 %, senzitivitou 91,3 % a specificitou 95,4 %, pozitivní a negativní prediktivní hodnotou 87,5 % a 96,9 % [17].
Image 6. Parametry nezbytné pro individualizaci léčby u pacientek v časném stadiu onemocnění 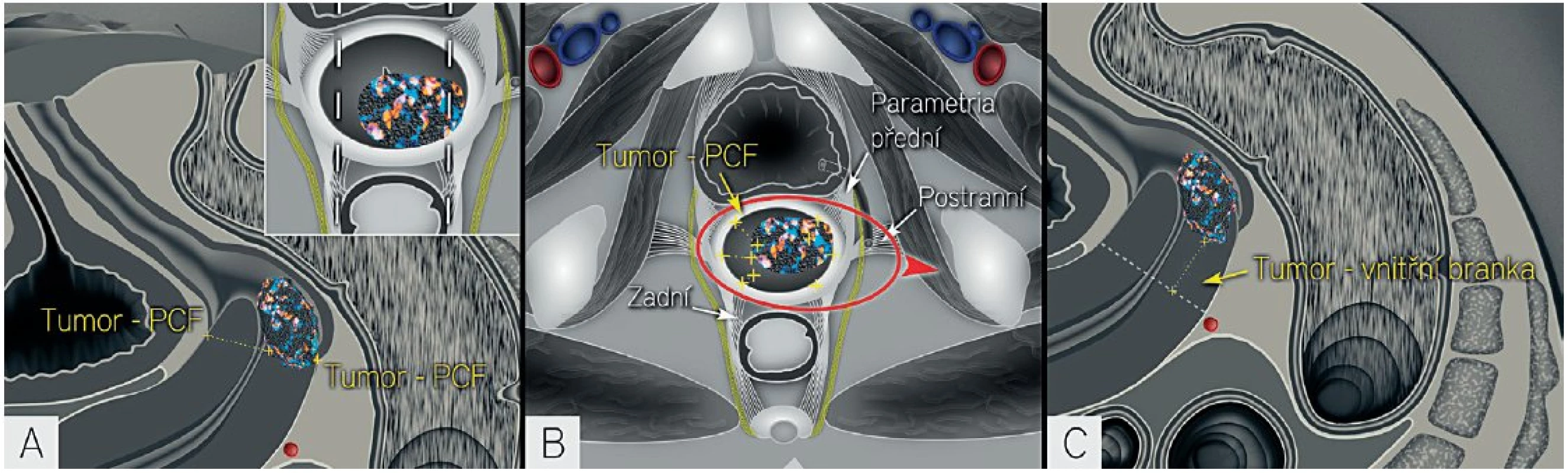
Schematický diagram znázorňující měření nejmenší vzdálenosti mezi nádorem a pericervikální fascií (laterálního volného okraje) v místě úponu předních a zadních vazů v sagitálním řezu (A), kdy místo úponu parametrií je znázorněno bílou čerchovanou čarou v transverzálním řezu. Měření vzdálenosti nádoru od pericervikální fascie v místě úponu předních, postranních a zadních vazů v transverzálním řezu (B), kdy radikalita resekce parametrií je znázorněna červeně v závislosti na uložení nádoru a dostatečném zdravém okraji od nádoru. Změření nejmenší vzdálenosti mezi horním pólem nádoru a vnitřní brankou (kraniální volný okraj) (C). Vnitřní branka je stanovena na základě zobrazení vstupu uterinních cév do dělohy. Tumor-PCF, vzdálenost nádoru od pericervikální fascie (PCF) znázorněné jako hyperechogenní prstenec kolem děložního hrdla. Na základě předložených dat lze využít ultrazvuk k plánování rozsahu resekce parametrií a fertilitu záchovné léčby. Pacientka však musí být pečlivě poučena o riziku ukončení operace v případě pozitivního nálezu při peroperačním vyšetření sentinelové uzliny a také o ukončení fertilitu záchovné operace při pozitivním kraniálním volném okraji preparátu. Sentinelové uzliny a kraniální volný okraj resekátu čípku jsou peroperačně vyšetřeny zmraženým řezem.
PŘEDOPERAČNÍ STANOVENÍ PŘÍTOMNOSTI INFILTROVANÝCH LYMFATICKÝCH UZLIN
Při předoperačním stanovení infiltrovaných lymfatických uzlin dosáhl ultrazvuk vysoké specificity (96 %). Tyto výsledky byly shodně získány nejen z poslední uvedené studie [17], ale také z další Evropské multicentrické studie autorky Palsdöttir a kol. [28]. Pro klinickou praxi to znamená, že pacientka s pozitivním nálezem infiltrovaných lymfatických uzlin není zatížena laparotomií, ale je přímo odeslána k laparoskopickému stagingovému vyšetření (tj. odstranění postižených pánevních uzlin v endobagu, jejich peroperačnímu zhodnocení a systematickému odstranění paraaortálních uzlin při histologické pozitivitě pánevních uzlin).
Na druhé straně, pokud je při zobrazení pánevních uzlin negativní nález, měla by být vždy pacientka referována k systematickému odstranění spádových uzlin a jejich histopatologickému vyšetření, protože v současnosti neexistuje žádná zobrazovací metoda, která by mohla spolehlivě detekovat uzlinové mikrometastázy. Senzitivita ultrazvuku byla v obou výše uvedených studiích nízká (38–43 %) [17, 28]. Je důležité zdůraznit, že pozitivní (metastaticky infiltrované) uzliny u klinicky časného stadia onemocnění byly ve většině případů normální velikosti (medián maximální velikosti postižené uzliny 14,0 mm, minimální a maximální rozsah 0,7–25,0 mm) a metastázy byly nalezeny většinou pouze mikroskopicky (medián maximální velikosti intranodální metastázy 3,5 mm, minimální a maximální rozsah 0,3–20,0 mm). Z těchto důvodů byla jejich před-operační detekce ultrazvukem technicky nesnadná až nemožná [17]. Ve studii se hodnotila oblast pánevních a paraaortálních uzlin transabdominální sondou, kdy bylo možné posoudit infiltrovanou uzlinu pouze na základě změny jejího tvaru a velikosti. V případě využití transvaginálně nebo transrektálně zavedené sondy lze navíc zobrazit změnu architektury a perfuze infiltrované uzliny, což by mělo zlepšit senzitivitu ultrazvukového vyšetření (obr. 7). Přínos kombinace transrektálního a transabdominálního ultrazvuku ve zlepšení detekce lymfatických uzlin se nyní ověřuje.
Image 7. Vyšetření lymfatických uzlin (kombinace transvaginálního a nebo transrektálního ultrazvukového vyšetření s transabdominálním ultrazvukem) 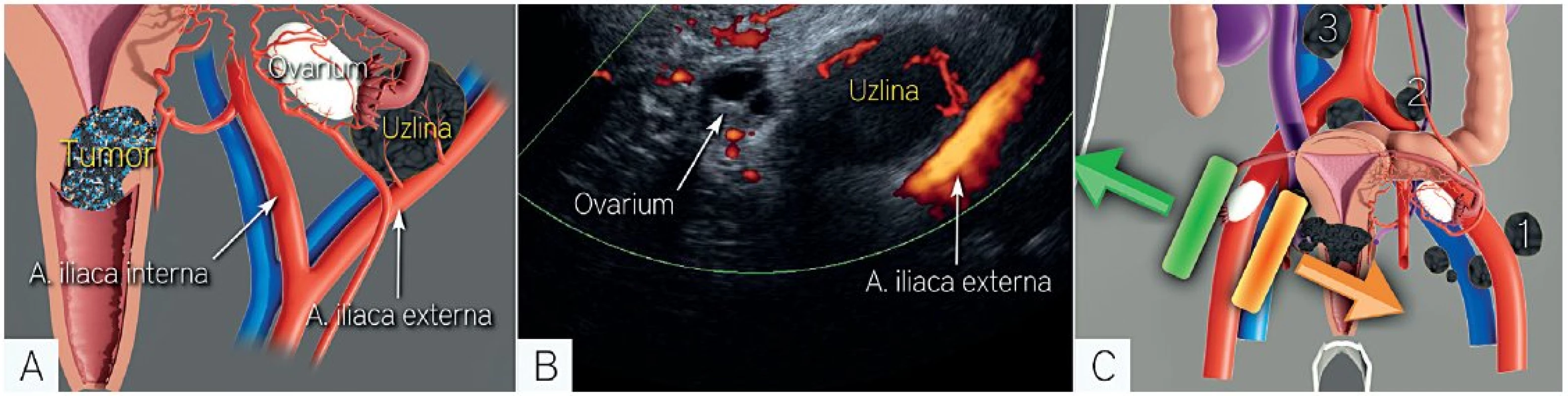
Transvaginální a nebo transrektální zavedení endoluminální sondy umožní zobrazení obturatorních a vnitřních ilických uzlin až do výše interilické bifurkace (A). Korespondující ultrazvukový nález s nálezem infiltrované zakulacené, hypoechogenní uzliny v obturatorní fosse s nádorovou perfuzí periferně v uzlině (v parakortexu)(B). Transabdominální vyšetření doplní informaci o přítomnosti uzlin uložených ventrálně na externích ilických cévách (1) a je klíčové pro zobrazení uzlin uložených kraniálně nad interilickou bifurkací (2 – společné ilické a 3 – paraaortální uzliny)(C). Pozn. podle anatomické terminologie jsou spádové lymfatické uzliny rozdělené na externí ilické uzliny (vč. uzlin interilických a obturatorních), interní ilické uzliny (vč. presakrálních) uzlin a společné ilické uzliny. TVS – transvaginální sonografie. TRS – transrektální sonografie. TAS – transabdominální sonografie. Další moderní zobrazovací metody mají obdobné limitace v zobrazení postižených uzlin u časného stadia zhoubného nádoru děložního hrdla, vzhledem k tomu, že jsou infiltrované uzliny často menší než 10 mm a mají pouze mikrometastatické postižení. Magnetická rezonance (MR) hodnotí postižené uzliny na základě jejich velikosti (velikost uzliny v krátké ose > 1 cm), změny tvaru (zakulacená), přítomnosti nepravidelných okrajů, nekróz a signálové intezity podobné primárnímu nádoru [3]. Pozitronová emisní tomografie kombinovaná s počítačovou tomografií (PET/CT) má také svoje limitace při zobrazení lézí menších než 5–10 mm. Proto je senzitivita PET/CT a MR pro záchyt infiltrovaných uzlin nevyhovující (58 % a 30 %) [24]. Podobné výsledky přinesla i studie, která srovnávala přínos hybridního MR/PET a PET/CT s doloženou senzitivitou 54,2 % pro MR/PET a 44,1 % pro PET/CT [25]. Specificita obou zobrazovacích metod (MR a PET/CT) byla vysoká (92,6 %) [24] a srovnatelná s ultrazvukovým vyšetřením (96 %) [17, 28].
Vzhledem k nepřesnosti zobrazovacích metod ve stanovení infiltrovaných uzlin zůstává nadále chirurgický a patologický staging nejpřesnějším postupem k získání relevantní informace pro plánování adekvátní léčby.
OBJEKTIVIZACE ULTRAZVUKOVÉHO MĚŘENÍ A VÝZNAM TROJROZMĚRNÉHO ULTRAZVUKU
Již zmíněná druhá Evropská multicentrická studie autorky Palsdöttir a kol., která probíhala v letech 2010 až 2013, měla za cíl vyhodnotit schopnost ultrazvukového vyšetření ve stanovení dvou důležitých prognostických faktorů onemocnění, tj. hlubokou stromální invazi a postižení lymfatických uzlin [28]. Tyto prognostické faktory byly stanoveny jednak subjektivně erudovaným sonografistou a dále byly vybrány a srovnávány objektivní a snadno měřitelné ul-trazvukové parametry, které by mohly predikovat přítomnost hluboké stromální invaze a nebo postižení lymfatických uzlin [28]. Pokud by měly tyto objektivní parametry srovnatelnou přesnost jako subjektivní hodnocení expertem, pak by mohl i méně zkušený sonografista spolehlivě identifikovat důležité prognostické faktory onemocnění (hloubku stromální invaze a lymfatické postižení). Tyto objektivní parametry byly stanoveny pomocí dvou - a trojrozměrného ultrazvuku (2D a 3D ultrazvuk). Dvourozměrný ultrazvuk umožňuje vyšetření pouze v sagitální a transverzální rovině, a také pouze subjektivní hodnocení cévní perfuze v nádoru (1 – žádná, 2 – minimální, 3 – střední, 4 – vysoká) [34]. Výhodou 3D ultrazvuku je vyšetření ve třech rovinách, podobně jako u magnetické rezonance, a možnost přesného stanovení objemu nádoru a kvantifikace cévní perfuze (obr. 8). Do studie bylo zahrnuto 104 pacientek s časným stadiem onemocnění, u kterých byla následně provedena operační léčba. Statistická analýza dat potvrdila, že subjektivní hodnocení hluboké stromální invaze expertem je nadále nejpřesnějším měřením (AUC 0,93, senzitivita 90,5 %, specificita 97,2 %), jeho přesnosti se blížilo objektivní změření, buď největšího rozměru nádoru v 2D obrazu (cut-off 20,5 mm, AUC 0,83, senzitivita 90,5 %, specificita 61,1 %) a/nebo objemu nádoru ve 3D zobrazení (cut-off 9,1 ml, AUC 0,85, senzitivita 79,4 %, specificita 83,3 %). Ani subjektivní hodnocení expertem (AUC 0,69, senzitivita 42,9 %, specificita 96,1 %), natož pak objektivní měření zvolených parametrů nebylo dostatečně přesné v predikci postižených lymfatických uzlin.
Image 8. Trojrozměrný ultrazvuk (objektivní zobrazení cévní perfuze) 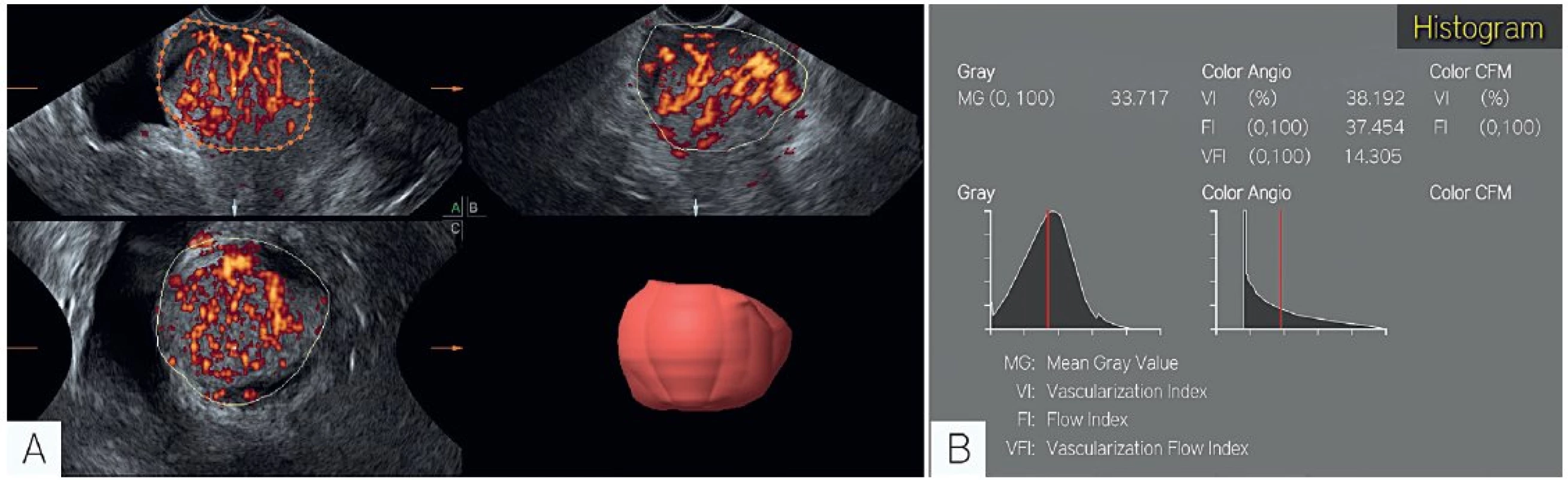
Zobrazení cévní perfuze nádoru energetickým Dopplerem v sagitálním, koronárním a transverzálním řezu (A). Histogram s objektivními parametry nádorové perfuze (B). VFI-vascular flow index (index vaskularizace a cévního toku, VFI = (VIxFI)/100), VI - vascularization index (index vaskularizace, poměr barevně kódovaných voxelů/všem voxelům ve snímaném objemu), Flow index (index toku, střední hodnota intenzity signálu energetického Doppleru ze všech barevných kódovaných voxelů). Podle výsledku studie bylo zřejmé, že měření subjektivně hodnocené stromální invaze je mnohem přesnější než testované objektivní parametry. Ultrazvukové předoperační vyšetření spádových lymfatických uzlin nemůže nahradit systematickou lymfadenektomii. Studie nepotvrdila klinický přínos 3D ultrazvukového zobrazení ve srovnání s informacemi, které získáme z běžně dostupného 2D zobrazení, což je velmi podstatné pro naši běžnou praxi, jelikož 3D modalita vyžaduje již speciální vybavení a software.
Dvourozměrné ultrazvukové vyšetření a subjektivní hodnocení nádoru zkušeným sonografistou zůstává nadále zlatým standardem ve vyšetření zhoubného nádoru děložního hrdla. Trojdimenzionální ultrazvuk lze využít pro externí hodnocení lokálního rozsahu nádoru druhou osobou (off-line analýzu) a umožní standardní dokumentaci nálezu. Obdobný závěr přinesla recentně publikovaná studie autorky Chiappy a kol., kdy 2D dynamický ultrazvuk byl rutinní metodou pro zobrazení nádorové infiltrace parametrií a 3D ultrazvuk umožnil detailní plánování léčby na základě off-line analýzy lokalizace a stupně nádorové infiltrace do parametrií (obr. 9) [23].
Image 9. Tomografické řezy v 3D ultrazvuku 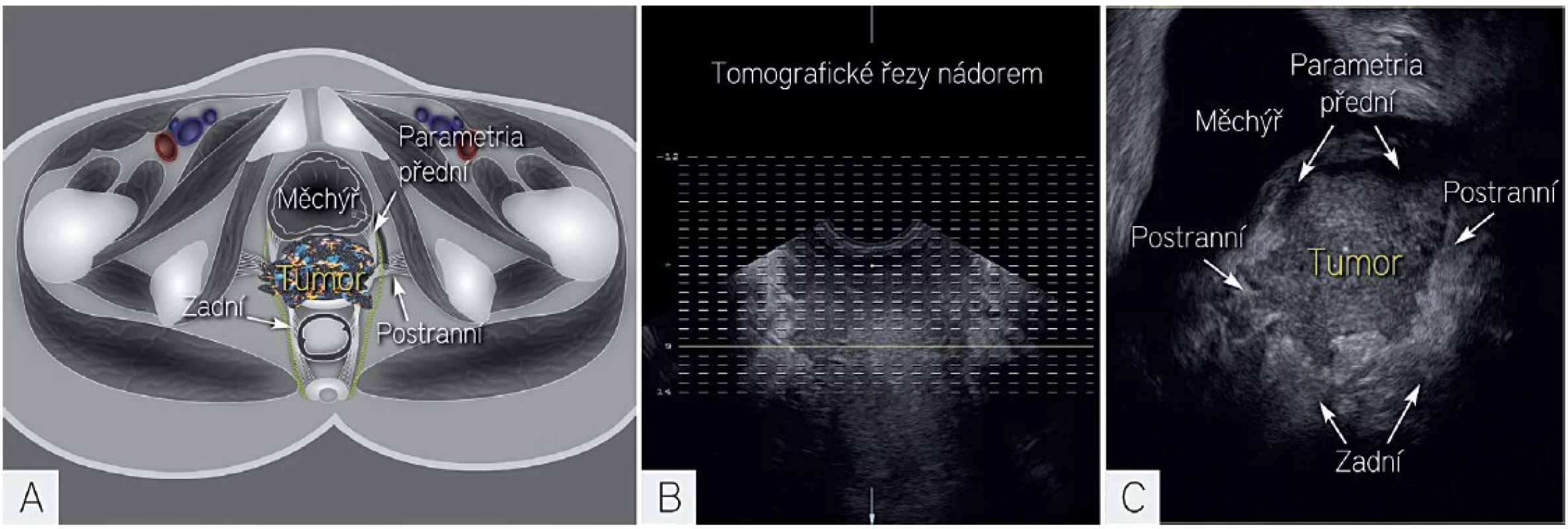
Schéma znázorňující lokálně pokročilý nádor s infiltrací odstupů všech parametrií (A). Linie tomografického řezu je označena žlutou čerchovanou čarou (B). Transverzální řez nádorem s infiltrací obou předních, obou postranních a obou zadních parametrií. ZÁVĚR
Podle prezentovaných dat je zřejmé, že ultra-zvukové vyšetření provedené zkušeným sonografistou, v ideálním případě onkogynekologem s nejvyšší znalostí problematiky onemocnění, dosahuje lepších výsledků ve stanovení lokálního rozsahu zhoubného nádoru děložního hrdla než doposud zlatý standard reprezentovaný magnetickou rezonancí. Ultrazvuk, podobně jako jiné moderní zobrazovací metody včetně magnetické rezonance, neumožní spolehlivé hodnocení postižených lymfatických uzlin a chirurgický staging zůstává nadále zlatým standardem v diagnostice stavu lymfatických uzlin.
Práce byla podpořena Univerzitou Karlovou v Praze (projekt UNCE 204024 a PRVOUK-P27/LF1/1), grantem Ministerstva zdravotnictví RVO-VFN64165 a grantem Interní grantové agentury Ministerstva zdravotnictví NT 13070.
MUDr. Daniela Fischerová, Ph.D.
Onkogynekologické centrum
Gynekologicko-porodnická klinika 1. LF UK a VFN
Apolinářská 18
128 51 Praha 2
e-mail: daniela.fischerova@seznam.cz
Sources
1. Amendola, MA., Hricak, H., Mitchell, DG., et al. Utilization of diagnostic studies in the pretreatment evaluation of invasive cervical cancer in the United States: results of intergroup protocol ACRIN 6651/GOG 183. J Clin Oncol, 2005, 23, 30, p. 7454–7459.
2. Arbyn, M., Castellsague, X., de Sanjose, S., et al. Worldwide burden of cervical cancer in 2008. Ann Oncol, 2011, 22, 12,p. 2675–2686.
3. Balleyguier, C., Sala, E., Da Cunha, T., et al. Staging of uterine cervical cancer with MRI: guidelines of the European Society of Urogenital Radiology. Eur Radiol, 2011, 21, 5, p. 1102–1110.
4. Benedet, JL., Bender, H., Jones, H., 3rd, et al. FIGO staging classifications and clinical practice guidelines in the management of gynecologic cancers. FIGO Committee on Gynecologic Oncology. Int J Gynaecol Obstet, 2000, 70, 2, p. 209–262.
5. Cibula, D., Slama, J., Velechovska, P., et al. Factors affecting spontaneous voiding recovery after radical hysterectomy. Int J Gynecol Cancer, 2010, 20, 4, p. 685–690.
6. Cibula, D., Velechovska, P., Slama, J., et al. Late morbidity following nerve-sparing radical hysterectomy. Gynecol Oncol, 2010, 116, 3, p. 506–511.
7. Cibula, D., Pinkavova, I., Dusek, L., et al. Local control after tailored surgical treatment of early cervical cancer. Int J Gynecol Cancer, 2011, 21, 4, p. 690–698.
8. Colombo, N., Carinelli, S., Colombo, A., et al. Cervical cancer: ESMO Clinical Practice Guidelines for diagnosis, treatment and follow-up. Ann Oncol, 2012, 23, Suppl. 7, p. vii27–32.
9. Diaz, JP., Sonoda, Y., Leitao, MM., et al. Oncologic outcome of fertility-sparing radical trachelectomy versus radical hysterectomy for stage IB1 cervical carcinoma. Gynecol Oncol, 2008, 111, 2, p. 255–260.
10. Dušek, L. Epidemiologie zhoubných nádorů v České republice. 2010.
11. Epstein, E., Di Legge, A., Masback, A., et al. Sonographic characteristics of squamous cell cancer and adenocarcinoma of the uterine cervix. Ultrasound Obstet Gynecol, 2010, 36, 4, p. 512–516.
12. Epstein, E., Testa, A., Gaurilcikas, A., et al. Early-stage cervical cancer: tumor delineation by magnetic resonance imaging and ultrasound – an European multicenter trial. Gynecol Oncol, 2013, 128, 3, p. 449–453.
13. Fischerova, D., Cibula, D., Stenhova, H., et al. Transrectal ultrasound and magnetic resonance imaging in staging of early cervical cancer. Int J Gynecol Cancer, 2008, 18, 4, p. 766–772.
14. Fischerova, D., Burgetova, A., Seidl, Z., Bělohlávek, O. Diagnostika zhoubného nádoru děložního hrdla. In Cibula, D. a Petruželka, L. Onkogynekologie. Praha: Grada Publishing, a. s., 2009, s. 405–411.
15. Fischerova, D., Novotný, J., Petruželka, L. Léčba zhoubného nádoru děložního hrdla (chemoterapie). In Cibula, D. a Petruželka, L. Onkogynekologie. Praha: Grada publishing, a. s., 2009,s. 412–426.
16. Fischerova, D. Ultrasound scanning of the pelvis and abdomen for staging of gynecological tumors: a review. Ultrasound Obstet Gynecol, 2011, 38, 3, p. 246–266.
17. Fischerova, D., Zikan, M., Pinkavova, I., et al. The role of ultrasound in planning fertility sparing surgery and individual treatment in early stage cervical cancer. Ultrasound Obstet Gynecol, 2012, 40, Suppl. 1, p. 51.
18. Fischerova, D., Burgetova, A. Volba vhodné zobrazovací metody v onkogynekologii. Čes Gynekol, 2014, 79, 6, p 425–435.
19. Fischerová, D., Burgetová, A., Seidl, Z., Bělohlávek, O. Diagnostika. In Cibula, D., Petruželka, L. Onkogynekologie. Praha: Grada Publishing, 2009, s. 101–131.
20. Gaurilcikas, A., Vaitkiene, D., Cizauskas, A., et al. Early-stage cervical cancer: agreement between ultrasound and histopathological findings with regard to tumor size and extent of local disease. Ultrasound Obstet Gynecol, 2011, 38, 6, p. 707–715.
21. Hricak, H., Lacey, CG., Sandles, LG., et al. Invasive cervical carcinoma: comparison of MR imaging and surgical findings. Radiology, 1988, 166, 3, p. 623–631.
22. Hricak, H., Gatsonis, C., Chi, DS., et al. Role of imaging in pretreatment evaluation of early invasive cervical cancer: results of the intergroup study American College of Radiology Imaging Network 6651 – Gynecologic Oncology Group 183. J Clin Oncol, 2005, 23, 36, p. 9329–9337.
23. Chiappa, V., Di Legge, A., Valentini, AL., et al. Agreement of two-dimensional and three-dimensional transvaginal ultrasound with magnetic resonance imaging with regard to parametrial infiltration in cervical cancer. Ultrasound Obstet Gynecol, 2014.
24. Choi, HJ., Roh, JW., Seo, SS., et al. Comparison of the accuracy of magnetic resonance imaging and positron emission tomography/computed tomography in the presurgical detection of lymph node metastases in patients with uterine cervical carcinoma: a prospective study. Cancer, 2006, 106, 4, p. 914–922.
25. Kim, SK., Choi, HJ., Park, SY., et al. Additional value of MR/PET fusion compared with PET/CT in the detection of lymph node metastases in cervical cancer patients. Eur J Cancer, 2009, 45, 12, p. 2103–2109.
26. Kim, SM., Choi, HS., Byun, JS. Overall 5-year survival rate and prognostic factors in patients with stage IB and IIA cervical cancer treated by radical hysterectomy and pelvic lymph node dissection. Int J Gynecol Cancer, 2000, 10, 4, p. 305–312.
27. Mitchell, DG., Snyder, B., Coakley, F., et al. Early invasive cervical cancer: tumor delineation by magnetic resonance imaging, computed tomography, and clinical examination, verified by pathologic results, in the ACRIN 6651/GOG 183 Intergroup Study. J Clin Oncol, 2006, 24, 36, p. 5687–5694.
28. Palsdottir, K., Fischerova, D., Franchi, D., et al. Preoperative prediction of lymph node metastasis and deep stromal invasion in women with invasive cervical cancer – A prospective multicenter study on 2D and 3D ultrasound. Ultrasound Obstet Gynecol, 2014.
29. Pecorelli, S. Revised FIGO staging for carcinoma of the vulva, cervix, and endometrium. Int J Gynaecol Obstet, 2009, 105, 2, p. 103–104.
30. Quinn, MA., Benedet, JL., Odicino, F., et al. Carcinoma of the cervix uteri. FIGO 26th Annual Report on the Results of Treatment in Gynecological Cancer. Int J Gynaecol Obstet, 2006, 95, Suppl. 1, p. S43–103.
31. Sankaranarayanan, R., Nene, BM., Shastri, SS., et al. HPV screening for cervical cancer in rural India. N Engl J Med, 2009, 360, 14, p. 1385–1394.
32. Subak, LL., Hricak, H., Powell, CB., et al. Cervical carcinoma: computed tomography and magnetic resonance imaging for preoperative staging. Obstet Gynecol, 1995, 86, 1, p. 43–50.
33. Testa, AC., Ludovisi, M., Manfredi, R., et al. Transvaginal ultrasonography and magnetic resonance imaging for assessment of presence, size and extent of invasive cervical cancer. Ultrasound Obstet Gynecol, 2009, 34, 3, p. 335–344.
34. Timmerman, D., Valentin, L., Bourne, TH., et al. Terms, definitions and measurements to describe the sonographic features of adnexal tumors: a consensus opinion from the International Ovarian Tumor Analysis (IOTA) Group. Ultrasound Obstet Gynecol, 2000, 16, 5, p. 500–505.
Labels
Paediatric gynaecology Gynaecology and obstetrics Reproduction medicine
Article was published inCzech Gynaecology

2014 Issue 6-
All articles in this issue
- Staging zhoubného nádoru děložního hrdla (stanovení předoperačního rozsahu onemocnění) – přehled výsledků nejnovějších ultrazvukových studií
- Ultrazvukový staging karcinomu děložního hrdla – návrh standardního postupu
- Zhoubný nádor děložního těla – předoperační odlišení nádorů s nízkým a vysokým rizikem metastázování (přehled výsledků nejnovějších ultrazvukových studií)
- Ultrazvukový staging karcinomu endometria – doporučená metodika vyšetření
- Doporučený diagnostický postup u ženy s ovariální cystou nebo nádorem
- Volba vhodné bioptické metody u primárně inoperabilního nebo recidivujícího zhoubného nádoru a metodika bioptického odběru
- Význam screeningu v onkogynekologii
- Metody bezkrevní péče v gynekologii a onkogynekologii
- Volba zobrazovací metody v onkogynekologii
- Czech Gynaecology
- Journal archive
- Current issue
- Online only
- About the journal
Most read in this issue- Doporučený diagnostický postup u ženy s ovariální cystou nebo nádorem
- Ultrazvukový staging karcinomu endometria – doporučená metodika vyšetření
- Ultrazvukový staging karcinomu děložního hrdla – návrh standardního postupu
- Zhoubný nádor děložního těla – předoperační odlišení nádorů s nízkým a vysokým rizikem metastázování (přehled výsledků nejnovějších ultrazvukových studií)
Login#ADS_BOTTOM_SCRIPTS#Forgotten passwordEnter the email address that you registered with. We will send you instructions on how to set a new password.
- Career

