-
Medical journals
- Career
Proteiny rezistence LRP, Pgp,MRP1, MRP3 a MRP5 u pacientek s karcinomem ovaria
Authors: I. Sedláková 1; J. Laco 2; J. Tošner 1; J. Špaček 1; Eva Čermáková 3
Authors‘ workplace: Porodnická a gynekologická klinika LF UK a FN, Hradec Králové, přednosta doc. MUDr. J. Špaček, Ph. D., IFEPAG 1; Fingerlandův ústav patologie LF UK a FN, Hradec Králové, přednosta prof. MUDr. A. Ryška, Ph. D. 2; Ústav lékařské biofyziky LF UK, Hradec Králové, přednosta doc. MUDr. J. Hanuš, CSc. 3
Published in: Ceska Gynekol 2013; 78(6): 545-553
Category: Original Article
Overview
Cíl studie:
Cílem této práce je stanovení proteinů rezistence LRP (Lung Resistance Protein), PgP (P-glykoprotein), MRP1 (Multidrug Related Protein, Multidrug Resistance – Associated Protein), MRP3 a MRP5 a zjištění jejich klinického významu u pacientek s karcinomem ovaria.Typ studie:
Prospektivní klinická studie.Název a sídlo pracoviště:
Porodnická a gynekologická klinika LF UK a FN, Hradec Králové.Metodika:
Stanovení proteinů rezistence (LRP, Pgp, MRP1, MRP3, MRP5) jsme provedli u 111 vzorků ovariálních karcinomů u pacientek operovaných na PGK FNHK v letech 2006–2010. Proteiny rezistence jsme stanovili metodou dvoustupňové imunohistochemie.Výsledky:
LRP, Pgp, MRP1 a MRP3 vykazovali výrazné rozdíly hodnot v závislosti na histologickém typu ovariálního karcinomu (MRP1 p = 0,023, MRP3 p = 0,056). Stupeň diferenciace významně ovlivnil pouze hodnoty MRP1 (G1 60,83 % (CI 10–100), G2 36,80 % (CI 20–100), G3 88,8 7% (CI 100–100), p = 0,039). Nárůst MRP1 od časných stadií (I+II) k pokročilému onemocnění (III+IV) byl významný (I+II 71,6 % (CI 60–100), III+IV 83,6 % (CI 100–100), p = 0,03). Pacientky s kompletní odpovědí na primární léčbu měly nižší hodnoty LRP, Pgp a MRP1 v porovnání s ostatními ženami. Medián délky PFS byl významně kratší u skupiny pacientek s Pgp a MRP1 nad 85 % v porovnání s pacientkami s hodnotami těchto proteinů rezistence pod 85 % (Kaplanův-Meierův test pro PFS, Pgp < 85 % Med PFS 23 měs. (CI 8–37) vs > 85 % Med PFS 11 měs. (CI 7–17), p = 0,054), (MRP1 < 85 % Med PFS 33 měs. (CI 11–49) vs > 85% Med PFS 11 měs. (CI 7–16), p = 0,046).Závěr:
Prokázali jsme klinický význam stanovení LRP, Pgp, MRP1 a MRP3 u pacientek s karcinomem ovaria. MRP5 nemá podle našich výsledků klinický význam u pacientek s karcinomem ovaria. MRP1 se z proteinů rezistence ukazuje jako nejperspektivnější prediktivní a prognostický faktor u pacientek s karcinomem ovaria.Klíčová slova:
karcinom ovaria – LRP – Pgp/ABCB1 – MRP1/ABCC1 – MRP3/ABCC3 – MRP5/ABCC5 – chemorezistenceÚVOD
Ovariální karcinom je šestým nejčastějším karcinomem u žen v České republice, reprezentuje 1,7 % ze všech nově diagnostikovaných neoplazmat (3,7 % u žen). Je odpovědný za 2,7 % všech úmrtí na rakovinu (6,2 % u žen) (zdroj dat: ÚZIS ČR, www.svod.cz). Výsledky přežití pacientek se za posledních 20 let zlepšily minimálně [4]. Standardní primární léčba se skládá z chirurgického výkonu a chemoterapie (paklitaxel + platinový preparát) u naprosté většiny pacientek s karcinomem ovaria. Hlavním klinickým problémem současné cytostatické léčby ovariálního karcinomu je léková rezistence na cytostatika (chemorezistence). Jejím následkem je selhání léčby [6].
Kompletní odpověd na primární chemoterapii je vysoká, mezi 50–70 %. Přesto 50–75 % pacientek s pokročilým ovariálním karcinomem onemocnění relabuje a dochází k vývoji lékové rezistence, zejména mnohočetné lékové rezistence (MDR). Maligní buněčné populace mohou být vůči chemoterapii rezistentní již v primární léčbě. V tomto případě jde o tzv. přirozenou (primární) rezistenci. Získaná (sekundární) rezistence vzniká až v průběhu cytostatické léčby, kdy se původně citlivé buňky stávají rezistentními a účinnost cytostatické léčby se snižuje. Pokud při ztrátě citlivosti k jednomu přípravku vzniká současně rezistence na jiné, většinou strukturálně příbuzné cytostatikum, hovoříme o rezistenci zkřížené. Byly však popsány případy zkřížené rezistence mezi protinádorovými léčivy lišícími se jak strukturálně, tak mechanismem účinku. Takové případy rezistence pak nazýváme mnohočetná léková rezistence (multidrug resistance, MDR). MDR vysvětluje případy necitlivosti některých nádorů k alternativním léčebným režimům, obsahujícím nové druhy cytostatik, nepoužitým v původní léčbě. Typická (klasická) MDR je zapříčiněna membránovým P-glykoproteinem (Pgp), který je produktem MDR1 genu. Jako atypická MDR jsou souhrnně označovány všechny mechanismy mnohočetné lékové rezistence, na kterých se neúčastní Pgp [17]. Jedním ze základních mechanismů vzniku MDR je transportní funkce některých transmembránových proteinů ze skupiny tzv. ABC-transportérů (ATP binding cassette proteins). Jedním z nejvýznamnějších ABC-transportérů přispívajících k rozvoji MDR je právě P-glykoprotein (Pgp). Jde o transmembránový glykoprotein o velikosti 170 kDa tvořený 1280 aminokyselinami [22]. Pgp/MDR je běžně exprimován v játrech, ledvinách, střevech, mozku, děloze, varlatech a placentě [15]. Z toho vyplývá i jeho fyziologická funkce, kterou je především řízení absorpce, distribuce a exkrece celé řady xenobiotik včetně řady klinicky významných léčiv. Brání také průniku xenobiotik do mozku či reprodukčních orgánů [21]. Pgp je kódován genem MDR1 (ABCB1). Exprese proteinu koreluje s expresí na úrovni genu [11]. Substráty Pgp jsou řada protinádorových léčiv, jako vinka-alkaloidy, antracykliny, taxany, kolchicin a aktinomycin D [15]. Taxany jsou standardní součástí chemoterapie první linie pokročilého ovariálního karcinomu. Při zvýšené expresi Pgp/MDR mohou být taková léčiva za účasti transportní funkce Pgp předčasně vylučována z nádorových buněk, což může způsobit pokles účinku dané léčby.
V roce 1992 byl objeven druhý ABC transportér nazývaný multidrug resistance-associated protein (MRP, MRP1/ABCC1). MRP1 byl následně rozpoznán jako prototyp nové podskupiny transportérů, ze kterých MRP1 zůstává jako nejlépe charakterizovaný [3, 9]. Lung resistance protein (LRP) je další protein rezistence [20]. Biologická funkce exprese LRP v normálních i nádorových buňkách není zatím plně vysvětlena. Předpokládá se, že se podílí na intracelulární redistribuci léčiv. Počet léků asociovaných s LRP je podstatně menší než u Pgp a MRP1 a zahrnuje alkylační cytostatika jako melfalan, cyklofosfamid a platinové preparáty [13]. Nejdůležitější geny ABC transportních proteinů podílející se na lékové rezistenci zahrnují MDR1/ABCB1 (Pgp), několik členů z podskupiny MRP/ABCC a ABCG2 [7]. Úloha ABC transportérů v klinické rezistenci, a zejména rezistenci u chemonaivních pacientů se solidními nádory je stále předmětem mnoha diskusí.
Cílem této práce je zhodnocení proteinů rezistence LRP (Lung Resistance Protein), Pgp (P-glycoprotein), MRP1 (Multidrug Related Protein), MRP3 a MRP5 a jejich klinicko-patologického významu u pacientek s karcinomem ovaria. Zhodnocení hodnot sledovaných proteinů rezistence v závislosti na stadiu onemocnění, stupni diferenciace, histologickém typu, typu léčebné odpovědi a délce období do progrese onemocnění.
METODIKA A SOUBOR PACIENTEK
Stanovení proteinů rezistence LRP, PgP, MRP1, MRP3, MRP5
Proteiny rezistence LRP (Lung Resistance Protein), Pgp (P-glycoprotein), MRP1 (Multidrug Related Protein), MRP3 a MRP5 jsme stanovili standardním postupem dvoustupňovou imunohistochemií ve Fingerlandově ústavu patologie ve Fakultní nemocnici Hradec Králové. Materiál získaný při operaci byl po odběru rutinně fixován v 10% formalinu. Ve všech případech byl proveden standardizovaný odběr tkáně na histologické (a následné imunohistochemické) vyšetření. Byly odebrány vždy nejméně tři vzorky z nádoru (zpravidla 1 bloček na 1 cm nádoru) se zaměřením na pouzdro, popřípadě periferii tumoru. Tkáňové bločky byly dále zpracovány standardní histologickou technikou a zality do parafinu. Z každého bločku byly krájeny řezy o tloušťce 2–3 µm. Tyto řezy se použily jednak k rutinnímu barvení hematoxylinem-eozinem, jednak k imunohistochemickému vyšetření. Stanoven byl histologický typ nádoru a stupeň jeho diferenciace.
Parafinové bločky byly imunohistochemicky vyšetřeny za použití těchto primárních protilátek: Pgp (klon C494, LabVision, Fremont, USA, ředění 1 : 50), LRP (klon 9D6, LabVision, ředění 1 : 20), MRP1 (klon 33A6, Novocastra, Newcastle upon Tyne, United Kingdom, ředění 1 : 100), MRP3 (klon DTX 1, Novocastra, ředění 1 : 100) a MRP5 (klon 69, Novocastra, ředění 1 : 50). Antigeny Pgp, LRP, MRP1 a MRP5 byly demaskovány inkubací v citrátovém pufru (pH 6) při teplotě 95 °C po dobu 30 minut (Pgp a LRP), resp. 60 minut (MRP1 a MRP5). Protein MRP3 byl demaskován v pufru S 3308 (DakoCytomation, Glostrup, Dánsko) (pH 6)při teplotě 95 °C po dobu 60 minut. K imunohistochemickému vyšetření byla použita nepřímá imunohistochemická metoda s použitím avidin-biotinového vizualizačního systému EnVision+ (DakoCytomation).
Ve světelném mikroskopu pak byla kvantitativně hodnocena pozitivita reakce, tj. procento pozitivních (hnědě zbarvených) nádorových buněk: Pgp – membránová popř. i cytoplazmatická pozitivita, LRP – cytoplazmatická pozitivita, MRP1 – membránová, případně i cytoplazmatická pozitivita, MRP3 – membránová, případně i cytoplazmatická pozitivita, MRP5 – membránová a cytoplazmatická pozitivita (obr. 1, 2, 3, 4, 5).
Image 1. Difuzní cytoplazmatická pozitivita LRP (zvětšeno 400×) 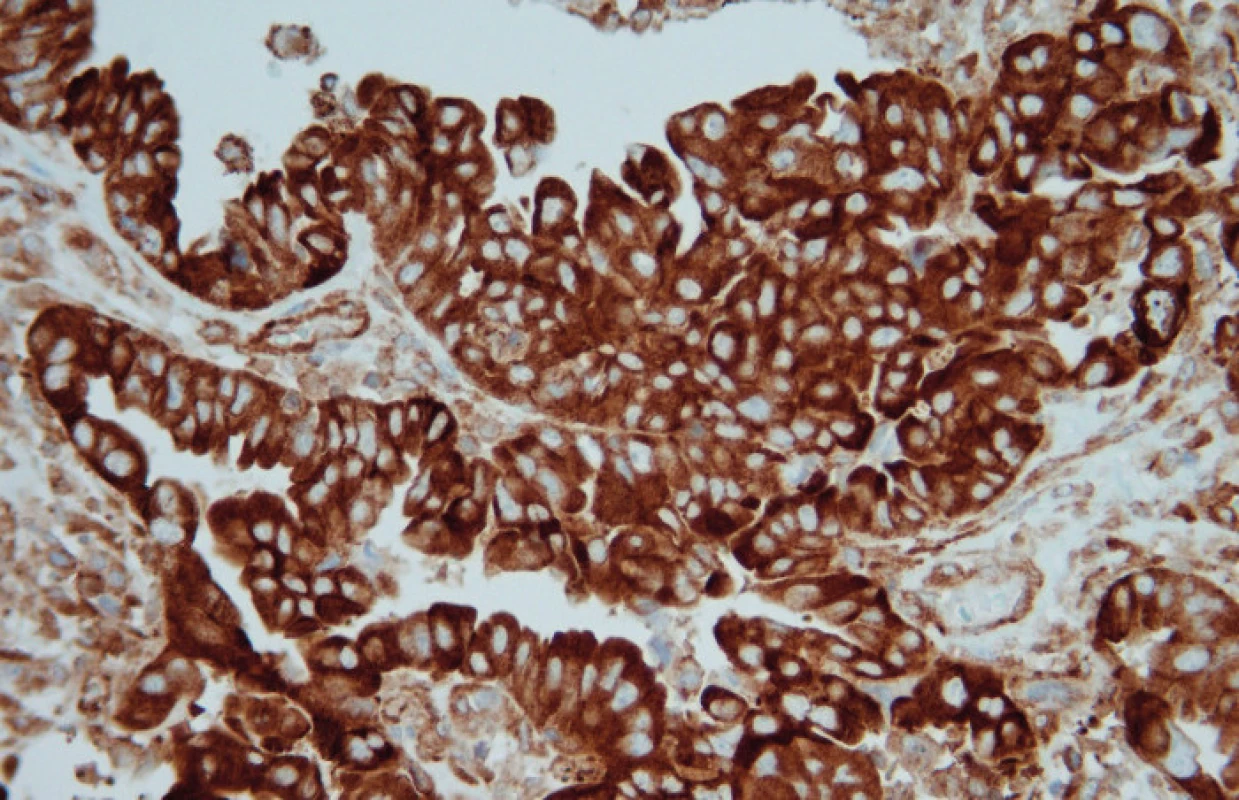
Image 2. Difuzní jaderná i cytoplazmatická pozitivita Pgp (zvětšeno 400×) 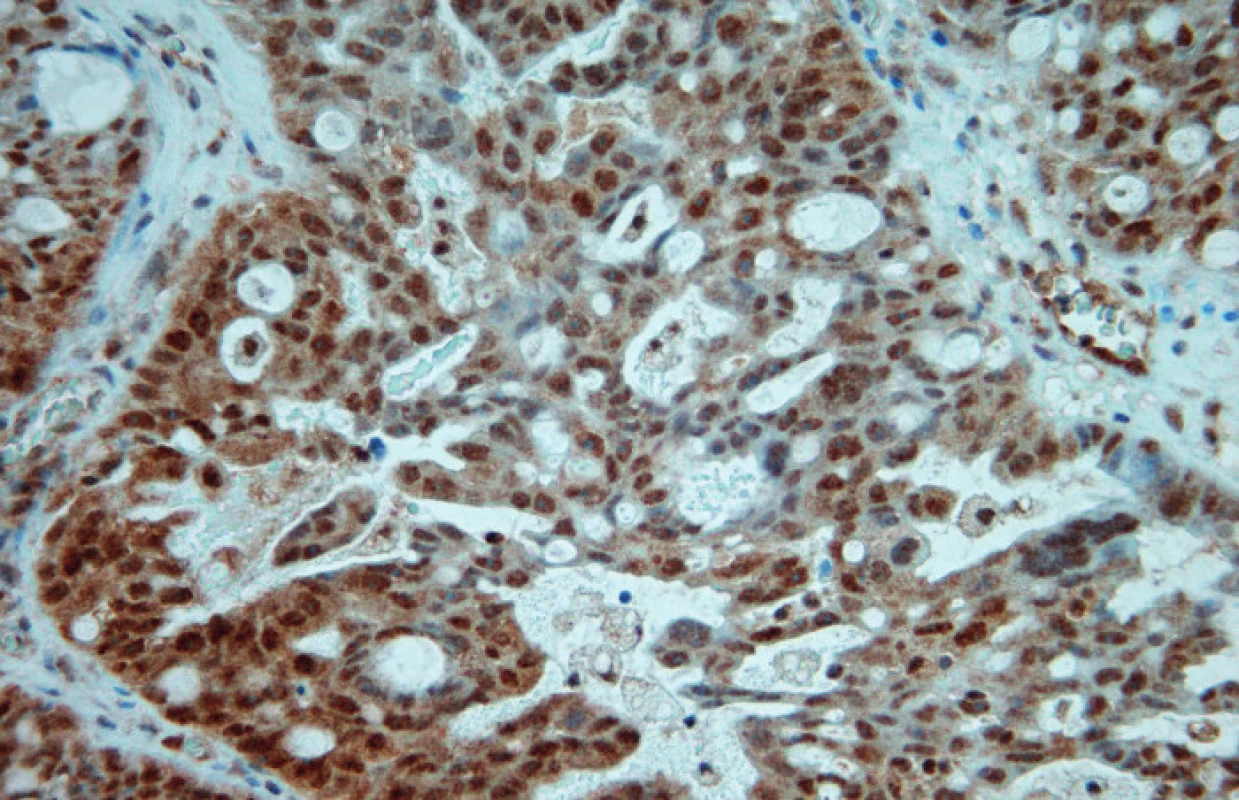
Image 3. Difuzní cytoplazmatická pozitivita MRP1 (zvětšeno 100×) 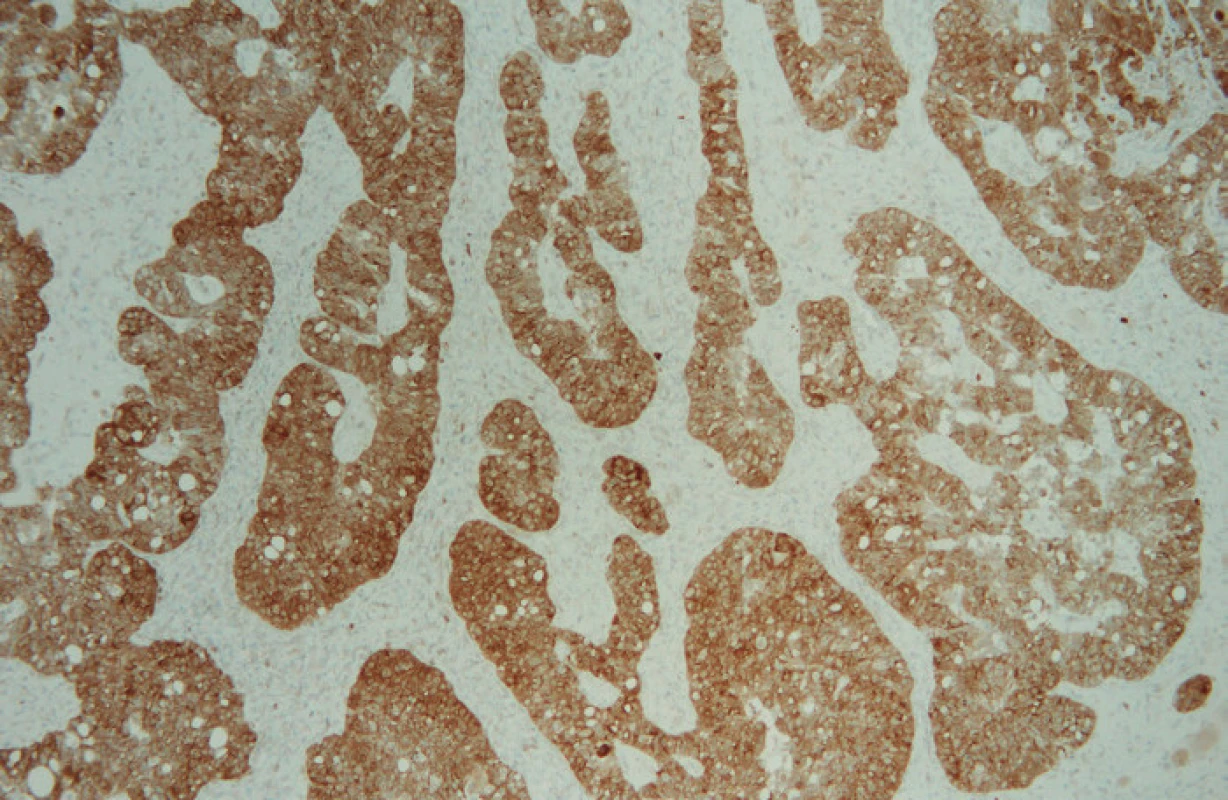
Image 4. Fokální cytoplazmatická pozitivita MRP3 (zvětšeno 100×) 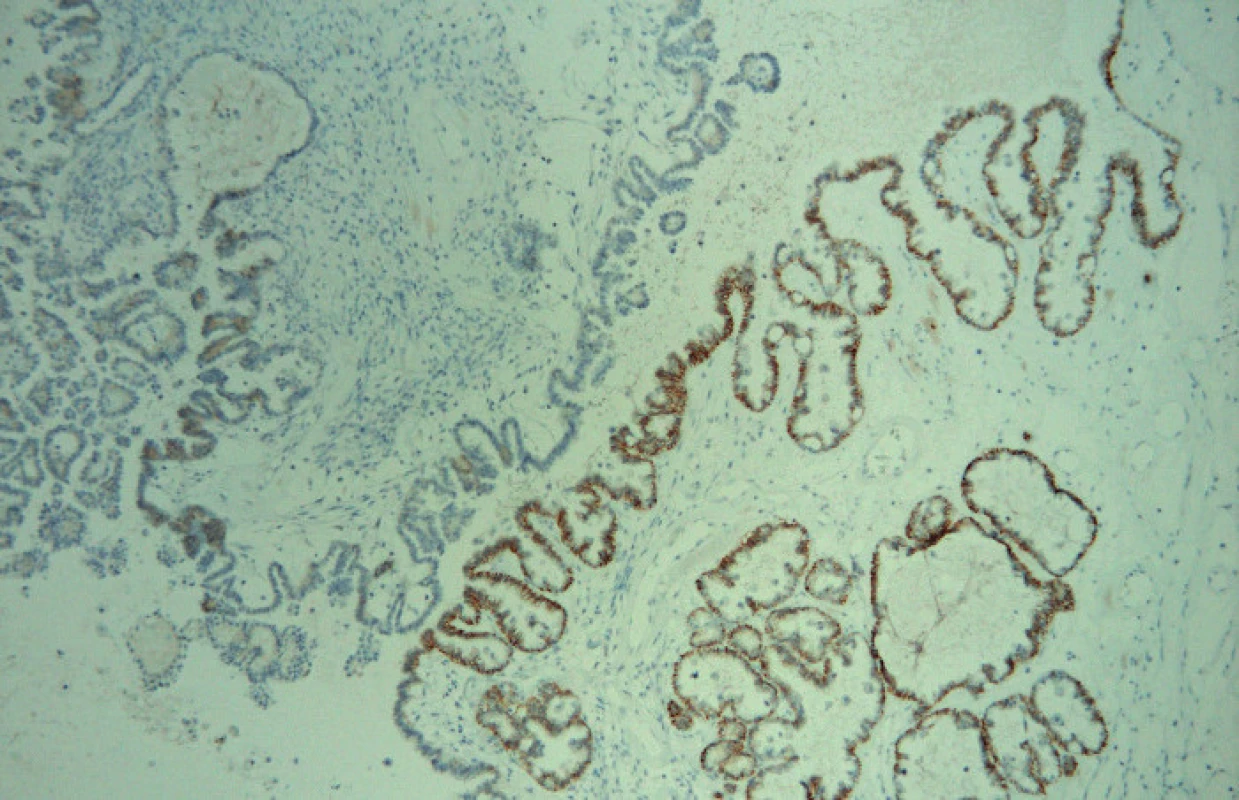
Image 5. Negativita MRP5 (zvětšeno 100×) 
Soubor pacientek
Stanovení proteinů rezistence (LRP, Pgp, MRP1, MRP3, MRP5) jsme provedli u 111 vzorků epiteliálních ovariálních karcinomů u pacientek operovaných na Porodnické a gynekologické klinice FNHK v letech 2006–2010 (tab. 1). Pacientky před danou operací neprodělaly chemoterapii ani žádnou jinou léčbu pro ovariální karcinom. Šlo o pacientky s nově zjištěným karcinomem ovaria – chemonaivní. Žádná z těchto pacientek nebyla v minulosti léčena pro jiný karcinom. Všechny pacientky měly před operací podepsaný informovaný souhlas s odběrem vzorků tkáně – schválený Etickou komisí FNHK. Celkem 83 pacientek z tohoto souboru dostalo podle současných doporučených standardů v rámci adjuvantní pooperační chemoterapie první linie6 cyklů kombinace paklitaxel (175 mg/m2) a karboplatina (AUC 5–6) a mělo zároveň dostatečné follow up pro sledování klinických parametrů.
Table 1. Charakteristika souboru 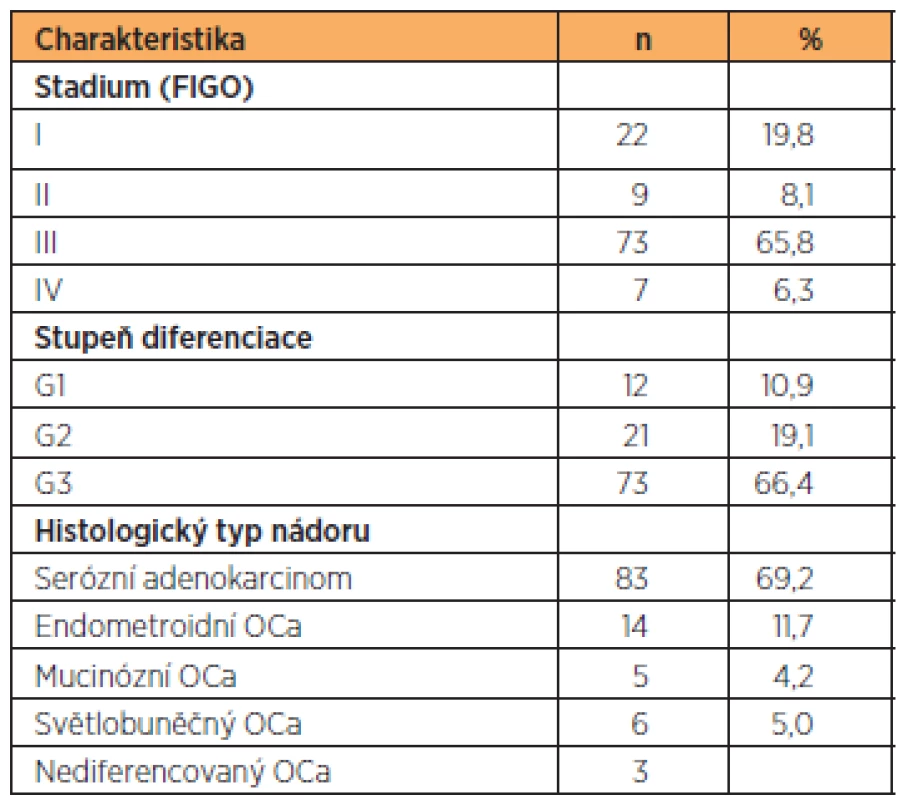
Průměrný věk testovaných pacientek byl 64,4 let (33–89 let). Stadium bylo stanoveno podle FIGO klasifikace (International Federation of Obstetrics and Gynecology). Za časné onemocnění jsme považovali stadium I+II a za pokročilé onemocnění stadium III+IV. Celkem bylo 22 pacientek se stadiem I, 9 pacientek se stadiem II, 73 pacientek se stadiem III a 7 pacientek se stadiem IV. Histopatologický typ ovariálního karcinomu byl stanoven podle WHO klasifikace (World Health Organization). Dobře diferencovaný ovariální karcinom v tomto souboru mělo 12 pacientek, 21 pacientek středně diferencovaný ovariální karcinom a 73 pacientek špatně diferencovaný karcinom ovaria. U 3 pacientek byl diagnostikován nediferencovaný ovariální karcinom. U 2 pacientek nebyl stupeň diferenciace určen. Serózní ovariální karcinom mělo 83 žen, mucinózní ovariální karcinom 5 pacientek, endometroidní ovariální karcinom mělo 14 pacientek a 6 žen mělo světlobuněčný ovariální karcinom. Pacientky s jinými histologickými typy ovariálního karcinomu ani borderline tumory jsme do této práce nezahrnuli.
Klinické údaje jsme zpětně dohledali z dokumentace pacientek. Minimální follow-up pro sledování klinických údajů bylo 2,5 roku. Deset pacientek z našeho souboru nesplňovalo požadavek minimálního follow up 2,5 roku, 9 pacientek dostalo chemoterapii na jiném pracovišti, 5 pacientek bylo diagnostikováno v časném stadiu a chemoterapii nedostávaly vůbec, 3 pacientky zemřely ještě před zahájením chemoterapie nebo v průběhu vlastního podání chemoterapie a 1 pacientka chemoterapii odmítla. Zhodnocení klinických údajů jsme tedy provedli u 83 pacientek z našeho souboru. Léčebnou odpověď na primární léčbu jsme hodnotili podle RECIST kritérií (RECIST 1.1). Typ léčebné odpovědi jsme stanovili na základě výsledků objektivního vyšetření, Ca 125, rtg plic a CT břicha po skončení chemoterapie první linie. Všechny pacientky s časným onemocněním(I + II) v našem souboru měly kompletní odpověď na primární léčbu. Kompletní odpověď na primární léčbu jsme zaznamenali celkem u 72 pacientek(prům. věk 62,44 let; min. 47, max. 80), částečnou odpověď na primární léčbu u 5 žen (pr. věk 67,8 let; min. 60, max. 80), „stable disease“ u jedné pacientky (56 let) a progresi onemocnění po skončení primární léčby u 5 žen z našeho souboru (pr. věk 65,0 let; min. 57, max. 70). Za délku PFS (progression free survival, období do progrese onemocnění) jsme hodnotili období od dosáhnutí kompletní remise onemocnění do objevení se recidivy, potvrzené laboratorně i zobrazovacími metodami.
Pro popis souboru byly použity deskriptivní metody statistiky. Pro hodnocení jsme použili průměrné hodnoty a pro stanovení míry rozptylu jsme využili 95% interval spolehlivosti (CI – confidence interval). Porovnání jednotlivých skupin bylo provedeno neparametrickým Mannovým-Whitneyho testem případně Kolmogorovovým-Smirnovovým testem v případě tří skupin byla použita Kruskalova–Wallisova neparametrická analýza rozptylu. Log-rank test pro porovnání Kaplanových-Meierových křivek pro PFS. Za statisticky významnou jsme považovali hladinu významnosti p < 0,05 a na hranici statistické významnosti p = 0,05–0,1.
VÝSLEDKY
Průměrný věk pacientek s epiteliálním ovariálním karcinomem byl 64,47 let (min. 33, max. 89).Při porovnání hodnot LRP, Pgp, MRP1, MRP3, MRP5 v závislosti na věku pacientek s využitím věkové hranice 50 let jsme nezaznamenali významné rozdíly. Pacientek ve věku nižším než 50 let bylo 12 a 99 žen bylo ve věku nad 50 let. Pouze Pgp byl nižší u pacientek ve věkové kategorii pod 50 let v porovnání s pacientkami nad 50 let věku (68 % vs. 89 %).
LRP, Pgp, MRP1 a MRP3 vykazovaly výrazné rozdíly hodnot v závislosti na histologickém typu ovariálního karcinomu (MRP1 p = 0,023, MRP3p = 0,056). Nejvyšší hodnoty LRP, Pgp, MRP1 a MRP3 u mucinózního ovariálního karcinomu v porovnání s ostatními histologickými typy jsme i přes malý počet v této skupině prokázali opakovaně. Nejnižší hodnoty jsme zjistili u endometroidního ovariálního karcinomu (tab. 2). Stupeň diferenciace významně ovlivnil pouze hodnoty MRP1, které narůstaly směrem od dobře diferencovaného ke špatně diferencovanému karcinomu ovaria (G1 60,83 % [CI 10–100], G2 36,80 % [CI 20–100], G3 88,87 % [CI 100–100], p = 0,039). Ostatní námi sledované proteiny se významně neměnily v závislosti na stupni diferenciace, a to ani v případě porovnání G1+G2 versus G3.
Table 2. Proteiny rezistence LRP, Pgp, MRP1, MRP3, MRP5 a histologický typ ovariálního karcinomu 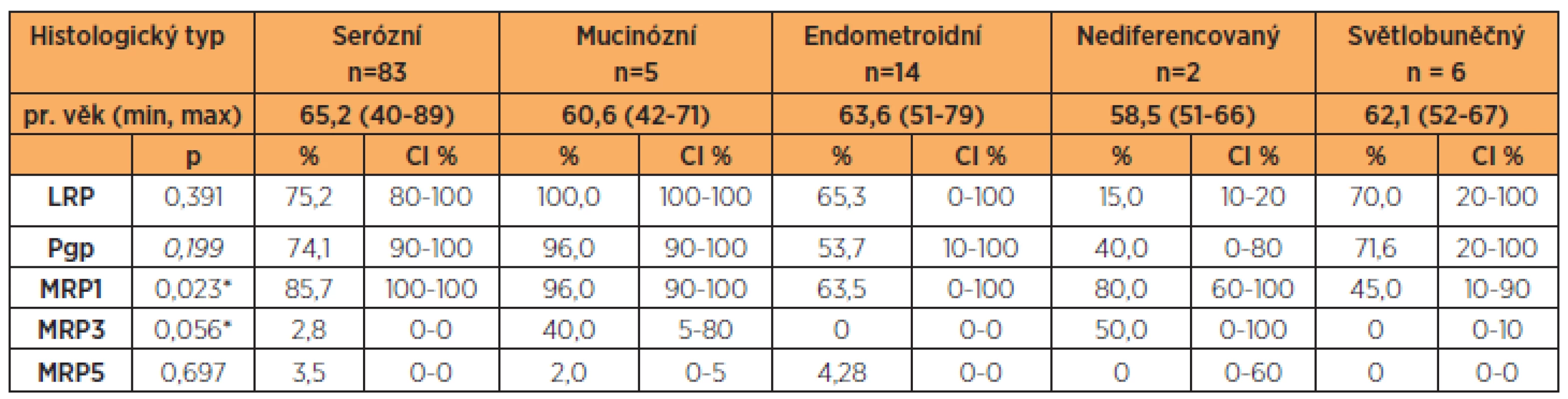
Prokázali jsme vztah proteinů rezistence s pokročilostí onemocnění. Nárůst MRP1 od časných stadií (I + II) k pokročilému onemocnění (III + IV) byl významný: I+II 71,6 % (CI 60–100), III+IV 83,6% (CI 100–100), (p = 0,03) (graf 1). LRP, Pgp, MRP3 a MRP5 nekorelovaly s pokročilostí onemocnění. Peroperační velikost nádoru ani velikost nádorového rezidua po primární operaci nevykazovaly vztah s žádným z námi sledovaných proteinů rezistence. Stejně tak jsme nezjistili významnější vztah mezi LRP, Pgp, MRP1, MRP3, MRP5 a výskytem trombocytopenie v průběhu podání chemoterapie první linie ve složení paklitaxel + karboplatina.
Graph 1. MRP1 a stadium onemocnění u pacientek s karcinomem ovaria (p = 0,03) 
Pro posouzení vztahu proteinů rezistence s klinickým průběhem onemocnění jsme zařadili do studie pouze pacientky, které dostaly 6 cyklů primární pooperační chemoterapie ve složení paklitaxel (175 mg/m2) a karboplatina (AUC 5–6). V této části jsme hodnotili pouze pacientky s dostatečným „follow up“, u kterých jsme mohli přesně dohledat data o klinickém průběhu onemocnění. Zvlášť jsme porovnávali skupinu pacientek se stadiem I + II a skupinu pacientek se stadiem III + IV. Ve skupině pacientek s časným onemocněním(I + II) dosáhly všechny pacientky po skončení primární léčby kompletní remise onemocnění (RECIST 1.1). Porovnávali jsme proteiny rezistence v jednotlivých kategoriích: kompletní odpověď(n = 72, pr. věk 62,2 let), částečná odpověď (n = 5, pr. věk 67,8 let), „stable disease“ (n = 1, 56 let), progrese onemocnění (n = 5, pr. věk 65,0 let). U LRP, Pgp a MRP1 narůstaly hodnoty postupně od nejnižších (u pacientek s kompletní odpovědí) po nevyšší (u pacientek s progresí onemocnění). Následně jsme porovnali skupinu pacientek s kompletní odpovědí versus ostatní pacientky. Pacientky s kompletní odpovědí na primární léčbu měly nižší hodnoty LRP, Pgp a MRP1 v porovnání s ostatními pacientkami (částečná odpověď, „stable disease“, progrese onemocnění). Nejvyšší hodnoty měly pacientky s prokázanou progresí onemocnění (tab. 3). U MRP3 a MRP5 jsme nezaznamenali významnější vztah k léčebné odpovědi u pacientek s ovariálním karcinomem.
Table 3. LRP, Pgp, MRP1, MRP3 a MRP5 a typ léčebné odpovědi (RECIST 1.1) 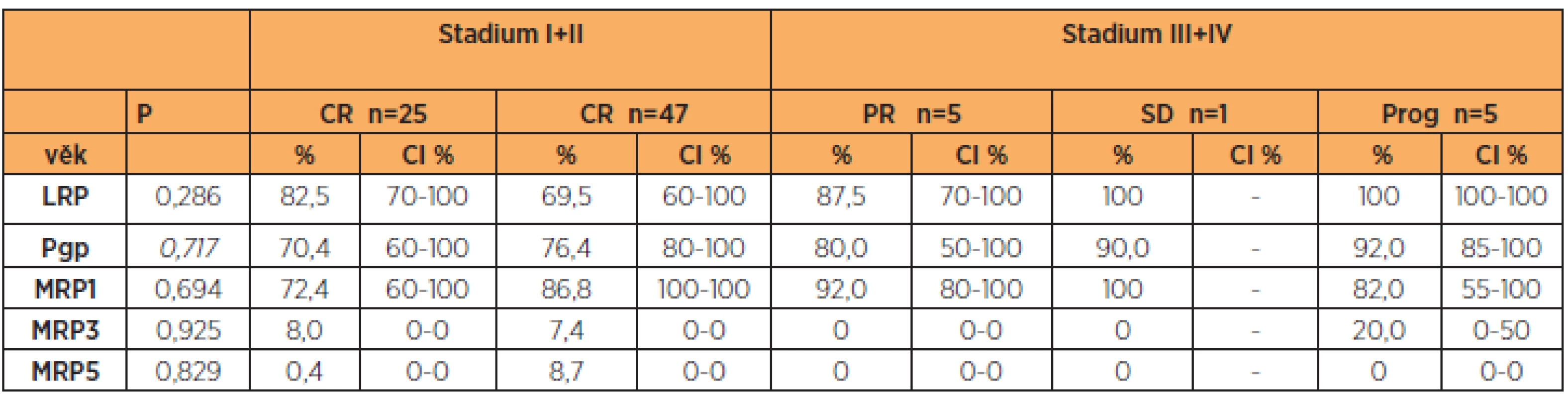
CR – kompletní odpověď, PR – částečná odpověď, SD – „stable disease“, Prog – progrese onemocnění Pacientky s vyššími hodnotami Pgp, MRP1, MRP3 měly také vyšší riziko recidivy. Pacientky s vysokou expresí Pgp a MRP1 měly významně kratší období do objevení se recidivy v porovnání s pacientkami s nízkou expresí těchto proteinů rezistence. LRP a MRP5 neměly vliv na výskyt recidivy ani na délku období do progrese onemocnění (PFS). Pro zhodnocení vztahu proteinů rezistence s délkou PFS jsme stanovili dvě kategorie pro Pgp a MRP1 < 85 % versus > 85 % a pro MRP3 kategorii 0 % versus ostatní. Rozdělení jsme stanovili vlastní, na základě posouzených dat, protože v dosud publikovaných studiích věnovaných hodnocení klinického významu proteinů rezistence Pgp a MRP1 nejsou rozdělení jednotná a nalezení odpovídajících kategorií je stále předmětem výzkumu. Hodnotili jsme délku PFS (progression free survival, období do progrese onemocnění) u skupiny pacientek s hodnotou Pgp a MRP1 vyšší než 85 % se skupinou pacientek s hodnotou Pgp a MRP1 menší než 85 %. Medián délky PFS byl statisticky významně kratší u skupiny pacientek s Pgp a MRP1 nad 85 % v porovnání s pacientkami s hodnotami těchto proteinů rezistence pod 85 % (Kaplanův-Meierův test pro PFS, Pgp < 85 % Med PFS 23 měs. (CI 8–37) vs > 85 % Med PFS 11 měs. (CI 7–17), p = 0,054), (MRP1 < 85 % Med PFS 33 měs. (CI 11–49) vs > 85 % Med PFS 11 měs. (CI 7–16), p = 0,046) (graf 2, 3). Na hranici statistické významnosti jsme nalezli kratší délku PFS u skupiny pacientek s nulovou expresí MRP3 v porovnání se skupinou žen s vyšší hodnotou MRP3 (= 0 % Med PFS 11 měs. (CI 9–17) vs > 0 % Med PFS 37 měs. (CI 19–37), p = 0,062) (graf 4).
Graph 2. Kaplanova-Meierova křivka přežití pro DFI – P-glykoprotein (Pgp) (p=0,054) Pgp < 85 % versus > 85% 
Graph 3. Kaplanova-Meierova křivka pro DFI – Multidrug Related Protein 1 ( MRP1) MRP1 < 85 % versus > 85% 
Graph 4. Kaplanova-Meierova křivka pro DFI - Multidrug Related Protein 3 ( MRP3) MRP3 = 0 % versus > 0% 
DISKUSE
Chemorezistence je hlavním klinickým problémem současné systémové léčby pacientek s karcinomem ovaria. Proteiny rezistence LRP, Pgp, MRP se podílejí na vzniku chemorezistence. Z dosud publikovaných prací věnovaných proteinům rezistence vyplývají nejednotná data. Problematika vzniku primární chemorezistence ovariálního karcinomu není stále jednoznačně objasněna. Z toho důvodu jsou velmi přínosné práce studující podstatu primární chemorezistence na konkrétních vzorcích nádorové tkáně od jednotlivých pacientek, a ne na vypěstovaných uniformních buněčných liniích. Ačkoli nově zkoumaná cytostatika nevedou k významnému prodloužení přežití, zůstává chemoterapie stále základem systémové léčby ovariálního karcinomu. I v případě klinických studií jsou nové typy následné primární léčby (biologická léčba, imunoterapie) podávány zatím „pouze“ v kombinaci s primární chemoterapií. Stanovení chemorezistence by mohlo přispět k predikci pacientek primárně nevhodných k současné standardní primární chemoterapii a následné individualizaci systémové léčby u pacientek s karcinomem ovaria.
V této studii jsme stanovili proteiny rezistence LRP, Pgp, MRP1, MRP3, MRP5. Takto komplexní zhodnocení proteinů rezistence z jednotlivých vzorků ovariálních karcinomů u pacientek s jedním typem chemoterapie nebylo dosud publikováno. Data ohledně klinického významu proteinů MRP3 a MRP5 u ovariálního karcinomu jsou ojedinělá. Zjistili jsme velmi významné rozdíly hodnot zejména LRP, Pgp, MRP1 a MRP3 u jednotlivých histologických typů ovariálního karcinomu. I přes malý počet pacientek s mucinózním ovariálním karcinomem jsme zaznamenali opět nejvyšší hodnoty LRP, Pgp, MRP1 a MRP3 v porovnání s ostatními histologickými typy. Přestože v našem souboru šlo o malou skupinu pacientek s mucinózním ovariálním karcinomem, mohla by tím být vysvětlena klinicky špatná odpověď pa-cientek s tímto histologickým typem ovariálního karcinomu na primární chemoterapii ve složení paklitaxel + karboplatina. Na druhé straně nejnižší hodnoty proteinů rezistence jsme zaznamenali u endometroidního ovariálního karcinomu. I zde můžeme najít korelaci s klinickým průběhem, protože endometroidní ovariální karcinom většinou dobře odpovídá na standardní chemoterapii první linie. Různé zastoupení proteinů rezistence u jednotlivých histologických typů ovariálního karcinomu potvrzuje různorodost chování jednotlivých histologických typů ovariálního karcinomu včetně odlišné odpovědi na jeden typ primární chemoterapie. Právě zastoupení proteinů rezistence může mít velký význam v úspěšnosti následné systémové léčby pacientek s ovariálním karcinomem.
Pacientky s karcinomem prsu s vysokou expresí Pgp/MDR léčené antracykliny nebo taxany přežívaly kratší dobu než pacientky léčené jinými režimy [22]. Izquierdo et al. sledovali expresi LRP, MRP a Pgp u ovariálních karcinomů. Pouze LRP prokázali jako independentní prognostický faktor odpovědi na chemoterapii a přežití [14]. Goff et al. naopak nezaznamenali rozdíl hodnot LRP a MRP u pacientek chemosenzitivních a chemorezistentních [8]. Další studie u ovariálního karcinomu taktéž neprokázala význam exprese LRP ve vztahu k léčebné odpovědi u pacientek s karcinomem ovaria [2]. Naše výsledky ukazují malý klinický význam LRP u pacientek s karcinomem ovaria.
Materna et al. prokázali prognostický význam Pgp a MRP2 u pacientek s karcinomem ovaria [16]. Pro posouzení významu míry exprese Pgp pro predikci úspěšnosti chemoterapie je rozhodujícím faktorem výběr cytostatika. V případě použití cytostatik, která jsou substráty Pgp, např. taxany, existuje předpoklad, že terapie může vést ke vzniku mnohočetné lékové rezistence. Díky případně zvýšené expresi Pgp mohou být taková léčiva za účasti transportní funkce Pgp předčasně vylučována z nádorových buněk, což může způsobit pokles účinku léčby [22]. Data o významu Pgp u ovariálního karcinomu jsou zatím nejvíce prozkoumána, ale stále jsou nejednotná. V devadesátých letech v začátcích intenzivnějšího sledování exprese MDR/Pgp u solidních nádorů byly publikovány práce, které u nepředléčených ovariálních karcinomů nenalezly žádnou expresi [5] nebo velmi nízkou expresi tohoto proteinu [10, 18]. To je zcela v kontroverzi s našimi závěry, kdy opakovaně prokazujeme u naprosté většiny ovariálních karcinomů určitou míru exprese proteinů rezistence u chemonaivních pacientek. Tedy u pacientek bez jakékoli předchozí chemoterapeutické léčby [19]. Při porovnání hodnot MDR v nádorové tkáni a párových vzorcích okolní přiléhající nenádorové tkáně bez morfologicky detekovaných nádorových buněk u pacientek s karcinomem prsu byla nalezena indukce exprese MDR po podání chemoterapie i v nenádorové tkáni [22]. Starší studie neprokázaly prognostický význam Pgp pro počáteční odpověď na chemoterapii [2, 12, 14]. Novější práce v souladu s našimi výsledky prokázaly negativní korelaci exprese Pgp s léčebnou odpovědí u pacientek s karcinomem ovaria [10, 16, 23]. Zcela určitě zde bude velmi významně ovlivňovat výsledky i použitá metodika ke stanovení exprese.
Exprese MRP byla prokázána u více než dvou třetin epiteliálních ovariálních karcinomů [1, 14]. Izquierdo et al. nalezli expresi MRP u 68 % epiteliálních ovariálních karcinomů stadia III/IV a exprese byla limitována hlavně v cytoplazmatické membráně [14]. Goff et al. zjistili expresi MRP u 66 % epiteliálních ovariálních karcinomů [8], nezaznamenali však asociaci s chemorezistencí. Tyto výsledky potvrdily i další studie, které nenalezly významný vztah mezi expresí MRP a chemorezistencí ovariálního karcinomu [1, 2, 14]. Yakirevich et al. nalezli statisticky významnou korelaci mezi silnou expresí Pgp a kratším přežitím u pacientek s karcinomem ovaria. Delší interval přežití měly pacientky Pgp negativní v porovnání s ženami s Pgp pozitivním tumorem. MRP1 a LRP podle jejich výsledků neměly vliv na délku přežití [23].
ZÁVĚR
Prokázali jsme klinický význam stanovení LRP, Pgp, MRP1 a MRP3 u pacientek s karcinomem ovaria. MRP5 podle našich výsledků vůbec nekoreluje se základními histopatologickými vlastnostmi ani s průběhem onemocnění u pacientek s karcinomem ovaria. Z našich dat se z proteinů rezistence ukazuje jako nejperspektivnější prediktivní a prognostický faktor u pacientek s karcinomem ovaria MRP1.
Tento projekt vznikl za podpory grantu NT 14107 IGA MZ CR.
MUDr. Iva Sedláková, Ph.D.
Porodnická a gynekologická klinika FN
Sokolská 581
500 05 Hradec Králové
iva.sedlakova@ fnhk.cz
Sources
1. Arao, S., Suwa, H., Mandai, M., et al. Expression of multidrug resistance gene and localization of P-glycoprotein in human primary ovarian cancer. Cancer Res, 1995, vol. 54, p. 1355–1359.
2. Arts, HJ., Katsaros, D., de Vries, FG., et al. Drug resistance-associated markers P-glycoprotein, multidrug resistance-associated protein 1, multidrug resistance-associated protein 2, and lung resistance protein as prognostic factors in ovarian carcinoma. Clin Cancer Res, 1999, 5, p. 2798–2805.
3. Borst, P., Evers, P., Kool, M., Wijnholds, J. A family of drug transporters: the multidrug resistance-associated proteins. J Natl Cancer Inst, 2000, 92, p. 1295–1302.
4. Cibula, D., Petruželka, L., a kol. Onkogynekologie, 1. vyd. Praha: Grada Publishing, 2009.
5. Codegoni, AM., Broggini, M., Pitelli, MR., et al. Expression of genes of potential importance in the response to chemotherapy and DNA repair in patients with ovarian cancer. Gynecol Oncol, 1997, 65, p. 130–137.
6. Fruehauf, PJ., Alberts, DS. In vitro drug resistance versus chemosensitivity: two sides of different coins. J Clin Oncol, 2005, 23, p. 3641–3643.
7. Glavinas, H., Krajcsi, P., Cserepes, J., et al. The role of ABC transporters in drug resistance, metabolism and toxicity. Curr Drug Deliv, 2004, 1, p. 27.
8. Goff, AB., Paley, JP., Greer, EB., Grown, MA. Evaluation of chemoresistance markers in women with epithelial ovarian carcinoma. Gynecol Oncol, 2001, 81, p. 18–24.
9. Gottesman, MM., Fojo, T., Bates, SE. Multidrug resistance in cancer: role of ATP-dependent transporters. Nat Rev Cancer, 2002, 2, p. 48–58.
10. Holzmayer, TA., Hilsenbeck, S., Von Hoff DD., Roninson, IB. Clinical correlates of MDR1 (P-glycoprotein) gene expression in ovarian and small-cell lung carcinomas. J Natl Cancer Inst, 1992, 84, p. 1486–1491.
11. Charpin, C., Vielh, P., Duffaud, F. et al. Quantitative immunocytochemical assays of P-glycoprotein in breast carcinomas: correlation to messenger RNA expression and to immunohistochemical prognostic indicators. J Natl Cancer Inst, 1994, 86, p. 1539–1545.
12. Ikeda, K., Sakai, K., Yamamoti, R., et al. Multivariate analysis for prognostic significance of histologic sybtype, GST-pi, MDR-1, and p-53 in stages II–IV ovarian cancer. Int J Gynecol Cancer, 2003, 13, p. 776–784.
13. Izquierdo, MA., Schoemaker, RH., Flens, MJ., et al. Over-lapping phenotypes of multidrug resistance among panels of human cancer-cell lines. Int J Cancer, 1996, 65, p. 230–237.
14. Izquierdo, M.A., van der Zee, AG., Vermorken, JB., et al. Drug resistance-associated marker LRP for prediction of response to chemotherapy and prognosis in advanced ovarian carcinoma.J Natl Cancer Inst, 1995, 87, p. 1230–1237.
15. Kuwano, M., Uchiumi, T., Hayakawa, H., et al. The basic and clinical implications of ABC transporters, Y-box-binding protein-1 and angiogenesis-related factors in human malignancies. Cancer Sci, 2003, 94, p. 9–14.
16. Materna, V., Pleger, J., Hoffmann, U., Lage, H. RNA--expression of MDR1/P-glycoprotein, DNA-topoisomerase I, and MRP2 in ovarian carcinoma patients: correlation with chemotherapeutic response. Gynecol Oncol, 2004, 94, p. 152–160.
17. Nosková, V., Hajdúch, M., Mihál, V., Cwiertka, K. Mechanismy mnohočetné lékové rezistence a jejich význam pro klinickou praxi. Klin Onkol, 2000, 13, s. 4–9.
18. Rubin, SC., Finstad, CL., Hoskins, WJ., et al. Expression of P-glycoprotein in epithelial ovarian cancer: evaluation as a marker of multidrug resistance. Am J Obstet Gynecol, 1990, 163, p. 69–73.
19. Sedláková, I., Laco, J., Tošner, J., et al. Proteiny rezistence a chemorezistence u pacientek s karcinomem ovaria. Klin Onkol, 2012, 25, p. 457–463.
20. Scheffer, GL., Wijngaard, PL., Flens, MJ., et al. The drug resistance related protein LRP is the human major vault protein. Nat Med, 1995, 1, p. 578–582.
21. Schinkel, AH. P-Glycoprotein, a gatekeeper in the blood-brain barier. Adv Drug Deliv Rev, 1999, 36, p. 179–194.
22. Václavíková, R., Hubáčková, M., Kubala, E., et al. Exprese genu mnohočetné lékové rezistence 1 (MDR1) a její význam v rozvoji a terapii karcinomu prsu. Klin Onkol, 2007, 3, p. 253–259.
23. Yakirevich, E., Sabo, E., Naroditsky, I., et al. Multidrug resistance-related phenotype and apoptosis-related protein expression in ovarian serous carcinomas. Gynecol Oncol, 2006, 100, p. 152–159.
Labels
Paediatric gynaecology Gynaecology and obstetrics Reproduction medicine
Article was published inCzech Gynaecology

2013 Issue 6-
All articles in this issue
- Lze považovat i na začátku třetího tisíciletí primární karcinom vejcovodu za enigma?
- Management předčasného odtoku plodové vody s ohledem na zánětlivé komplikace – naše zkušenosti
- Hypersenzitivní reakce po podání karboplatiny a paklitaxelu – naše pětileté zkušenosti
- Jaký je aktuální stav diagnostiky vulvovaginálního dyskomfortuv České republice? Pilotní analýza
- Vezikouterinní vlasová píštěl osm let po císařském řezu – kazuistika
- Variabilita v načasování dělení lidských embryí monitorovaných systémem time-lapse v závislosti na věku pacientky
- Je diabetes mellitus rizikový faktor kvasinkového poševního zánětu?
- Proteiny rezistence LRP, Pgp,MRP1, MRP3 a MRP5 u pacientek s karcinomem ovaria
- Transuretrální aplikace polyacrylamid hydrogelu (Bulkamidu®) při léčbě ženské stresové inkontinence močia změny léčebného efektu v závislosti na čase od operace
- Incidence, etiologie a klinický význam trombocytopenie v graviditě
- Epidemiologie, etiologie a diagnostika nykturie
- Postup u předčasného porodu s plodem na hranici viability (22.-25. týden) těhotenství
- Vliv způsobu porodu na ženskou sexualitu
- Czech Gynaecology
- Journal archive
- Current issue
- Online only
- About the journal
Most read in this issue- Postup u předčasného porodu s plodem na hranici viability (22.-25. týden) těhotenství
- Management předčasného odtoku plodové vody s ohledem na zánětlivé komplikace – naše zkušenosti
- Hypersenzitivní reakce po podání karboplatiny a paklitaxelu – naše pětileté zkušenosti
- Vliv způsobu porodu na ženskou sexualitu
Login#ADS_BOTTOM_SCRIPTS#Forgotten passwordEnter the email address that you registered with. We will send you instructions on how to set a new password.
- Career

