-
Medical journals
- Career
PERI-IMPLANTITÍDA: KLASIFIKÁCIA, ETIOLÓGIA A PREVENCIA
Authors: M. Štefanatný 1,2; M. Starosta 3; R. Žižka 2; J. Štefanatná 1; Š. Belák 1
Authors‘ workplace: Blanc Dental Studio, Žilina, Slovensko 1; Klinika zubního lékařství, Lékařská fakulta Univerzity Palackého v Olomouci, a Fakultní nemocnice Olomouc 2; Stomatologická klinika, Univerzita Karlova, 1. lékařská fakulta, a Všeobecná fakultní nemocnice v Praze 3
Published in: Česká stomatologie / Praktické zubní lékařství, ročník 123, 2023, 1, s. 19-28
Category: Review Article
doi: https://doi.org/10.51479/cspzl.2022.012Naratívny prehľadový článok
Overview
Úvod a cieľ: Cieľom článku je predstaviť novú klasifikáciu ochorení peri-implantátových tkanív. Súčasne tiež zhrnúť doterajšie poznatky v etiológii a prevencii ochorení postihujúcich tkanivá v okolí dentálnych implantátov (DI).
Materiál a metodika: Prebehlo vyhľadanie odborných článkov publikovaných v databázach PubMed-MEDLINE, Scopus, EMBASE a Google Scholar nasledované ručným dohľadaním. Do analýzy boli zavzaté klinické štúdie, prehľadové články a konsenzuálne články ohľadom peri-implantátových tkanív, ich zdravia a ochorení, publikované v anglickom jazyku v rozmedzí rokov 1990–2021.
Záver: V prípade, že poznáme všetky rizikové faktory vzniku ochorení peri-implantátových tkanív, je viac než na mieste, aby prvým krokom pred zavedením DI bol správny výber pacienta. DI by sme v žiadnom prípade nemali zavádzať u pacientov s aktívnou parodontitis a je potrebné pracovať najskôr na jej stabilizácii, až následne na ošetrení chýbajúcich zubov pomocou DI. V prípade výskytu ďalších rizikových faktorov, ako diabetes mellitus alebo fajčenie, by sme mali byť ostražití a dôkladne zvážiť aj iné možnosti náhrady chýbajúcich zubov ako len pomocou DI. Následná starostlivosť o pacienta po zavedení DI v podobe podpornej peri-implantátovej liečby by mala začať okamžite po ošetrení a opakovať sa v pravidelných intervaloch.
Klíčová slova:
mukozitida – dentálny implantát – peri-implantitída – supportive implant therapy
ÚVOD
Dentálne implantáty (DI) sa stali čoraz populárnejším spôsobom liečby náhrady chýbajúcich alebo stratených zubov. Zubné implantáty majú vysokú mieru dlhodobého prežitia [1–4] a používajú sa na podporu rôznych typov zubných náhrad. Napriek tomu v posledných desaťročiach pribúdajú dôkazy o existencii peri-implantátových zápalov, ktoré predstavujú jedny z najčastejších komplikácií ovplyvňujúcich okolité mäkké aj tvrdé tkanivá. Pri dlhodobom trvaní a progresii zápalu peri - -implantátových tkanív môže dôjsť až k strate DI. Treba si tiež uvedomiť, že dlhodobé prežitie DI neznamená to isté čo dlhodobý úspech [5]. Tak DI, ako aj suprakonštrukcie nimi nesené, môže postihnúť množstvo biologických a mechanických komplikácií [6].
Biologické komplikácie sa týkajú hlavne zápalových stavov spojených s bakteriálnym ochorením [7–9]. Už v roku 1994 boli Albrektssonom a Isidorom definované dve zápalové ochorenia postihujúce tkanivá okolo DI [10]. Zatiaľ čo peri-implantátová mukozitída bola definovaná ako reverzibilná zápalová reakcia mäkkých tkanív v okolí implantátu, peri-implantitídu charakterizovali zápalové reakcie spojené so stratou podpornej kosti. Táto definícia vydržala takmer nezmenená dodnes.
Cieľom nášho prehľadového článku je predstaviť novú klasifikáciu ochorení peri - -implantátových tkanív a začleniť ju do vývoja chápania a klasifikácie ochorení týkajúcich sa DI. Súčasne sa snažíme zhrnúť doterajšie poznatky v etiológii a prevencii ochorení postihujúcich tkanivá v okolí DI. Ich pochopenie je nevyhnutnou podmienkou nielen pre správnu indikáciu a zavedenie DI, ale aj pre terapiu možných peri-implantátových ochorení.
MATERIÁL A METODIKA
Za účelom zaistenia podkladov pre tento naratívny prehľadový článok prebehlo systematické vyhľadanie relevantných článkov z troch elektronických databáz: Scopus (https://www.scopus.com/home.uri), PubMed (https://pubmed.ncbi.nlm.nih.gov/) a Embase (https://www.embase.com/). Zohľadnili sme iba klinické štúdie, prehľadové články a konsenzuálne články publikované v anglickom jazyku, a to od roku 1990 do roku 2021. Vyhľadanie prebehlo (M. Š.) s využitím kľúčových slov: (periimplantitis OR peri-implantitis OR mucositis OR supportive implant therapy) AND (etiology OR prevention OR classification). Za účelom vyhľadania publikácií z konferencií a inej „šedej literatúry“ prebehlo vyhľadanie cez Google Scholar. Taktiež boli ručne prehľadané zoznamy citácií už vyhľadaných článkov a konsenzov [11, 12, 13].
KLASIFIKÁCIA
Na svetovom workshope konanom v novembri 2017 v Chicagu, USA, bola stanovená nová klasifikácia pre ochorenia a stavy peri-implantátových tkanív. Boli definované zdravé peri-implantátové tkanivá [11], peri-implantátová mukozitída [12], peri-implantitída [13] a defekty mäkkých a tvrdých peri-implantátových tkanív. Vynaložilo sa úsilie na preskúmanie všetkých aspektov zdravia a chorôb okolo implantátov, aby sa dosiahol konsenzus a vznikla klasifikácia, ktorá by mohla byť akceptovaná na celom svete (tab. 1).
Table 1. Klasifikácia peri-implantátotvých chorôb a stavov.
Tab. 1 Classification of peri-implant diseases and conditions.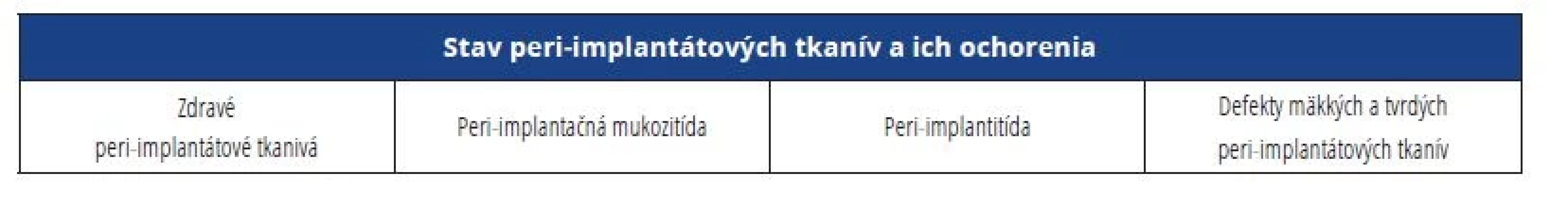
ZDRAVÉ PERI-IMPLANTÁTOVÉ TKANIVÁ (obr. 1)
Image 1. Zdravé peri-implantátové tkanivá.
Fig. 1 Peri-implant health.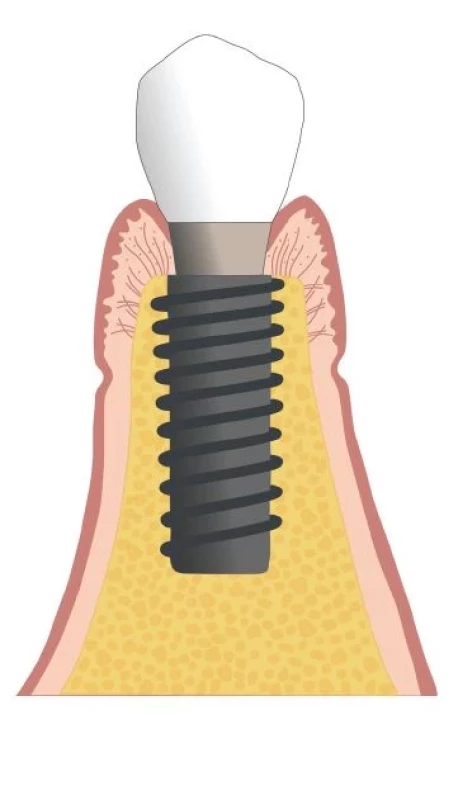
(Autor/author MDDr. Jana Štefanatná) Zdravie tkanív okolo implantátu definujú dve základné zložky, zložka mäkkých tkanív a zložka tvrdých tkanív. Zložka mäkkých tkanív, nazývaná tiež peri-implantátová sliznica, je formovaná hojením po zavedení DI / protetického komponentu. V prípade otvoreného hojenia je to okamžite v deň implantácie, v prípade uzavretého hojenia až v deň druhej chirurgickej fáze. Jej hlavná úloha je ochrana kostného tkaniva, ktorého význam spočíva v mechanickej podpore DI. Zdravá sliznica meraná od slizničného okraja po hrebeň peri-implantátovej kosti je vysoká 3–4 mm. Plocha sliznice naliehajúca ku krčkovej časti DI a abutmentu je rozdelená na koronárny a apikálny segment. Koronárny segment je lemovaný tenkým bariérovým a sulkulárnym epitelom. V apikálnom segmente je spojivo v priamom kontakte s povrchom implantátu [11]. Tomasi ukázal, že rozmer koronárneho segmentu je približne 2 mm a rozmer apikálneho segmentu 1,5 mm [14]. Táto bariéra mäkkých tkanív so sumárnym rozmerom približne 3,5 mm, nachádzajúca sa u každého implantátu, sa tiež označuje ako suprakrestálne pripojené tkanivá. Používa sa pre nich tiež termín biologická šírka (z angl. BW = biological width) [11, 15] (obr. 2). Toto kombinované spojenie väziva a bariérového epitelu k povrchu DI a abutmentu sa objavuje už po 6–8 týždňoch od jeho zavedenia [16]. Po tomto období ostáva adhézia mäkkých tkanív takmer bez zmeny a dá sa teda predpokladať, že nastala homeostáza.
Image 2. Suprakrestálne pripojené tkanivá.
Fig. 2 Supracrestal tissue attachment.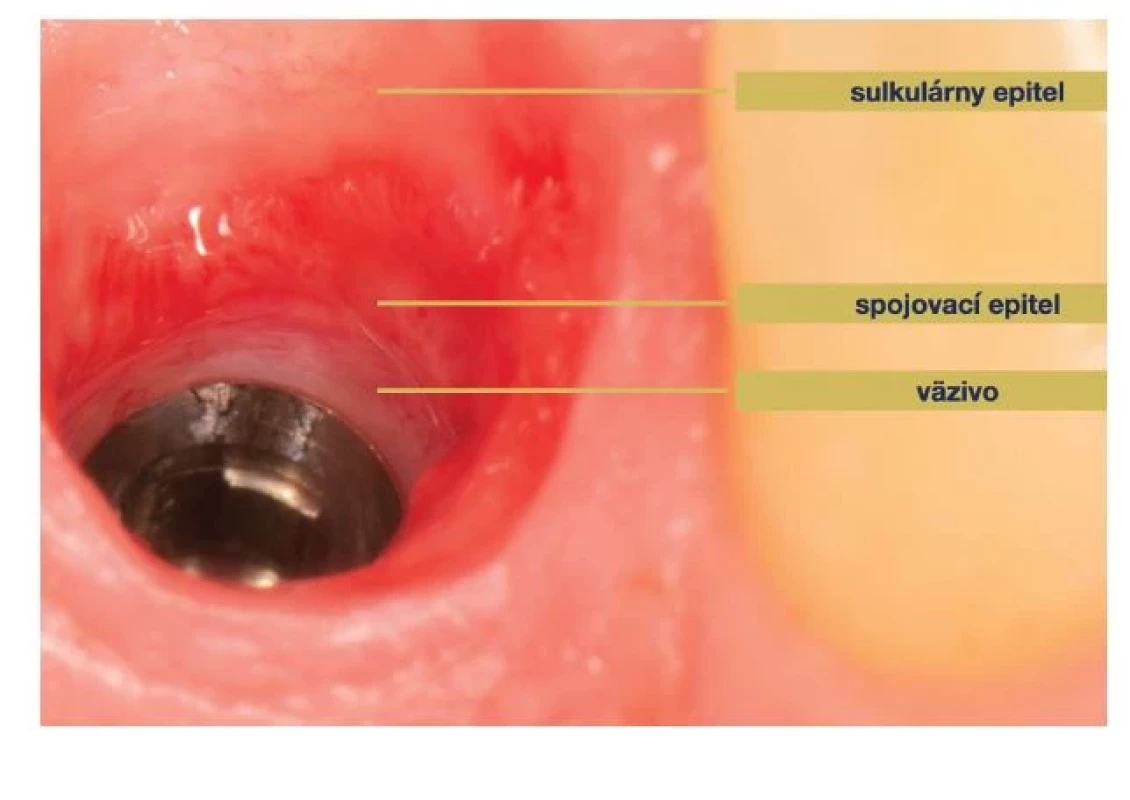
(Autor/author MDDr. Michal Štefanatný) Klinická diagnostika zdravých periimplantátových tkanív podľa Renverta [17]:
1. Vizuálna inšpekcia – absencia znakov zápalu.
2. Absencia profúzneho (kvapka alebo línia) krvácania po sondáži.
3. Hĺbka sondáže – závisí na výške mäkkých tkanív v lokalizácii DI. Nemala by sa v čase zvyšovať.
4. Absencia straty kosti po iniciálnom hojení – menšia ako 2 mm.
PERI-IMPLANTÁTOVÁ MUKOZITÍDA
Heterogenita definičných kritérií peri-implantátovej mukozitíty bola behom posledných rokov veľmi veľká [17] (tab. 2). Aj keď by sa na prvý pohľad mohlo zdať, že medzi mukozitídou v okolí implantátov a gingivitídou v okolí zubov nie sú rozdiely, nejde o jedno a to isté ochorenie (tab. 3).
Table 2. Definičné kritériá peri-implantátovej mukozitídy.
(BOP = bleeding on probing, krvácanie po sondáži; PD = probing depth, hĺbka sondáže)
Tab. 2 Definition criteria of peri-implant mucositis.
(BOP = bleeding on probing; PD = probing depth)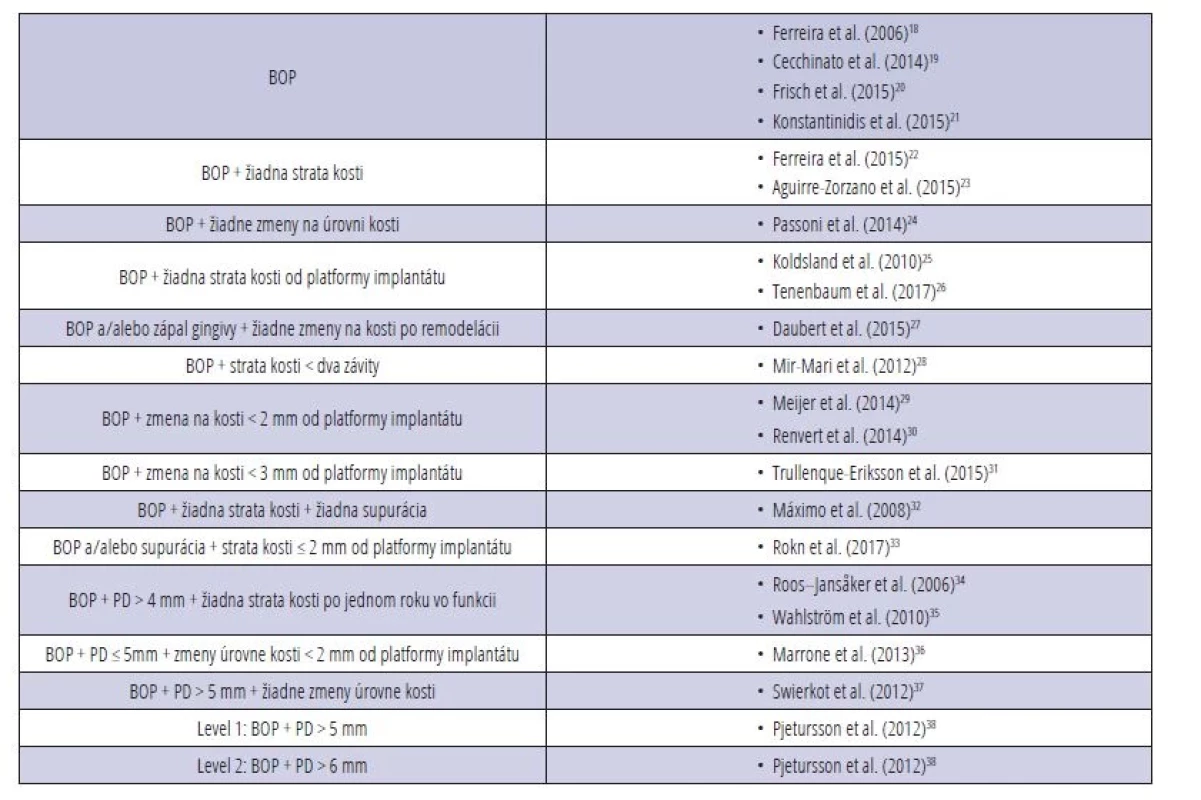
Table 3. Rozdiely medzi gingivitídou a peri-implantátovou mukozitídou.
Tab. 3 Differences between gingivitis and peri-implant mucositis.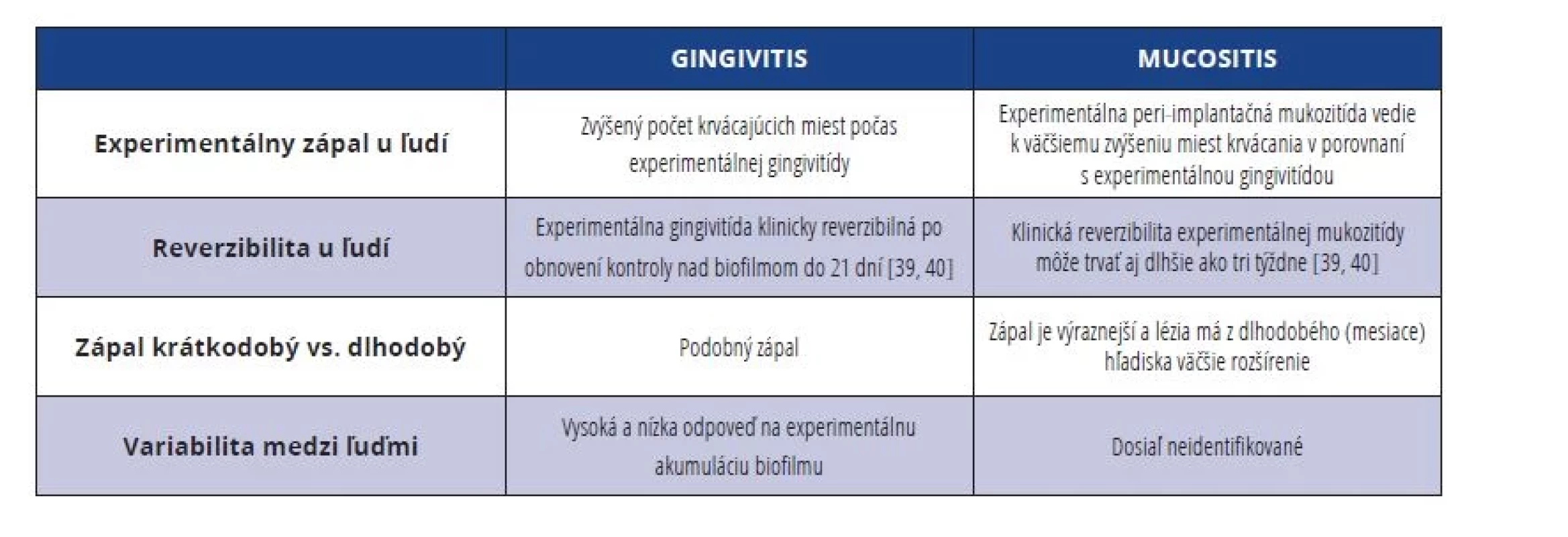
V súčasnej dobe je peri-implantátová mukozitída definovaná ako zápal sliznice v okolí DI bez pokračujúcej straty peri-implantátovej kosti [12]. Je spôsobená akumuláciou biofilmu, ktorý narúša homeostázu na prechode mukóza -implantát [39–42]. Klinickým prejavom tohto zápalu je najmä krvácanie po sondáži (BOP), erytém, opuch a supurácia (obr. 3).
Image 3. Mukozitída.
Fig. 3 Mucositis.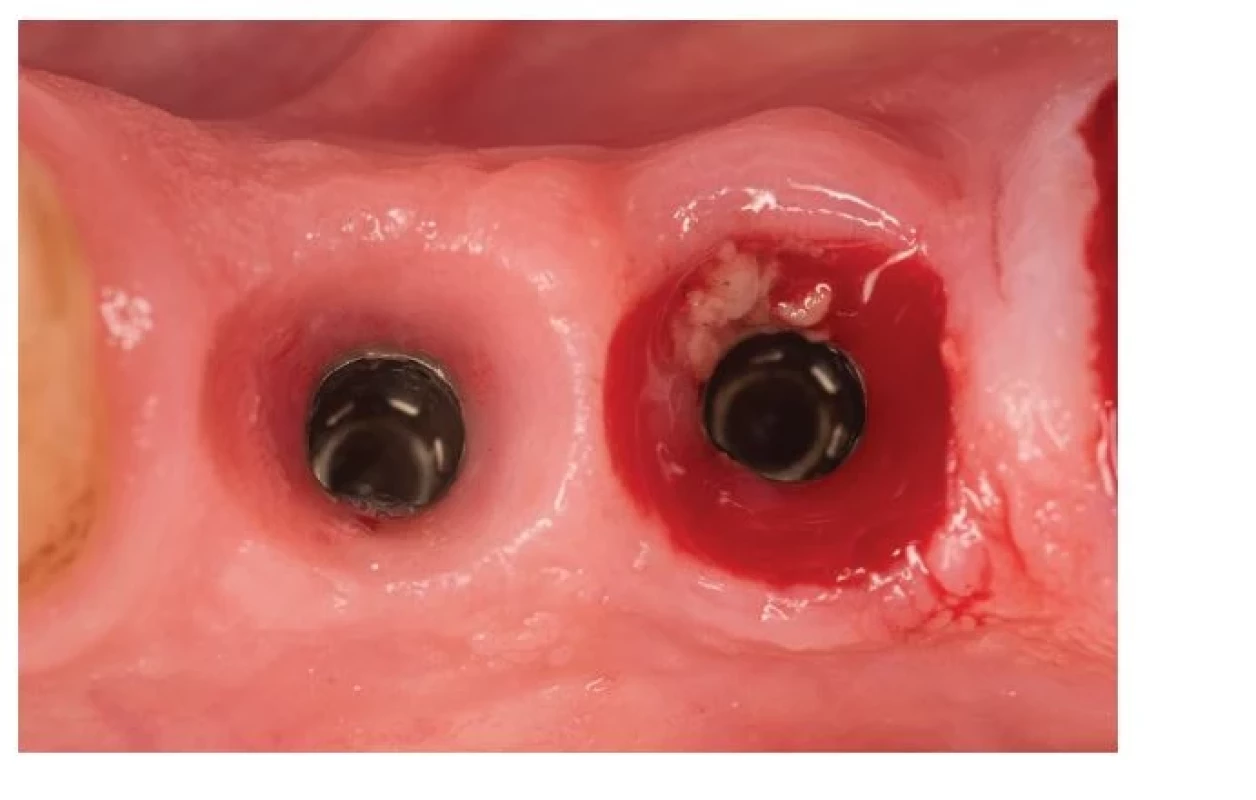
(Autor/author MDDr. Michal Štefanatný) Prevalencia peri-implantátovej mukozitídy sa pohybuje od 45 % [43, 44] po 63 % pacientov [24]. Mukozitída je reverzibilný proces, avšak úplne vymiznutie klinických známok zápalu môže trvať dlhšie ako tri týždne [39, 40]. Z histologického hľadiska je charakteristická tým, že veľkosť a apikálne rozšírenie zápalového infiltrátu nepresahuje cez spojovací epitel [46]. Peri-implantátová mukozitída je považovaná za prekurzor peri-implantitídy, avšak môže byť prítomná dlhší čas bez toho, že by ochorenie progredovalo.
Klinická diagnostika peri-implantátovej mukozitídy [12, 17]:
1. Vizuálna inšpekcia znakov zápalu: sčervenanie, opuch, mäkká konzistencia tkanív.
2. Prítomnosť profúzneho (kvapka alebo línia) krvácania po sondáži a/alebo hnisavá exsudácia.
3. Zvýšená hĺbka sondáže v porovnaní s iniciálnym stavom.
4. Absencia straty kosti (mimo kostné zmeny, ktoré sú súčasťou iniciálnej remodelácie).
PERI-IMPLANTITÍDA
Podobne ako pri mukozitíde, aj v prípade peri-implantitídy bola do roku 2018 značná heterogenita v diagnostických kritériách (tab. 4).
Table 4. Porovnanie diagnostických kritérií pre peri-implantitídu.
Tab. 4 Comparison of diagnostic criteria for peri-implantitis.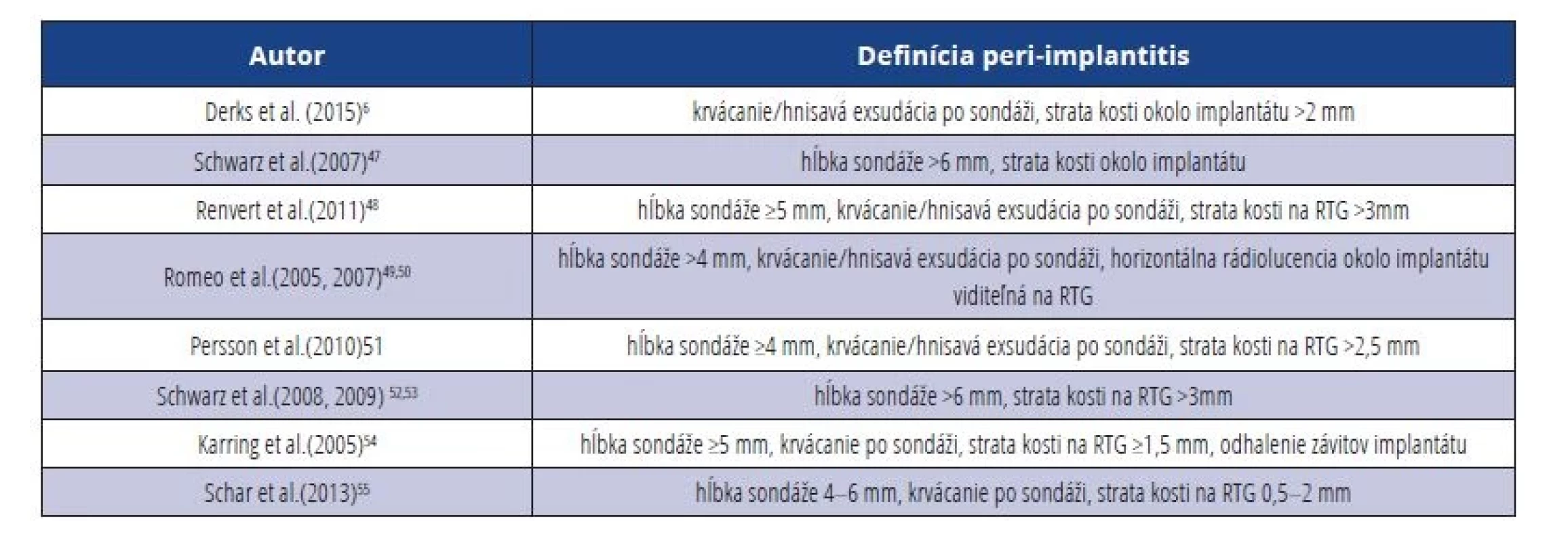
Peri-implantitída je patologický stav vyskytujúci sa v tkanivách okolo DI. Charakterizovaný je zápalom sliznice okolo DI a súčasne progresívnou stratou okolitej kosti [13, 56, 57]. Predpokladá sa, že jej vždy predchádza mukozitída [9]. V porovnaní s parodontitis chronica (PCH) lézie spojené s experimentálnou peri-implantitídou vykazovali infiltráty zápalových buniek, ktoré boli väčšie, rozšírené bližšie k hrebeňu kosti a obsahovali väčšie podiely neutrofilných granulocytov a osteoklastov [58]. Nástup peri-implantitídy sa môže objaviť veľmi skoro po nasadení protetickej práce, pretože väčšina implantátov preukázala prvé známky úbytku kostnej hmoty (> 0,5 mm) už po druhom (52 %) a treťom roku (66 %) funkcie [59].
Na základe klinického vyšetrenia možno kostné defekty v okolí DI rozdeliť do dvoch základných tried. Vo všeobecnosti možno defekty popísať ako intraoseálne (I. trieda) a supraalveolárne (II. trieda). Intraoseálne defekty môžu byť ďalej klinicky rozdelené do piatich podtried (Ia–Ie) [60] (obr. 4). V klinickej praxi môžeme u jedného implantátu typicky sledovať kombináciu defektov I. aj II. triedy súčasne [60, 61].
Image 4. Intraoseálne kostné defekty, trieda I (autorka MDDr. Jana Štefanatná, upravené podľa prof. F. Schwarza).
(a) Trieda Ia – vestibulárny/ orálny pohľad;
(b) Trieda Ia – okluzálny pohľad;
(c) Trieda Ib – okluzálny pohľad;
(d) Trieda Ic – okluzálny pohľad;
(e) Trieda Id – okluzálny pohľad;
(f) Trieda Ie – okluzálny pohľad;
v – vestibulárny; o – orálny; m – meziálny; d – distálny
Fig. 4 Intraosseal bone defects, Class I. (autor MDDr. Jana Štefanatná, modified by prof. F. Schwarz).
(a) Class Ia – vestibular/oral view;
(b) Class Ia – occlusal view;
(c) Class Ib – occlusal view;
(d) Class Ic – occlusal view;
(e) Class Id – occlusal view;
(f) Class Ie – occlusal view;
v – vestibular; o – oral; m – mesial; d – distal)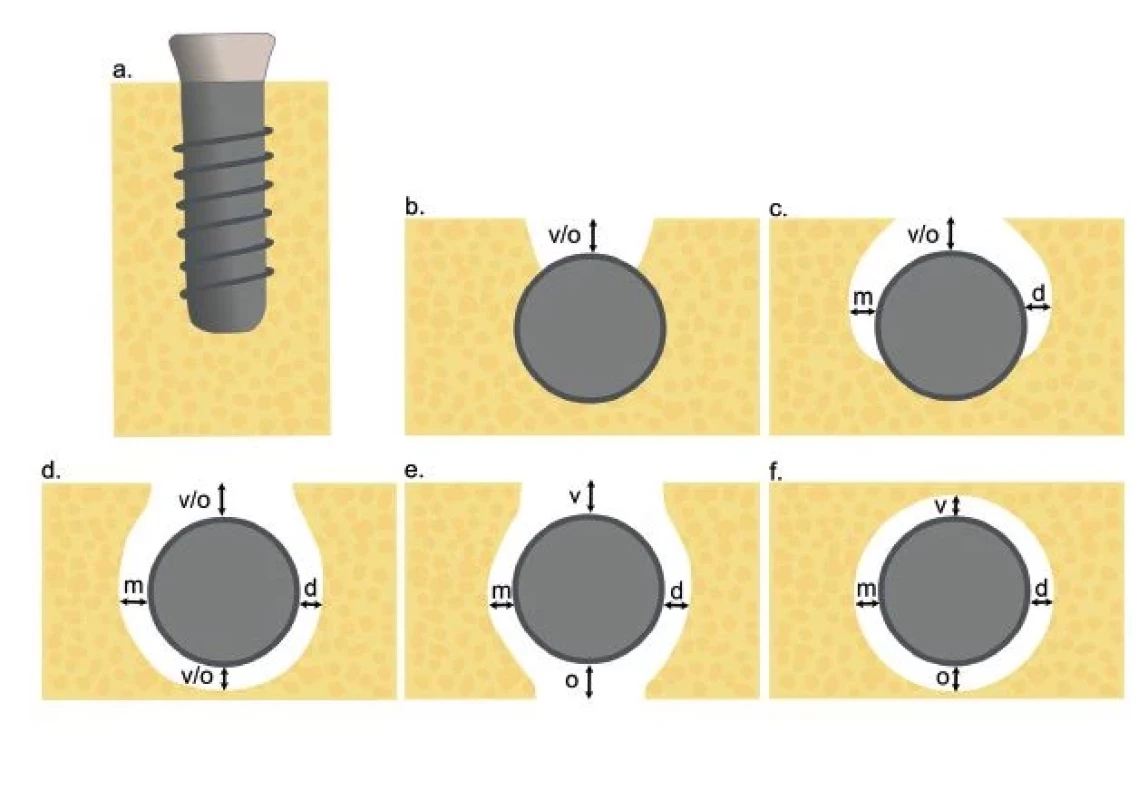
Prevalencia peri-implantitídy u pacientov, alebo u DI sa v odbornej literatúre veľmi líši. Je to dané najmä tým, že do roku 2018 neexistoval jednoznačný konsenzus na diagnostických kritériách pre toto ochorenie, ako sme už spomínali vyššie (tab. 5).
Table 5. Prevalencia peri-implantitídy.
Tab. 5 Prevalence of peri-implantitis.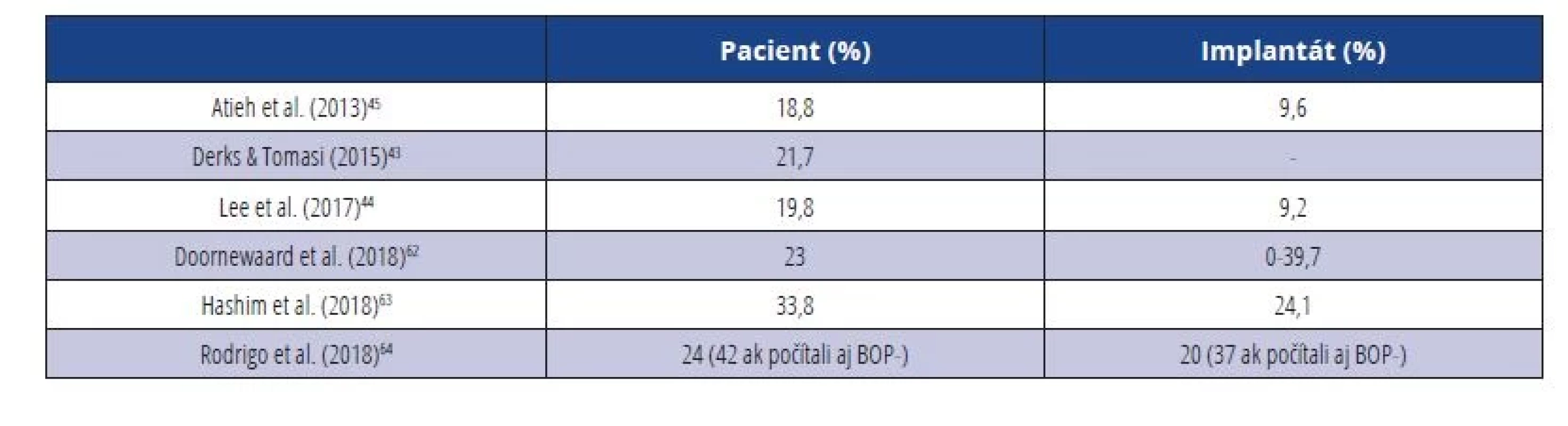
Klinická diagnostika peri-implantitídy [17, 56]:
1. Vizuálny dôkaz zápalových zmien v mäkkých tkanivách okolo DI v kombinácii s krvácaním po sondovaní a/alebo supuráciou.
2. Rastúca hĺbka sondáže v porovnaní s meraniami získanými po umiestnení suprakonštrukcie.
3. Progresívna strata kosti jeden rok po odovzdaní protetickej rekonštrukcie, v porovnaní s iniciálnym stavom.
4. V prípade absencie iniciálneho röntgenologického vyšetrenia a informáciách o hĺbkach sondáže diagnostikujeme peri-implantitídu, ak je na röntgene prítomný úbytok kosti ≥ 3 mm a/alebo hĺbka sondáže ≥ 6 mm v kombinácii s profúznym krvácaním.
ETIOLÓGIA A RIZIKOVÉ FAKTORY
Biofilm
V odbornej literatúre boli skúmané mnohé rizikové faktory, ktoré môžu ovplyvniť vznik a priebeh peri-implantátovej mukozitídy a následne peri-implantitídy [12, 13]. Medzi najväčšie z nich patrí jednoznačne úroveň ústnej hygieny, ktorá výrazne ovplyvňuje aj vznik a priebeh PCH. Prítomnosť orálneho biofilmu je už dlho spájaná s jej vznikom [18, 21, 34, 65, 66].
Najmä pacienti nedodržiavajúci podpornú peri-implantátovou liečbu (angl. supportive implant therapy, SIT) majú vyššie riziko vzniku peri-implantitídy v horizonte piatich rokov [67].
Parodontitis chronica v anamnéze
So stúpajúcim vekom, najmä v mužskej populácii, stúpa aj prevalencia PCH. V USA trpí týmto ochorením takmer polovica (45,9 %) populácie ≥ 30 rokov [68]. Costa vo svojom výskume ukázal, že pacienti s aktívnym ochorením PCH majú v horizonte piatich rokov až deväťkrát vyššie riziko vzniku peri-implantitídy ako pacienti so zdravým parodontom [67]. Dokonca už história PCH, teda pacienti, ktorí v minulosti trpeli PCH, ale v čase implantácie sú stabilizovaní, zvyšuje 4–6násobne riziko vzniku peri-implantitídy v porovnaní s pacientmi, ktorí PCH nikdy netrpeli [32, 69, 70].
Fajčenie
Už dlho je dokázané, že fajčenie má silný vplyv na vznik a priebeh PCH, stratu attachmentu a následne aj stratu zubov [71, 72]. Priamy vplyv fajčenia na vznik a priebeh peri - implantitídy je však stále predmetom výskumu. Viacerí autori už takmer 30 rokov poukazujú na to, že cigarety môžu nepriaznivo ovplyvniť zdravie okolo implantátu [65, 69, 73, 74]. Na druhej strane je mnoho štúdií, ktoré tento negatívny vplyv nepotvrdili [23, 25, 30, 32, 66, 70]. Za touto variabilitou vo výsledkoch pravdepodobne stojí to, že definícia fajčenia ako rizikového faktora sa líšila štúdiu od štúdie. Navyše sa pri tom musíme spoliehať len na pravdivosť informácií o fajčení odobraných pacientom pri anamnéze, ktorá nemusí vždy súhlasiť s realitou.
V druhom desaťročí 21. storočia vstúpili na trh aj elektronické cigarety, ktoré zmätok v definovaní a kvantifikovaní rizík fajčenia len zvyšujú. Prvé výskumy však naznačujú, že minimálne na riziko vzniku PCH môžu mať rovnako negatívny vplyv ako klasické cigarety, pretože výrazne ovplyvňujú mikroflóru dutiny ústnej. A to dokonca bez ohľadu na to, či obsahujú nikotín [75].
Fixačný materiál
Cementované protetické práce taktiež korelujú s vyšším výskytom peri-implantátových ochorení [76–79]. Po odstránení prebytkov došlo až u 74 % implantátov k navráteniu homeostázy, a teda stavu zdravia peri-implantátových tkanív [76]. Ide teda skôr o sekundárny účinok fixačného cementu, ktorý v podobe prebytkov v okolí protetických prác pôsobí ako retenčné miesto pre zachytávanie a vznik biofilmu. Čím hlbšie pod gingiválnym okrajom je spojenie korunky a abutmentu umiestnené, tým väčšie množstvo reziduálneho cementu, aj po jeho pokuse o očistenie, ostáva stále prítomné [80]. Ten tvorí riziko najmä u pacientov s históriou PCH.
Diabetes mellitus
Toto systémové ochorenie vyskytujúce sa u takmer 8 % populácie [81] je jedným z rizikových faktorov PCH [82]. Jeho priamy vplyv na vznik peri-implantitídy je stále otázny [13]. Viacerí autori však dokázali, že u pacientov s úrovňou HbA1c ≥ 7 % je vyššie riziko vzniku peri - -implantitídy ako u pacientov s normálnou hladinou glykovaného hemoglobínu [18, 27, 83].
PREVENCIA
Základom prevencie každého ochorenia by malo byť správne vyšetrenie. V parodontológii aj implantológii je hlavným vyšetrovacím nástrojom parodontálna sonda. Nie sú dôkazy o tom, že by sondovanie s použitím ľahkej sily (0,25 N) spôsobovalo poškodenie peri-implantátových tkanív. Hĺbka sondáže, prítomnosť krvácania po sondáži a supurácia by mali byť pravidelne hodnotené za účelom diagnostiky peri-implantátových ochorení [74] (obr. 5). Súčasťou klinického vyšetrenia by malo byť aj zhotovenie správnej röntgenovej snímky, pri ktorej je centrálny lúč orientovaný kolmo na osu implantátu. Tá nám slúži najmä na hodnotenie úrovne alveolárnej kosti v oblasti krčku DI (obr. 6).
Image 5. Klinické vyšetrenie pomocou plastickej parodontálnej sondy.
Fig. 5 Clinical examination using plastic periodontal probe.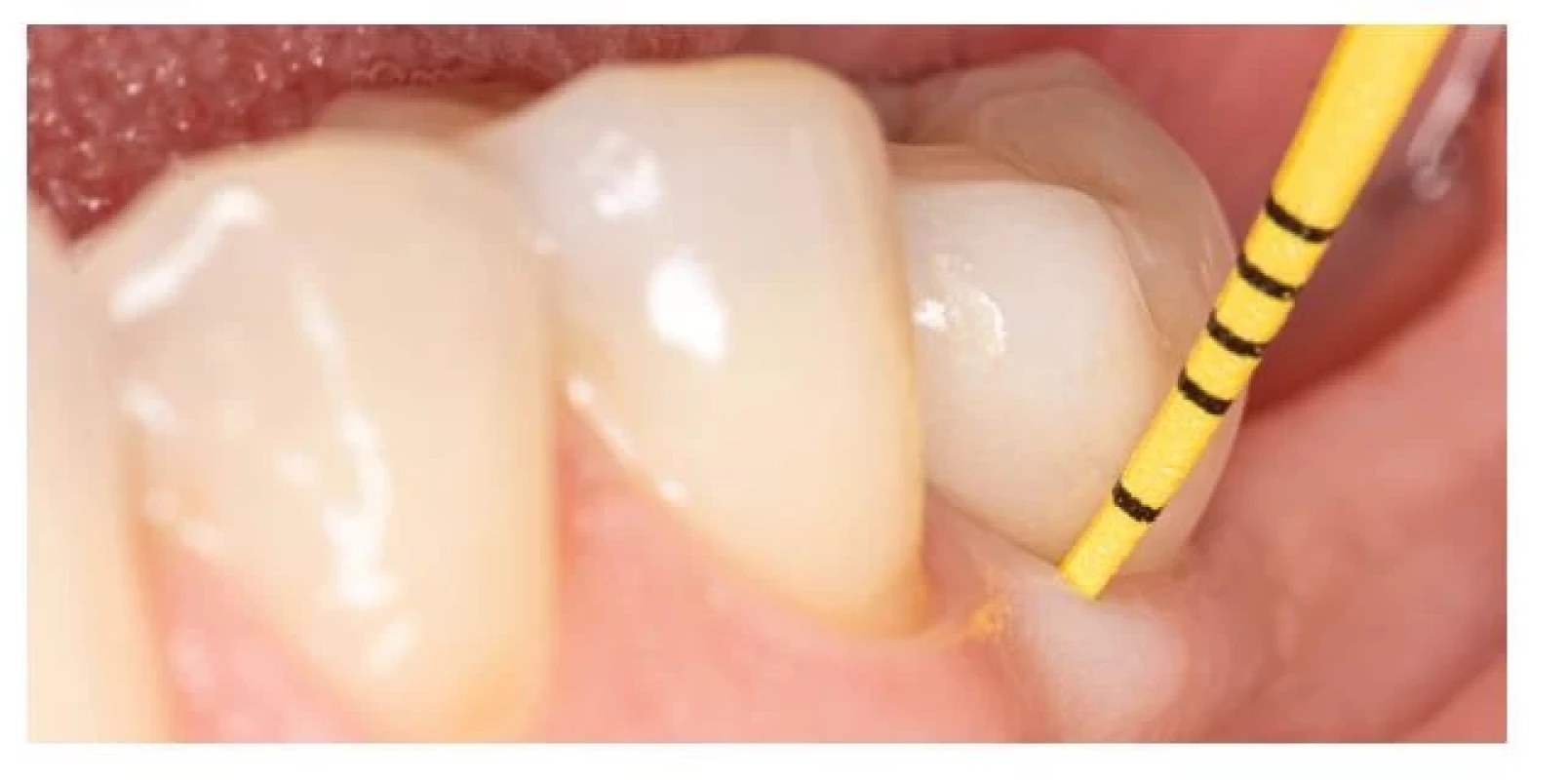
(Autor/author MDDr. Michal Štefanatný) Image 6. Porovnanie štyroch intraorálnych röntgenových snímok v horizonte piatich rokov.
Fig. 6 Comparison of 4 intraoral X-rays in 5-years horizon.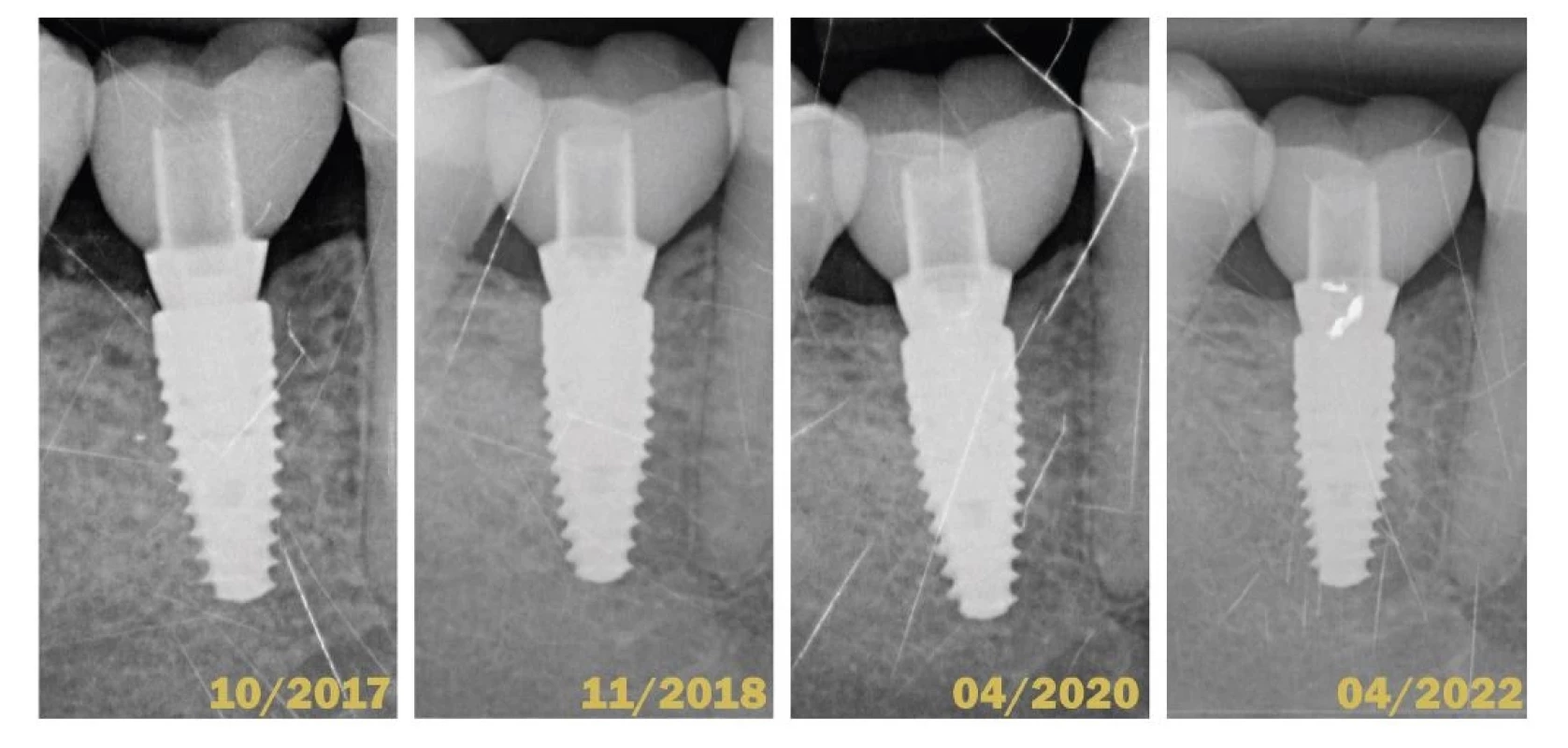
(Autor/author MDDr. Michal Štefanatný) Mechanické odstraňovanie biofilmu, či už na strane pacienta, alebo z rúk odborníka na dentálnu hygienu, by sa malo považovať za štandard v dlhodobej starostlivosti o dentálne implantáty. V prípade peri-implantátovej mukozitídy sa dokonca jedná o hlavný terapeutický postup pre návrat k zdravým peri - implantátovým tkanivám a považuje sa za prevenciu vzniku peri-implantitídy [9, 84, 85]. V horizonte troch mesiacov sme schopní kompletne eliminovať BOP až u 38 % implantátov s diagnózou peri-implantátovej mukozitídy, a to len vďaka profesionálnej dentálnej hygiene a optimálnej domácej starostlivosti o orálne zdravie [86]. Aplikácia chlórhexidínového gélu nijako nezlepšila výsledky v porovnaní so samotným mechanickým čistením.
Nevyhnutnou podmienkou pre efektívne odstraňovanie biofilmu je kvalitné zhotovenie protetickej časti, ktorej implantát robí podporu. Vo vzorke 23 pacientov, ktorí trpeli peri-implantitídou, bola až v 74 % prípadov znemožnená správna orálna hygiena nevyhovujúcim tvarom protetickej práce [87]. V prípade cementovaných protetických prác bola tiež dokázaná vyššia prevalenicia mukozitíty ako u prác skrutkovaných [77]. Z tohto dôvodu sa odporúča pri výbere cementovanej práce usmiestnenie okraja supragingiválne, prípadne zhotovenie individuálneho abutmentnu (obr. 7). Posledné výskumy nasvedčujú tomu, že ak už raz došlo k úspešnej osseointegrácii DI, potom veľký vplyv na jeho dlhodobú stabilitu nemá ani tak implantát samotný, ako jeho protetická časť. Ide teda hlavne o typ korunky, tvar odstupu abutmentu a korunky v mieste kontaktu s mäkkými tkanivami (angl. emergence profile) ako aj o samotné materiály, z ktorých sú protetické komponenty zhotovené.
Image 7. Fixácia korunky na implantát s použitím kofferdamu a individálne zhotoveného ZrO abutmentu.
Fig. 7 Fixation of implant crown using rubber dam and custommade zirconia abutment.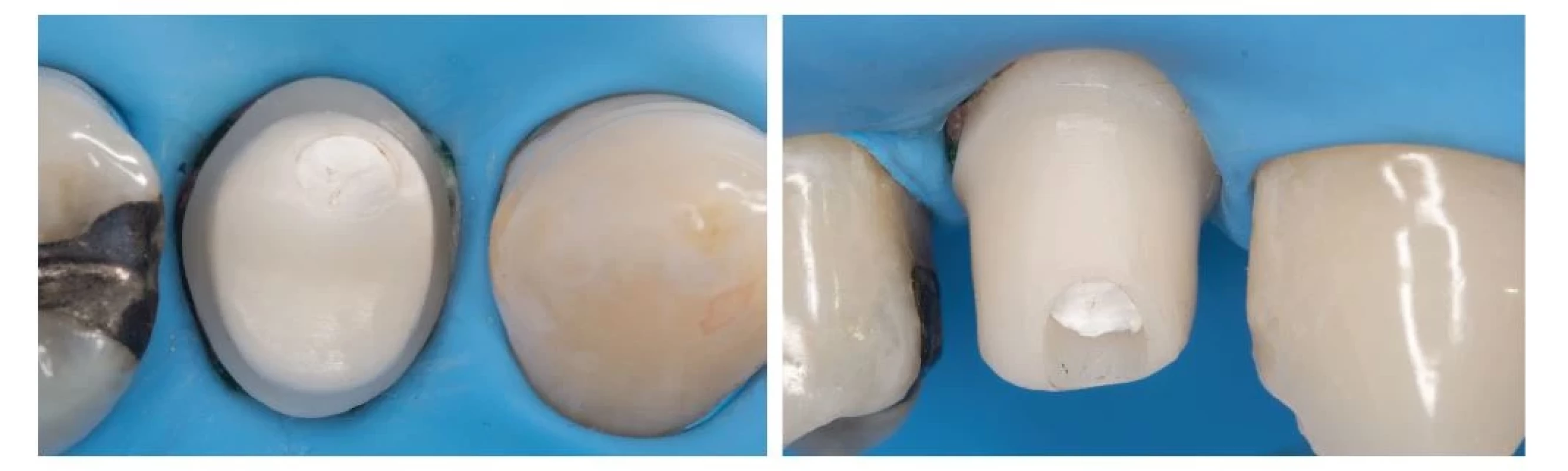
(Autor/author MDDr. Michal Štefanatný) Význam rozsahu keratinizovanej sliznice v okolí DI je doteraz sporný. V niektorých prípadoch bol dokázaný pozitívny účinok dostatočnej šírky (> 2 mm) keratinizovanej sliznice na prevenciu vzniku peri-implantitídy [88–92], iní autori však tieto výsledky nepotvrdili [20, 93–95]. Jednoznačne však môžeme povedať, že dostatočná šírka (> 2 mm) keratinizovanej sliznice znižuje BOP v okolí DI, chráni pred vznikom recesu a je spojená s nižšou akumuláciou orálneho biofilmu [89–94, 96]. To môže súvisieť najmä s tým, že pacienti s nedostatočnou šírkou keratinizovanej sliznice (< 2 mm) v okolí DI spájajú čistenie v tejto oblasti s nepríjemnými pocitmi až bolesťou [96].
Dôležitou súčasťou prevencie vzniku ochorení parodontu [97, 98] alebo peri - -implantátových tkanív je SIT. Tá spočíva v pravidelných návštevách zubného lekára alebo dentálnej hygieničky a profesionálnom odstránení biofilmu. Medzi pacientmi, ktorí pravidelne neabsolvovali SIT, bola prevalencia peri-implantátovej mukozitídy až takmer 50% [34, 69, 99]. V skupine pacientov s mukozitídou Costa ukázal, že ak sa v horizonte piatich rokov nedostavili na SIT ani raz, bola incidencia peri - -implantitídy až 43,9 %. Naproti tomu u pacientov, ktorí absolvovali počas sledovaného obdobia SIT aspoň raz ročne, sa rozvinula peri - implantitída len v 18 % prípadov [67].
ZÁVER
Pochopenie anatómie a funkcie peri-implantátových štruktúr je základom pre úspešnú terapiu pomocou dentálnych implantátov. V prípade, že poznáme všetky rizikové faktory vzniku ochorení peri-implantátových tkanív, je viac ako na mieste, aby prvým krokom pred zavedením DI bol správny výber pacienta. DI by sme v žiadnom prípade nemali zavádzať u pacientov s aktívnou parodontitídou a je potrebné pracovať najskôr na jej stabilizácii, až následne na ošetrení chýbajúcich zubov pomocou DI. V prípade výskytu ďalších rizikových faktorov, ako je diabetes mellitus alebo fajčenie, by sme mali byť ostražití a dôkladne zvážiť aj iné možnosti náhrady chýbajúcich zubov ako len pomocou DI.
Následná starostlivosť o pacienta po zavedení DI v podobe SIT by mala začať okamžite po ošetrení a opakovať sa v pravidelných intervaloch.
MDDr. Michal Štefanatný
Blanc Dental Studio
Obchodná 8985, 010 08 Žilina, Slovensko
e-mail: michal.stefanatny@gmail.com
Sources
1. van Velzen FJJ, Ofec R, Schulten EAJM, ten Bruggenkate CM. 10-year survival rate and the incidence of peri-implant disease of 374 titanium dental implants with a SLA surface: a prospective cohort study in 177 fully and partially edentulous patients. Clin Oral Implants Res. 2015; 26(10): 1121–1128.
2. Simonis P, Dufour T, Tenenbaum H. Long-term implant survival and success: a 10–16-year follow-up of non-submerged dental implants. Clin Oral Implants Res. 2010; 21(7): 772–777.
3. Balshi TJ, Wolfinger GJ, Stein BE, Balshi SF. A long-term retrospective analysis of survival rates of implants in the mandible. Int J Oral Maxillofac Implants. 2015; 30(6):1348–1354.
4. Chappuis V, Buser R, Brägger U, Bornstein MM, Salvi GE, Buser D. Long-term outcomes of dental implants with a titanium plasma-sprayed surface: A 20-year prospective case series study in partially edentulous patients. Clin Implant Dent Relat Res. 2013; 15(6): 780–790.
5. Misch CE, Perel ML, Wang H-L, Sammartino G, Galindo-Moreno P, Trisi P, et al. Implant Success, Survival, and Failure: The International Congress of Oral Implantologists (ICOI) Pisa consensus conference. Implant Dent. 2008; 17(1): 5-15.
6. Derks J, Schaller D, Håkansson J, Wennström JL, Tomasi C, Berglundh T. Effectiveness of implant therapy analyzed in a Swedish population: prevalence of periimplantitis. J Dent Res. 2015; 95(1): 43–49.
7. Lang NP, Berglundh T. Periodontology on B of WG 4 of the SEW on. Periimplant diseases: where are we now? – Consensus of the Seventh European Workshop on Periodontology. J Clin Periodontol. 2011; 38(11): 178–181.
8. Sanz M, Chapple IL. Periodontology* on behalf of WG 4 of the VIEW on. Clinical research on peri-implant diseases: consensus report of Working Group 4. J Clin Periodontol. 2012; 39(12): 202–206.
9. Jepsen S, Berglundh T, Genco R, Aass AM, Demirel K, Derks J, et al. Primary prevention of peri-implantitis: Managing peri-implant mucositis. J Clin Periodontol. 2015; 42(16): 152–157.
10. Albrektsson T, Isidor F, Lang NP, Karring T. Consensus report of session IV. In 1985.
11. Araujo MG, Lindhe J. Peri-implant health. J Periodontol. 2018; 89(1): 249–256.
12. Heitz-Mayfield LJA, Salvi GE. Peri-implant mucositis. J Clin Periodontol. 2018; 45(20): 237–245.
13. Schwarz F, Derks J, Monje A, Wang HL. Peri-implantitis. J Periodontol. 2018; 89(1): 267–290.
14. Tomasi C, Tessarolo F, Caola I, Wennström J, Nollo G, Berglundh T. Morphogenesis of peri-implant mucosa revisited: an experimental study in humans. Clin Oral Implants Res. 2014; 25(9): 997–1003.
15. Abrahamsson I, Berglundh T, Lindhe J. The mucosal barrier following abutment dis/ reconnection. An experimental study in dogs. J Clin Periodontol. 1997; 24(8): 568–572.
16. Berglundh T, Abrahamsson I, Welander M, Lang NP, Lindhe J. Morphogenesis of the peri-implant mucosa: an experimental study in dogs. Clin Oral Implants Res. 2007; 18(1): 1–8.
17. Renvert S, Persson GR, Pirih FQ, Camargo PM. Peri-implant health, periimplant mucositis, and peri-implantitis: Case definitions and diagnostic considerations. J Periodontol. 2018; 89(1): 304–312.
18. Ferreira SD, Silva GLM, Cortelli JR, Costa JE, Costa FO. Prevalence and risk variables for peri-implant disease in Brazilian subjects. J Clin Periodontol. 2006; 33(12): 929–935.
19. Cecchinato D, Parpaiola A, Lindhe J. Mucosal inflammation and incidence of crestal bone loss among implant patients: a 10-year study. Clin Oral Implants Res. 2014; 25(7): 791–796.
20. Frisch E, Ziebolz D, Vach K, Ratka-Krüger P. The effect of keratinized mucosa width on peri-implant outcome under supportive postimplant therapy. Clin Implant Dent Relat Res. 2015; 17(Suppl. 1): e236-244.
21. Konstantinidis IK, Kotsakis GA, Gerdes S, Walter MH. Cross-sectional study on the prevalence and risk indicators of peri-implant diseases. Eur J Oral Implantol. 2015; 8(1): 75–88.
22. Ferreira CF, Buttendorf AR, de Souza JGO, Dalago H, Guenther SF, Bianchini MA. Prevalence of peri-implant diseases: analyses of associated factors. Eur J Prosthodont Restor Dent. 2015; 23(4): 199–206.
23. Aguirre-Zorzano LA, Estefanía-Fresco R, Telletxea O, Bravo M. Prevalence of peri-implant inflammatory disease in patients with a history of periodontal disease who receive supportive periodontal therapy. Clin Oral Implants Res. 2015; 26(11): 1338–1344.
24. Passoni BB, Dalago HR, Schuldt Filho G, Oliveira De Souza JG, Benfatti CAM, Magini R de S, et al. Does the number of implants have any relation with peri-implant disease? J Appl Oral Sci. 2014; 22(5): 403–408.
25. Koldsland OC, Scheie AA, Aass AM. Prevalence of peri-implantitis related to severity of the disease with different degrees of bone loss. J Periodontol. 2010; 81(2): 231–238.
26. Tenenbaum H, Bogen O, Séverac F, Elkaim R, Davideau J-L, Huck O. Long-term prospective cohort study on dental implants: clinical and microbiological parameters. Clin Oral Implants Res. 2017; 28(1): 86–94.
27. Daubert DM, Weinstein BF, Bordin S, Leroux BG, Flemming TF. Prevalence and predictive factors for peri-implant disease and implant failure: a cross-sectional analysis. J Periodontol. 2015; 86(3): 337–347.
28. Mir-Mari J, Mir-Orfila P, Figueiredo R, Valmaseda-Castellón E, Gay-Escoda C. Prevalence of peri-implant diseases. A crosssectional study based on a private practice environment. J Clin Periodontol. 2012; 39(5): 490–494.
29. Meijer HJA, Raghoebar GM, de Waal YCM, Vissink A. Incidence of peri-implant mucositis and peri-implantitis in edentulous patients with an implant-retained mandibular overdenture during a 10-year follow-up period. J Clin Periodontol. 2014; 41(12): 1178–1183.
30. Renvert S, Aghazadeh A, Hallström H, Persson GR. Factors related to peri-implantitis – a retrospective study. Clin Oral Implants Res. 2014; 25(4): 522–529.
31. Trullenque-Eriksson A, Guisado Moya B. Retrospective long-term evaluation of dental implants in totally and partially edentulous patients: part II: periimplant disease. Implant Dent. 2015; 24(2): 217–221.
32. Máximo MB, de Mendonça AC, Alves JF, Cortelli SC, Peruzzo DC, Duarte PM. Peri-implant diseases may be associated with increased time loading and generalized periodontal bone loss: preliminary results. J Oral Implantol. 2008; 34(5): 268–273.
33. Rokn A, Aslroosta H, Akbari S, Najafi H, Zayeri F, Hashemi K. Prevalence of peri-implantitis in patients not participating in well-designed supportive periodontal treatments: a cross-sectional study. Clin Oral Implants Res. 2017; 28(3): 314–319.
34. Roos-Jansåker A-M, Lindahl C, Renvert H, Renvert S. Nine - to fourteenyear follow-up of implant treatment. Part II: presence of peri-implant lesions. J Clin Periodontol. 2006; 33(4): 290–295.
35. Wahlström M, Sagulin G-B, Jansson LE. Clinical follow-up of unilateral, fixed dental prosthesis on maxillary implants. Clin Oral Implants Res. 2010; 21(11): 1294–1300.
36. Marrone A, Lasserre J, Bercy P, Brecx MC. Prevalence and risk factors for peri-implant disease in Belgian adults. Clin Oral Implants Res. 2013; 24(8): 934–940.
37. Swierkot K, Lottholz P, Flores-de-Jacoby L, Mengel R. Mucositis, peri-implantitis, implant success, and survival of implants in patients with treated generalized aggressive periodontitis: 3 - to 16-year results of a prospective long-term cohort study. J Periodontol. 2012; 83(10): 1213–1225.
38. Pjetursson BE, Helbling C, Weber H-P, Matuliene G, Salvi GE, Brägger U, et al. Peri-implantitis susceptibility as it relates to periodontal therapy and supportive care. Clin Oral Implants Res. 2012; 23(7): 888–894.
39. Salvi GE, Aglietta M, Eick S, Sculean A, Lang NP, Ramseier CA. Reversibility of experimental peri-implant mucositis compared with experimental gingivitis in humans. Clin Oral Implants Res. 2012; 23(2): 182–190.
40. Meyer S, Giannopoulou C, Courvoisier D, Schimmel M, Müller F, Mombelli A. Experimental mucositis and experimental gingivitis in persons aged 70 or over. Clinical and biological responses. Clin Oral Implants Res. 2017; 28(8): 1005–1012.
41. Zitzmann NU, Berglundh T, Marinello CP, Lindhe J. Experimental peri-implant mucositis in man. J Clin Periodontol. 2001; 28(6): 517–523.
42. Pontoriero R, Tonelli MP, Carnevale G, Mombelli A, Nyman SR, Lang NP. Experimentally induced peri-implant mucositis. A clinical study in humans. Clin Oral Implants Res. 1994; 5(4): 254–259.
43. Derks J, Tomasi C. Peri-implant health and disease. A systematic review of current epidemiology. J Clin Periodontol. 2015; 42(16): 158–171.
44. Lee CT, Huang YW, Zhu L, Weltman R. Prevalences of peri-implantitis and periimplant mucositis: systematic review and meta-analysis. J Dent. 2017; 62(1): 1–12.
45. Atieh MA, Alsabeeha NHM, Faggion Jr. CM, Duncan WJ. The frequency of peri-implant diseases: A systematic review and meta-analysis. J Periodontol. 2013; 84(11): 1586–1598.
46. Abrahamsson I, Berglundh T, Lindhe J. Soft tissue response to plaque formation at different implant systems. A comparative study in the dog. Clin Oral Implants Res. 1998; 9(2): 73–79.
47. Schwarz F, Herten M, Sager M, Bieling K, Sculean A, Becker J. Comparison of naturally occurring and ligature-induced peri-implantitis bone defects in humans and dogs. Clin Oral Implants Res. 2007; 18(2): 161–170.
48. Renvert S, Lindahl C, Roos Jansåker A-M, Persson GR. Treatment of peri-implantitis using an Er:YAG laser or an air-abrasive device: a randomized clinical trial. J Clin Periodontol. 2011; 38(1): 65–73.
49. Romeo E, Ghisolfi M, Murgolo N, Chiapasco M, Lops D, Vogel G. Therapy of peri-implantitis with resective surgery. Clin Oral Implants Res. 2005; 16(1): 9–18.
50. Romeo E, Lops D, Chiapasco M, Ghisolfi M, Vogel G. Therapy of peri-implantitis with resective surgery. A 3-year clinical trial on rough screwshaped oral implants. Part II: Radiographic outcome. Clin Oral Implants Res. 2007; 18(2): 179–187.
51. Persson GR, Samuelsson E, Lindahl C, Renvert S. Mechanical non-surgical treatment of peri-implantitis: a single-blinded randomized longitudinal clinical study. II. Microbiological results. J Clin Periodontol. 2010; 37(6): 563–573.
52. Schwarz F, Sahm N, Bieling K, Becker J. Surgical regenerative treatment of periimplantitis lesions using a nanocrystalline hydroxyapatite or a natural bone mineral in combination with a collagen membrane: a four-year clinical follow-up report. J Clin Periodontol. 2009; 36(9): 807–814.
53. Schwarz F, Sculean A, Bieling K, Ferrari D, Rothamel D, Becker J. Two-year clinical results following treatment of peri-implantitis lesions using a nanocrystalline hydroxyapatite or a natural bone mineral in combination with a collagen membrane. J Clin Periodontol. 2008; 35(1): 80–87.
54. Karring ES, Stavropoulos A, Ellegaard B, Karring T. Treatment of peri-implantitis by the Vector® system. Clin Oral Implants Res. 2005; 16(3): 288–293.
55. Schär D, Ramseier CA, Eick S, Arweiler NB, Sculean A, Salvi GE. Anti-infective therapy of peri-implantitis with adjunctive local drug delivery or photodynamic therapy: six-month outcomes of a prospective randomized clinical trial. Clin Oral Implants Res. 2013; 24(1): 104–110.
56. Berglundh T, Armitage G, Araujo MG, Avila-Ortiz G, Blanco J, Camargo PM, et al. Peri-implant diseases and conditions: Consensus report of workgroup 4 of the 2017 World Workshop on the Classification of Periodontal and Peri-Implant Diseases and Conditions. J Periodontol. 2018; 89(1): 313–318.
57. Lindhe J, Meyle J. Peri-implant diseases: Consensus report of the Sixth European Workshop on Periodontology. J Clin Periodontol. 2008; 35(8): 282–285.
58. Carcuac O, Abrahamsson I, Albouy JP, Linder E, Larsson L, Berglundh T. Experimental periodontitis and peri-implantitis in dogs. Clin Oral Implants Res. 2013; 24(4): 363–371.
59. Derks J, Schaller D, Håkansson J, Wennström JL, Tomasi C, Berglundh T. Peri-implantitis – onset and pattern of progression. J Clin Periodontol. 2016; 43(4): 383–388.
60. Schwarz F, Herten M, Sager M, Bieling K, Sculean A, Becker J. Comparison of naturally occurring and ligature-induced peri-implantitis bone defects in humans and dogs. Clin Oral Implants Res. 2007; 18(2): 161–170.
61. Serino G, Turri A, Lang NP. Probing at implants with peri-implantitis and its relation to clinical peri-implant bone loss. Clin Oral Implants Res. 2013; 24(1): 91–95.
62. Doornewaard R, Jacquet W, Cosyn J, De Bruyn H. How do peri-implant biologic parameters correspond with implant survival and periimplantitis? A critical review. Clin Oral Implants Res. 2018; 29(S18): 100–123.
63. Hashim D, Cionca N, Combescure C, Mombelli A. The diagnosis of peri-implantitis: A systematic review on the predictive value of bleeding on probing. Clin Oral Implants Res. 2018; 29(S16): 276–293.
64. Rodrigo D, Sanz-Sánchez I, Figuero E, Llodrá JC, Bravo M, Caffesse RG, et al. Prevalence and risk indicators of peri-implant diseases in Spain. J Clin Periodontol. 2018; 45(12): 1510–1520.
65. Lindquist LW, Carlsson GE, Jemt T. A prospective 15-year follow-up study of mandibular fixed prostheses supported by osseointegrated implants. Clinical results and marginal bone loss. Clin Oral Implants Res. 1996; 7(4): 329–336.
66. de Araújo Nobre M, Mano Azul A, Rocha E, Maló P. Risk factors of peri-implant pathology. Eur J Oral Sci. 2015; 123(3): 131–139.
67. Costa FO, Takenaka-Martinez S, Cota LOM, Ferreira SD, Silva GLM, Costa JE. Peri-implant disease in subjects with and without preventive maintenance: a 5-year follow-up. J Clin Periodontol. 2012; 39(2): 173–181.
68. Eke PI, Dye BA, Wei L, Slade GD, Thornton-Evans GO, Borgnakke WS, et al. Update on prevalence of periodontitis in adults in the United States: NHANES 2009 to 2012. J Periodontol. 2015; 86(5): 611–622.
69. Roos-Jansåker AM, Renvert H, Lindahl C, Renvert S. Nine - to fourteen-year follow-up of implant treatment. Part III: Factors associated with peri-implant lesions. J Clin Periodontol. 2006; 33(4): 296–301.
70. Koldsland OC, Scheie AA, Aass AM. The association between selected risk indicators and severity of peri-implantitis using mixed model analyses. J Clin Periodontol. 2011; 38(3): 285–292.
71. Axelsson P, Paulander J, Lindhe J. Relationship between smoking and dental status in 35-, 50-, 65-, and 75-year-old individuals. J Clin Periodontol. 1998; 25(4): 297–305.
72. Tomar SL, Asma S. Smoking-attributable periodontitis in the United States: findings from NHANES III. National Health and Nutrition Examination Survey. J Periodontol. 2000; 71(5): 743–751.
73. Rinke S, Ohl S, Ziebolz D, Lange K, Eickholz P. Prevalence of periimplant disease in partially edentulous patients: a practice-based crosssectional study. Clin Oral Implants Res. 2011; 22(8): 826–833.
74. Heitz-Mayfield LJA. Peri-implant diseases: diagnosis and risk indicators. J Clin Periodontol. 2008; 35(8): 292–304.
75. Ganesan SM, Dabdoub SM, Nagaraja HN, Scott ML, Pamulapati S, Berman ML, et al. Adverse effects of electronic cigarettes on the disease-naive oral microbiome. Sci Adv. 2020; 6(22):eaaz0108. doi: 10.1126/sciadv.aaz0108
76. Wilson Jr. TG. The Positive Relationship Between Excess Cement and Peri-Implant Disease: A prospective clinical endoscopic study. J Periodontol. 2009; 80(9): 1388–1392.
77. Linkevicius T, Puisys A, Vindasiute E, Linkeviciene L, Apse P. Does residual cement around implantsupported restorations cause peri-implant disease? A retrospective case analysis. Clin Oral Implants Res. 2013; 24(11): 1179–1184.
78. Pauletto N, Lahiffe BJ, Walton JN. Complications associated with excess cement around crowns on osseointegrated implants: a clinical report. Int J Oral Maxillofac Implants. 1999; 14(6): 865–868.
79. Sailer I, Mühlemann S, Zwahlen M, Hämmerle CHF, Schneider D. Cemented and screw-retained implant reconstructions: a systematic review of the survival and complication rates. Clin Oral Implants Res. 2012; 23(6): 163–201.
80. Linkevicius T, Vindasiute E, Puisys A, Peciuliene V. The influence of margin location on the amount of undetected cement excess after delivery of cement-retained implant restorations. Clin Oral Implants Res. 2011; 22(12): 1379–1384.
81. Shaw JE, Sicree RA, Zimmet PZ. Global estimates of the prevalence of diabetes for 2010 and 2030. Diabetes Res Clin Pract. 2010; 87(1): 4–14.
82. Genco RJ, Graziani F, Hasturk H. Effects of periodontal disease on glycemic control, complications, and incidence of diabetes mellitus. Periodontol 2000. 2020; 83(1): 59–65.
83. Tawil G, Younan R, Azar P, Sleilati G. Conventional and advanced implant treatment in the type II diabetic patient: surgical protocol and long-term clinical results. Int J Oral Maxillofac Implants. 2008; 23(4): 744–752.
84. Salvi GE, Ramseier CA. Efficacy of patient-administered mechanical and/or chemical plaque control protocols in the management of peri-implant mucositis. A systematic review. J Clin Periodontol. 2015; 42(1): 187–201.
85. Schwarz F, Becker K, Sager M. Efficacy of professionally administered plaque removal with or without adjunctive measures for the treatment of peri-implant mucositis. A systematic review and meta-analysis. J Clin Periodontol. 2015; 42(1): 202–213.
86. Heitz-Mayfield LJA, Salvi GE, Botticelli D, Mombelli A, Faddy M, Lang NP. Anti-infective treatment of peri-implant mucositis: a randomised controlled clinical trial. Clin Oral Implants Res. 2011; 22(3): 237–241.
87. Serino G, Ström C. Peri-implantitis in partially edentulous patients: association with inadequate plaque control. Clin Oral Implants Res. 2009; 20(2): 169–174.
88. Bouri AJ, Bissada N, Al-Zahrani MS, Faddoul F, Nouneh I. Width of keratinized gingiva and the health status of the supporting tissues around dental implants. Int J Oral Maxillofac Implants. 2008; 23(2): 323–326.
89. Adibrad M, Shahabuei M, Sahabi M. Significance of the width of keratinized mucosa on the health status of the supporting tissue around implants supporting overdentures. J Oral Implantol. 2009; 35(5): 232–237.
90. Schrott AR, Jimenez M, Hwang JW, Fiorellini J, Weber HP. Five-year evaluation of the influence of keratinized mucosa on peri-implant softtissue health and stability around implants supporting full-arch mandibular fixed prostheses. Clin Oral Implants Res. 2009; 20(10): 1170–1177.
91. Lin GH, Chan HL, Wang HL. The significance of keratinized mucosa on implant health: a systematic review. J Periodontol. 2013; 84(12): 1755–1767.
92. Boynueğri D, Nemli SK, Kasko YA. Significance of keratinized mucosa around dental implants: a prospective comparative study. Clin Oral Implants Res. 2013; 24(8): 928–933.
93. Crespi R, Capparè P, Gherlone E. A 4-year evaluation of the peri-implant parameters of immediately loaded implants placed in fresh extraction sockets. J Periodontol. 2010; 81(11): 1629–1634.
94. Zigdon H, Machtei EE. The dimensions of keratinized mucosa around implants affect clinical and immunological parameters. Clin Oral Implants Res. 2008; 19(4): 387–392.
95. Wennström JL, Derks J. Is there a need for keratinized mucosa around implants to maintain health and tissue stability? Clin Oral Implants Res. 2012; 23(6): 136–146.
96. Souza AB, Tormena M, Matarazzo F, Araújo MG. The influence of peri-implant keratinized mucosa on brushing discomfort and peri-implant tissue health. Clin Oral Implants Res. 2016; 27(6): 650–655.
97. Axelsson P, Lindhe J. The significance of maintenance care in the treatment of periodontal disease. J Clin Periodontol. 1981; 8(4): 281–294.
98. Axelsson P, Nyström B, Lindhe J. The long-term effect of a plaque control program on tooth mortality, caries and periodontal disease in adults. Results after 30 years of maintenance. J Clin Periodontol. 2004; 31(9): 749–757.
99. Roos-Jansåker AM, Lindahl C, Renvert H, Renvert S. Nine - to fourteen-year follow-up of implant treatment. Part I: implant loss and associations to various factors. J Clin Periodontol. 2006; 33(4): 283–289.
Labels
Maxillofacial surgery Orthodontics Dental medicine
Article was published inCzech Dental Journal

2023 Issue 1
Most read in this issue- USE OF MIDAZOLAM IN PAEDIATRIC DENTISTRY
- MANUAL TOOTHBRUSHES – BRISTLES QUALITY
- PERI-IMPLANTITIS: CLASSIFICATION, ETIOLOGY AND PREVENTION
- ČASOPIS ČSPZL: NOVÝ WEB A REDAKČNÍ SYSTÉM
Login#ADS_BOTTOM_SCRIPTS#Forgotten passwordEnter the email address that you registered with. We will send you instructions on how to set a new password.
- Career

