-
Medical journals
- Career
PROTEÓM SLINNÝCH EXOZÓMOV AKO NOVÝ PROSTRIEDOK PRE DIAGNOSTIKU ORÁLNYCH OCHORENÍ
Authors: G. Laputková 1; I. Talian 1; Z. Jendrichovská 1; V. Schwartzová 2; Z. Schwartzová 3; J. Sabo 1
Authors‘ workplace: Ústav lekárskej a klinickej biofyziky, Lekárska fakulta, Univerzita P. J. Šafárika, Košice, Slovenská republika 1; Klinika stomatológie a maxilofaciálnej chirurgie, Lekárska fakulta, Univerzita P. J. Šafárika, a UNLP, Košice, Slovenská republika 2; Ústav epidemiológie, Lekárska fakulta, Univerzita P. J. Šafárika, Košice, Slovenská republika 3
Published in: Česká stomatologie / Praktické zubní lékařství, ročník 121, 2021, 3, s. 75-82
Category: Original Article – Clinical Study
Overview
Úvod a cieľ práce: Exozómy, ktoré sú generované endozomálnou cestou, sa exocytózou uvoľňujú do extracelulárneho priestoru vrátane slín. Obsahujú nukleové kyseliny, proteíny a lipidy, ktoré transportujú do rôznych častí tela. Podieľajú sa na medzibunkovej komunikácii, či už podporujú alebo narúšajú rôzne fyziologické procesy.
Cieľom práce bolo overiť efektívnosť ultracentrifugačnej metódy izolácie exozómov zo slín, izolovať a identifikovať proteíny v nich obsiahnuté, s dôrazom na exozomálne proteíny súvisiace s ochoreniami ústnej dutiny alebo systematickými ochoreniami s prejavmi v ústnej dutine.
Metódy: Exozómy boli z plných nestimulovaných ľudských slín izolované opakovanými centrifugačnými krokmi s premývaním vo fosfátovom tlmivom roztoku s následnou metanolovo/chloroformovou precipitáciou proteínov. Proteíny boli identifikované bottom-up prístupom pomocou hmotnostnej spektrometrie s predradenou separáciou na kvapalinovom chromatografe.
Výsledky: Identifikované proteíny boli klasifikované podľa proteínových tried, molekulových funkcií a biologických procesov. Najviac identifikovaných proteínov bolo z proteínových tried: cytoskeletálne proteíny, obranné/imunitné proteíny a štrukturálne proteíny, a proteínov zodpovedajúcich za katalytickú aktivitu a štrukturálnu molekulovú aktivitu.
Závery: Proteíny boli klasifikované do skupín na základe ich molekulovej funkcie a biologických procesov, na ktorých sa v ľudskom organizme zúčastňujú. Boli identifikované niektoré proteíny/skupiny proteínov, ktoré môžu byť zaujímavé z hľadiska skúmania etiológie niektorých orálnych ochorení, napr. anexín A1, zymogén granulárny proteín 16 homológ B, mucín-5B, oblasti Ig lambda-3 reťazca C, oblasť Ig kapa reťazca C, oblasť Ig alfa-2 reťazca C a oblasť Ig alfa-1 reťazca C.
Klíčová slova:
sliny – exozomy – proteomika – orálne ochorenia
ÚVOD A CIEĽ
Bunky nepretržite vylučujú do extracelulárneho priestoru veľké množstvo mikrovezikúl, makromolekulárnych komplexov a malých molekúl. Zo sekretovaných častíc sa v súčasnosti intenzívne skúmajú exozómy. Produkuje ich väčšina typov buniek so sekréciou do telesných tekutín vrátane krvi, moču a slín. Exozómy sú generované endozomálnou cestou a uvoľňované exocytózou multivezikulárnych telies do extracelulárneho priestoru. Tieto malé útvary (30–120 nm) obsahujú nukleové kyseliny (RNA, miRNA), proteíny a lipidy, ktoré transportujú do rôznych častí tela [1].
Predpokladá sa, že všetky exozómy vylučované bunkami v kultúre do média alebo rôznymi orgánmi do pridružených telesných tekutín sa podieľajú na medzibunkovej komunikácii, či už podporujú, alebo narúšajú rôzne fyziologické procesy [2].
V závislosti od buniek/tkanív, z ktorých exozómy pochádzajú, je možné priradiť im rôzne funkcie: sprostredkovanie imunitnej reakcie, účasť v programovej bunkovej smrti, angiogenéze, zápale a koagulácii, účasť pri spracovaní a degradácii RNA, rozšírení nádorov, priónových proteínov a retrovírusov [3].
Diagnostike ochorení na báze proteínov slín sa v súčasnosti venuje čoraz väčšia pozornosť, pretože je neinvazívna a sekréty slinných žliaz sa získavajú jednoducho v porovnaní s inými metódami s možnosťou viacnásobného opakovania i v kratšom časovom úseku. Okrem toho je obsah slinných proteínov podobný obsahu proteínov plazmy v dôsledku fyzikálnej interakcie medzi zdrojmi slín a krvou [4].
Na izoláciu exozómov v slinách existujú dve základné metódy: klasická fyzikálna metóda ultracentrifugácie a precipitácia exozómov pomocou špeciálnych chemických agentov. Pre možnú kontamináciu neexozomálnymi proteínmi je pomerne technicky náročné izolovať exozómy z biologických materiálov. V tomto zmysle má práve izolácia exozómov zo slín ultracentrifugáciou výhody kvôli minimálnej kontaminácii vzorky [5].
V poslednom období pribúdajú dôkazy o možnej korelácii exozómov v slinách s orálnymi chorobami, ako je rakovina ústnej dutiny [6], orálny lichen planus [7], Sjögrenov syndróm [8], alebo inými systémovými ochoreniami, ako je zápalové ochorenie čriev [9], rakovina pankreasu [10] a rakovina pľúc [11].
Cieľom práce bolo preto overiť efektívnosť ultracentrifugačnej metódy izolácie exozómov zo slín, izolovať a identifikovať pomocou hmotnostnej spektrometrie (MS) proteíny v nich obsiahnuté s dôrazom na exozomálne proteíny súvisiace s ochoreniami ústnej dutiny alebo systematickými ochoreniami s prejavmi v ústnej dutine.
MATERIÁL A METODIKA
Materiál a chemikálie
Pri experimentoch boli použité: acetón a chlorid vápenatý (ApplyChem, Darmstadt, Nemecko), močovina, DL-ditiotreitol (DTT), Tris-HCL, tiomočovina, jódoacetamid, Quick Bradfordova testovacia súprava a albumín z bovinného séra (BioRad, Kalifornia, USA) a kokteil inhibítorov proteáz (Sigma, St. Louis, Missouri, USA). Pre enzymatické štiepenie proteínov bol použitý prasací trypsín (Promega, Madison, WI, USA). Bol použitý fosfátový tlmivý roztok (PBS) a Laemmliho roztok. Všetky chemikálie a činidlá vrátane etanolu, metanolu, chloroformu, kyseliny trifluóroctovej (TFA) a kyseliny mravčej (FA) boli kvality vhodnej pre MS.
Odber slín a príprava vzorky
Plná nestimulovaná slina bola získaná od piatich zdravých dobrovoľníkov vo veku od 22 do 24 rokov (schválené etickou komisiou Lekárskej fakulty, Univerzita P. J. Šafárika v Košiciach, číslo protokolu: 2N/2017). Približne 10–15 ml slín bolo zozbieraných ráno medzi 9. a 10. hodinou do 50 ml polypropylénovej skúmavky (BD Falcon, BD Bioscience, New Jersey, USA) umiestnenej na ľade. Sekrécia sliny nebola stimulovaná chemicky ani mechanicky. Po odbere bol k slinám pridaný 1 µl kokteilu inhibítorov proteáz (CIP) na 1 ml sliny, aby sa zabránilo degradácii vzorky spôsobenej enzýmami z epiteliálnych buniek, leukocytov a orálnych mikroorganizmov. Vzorka bola následne doplnená PBS v pomere 1 : 1 k odobratej sline.
Slina bola prečistená centrifugáciou pri 2000xg pri 4 °C počas 30 minút (Hermle Z36HK, rotor Hermle 221.19). Pelety boli odstránené, supernatant bol premiestnený do polyalomérových skúmaviek (Beckman, Beckman Instruments, Inc., Palo Alto, Kalifornia) a doplnený do 12,5 ml PBS. Nasledovala centrifugácia pri 14000×g pri 4 °C počas 45 minút (Beckman Coulter Allegra 64R, rotor Beckman F1010). V ďalšom kroku bol supernatant doplnený PBS tak, aby výsledný objem vzorky bol 12,5 mla centrifugovaný (Beckman Coulter Avanti S-30I, výkyvný rotor JS-24) pri 110500xg pri 4 °C 70 minút. Po odstránení supernatantu boli pelety rozsuspendované v 1 ml PBS. Skúmavky boli následne doplnené PBS do 12,5 ml a opakovane centrifugované za tých istých podmienok. Supernatant bol odstránený a pelety rozsuspendované v 0,5 ml PBS. Roztok bol prenesený do dvoch otvorených hrubostenných polyalomérových 1ml skúmaviek (Beckman, Beckman Instruments, Inc., Palo Alto, Kalifornia) a centrifugovaný na laboratórnej ultracentrifúge (Beckman Coulter Optima MAX-XP ultracentrifuge, rotor MLA-130) pri 110500xg pri 4 °C 70 minút. Supernatant bol odstránený, peleta bola rozpustená v 50 µl PBS (obr. 1).
Image 1. Schéma purifikácie exozómov založená na ultracentrifugácii. Relatívna centrifugačná sila a trvanie jednotlivých centrifugácii je uvedené vpravo (upravené podľa [30])
Fig. 1 Exosome purification scheme based on ultracentrifugation. The relative centrifugal force and the duration of the individual centrifugations are given on the right (adapted from [30])![Schéma purifikácie
exozómov založená na
ultracentrifugácii. Relatívna
centrifugačná sila a trvanie
jednotlivých centrifugácii je
uvedené vpravo (upravené
podľa [30])<br>
Fig. 1
Exosome purification scheme
based on ultracentrifugation.
The relative centrifugal force
and the duration of the
individual centrifugations are
given on the right (adapted
from [30])](https://www.prolekare.cz/media/cache/resolve/media_object_image_small/media/image_pdf/712d025269add11b4c6ef7e5d1404c75.png)
Skúška celkového obsahu proteínov
Z pelety rozpustenej v 50 µl PBS bolo odobratých 5 µl roztoku, ku ktorému bolo pridaných 5 µl Laemmliho roztoku na lyzáciu exozómov. Celkový obsah proteínov bol stanovený Bradfordovou metódou pomocou Quick Start Bradford Protein Assay (BioRad, Hercules, California, USA) s albumínom z bovinného séra (BioRad, Hercules, California, USA). Absorpcia bola meraná spektrofotometricky (UV – 3600 Spectrophotometer, Shimadzu Corp., Kyoto, Japonsko) pri vlnovej dĺžke 595 nm.
Metanolová/chloroformová precipitácia proteínov
K pripravenému objemu vzorky bol pridaný metanol v pomere 4 : 1. Zmes bola postupne doplnená o 100 µl chloroformu a 300 µl ultračistej vody s intenzívnym zamiešaním pri 750 ot/min po oboch krokoch. Nasledovala centrifugácia vzorky 2 min pri 14000xg. Vodná vrstva bola odstránená tak, aby tenký povlak proteínov medzi jednotlivými vrstvami ostal neporušený. K roztoku bolo pridaných 400 µl metanolu, zmes bola opäť krátko zvortexovaná pri 750 ot/min a centrifugovaná 3 min pri 14000×g. Peleta vyzrážaných proteínov bola po odstránení supernatantu vysušená pomocou vákuového koncentrátora (CentriVap Vacuum Concentrator, Labconco, Kansas City, USA).
Enzymatické štiepenie proteínov trypsínom v roztoku
Proteíny boli resuspendované v roztoku 8 mol l-1 močoviny/100 mmol l-1 Tris-HCl (pH = 8). Redukcia disulfidových väzieb bola dosiahnutá pridaním stechiometrického množstva 0,1 mol l-1 ditiotreitolu/100 mmol l-1 Tris-HCl (pH = 8) a inkubáciou 30 minút pri teplote 37 °C. Tiolové skupiny boli alkylované pomocou 0,5 mol l-1 jódoacetamidu/100 mmol l-1 Tris-HCl (pH = 8) 30 min v tme pri teplote 37 °C. Proteíny boli vyzrážané acetónom (inkubácii 60 min pri -25 °C). Vyzrážané proteíny boli po odstránení supernatantu vysušené vo vákuovom koncentrátore. Proteínová vzorka bola resuspendovaná v roztoku 8 mol l-1 močoviny/100 mmol l-1 Tris-HCl (pH = 8). Roztok bol zriedený 2 mmol l-1 chloridom vápenatým/10 mmol l-1 Tris-HCl tak, aby výsledná koncentrácia močoviny bola 2 mol l-1. Počas noci prebehlo enzymatické štiepenie proteínov pridaním trypsínu (0,1 µg µl-1) pri teplote 37 °C. Aktivita trypsínu bola na druhý deň inhibovaná pridaním 1/20 objemu 20% TFA.
Čistenie v C18 kolónach
Vzorka bola zbavená nežiaducich látok, solí a amfolytov extrakciou látok na tuhej fáze (solid phase extraction – SPE) v kolóne Bond Elut C18 (Agilent Technologies, Santa Clara, Kalifornia, USA). Bol použitý preplachovací roztok H2O/metanol/acetonitril (34 : 33 : 33; v/v/v), vlhčiaci roztok H2O/acetonitril (50 : 50; v/v) a ekvilibračný roztok H2O/acetonitril/TFA (94,5 : 5:0,5; v/v). Peptidy boli eluované do čistej skúmavky roztokom acetonitrilu/H2O/FA (70 : 29,9 : 0,1; v/v/v).
LC-MS analýza
Identifikácia proteínov extrahovaných z exozómov bola vykonaná pomocou LC-MS analýzy prístupom bottom-up. Peptidy boli separované na kolóne so stacionárnou fázou C18 (Acclaim PepMap, Thermo Scientific 75 μmx150mm, 300 A) na kvapalinovom chromatografe (Agilent 1260) v gradiente od 4% mobilnej fázy B (0,1% FA+98% ACN) do 35% mobilnej fázy B počas 60 minút nasledované výplachom kolóny pomocou 80% mobilnej fázy B počas 10 minút a ekvilibračnou fázou so 4% mobilnou fázou B počas 30 minút (mobilná fáza A – 0,1% FA). Peptidy boli on-line identifikované pomocou hmotnostného spektrometra Agilent QTOF UHD 6538 v auto MS/MS móde. Parametre pre auto MS/MS mód boli nasledovné: na každý MS scan bolo vybraných 5 prekurzorov pre následnú MS/MS analýzu podľa ich intenzity s nábojom 2+ alebo 3+ a aktívnou exklúziou už zmeraného prekurzora počas nasledujúcich 0,3 min. Namerané hmotnostné spektrá boli následne vyhodnotené pomocou kompletného proteomického softvéru Proteinscape 3.1 s vyhľadávacím algoritmom MASCOT 2.4. Parametre vyhľadávania boli nastavené nasledovne: taxonómia HOMO SAPIENS, fixná modifikácia – karbamidometylácia (Cys), variabilné modifikácie – oxidácia (Met), fosforilácia (Ser, Thr, Tyr) a acetylácia N konca peptidov, presnosť určenia hmoty prekurzora do 50 ppm a v MS/MS móde do 500 ppm, vybrané prekurzory museli mať náboj viac ako 1+. Aby boli vylúčené falošne pozitívne identifikácie extrahovaných proteínov, bol nastavený tzv. false discovery rate na 1 %.
VÝSLEDKY
Cieľom experimentov bolo preskúmať možnosti zvoleného spôsobu identifikácie proteínového obsahu exozómov ľudských slín. Úplný zoznam proteínov identifikovaných vo vzorkách z plnej nestimulovanej sliny je uvedený v tab. 1.
Table 1. Zoznam proteínov identifikovaných vo vzorkách exozómov z plnej nestimulovanej sliny
Tab. 1 1 List of proteins identified in exosome samples from the whole unstimulated saliva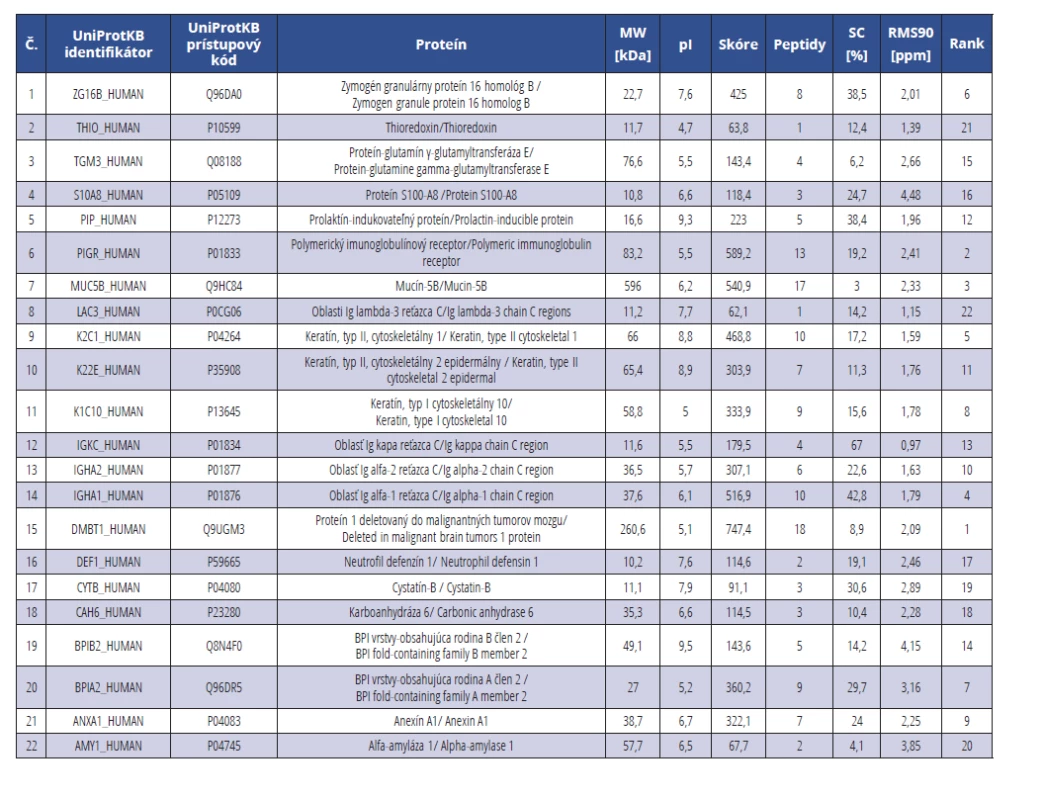
Identifikované proteíny boli klasifikované podľa proteínových tried, molekulových funkcií a biologických procesov, ktorých sú súčasťou, v súlade s Genome Ontology (GO) klasifikáciou s pomocou databázy PANTHER (http://pantherdb.org/). Výsledky sú znázornené graficky (graf 1–3).
Z GO klasifikácie identifikovaných proteínov podľa ich proteínových skupín (graf 1) vyplýva, že najviac identifikovaných proteínov bolo z proteínových tried: cytoskeletálne proteíny, obranné/imunitné proteíny a štrukturálne proteíny (12 %). Identifikované proteíny sme taktiež pomocou GO klasifikácie zatriedili podľa molekulovej funkcie (graf 2).
Graph 1. GO klasifikácia identifikovaných proteínov do proteínových tried
Graph 1 GO classification of identified proteins into protein classes
Graph 2. GO klasifikácia identifikovaných proteínov podľa ich molekulovej funkcie
Graph 2 GO classification of identified proteins according to their molecular function
Z grafu vyplýva, že prevažná časť identifikovaných proteínov zodpovedá za katalytickú aktivitu (43 %) a štrukturálnu molekulovú aktivitu (22 %). GO klasifikácia proteínov podľa biologických procesov, na ktorých sa podieľajú, je zobrazená na grafu 3. Z grafu vyplýva, že identifikované proteíny sa v najväčšej miere podieľajú na metabolických procesoch (25 %) a bunkových procesoch (20 %), ktoré zahŕňajú procesy na bunkovej úrovni, ale nie sú nevyhnutne obmedzené na jedinú bunku, napr. medzibunková komunikácia.
Graph 3. GO klasifikácia identifikovaných proteínov podľa typu biologických procesov, na ktorých sa podieľajú
Graph 3 GO classification of identified proteins according to the type of biological processes in which they participate
V ďalšom kroku sme vykonali analýzu identifikovaných proteínov s využitím databázy OralCard (http://bioinformatics.ua.pt/OralCard/). Táto databáza predstavuje vhodný zdroj informácii o proteínoch obsiahnutých v ľudských slinách, proteín-proteínových interakciách a súvislostiach vzniku ochorení, ktoré sa prejavujú v ústnej dutine, s expresiou jednotlivých proteínov v slinách. V tab. 2 sú uvedené identifikované proteíny a ich skupiny z hľadiska ich možného podielu na vzniku rôznych ochorení ústnej dutiny alebo systémových ochorení s prejavmi v ústnej dutine.
Table 2. Zoznam skupín proteínov identifikovaných vo vzorkách exozómov z plnej nestimulovanej sliny korelujúcich s niektorými ochoreniami (OralCard, http://bioinformatics.ua.pt/OralCard/)
Tab. 2 List of groups of proteins identified in exosome samples from the whole unstimulated saliva correlated with certain diseases (OralCard, http://bioinformatics.ua.pt/OralCard/)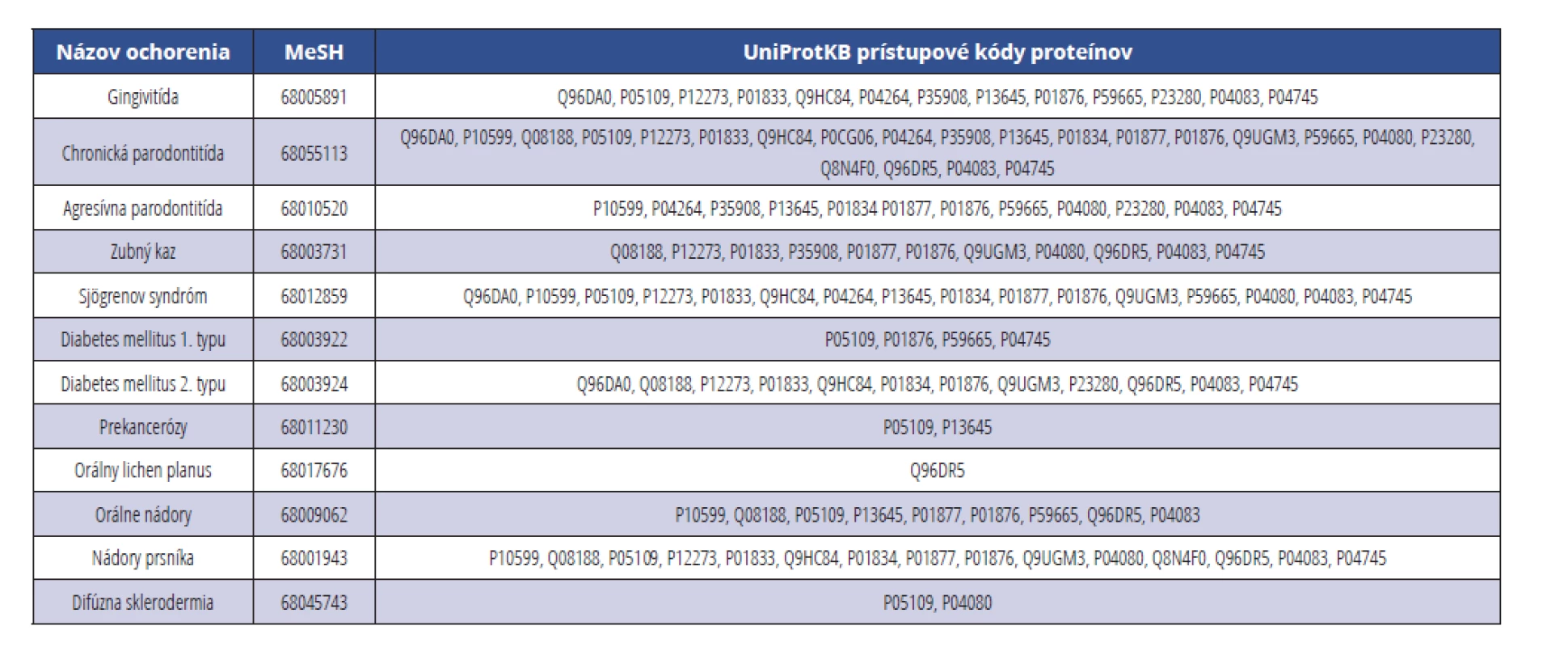
DISKUSIA
LC-MS analýzou proteínov slinných exozómov bolo identifikovaných 22 proteínov z rôznych proteínových rodín. Medzi ne patria 3 proteíny z rodiny keratínov a 4 z rodiny imunoglobulínov. Ďalej sme identifikovali rôzne mikrovezikulové proteíny, napr. zymogén granulárny proteín 16 homológ B, mucín-5B, oblasti Ig lambda-3 reťazca C, oblasť Ig kapa reťazca C, oblasť Ig alfa-2 reťazca C a oblasť Ig alfa-1 reťazca C. Ďalej boli izolované: proteín-glutamín γ-glutamyltransferáza E, proteín S100-A8, neutrofil defenzín 1, proteín S100-A8, anexín A1 a ďalšie. Anexín A1 (lipokortín-1) je endogénny proteín regulovaný glukokortikoidmi. Proteín hrá významnú úlohu v prirodzenej imunitnej odpovedi ako efektor glukokortikoidmi sprostredkovanej odpovede a ako regulátor zápalového procesu [12]. Kombinácia mechanizmov jeho pôsobenia vedie k účinnému zmierneniu zápalu a predstavuje tak sľubný nástroj na vývoj nových terapeutických stratégií na liečbu zápalových ochorení [13]. Up-regulovaný anexín A1 bol zaznamenaný napríklad v slinách karies-susceptibilných pacientov mužského pohlavia [14]. Proteín je aktérom i v procesoch proliferácie buniek, bunkovej signalizácie a zvlášť pri karcinogenéze. Je ďalším kľúčovým uzlom v proteínovej sieti súvisiacej s rakovinou ústnej dutiny a môže byť potenciálnym biomarkerom stupňa patologickej diferenciácie rakoviny ústnej dutiny v kombinácii s inými kľúčovými proteínmi [15, 16].
Ďalšie proteíny izolované zo slín, ktoré by mohli slúžiť ako biomarkery v diagnostike nádorov ústnej dutiny, sú proteín S100-A8 [17], proteín-glutamín γ-glutamyltransferáza E [18] a neutrofil defenzín 1 [19]. Pretože všetky rakovinové bunky produkujú exozómy od skorých štádií, a tieto extracelulárne vezikuly hrajú účinnú úlohu v prijímajúcich bunkách, ich molekulárny obsah môže poskytnúť jedinečné molekulárne markery pre včasnú diagnostiku a prognózu.
S100-A8 (calgranulín A) je proteín viažuci vápnik a zinok, ktorý hrá významnú úlohu v regulácii zápalových procesov a imunitnej reakcie. Podľa autorov prác [20, 21] hladiny S100-A8 v slinách odrážajú rôzne aspekty periodontálneho zápalu a ako také by mohli slúžiť ako biomarkery chronickej parodontitídy [22].
Ako biomarkery chronickej parodontitídy by mohli pomôcť aj prolaktín-indukovateľný proteín [23] a mucín-5B [24]. Zatiaľ čo funkcia prolaktín-indukovateľného proteínu nie je dostatočne objasnená, početné dôkazy jasne poukazujú na jeho úlohu pri vrodenej aj adaptívnej imunite. Podľa [25] prolaktín-indukovateľný proteín je zodpovedný za antimikrobiálnu humorálnu imunitnú odpoveď a je silne prepojený so vznikom ochorení závesného systému zuba a ďasien.
Mucín-5B je glykozylovaný proteín s vysokou molekulovou hmotnosťou produkovaný epitelovým tkanivom a vylučovaný mukozálnymi povrchmi, ktorého kľúčovou vlastnosťou je schopnosť tvoriť gél. Jeho antimikrobiálne vlastnosti tvoria primárnu obrannú bariéru v epitelovom tkanive. Mucín je súčasťou neimunitného obranného systému. Jeho down-regulácia je spojená s takou poruchou autoimunitného systému, ako je Sjögrenov syndróm, ktorý je asociovaný s vyšším výskytom a závažnosťou parodontitídy [24].
Integrované dáta z transcriptomických a proteomických meraní potvrdili zmenené hladiny keratínu typu II cytoskeletálneho 1 v tkanive gingivy pacientov s chronickou parodontitídou [26]. Zmena expresie keratínu, typ II, cytoskeletálny 1 a keratínu, typ II, cytoskeletálny 2 epidermálny bola pozorovaná i pri skúmaní hystopatologických vzoriek metódou MALDI-MS Imaging pri hľadaní biomarkerov užitočných pri detekcii malignantných buniek pri skvamcelulárnom karcinóme [27].
Vekovo špecifický proteín keratín, typ II cytoskeletálny 10, súvisí i so stavom zubnej hmoty, a preto informácia o jeho hladine v slinách by mohla byť asociovaná so vznikom zubného kazu [28].
Expresia proteínu polymerický imunoglobulínový receptor (PIGR), ktorého úloha je transport polymérového IgA a IgM, sa bežne zvyšuje pri reakcii na vírusovú alebo bakteriálnu infekciu; spája sa s vrodenou a získanou imunitou. Bola tiež pozorovaná abnormálna expresia PIGR pri nádoroch, ale jeho klinický význam zatiaľ zostáva neistý [29].
Izolácia exozómov predstavuje napriek dosiahnutým úspechom stále zdĺhavý, nákladný a často nereprodukovateľný proces. Na izoláciu exozómov z rôznych biologických tekutín (vrátane slín) bolo použitých doteraz niekoľko strategických prístupov. Z nich spomenieme napríklad diferenciálnu centrifugáciu [31] a centrifugáciu v hustotnom gradiente, ktorá poskytuje vzorky s vysokou čistotou [32]. Je však pomerne časovo náročná. Ultrafiltračné metódy [33] zas dovolia pripraviť vzorky, ktoré sú často kontaminované proteínmi, ktoré nie sú vezikulárneho pôvodu. Podobnými nedostatkami trpia i niektoré precipitačné metódy [34]. Pre naše prvotné experimenty sme zvolili lacnú a jednoduchú ultracentrifugačnú metódu. Umožňuje pracovať s veľkými objemami vzorky. Výsledný produkt však môže byť tak isto horšie reprodukovateľný a s nízkou čistotou. V budúcnosti nevylučujeme použitie iného spôsobu izolácie vezikúl tak, aby kvalita vzorky bola vyvážená s cenou a časom potrebným na jej prípravu.
ZÁVER
Jednoduchou ultracentrifugačnou metódou boli izolované exozómy z plných nestimulovaných slín a bottom-up proteomickým prístupom bol identifikovaný ich proteínový obsah. Slinné exozómy obsahovali proteíny z rôznych proteínových rodín vrátane troch členov rodiny keratínov, zymogén granulárny proteín 16 homológ B, mucín-5B, oblasti Ig lambda-3 reťazca C, oblasť Ig kapa reťazca C, oblasť Ig alfa-2 reťazca C a oblasť Ig alfa-1 reťazca C, proteín-glutamín γ-glutamyltransferáza E, neutrofil defenzín 1, proteín S100-A8 a ďalšie. Niektoré z nich, resp. ich skupiny, sú považované za možný rizikový faktor spojený s niektorými ochoreniami orálnej dutiny alebo systémových ochorení s prejavmi v ústnej dutine. Kým predchádzajúce štúdie sa opierali predovšetkým o proteomické skúmanie krvi, synoviálnej tekutiny či tkanív izolovaných z rôznych častí ústnej dutiny, nami zvolené slinné vezikuly predstavujú menej komplikovaný systém. Odber vzoriek slín je pomerne jednoduchá a málo nákladná metóda, ktorá by mohla uľahčiť presnú a včasnú diagnostiku niektorých ochorení. Pri zdokonalení metodiky môžu byť exozómy zdrojom diagnostických biomarkerov pre široké spektrum chorôb a môžu nájsť v budúcnosti uplatnenie v diagnostike a terapii rôznych ochorení ústnej dutiny.
Tento výskum sa uskutočnil s podporou Agentúry MŠVVaŠ SR pre štrukturálne fondy EÚ, projekt: ITMS 26220120039 a Vedeckej grantovej agentúry MŠVVaŠ SR a SAV, VEGA grant: 1/0196/20.
RNDr. Galina Laputková, CSc.
Ústav lekárskej a klinickej biofyziky
Lekárska fakulta UPJ Šafárika
Trieda SNP 1
040 11 Košice
e-mail: galina.laputkova@upjs.sk
Sources
1. Vlassov AV, Magdaleno S, Setterquist R, Conrad R. Exosomes: current knowledge of their composition, biological functions, and diagnostic and therapeutic potentials. Biochim Biophys Acta. 2012; 1820(7): 940–948.
2. Meldolesi J. Exosomes and ectosomes in intercellular communication. Curr Biol. 2018; 28(8): R435–R444.
3. Zheng X, Chen F, Zhang J, Zhang Q, Lin J. Exosome analysis: a promising biomarker system with special attention to saliva. J Membr Biol. 2014; 247(11): 1129–1136.
4. Keller S, Ridinger J, Rupp AK, Janssen JW, Altevogt P. Body fluid derived exosomes as a novel template for clinical diagnostics. J Transl Med. 2011; 9 : 86.
5. Zlotogorski-Hurvitz A, Dayan D, Chaushu G, Korvala J, Salo T, Sormunen R, Vered M. Human saliva-derived exosomes: comparing methods of isolation. J Histochem Cytochem. 2015; 63(3): 181–189.
6. Zlotogorski-Hurvitz A, Dayan D, Chaushu G, Salo T, Vered M. Morphological and molecular features of oral fluid-derived exosomes: oral cancer patients versus healthy individuals. J Cancer Res Clin Oncol. 2016; 142(1): 101–110.
7. Byun JS, Hong SH, Choi JK, Jung JK, Lee HJ. Diagnostic profiling of salivary exosomal microRNAs in oral lichen planus patients. Oral Dis. 2015; 21(8): 987–993.
8. Katsiougiannis S, Wong DT. The proteomics of saliva in Sjögren's syndrome. Rheum Dis Clin North Am. 2016; 42(3): 449–456.
9. Zheng X, Chen F, Zhang Q, Liu Y, You P, Sun S, Lin J, Chen N. Salivary exosomal PSMA7: a promising biomarker of inflammatory bowel disease. Protein Cell. 2017; 8(9): 686–695.
10. Lau C, Kim Y, Chia D, Spielmann N, Eibl G, Elashoff D, Wei F, Lin YL, Moro A, Grogan T, Chiang S, Feinstein E, Schafer C, Farrell J, Wong DT. Role of pancreatic cancer-derived exosomes in salivary biomarker development. J Biol Chem. 2013; 288(37): 26888–26897.
11. Sun Y, Xia Z, Shang Z, Sun K, Niu X, Qian L, Fan LY, Cao CX, Xiao H. Facile preparation of salivary extracellular vesicles for cancer proteomics. Sci Rep. 2016; 6 : 24669.
12. UniProt Consortium. UniProt: a hub for protein information. Nucleic Acids Res. 2015; 43(Database issue): D204–D212.
13. Sugimoto MA, Vago JP, Teixeira MM, Sousa LP. Annexin A1 and the resolution of inflammation: modulation of neutrophil recruitment, apoptosis, and clearance. J Immunol Res. 2016; 2016 : 8239258.
14. Kulhavá L, Eckhardt A, Pataridis S, Bartoš M, Foltán R, Mikšík I. Differences of saliva composition in relation to tooth decay and gender. Folia Biol. 2018; 64(5/6): 195–203.
15. Amiri Dash Atan N, Koushki M, Rezaei Tavirani M, Ahmadi NA. Protein-protein interaction network analysis of salivary proteomic data in oral cancer cases. Asian Pac J Cancer Prev. 2018; 19(6): 1639–1645.
16. Foo SL, Yap G, Cui J, Lim LHK. Annexin-A1 – A blessing or a curse in cancer? Trends Mol Med. 2019; 25(4): 315–327.
17. Jou YJ, Hua CH, Lin CD, Lai CH, Huang SH, Tsai MH, Kao JY, Lin CW. S100A8 as potential salivary biomarker of oral squamous cell carcinoma using nanoLC-MS/MS. Clin Chim Acta. 2014; 436 : 121–129.
18. Zhang S, Tian L, Ma P, Sun Q, Zhang K, GuanchaoWang, Liu H, Xu B. Potential role of differentially expressed lncRNAs in the pathogenesis of oral squamous cell carcinoma. Arch Oral Biol. 2015; 60(10): 1581–1587.
19. Dickinson A, Saraswat M, Mäkitie A, Silén R, Hagström J, Haglund C, Joenväärä S, Silén S. Label-free tissue proteomics can classify oral squamous cell carcinoma from healthy tissue in a stage-specific manner. Oral Oncol. 2018; 86 : 206–215.
20. Holmström SB, Lira-Junior R, Zwicker S, Majster M, Gustafsson A, Åkerman S, Klinge B, Svensson M, Boström EA. MMP-12 and S100s in saliva reflect different aspects of periodontal inflammation. Cytokine. 2019; 113 : 155–161.
21. Dommisch H, Skora P, Hirschfeld J, Olk G, Hildebrandt L, Jepsen S. The guardians of the periodontium-sequential and differential expression of antimicrobial peptides during gingival inflammation. Results from in vivo and in vitro studies. J Clin Periodontol. 2019; 46(3): 276–285.
22. Shin MS, Kim YG, Shin YJ, Ko BJ, Kim S, Kim HD. Deep sequencing salivary proteins for periodontitis using proteomics. Clin Oral Investig. 2019; 23(9): 3571–3580.
23. Grant M, Kilsgård O, Åkerman S, Klinge B, Demmer RT, Malmström J, Jönsson D. The human salivary antimicrobial peptide profile according to the oral microbiota in health, periodontitis and smoking. J Innate Immun. 2019; 11(5): 432–444.
24. Bostanci N, Selevsek N, Wolski W, Grossmann J, Bao K, Wahlander A, Trachsel C, Schlapbach R, Öztürk VÖ, Afacan B, Emingil G, Belibasakis GN. Targeted proteomics guided by label-free quantitative proteome analysis in saliva reveal transition signatures from health to periodontal disease. Mol Cell Proteomics. 2018; 17(7): 1392–1409.
25. Hartenbach FARR, Velasquez É, Nogueira FCS, Domont GB, Ferreira E, Colombo APV. Proteomic analysis of whole saliva in chronic periodontitis. J Proteomics. 2020; 213 : 103602.
26. Guzeldemir-Akcakanat E, Alkan B, Sunnetci-Akkoyunlu D, Gurel B, Balta VM, Kan B, Akgun E, Yilmaz EB, Baykal AT, Cine N, Olgac V, Gumuslu E, Savli H. Molecular signatures of chronic periodontitis in gingiva: A genomic and proteomic analysis. J Periodontol. 2019; 90(6): 663–673.
27. Hoffmann F, Umbreit C, Krüger T, Pelzel D,Ernst G, Kniemeyer O, Guntinas-Lichius O, Berndt A, von Eggeling F. Identification of proteomic markers in head and neck cancer using MALDI-MS imaging, LC-MS/MS, and immunohistochemistry. Proteomics Clin Appl. 2019; 13(1): e1700173.
28. Wang K, Wang X, Zheng S, Niu Y, Zheng W, Qin X, Li Z, Luo J, Jiang W, Zhou X, Li W, Zhang L. iTRAQ-based quantitative analysis of age-specific variations in salivary proteome of caries-susceptible individuals. J Transl Med. 2018; 16(1): 293.
29. Ai J, Tang Q, Wu Y, Xu Y, Feng T, Zhou R, Chen Y, Gao X, Zhu Q, Yue X, Pan Q, Xu S, Li J, Huang M, Daugherty-Holtrop J, He Y, Xu HE, Fan J, Ding J, Geng M. The role of polymeric immunoglobulin receptor in inflammation-induced tumor metastasis of human hepatocellular carcinoma. J Natl Cancer Inst. 2011; 103(22): 1696–1712.
30. Théry C, Amigorena S, Raposo G, Clayton A. Isolation and characterization of exosomes from cell culture supernatants and biological fluids. Curr Protoc Cell Biol. 2006; Chapter 3: Unit 3.22.
31. Skog J, Würdinger T, Van Rijn S,Meijer DH, Gainche L, Curry WT Jr, Carter BS, Krichevsky AM, Breakefield XO. Glioblastoma microvesicles transport RNA and proteins that promote tumour growth and provide diagnostic biomarkers. Nat Cell Biol 2008; 10(12): 1470–1476.
32. Beyer C, Pisetsky DS. The role of microparticles in the pathogenesis of rheumatic diseases. Nat Rev Rheumatol. 2010; 6(1): 21–29.
33. Han Y, Jia L, Zheng Y, Li W. Salivary exosomes: emerging roles in systemic disease. Int J Biol Sci. 2018; 14(6): 633–643.
34. Greening DW, Xu R, Ji H, Tauro BJ, Simpson RJ. A protocol for exosome isolation and characterization: evaluation of ultracentrifugation, density-gradient separation, and immunoaffinity capture methods. Methods Mol Biol. 2015; 1295 : 179–209.
Labels
Maxillofacial surgery Orthodontics Dental medicine
Article was published inCzech Dental Journal

2021 Issue 3-
All articles in this issue
- EDITORIAL
- SLAVNOSTNÍ A ODBORNÉ UDÁLOSTI K 30. VÝROČÍ ČSK
- ZMĚNY ORÁLNÍHO MIKROBIOMU V PRŮBĚHU NECHIRURGICKÉ TERAPIE PACIENTŮ S POKROČILOU PARODONTITIDOU
- PROTEÓM SLINNÝCH EXOZÓMOV AKO NOVÝ PROSTRIEDOK PRE DIAGNOSTIKU ORÁLNYCH OCHORENÍ
- OŠETŘENÍ KAZU BLÍZKÉHO ZUBNÍ DŘENI A METODA ODLOŽENÉ EXKAVACE
- SBORNÍK ABSTRAKTŮ KONFERENCE ÚSMĚV 021
- Czech Dental Journal
- Journal archive
- Current issue
- Online only
- About the journal
Most read in this issue- OŠETŘENÍ KAZU BLÍZKÉHO ZUBNÍ DŘENI A METODA ODLOŽENÉ EXKAVACE
- ZMĚNY ORÁLNÍHO MIKROBIOMU V PRŮBĚHU NECHIRURGICKÉ TERAPIE PACIENTŮ S POKROČILOU PARODONTITIDOU
- PROTEÓM SLINNÝCH EXOZÓMOV AKO NOVÝ PROSTRIEDOK PRE DIAGNOSTIKU ORÁLNYCH OCHORENÍ
- SBORNÍK ABSTRAKTŮ KONFERENCE ÚSMĚV 021
Login#ADS_BOTTOM_SCRIPTS#Forgotten passwordEnter the email address that you registered with. We will send you instructions on how to set a new password.
- Career

