-
Medical journals
- Career
Hojení patologických kostních dutin čelistí po augmentaci
: M. Machálka; O. Bulik; O. Liberda
: Klinika ústní, čelistní a obličejové chirurgie LF MU a FN, Brno
: Česká stomatologie / Praktické zubní lékařství, ročník 109, 2009, 3, s. 54-57
Patologické kostní dutiny v čelistech souvisejí s výskytem kostních cyst a tumorů. U rozsáhlé kostní dutiny po cystektomii se může pooperační hematom při dehiscenci sutury sliznice zánětem rozpadnout. Dutina po cystě je spojená s ústní dutinou, hojí se komplikovaně a dlouhodobě. Je snahou vyplňovat dutiny materiálem, který nejen zmenší jejich objem, ale také stimuluje novou tvorbu kosti.
Z materiálů, které sledujeme v rámci výzkumné aktivity, jsme užívali lidskou lyofilizovanou kostní drť (tři díly) a jeden díl trikalciumfosfátu, které jsou smíchány s venózní krví nemocného do vytvoření soudržné hmoty augmentátu. Antibiotika jsme nepřidávali. U nemocných po augmentaci a u kontrolní skupiny bez implantace materiálu pravidelně sledujeme stav kostního hojení a případné komplikace.
Dosavadní výsledky u 32 nemocných s vyplněním směsí uvedených materiálů do 21 kostních dutin po cystách a u 11 kostních benigních tumorů ukazují na nekomplikované hojení.Klíčová slova:
kostní odontogenní cysty - augmentace - lyofilizovaná kostní drťÚVOD
V čelistní chirurgii nejsou vzácné případy potřeby nahradit a také zmenšit prostor patologických kostních dutin [7]. Pozvolna rostoucí odontogenní kostní cysty i benigní kostní tumory jsou nejčastější příčinou těchto kostních defektů. Již v minulosti se chirurgové snažili velké kostní dutiny vyplňovat vhodným nedráždivým materiálem, z počátku se snahou zmenšit velikost dutiny, kde se po exstirpaci tvoří krevní koagulum, které je nejpřirozenějším a nejvhodnějším prvotním obvazem a výplní. Velikost tohoto patologického prostoru a provedení sutury z části nad dutinou bez kostního podkladu však často zapříčinilo rozestup slizniční rány s infekcí obsahu dutiny a rozpadem koagula [6]. U rozsáhlých dutin nezbývalo něž zvolit metodu marsupializace s vytvořením širokého spojení dutiny s ústní dutinou. Hojení těchto defektů je však zdlouhavé a nemocného velmi obtěžuje. Když se dutina zmenšila (dříve se užívala i pálená křída, kostní moučka a podobně), bylo hojení nerušené. Takovýto materiál se ale později také často stával nežádoucím neresorbovatelným cizím předmětem a obtížně se zde tvořila potřebná pletivová kost. Je proto snahou hledat a zkoušet vhodné materiály, které tyto požadavky splní bez poškození příjemce a zajistí dokonalé vyhojení kostní rány [1].
MATERIÁL A METODIKA
Podle stanovených kritérií jsme vyšetřili 522 nemocných, z nichž bylo 268 mužů a 254 žen, přicházejících s diagnózou odontogenní kostní cysty nebo benigně rostoucího kostního nádoru čelistí. Na vzniku patologických kostních dutin čelistí se nejvíce podílely radikulární cysty (342), vývojové cysty (33), ostatní cysty (61) a benigní kostní tumory (86). Z nich jsme do konce roku 2008 vybrali 32 nemocných, 21 žen a 11 mužů, v průměrném věku 27,5 let, u nichž jsme po exstirpaci patologického procesu provedli augmentaci velké dutiny (obr. 1).
1. Patologická kostní dutina po exstirpaci odontogenní cysty. 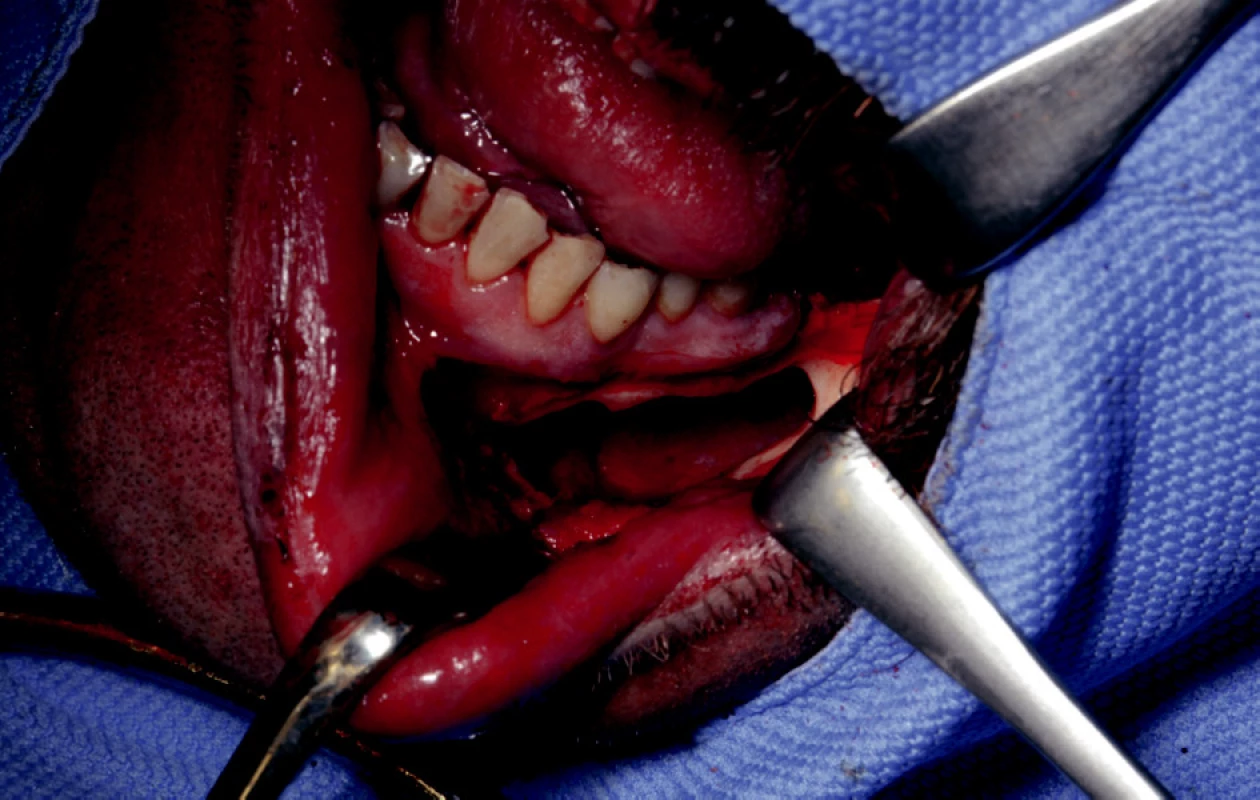
Vybrali jsme zdravé nemocné s ukončeným kostním růstem, s patologickou dobře ohraničenou jednokomorovou dutinou s obsahem nad 10 ml, bez klinických známek zánětu, s možností dokonalého endodontického ošetření zubů do ní zasahujících a s dostatkem měkkých tkání k primárnímu uzávěru po operaci. Podle předcházejících výsledků hodnocení různých augmentačních materiálů jsme pro tuto skupinu zvolili směs složenou ze 3 dílů drcené tříděné lidské kostní spongiózy, která byla lyofilizována a sterilizována zářením [5]. Směs byla opatřena všemi potřebnými atesty a byla vyrobena Tkáňovou stanicí ve FN Brno. Dále jsem přidali 1 díl trikalciumfosfátu, dodávaného v granulích o velikosti 0,6-1,0 mm ve sterilní formě tuzemskou firmou Lasak [4]. Pro vytvoření spojení a možnost dobré aplikace jsme přidávali venózní krev příjemce (obr. 2). Do směsi jsme nepřidávali žádná antibiotika nebo jiné materiály. Ke krytí vstupního defektu operačního vstupu do dutiny jsme při uzávěru neužívali žádnou membránu.
2. Připravená směs augmentátu. 
Metody uvedené augmentace byly projednány a schváleny etickou komisí nemocnice. Kostní dutina se v závěru operace vyplnila v celém svém rozsahu uvedeným augmentátem (obr. 3) a byla provedena dokonalá sutura sliznice.
3. Kostní dutina vyplněná augmentátem. 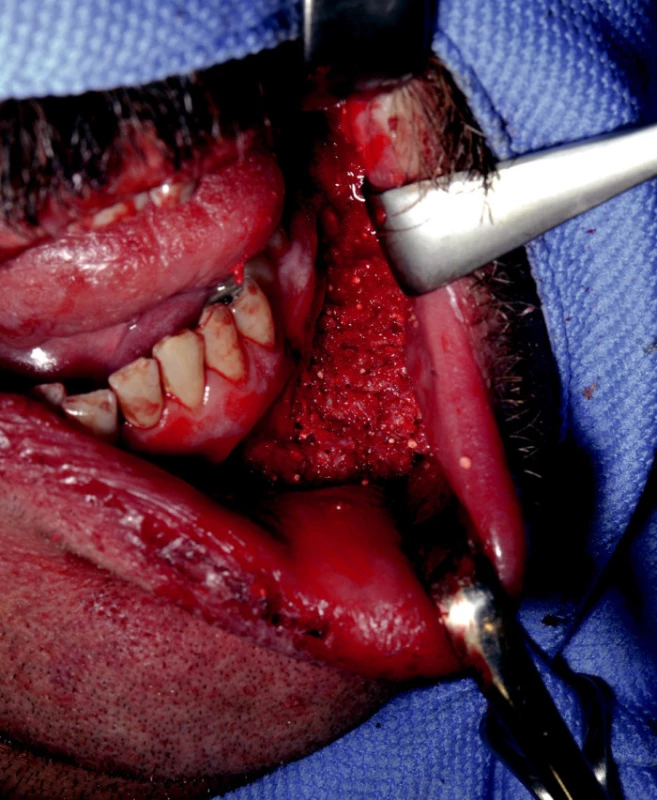
Vedle této skupiny nemocných jsme vytvořili kontrolní skupinu 10 nemocných (6 mužů a 4 ženy v průměrném věku 24,3 let) s obdobnou patologickou dutinou vybranou podle stejných kritérií, kde jsme augmentaci neprovedli. Obě skupiny jsme pravidelně kontrolovali jak lokálním vyšetřením, tak i zhotovením rentgenogramů v intervalech 1 měsíc, 6 měsíců a 1 rok od operace.
VÝSLEDKY
U skupiny nemocných s augmentací jsme zaznamenali zánětlivou komplikaci celkem u dvou nemocných. U jednoho z nich byla dehiscence operační rány s částečným prořezáním a ztrátou augmentátu a druhá nemocná udávala neurčité parestetické obtíže při aplikaci do dutiny v čelistním úhlu.
V kontrolní skupině, kde bylo jen 10 nemocných, se objevily čtyři zánětlivé komplikace a hojení s rozestupem operační rány jsme zaznamenali u pěti nemocných. Na kontrolních rentgenogramech bylo u augmentací patrné kompaktní vyplnění dutiny (obr. 4, obr. 5). V dutinách, kde se vytváří novotvořená pletivová kost, jsou místy dlouhodobě patrné ostrůvky alogenního materiálu. Nedochází zde k tvorbě nových patologických dutin. Novotvorba kosti v dutinách bez augmentace je málo patrná, dlouho přetrvává kostní defekt.
4. Ortopantomogram nemocného jeden měsíc po vyplnění kostní dutiny. 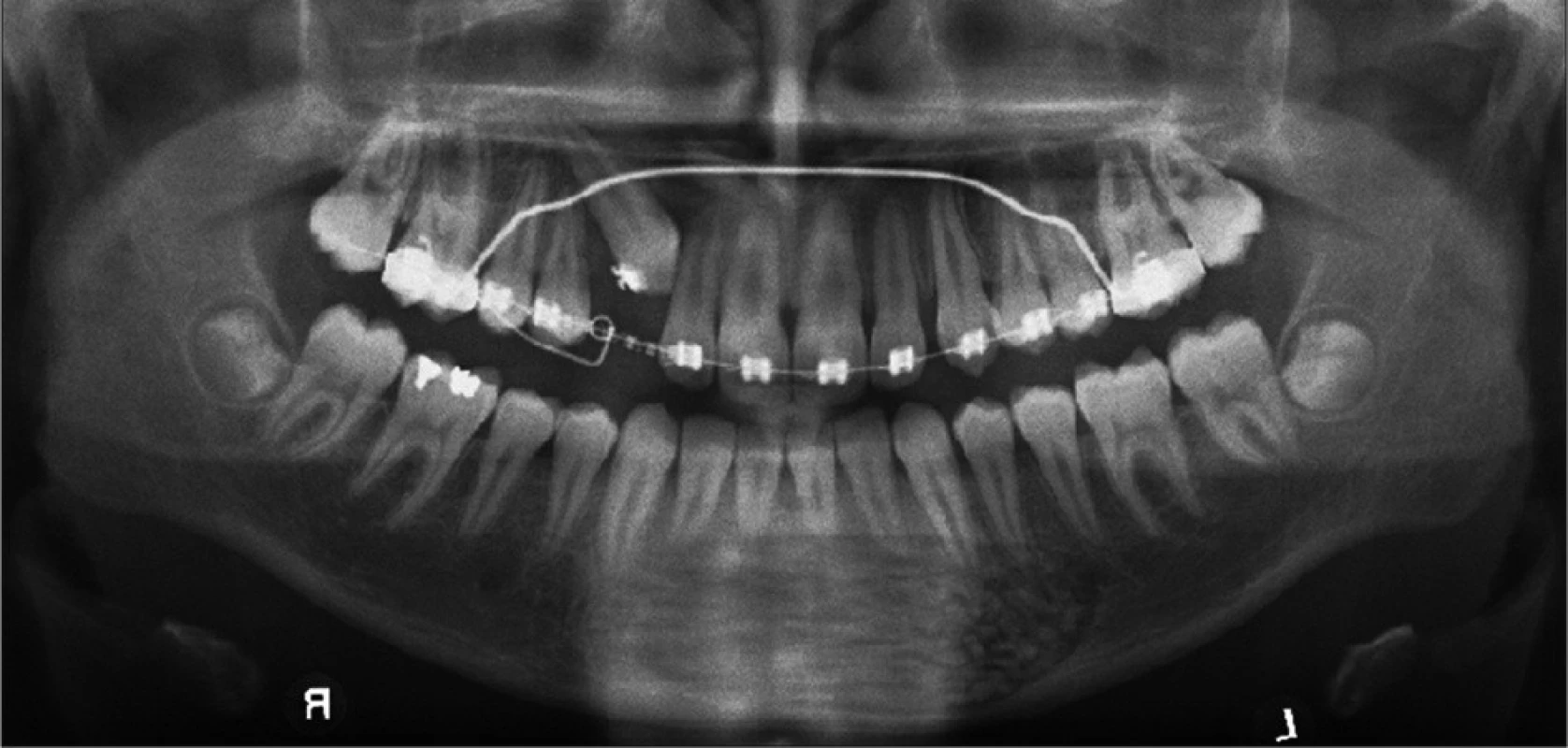
5. Ortopantomogram téhož nemocného po jednom roce. 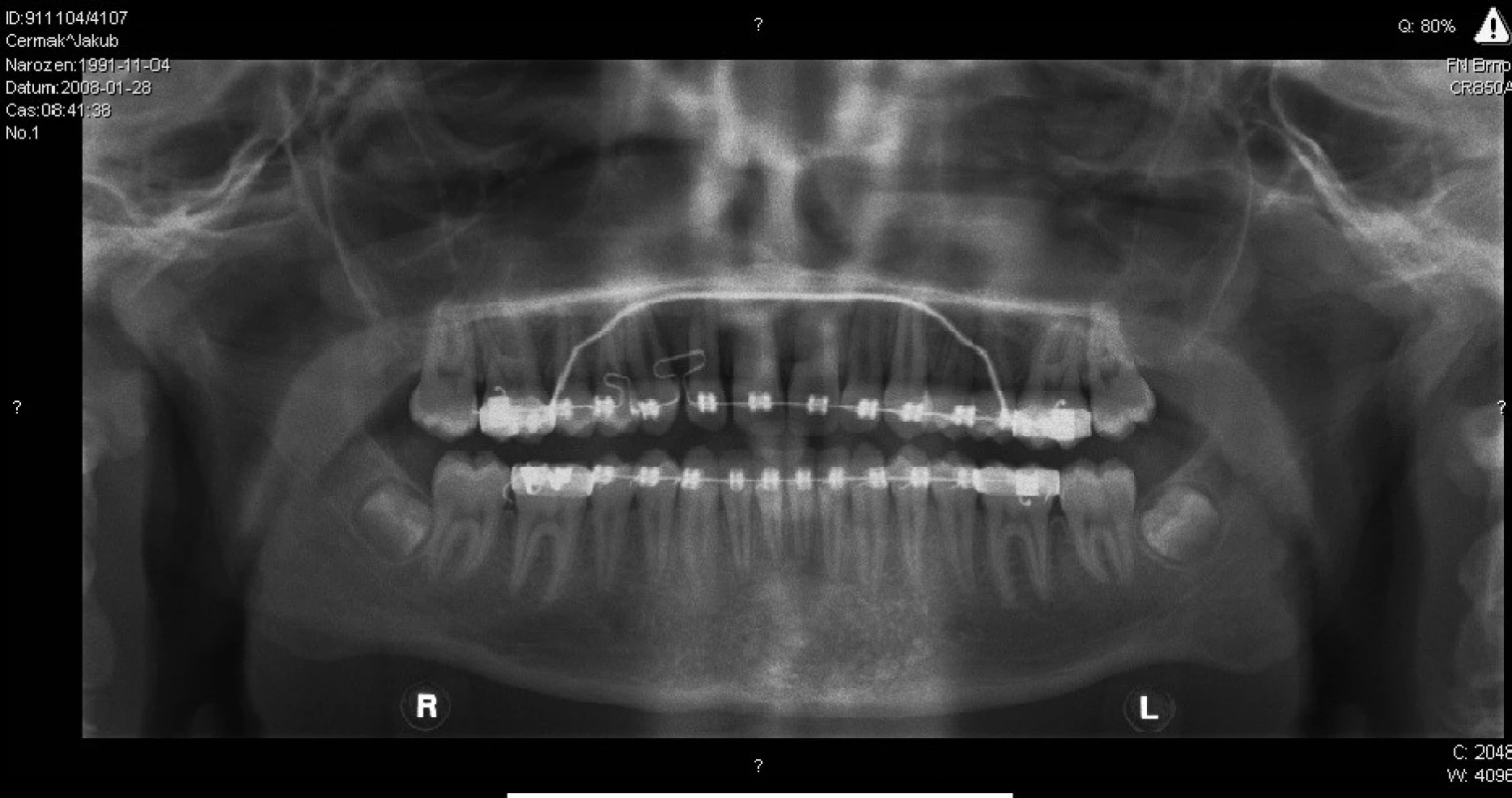
DISKUSE
Vyplňování poextrakčních defektů a dutin po exstirpaci cyst náleží mezi tradiční a známé indikace použití kostních alotransplantátů. Analogicky postupujeme i u poúrazových defektů čelistí. V implantologii je touto metodou možno docílit hodnotnější a masivnější kostní regenerace alveolárního hřebene a dosáhnout výhodnější kostní nabídky pro uvažované implantáty. U velkých defektů je třeba zvážit, podobně jako u sinusliftu, použití směsi kostního auto a alotransplantátu [8]. Hlavními důvody, proč implantujeme do patologické kostní dutiny, jsou porušení tvaru kostního úseku, zhoršené podmínky kostního hojení a ztráta kvality kostní hmoty.
Augmentace ovlivní hojení kostního defektu udržením celkového objemu kostní dutiny. Po vyplnění augmentátem dojde k podstatnému zmenšení velikosti vytvořeného krevního koagula a jsou zlepšené podmínky pro jeho nerušenou organizaci. Podstatně je sníženo riziko zánětu. Sutura sliznice, uzavírající kostní defekt, je provedena nad pevným podkladem [9]. Snáze se vytvoří provizorní matrix, dojde k pevnému uzávěru kostního defektu s neporušenou epitelizací na povrchu. To stimuluje tvorbu primární kostní tkáně, augmentát vytváří i mechanickou podporu pro dobrou a pevnou osifikaci v dutině se současnou resorpcí a přestavbou vloženého materiálu. Podmínkou pro hojení patologických dutin čelistních kostí je dostatek osteoprogenitorových buněk, které jsou původně buňky vazivové, a jejichž zdrojem je kostní dřeň, endost a periost. Pokud není kost ve stavu po ozáření nebo po lékové depresi, má dobré cévní zásobení, které je také pro hojení nezbytné [3]. Zamezení prorůstání měkkých tkání do kostní dutiny pomocí membrány má svoje opodstatnění i u velkých defektů. U žádného z našich nemocných jsme však membrány neužívali, zejména pro příliš vysoké finanční náklady. Neopominutelnou podmínkou je zabránění infekce obsahu dutiny od kořenů devitálních nebo nedokonale ošetřených zubů. Pokud nelze vícekořenové zuby dokonale endodonticky ošetřit, vždy je extrahujeme při exstirpačním procesu.
Skladba augmentátu může vyvolat otázku, proč neužít na místo venózní krve příjemce čerstvou plazmu, bohatou na trombocyty [3]. Tato aplikace vyžaduje individuální separaci, přístrojové vybavení nebo pomoc specializovaných laboratoří. Výsledky hojení u velkých kostních defektů při jejím užití nejsou jednoznačné. Náš zájem je v tomto směru věnován možnosti volit alogenní lyofilizované trombocyty, které je možno po dohodě v potřebné normě získat rovněž z tkáňových bank. Zatím však jsou naše zkušenosti malé [2].
ZÁVĚR
Praktická potřeba a prováděné výzkumné aktivity dovolily řešit ošetření kostních defektů jejich vyplněním vhodným materiálem. Hojení kostních dutin po augmentacích bylo pro nemocné bez komplikací, rychleji došlo k vyhojení měkkých tkání s dokonalým uzávěrem defektů. Nemocní nebyli obtěžováni potřebou každodenního čištění a vyplachování postupně se uzavírajících defektů.
Věnováno prof. MUDr. Jiřímu Vaňkovi, CSc., k jeho významnému životnímu jubileu.
Práce vychází z projektu MŠMT č. 1, M0528 Stomatologické výzkumné centrum.
Doc. MUDr. Milan Machálka, CSc.
Klinika ústní, čelistní a obličejové chirurgie
LF MU a FN
Jihlavská 20
625 00 Brno
Sources
1. Fassmann, A.: Řízená tkáňová a kostní regenerace ve stomatologii. Grada Publishing, Praha, 2002.
2. Fennis, J. M. P., Stoelinga, P. J. W., Jansen, J. A.: Mandibular reconstruction: A histological and histomorphometric study on the use autogenous scaffolds particulate cortico-cancellous bone grafts and platelet rich plasma in goats. Int. J. Oral Maxillofac. Surg., 2004, 33, s. 48-55.
3. Hislop, W. S., Finlay, P. M., Moos, K. P.: A preliminary study into the uses of inorganic bone in oral and maxillofacial surgery. Br. J. Oral. Maxillofac. Surg., 1993, 31, s. 149-153.
4. Jarcho, M.: Biomaterial aspects of calcium phosphates. Dent. Clin. North. Am., 1986, 30, s. 25-47.
5. Lane, J. M.: Bone graft substitutes. Western J. Med., 1995, s. 565-567.
6. Pazdera, J., Zbořil, V., Generová, M., Kolář, Z., Novotný, J., Tvrdý, P.: K problematice odontogenních keratocyst. Čes. Stomat., 104, 2004, č. 5, s. 171-179.
7. Sailer, H. F., Pajarola, G. F.: Oral surgery for the general dentist. G. Thieme, Stuttgart, New York, 1999.
8. Thorward et al.: Knöcherne Regeneration mit nanopartikulären Hydroxyapatit. Implantologie, 2004, 12/1, s. 21-32.
9. Zbořil, V., Pazdera, J., Moťka, V.: Bone defects of facial skeleton: Replacement with biomaterials. Biomedical Papers, 147, 2003, s. 51-56.
Labels
Maxillofacial surgery Orthodontics Dental medicine
Article was published inCzech Dental Journal

2009 Issue 3-
All articles in this issue
- Salivary Markers for Diseases of Periodontium and other Organs
- Biophysical Mechanism Determining Dental Implants Biocompatibility and Conditioning their Osseointegration
- Healing of Pathologic Bone Cavities of Jaws after Augmentation
- Effect of the Implant Length on its Primary Stability
- Papillon-Lefevre Syndrome
- Binary Titanium-tantalum alloys and their Biocompatibility
- Tooth Autotransplantation. A Review
- Czech Dental Journal
- Journal archive
- Current issue
- Online only
- About the journal
Most read in this issue- Papillon-Lefevre Syndrome
- Healing of Pathologic Bone Cavities of Jaws after Augmentation
- Tooth Autotransplantation. A Review
- Salivary Markers for Diseases of Periodontium and other Organs
Login#ADS_BOTTOM_SCRIPTS#Forgotten passwordEnter the email address that you registered with. We will send you instructions on how to set a new password.
- Career

