-
Medical journals
- Career
Pokroky ve farmakoterapii chorob ústní sliznice
Authors: R. Slezák; Z. Šustová; V. Nováková
Authors‘ workplace: Stomatologická klinika LF UK a FN, Hradec Králové
Published in: Česká stomatologie / Praktické zubní lékařství, ročník 109, 2009, 1, s. 7-13
Category: Comprehensive Report
Overview
V souborném referátu jsou charakterizována některá novější léčiva použitelná v terapii chorob ústní sliznice. Jsou jimi Gelclair®, imiquimod a takrolimus pro lokální aplikaci, mykofenolát mofetil, vorikonazol, posakonazol a valganciklovir pro systémové podání.
Klíčová slova:
ústní sliznice - farmakoterapieÚVOD
Nemoci ústní sliznice představují nezanedbatelnou, v kontextu současné stomatologie medicínsky velmi zajímavou problematiku s mnoha mezioborovými vazbami k maxilofaciální chirurgii na jedné straně a klinickou farmakologií a farmaceutickou medicínou na straně druhé.
V současné době existuje i v našich domácích poměrech možnost použít k léčbě řady nemocí ústní sliznice, včetně retní červeně, některá novější léčiva, která mají při srovnání s již zavedenými, dlouhodobě používanými a někdy snad již i „klasickými“ preparáty a léčebnými postupy řadu výhod. Protože recentních domácích prací na toto téma je poskrovnu, rozhodli jsme se provést tento stručný výčet některých moderních léčiv, která lze za určitých podmínek výhodně použít k léčbě nemocných s chorobami ústní sliznice a retní červeně. Jedná se o léčiva různých lékových skupin pro lokální či celkovou perorální aplikaci. Do sdělení jsme tak zařadili následující léčiva:
- Gelclair®,
- imiquimod,
- takrolimus,
- mykofenolát mofetil,
- vorikonazol,
- posakonazol,
- valganciklovir.
Gelclair®
Přípravek s obchodním označením Gelclair® je koncentrovaný bioadhezivní gelový preparát připravený na bázi polyvinylpyrrolidonu a kyseliny hyaluronové a vyvinutý primárně pro lokální ošetřování ústní sliznice u onkologických pacientů s projevy mukositidy vznikající v průběhu protinádorové radio - a chemoterapie. Používán je od roku 2001 [5]. Ústní sliznici chrání, hydratuje a lubrikuje tím, že na ní relativně snadno ulpívá v podobě tenkého filmu. K okamžitému použití se Gelclair® připravuje smísením koncentrovaného gelu s malým množstvím vody (balení obsahuje 21 sáčků s 15 ml orálního gelu). Podává se obvykle 3x denně, ústní dutina se jím důkladně proplachuje. Preparát není toxický, lze jej polknout. Po jeho aplikaci se doporučuje přibližně hodinu nejíst a nepít.
Gelclair® je indikován nejen při mukositidě, ale i při jiných bolestivých stomatitidách s rozsáhlejším slizničním postižením, při poúrazových a pooperačních stavech [13]. Zásadním problémem při jeho používání v našich domácích podmínkách se jeví jeho současná velmi vysoká cena, výrazně limitující širší využití Gelclairu® u ambulantních i hospitalizovaných pacientů.
Imiquimod
Imiquimod, imidazolchinolinamin (obr. 1), je látka s imunomodulačním účinkem určená pouze pro lokální použití. Cílovými buňkami, na které imiquimod působí, jsou Langerhansovy buňky, B lymfocyty, NK buňky a makrofágy. Její protinádorový a protivirový účinek není dosud zcela přesně znám, je však podmíněn lokální indukcí řady cytokinů, zejména interferonu α, interleukinu 6 a TNFα. Zvýšená lokální produkce prozánětlivých cytokinů stimuluje vstup imunokompetentních buněk do místa kožní léze a destrukci jejích buněčných elementů mechanismem apoptózy. Resorpce látky do organismu po její zevní aplikaci je velmi malá (méně než 0,9 %) [6, 10].
Image 1. Strukturní vzorec imiquimodu. 
Imiquimod se využívá k nechirurgické léčbě menších, nehyperkeratotických bazocelulárních karcinomů, Bowenovy dermatózy a aktinických keratóz v oblasti hlavy a krku zejména u pacientů, u nichž jsou jiné způsoby terapie (excize, kryodestrukce) méně vhodné. Analogicky jej lze použít k nechirurgické terapii aktinické cheilitidy [10]. Další indikací pro léčbu imiquinodem jsou infekce vyvolané lidským papilomavirem (HPV), zejména condyloma acuminatum, v orofaciální krajině v úvahu přichází též léčba periorálních projevů tzv. floridní orální papilomatózy stejného virového původu. Podávání imiquimodu u potenciálně maligních afekcí a bazaliomů by se mělo dít po předchozí verifikaci klinické diagnózy histopatologickým vyšetřením. Nedoporučuje se u afekcí, jež byly dříve již jinak ošetřovány.
Doba léčby trvá 4 - 6 týdnů, efekt terapie je nutno hodnotit s několikatýdenním odstupem. Přípravek se aplikuje vždy na noc na omytou a osušenou kůži či retní červeň, a to na 8 - 10 hodin, poté se zbytky krému smyjí. Aplikace se provádí několikrát týdně (3 - 5x týdně) dle povahy léčené afekce. Při nedostatečném účinku lze léčebný cyklus s odstupem 4 týdnů jedenkrát opakovat.
Imiquimod je kontraindikován u jedinců přecitlivělých na složky léčebného přípravku, v těhotenství a laktaci. U jedinců léčených imunosupresivy a trpících autoimunitními chorobami je při léčbě imiquimodem zapotřebí zvýšené opatrnosti. Nežádoucími účinky jsou zánětlivé projevy - erytém, edém, někdy puchýřky, eroze a krusty. Mohou být provázeny i zvýšenou tělesnou teplotou a celkovými projevy typu malátnosti, nevolnosti, svalové ztuhlosti a myalgiemi. V České republice je registrován přípravek obsahující imiquimod s obchodním označením Aldara 5% Cream drm crm. Obsahuje 12 sáčků určených pro jednotlivé aplikace, po nichž je zapotřebí řádně si vždy omýt ruce vodou a mýdlem.
Takrolimus
Takrolimus (dříve FK506) (obr. 2), produkt plísně Streptomyces tsukubaensis, je společně s cyklosporinem A selektivně působícím imunosupresivem ze skupiny tzv. kalcineurinových inhibitorů [7, 11]. Po vazbě na polyfunkční intracelulární proteiny, označované jako imunofiliny, inhibuje takrolimus 10x - 100x silněji než cyklosporin A aktivitu kalcineurinu, enzymu nezbytného k ativaci řady jiných enzymů a transkripčních faktorů podílejících se na selektivní stimulaci T lymfocytů a B lymfocytů. Je proto využíván celkově v transplantační medicíně jako relativně netoxické, selektivně účinkující imunosupresivum v profylaxi a terapii rejekční reakce u jedinců po transplantacích solidních orgánů a v léčbě GVHD (reakce štěpu proti hostiteli), neboť velmi výrazně pomáhá snížit dávky ostatních imunosupresiv s výraznějšími nežádoucími účinky. Kontraindikován je při přecitlivělosti na účinnou látku a jiné makrolidy, v graviditě a při laktaci. Vzhledem ke skutečnosti, že je v těle metabolizován pomocí enzymatického systému cytochrom P 450, vstupuje při celkovém podávání s ostatními léčivy, do řady lékových interakcí různé závažnosti, které jsou těmito enzymy rovněž metabolizovány.
Image 2. Strukturní vzorec takrolimu. 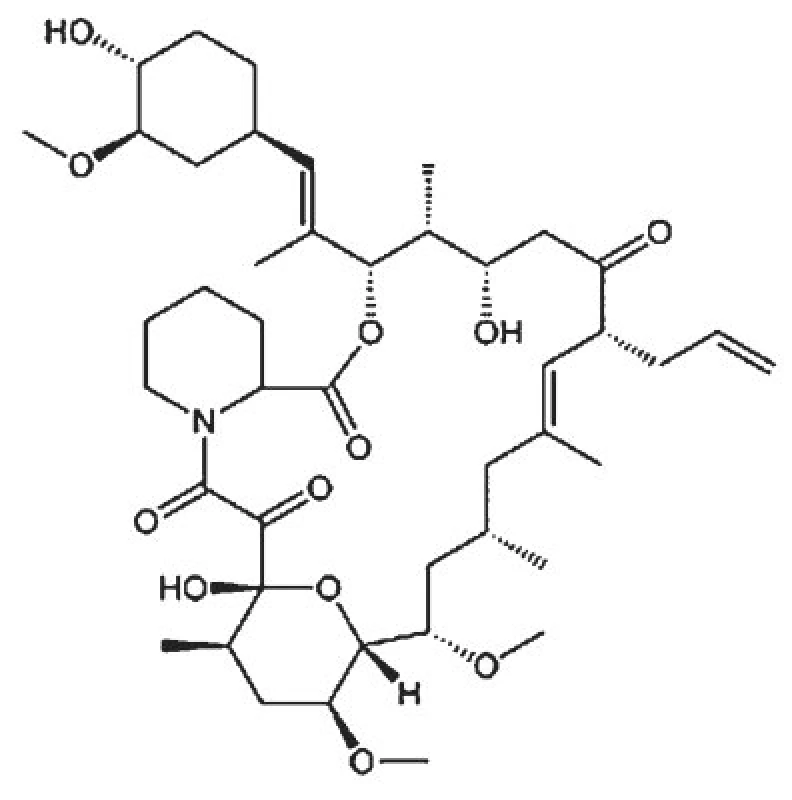
Využití takrolimu ve stomatologických indikacích přichází v současnosti v úvahu zejména v podobě lokální aplikace individuálně připravené suspenze na ústní sliznici při léčbě erozivních forem orálního lichen planus, projevů chorob ze skupiny pemphigoidu a Behçetovy choroby, jejichž odpovídavost na celkovou imunosupresivní terapii je dosti často neadekvátní a samotná lokální terapie jinými preparáty se jeví jako nedostačující [4, 8].
K léčbě kožních chorob zánětlivé povahy, zejména atopického ekzému, psoriázy, pyoderma gangraenosum, alopecia areata a dalších, včetně pemphigoidu, paraneoplastického pemphigu, m. Hailey-Hailey a diskoidního lupus erythematodes, se užívá takrolimus v podobě krému u jedinců, u nichž nebylo konvenční terapií dosaženo uspokojivých léčebných výsledků (v České republice registrovaná léčiva Protopic 0,03% Mast drm. ung. a Protopic 0,1% Mast drm. ung.).
Mykofenolát mofetil
Mykofenolát mofetil, ester kyseliny mykofenolové (obr. 3), je produktem plísně Penicillium brevicompactum. Ester je proléčivem, které se po perorálním podání z trávicího ústrojí rychle vstřebává a metabolizuje na kyselinu mykofenolovou, farmakologicky účinnou látku, která má velmi výrazný imunosupresivní účinek. Inhibice aktivity inosinmonofosfátdehydrogenázy, enzymu katalyzujícího přeměnu inosinmonofosfátu na xantinmonofosfát, vede k zablokování syntézy nukleových kyselin tvořících se eukaryotických buněk, včetně B a T lymfocytů, které - na rozdíl od jiných buněk - nejsou schopny využít k syntéze DNA a RNA tzv. záchrannou cestu syntézy purinových nukleosidů. Cytostatický účinek kyseliny mykofenolové na lymfocyty je proto mnohem výraznější než její účinek na jiné buňky lidského organismu. Kyselina mykofenolová rovněž interferuje s adhezními interakcemi mezi leukocyty a aktivovanými endoteliemi a brání tak prostupu lymfocytů a monocytů do míst chronického zánětu. Negativně ovlivňuje také aktivitu polymorfonukleárů [7, 11, 14].
Image 3. Strukturní vzorec kyseliny mykofenolové. 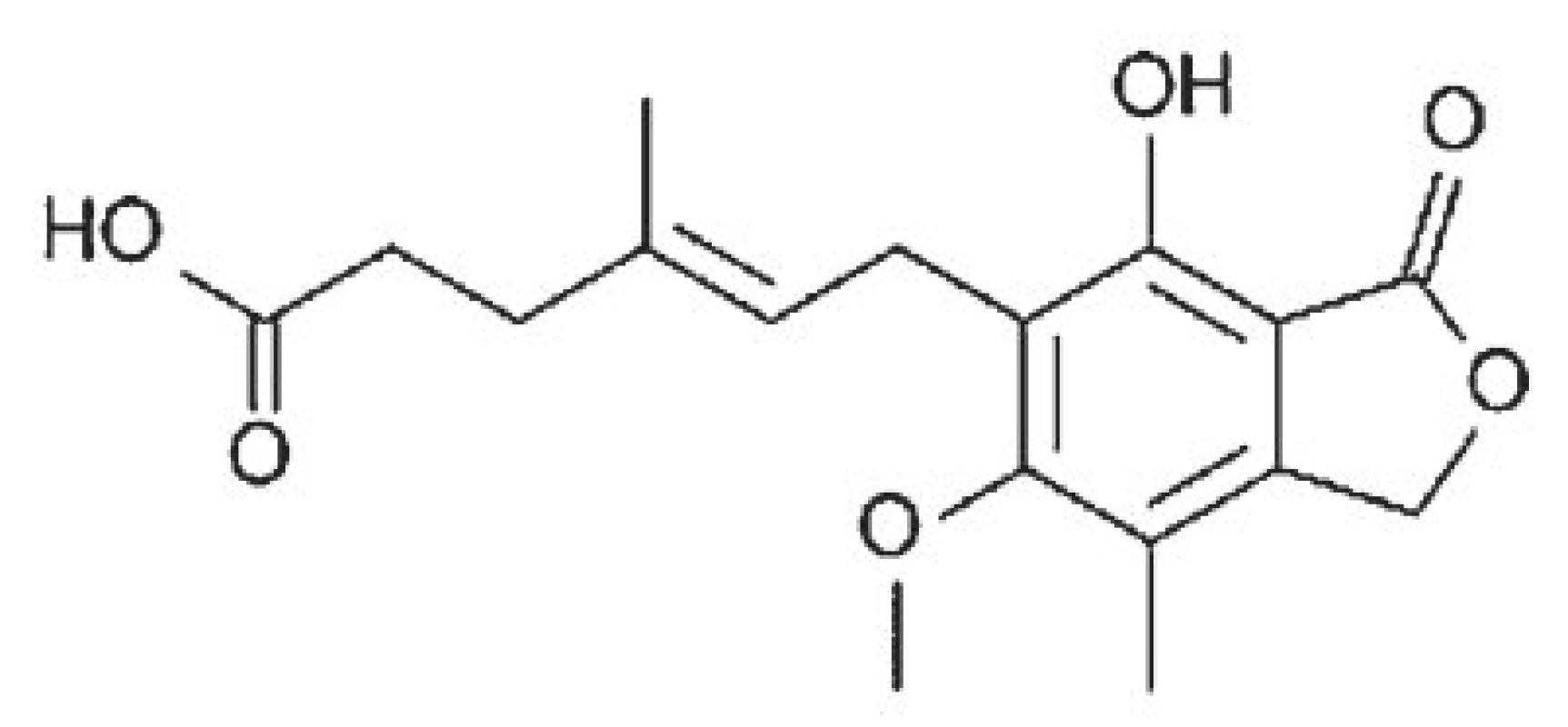
Mykofenolát mofetil (MMF) má po perorálním podání dobrou biologickou dostupnost, v plazmě se váže silně na albumin. Podléhá enterohepatální recirkulaci. V játrech je kyselina mykofenolová transformována na farmakologicky neaktivní glukuronid. Převážně močí je pak v této podobě vylučována z organismu.
Hlavní současné využití MMF je v transplantační medicíně. Spočívá v navození imunosuprese u jedinců s transplantovanými solidními orgány - ledvinami, srdcem, plícemi. Tato léčba se zahajuje ihned po transplantaci v denní dávce 2 - 3 g MMF, lék se zpočátku podává parenterálně. Myelotoxicita MMF není výraznější než u azathioprinu. MMF však není nefrotoxický, hepatotoxický a neurotoxický. Nežádoucí účinky jsou podmíněny zejména myelotoxicitou a projevují se zejména vznikem leukopenie a anémie. Možný je též rozvoj oportunních infekcí (zejména herpesvirových a mykotických) a gastrointestinálních potíží. Vstřebávání léku z trávicího ústrojí narušují antacida. Lékové interakce vedoucí ke změně účinnosti MMF jsou popisovány zejména s acyklickými nukleosidy (aciklovir, ganciklovir) a s cholestyraminem. Podávání léku ženám v reprodukčním věku má být spojeno s účinnou antikoncepční metodou po celou dobu trvání této léčby a po dalších 6 týdnů po jejím ukončení. Nepodává se kojícím ženám. Krevní obraz vyšetřujeme během prvního měsíce terapie MMF každý týden, ve druhém a třetím měsíci terapie jej kontrolujeme 2x měsíčně. Neutropenie je důvodem pro přerušení či ukončení podávání MMF.
V léčbě autoimunitních nemocí se MMF užívá stále častěji, a to i přes určité problémy spojené díky vyšší ceně s ekonomickými argumenty. Velmi dobré léčebné výsledky jsou popisovány zejména při léčbě pemphigus vulgaris, včetně orálních projevů této choroby, je-li tato rezistentní na léčbu kortikosteroidy či jejich kombinaci s konvenčními imunosupresivy (azathioprin, methotrexat). MMF se k léčbě pemphigu používá buď samotný, tj. v monoterapii, a to v denní dávce 34 - 45 mg/kg tělesné hmotnosti, nebo v kombinaci s kortikosteroidy či cyklosporinem A, obvykle v denní dávce 1 g. U většiny nemocných užívající MMF pro pemphigus vulgaris léčebně nezvládnutelný konvenční farmakoterapií, jejímž základem je podávání kortikosteroidů, bylo v relativně krátké době dosaženo dlouhodobé remise [11].
Méně často je v současnosti MMF využíván k terapii dalších chorob ústní sliznice, zejména ze skupiny pemphigoidu a při multiformním erytému [11]. MMF pro perorální podání je v České republice dostupný jako přípravky Cellcept 250 mg por. tbl. nob., Cellcept 500 mg por. tbl. nob., dále jako přípravky Myfenax, Mycofenolat Mofetil Sandoz a Mycofenolat Mofetil Teva.
Vorikonazol
Vorikonazol (obr. 4) patří mezi novější systémově použitelná širokospektrá triazolová antimykotika určená pro perorální podání. Je účinný proti kvasinkám rodu Candida, včetně kmenů rezistentních ke flukonazolu a proti houbám rodu Aspergillus. Antimykotický účinek je založen, stejně jako u všech ostatních azolových antimykotik, na inhibici syntézy ergosterolu stěny patogenních hub, odehrávající se na úrovni enzymatického systému cytochromu P 450.
Image 4. Strukturní vzorec vorikonazolu. 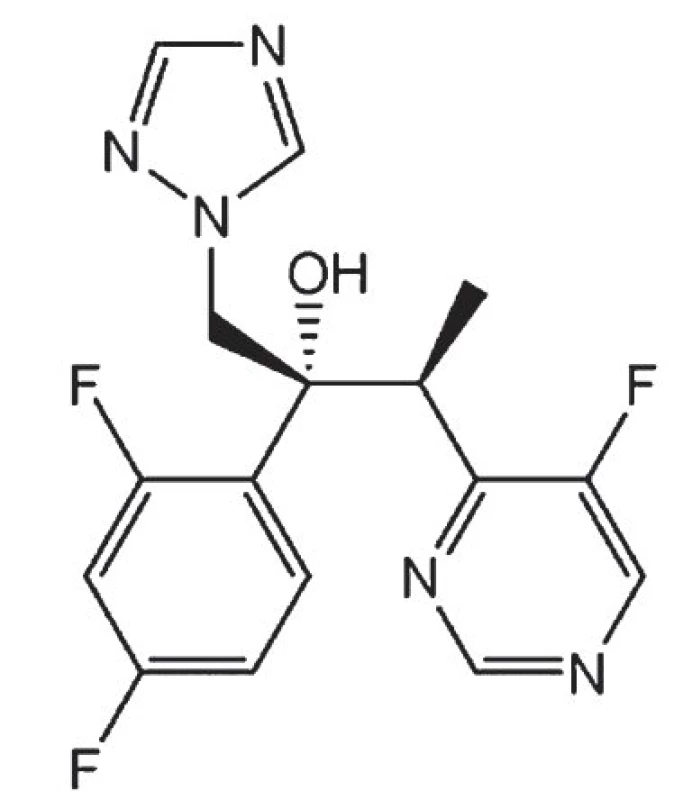
Vorikonazol se velmi dobře a rychle vstřebává z trávicího ústrojí, má velký distribuční objem, jeho biologická dostupnost činí 96 %. Z těla se vylučuje v podobě neaktivních metabolitů, na něž je transformován v játrech. Kontraindikován je v graviditě a laktaci, při přecitlivělosti na některou složku léčiva či jiná azolová antimykotika. Podobně jako ostatní azoly vstupuje vorikonazol do různě závažných lékových interakcí s terfenadinem, astemizolem, chinidinem, cisapridem, rifampicinem, karbamazepinem, fenobarbitalem, ritornavirem, námelovými alkaloidy, sirolimem, efavirenzem, s nimiž proto jeho současné podávání není vhodné. Před zahájením léčby a v jejím průběhu jsou nutné kontroly jaterních funkcí. Speciální režim je zapotřebí při současném podávání vorikonazolu s kalcineurinovými inhibitory, warfarinem, fenytoinem, methadonem, deriváty sulfonylurey, vinkristinem a vinblastinem.
Vorikonazol se v současnosti používá výhradně v léčbě závažných mykotických infekcí, včetně sepsí vyvolaných citlivými druhy patogenních hub [1, 3]. Jeho využití v léčbě závažných rozsáhlých forem orofaryngeální kandidózy u jedinců s poruchami obranyschopnosti je možné. Denní dávka perorálního léčiva činí 2x400 mg během 1. dne, dále 2x200 mg. Podává se s odstupem 1 hodiny od jídla (před jídlem či po něm).
Nežádoucími účinky jsou kožní exantémy a fotosenzitivita, vývoj Stevensova-Johnsonova syndromu, zrakové poruchy, febrilie, nauzea a zvracení. Během léčby vorikonazolem je zakázáno řízení motorových vozidel a obsluha strojů.
V České republice jsou dostupné perorální přípravky Vfend 50 mg por. tbl. flm., Vfend 200 mg por. tbl. flm., Vfend 40 mg/ml por. plv. sus.
Posakonazol
Posakonazol je rovněž syntetickým triazolovým inhibitorem lanosterol 14α–demethylázy, enzymu nutného k syntéze ergosterolu stěny mikrobiální buňky (obr. 5). Má široké spektrum antimykotické účinosti, a to proti houbám rodu Aspergillus, Candida, Fusarium a dalším [2, 12].
Image 5. Strukturní vzorec posakonazolu. 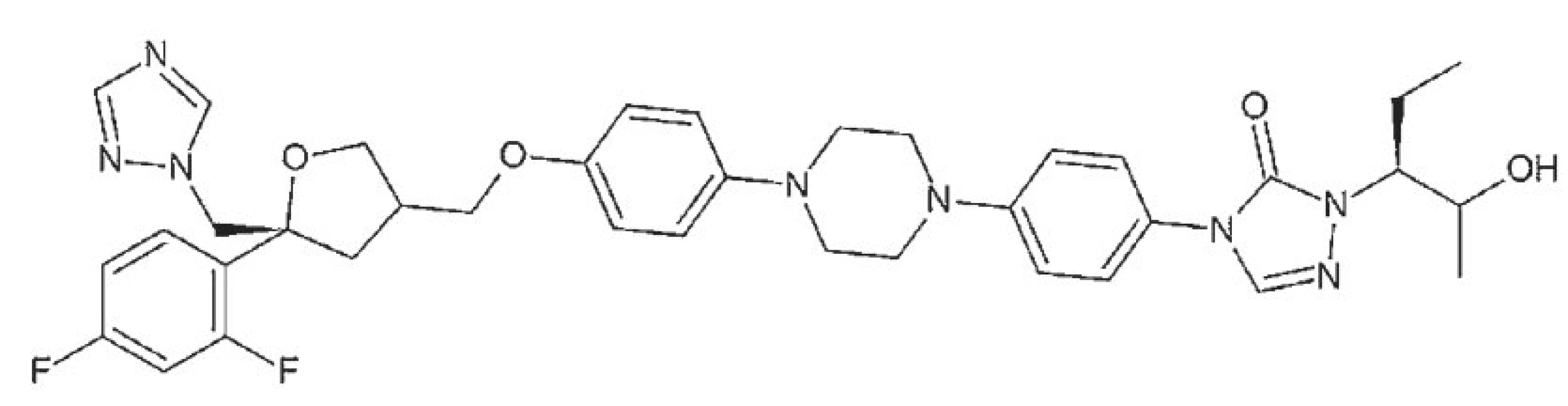
Resorpce látky z trávicího ústrojí je dobrá, pomalá, doporučuje se její podávání současně s jídlem. Vazba na sérový albumin je velmi vysoká (98%). Z organismu se vylučuje pomalu, z největší části stolicí, a to v nezměněné podobě. Kontraindikován je při přecitlivělosti na některou ze složek léčebného přípravku a ostatní azolové preparáty, v graviditě, laktaci, u jedinců mladších 18 let, při současné terapii statiny a dále při současném podávání řady léků s metabolismem závislým na cytochromu P 450, jak je uvedeno u vorikonazolu. Farmakologicky významné interakce však mohou vzniknout i při současném podávání posakonazolu s inhibitory protonové pumpy a H2 blokátory, vinkristinu a vinblastinu, kalcineurinových inhibitorů, inhibitorů proteáz a reverzní transkriptázy, benzodiazepinů, blokátorů kalciového kanálu a derivátů sulfonylurey.
Častějšími nežádoucími účinky jsou gastrointestinální potíže a bolesti hlavy [12]. Posakonazol je vhodný k léčbě a profylaxi invazivních infekcí vyvolaných citlivými mikroorganismy, včetně orální a orofaryngeální kandidózy, zejména u jedinců, u nichž nelze použít jiná systémově účinná antimykotika a u jedinců imunodeficientních. Při orofaryngeální kandidóze se obvykle podává 100 - 200 mg posakonazolu denně.
V České republice jsou registrovány přípravky Posaconazole SP 40 mg/ml por. sus. a Noxafil 40 mg/ml por. sus. obsahující 100 mg posakonazolu ve 40 ml suspenze.
Valganciklovir
Perorálně podávaným proléčivem acyklického nukleosidového virostatika gancikloviru, na nějž se po perorálním podání rychle metabolizuje, je jeho L-valyl ester valganciklovir (obr. 6). Samotný ganciklovir, syntetický analog 2-deoxyguanosinu, který má antivirové účinky proti všem lidským herpesvirům, lze podávat jen parenterálně. V klinické praxi je využíván výlučně v léčbě cytomegalovirové choroby, včetně jejích orálních projevů, které mohou předcházet závažnějším formám této oportunní infekce postihující výlučně imunodeficientní jedince. Biologická dostupnost gancikloviru je po perorálním podání jeho esteru srovnatelná s biologickou dostupností gancikloviru podaného intravenózně. Z organismu se ganciklovir vylučuje ledvinami v nezměněné formě, jeho eliminační poločas se prodlužuje při poruše renálních funkcí.
Image 6. Strukturní vzorec valgancikloviru. 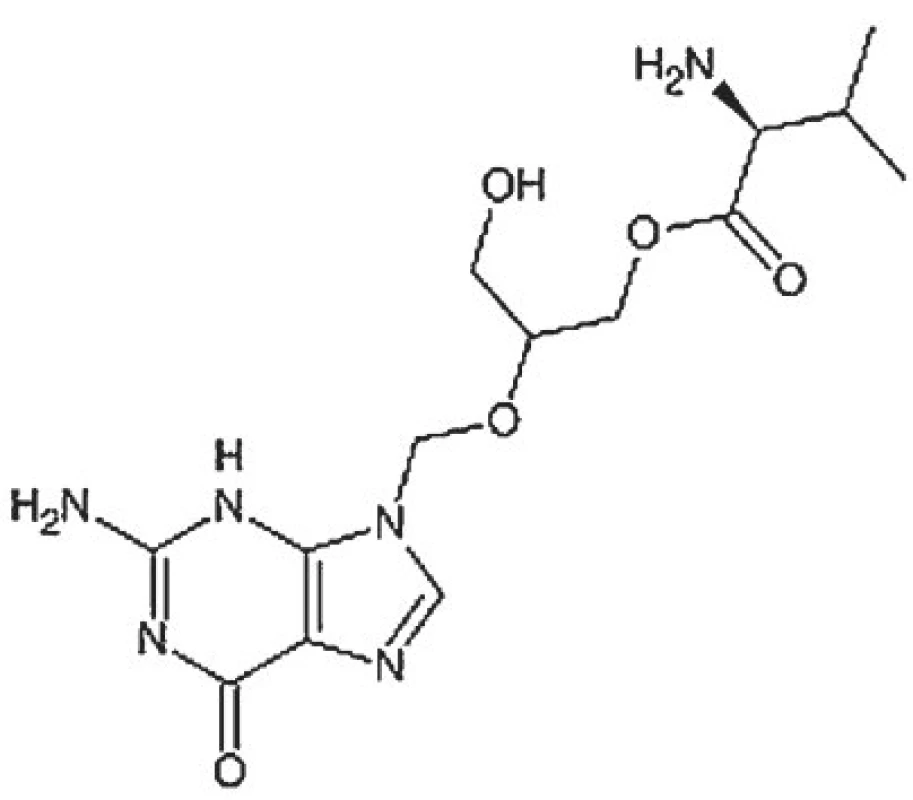
V klinické praxi je valganciklovir využíván k terapii a profylaxi cytomegalovirové choroby, postihující téměř výlučně jedince s transplantovanými orgány a HIV-pozitivní jedince. Jeho podání je kontraindikováno při prokázané přecitlivělosti na ganciklovir i ostatní acyklické nukleosidové analogy též v graviditě, laktaci, u dětí a dospívajících, u hemodialyzovaných pacientů a při závažnějších poruchách krvetvorby. Možnými nežádoucími účinky jsou neutropenie, anémie a průjmy. Z lékových interakcí je významné snížení renální exkrece gancikloviru při současném podávání probenecidu. Plazmatickou hladinu gancikloviru může zvýšit také mykofenolát mofetil. Myelotoxicita gancikloviru může být potencována současným užíváním jiných léčiv s tímto nežádoucím efektem (didanosin, zidovudin).
Obvyklá terapeutická denní dávka valgancikloviru činí 1 - 2x 900 mg. Dávka profylaktická a udržovací je 900 mg denně. Při ledvinném selhávání se redukce denní dávky řídí podle hodnot clearance kreatininu.
Použití valgancikloviru ve stomatologických indikacích přichází v úvahu jen při existenci intraorálních projevů cytomegalovirové choroby, jejichž diagnostika je založena na klinickém, virologickém a histopatologickém vyšetření, potvrzujícím přímo či nepřímo přítomnost aktivní cytomegalovirové infekce. Doba léčby může činit několik dní až několik týdnů [9]. V České republice je registrován přípravek Valcyte 450 mg por. tbl. flm. s obsahem 450 mg valgancikloviru v tabletě.
DISKUSE
Základem úspěšné terapie všech chorob ústní sliznice nepochybně zůstává stanovení správné diagnózy. Již toto konstatování představuje samo o sobě téma pro rozsáhlejší odborné sdělení.
Základem úspěšné farmakoterapie akutních infekcí ústní sliznice virového a mykotického původu zůstává přes veškeré pokroky v jejich léčbě včasná diagnostika infekční choroby. To platí zejména pro všechny projevy pásového oparu v oblasti hlavových a cervikálních nervů (zoster cephalicus), s nímž se v ústní dutině setkáváme nejčastěji při jeho výsevu v anatomické oblasti inervované senzitivně 2. nebo 3. větví trojklanného nervu (zoster facialis), méně často při postižení lícního nervu (zoster oticus). Včasné zahájení protivirové terapie je nejúčinnější „prevencí“ závažných pozdních důsledků neuritid těchto nervů, projevujících se až v době po zhojení zosteru vývojem farmakologicky neovlivnitelných postherpetických neuralgiformních bolestí a ireparabilních obrn motorických hlavových nervů.
V otázce terapie všech závažnějších forem orální kandidózy, u nichž je indikováno celkové podávání antimykotik, nadále platí pravidlo výhodnosti kombinace lokální a celkové léčby. Zapomínat bychom neměli ani na možnost eliminace některých disponujících faktorů pro vznik této oportunní mykotické infekce, jejíž výskyt z mnoha důvodů prokazatelně trvale narůstá.
V léčbě závažných chronických nemocí ústní sliznice autoagresivního původu, mezi nimiž závažností i četností výskytu dominuje pemphigus vulgaris, se nabízejí nová imunosupresiva modifikace léčebných postupů s méně častým výskytem a nižší závažností nežádoucích účinků dlouhodobé medikamentózně navozené imunosuprese. Počet jedinců s těmito chorobami trvale narůstá, přinejmenším kvůli prodlužující se střední délce lidského života, jehož kvalitu mohou novější imunosupresiva významně zlepšit.
Počet dostupných preparátů pro lokální užití v´ústní dutině, zejména afekcí typu nenádorových erozí a vředů, včetně postradiační mukositidy, multiformního erytému, orálních projevů lupus erythematodes, ale i těžších forem aftózní stomatitidy, je v našich domácích podmínkách trvale nedostačující. Každé nově registrované léčivo, které přinese těmto pacientům úlevu, umožní řeč, snazší příjem potravy a polykání, kvalitní ústní hygienu, je velmi žádáno, i když jeho účinek zůstává jen symptomatický.
V neposlední řadě imiquimod představuje zcela novou možnost nechirurgické léčby aktinické cheilitidy, tj. nejčastější prekancerózy retní červeně, ale i bazaliomů a projevů infekce způsobené lidským papilomavirem v orofaciální oblasti.
Společným problémem nemedicínské povahy všech výše uvedených léčiv, která mohou velmi dobře pomoci řadě našich pacientů s vážnými chorobami manifestujícími se v ústní dutině či v jejím okolí, zůstává v současnosti vyšší cena těchto přípravků, vynucující si různá opatření omezující jejich dostupnost, jimiž jsou např. plná úhrada ceny, preskripční omezení dle odbornosti lékaře, možnost podání pouze při hospitalizaci pacienta v lůžkovém zdravotnickém zařízení a další. I v našich poměrech je však jejich použití možné, zejména při dobré spolupráci se specialisty z jiných medicínských oborů.
ZÁVĚR
Chceme-li správně používat nová moderní léčiva, musíme dobře znát všechny jejich vlastnosti, nejen jejich výhody, studovat recentní odbornou literaturu, mnohdy i z jiných medicínských oborů. Zapomínat však nelze ani na ekonomickou stránku dané problematiky, která může být při naší snaze o zavádění nových léčiv do naší klinické praxe limitujícím činitelem.
Práce vznikla v rámci grantového projektu MŠMT NPV II č. 2B06104.
Doc. MUDr. Radovan Slezák, CSc.
Stomatologická klinika LF UK a FN
Sokolská 581
500 05 Hradec Králové
e-mail: slezak@lfhk.cuni.cz
Sources
1. Bagg, J., Sweeney, M. P., Davies, A. N., Jackson, M. S., Brailsford, S.: Voriconazole susceptibility of yeasts isolated from the mouths of patients with advanced cancer. J. Med. Microbiol., roč. 54, 2005, s. 959-964.
2. Baker, R.: Posaconazole versus fluconazole for the treatment of oropharyngeal candidiasis in HIV patients. In: http://www.hivandhepatitis.com.
3. Burn, K., Fothergill, A. W., Kirkpatrick, W. R., Coco, B. J., Patterson, T. F., McCarthy, D. I., Rinaldi, M. G., Redding, S. W.: Comparison of antifungal susceptibilities to fluconazole and voriconazole of oral Candida glabrata isolates from head and neck radiation patients. J. Clin. Microbiol., roč. 42, 2004, č. 12, s. 5846-5848.
4. Hodgson, T. A., Sahni, N., Kaliakatsou, F., Buchanan, J. A. G., Porter, S. R.: Long-term efficacy and safety of topical tacrolimus in the management of ulcerativeerosive oral lichen planus. Eur J. Dermatos., roč. 13, 2003, č. 5, s. 466-470.
5. http://www.gelclair.co.uk
6. Kovandová, H.: Imiquimod v terapii kožních onemocnění. Derm. Praxi, roč. 1, 2007, č. 4, s. 188-190.
7. Krejsek, J., Kopecký, O.: Modulace imunitního systému (kap.). In: Krejsek. J., Kopecký, O.: Klinická imunologie, Hradec Králové. Nucleus HK, 2004, s. 804-810.
8. Lener, E. V., Brieva, J., Schachter, M., West, L. E., West, D. P.: Successful treatment of erosive lichen planus with topical tacrolimus. Arch. Dermatos., roč. 137, 2001, č. 4, s. 419-422.
9. Ojha, J., Islam, N.; Cohen, D. M., Marsal, D., Reavis, M. R., Bhattacharyya, I.: Post-transplant lymphoproliferative disorders of oral cavity. Oral Surg. Oral Med. Oral Pathol. Oral Radiol. Endod., roč. 105, 2008, č. 5, s. 589-596.
10. Smith, K. J., Germain, M., Yeager, J., Skeleton, H.: Topical 5% imiquimod for the therapy of actinic cheilitis. J. Amer. Acad. Dermatol, roč. 47, 2002, 4, s. 497-501.
11. Thoma-Uszynski, S., Eming, R.: Novel therapeutic approaches in autoimmune skin disorders (kap.). In: Hertl, M. (Ed): Autoimmune diseases of the skin. Pathogenesis, diagnosis, management. Springer, Wien New York, 2. vyd., 2005, s. 421-456.
12. Vazquez, J. A., Siest, D. J., Nieto, L., Northland, R., Sanne, I., Gogate, J., Greaves, W., Isaacs, R.: A multicenter randomized trial evaluating posaconazole versus fluconazole for the treatment of oropharyngeal candidiasis in subjects with HIV/AIDS. Clin. Infect Dis, roč. 42, 2006, s. 1179-1186.
13. Vokurka, S.: Mukositida dutiny ústní u pacientů po chemoterapii. Kompendium ambulantní medicíny. Medical Tribune, roč. 7, 2008, č. 10/3 2008, s. 8.
14. Weberová, J., Vobořil, R., Semecký, V.: Mycophenolat mofetil, nové perspektivní imunosupresivum. Čes. slov. Farm., roč. 51, 2002, č. 5: s. 220-225.
Labels
Maxillofacial surgery Orthodontics Dental medicine
Article was published inCzech Dental Journal

2009 Issue 1
Most read in this issue- Diskoplikace jako operační metoda dislokací disku čelistního kloubu
- Transplantace zubů
- Pokroky ve farmakoterapii chorob ústní sliznice
- Sonoabrazivní technika preparace tvrdých zubních tkání
Login#ADS_BOTTOM_SCRIPTS#Forgotten passwordEnter the email address that you registered with. We will send you instructions on how to set a new password.
- Career

