-
Medical journals
- Career
Vztah sérové koncentrace D-serinu a psychopatologie u schizofrenie
Authors: J. Hons 1; R. Žirko 1; M. Ulrychová 2; Eva Čermáková 3; J. Libiger 1
Authors‘ workplace: Psychiatrická klinika, LF UK a FN, Hradec Králové ; přednosta prof. MUDr. J. Libiger, CSc. Ústav klinické biochemie a diagnostiky, FN, Hradec Králové 1; přednosta prof. MUDr. V. Palička, CSc. Ústav lékařské biofyziky LF UK, Hradec Králové 2; přednosta doc. Ing. J. Hanuš, CSc. 3
Published in: Čes. a slov. Psychiat., 104, 2008, No. 6, pp. 281-288.
Category: Original Article
Overview
Hypofunkce glutamátergního NMDA (N-methyl-D-aspartát) receptoru se podílí na patofyziologii schizofrenního onemocnění. Aminokyselina D-serin účinkuje jako endogenní koagonista na glycinovém modulačním místě NMDA receptoru. U nemocných schizofrenií byly ve srovnání se zdravými kontrolními subjekty prokázány snížené koncentrace D-serinu v krevním séru. D-serin v klinických studiích zlepšoval u nemocných schizofrenií v augmentaci léčby antipsychotiky 1. a 2. generace pozitivní a negativní příznaky. V populaci 50 nemocných schizofrenií zařazených do klinické studie jsme neprokázali vztah mezi sérovou koncentrací D-serinu a celkovými skóry a skóry subškál PANSS (The Positive and Negative Syndrome Scale) a SANS (The Scale for the Assessment of Negative Symptoms). U nemocných žen jsme ve srovnání s muži zaznamenali nevýznamně nižší sérové koncentrace D-serinu. Pohlavní rozdíly v glutamátergní dysfunkci spojené se schizofrenií si v souvislosti s tímto nálezem zaslouží další pozornost.
Klíčová slova:
D-serin, NMDA receptor, schizofrenie, excitační aminokyseliny, glutamátergní neurotransmise.ÚVOD
Na patofyziologii schizofrenie se podílí dysfunkce glutamátergní neurotransmise v prefrontální kůře a limbickém systému [25]. Na souvislost glutamátergní dysfunkce se sníženou aktivitou NMDA (N-methyl-D-aspartát) receptorů u schizofrenie poukazují účinky kompetitivních antagonistů NMDA receptoru fencyklidinu a ketaminu, které u zdravých lidí způsobují rozvoj příznaků podobných schizofrenii, včetně negativních příznaků a kognitivního deficitu [13, 17]. Pro hypofunkci NMDA receptorů u schizofrenie svědčí i výsledky adjuvantní léčby jejich agonisty D-cykloserinem [4, 5, 10], glycinem [11, 14, 15] a D-serinem [12, 28].
D-serin svým koagonistickým účinkem na glycinovém modulačním místě NMDA receptoru za fyziologických podmínek moduluje glutamátergní neurotransmisi [26]. NMDA receptor je asociovaný s napěťově řízeným iontovým kanálem, jehož propustnost pro ionty závisí na vazbě ligandů na receptor. K aktivaci NMDA receptoru, otevření iontového kanálu pro sodíkové a vápníkové ionty a následné depolarizaci postsynaptického neuronu vede vazba D-serinu nebo glycinu na glycinové místo současně s vazbou glutamátu na primární vazebné místo NMDA receptoru. Ve srovnání s glycinem je vazebná potence D-serinu pro aktivaci všech podjednotek NMDA receptoru třikrát vyšší [21] a byla prokázána také až stokrát vyšší funkční účinnost D-serinu v potenciaci NMDA receptorem zprostředkované spontánní synaptické aktivity [33]. D-serin je pravděpodobně efektivnější při aktivaci kanálu spojeného s NMDA receptorem v souvislosti s rozdílným metabolismem a mechanismy transportu. Transportní systémy D-serinu jsou nízkoafinitní [25] a v porovnání s glycinem a dalšími typickými neurotransmitéry tak může D-serin zůstávat v extracelulárním prostoru v oblasti synapse delší dobu. Synaptickou koncentraci D-serinu se zatím nepodařilo stanovit [33], ale je zřejmé, že koncentrace D-serinu na synapsi je ovlivněna hlavně jeho syntézou a difuzí [25].
D-serin je v CNS syntetizován výlučně v cytosolové matrix astrocytů šedé mozkové hmoty [23, 24, 32] sekvenční konverzí z L-serinu za účasti enzymu D-serinracemázy [25, 32]. Přítomnost vyšší koncentrace D-serinu koreluje velmi úzce s distribucí NMDA receptorů v prefrontální, parietální a temporální kůře, hipokampu a striatu [6]. D-serin je metabolizován enzymem D-aminooxidázou (D-amino acid oxidase, DAAO). DAAO je peroxisomální flavoprotein, který selektivně katalyzuje oxidativní deaminaci neutrálních D-aminokyselin [23]. Přestože metabolizuje více než 90 % celkového D-serinu bez vlivu na koncentrace jiných aminokyselin, selektivně snižuje odpověď NMDA receptoru jen o 50-70 % [33].
Bendiková prokázala u nemocných schizofrenií 25% snížení koncentrace D-serinu v mozkomíšním moku a snížení poměru D-serin/L-serin [3]. Nízká koncentrace D-serinu v mozkomíšním moku u nemocných schizofrenií by mohla přímo souviset s nálezy snížené koncentrace proteinu serinracemázy ve frontální kůře a hipokampu a zvýšené koncentrace proteinu DAAO v hipokampu [3]. U nemocných schizofrenií byla prokázána také významně nižší koncentrace D-serinu v krevním séru [7, 34]. K úvahám o snížené aktivitě serinracemázy u schizofrenie vedl nález vyšší koncentrace L-serinu a celkového serinu a nižšího procentuálního zastoupení D-serinu v celkovém serinu u nemocných schizofrenií [7]. Nižší procentuální zastoupení D-serinu v celkovém serinu bylo prokázáno také v mozkomíšním moku u neléčených pacientů s první epizodou schizofrenie [9].
V adjuvantní léčbě D-serin u nemocných schizofrenií léčených antipsychotiky 2. generace zlepšoval negativní, pozitivní, kognitivní [12, 28] a depresivní příznaky [12]. Výraznější zlepšení negativních, pozitivních a kognitivních příznaků bylo spojeno se zvýšením sérové koncentrace D-serinu [28]. Klinické účinky D-serinu shrnují výsledky metaanalýzy 18 krátkodobých studií, která neprokázala jeho účinek na pozitivní příznaky a kognitivní deficit. D-serin u nemocných schizofrenií jen mírně a statisticky nevýznamně zlepšoval negativní příznaky [30].
Nálezy odlišné sérové koncentrace a specifických klinických účinků D-serinu nás vedou k předpokladu možnosti klinické a laboratorní diferenciace schizofrenních psychóz. Cílem naší studie je popis vztahu sérových koncentrací D-serinu a intenzity negativních a pozitivních příznaků hodnocených posuzovacími stupnicemi psychopatologie PANSS a SANS. Na základě výsledků výše zmíněných klinických studií jsme formulovali hypotézu negativní asociace intenzity negativních příznaků s koncentrací D-serinu v krevním séru u nemocných schizofrenií.
METODIKA
Subjekty klinické studie
Do klinické studie byli zařazeni nemocní schizofrenií starší 18 let ambulantně léčení na Psychiatrické klinice FN v Hradci Králové. U nemocných byla diagnostikována schizofrenie dle kritérií 10. revize MKN. Nejčastěji byl diagnostikován paranoidní typ schizofrenie (n=35), dále reziduální (n=7), nediferencovaný (n=5), hebefrenní (n=2) a simplexní typ (n=1). Nemocní během účasti ve studii pokračovali v léčbě indikované v rámci ambulantní péče, včetně užívání nasazených psychofarmak. 49 nemocných bylo léčeno antipsychotiky. Jedna nemocná neužívala žádná psychofarmaka, délka trvání její nemoci byla 2 roky a v době své účasti ve studii byla v klinicky stabilním stavu. Čtyři nemocní byli léčeni monoterapií antipsychotikem 1. generace, 36 nemocných užívalo v monoterapii antipsychotikum 2. generace. 5 nemocných bylo léčeno kombinací antipsychotika 1. a 2. generace, 4 nemocní kombinací dvou antipsychotik 2. generace. Charakteristiky souboru nemocných jsou shrnuty v tabulce 1. Do studie nebyli zařazeni nemocní, kteří byli v posledních 5 měsících léčeni elektrokonvulzemi, těhotné nemocné a nemocní s pozitivním nálezem v toxikologickém vyšetření moči nebo přítomností abúzu psychoaktivních látek v posledních 6 měsících. Demografické a anamnestické údaje byly získány od nemocných nebo z jejich lékařské dokumentace. Do studie nebyli zařazeni nemocní, u kterých bylo podle anamnestických údajů, podle výsledků somatického vyšetření nebo výsledků laboratorních vyšetření prokázáno neurologické nebo kardiovaskulární onemocnění nebo poruchy ledvinných funkcí.
Stanovení sérové koncentrace D-serinu
Nemocným byl ráno mezi 8.00 a 9.30 hod. po 12hodinovém lačnění proveden odběr žilní krve (cca 20 ml) k laboratornímu stanovení koncentrace D-serinu v krevním séru metodou kapalinové chromatografie (high-performance liquid chromatography, HPLC). Pro přípravu mobilní fáze byl použit metanol, kyselina octová (Penta, ČR), octan sodný bezvodý (Sigma-Aldrich, Německo) a NaOH (Kulich, ČR). Derivatizační činidla byla připravena z N-acetyl-L-cysteinu (NAC), 3-merkaptopropionové kyseliny (MPA), o-ftaldialdehydu (OPA) (Sigma-Aldrich, Německo), kyseliny borité a metanolu (Penta, ČR). Po deproteinaci metodou ultrafiltrace pomocí kolonek Microcon – 10 kDa, 0,5 ml (Millipore, USA) byly vzorky uchovávány při teplotě -20 °C. Chromatografická analýza byla realizována na systému HPLC typ LC-10A vp (Shimadzu, Japonsko). Chromatografická separace byla provedena v režimu gradientové eluce v systému reverzní fáze. Pro stanovení D-serinu bylo jako mobilní fáze použito 0,21 μmol/l octanového pufru o hodnotě pH 5,6 (A) a metanol (B) [36]. Separace byla prováděna na dvou sériově zapojených kolonách 250x4 mm Lichrospher RP-18e o velikosti částic náplně 5 μm (Merck, Německo). Signál byl detekován pomocí fluorescenčního detektoru (emisní vlnová délka 454 nm a excitační vlnová délka 337 nm) [19, 31, 36]. Reprodukovatelnost byla 4,54%, bias 1,58%, limit detekce byl stanoven na 0,27 μmol/l .
Vyšetření psychopatologie
Nemocní byli psychiatricky vyšetřeni do 4 hodin po odběru krevního vzorku na stanovení sérové koncentrace D-serinu. Psychopatologie byla hodnocena pomocí posuzovacích stupnic PANSS (The Positive and Negative Syndrome Scale; 30 položek, skór 1-7) [16] a SANS (The Scale for the Assessment of Negative Symptoms; 30 položek, skór 0-5) [1]. Vyšetření klinického stavu nemocných a hodnocení psychopatologie bylo provedeno jedním specializovaným psychiatrem se zkušeností s aplikací hodnotících škál.
Statistické hodnocení
Pro jednotlivé soubory dat a skórů byl stanoven průměr, směrodatná odchylka, medián a rozpětí hodnot. Vzhledem k nenormálnímu rozložení dat byly ke stanovení asociací jednotlivých proměnných použity neparametrické Spearmanovy korelační koeficienty. Ke stanovení rozdílů hodnot proměnných mezi oběma pohlavími byl použit t-test a v případě nenormálního rozložení dat neparametrický Mann-Whitney U test. Zvolená hladina významnosti byla α = 0,05. Asociace hodnot sérových koncentrací D-serinu s hodnotami skórů posuzovacích stupnic psychopatologie u obou pohlaví jsou prezentovány pomocí bodových grafů (scatter plot) s regresními přímkami (obr. 1, obr. 2).
Image 1. Vztah sérové koncentrace D-serinu a celkového skóru PANSS – pohlavní rozdíly (bodový graf s regresivními přímkami; p, hladina významnosti. 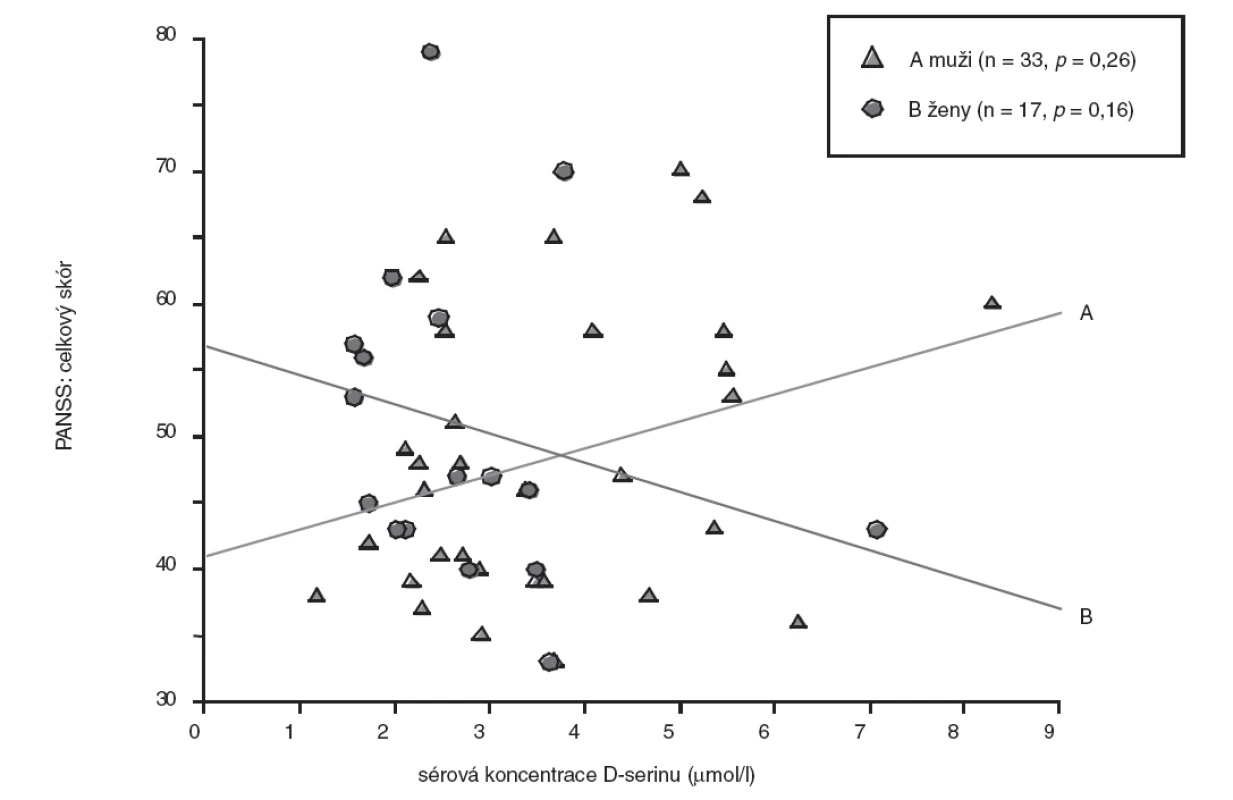
Image 2. Vztah sérové koncentrace D-serinu a celkového skóru SANS - pohlavní rozdíly (bodový graf s regresními přímkami; p, hladina významnosti). 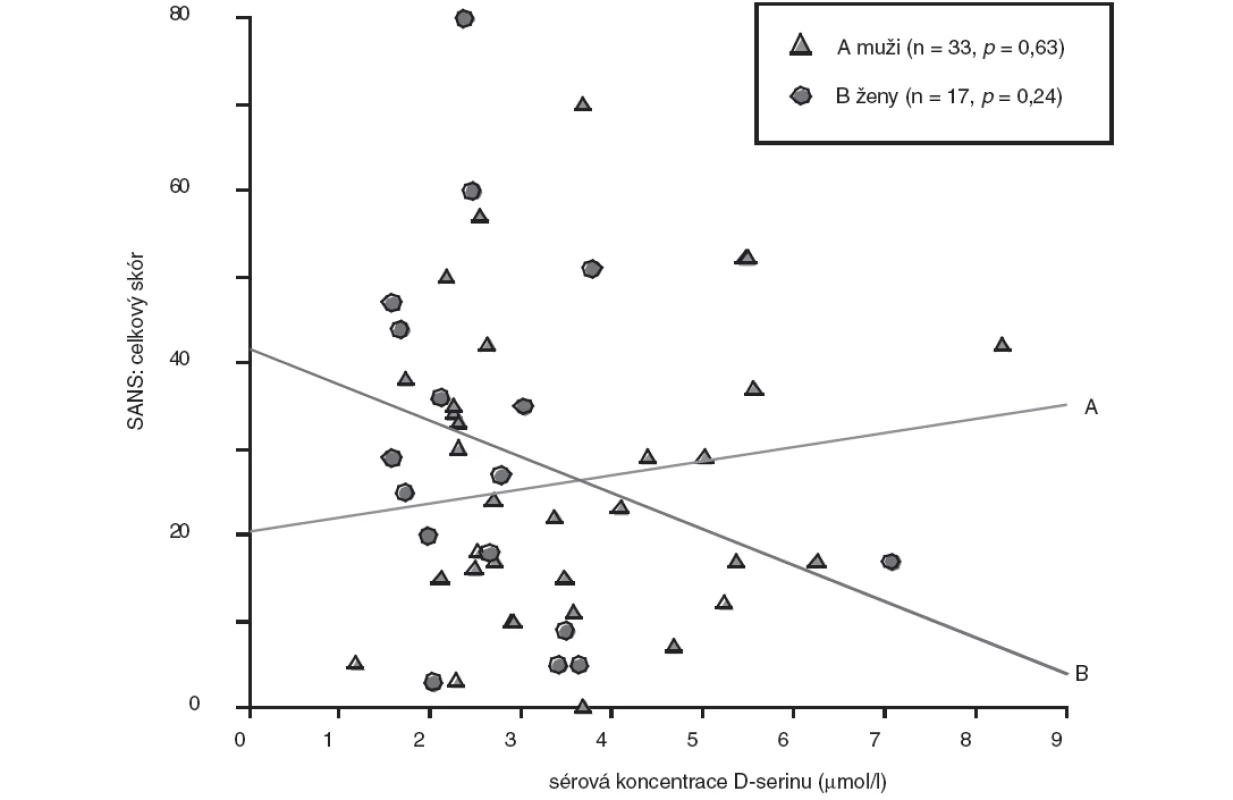
Etické aspekty
Nemocní byli seznámeni na úrovni odpovídající jejich vzdělání a rozumové úrovni s obsahem a záměrem výzkumu a podepsali informovaný souhlas se vstupem do klinické studie. Informovaný souhlas a protokol studie byly schváleny Etickou komisí Fakultní nemocnice Hradec Králové, Lékařské fakulty v Hradci Králové a Vojenské lékařské akademie JEP v Hradci Králové.
VÝSLEDKY
Do klinické studie bylo zařazeno 50 nemocných trpících schizofrenií (průměr ± SD věk, 35,1 ± 11,1 roků; 33 mužů a 17 žen) (tab. 1). Metodou HPLC jsme u nemocných stanovili koncentrace D-serinu v krevním séru (průměr ± SD, 3,30 ± 1,53 μmol/l). Výsledky klinického hodnocení, včetně hodnocení psychopatologie pomocí posuzovacích stupnic PANSS a SANS u nemocných schizofrenií, jsou shrnuty v tabulce 2.
Table 1. Deskriptivní charakteristiky souboru nemocných schizofrenií (n = 50). 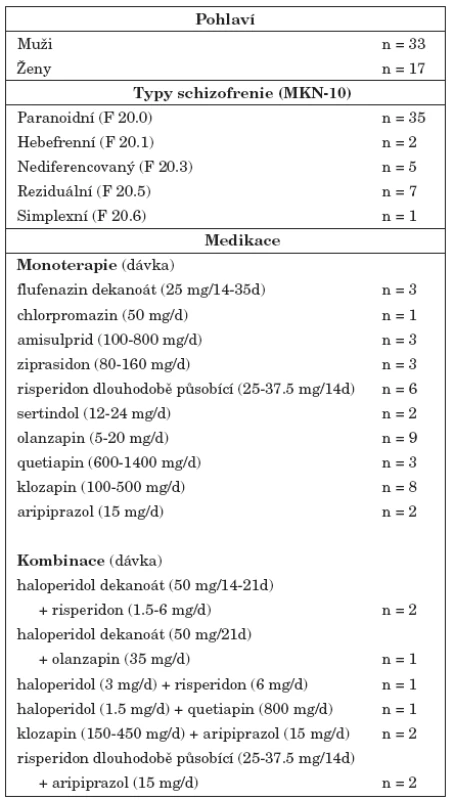
Table 2. Výsledky souboru nemocných schizofrenií (r, korelace proměnné s hodnotou sérové koncentrace D-serinu: Spearmanův korelační koeficient; p, hladina významnosti; PANSS, The Positive and Negative Syndrome Scale; SANS, The Scale for the Assessment of Negative Symptoms; Min-Max, Minimum-Maximum; N.A., not applicable). 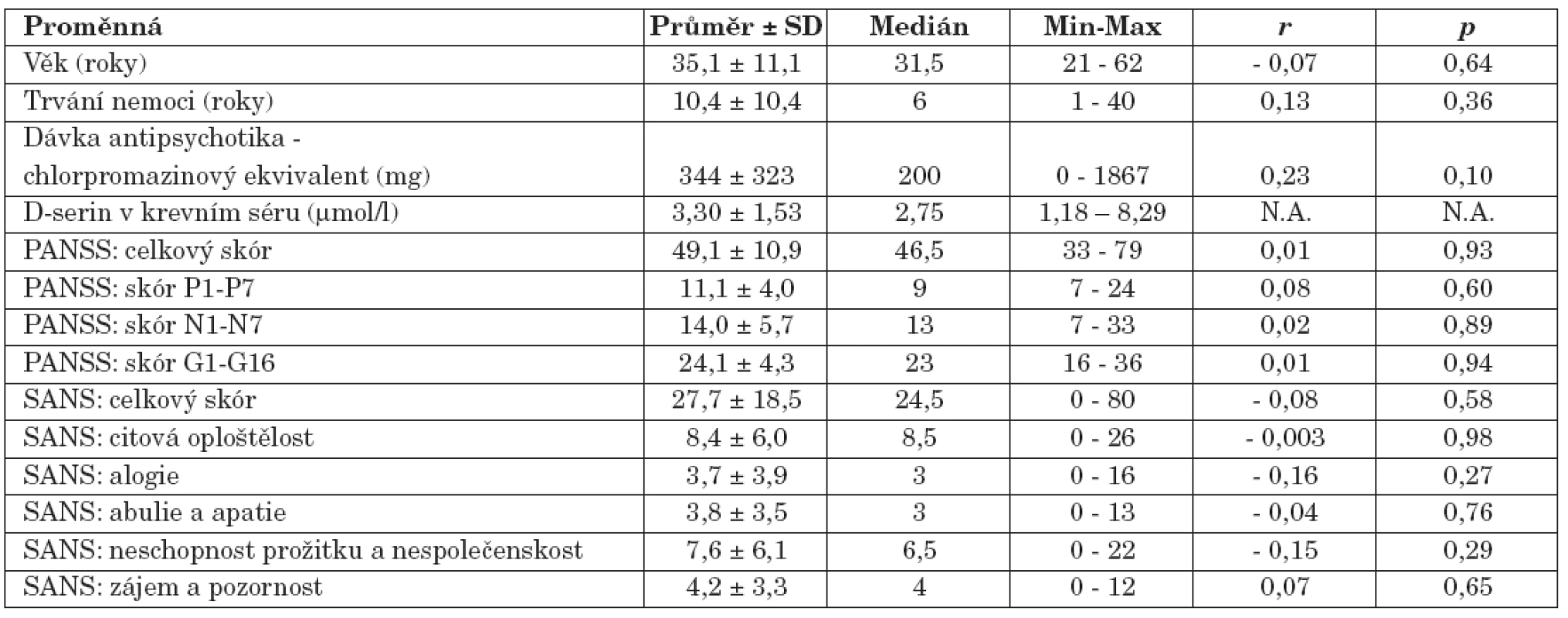
Hodnota sérové koncentrace D-serinu (medián, 2,75 μmol/l) nesouvisela s věkem nemocných (medián, 31,5 roků) (r = - 0,07, p = 0,64, Spearmanův korelační koeficient), dobou trvání jejich nemoci (medián, 6 roků) (r = 0,13, p = 0,36) ani s dávkou užívaných antipsychotik vyjádřenou chlorpromazinovým ekvivalentem (medián, 200 mg) (r = 0,23, p = 0,10).
U nemocných jsme neprokázali vztah mezi hodnotou koncentrace D-serinu v séru a hodnotami celkového skóru PANSS (r = 0,01, p = 0,93), skóru subškály pozitivních příznaků PANSS (P1-P7) (r = 0,08, p = 0,60), skóru subškály negativních příznaků PANSS (N1-N7) (r = 0,02, p = 0,89) a skóru subškály všeobecné psychopatologie PANSS (G1-G16) (r = 0,01, p = 0,94). S koncentrací D-serinu v séru neasociovala intenzita negativní symptomatiky hodnocená celkovým skórem škály SANS (r = - 0,08, p = 0,58), neprokázali jsme ani souvislost s hodnotami skórů subškál citové oploštělosti (r = - 0,003, p = 0,98), alogie (r = - 0,16, p = 0,27), abulie a apatie (r = - 0,04, p = 0,76), neschopnosti prožitku a nespolečenskosti (r = - 0,15, p = 0,29) a skóru subškály zájmu a pozornosti (r = 0,07, p= 0,65).
U skupiny nemocných žen jsme prokázali statisticky nevýznamně (p>0,05, Mann-Whitney U test) nižší koncentrace D-serinu (medián, 2,46 μmol/l) ve srovnání se skupinou mužů (medián, 2,91 μmol/l). Rozdíly hodnot mezi skupinami nemocných mužů a žen jsou shrnuty v tabulce 3. U nemocných mužů jsme zaznamenali jen nevýznamnou lineární souvislost mezi hodnotou sérové koncentrace D-serinu a hodnotou celkového skóru PANSS (r = 0,20, p = 0,26) (obr. 1), u žen nevýznamnou inverzní korelaci hodnoty koncentrace D-serinu v séru s hodnotou celkového skóru PANSS (r = -0,35, p = 0,16) (obr. 1) a celkového skóru SANS (r = -0,30, p = 0,24) (obr. 2). Hodnoty sérových koncentrací D-serinu u skupiny mužů a skupiny žen nekorelovaly s hodnotami skórů subškál stupnic PANSS a SANS.
Table 3. Výsledky souboru nemocných schizofrenií: pohlavní rozdíly (1Mann-Whitney U test; 2 t-test; p, hladina významnosti; PANSS, The Positive and Negative Syndrome Scale; SANS, The Scale for the Assessment of Negative Symptoms). 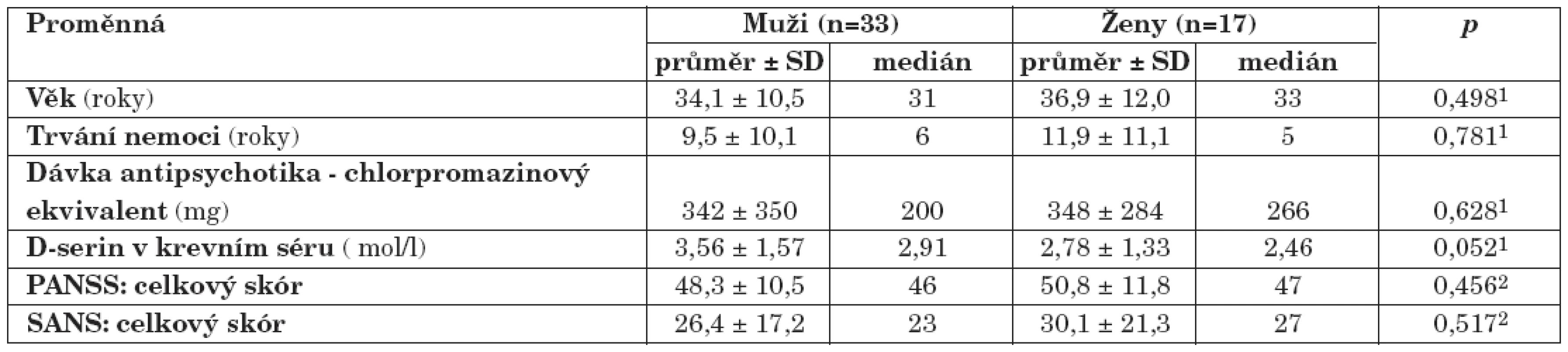
DISKUSE
V klinické studii se nám u souboru 50 nemocných schizofrenií nepodařilo prokázat vztah mezi sérovou koncentrací D-serinu a intenzitou negativních příznaků. Sérová koncentrace D-serinu neasociovala ani s intenzitou pozitivních příznaků. V hodnotách sérových koncentrací D-serinu jsme zaznamenali určité pohlavní rozdíly. U nemocných žen, které měly ve srovnání s muži nevýznamně nižší sérovou koncentraci D-serinu, jsme zjistili negativní asociaci hodnoty sérové koncentrace D-serinu s intenzitou psychopatologie hodnocené celkovým skórem škály PANSS a intenzitou negativních příznaků hodnocených celkovým skórem SANS. Asociace těchto proměnných byly ale jen mírné a statisticky nevýznamné, stejně tak jako vztah sérové koncentrace D-serinu a intenzity psychopatologie hodnocené celkovým skórem škály PANSS u mužů (obr. 1, obr. 2). Rozdíly sérových koncentrací D-serinu ve vztahu k pohlaví nebyly zatím v klinických studiích u nemocných schizofrenií testovány. Tomiya prokázal u mužů nemocných schizofrenií významně zvýšené sérové koncentrace celkového serinu [27]. Koncentrace D-serinu nebyly u nemocných v této studii stanovovány. Rozdíly sérových koncentrací aminokyselin u mužů a žen nemocných schizofrenií mohou být způsobeny pohlavními odlišnostmi hormonálních profilů. Pohlavní rozdíly v dysfunkci glutamátergní neurotransmise spojené se schizofrenií jsou tak zajímavým tématem pro další výzkum.
Hypotézu negativní asociace hodnoty sérové koncentrace D-serinu a intenzity negativní symptomatiky jsme formulovali na základě nálezů snížených koncentrací D-serinu v krevním séru [7, 34] a v mozkomíšním moku [3, 9] u nemocných schizofrenií a klinického účinku adjuvantní léčby D-serinem na negativní příznaky [30]. Tuto hypotézu jsme nepotvrdili a je otázkou, zdali je sérová koncentrace D-serinu vhodným biochemickým markerem funkční úrovně glutamátergního systému v CNS. V CNS je endogenní D-serin syntetizován výlučně v astrocytech šedé mozkové hmoty [23, 24, 32], ale kromě CNS se ve velmi nízkých koncentracích vyskytuje i v krevním séru, slinách a moči. Syntéza D-serinu může u savců probíhat i v periferních tkáních [6]. Pravděpodobným zdrojem D-serinu jsou játra, protože jen hepatocyty jako další buňky vedle astrocytů exprimují významné koncentrace serinracemázy [25]. Některé periferní tkáně (např. magakaryocyty, osteoklasty) exprimují NR1 podjednotku NMDA receptoru, se kterou D-serin interaguje. Transport D-serinu v periferních tkáních probíhá prostřednictvím exchangerů nebo transportérů a z organismu se odstraňuje ledvinami [25]. Vztah mezi sérovou koncentrací D-serinu a dysfunkcí glutamátergní neurotransmise jako patogenetického faktoru schizofrenie předpokládá souvislost mezi poolem D-serinu v CNS a v periferních tkáních. Také klinický účinek adjuvantní léčby D-serinem na negativní a pozitivní příznaky u nemocných schizofrenií léčených antipsychotiky [12, 28, 30] závisí na průchodu periferně podaného D-serinu přes hematoencefalickou bariéru (HEB). Mechanismy transportu D-serinu přes HEB nebyly dosud zcela objasněny. Transport přes HEB je u neutrálních AMK limitován [6]. D-serin prochází HEB lépe než glycin [22, 28, 33] a ve větším množství proniká do CNS i ve srovnání s L-serinem. Hlavní transportní mechanismus D - a L-serinu v HEB je zajišťován na Na+ nezávislým transportním systémem [35], ale u D-serinu byl prokázán i preferenční stereoselektivní transport [2]. Souvislost mezi poolem D-serinu v periferii a CNS a možnost transportu přes HEB prokazují výsledky studií na hlodavcích. Po intraperitoneálním podání D-serinu dochází u krys ke změnám koncentrací D-serinu ve všech periferních tkáních a ve všech oblastech CNS [8]. Je tedy velmi pravděpodobné, že existuje vztah mezi koncentrací D-serinu v krevním séru a v CNS. Sérová koncentrace D-serinu by tak mohla být vhodným markerem funkční úrovně glutamátergní neurotransmise v CNS.
Zdrojem naší hypotézy byly důkazy pozitivního klinického účinku adjuvantní léčby D-serinem v některých klinických studiích [12, 28, 30]. Výsledky studií testujících účinky D-serinu ale nejsou jednotné [20, 29, 30] a jejich rozdíly mohou být způsobeny odlišnostmi v délce trvání jednotlivých studií, malými soubory nebo zařazováním nemocných s rezistentní schizofrenií. Přestože augmentace D-serinem vedla ke zvýšení jeho sérových koncentrací i u nemocných schizofrenií léčených klozapinem [29] a risperidonem [20], nedošlo u nich ke zlepšení schizofrenní symptomatiky. Neúčinnost D-serinu u nemocných léčených klozapinem může souviset s parciálně agonistickým nebo agonistickým účinkem klozapinu na NMDA receptorech.
Výsledky naší studie mohou být vzhledem k velmi nízké fyziologické koncentraci D-serinu v krevním séru ovlivněny senzitivitou metody jeho stanovení. Metoda stanovení D-serinu použitá v naší studii (HPLC) byla stejná a také velikost našeho souboru nemocných byla podobná ve srovnání s použitou metodou a velikostí souborů testovaných v klinických studiích, které byly zdrojem naší hypotézy [7, 34]. Negativní výsledky naší studie mohou tak být ovlivněny odlišnými charakteristikami populace nemocných, účinky antipsychotické medikace nebo dietními návyky. Do naší studie byli zařazeni nemocní v ambulantní péči, kteří byli léčeni převážně antipsychotiky 2. generace a z klinického hlediska byli ve stabilním stavu nevyžadujícím hospitalizaci. Hashimoto do své studie zařadil nemocné, jejichž stav vyžadoval hospitalizaci [7]. Rozdíly v sérových koncentracích D-serinu mezi skupinou antipsychotiky léčených a neléčených nemocných schizofrenií nezjistil a v souhlase s našimi výsledky také nenalezl souvislost sérové koncentrace D-serinu s dávkou antipsychotika vyjádřenou chlopromazinovým ekvivalentem [7]. Vliv farmakoterapie na naše výsledky ale přesto nelze vyloučit. Koncentrace aminokyselin v krevním séru by mohla být ovlivněna jejich příjmem v potravě. Stejně tak jako v klinických studiích, ve kterých odběru nalačno žádná dietní opatření nepředcházela [7, 34], jsme v naší studii vzorek krve odebírali ráno po nočním 12hodinovém lačnění. Průměrné sérové koncentrace D-serinu se u nemocných v naší studii pohybovaly v mezích laboratorních referenčních hodnot a byly ve srovnání s hodnotami zjištěnými stejnou metodou (HPLC) bez předchozí speciální diety a v podobně velkém souboru nemocných [7] nižší.
Objasnění rozdílů v nálezech sérových koncentrací D-serinu má u nemocných schizofrenií velký praktický význam vzhledem k perspektivě léčby agonisty NMDA receptorů. Pro poznání role dysfunkce glutamátergního systému v patogenezi schizofrenie je důležité stanovení biochemických markerů funkční úrovně tohoto systému v CNS. Hledání vztahu sérových koncentrací excitačních aminokyselin ke specifickým psychopatologickým dimenzím umožní laboratorní a klinickou diferenciaci schizofrenních psychóz. Předpokládáme, že stanovení biochemických a klinických profilů povede k identifikaci specifických subtypů schizofrenie. Formulování takové typologie umožní cílenou léčbu na ovlivnění glutamátergní dysfunkce v CNS.
Klinická studie je realizována za finanční podpory výzkumného záměru MSM 0021620816.
MUDr. Jaromír Hons
Psychiatrická klinika LF UK a FN
Sokolská 581
500 05 Hradec Králové
e-mail: honsj@lfhk.cuni.cz
Sources
1. Andreasen, N. C.: The Scale for the Assessment of Negative Symptoms (SANS): conceptual and theoretical foundations. Br. J. Psychiat. Suppl., 7, 1989, pp. 49-58.
2. Bauer, D., Hamacher, K., Bröer, S., Pauleit, D., Palm, C., Zilles, K., Coenen, H. H., Langen, K. J.: Preferred stereoselective brain uptake of D-serine – a modulator of glutamatergic neurotransmission. Nucl. Med. Biol., 32, 2005, 8, pp. 793-797.
3. Bendikov, I., Nadri, C., Amar, S., Panizzutti, R., De Miranda, J., Wolosker, H., Agam, G.: A CSF and postmortem brain study of D-serine metabolic parameters in schizophrenia. Schizophr. Res., 90, 2007, 1-3, pp. 41-51.
4. Evins, A. E., Amico, E., Posever, T. A., Toker, R., Goff, D. C.: D-cycloserine added to risperidone in patients with primary negative symptoms of schizophrenia. Schizophr. Res., 56, 2002, 1-2, pp. 19-23.
5. Goff, D. C., Tsai, G., Manoach, D. S., Coyle, J. T.: A dose-finding trial of D-cycloserine added to neuroleptic for negative symptoms in schizophrenia. Am. J. Psychiat., 152, 1995, pp. 1213-1215.
6. Hashimoto, A., Oka, T.: Free D-aspatate and D-serine in the mammalian brain and periphery. Prog. in Neurobiol., 52, 1997, pp. 325-353.
7. Hashimoto, K., Fukushima, T., Shimizu, E., Komatsu, N., Watanabe, H., Shinoda, N., Nakazato, M., Kumakiri, C., Okada, S., Hasegawa, H., Imai, K., Iyo, M.: Decreased serum levels of D-serine in patients with schizophrenia: evidence in support of the N-methyl-D-aspartate receptor hypofunction hypothesis of schizophrenia. Arch. Gen. Psychiat., 60, 2003, 6, pp. 572-576.
8. Hashimoto, A., Chiba, Y.: Effect of systemic administration of D-serine on the levels of D - and L-serine in several brain areas and periphery of rat. Eur. J. Pharmacol., 495, 2004, 2-3, pp. 153-158.
9. Hashimoto, K., Engberg, G., Shimizu, E., Nordin, C., Lindstrom, L. H., Iyo, M.: Reduced D-serine to total serine ratio in the cerebrospinal fluid of drug naive schizophrenic patients. Prog. Neuropsychopharmacol. Biol. Psychiat., 29m 2005, 5, pp. 767-769.
10. Heresco-Levy, U., Ermilov, M., Shimoni, J., Shapira, B., Silipo, G., Javitt, D. C.: Placebo-controlled trial of D-cycloserin added to conventional neuroleptics, olanzapine, or risperidone in schizophrenia. Am. J. Psychiat., 159, 2002, 3, pp. 480-482.
11. Heresco-Levy, U., Javitt, D. C.: Comparative effects of glycine and D-cycloserine on persistent negative symptoms in schizophenia: a retrospective analysis. Schizophr. Res., 66, 2004, 2-3, pp. 89-96.
12. Heresco-Levy, U., Javitt, D. C., Ebstein, R., Vass, A., Lichtenberg, P., Bar, G., Catinari, S., Ermilov, M.: D-serine efficacy as add-on pharmacotherapy to risperidone and olanzapine for treatment-refractory schizophrenia. Biol. Psychiat., 57, 2005, 6, pp. 577-585.
13. Javitt, D. C., Zukin, S. R.: Recent advances in the phencyclidine model of schizophrenia. Am. J. Psychiat,. 148, 1991, pp. 1301-1308.
14. Javitt, D. C., Zylberman, I., Zukin, S. R., Heresco-Levy, U., Lindenmayer, J. P.: Amelioration of negative symptoms in schizophrenia by glycine. Am. J. Psychiat., 151, 1994, pp. 1234-1236.
15. Javitt, D. C., Silipo, G., Cienfuegos, A., Shelley, A. M., Bark, N., Park, M., Lindenmayer, J. P., Suckow, R., Zukin, S. R.: Adjunctive high-dose glycine in the treatment of schizophrenia. Int. J. Neuropsychopharmacol., 4, 2001, 4, pp. 385-391.
16. Kay, S. R., Fiszbein, A., Opler, L. A.: The positive and negative syndrome scale (PANSS) for schizophrenia. Schizophr. Bull., 13, 1987, 2, pp. 261-276.
17. Krystal, J. H., Karper, L. P., Seibyl, J. P., Freeman, G. K., Delaney, R., Bremner, J. D., Heninger, G. R., Bowers, M. B., Charney, D. S.: Subanesthetic effects of the noncompetitive NMDA antagonist, ketamine, in humans. Psychotomimetic, perceptual, cognitive, and neuroendocrine responses. Arch. Gen. Psychiat., 51, 1994, pp. 199-214.
18. Krystal, J. H., Pery, E. B., Gueorguieva, R., Belger, A., Madonick, S. H., Abi-Dargham, A., Cooper, T. B., MacDougall, L., Abi-Saab, W., D´Souza, D. C.: Comparative and interactive human psychopharmacologic effects of ketamine and amphetamine: implications for glutamatergic and dopaminergic model psychoses and cognitive function. Arch. Gen. Psychiat., 62, 2005, pp. 985-995.
19. Kutlan, D., Presits, P., Molnar-Perl, I.: Behavior and characteristics of amine derivatives obtained with o-phthaldialdehyde/3-mercaptopropionic acid and with o-phthaldialdehyde/N-acetyl-cysteine reagents. J. Chromatogr. A., 949, 2002, pp. 235-248.
20. Lane, H., Chang, Y., Liu, Y., Chiu, Ch., Tsai, G.: Sarcosine or D-serine add-on treatment for acute exacerbation of schizophrenia. Arch. Gen. Psychiat., 62, 2005, pp. 1196-1204.
21. Matsui, T., Sekiguchi, M., Hashimoto, A., Tomita, U., Nishikawa, T., Wada, K.: Functional comparison of D-serine and glycine in rodents: the effect on cloned NMDA receptors and the extracellular concentration J. Neurochem., 65, 1995, pp. 454-458.
22. Oldendorph, W. M.: Brain uptake of radio labeled amino acids, amines and hexoses after arterial injection. Am. J. Physiol., 221, 1971, pp. 1629-1639.
23. Schell, M. J., Molliver, M. E., Snyder, S. H.: D-serine, an endogenous synaptic modulator: localization to astrocytes and glutamate-stimulated release. Proc. Natl. Acad. Sci. USA., 92, 1995, 9, pp. 3948-3952.
24. Schell, M. J., Brady, R. O., Molliver, M. E., Snyder, S. H.: D-serine as a neuromodulator: regional and developmental localizations in rat brain glia resemble NMDA receptors. J. Neurosci., 17, 1997, pp. 1604-1615.
25. Schell, M. J.: The N-methyl-D-aspartate receptor glycine site and D-serine metabolism: an evolutionary perspective. Phil. Trans. R. Soc. Lond. B., 359, 2004, pp. 943-964.
26. Scolari, M. J., Acosta, G. B.: D-serine: a new word in the glutamatergic neuro-glial language. Amino Acids., 33, 2007, pp. 563-574.
27. Tomiya, M., Fukushima, T., Watanabe, H., Fukami, G., Fujisaki, M., Iyo, M., Hashimoto, K., Mitsuhashi, S., Toyo´oka, T.: Alterations in serum amino acid concentrations in male and female schizophrenic patients. Clin. Chim. Act., 380, 2007, pp. 186-190.
28. Tsai, G., Yang, P., Chung, L., Lange, N., Coyle, J. T.: D-serine added to antipsychotics for treatment of schizophrenia. Biol. Psychiat., 44, 1998, 11, pp. 1081-1089.
29. Tsai, G., Yang, P., Chung, L., Tsai, I., Tsai, Ch., Coyle, J. T.: D-serine added to clozapine for the treatment of schizophrenia. Am. J. Psychiat., 156, 1999, pp. 1822-1825.
30. Tuominen, H. J., Tiihonen, J., Wahlbeck, K.: Glutamatergic drugs for schizophrenia: a systematic review and meta-analysis. Schizophr. Res., 72, 2005, pp. 225-234.
31. Vasanits, A., Kutlan, D., Sass, P., Molnar-Perl, I.: Retention/quantification properties of the o-phthaldialdehyde-3-mercaptopropionic acid and the o-phthaldialdehyde-N-acetyl-L-cysteine amino acid derivatives in reversed-phase high-performance liquid chromatography. J. Chromatogr. A., 870, 2000, pp. 271-287.
32. Wolosker, H., Blackshaw, S., Snyder, S. H.: Serine racemase: a glial enzyme synthesizing D-serine to regulate glutamate-N-methyl-D-aspartate neurotransmission. Proc. Natl. Acad. Sci.. 96, 1999, pp. 13409-13414.
33. Wolosker, H., Panizzutti, R., De Miranda, J.: Neurobiology through the looking-glass: D-serine s a new glial-derived transmitter. Neurochem. Internat., 41, 2002, 5, pp. 327-332.
34. Yamada, K., Ohnishi, T., Hashimoto, K., Ohba, H., Iwayama-Shigeno, Y., Toyoshima, M., Okuno, A., Takao, H., Toyota, T., Minabe, Y., Nakamura, K., Shimizu, E., Itokawa, M., Mori, N., Iyo, M., Yoshikawa, T.: Identification of multiple serine racemase (SRR) mRNA isoforms and genetic analyses of SRR and DAO in schizophrenia and D-serine levels. Biol. Psychiat., 57, 2005, pp. 1493-1503.
35. Yamamoto, N., Tomita, U., Umino, A., Nishikawa, T.: Uptake of D-serine by synaptosomal P2 fraction isolated from rat brain. Synapse, 42, 2001, 2, pp. 84-86.
36. Zhao, M., Bada, J. L.: Determination of α-dialkylamino acids and their enantiomers in geological samples by high-performance liquid chromatography after derivatization with chiral adduct of o-phthaldialdehyde. J. Chromatogr. A., 690, 1995, pp. 55-63.
Labels
Addictology Paediatric psychiatry Psychiatry
Article was published inCzech and Slovak Psychiatry

2008 Issue 6-
All articles in this issue
- Vztah sérové koncentrace D-serinu a psychopatologie u schizofrenie
- Disociace a kognitivní funkce u obsedantně-kompulzivní poruchy – průřezová studie
- Kanabinoidy a duševní poruchy
- Jak porozumět výsledkům klinických studií a přeložit je do klinické praxe s pomocí NNT
- Vliv duševních chorob na pracovní výkonnost
- Czech and Slovak Psychiatry
- Journal archive
- Current issue
- Online only
- About the journal
Most read in this issue- Kanabinoidy a duševní poruchy
- Disociace a kognitivní funkce u obsedantně-kompulzivní poruchy – průřezová studie
- Jak porozumět výsledkům klinických studií a přeložit je do klinické praxe s pomocí NNT
- Vliv duševních chorob na pracovní výkonnost
Login#ADS_BOTTOM_SCRIPTS#Forgotten passwordEnter the email address that you registered with. We will send you instructions on how to set a new password.
- Career

