-
Medical journals
- Career
Selektívne inhibítory cyklooxygenázy 2 – ich minulosť, prítomnosť a budúcnosť
Authors: Simona Valášková; Ján Kyselovič; Andrea Gažová
Published in: Čes. slov. Farm., 2023; 72, 63-69
Category: Review Articles
doi: https://doi.org/https://doi.org/10.5817/CSF2023-2-63Overview
Bolesť je závažný subjektívny vnem, ktorý hoci má ochranný charakter, pacienta nielen fyzicky, ale aj psychicky vyčerpáva. Farmakologická oblasť vývoja a výskumu liečby a odstraňovania bolesti je od izolovania kyseliny salicylovej stále dynamická a zaujímavá. Po objavení molekulárnej podstaty cyklooxygenázy a jej inhibície sa výskum nasmeroval na selektívne inhibítory COX-2, ktoré však boli veľkým sklamaním. Dnes sa opäť objavuje možnosť ako kombináciou liečiv prispieť pacientovi k bezpečnej a účinnej analgeticko-antiflogistickej liečbe.
Klíčová slova:
inhibícia cyklooxygenázy – nesteroidné antiflogistiká – koxiby
Úvod
Nesteroidné antiflogistiká (NSA) sú široká skupina liečiv, ktoré pôsobia analgeticky, antipyreticky a antiflogisticky. Tieto farmakologické vlastnosti umožňujú ich použitie v klinickej praxi pri liečbe bolesti nielen pohybového aparátu, dysmenorey, horúčky, dny a migrény1). Svoje opodstatnenie si našli aj v liečbe chronických ochorení, ktoré sú často sprevádzané zápalom a bolestivosťou, ako je reumatoidná artritída, osteoartróza a ankylozujúca spondylitída.
História NSA sa začala písať už v roku 1828, kedy bola prvý krát vyizolovaná kyselina salicylová. V roku 1899, po uvedení aspirínu na klinický trh, sa nesteroidné antiflogistiká stali stredobodom pozornosti v liečbe akútnej bolesti. Spolu s ďalším členom tejto skupiny, ibuprofénom, boli centrom záujmu mnohých medicínskych a farmaceutických odvetví. Pre svoju účinnosť, nenávykovosť a bezpečnosť sa začali používať častejšie ako opioidné analgetiká2, 3). Aj v súčasnosti je táto skupina liekov jednou z najbežnejšie používaných na svete a uvádza sa, že približne 90 % užívaných analgetík patrí medzi nesteroidné antiflogistiká. Na celom svete užíva NSA denne viac ako 30 miliónov ľudí, čo je spôsobené rastúcim priemerným vekom obyvateľstva a množstvom pacientov s chronickými ochoreniami4, 5). Veľkosť globálneho trhu s nesteroidnými antiflogistikami bola v roku 2019 na úrovni 15,58 miliardy USD a predpokladá sa, že sa do roku 2027 zvýši na 24,35 miliardy USD. Podľa tlačovej správy Endo International plc sa len v USA ročne predpíše približne 84 miliónov receptov na NSA4). Spotreba týchto liekov sa v jednotlivých krajinách sveta líši v závislosti od úrovne zdravotnej starostlivosti, hospodárstva a priemernej dĺžky života ľudí. V mnohých krajinách je predaj nesteroidných antiflogistík vo veľkej miere dostupný bez lekárskeho predpisu, čím sa spotreba ešte zvyšuje. Podľa analýz sa NSA indikujú najviac na bolesti a zápaly pohybového aparátu, na zápaly šliach, pooperačné bolesti, artritídy alebo zlomeniny. Podávajú sa v tabletách, kapsulách, granulátoch alebo v topickej forme. Mnohé sú vyrábané v kapsulách s riadeným uvoľňovaním alebo s rýchlejším nástupom účinku. Podľa organizácie OECD bola v roku 2019 (obdobie pred „Covidom“ a umelým vytváraním zásob liekov obyvateľstvom) denná spotreba nesteroidných antiflogistík z Európskych krajín najvyššia v Portugalsku a Slovenská republika bola na 10 mieste (obr. 1)6).
Image 1. Denná spotreba nesteroidných antiflogistík v Európskych krajinách podľa OECD za rok 2019 6) 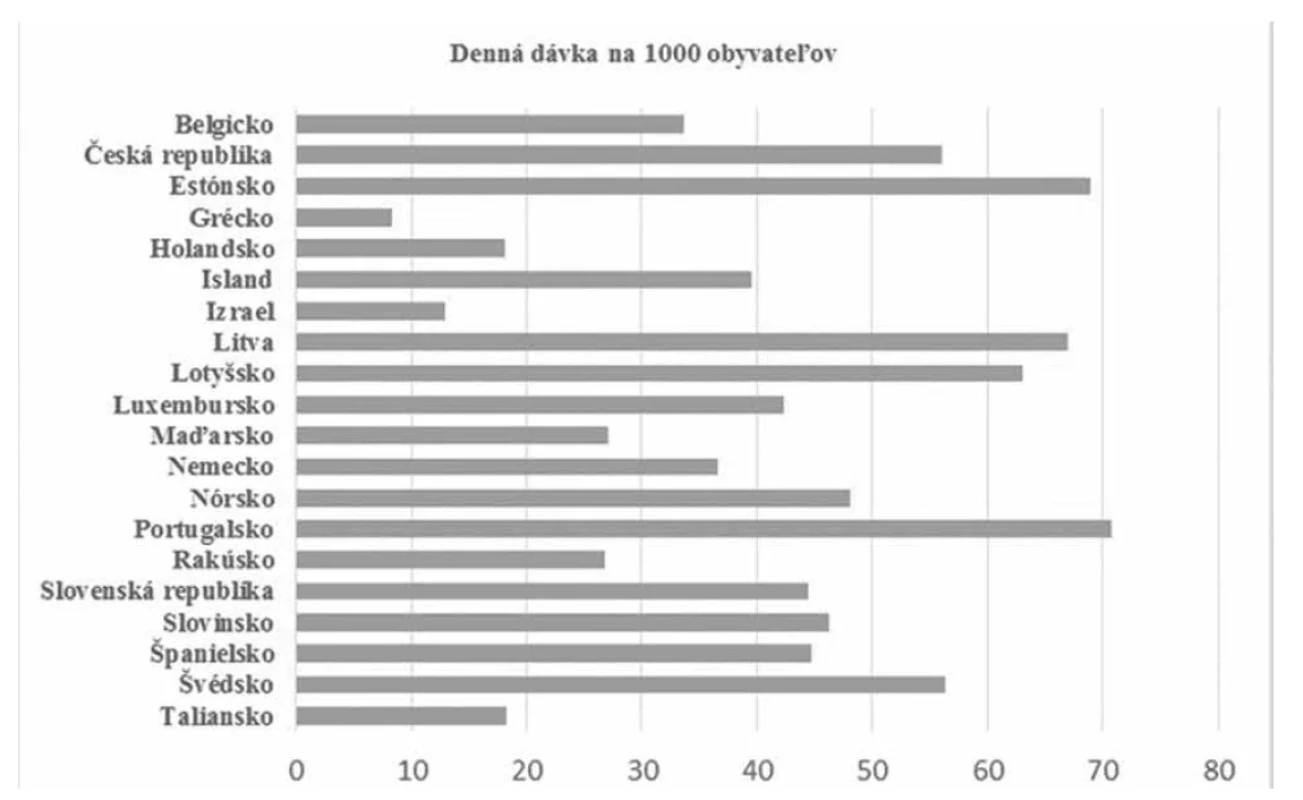
Na Slovensku sa predpisujú NSA vo väčšine prípadov na bolesť a zápal muskuloskeletálneho systému. Za rok 2021 bola spotreba liekov v ATC skupine M-Muskuloskeletálny systém 3 714 182 balení, z čoho 2 722 293,8 boli konkrétne antireumatiká a antiflogistiká zatriedené do skupiny M01. V rebríčku spotreby liekov na bolesť vydaných na lekársky predpis bolo vydaných najviac balení analgetikého lieku NOVALGIN (metamizol) 500 mg tbl flm 20 × 500 mg, a to 1 270 533 balení. Liek FLECTOR EP RAPID (diklofenak) 50 mg gra 20 × 50 mg bol na prvom mieste v skupine nesteroidných antiflogistík a bolo z neho vydaných najviac balení, a to 737 tisíc. Iné je poradie vo voľnopredajných liekov. Prvenstvo v spotrebe voľnopredajných liekov na bolesť (analgetík) už niekoľko rokov patrí lieku PARALEN (paracetamol) 500 tbl 24 × 500 mg. Za uplynulý rok sa v lekárňach predalo viac ako 2,5 milióna balení. Z nesteroidných antiflogistík si drží prvenstvo ACYLPYRIN (kyselina acetylsalicylová) tbl 10 × 500 mg v počte balení 1 044 856 a na druhom mieste bol IBALGIN (ibuprofén) 400 tbl flm 48 × 400 mg v počte balení 727 166 za rok 2021. Lieky s účinnou látkou diklofenak boli v spotrebe za rok 2021 na treťom mieste7).
Tradične sa nesteroidné antiflogistiká klasifikovali na základe ich chemických vlastností ako hlavné deriváty kyseliny salicylovej, kyseliny octovej, kyseliny enolovej, kyseliny antranilovej alebo kyseliny propiónovej. S pokrokom vedeckých zistení sa klasifikácia posunula k zrozumiteľnejšiemu deleniu podľa ich miery inhibície prozápalového enzýmu cyklooxygenázy. Miera inhibície cyklooxygenázy totiž odzrkadľuje nielen farmakologický profil liečiva, ale aj jeho potenciálne nežiaduce účinky a určuje aj ich bezpečnostný profil3, 8). Mechanizmom inhibície sa zablokuje syntéza prostaglandínov z kyseliny arachidónovej nachádzajúcej sa v bunkových membránach (obr. 2).
Image 2. Mechanizmus účinku nesteroidných antiflogistík na základe inhibície enzýmu cyklooxygenázy9) 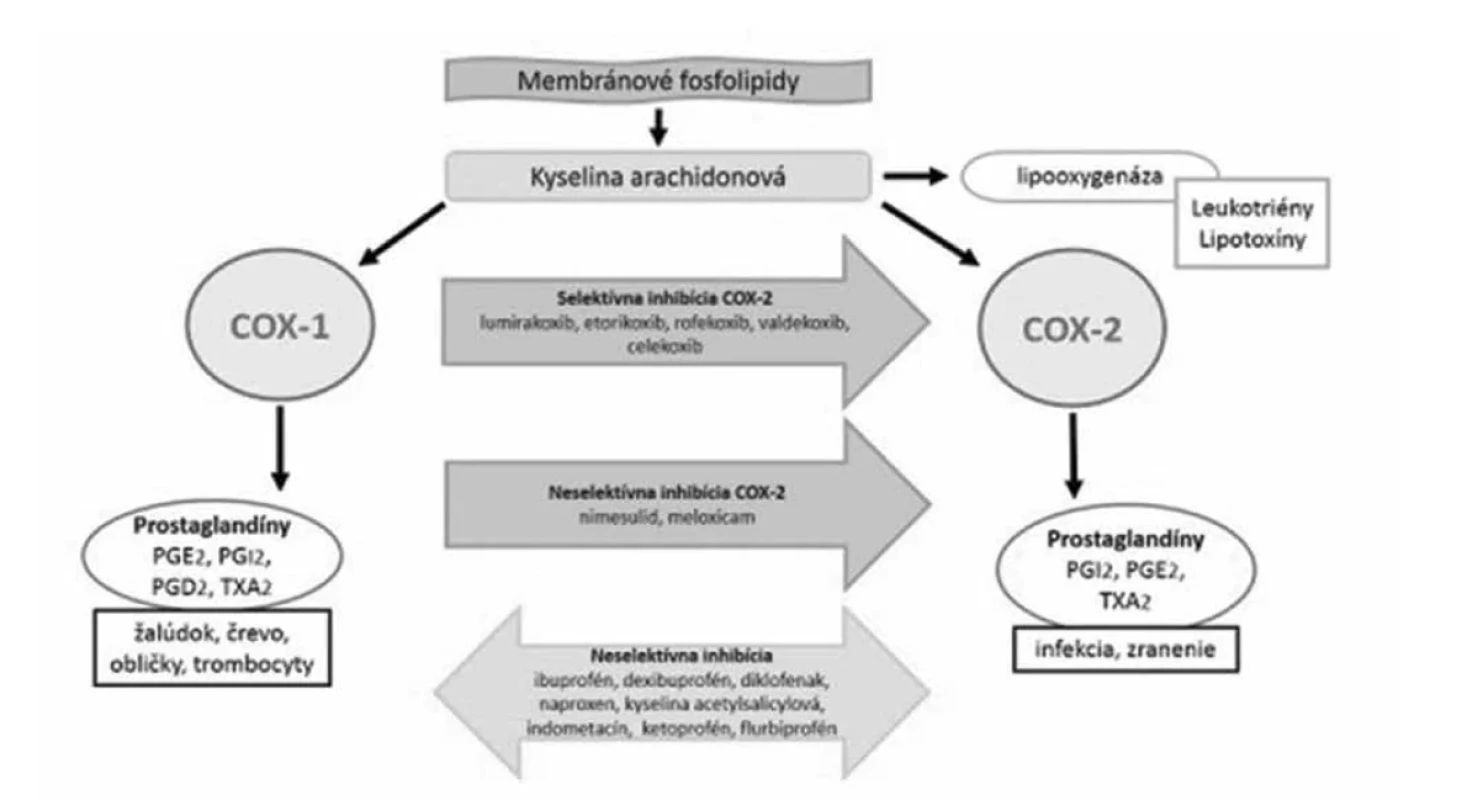
Okrem samotnej inhibície cyklooxygenázy sa NSA podieľajú aj na inhibícii syntézy prozápalových cytokínov, leukotriénov, bránia uvoľneniu lyzozómových enzýmov, potláčajú aktivitu polymorfonukleárov a superoxidových radikálov9).
Až do konca 70. rokov sa na liečbu bolesti a zápalu celosvetovo najviac používal liek Aspirin bez toho, aby sa vedelo, že má schopnosť inhibovať tvorbu prostaglandínov prostredníctvom blokácie enzýmu cyklooxygenázy. V roku 1971 publikoval anglický farmakológ John Robert Vane článok „Inhibition of Prostaglandin Synthesis as a Mechanism of Action form Asprin-like Drugs“, v ktorom popísal mechanizmus účinku Aspirinu a za tento objav bol následne ocenený Nobelovou cenou10). Enzým cyklooxygenáza je známa v dvoch izoformách: cyklooxygenáza 1 (COX-1) a cyklooxygenáza 2 (COX-2). Práve objav izoenzýmu a jeho dvoch izoforiem viedlo k raketovému vývoju inhibítorov COX-1 a COX-2. Štruktúra a funkcia oboch izoforiem je takmer identická. Konštitutívna COX-1 je zodpovedná za vznik prostaglandínov, ktoré sa zapájajú do celej rady fyziologických funkcií v celom organizme. Bolo dokázané, že COX-1 je široko exprimovaná vo väčšine tkanív vrátane gastrointestinálnej sliznice, krvných doštičiek, endotelu, obličiek a maternice. Expresia indukovateľnej COX-2 formy sa výrazne zvyšuje len pri zápale11).
Na základe selektivity voči cyklooxygenáze delíme nesteroidné antiflogistiká na neselektívne, inhibujú cyklooxygenázu COX-1 aj COX-2, preferenčné, inhibujú prednostne COX-2, ale aj COX-1 a selektívne, ktoré inhibujú len COX-2. Čím väčšia je miera inhibície COX-1, tým je väčšia miera rizika výskytu nežiaducich účinkov (obr. 3) – predovšetkým krvácanie, nefro - a gastrotoxicitu. Je to spôsobené tým, že prostaglandíny syntetizované pomocou COX-1 sú zodpovedné za prekrvenie žalúdočnej sliznice, zvyšujú produkciu hlienu a znižujú sekréciu kyseliny chlorovodíkovej, a jej prípadná inhibícia môže viesť ku gastrointestinálnym ťažkostiam. COX-1 má tiež jedinečnú úlohu pri syntéze tromboxánu, ktorý je zodpovedný za ireverzbilnú agregáciu trombocytov, a preto jej inhibícia nesteroidnými antiflogistikami vedie k zvýšenej krvácavosti. Pri dlhodobom užívaní neselektívnych antiflogistík sa môžu vyskytnúť okrem renálnych aj kardiovaskulárne problémy12). Čisto protizápalový a analgetický účinok je spätý práve s inhibíciou COX-2. Odhalenie jej vlastností viedlo k vývoju nových NSA, ktoré boli selektívne voči COX-2 a nazývajú sa koxiby. Prvé používané koxiby boli celekoxib (na Slovensku registrované Aclexa a Celebrex) a rofekoxib, no v klinickej praxi sa uplatnili aj koxiby II. generácie, a to valdekoxib, parekoxib, etorikoxib a lumirakoxib13, 14).
Image 3. Miera nežiaducich účinkov nesteroidných antiflogistík na základe selektivity voči cyklooxygenáze 1 a cyklooxygenáze 29) 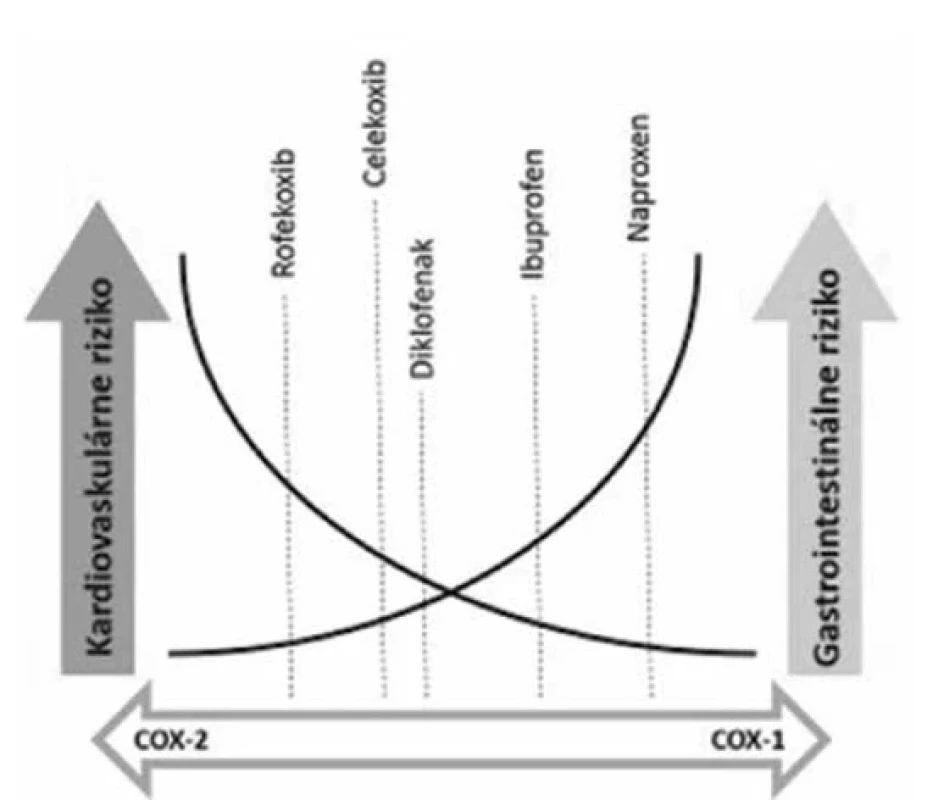
Nesteroidné antiflogistiká a gastrointestinálne riziko
Gastrointestinálne riziko nesteroidných antiflogistík tvorí viac ako 50 % všetkých nežiaducich účinkov tejto farmakologicky rozsiahlej skupiny. Patofyziologickým základom ťažkostí je práve inhibícia syntézy prostaglandínov blokáciou COX-1. Tým, že sa inhibíciou prostaglandínov naruší integrita a rovnováha žalúdočného prostredia, potláčajú sa všetky prirodzené tráviace mechanizmy. Najčastejším nežiaducim účinkom je dyspepsia, klinicky prejavujúca sa bolesťou v oblasti brucha, nauzeou a zvracaním. Následkom bývajú mikroerózie a erózie sliznice žalúdka, dvanástnika a čriev. Najzávažnejšou komplikáciou je ulcerácia v oblasti gastroduodéna končiaca obvykle krvácaním. Prasknutie žalúdočného vredu je sprevádzané čiernou stolicou a zvracaním natrávenej krvi, čo môže mať pre človeka fatálny priebeh. Nie je úplne objasnený interval medzi začiatkom užívania NSA a vznikom slizničných lézií. Predpokladá sa, že u 1–2 % pacientov, ktorí užívajú NSA minimálne 3 mesiace, sa postupne narúša sliznica a tvoria sa menšie vriedky. K regenerácii žalúdka dochádza takmer okamžite po ukončení podávania nesteroidných antiflogistík. Najväčšie gastrointestinálne riziko majú liečivá s dlhým polčasom rozpadu alebo lieky s postupným uvoľňovaním liečiva15). Gastroduodenálna toxicita neselektívnych NSA je rôzna v závislosti od druhu liečiva a dávky. Podľa dostupných štúdií sú najvážnejšie gastrointestinálne ťažkosti spôsobené liečivom ketorolac (v SR neregistrovaný) a následne v poradí piroxikam (Flamexin), meloxikam (Movalis), indometacín, ketoprofén, kyselina acetylsalicylová (Aspirin) a naproxén (Nalgesin). Najčastejšie odporúčaný ibuprofén (Ibuprofen, Ibalgin), dexibuprofén (Ibolex) a diklofenak (Voltaren, Veral) majú z neselektívnych nesteroidných antiflogistík najbezpečnejší profil v rámci gastrointestinálneho traktu, v závislosti na dávke a spôsobu užívania12). Avšak u diklofenaku je veľmi otázna kardiovaskulárna bezpečnosť, dnes už pri NYHA III, IV kontraindikovaný. Až do 90. rokov 20. storočia sa nepodarilo vyvinúť NSA, ktoré by nespôsobovali gastrointestinálne ťažkosti. Odhalenie prozápalového mechanizmu inhibíciou COX-2 predpovedalo úspešnosť selektivity nesteroidných inhibítorov cyklooxygenázy. Hypotéza selektívneho pôsobenia na COX-2 si získala široké prijatie a popularitu. Prvotné experimenty preukázali inhibíciu karagénanom indukovaného zápalu, pričom nenastala žiadna výrazná zmena v bazálnej produkcii prostaglandínov v žalúdku a neboli lokalizované žiadne žalúdočné lézie. Išlo o predklinické porovnávanie selektívneho inhibítora COX-2 s neselektívnym indometacínom. Výsledky vtedy naznačovali potenciálnu významnosť selektivity na liečbu zápalu bez patologického ovplyvnenia gastrointestinálneho traktu16).
Kontroverznosť klinických štúdií koxibov
Zníženie nežiaducich účinkov nesteroidných antiflogistík sa stalo prioritou číslo jedna a výskum inhibítorov COX-2 vyústil do vývoja nových NSA, tzv. koxibov. Za veľmi krátky čas, na základe výsledkov získaných v relatívne malých a krátkodobých klinických testoch, dosiahli koxiby ohromný komerčný úspech a prevzali veľký podiel na trhu s liekmi. Mnohé farmaceutické firmy si zobrali za cieľ uviesť na trh koxiby bez akejkoľvek záťaže na tráviaci trakt pacienta. To bolo dokázané tromi významnými štúdiami: CLASS, VIGOR a TARGET, do ktorých sa zapojilo viac ako 10 000 pacientov s diagnostikovanou reumatoidnou artritídou alebo osteoartrózou. V roku 1999 farmaceutické firmy predstavili prvé dve liečivá z rady koxibov, a to celekoxib a rofekoxib. Za menej ako rok vykazovali obe liečivá predaje presahujúce 3 miliardy amerických dolárov len na území Spojených štátov amerických. Ďalšie roky predaje ešte viac stúpli a lieky expandovali postupne do celého sveta, čo bolo pre farmaceutický priemysel dovtedy nevídané. FDA odporučil koxiby ako prvú voľbu liečby reumatoidnej artritídy a osteoartrózy. Celekoxibu boli postupne schválené indikácie dysmenorea a možnosť doplnkovej liečby pri familiárnej adenomatóznej polypóze. Väčšinu zásluh za tento raketový vzostup koxibov možno pripísať práve spomínanej štúdii CLASS (Celecoxib Long-term Arthritis Safety Study), ktorá prebiehala od septembra 1998 do marca 2000. Štúdia bola financovaná výrobcom samotného liečiva a porovnávala celekoxib 800 mg/deň s ibuprofénom 2400 mg/deň a diklofenakom 150 mg/deň u pacientov s osteoartrózou alebo reumatoidnou artritídou. Aj napriek výskytu komplikácií horného gastrointestinálneho traktu (krvácanie, perforácia alebo obštrukcia) počas prvých 6 mesiacov liečby sa dospelo k záveru, že celekoxib je spojený s nižším výskytom symptomatických vredov v porovnaní s tradičnými NSA17). Táto štúdia bola zložená z dvoch podštúdií, ktoré sa líšili v dizajne, čase trvania, analýzach a v konečnom dôsledku aj vo výsledkoch, čo vnieslo do celkového obrazu chaos. Na nedostatky a limity štúdie však bolo poukázané až o niekoľko rokov. Po preskúmaní jednotlivých analýz sa zistilo nedostatočné interpretovanie výsledkov súvisiacich s vredmi. Nešlo totiž len o výskyt symptomatických vredov, ako sa primárne uvádzalo, ale aj o závažnejšie vredové komplikácie po 12–15 mesiaci sledovania18). V tom čase však už bol na trhu koxib druhej generácie, a to valdekoxib, ktorý bol indikovaný rovnako na liečbu reumatoidnej atritídy alebo osteoartrózy. Lieky s liečivom etorikoxib a lumirakoxib čakali na schválenie, a preto sa obdobie do roku 2004 pokladal v rámci liečby bolesti za éru koxibov.
Štúdia VIGOR (Vioxx Gastrointestinal Outcomes Research) bola rovnako vplyvná na predaj koxibov ako štúdia CLASS a v priebehu roku 1999 boli do nej zapojení pacienti z 22 krajín. Táto štúdia porovnávala liečivo rofekoxib 50 mg/deň s naproxénom 500 mg/dvakrát denne a jej hlavným cieľom bolo dokázať bezpečnosť užívania lieku Vioxx (rofekoxib) na tráviaci trakt pacientov. Štúdia vo svojich výsledkoch dokázala znížený výskyt žalúdočných lézií pri dlhodobom užívaní rofekoxibu v porovnaní s naproxénom18). Ubehlo 6 mesiacov od začiatku komerčnej dostupnosti lieku, keď bezpečnostná rada FDA vyzvala farmaceutickú firmu o prešetrenie bezpečnosti lieku Vioxx so zameraním sa na kardiovaskulárne komplikácie. V tom čase malo 79 pacientov zo 4000, ktorí užívali Vioxx, vážne problémy so srdcom alebo zomreli. V bezpečnostných štúdiách sa naďalej pokračovalo a o mesiac neskôr bol počet srdcových príhod dvakrát častejší u pacientov, ktorí užívali rofekoxib v porovnaní s pacientmi užívajúci naproxén. Rok po schválení lieku Vioxx publikovala firma Merck výsledky štúdie VIGOR. Údaje zahŕňali 17 prípadov pacientov s infarktom myokardu, ktorý užívali rofekoxib, pričom skutočný počet bol 20. V článku tiež neboli spomenuté mnohé ďalšie kardiovaskulárne nežiaduce účinky (zvýšený krvný tlak, edémy)19). Početné epidemiologické štúdie od januára 2002 až do augusta 2004 odhalili veľké množstvo prípadov s kardiovaskulárnymi ťažkosťami po užívaní lieku Vioxx, a preto v septembri 2004 firma Merck stiahla dobrovoľne svoj liek z trhu na celom svete20, 21). Stiahnutie lieku bolo definitívne rozhodnuté po zverejnení výsledkov rozsiahlej štúdie APPROVE (Adenomatous Polyp Prevention on Vioxx), ktorá preukázala zvýšené riziko závažných trombotických príhod u pacientov s črevnými polypmi. Pacienti, ktorí užívali kompromitujúci liek viac ako 18 mesiacov, mali väčšie riziko infarktu myokardu alebo mozgovej príhody22). Zistilo sa tiež, že inhibítory COX-2 v mnohých prípadoch zvyšujú krvný tlak a u pacientov zo štúdie VIGOR, ktorí užívali rofekoxib, sa vyvinula hypertenzia. K zvýšeniu došlo pri systolickom tlaku o 4,6 mmHg a diastolického o 1,7 mmHg v porovnaní s krvným tlakom, ktorý bol meraný pacientom užívajúci naproxén. Zvýšenie krvného tlaku je spôsobené zmenami v dráhe renín-angiotenzín, zmenami v zadržiavaní sodíka a vody v obličkách, inhibíciou vazodilatačných prostaglandínov a produkciou vazokonstrikčných faktorov, vrátane kyseliny arachidónovej. Ďalšími kardiovaskulárnymi príhodami, ktoré sa počas štúdií vyskytli, boli edém, vaskulitída alebo celkové zhoršenie zdravotného stavu pacientov so zlyhávajúcim srdcom. Dnes už je známe, že neselektívne nesteroidné antiflogistiká zvyšujú riziko srdcového zlyhávania. Podľa štúdie z roku 1999 sa zistilo, že pacienti so srdcovým zlyhávaním, ktorí užívali kombináciu NSA a diuretík, mali dvojnásobné riziko hospitalizácie v porovnaní s pacientmi užívajúci len diuretiká23).
V čase, keď bol liek Vioxx stiahnutý z trhu, tento liek užilo približne 20 miliónov Američanov. Neskôr časopis Lancet publikoval, že 88 000 Američanov dostalo infarkt po užívaní lieku a 38 000 z nich zomrelo24). Čo sa týka Európskej agentúry pre lieky, už v roku 2003 rozhodla o preskúmaní všetkých dostupných údajov o kardiovaskulárnej bezpečnosti pre všetky licencované inhibítory COX-2 (celekoxib, etorikoxib, parekoxib, rofekoxib a valdekoxib). Na základe všetkých informácií, ktoré boli v tom čase dostupné, vedecký výbor EMA rozhodol, že celkové prínosy inhibítorov COX-2 prevažujú nad rizikom vedľajších účinkov pre cieľovú skupinu pacientov. Bolo však potrebné striktne upozorniť na možné vedľajšie účinky zasahujúce žalúdok, črevá, srdce a kožu. Obzvlášť veľká opatrnosť mala byť pri predpisovaní liekov skupine pacientov, ktorý mali v anamnéze gastrointestinálne alebo kardiovaskulárne problémy, a všetky licencované lieky mali mať revidovaný súhrn charakteristických vlastností lieku (SPC)25). Odhaduje sa, že spoločnosť Merck čelila viac ako 27 000 žalobám, ktoré súviseli s kardiovaskulárnymi rizikami spojených s užívaním lieku Vioxx. Dobrovoľné stiahnutie lieku a urovnanie súdnych sporov firmu stálo viac ako 4,5 miliardy USD. Rovnako ako firma Merck aj firma Pfizer čelila mnohým súdnym sporom, ktoré súviseli s nežiadúcimi účinkami liekov Celebrex (celekoxib) a Brextra (valdekoxib). Lieky Arcoxia (etorikoxib) a Prexige (lumirakoxib) boli krátko po svojej registrácii stiahnuté z trhu26). Veľmi sľubným liečivom bol práve lumirakoxib, ktorý sledovala štúdia TARGET (Therapeutic Arthritis Research and Gastrointestinal Event Trial). Štúdia sa zakladala na hypotéze, že účinnosť a bezpečnosť lumirakoxibu je v porovnaní s tradičnými NSA lepšia. Vedci vychádzali z jeho štrukturálnej odlišnosti oproti iným inhibítorom COX-2, ktorá zaručuje jeho vyššiu selektivitu a pomerne krátky plazmatický polčas. Štúdia priniesla výsledky, ktoré poukázali na znížený výskyt vredových komplikácií až o 80 % u pacientov užívajúci lumirakoxib v porovnaní s pacientmi, ktorí užívali ibuprofén alebo naproxén. Štúdia dokonca nezaznamenala výrazný nárast kardiovaskulárnych príhod u pacientov, ktorí užívali lumirakoxib. K jeho schváleniu došlo v roku 2003 a doteraz sa predáva v Mexiku, Ekvádore alebo Dominikánskej republike. V roku 2006 síce získal liek Prexige marketingové schválenie Európskej únie, no po častých pečeňových zlyhaniach, ktoré viedli k transplantácii alebo úmrtiu, začali európske štáty po roku 2007 liek postupne sťahovať zo svojich trhov27).
Momentálne je dostupnosť koxibov v jednotlivých krajinách sveta rôzna. Niektoré krajiny majú predaj pozastavený, v iných je možné predpisovať lieky s obmedzením. Na Slovensku je stále možné predpísať lieky s obsahom celekoxibu v dávkach 100 mg alebo 200 mg. Predpisovať lieky môže len reumatológ, ortopéd alebo neurológ na určitú diagnózu a na čo najkratší čas. Kvôli potenciálnym gastrointestinálnym, kardiovaskulárnym a renálnym rizikám je nutné pacientov sledovať a v prípade výskytu akýchkoľvek komplikácií je nutné liečbu ukončiť.
Od kontroverzného obdobia koxibov už ubehlo takmer 20 rokov a počas tejto doby sa veda neustále zaoberá otázkou ich bezpečnosti. Klinické a bezpečnostné štúdie ukončené po roku 2017 prinášajú pomerne sľubné objavy, pre využitie koxibov na liečbu vybraných ochorení, pre konkrétnu skupinu pacientov. Jedna z najväčších prospektívnych štúdií bola štúdia PRECISION, ktorej sa zúčastnilo 24 081 pacientov s reumatoidnou artritídou alebo osteoartrózou. Pacienti boli rozdelení do troch skupín, pričom prvá skupina užívala celekoxib v dávke 100–200 mg dvakrát denne, druhá skupina ibuprofén 600–800 mg trikrát denne a tretia skupina naproxén 375–500 mg na zmiernenie príznakov. Počas priemernej doby sledovania 34,1 mesiacov preukázal celekoxib porovnateľnú kardiovaskulárnu bezpečnosť ako ibuprofén či naproxén a dokonca pacienti užívajúci celekoxib mali menej gastrointestinálnych ťažkostí28). Otázkou však stále ostáva, pre ktorých pacientov je benefit celekoxibu vyšší. Použitie koxibov pri klinických ťažkostiach naráža na ešte jeden dôležitý aspekt, a tým je pravidelné užívanie kyseliny acetylsalicylovej. Cieľom pokračovacej štúdie PRECISION Aspirin bolo potvrdiť alebo vyvrátiť obavy, že by súčasným užívaním koxibov a kyseliny acetylsalicylovej dochádzalo k potláčaniu antitrombotickej účinnosti. Výsledky štúdie preukázali, že pacienti užívajúci celekoxib, ale bez kyseliny acetylsalicylovej, mali lepšie výsledky bezpečnosti. Celekoxib sa spájal s menším výskytom kardiovaskulárnych, gastrointestinálnych a renálnych príhod. Z týchto výsledkov vyplynulo veľa dôležitých informácií. Kyselina acetylsalicylová sa môže bezpečne užívať ako so neselektívnymi, tak so selektívnymi NSA, pretože kardiovaskulárny risk je v tomto prípade u všetkých NSA ekvivalentný. Celekoxib má výhody v jeho nižšej gastrointestinálnej toxicite. U pacientov bez indikácie na každodenné užívanie kyseliny acetylsalicylovej má celekoxib lepšiu celkovú a kardiovaskulárnu bezpečnosť28, 29).
Štúdií, pri ktorých sa sleduje kardiovaskulárny bezpečnostný profil koxibov, je za posledné roky niekoľko. Mnohí vedci sa pokúšajú navrhnúť nové liečivo, ktoré by v kombinácii s inhibítorom COX-2 nespôsobovalo nežiaduce účinky na kardiovaskulárny systém. Jedným z týchto liekov je liek CONSENSI schválený FDA v máji 2018 na liečbu hypertenzie a osteoartrózy. Obsahuje amlodipín, antihypertenzívny blokátor kalciového kanála a celekoxib, selektívny inhibítor COX-2. Schválený bol na základe štúdie z roku 201630), ktorá priniesla výsledky o priaznivých renovaskulárnych, antiflogistických a antihypertenzívnych účinkoch lieku bez rizika kardiovaskulárnych príhod, ako sú mŕtvica a infarkt myokardu. Kombinovaný prípravok má v súhrnných vlastnostiach spomínanú kardiovaskulárnu bezpečnosť, resp. poukazuje na opatrnosť užívania tohto lieku u pacientov s kardiovaskulárnymi ťažkosťami. Na základe dostupných údajov treba ešte vykonať viac klinických štúdií, ktoré by benefit lieku uprednostnili pred jeho rizikami.
Niektorý vedci sa zamýšľajú nad súčasným užívaním celecoxibu a kvercetínu ako prírodného aktivátora a kofaktora COX-2. Predpokladajú, že by kardioprotektívny účinok kvercetínu mohol byť užitočný pri dlhodobom užívaní koxibov u pacientov s reumatoidnými ochoreniami, ktorým zároveň hrozia kardiovaskulárne ťažkosti31).
Záver
Od zlatej éry koxibov onedlho uplynú dve desaťročia a je možné, že ďalšie roky prinesú nové nápady a myšlienky na používanie koxibov v klinickej praxi. Tak, ako bol výskyt nežiaducich účinkov koxibov pre farmakológov veľkým sklamaním, tak sa možným synergickým podávaním liečiv znova otvoria možnosti využitia selektívnych inhibítorov COX-2 v klinickej praxi bez obmedzení, indikačných a preskripčných podmienok a bez kontraindikácií.
Stret záujmov: žiadny.
Došlo 1. februára 2023 / Prijato 10. marca 2023
S. Valášková1, J. Kyselovič1, 2
1V. interná klinika LF UK a Univerzitná nemocnica Bratislava
Nemocnica Ružinov Bratislava, Slovenská republika
2Katedra farmakológie a toxikológie, Univerzita veterinárskeho lekárstva a farmácie Košice,
Slovenská republika
doc. PharmDr. Andrea Gažová, PhD.
Ústav farmakológie a klinickej farmakológie LF UK
Sasinkova 4, 824 42 Bratislava, Slovenská republika
e-mail: andrea.gazova@fmed.uniba.sk
Sources
1. Ghlichloo I., Gerriets V. Nonsteroidal Anti-inflammatory Drugs (NSAIDs). StatPearls Publishing 2022.
2. Ahn G.Y., Bae S.-C. Strategies for the safe use of non-steroidal anti-inflammatory drugs. J. Korean. Med. Assoc. 2018; 61, 367–375. https://doi.org/10.5124/jkma.2018.61.6.367
3. Bindu S., Mazumder S., Bandyopadhyay U. Non-steroidal anti-inflammatory drugs (NSAIDs) and organ damage: A current perspective. Biochem. Pharmacol. 2020; 180, 114147. https://doi.org/10.1016/j.bcp.2020.114147
4. Fortune business insights. Non-steroidal Anti-Inflammatory Drugs [NSAIDs] Market Size By 2027 n.d. https://www.fortunebusinessinsights.com/non-steroidal--anti-inflammatory-drugs-nsaids-market-102823 (30. 6. 2022).
5. Kasciuškevičiūtė S., Gumbrevičius G., Vendzelytė A., Ščiupokas A., Petrikonis K., Kaduševičius E. Impact of the World Health Organization Pain Treatment Guidelines and the European Medicines Agency Safety Recommendations on Nonsteroidal Anti-Inflammatory Drug Use in Lithuania: An Observational Study. Medicina 2018; 54, 30. https://doi.org/10.3390/medicina540200306. OECD. Health at a Glance 2021 - OECD n.d. https://www.oecd.org/health/health-at-a-glance/ (30. 6. 2022).
7. NCZI. Zdravotnícka ročenka Slovenskej republiky 2021. Spotreba_liekov_a_zdravotnickych_pomocok_v_SR_2021_Sprava_k_publikovanym_vystupom.pdf (nczisk.sk)
8. Gažová A., Kyselovič J. Známe a neznáme fakty o diklofenaku. Via practica 2017; 14(6), 311–312. www.solen.sk
9. Lukáč J., Lukáčová O. Účinnosť a bezpečnosť koxibov. Ambulantná terapia 2007; 5(3–4), 192–198.
10. Vane J. R. Inhibition of prostaglandin synthesis as a mechanism of action for aspirin-like drugs. Nat. New. Biol. 1971; 231, 232–235. https://doi.org/10.1038/newbio231232a0
11. Rouzer C. A., Marnett L. J. Cyclooxygenases: structural and functional insights. J. Lipid Res. 2009; 50, S29–34. https://doi.org/10.1194/jlr.R800042-JLR200
12. Domper Arnal M.-J., Hijos-Mallada G., Lanas A. Gastrointestinal and cardiovascular adverse events associated with NSAIDs. Expert Opin. Drug Saf. 2022; 21, 373–384. https://doi.org/10.1080/14740338.2021.1965988
13. Ju Z., Li M., Xu J., Howell D. C., Li Z., Chen F.-E. Recent development on COX-2 inhibitors as promising antiinflammatory agents: The past 10 years. Acta Pharm. Sin. B. 2022; 12, 2790–2807. https://doi.org/10.1016/j.apsb.2022.01.002
14. Ahmadi M., Bekeschus S., Weltmann K.-D., von Woedtke T., Wende K. Non-steroidal anti-inflammatory drugs: recent advances in the use of synthetic COX-2 inhibitors. RSC Med. Chem. 2022; 13, 471–496. https://doi.org/10.1039/D1MD00280E
15. Szeto C.-C., Sugano K., Wang J.-G., Fujimoto K., Whittle S., Modi G. K., Chen C. H., Park J. B., Tam L. S., Vareesangthip K., Tsoi K. K. F., Chan F. K. L. Non-steroidal anti-inflammatory drug (NSAID) therapy in patients with hypertension, cardiovascular, renal or gastrointestinal comorbidities: joint APAGE/APLAR/APSDE/APSH/APSN/PoA recommendations. Gut 2020; 69, 617–29. https://doi.org/10.1136/gutjnl-2019-319300
16. Masferrer J., Zweifel B., Manning P., Hauser S., Leahy K., Smith W., Isakson P. C., Seibert K. Selective inhibition of inducible cyclooxygenase 2 in vivo is antiinflammatory and nonulcerogenic. Proc. Natl. Acad. Sci. U.S.A. 1994; 91, 3228–3232. https://doi.org/10.1073/pnas.91.8.3228
17. Silverstein F. E., Faich G., Goldstein J. L., Simon L. S., Pincus T., Whelton A., Makuch R., Eisen G., Agrawal N. M., Stenson W. F., Burr A. M., Zhao W. W., Kent J. D., Lefkowith J. B., Verburg K. M., Geis G. S. Gastrointestinal toxicity with celecoxib vs nonsteroidal anti-inflammatory drugs for osteoarthritis and rheumatoid arthritis: the CLASS study: A randomized controlled trial. Celecoxib Long-term Arthritis Safety Study. JAMA 2000; 284, 1247–1255. https://doi.org/10.1001/jama.284.10.1247
18. Malhotra S., Shafiq N., Pandhi P. COX-2 Inhibitors: A CLASS Act or Just VIGORously Promoted. MedGenMed2004; 6, 6.
19. MERCK & CO.,INC. VIOXX®, Warning: Risk of serious cardiovascular and gastrointestinal events. www.accessdata.fda.gov, 2016.
20. Lenzer J. FDA is incapable of protecting US “against another Vioxx.” BMJ 2004; 329, 1253.
21. Research C for DE and. Vioxx (rofecoxib) Questions and Answers. FDA 2018.
22. Sibbald B. Rofecoxib (Vioxx) voluntarily withdrawn from market. CMAJ 2004; 171, 1027–1028. https://doi.org/10.1503/cmaj.1041606
23. Heerdink E. R., Leufkens H. G., Herings R. M., Ottervanger J. P., Stricker B. H., Bakker A. NSAIDs associated with increased risk of congestive heart failure in elderly patients taking diuretics. Arch. Intern. Med. 1998; 158, 1108–1112. https://doi.org/10.1001/archinte.158.10.1108
24. Horton R. Vioxx, the implosion of Merck, and aftershocks at the FDA. The Lancet 2004; 364, 1995–1996. https://doi.org/10.1016/S0140-6736(04)17523-5
25. EMA.www.ema.europa.eu/en/documents/referral/rofecoxib-article-31-referral-annex-i-ii-iii_en.pdf
26. El-Malah A. A., Gineinah M. M., Deb P. K., Khayyat A. N., Bansal M., Venugopala K. N., Aljahdali A. S. Selective COX-2 Inhibitors: Road from Success to Controversy and the Quest for Repurposing. Pharmaceuticals 2022; 15, 827. https://doi.org/10.3390/ph15070827
27. Schnitzer T. J., Burmester G. R., Mysler E., Hochberg M. C., Doherty M., Ehrsam E., Gitton X., Krammer G., Mellein B., Matchaba P., Gimona A., Hawkey C. J.; TARGET Study Group. Comparison of lumiracoxib with naproxen and ibuprofen in the Therapeutic Arthritis Research and Gastrointestinal Event Trial (TARGET), reduction in ulcer complications: randomised controlled trial. Lancet 2004; 364, 665–674. https://doi.org/10.1016/S0140-6736(04)16893-1
28. Reed G. W., Nissen S. E. NSAID choice: lessons from PRECISION. Aging (Albany NY) 2019; 11, 2181–2182. https://doi.org/10.18632/aging.101930
29. Inova Health Care Services. NSAIDs vs. Coxibs in the Presence of Aspirin: Effects on Platelet Function, Endothelial Function, and Biomarkers of Inflammation in Subjects With Rheumatoid Arthritis and Increased Cardiovascular Risk or Cardiovascular Disease. clinicaltrials.gov; 2018.
30. Kitov Pharma Ltd. A Prospective Randomized Placebo Controlled Study to Evaluate the Effect of Celecoxib on the Efficacy and Safety of Amlodipine on Renal and Vascular Function in Subjects With Existing Hypertension Requiring Antihypertensive Therapy. clinicaltrials.gov; 2019.
31. Chen W., Zhong Y., Feng N., Guo Z., Wang S., Xing D. New horizons in the roles and associations of COX-2 and novel natural inhibitors in cardiovascular diseases. Mol. Med. 2021; 27, 123. https://doi.org/10.1186/s10020-021-00358-4
Labels
Pharmacy Clinical pharmacology
Article was published inCzech and Slovak Pharmacy

2023 Issue 2-
All articles in this issue
- Barevnost a obsah některých kovů v medu
- Selektívne inhibítory cyklooxygenázy 2 – ich minulosť, prítomnosť a budúcnosť
- Mezinárodní spolupráce tří uznávaných Farmaceutických fakult – sdílení výzkumných zkušeností a vzdělávacích technik v oblasti drug-designu
- NOVÉ KNIHY
- Role farmaceutické péče v léčebných schématech ve veřejné lékárně
- Marketingový výzkum kombinovaných léčivých přípravků pro léčbu kardiovaskulárních onemocnění
- Antimikrobiální vlastnosti nového kombinovaného dentálního gelu
- Czech and Slovak Pharmacy
- Journal archive
- Current issue
- Online only
- About the journal
Most read in this issue- Selektívne inhibítory cyklooxygenázy 2 – ich minulosť, prítomnosť a budúcnosť
- Role farmaceutické péče v léčebných schématech ve veřejné lékárně
- Marketingový výzkum kombinovaných léčivých přípravků pro léčbu kardiovaskulárních onemocnění
- Barevnost a obsah některých kovů v medu
Login#ADS_BOTTOM_SCRIPTS#Forgotten passwordEnter the email address that you registered with. We will send you instructions on how to set a new password.
- Career

