-
Medical journals
- Career
Barevnost a obsah některých kovů v medu
Authors: Jan Šubert; Jozef Kolář; Jozef Čižmárik
Published in: Čes. slov. Farm., 2023; 72, 59-62
Category: Review Articles
doi: https://doi.org/https://doi.org/10.5817/CSF2023-2-59Overview
Příspěvek upozorňuje na korelace mezi výsledky instrumentálního měření barevnosti a obsahem některých kovů v medech. Dostatečně těsné korelace mohou vést k vývoji postupů pro rychlé stanovení obsahu těchto kovů v medu měřením barevnosti bez nutnosti náročnější úpravy vzorků.
Klíčová slova:
korelace – kovy – barevnost
Úvod
Včelí med má řadu vlastností prospěšných lidskému zdraví1–4). Mimo četné organické biologicky aktivní látky obsahuje také látky anorganické, z nichž významné jsou zejména kovy. Medy jsou prakticky vždy více, či méně barevné. Řada publikovaných prací, např.5–10), zmiňuje souvislost barvy medů s obsahem minerálních látek, resp. kovů, které se v medech mohou vyskytovat ve formě jednoduchých iontů7) i komplexů s anorganickými7) a organickými látkami7, 10–13), např. s polyfenoly anebo flavonoidy10–12) či flavonoly13). Barevné jsou v řadě případů i hydráty iontů kovů14). Záměrem našeho příspěvku je poukázat na těsnější korelace hodnot ukazatelů barevnosti medů získaných instrumentálním měřením jejich barevnosti s obsahem kovů v medech využitelné k vývoji nových postupů pro stanovení obsahu příslušných kovů v medech. Charakteristiky barevnosti medů používané v této souvislosti jsou stejné jako při sledování vztahů mezi barevností medů a jejich antioxidační aktivitou15) nebo mezi barevností medů a obsahem některých biologicky aktivních organických látek16) s tím, že v publikovaných pracích popisujících korelace ukazatelů barevnosti s obsahem kovů lze nalézt jako jednu z proměnných také optickou hustotu17, 18) nebo index žlutosti19).
Korelace výsledků měření barevnosti a obsahu některých kovů v medech
Popis barevnosti medů parametry barevných prostorů CIE20) vedl k těsnějším korelacím s obsahem kovů v medech v případech uvedených v tabulce 1.
Table 1. Těsnější korelace mezi parametry získanými měřením barevnosti medů v barevných prostorech CIE a obsahem některých kovů v medech 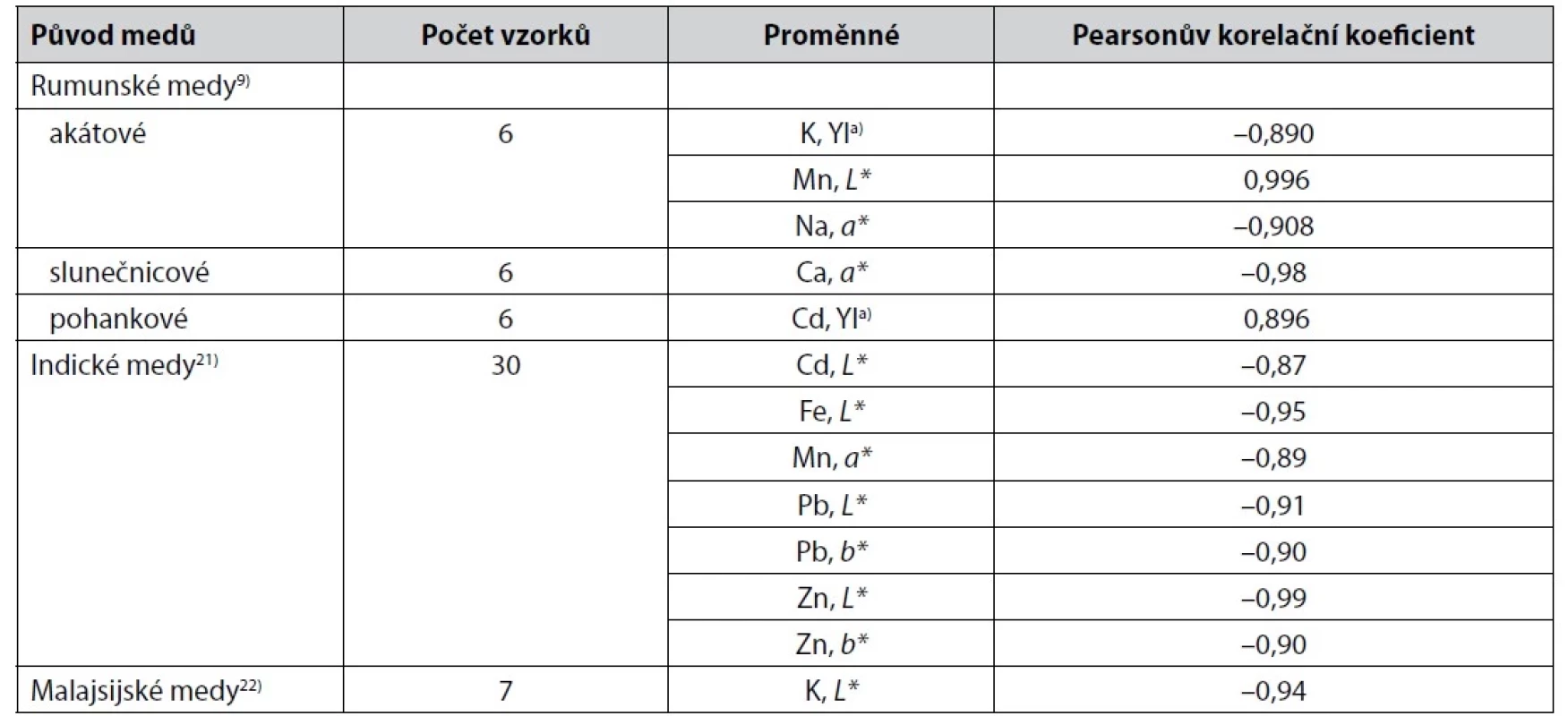
a) Index žlutosti Ve studii19) je u rumunských květových medů uvedena řada dalších těsnějších korelací popsaných hodnotami Pearsonova korelačního koeficientu. U akátových medů k nim patří korelace obsahu Ca s hodnotami souřadnice L* (0,794), obsahu Cd s hodnotami souřadnice a* (–0,823) nebo s hodnotami měrného úhlu barevného tónu v barevném prostoru CIELCH hab (0,753), dále korelace obsahu K a Na s hodnotami hab (0,803 a 0,834). U slunečnicových medů jde o korelace mezi hodnotami souřadnice L* a obsahem Cu (0,82), mezi hodnotami chroma Cab* a obsahem Ca a Mn (–0,71, 0,82) nebo mezi obsahem Zn a hodnotami souřadnice a* (0,78). U pohankových medů pak korelace hodnot L*, b* nebo Cab* a obsahu Zn s hodnotami korelačního koeficientu 0,819, 0,825 a 0,825. U lučních medů je zajímavá korelace obsahu Mg s hodnotami souřadnice a* nebo hodnotou hab (0,852, 0,834), u maliníkových medů korelace hodnot souřadnice a* nebo souřadnice b* s obsahem Ni (0,804, 0,798)19). U indických medů21) byly popsány další těsnější korelace (Pearsonův korelační koeficient) obsahu Cd se souřadnicí b* (–0,82), Cu s L* (0,80), Fe a Mn s b* (–0,81 a –0,84), Mn s L* (–0,82), Pb a Zn s a * (–0,85 a –0,83). Těsnější korelace parametrů barevného prostoru CIELAB a obsahu některých kovů ve španělských medech počítané z většího objemu vzorků medů jsou popsány ve studii6).
V rámci měření barevnosti medů jako jejich absorbance při určitých vlnových délkách ve viditelné spektrální oblasti vedl k těsnějším korelacím s obsahem kovů v medech častěji než jiné možnosti rozdíl absorbance při 450 nm a 720 nm (tabulka 2 a text pod ní).
Table 2. Těsnější korelace mezi hodnotami rozdílu absorbance vodných roztoků medů při 450 a 720 nm s obsahem některých kovů v medech 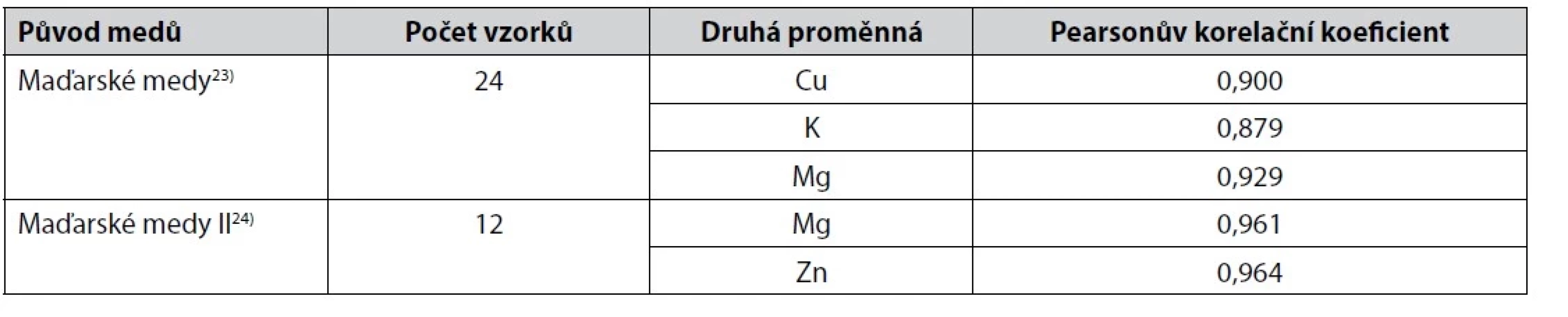
Z méně těsných korelací hodnot rozdílu absorbance roztoků medů při 450 nm a 720 nm s obsahem kovů lze u maďarských medů23) zmínit korelace s obsahem Ca, Fe a Na (korelační koeficient 0,845, 0,841 a 0,713). U maďarských medů II24) korelace s Ca a Fe (korelační koeficient 0,842 a 0,823) a u jiných maďarských medů25) korelace s Mg a Mn s korelačním koeficientem 0,771 a 0,769 (vždy šlo o korelační koeficient Pearsonův).
U polských medů byla těsnost korelace obsahu Fe a obsahu Fe v hydrofobní frakci medů s jejich optickou hustotou při 420 nm popsána Spearmanovým korelačním koeficientem 0,883 a 0,90018).
Absorbance vodných roztoků medů měřená při 635 nm bývá obvykle přepočítávána do stupnice barevnosti medů podle Pfunda26). Ze vztahů takto získaných hodnot a obsahu kovů v medech je třeba zmínit korelaci s obsahem Fe v marockých medech (Pearsonův korelační koeficient 0,705)27), s obsahem K a Mg v malajsijských medech (Spearmanův korelační koeficient 0,781 a 0,779)28) a korelaci s obsahem Mg v rumunských medech (Pearsonův korelační koeficient 0,84)29). Hodnoty Pearsonova korelačního koeficientu s použitím hodnot Pfund (mm) získaných jiným postupem ukazují, že i s tato proměnná může vést k těsnějším korelacím. U argentinských medů byl Pearsonův korelační koeficient s obsahem K 0,96430), u indických medů byl z 30 vzorků Pearsonův korelační koeficient s obsahem Cd, Fe, Pb a Zn 0,87, 0,99, 0,89 a 1,0021).
Těsné korelace mezi výsledky instrumentálního měření barevnosti a výsledky stanovení obsahu kovů v medech nejsou tak časté jako těsné korelace s výsledky stanovení obsahu biologicky aktivních látek16) a stejně jako u nich určují barvu medu i další faktory, včetně podmínek jeho uchovávání31). Přesto lze za předpokladu adekvátního rozpracování problematiky zvážit jejich využití k vývoji alternativních postupů pro rychlé stanovení obsahu některých kovů v medech, včetně kovů potenciálně toxických32) měřením barevnosti medů bez nutnosti náročnější úpravy vzorků. Zajímavé poznatky by mohlo přinést využití parametrů barevného prostoru RGB20), který byl v této souvislosti dosud opomíjen.
Střet zájmů: žádný.
Došlo 9. ledna 2023 / Přijato 9. března 2023
J. Šubert
Dušínova 1512/42, 664 34 Kuřim
doc. RNDr. Jozef Kolář, CSc.
Ústav aplikované farmacie
Farmaceutická fakulta, Masarykova univerzita
Palackého třída 1946/1, 612 00 Brno
e-mail: kolarj@pharm.muni.cz
J. Čižmárik
Katedra farmaceutickej chémie FaF
Univerzita Komenského v Bratislave, Slovenská republika
Sources
1. Rana S., Mishra M., Yadav D., Subramani S. K., Katare C., Prasad, G. B. K. S. Medicinal uses of honey: A review on its benefits to human health. Prog. Nutr. 2018; 20(Suppl.1), 5–14. doi: 10.23751/pn.v20i1-S.6394 (20. 9. 2021).
2. Gündoğdu E., Çakmakçı S., Şat İ. G. An overview of honey: its composition, nutritional and functional properties. J. Food Sci. Eng. 2019; 9, 10–14. doi:10.17265/2159-5828/2019.01.003 (27. 11. 2022).
3. Lakhote M. S. M., Sawane A. P. Review on physico-chemical nutritional and medical status of honey. Int. J. Res. Biosci. Agric. Technol. 2022; II(X), 163–179. https://ijrbat.in/upload_papers/01062022034617E24_R23%20 Lakhote.pdf (3.1.2023).
4. Shah K., Chhabra S., Chauhan N. S. Chemistry and pharmacology of honey. Pharmacognosy Res. 2022; 14, 356–359. https://www.phcogres.com/article/2022/14/4/105530pres14453 (29. 11. 2022).
5. Schuette H. A., Remy K. Degree of pigmentation and its probable relationship to the mineral constituents of honey. J. Am. Chem. Soc. 1932; 54, 2909–2913. https://doi.org/10.1021/ja01346a032 (4. 12. 2022).
6. González-Miret M. L., Terrab A., Hernanz D., Fernández-Recamales M. Á., Heredia F. J. Multivariate correlation between color and mineral composition of honeys and by their botanical origin. J. Agric. Food Chem. 2005; 53, 2574–2580. https://doi.org/10.1021/jf048207p (4. 12. 2022).
7. Pohl P., Sergiel I., Stecka H. Determination and fractionation of metals in honey. Crit. Rev. Anal. Chem. 2009; 39, 276–288. https://doi.org/10.1080/10408340903001250 (4. 12. 2022).
8. Solayman M., Islam M. A., Paul S., Ali Y., Khalil M. I., Alam N., Gan S. H. Physicochemical properties, minerals, trace elements, and heavy metals in honey of different origins: A comprehensive review. Compr. Rev. Food Sci. Food Saf. 2016; 15, 219–233. https://researchmgt.monash.edu/ws/portalfiles/portal/348012280/345788507_oa.pdf (4. 12. 2022).
9. Machado De-Melo A. A., Almeida-Muradian L. B. D., Sancho M. T., Pascual-Maté A. Composition and properties of Apis mellifera honey: A review. J. Apic. Res. 2018; 57(1), 5–37. http://dx.doi.org/10.1080/00218839.2017.1338444 (4. 12. 2022).
10. Pauliuc D., Dranca F., Oroian M. Antioxidant activity, total phenolic content, individual phenolics and physicochemical parameters suitability for Romanian honey authentication. Foods 2020; 9(3), 306. https://doi.org/10.3390/foods9030306 (11. 12. 2022).
11. Pohl P., Sergiel I. Direct determination of the total concentrations of copper, iron and manganese and their fractionation forms in freshly ripened honeys by means of flame atomic absorption spectrometry. Microchim. Acta 2010; 168, 9–15. https://doi.org/10.1007/s00604-009-0266-8 (11. 12. 2022).
12. Brudzynski K., Sjaarda C. P. Colloidal structure of honey and its influence on antibacterial activity. Compr. Rev. Food Sci. Food Saf. 2021; 20, 2063–2080. https://doi.org/10.1111/1541-4337.12720 (11. 12. 2022).
13. Miguel M. G., Faleiro L., Antunes M. D., Aazza S., Duarte J., Silvério A. R. Antimicrobial, antiviral and antioxidant activities of “água-mel” from Portugal. Food Chem. Toxicol. 2013; 56, 136–144. https://doi.org/10.1016/j.fct.2013.02.007 (18. 12. 2022).
14. Persson I. Hydrated metal ions in aqueous solution: How regular are their structures? Pure Appl. Chem. 2010; 82, 1901–1917. https://doi.org/10.1351/PAC-CON-09-10-22 (20. 12. 2022).
15. Šubert J., Kolář J., Čižmárik J. Barevnost a antioxidační aktivita medů. Čes. slov. Farm. 2022; 71, 20–26.
16. Šubert J., Kolář J., Čižmárik J. Barevnost a obsah některých biologicky aktivních látek v medu. Čes. slov. Farm. 2022; 71, 127–134.
17. Townsend G. F. Optical density as a means of colour classification of honey. J. Apic. Res. 1969; 8(1), 29–36. https://doi.org/10.1080/00218839.1969.11100215 (16.12. 2022).
18. Pohl P., Stecka H., Greda K., Jamroz P. Determination of the hydrophobic fraction of Ca, Fe, Mg and Zn in dark color honeys using solid phase extraction and flame atomic absorption spectrometry. J. Braz. Chem. Soc. 2012; 23, 1098–1103. https://doi.org/10.1590/S0103-50532012000600014 (18. 12. 2022).
19. Scripca L. A., Amarei S. The influence of chemical contaminants on the physicochemical properties of unifloral and multifloral honey. Foods 2021; 10(5), 1039. https://doi.org/10.3390/foods10051039 (20. 12. 2022).
20. Ohta N., Robertson A. R. Colorimetry: Fundamentals and applications. Chichester: Wiley 2005.
21. Nayik G. A., Nanda V. Physico-chemical, enzymatic, mineral and colour characterization of three different varieties of honeys from Kashmir valley of India with a multivariate approach. Pol. J. Food Nutr. Sci. 2015; 65, 101–108. https://doi.org/10.1515/pjfns-2015-0022 (3. 1. 2023).
22. Ramly N. S., Sujanto I. S. R., Tang J. Y. H., Abd Ghani A., Alias N., Bakar M. F. A., Ngah N. Correlation between the color lightness and sweetness of stingless bee honey with its minerals content. J. Agrobiotechnology 2021; 12, 88–96. https://doi.org/10.37231/jab.2021.12.2.250 (26.12. 2022).
23. Bodó A., Radványi L., Kőszegi T., Csepregi R., Nagy D. U., Farkas Á., Kocsis M. Quality evaluation of light-and dark-colored Hungarian honeys, focusing on botanical origin, antioxidant capacity and mineral content. Molecules 2021; 26(9), 2825. https://doi.org/10.3390/molecules26092825 (30. 12. 2022).
24. Kocsis M., Bodó A., Kőszegi T., Csepregi R., Filep R., Hoffmann G., Farkas Á. Quality assessment of goldenrod, milkweed and multifloral honeys based on botanical origin, antioxidant capacity and mineral content. Int. J. Mol. Sci. 2022; 23(2), 769. https://doi.org/10.3390/ijms23020769 (3. 1. 2023).
25. Farkas Á., Balázs V. L., Kõszegi T., Csepregi R., Kerekes E., Horváth G., Szabó P., Gaál K., Kocsis M. Antibacterial and biofilm degradation effects of Hungarian honeys linked with botanical origin, antioxidant capacity and mineral content. Front. Nutr. 2022; 9, 953470. https://doi.org/10.3389%2Ffnut.2022.953470 (30.12.2022).
26. Pfund scale. https://www.sizes.com/units/pfund_scale.htm (28. 9. 2021).
27. El Menyiy N., Akdad M., Elamine Y., Lyoussi B. Microbiological quality, physicochemical properties, and antioxidant capacity of honey samples commercialized in the Moroccan Errachidia region. J. Food Qual. 2020; Article ID 7383018. https://doi.org/10.1155/2020/7383018 (26. 5. 2022).
28. Lim A. R., Sam L. M., Gobilik J., Ador K., Choon J. L. N., Majampan J., Benedick S. Physicochemical properties of honey from contract beekeepers, street vendors and branded honey in Sabah, Malaysia. Trop. Life Sci. Res. 2022; 33(3), 61. https://doi.org/10.21315/tlsr2022.33.3.5 (1. 1. 2023).
29. Pop I. M., Simeanu D., Cucu-Man S. M., Pui A., Albu A. Quality profile of several monofloral Romanian honeys. Agriculture 2023; 13(1), 75. https://doi.org/10.3390/agriculture13010075 (1. 1. 2023).
30. Balbarrey G. P., Andrada A., Echazarreta J. U. A. N., Iaconis D. I. E. G. O., Gallez L. Relationship between mineral content and color in honeys from two ecological regions in Argentina. In: Color in Food. Boca Raton: CRC Press 2012; 305–313.
31. Piotraszewska-Pająk A., Gliszczyńska-Świgło A. Directions of colour changes of nectar honeys depending on honey type and storage conditions. J. Apic. Sci. 2015; 59(2), 51–61. http://dx.doi.org/10.1515/jas-2015-0019 (3. 1. 2023).
32. Islam M. N., Khalil M. I., Islam M. A., Gan S. H. Toxic compounds in honey. J. Appl. Toxicol. 2014; 34, 733–742. https://doi.org/10.1002/jat.2952 (2. 1. 2023).
Labels
Pharmacy Clinical pharmacology
Article was published inCzech and Slovak Pharmacy

2023 Issue 2-
All articles in this issue
- Colour and content of some metals in honey
- Selective inhibitors of cyclooxygenase 2 – their past, present and future
- Mezinárodní spolupráce tří uznávaných Farmaceutických fakult – sdílení výzkumných zkušeností a vzdělávacích technik v oblasti drug-designu
- NOVÉ KNIHY
- Role of pharmaceutical care in therapeutic regimens within the community pharmacy
- Marketing research of combined drugs for treatment of cardiovascular diseases
- Antimicrobial properties of the new combined dental gel
- Czech and Slovak Pharmacy
- Journal archive
- Current issue
- Online only
- About the journal
Most read in this issue- Selective inhibitors of cyclooxygenase 2 – their past, present and future
- Role of pharmaceutical care in therapeutic regimens within the community pharmacy
- Marketing research of combined drugs for treatment of cardiovascular diseases
- Colour and content of some metals in honey
Login#ADS_BOTTOM_SCRIPTS#Forgotten passwordEnter the email address that you registered with. We will send you instructions on how to set a new password.
- Career

