-
Medical journals
- Career
Stanovení nabumetonu a kyseliny 6‑methoxy-2-naftyloctové v plazmě pomocí HPLC s UV a MS detekcí
: Lenka Nespěšná 1,2; Martin Štícha 1; Olga Matoušková 2; František Perlík 2; Ondřej Slanař 2
: Univerzita Karlova v Praze, Katedra organické a jaderné chemie, Přírodovědecká fakulta 1; Univerzita Karlova v Praze, Farmakologický ústav 1. lékařské fakulty 2
: Čes. slov. Farm., 2011; 60, 17-24
: Original Articles
Cílem práce bylo zavést a validovat analytickou metodu, která by umožnila detekovat koncentrace nabumetonu a kyseliny 6-methoxy-2-naftyloctové (6-MNA) po jednorázovém podání terapeutické dávky léčiva. Byly porovnány dvě metody stanovení pomocí HPLC s UV a hmotnostní detekcí. Při úpravě vzorku bylo optimálních výsledků dosaženo pomocí extrakce na pevné fázi (SPE). Výtěžnost se pohybovala okolo 84 % pro nabumeton a 86–90 % pro 6-MNA. HPLC separace analytů byla prováděna na reverzní C18 koloně. Limit UV detekce pro 6-MNA byl 50 nM, pro nabumeton 0,1 μM. Limit MS detekce pro 6-MNA činil 1 μM, pro nabumeton 0,5 μM. Přesnost metody pro stanovení nabumetonu se pohybovala v rozmezí 4,2–14,4 % při UV detekci a 4,6–8,5 % při MS detekci. Přesnost metody pro 6-MNA byla 2,4–12,5% při UV detekci a 2,1–9,4 % při MS detekci. Správnost metody pro stanovení nabumetonu se pohybovala v rozmezí 93,4–109,6 % při UV detekci a 86,2–107,9 % při MS detekci. Správnost metody pro 6-MNA byla 87,8–107,4 % při UV detekci a 86,3–106,4 % při MS detekci. Vhodnost metody byla ověřená na vzorcích pro stanovení farmakokinetiky léčiva u 24 zdravých dobrovolníků.
Klíčová slova:
nabumeton – farmakokinetika – kyselina 6-methoxy-2-naftyloctová – HPLC – LC/MSÚvod
Nabumeton (4-(6-methoxy-2-naftyl)-butan-2-on) patří mezi nesteroidní protizánětlivé látky vykazující preferenční inhibici cyklooxygenázy 2 1). Je používán v léčbě akutních i chronických symptomů revmatoidní artritidy a osteoartrózy 2, 3). Nabumeton je proléčivo, které nevykazuje protizánětlivou aktivitu, zatímco jeho hlavní metabolit kyselina 6-methoxy-2-naftyloctová (6-MNA) vykazuje farmakodynamické účinky antiflogistické, antipyretické a analgetické.
Přestože jsou klinické účinky nabumetonu dobře popsány, farmakokinetika nabumetonu dosud podrobněji popsána nebyla kvůli příliš nízkým koncentracím mateřské látky v krvi po podání terapeutických dávek. Z důvodu nízkých hladin nabumetonu v krvi je dosud publikována jen jedna metoda HPLC s fluorimetrickou detekcí nabumetonu pro použití v klinických studiích 4). Dobře je naopak popsána farmakokinetika 6-MNA díky dostupnosti dostatečně citlivých analytických technik 5–9).
Cílem naší práce bylo zavést a validovat analytickou metodu, která by umožnila detekovat koncentrace nabumetonu a 6-MNA po jednorázovém podání terapeutické dávky léčiva.
Pokusná část
Chemikálie
Nabumeton p.a. (Sigma-Aldrich), 6-MNA p.a. (MP Biomedicals), naproxen 98% (Sigma-Aldrich), methanol pro HPLC (Lach-Ner), aceton p.a. (Merck), propan-2-ol p.a. (Lach-Ner) kyselina o-fosforečná 85% (Merck), fosforečnan sodný terciární čistý (Lachema), acetonitril pro HPLC (Lach-Ner), kyselina trifluorooctová 99% (Sigma-Aldrich), deionizovaná voda (Millipore), dusík 4.6 (Linde Gas), helium 4.6 (Linde Gas).
Příprava vzorků
Vzorky krve jsme odebírali do zkumavek Vacutainer s přídavkem heparinu. Ihned po odebrání krve jsme oddělili plasmu centrifugací při 3000 g. Plasma byla poté uložena do -70 °C až do doby analýzy.
Pro předúpravu vzorků jsme zvolili techniku extrakce na tuhou fázi (SPE). K 0,5 ml vzorku jsme přidali 50 μl roztoku vnitřního standardu o koncentraci 0,1 mmol/l. Vzorek jsme naředili 0,5 ml fosfátového pufru pH 2 (10 mM), okyselili 50 μl 10% kyseliny fosforečné a řádně promíchali.
Takto připravený vzorek jsme aplikovali na kolonku Discovery® DSC-18 (1 ml, 100 mg), Supelco, USA předem promytou 2 ml methanolu a 2 ml fosfátového pufru pH 2 (10 mM). Všechny roztoky protekly rychlostí 1 ml.min-1.
Následně jsme kolonku prosávali vzduchem po dobu 5 minut. Zachycené látky byly vymyty 2 ml methanolu. Získaný extrakt jsme odpařili dosucha při 45 °C pod mírným proudem dusíku. Reziduum jsme poté rozpustili ve 250 μl mobilní fáze a 30 μl nastříkli do HPLC.
HPLC/UV/MS analýza
Pro analýzu extraktu jsme použili kapalinový chromatograf HP 1100 s UV DAD, Hewlett Packard, USA. Jako hmotnostní detektor jsme použili přístroj Esquire 3000, Bruker Daltonics, Německo.
Separace probíhala na koloně Supelcosil LC-18 15 cm × 4,6 mm 5 μm, Supelco, USA a jako mobilní fázi jsme použili směs acetonitrilu a 0,1% TFA v poměru 50 : 50 (v/v) o průtokové rychlosti 0,3 ml.min-1.
UV detekce proběhla při vlnové délce absorpčního maxima sledovaných látek λ = 230 nm. Současně jsme sledovali i hmotnostní detekci s chemickou ionizací za atmosférického tlaku v pozitivním módu. Podmínky APCI detekce byly následující: rozsah skenu 50–800 u, teplota sušícího plynu 250 °C, teplota iontového zdroje 400 °C, tlak plynu v zamlžovači 30 psi, průtok sušícího plynu (N2) 5 l.min-1, napětí na kapiláře 4 kV.
Vyhodnocení jsme provedli podle chromatogramu náležejícího nejintenzivnějšímu iontu ve spektru příslušné látky. Pro 6-MNA a nabumeton to byl ion m/z 171 a pro vnitřní standard – naproxen ion m/z 185.
Validace metody
Validaci metody jsme provedli na základě požadavků pro validaci bioanalytických metod 10). V souladu s těmito požadavky jsme stanovili mez stanovitelnosti (LLOQ), správnost, přesnost, výtěžnost, linearitu a selektivitu detekce.
Pro nabumeton i 6-MNA byly sestrojeny kalibrační křivky. Vzorky o známé koncentraci s přídavkem vnitřního standardu byly zpracovány SPE a dále analyzovány pomocí HPLC s UV a MS detekcí. Pro 6-MNA byly připraveny roztoky o těchto koncentracích: 0,2; 0,5; 1; 2; 5; 10; 20; 50 a 100 μmol/l pro nabumeton 0,2; 0,5; 1; 2; 5; 10 a 20 μmol/l.
Mez stanovitelnosti jsme určili jako nejnižší bod kalibrační křivky, kde pík analytu je indentifikovatelný, oddělený a reprodukovatelný s přesností 20 % a správností 80–120 %.
Součástí validace metody bylo také studium stability zásobních roztoků a vzorků. V případě zásobních roztoků analytů a vnitřního standardu jsme měřili koncentrace látek přítomných ve vzorku v závislosti na čase u skladovaných roztoků po nástřiku 5 μl zásobního roztoku. Detekční podmínky byly shodné s podmínkymi při měření extraktů z plazmy. První měření proběhlo ihned po jejich přípravě.
Dále jsme sledovali vliv zmrazení a roztátí vzorků v několika cyklech na koncentraci analytů ve vzorku. Vzorky o vysoké a nízké koncentraci analytů (množství dostatečné pro tři analýzy na koncentraci, pro 6-MNA 1 a 50 μM; pro nabumeton 0,5 a 10 μM) jsme skladovali při teplotě -70 °C po dobu 24 hodin. Poté roztály při laboratorní teplotě a následně byly znovu zmraženy. Tento postup jsme opakovali a po čtvrtém cyklu roztátí vzorků jsme provedli analýzu.
Pro studium krátkodobé teplotní stability jsme připravili vzorky o vysoké a nízké koncentraci (pro 6-MNA 1 a 50 μM; pro nabumeton 0,5 a 10 μM, tři alikvoty od každé). Vzorky byly ponechány při laboratorní teplotě 6 hodin a následně zpracovány.
Pro stanovení dlouhodobé teplotní stability vzorků jsme připravili vzorky o vysoké a nízké koncentraci analytů (pro 6-MNA 1 a 50 μM; pro nabumeton 0,5 a 10 μM). Vzorky jsme uchovávali při teplotě -70 °C a v časových intervalech je analyzovali ve třech stanoveních v každé koncentraci.
Reprodukovatelnost metody jsme zhodnotili na základě výsledků analýz kontrolních vzorků, které jsme provedli v průběhu pěti týdnů. Celkem jsme analyzovali deset sérií po třech koncentracích (nízké, střední a vysoké) pro oba analyty. 6-MNA byla sledována na koncentračních úrovních 1; 10 a 50 μM, nabumeton pak v koncentracích 0,5; 2 a 10 μM.
Aplikace metody
Metodu jsme následně použili na stanovení farmakokinetických parametrů nabumetonu a 6-MNA u 24 zdravých dobrovolníků po podání 500 mg nabumetonu (Relifex, MEDA AB Švédsko). Zdraví dobrovolníci byli po vstupním fyzikálním, biochemickém a hematologickém vyšetření krátkodobě hospitalizováni na našem oddělení. Během hospitalizace dostal každý dobrovolník jednorázovou dávku přípravku Relifex s 250 ml vody na zapití. Podání léčiva probíhalo vždy v ranních hodinách pod dohledem zdravotní sestry. Po dobu studie měli dobrovolníci volný přístup k pitné vodě ad libitum. První lehké standardizované jídlo bylo podáváno za 4 hodiny od podání nabumetonu. Odběry jsme prováděli v čase před podáním léčiva a 1, 2, 3, 4, 6, 8, 10, 12, 24, 48, 72 a 96 hodin po podání léku. Tato studie byla schválena Etickou komisí VFN a všichni dobrovolníci podepsali informovaný souhlas před zařazením do studie.
Výsledky a diskuze
Optimalizace metody
HPLC separace analytů proběhla na reverzní C18 koloně. Testovali jsme mobilní fáze o složení acetonitril/voda a acetonitril/0,1% TFA. Chromatografická separace byla ve všech případech provedena isokratickou eluční technikou.
Jako výchozí bod jsme zvolili mobilní fázi acetonitril : voda 50 : 50 (v/v), kdy jsme pozorovali dobrou separaci analytů a vnitřního standardu. Zjistili jsme, že rostoucí průtoková rychlost měla negativní vliv na symetrii píků a odezva MS detekce (výška píku) při překročení průtoku 0,3 ml.min-1 klesala.
Při použití mobilní fáze acetonitril: 0,1% TFA v poměru 50 : 50 (v/v) došlo k očekávanému vylepšení symetrie píků a k navýšení signálu MS, nicméně při překročení průtokové rychlosti 0,3 ml.min-1 i za těchto podmínek účinnost ionizace MS klesala.
Vyšší obsah acetonitrilu vedl ke snížení retence a zhoršení symetrie píků. Odezva MS při obsahu acetonitrilu 50 % a více setrvávala na přibližně konstantní úrovni. Pro další práci jsme zvolili poměr acetonitril : 0,1% TFA 50 : 50 (v/v).
MS detekce
Současné požadavky na validaci bioanalytických metod vyžadují průkaz nepřítomnosti matričních efektů. V naší práci jsme tento průkaz nezjišťovali, protože jsme použili metodu chemické ionizace za atmosferického tlaku (APCI), která je podstatně robustnější vzhledem ke složení matrice a riziko matričních efektů je významně nižší ve srovnání s metodou elektrosprejové ionizace (ESI). Pro použití v rámci TDM, ke kterému jsme naší metodu vyvinuli, lze proto popisovanou metodu považovat za dostatečně robustní s ohledem na matriční efekty.
Při použití chemické ionizace za atmosferického tlaku všechny tři sledované látky poskytovaly signál pouze při záznamu kladných iontů.
Na obrázku 1 je zobrazeno spektrum 6-MNA, kde lze vidět ion m/z 217, který je tvořen protonovanou molekulou (M+H)+ a fragmentový ion m/z 171, vzniklý dekarboxylací molekuly. Ion m/z 282 nepatří sledované látce, jedná se o ion z pozadí. Na obrázku 2 je APCI spektrum naproxenu. Opět je zde pozorovatelná protonovaná molekula (M+H)+ o hmotě m/z 231 a intenzivní fragmentový ion m/z 185 vzniklý dekarboxylací.
1. Hmotnostní APCI spektrum 6-MNA, pozitivní mód (50 μM roztok, ACN : 0,1% TFA 50 : 50 (v/v)) 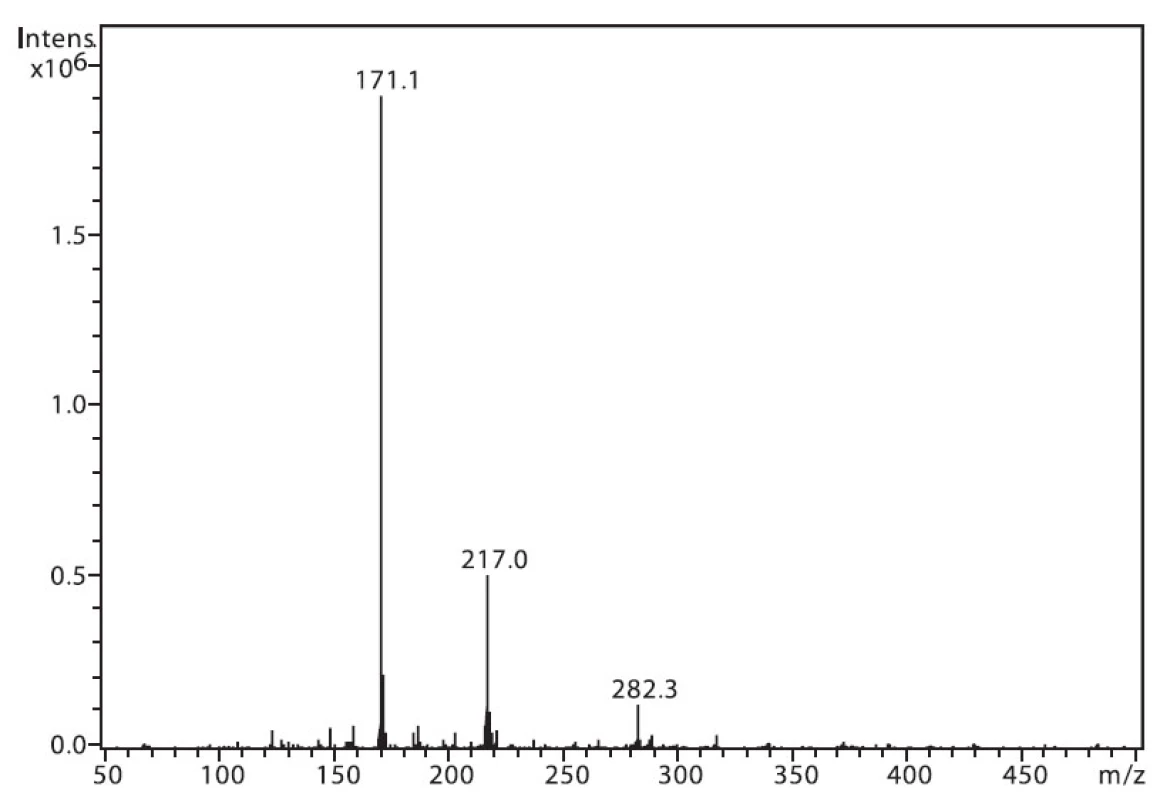
2. Hmotnostní APCI spektrum naproxenu, pozitivní mód (50 μM roztok, ACN : 0,1% TFA 50 : 50 (v/v)) 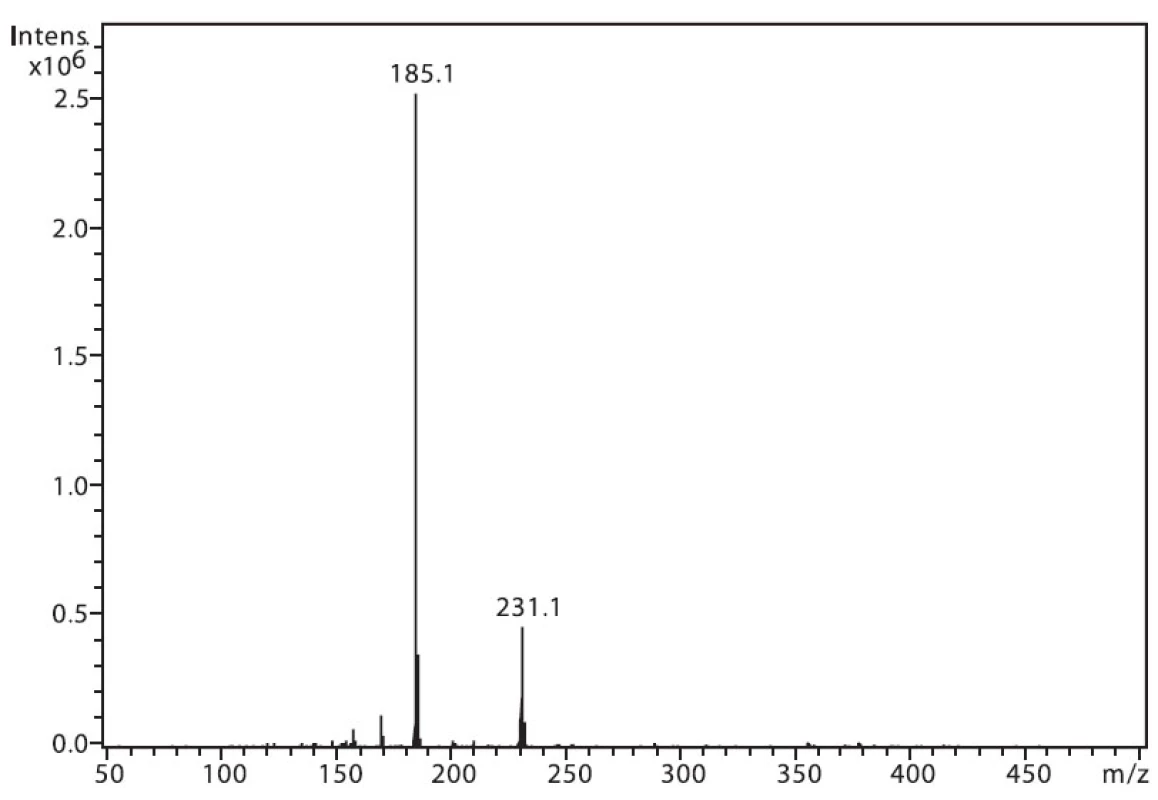
Na obrázku 3 je zobrazeno spektrum nabumetonu. Ion m/z 229 patří protonované molekule (M+H)+ a intenzivní m/z 171 je fragment vzniklý odštěpením části postranního řetězce (M–CH3COCH2)+. Ion m/z 211 pak odpovídá ztrátě 17 u. Ostatní přítomné ionty patří k signálu pozadí.
3. Hmotnostní APCI spektrum nabumetonu, pozitivní mód (50 μM roztok, ACN : 0,1% TFA 50 : 50 (v/v)) 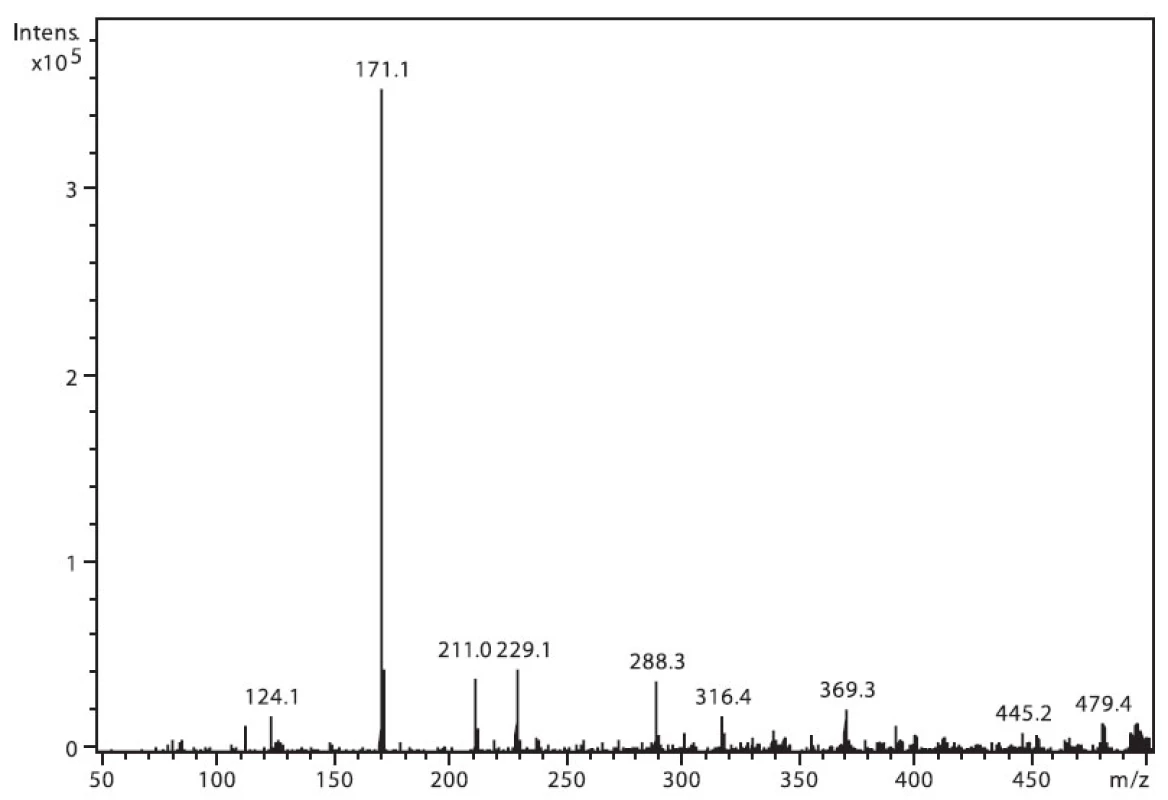
Validace
Metoda stanovení 6-MNA a nabumetonu splňuje požadavky na přesnost a správnost. Selektivita metody byla testována analýzou deseti „slepých“ vzorků, přičemž jsme nepozorovali žádné interference.
Zároveň jsme určili detekční limity pro obě stanovované látky. Limit UV detekce pro 6-MNA byl 50 nM, pro nabumeton 0,1 μM. Limit MS detekce pro 6-MNA činil 1 μM, pro nabumeton 0,5 μM.
V přítomnosti naproxenu jako vnitřního standardu (10 μM) byla v koncentračním rozmezí 0,2–200 μM na deseti koncentračních úrovních proměřena odezva standardních roztoků 6-MNA a nabumetonu s využitím UV detekce. Rozmezí pro MS detekci bylo 0,5–200 μM, devět koncentračních úrovní.
Odezva byla pro oba analyty v uváděném rozsahu lineární při použití UV i MS detekce (obr. 4 až 7).
4. Závislost odezvy standardních roztoků 6-MNA na koncentraci (kolona Supelcosil LC-18 15 cm × 4,6 mm 5 μm; ACN : 0,1% TFA 50 : 50 0,3 ml.min-1; nástřik 30 μl, UV 230 nm) 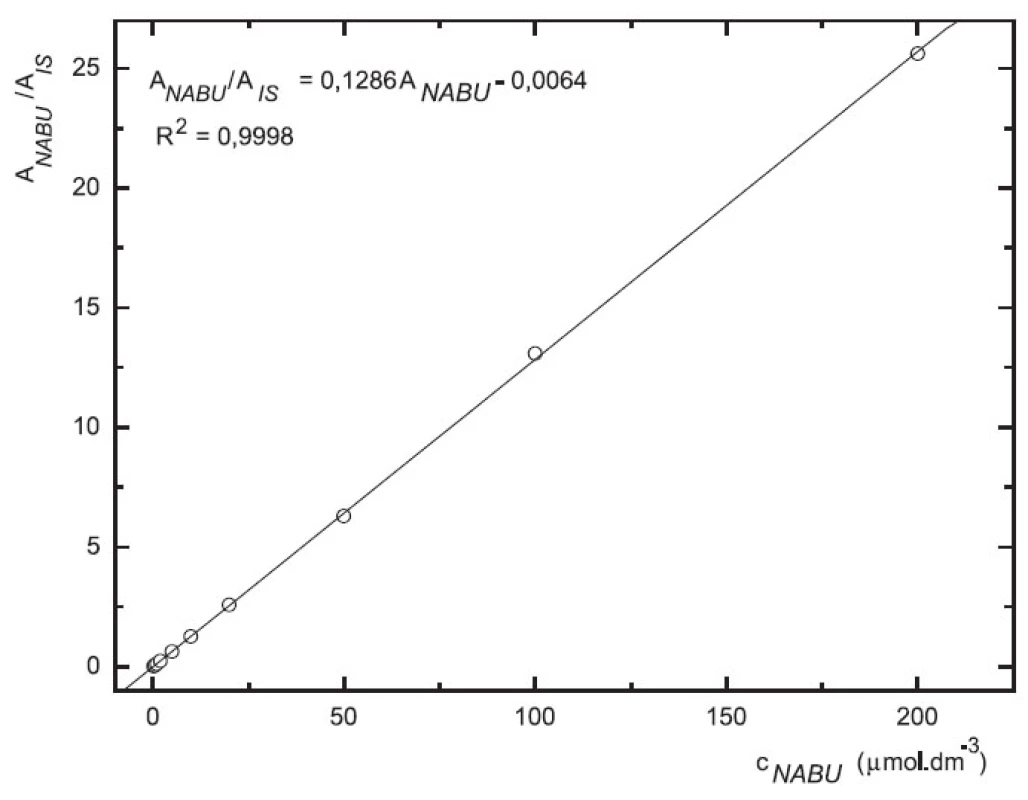
5. Závislost odezvy standardních roztoků 6-MNA na koncentraci (kolona Supelcosil LC-18 15 cm × 4,6 mm 5 μm; ACN : 0,1% TFA 50 : 50 0,3 ml.min-1; nástřik 30 μl, MS m/z 171, m/z 185) 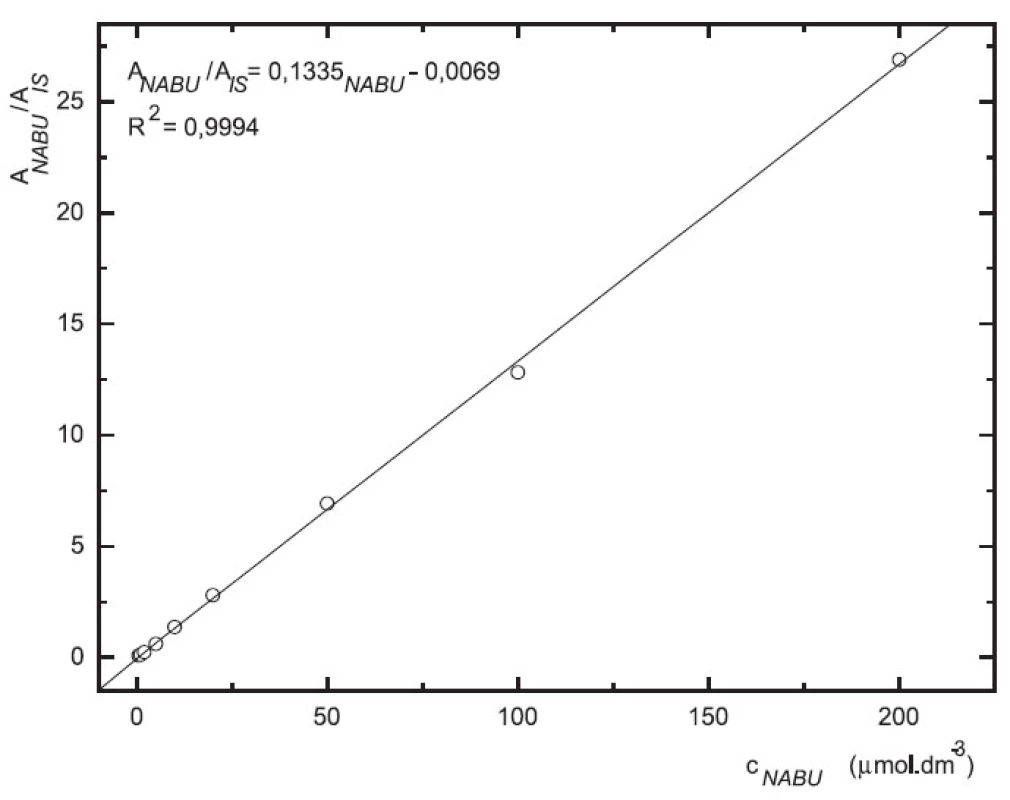
6. Závislost odezvy standardních roztoků nabumetonu na koncentraci (kolona Supelcosil LC-18 15cm × 4,6 mm 5 μm; ACN : 0,1% TFA 50 : 50 0,3 ml.min-1; nástřik 30 μl, MS m/z 171, m/z 185) 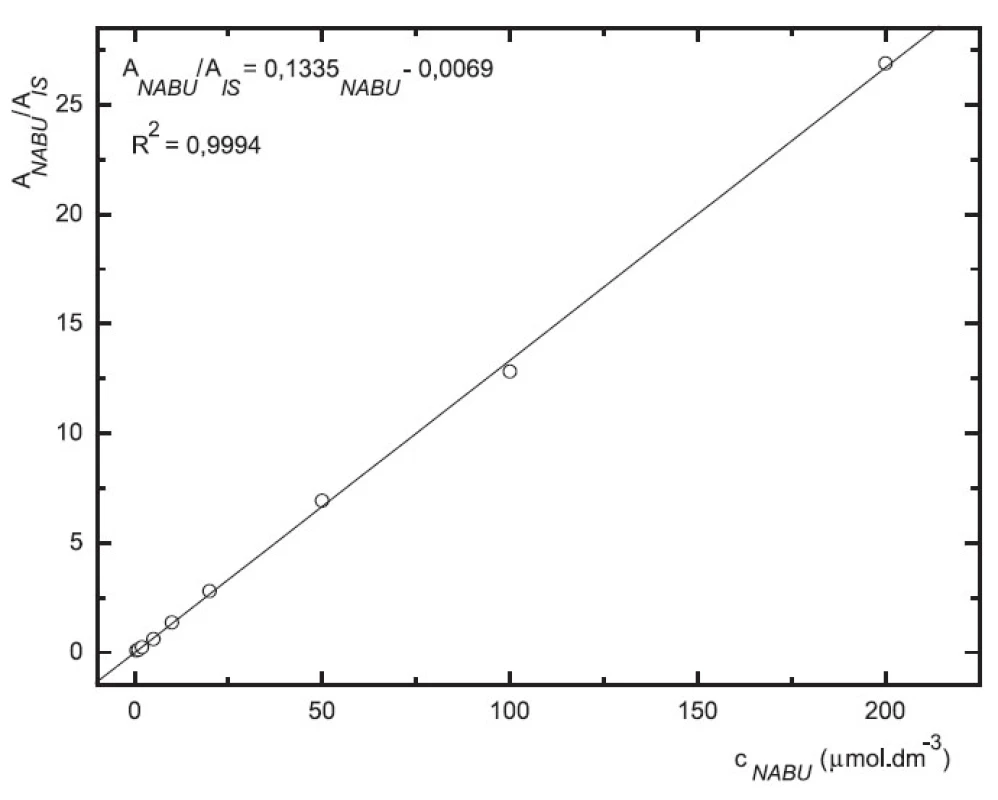
7. Závislost odezvy standardních roztoků 6-MNA na koncentraci (kolona Supelcosil LC-18 15cm × 4,6 mm 5 μm; ACN : 0,1% TFA 50 : 50 0,3 ml.min-1; nástřik 30 μl, MS m/z 171, m/z 185) 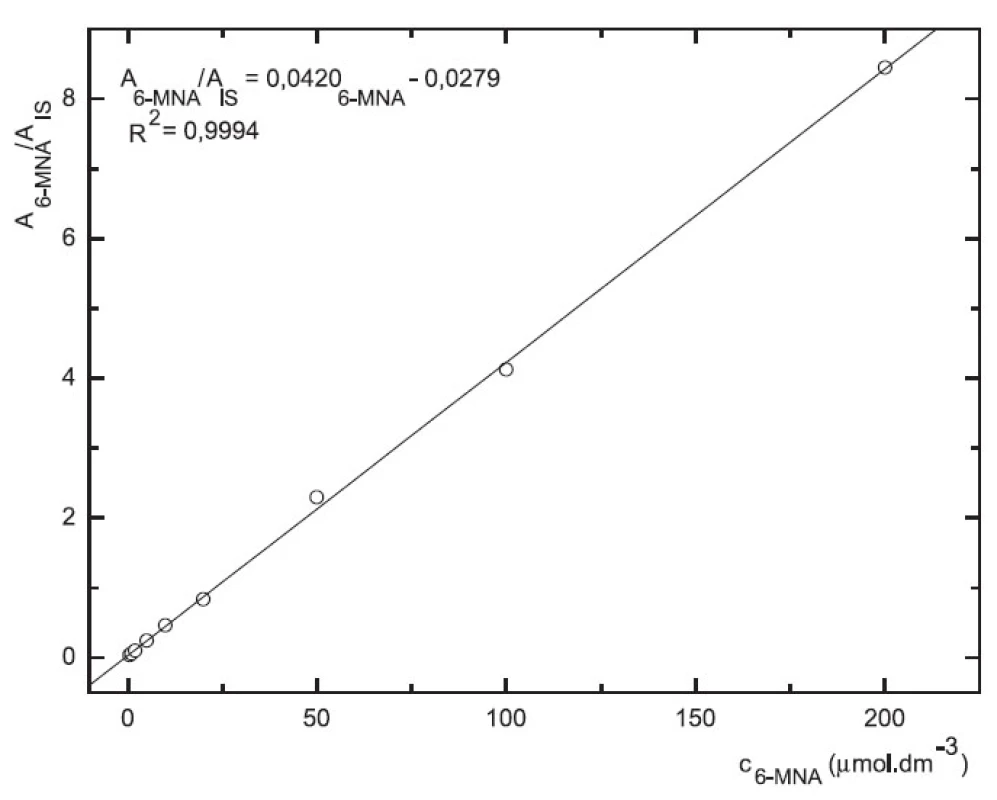
Validace byla provedena pro UV a pro MS detekci zvlášť. Parametry validace pro stanovení 6-MNA jsou uvedeny v tabulce 1. Validace metody stanovení nabumetonu je shrnuta v tabulce 2. Výtěžnost se pohybovala okolo 84 % pro nabumeton a 86–90 % pro 6-MNA (tab. 3).
1. Validace metody stanovení 6-MNA 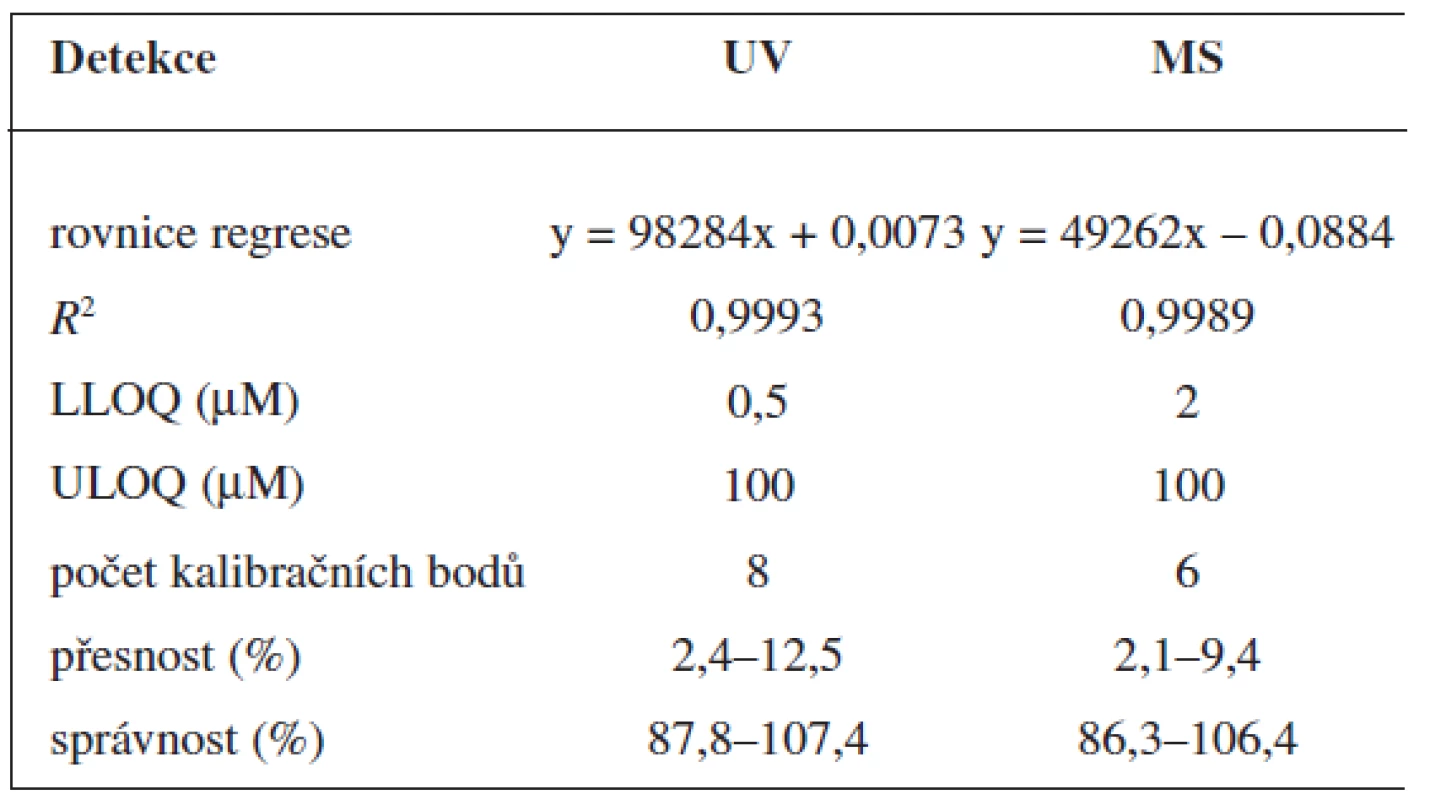
2. Validace metody stanovení nabume 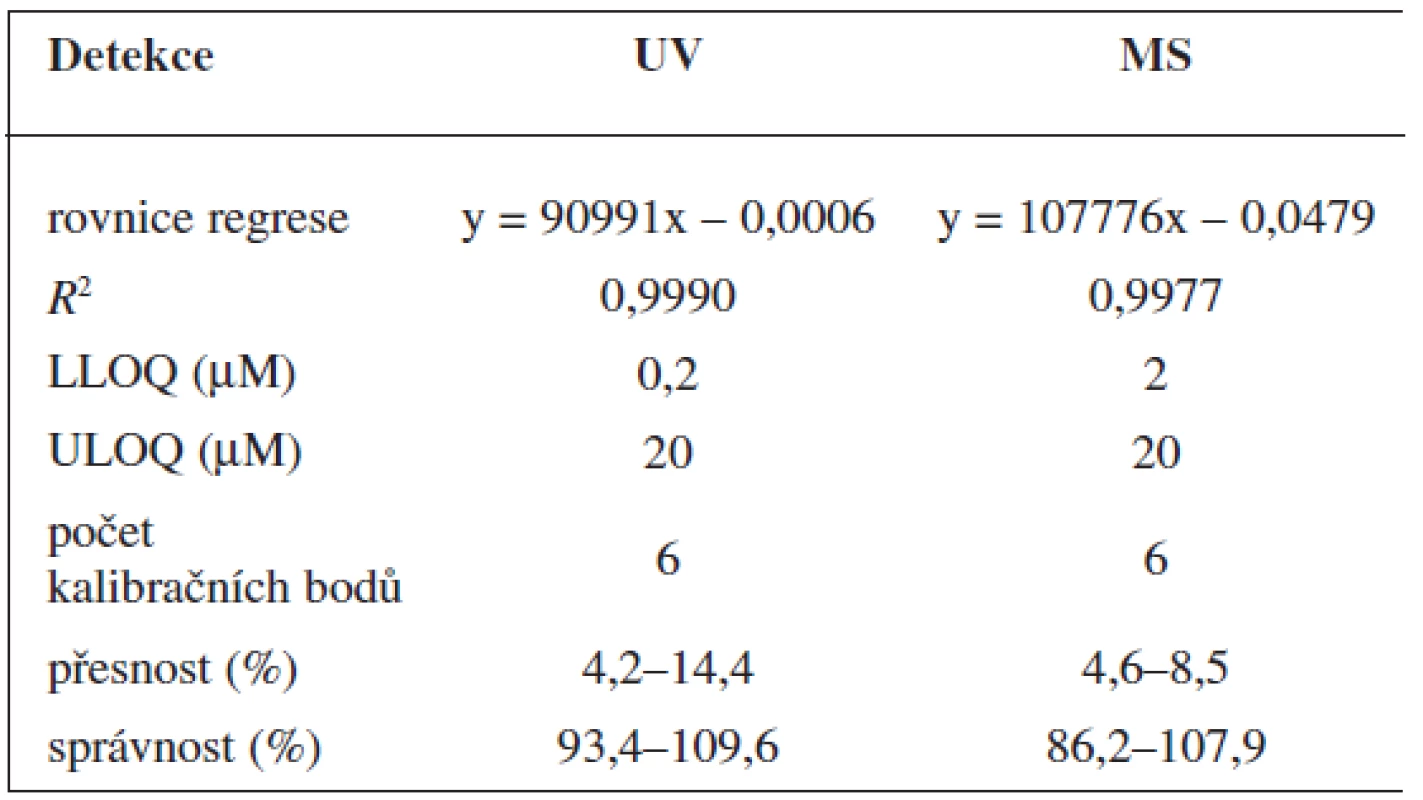
3. Výtěžnost metody pro 6-MNA a nabumeton (UV detekce) 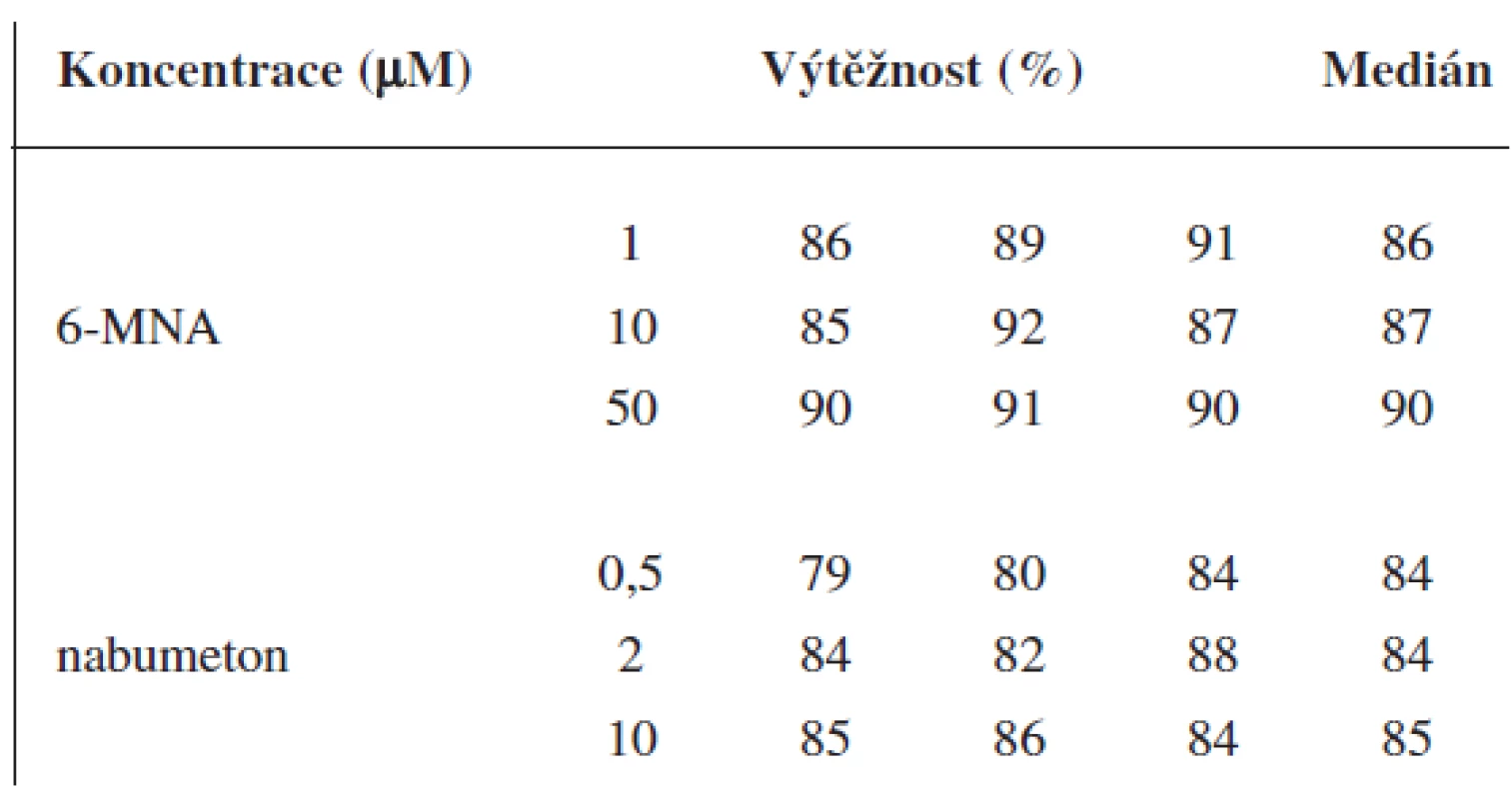
Stabilita zásobních roztoků
Stabilitu zásobních roztoků jsme sledovali v intervalech 14, 30, 60 a 120 dní. V žádném z intervalů se plochy píku pro 6-MNA, nabumeton nebo vnitřní standard neodchylovaly o více než 2 % od bazálních hodnot.
Stabilita vzorků krevní plazmy
Čtyři cykly zmrazení a opětovného roztátí nevedly k významnému poklesu obsahu analytů ve vzorku.
Krátkodobou teplotní stabilitu jsme sledovali u vzorků krevní plazmy, kdy jsme roztoky ponechali při laboratorní teplotě po dobu 6 hodin. Po této době opět nedošlo k významnému poklesu obsahu analytů ve vzorku podobně jako při testech dlouhodobé stability po 60 a 120 dnech skladování při -70 °C. Všechny výsledky stabilit testů krevní plazmy jsou sumarizovány v tabulce 4.
4. Krátkodobá a dlouhodobá stabilita vzorků krevní plasmy a stabilita po čtyřech cyklech zmrazení a roztátí. Medián ze 3 měření (UV detekce) 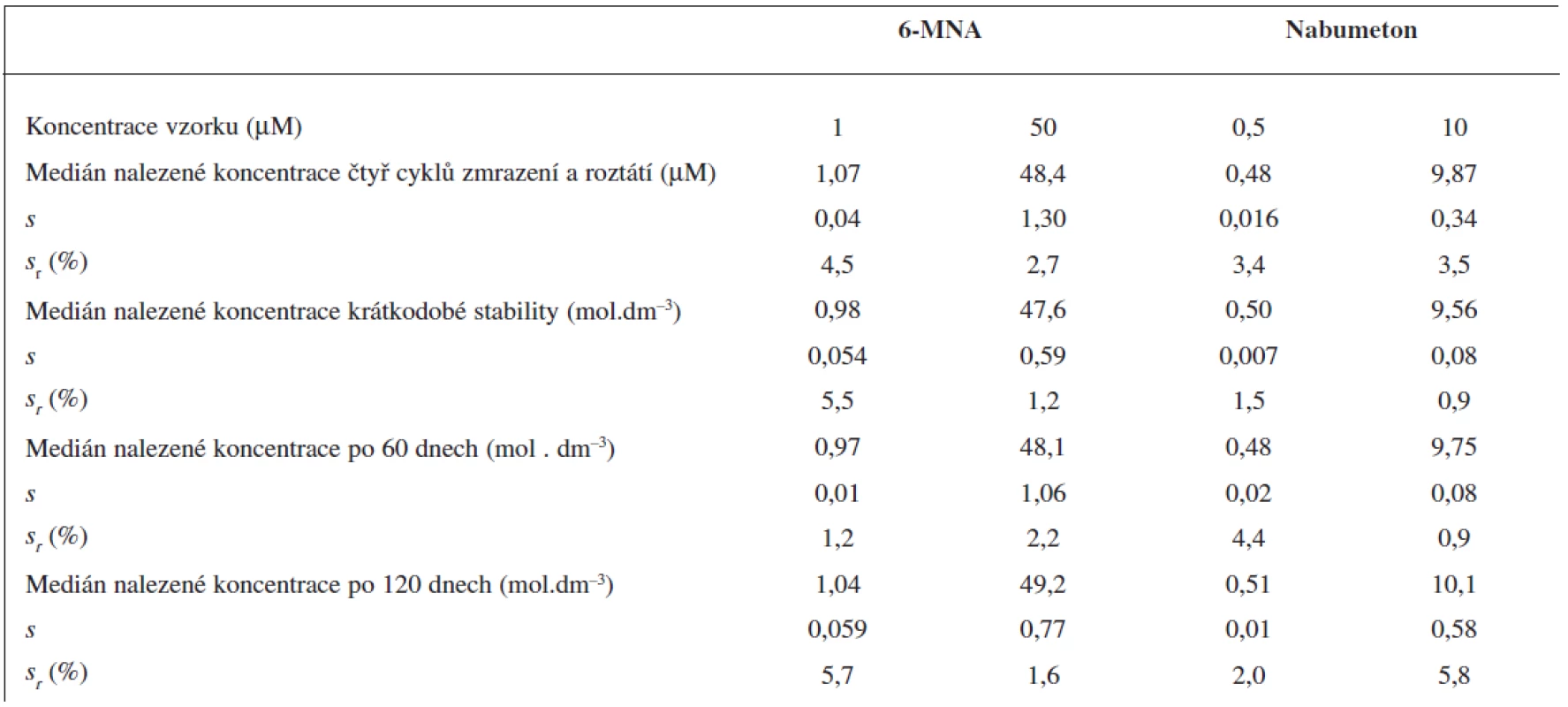
Reprodukovatelnost metody
Relativní směrodatná odchylka stanovení 6-MNA v kontrolních vzorcích na třech různých koncentračních hladinách se pohybovala v rozmezí 2,9–6,1 %. Obdobně nabývala i v případě nabumetonu relativní směrodatná odchylka hodnot 1,6–3,6 %.
Aplikace metody
Průměrné hladiny (95% CI) nabumetonu a 6-MNA získané UV detekcí jsou uvedeny na obrázcích 8 a 9. Základní farmakokinetické parametry nabumetonu a 6‑MNA jsou uvedeny v tabulce 5.
8. Průběh průměrných koncentrací nabumetonu v čase (± 95%CI) 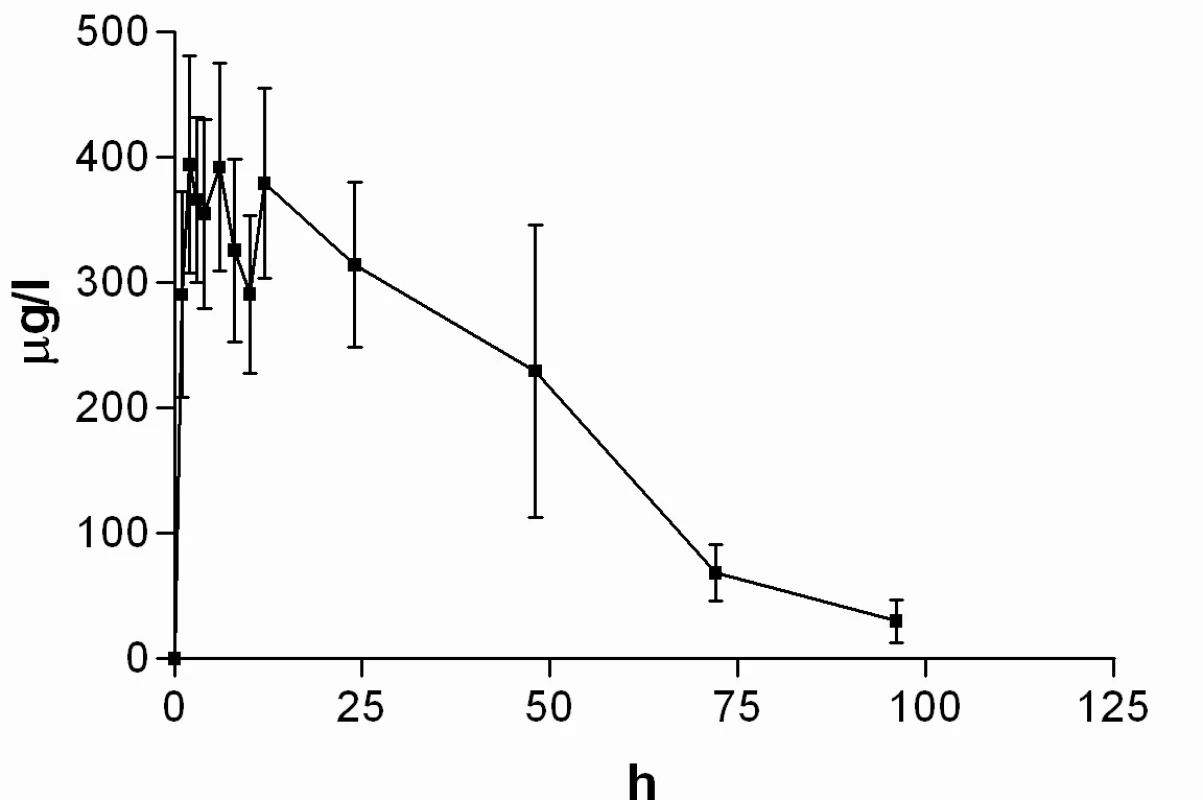
9. Průběh průměrných koncentrací 6-MNA v čase (± 95%CI) 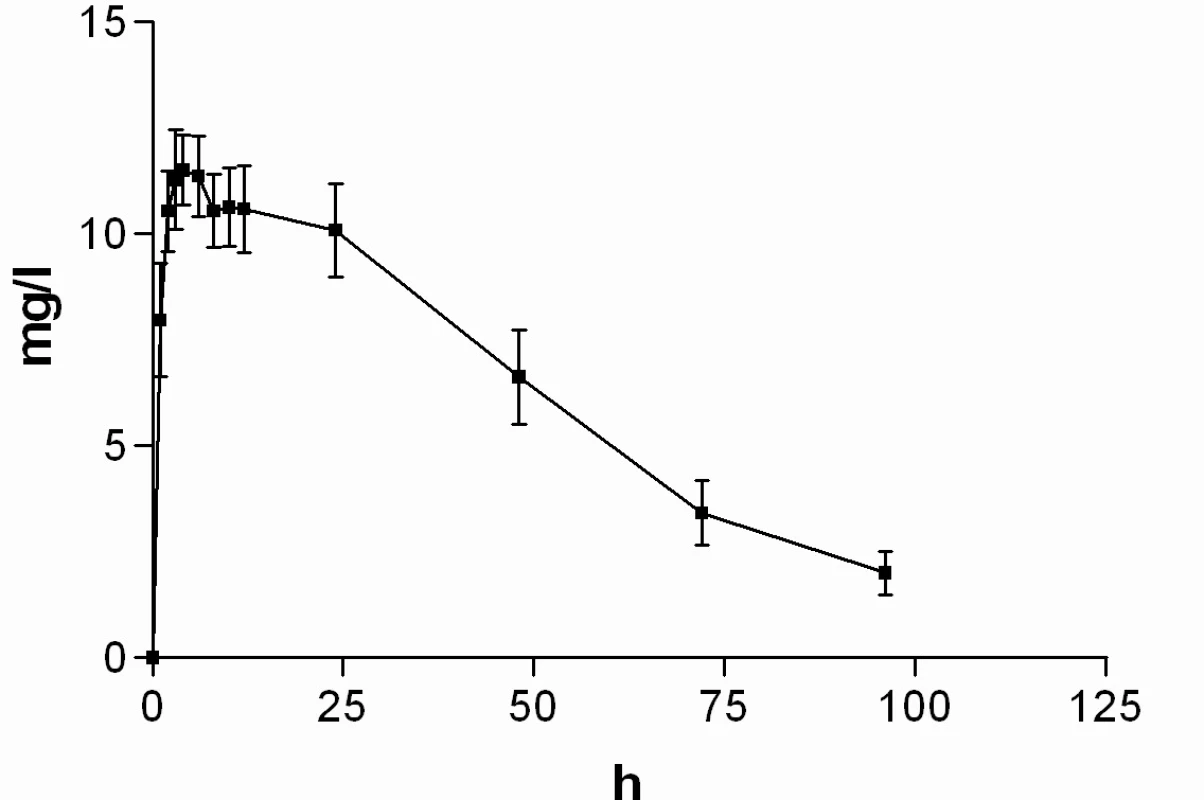
5. Průměrné (SD) hodnoty základních farmakokinetických parametrů ve skupině 24 dobrovolníků 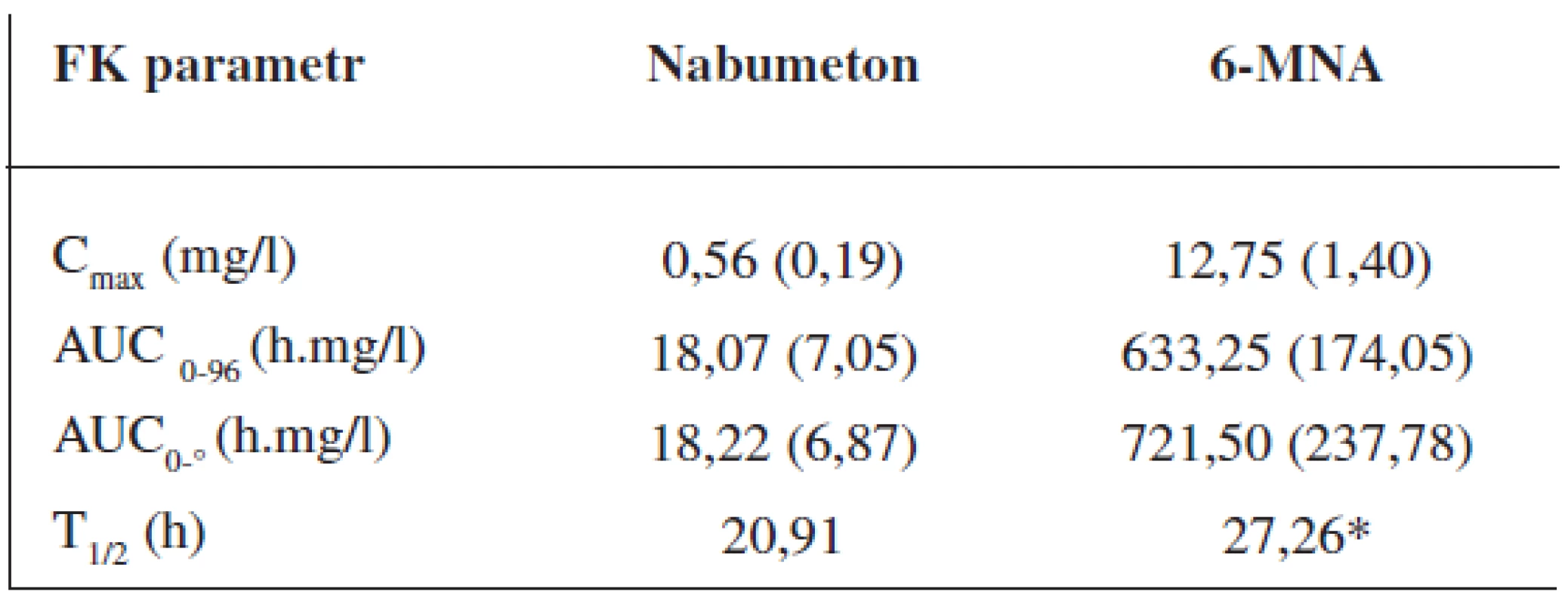
Závěr
Při srovnání obou detekčních technik, lze říci, že UV detekce, jak dokládají směrnice z rovnic kalibračních přímek, je stejně citlivá pro 6-MNA i pro nabumeton. Pokud stejným způsobem zhodnotíme hmotnostní detekci, je citlivější pro nabumeton (směrnice kalibrační přímky nabumetonu je přibližně 2× než směrnice kalibrační přímky 6-MNA). Při použití UV detekce jsme u obou analytů dosáhli nižší meze stanovitelnosti než v případě detekce hmotnostní. Lze předpokládat, že použitím techniky SIM u kvadrupólového hmotnostního spektrometru, případně techniky MRM u tandemových přístrojů by bylo možné zvýšit citlivost o několik řádů a dostat se minimálně na úroveň UV detekce. Tyto módy detekce však námi použité přístrojové vybavení neumožnilo.
Zavedené metody UV i hmotnostní detekce umožňují stanovit koncentrace nabumetonu a 6-MNA po jednorázovém podání terapeutické dávky léčiva.
Práce vznikla za podpory grantu GA UK 52707.
Došlo 26. listopadu 2010
Přijato 20. prosince 2010
Adresa pro korespondenci:
doc. MUDr. Ondřej Slanař, Ph.D.
Farmakologický ústav 1. LF UK
Albertov 4, 128 00 Praha 2
e-mail: oslan@lf1.cuni.cz
Sources
1. Boyle, E. A., Freeman, P. C., Mangan, F. R., Thomson, M. J.: Nabumetone (BRL 14777, 4-[6-methoxy-2-naphthyl]-butan-2-one): a new anti-inflammatory agent. J Pharm Pharmacol. 1982; 34, 562–569.
2. Battisti, W. P., Katz, N. P., Weaver, A. L., Matsumoto, A. K., Kivitz, A. J., Polis, A. B., Geba, G. P.: Pain management in osteoarthritis: a focus on onset of efficacy – a comparison of rofecoxib, celecoxib, acetaminophen, and nabumetone across four clinical trials. J Pain. 2004; 5, 511–520.
3. Hedner, T., Samulesson, O., Wahrborg, P., Wadenvik, H., Ung K. A., Ekbom, A.: Nabumetone: therapeutic use and safety profile in the management of osteoarthritis and rheumatoid arthritis. Drugs. 2004; 64, 2315–2343; discussion 2344–2315.
4. Kobylinska, K., Barlinska, M., Kobylinska, M.: Analysis of nabumetone in human plasma by HPLC. Application to single dose pharmacokinetic studies. J Pharm Biomed Anal. 2003; 32, 323–328.
5. Starek, M., Krzek, J.: A review of analytical techniques for determination of oxicams, nimesulide and nabumetone. Talanta. 2009; 77, 925–942.
6. Kendall, M. J., Chellingsworth, M. C., Jubb, R., Thawley, A. R., Undre, N. A., Kill, D. C.: A pharmacokinetic study of the active metabolite of nabumetone in young healthy subjects and older arthritis patients. Eur J Clin Pharmacol. 1989; 36, 299–305.
7. Davies, N. M.: Clinical pharmacokinetics of nabumetone. The dawn of selective cyclo-oxygenase-2 inhibition? Clin Pharmacokinet. 1997; 33, 404–416.
8. Patel, B. N., Sharma, N., Sanyal, M., Prasad, A., Shrivastav, P. S.: High-throughput LC-MS/MS assay for 6-methoxy-2-naphthylacetic acid, an active metabolite of nabumetone in human plasma and its application to bioequivalence study. Biomed Chromatogr. 2008; 22, 1213–1224.
9. Srinivas N. R.: Applicability of LC/MS/MS assay for 6-methoxy-2-napthylacetic acid to support the bioequivalence study of nabumetone-comments on the research work of Patel et al. (2008). Biomed Chromatogr. 2009; 23, 674–675.
10. Food and Drug Administration: FDA Guidance for Industry: Bioanalytical Method Validation. 2001; http://www.fda.gov/cder/quidance (15. 11. 2010).
Labels
Pharmacy Clinical pharmacology
Article was published inCzech and Slovak Pharmacy

2011 Issue 1-
All articles in this issue
- On teaching the chemistry of pharmaceutical auxiliary substances within the framework of pharmaceutical education in the Czech and Slovak Republics
- Determination of nabumetone and 6-methoxy-2-naphthylacetic acid in plasma using HPLC with UV and MS detection
- Determination of airborne and surface contamination with cyclophosphamide at the Masaryk Memorial Cancer Institute, Brno, Czech Republic
- Energy evaluation of the compaction process of directly compressible isomalt
- Study on 99mTc-MAG3 and 99mTc-DMSA renal accumulation using in vitro cellular model
- Czech and Slovak Pharmacy
- Journal archive
- Current issue
- Online only
- About the journal
Most read in this issue- On teaching the chemistry of pharmaceutical auxiliary substances within the framework of pharmaceutical education in the Czech and Slovak Republics
- Study on 99mTc-MAG3 and 99mTc-DMSA renal accumulation using in vitro cellular model
- Determination of nabumetone and 6-methoxy-2-naphthylacetic acid in plasma using HPLC with UV and MS detection
- Determination of airborne and surface contamination with cyclophosphamide at the Masaryk Memorial Cancer Institute, Brno, Czech Republic
Login#ADS_BOTTOM_SCRIPTS#Forgotten passwordEnter the email address that you registered with. We will send you instructions on how to set a new password.
- Career

