-
Medical journals
- Career
Hodnocení reaktivační účinnosti vybranných reaktivátorů paraoxonem inhibované acetylcholinesterasy in vitro
Authors: O. Holas 1; K. Musílek 1,2; V. Opletalová 1; K. Kuča 2,3
Authors‘ workplace: Univerzita Karlova v Praze, Farmaceutická fakulta v Hradci Králové, Katedra farmaceutické chemie a kontroly léčiv 1; Univerzita obrany Brno, Fakulta vojenského zdravotnictví Hradec Králové, Katedra toxikologie 2; Univerzita obrany Brno, Fakulta vojenského zdravotnictví Hradec Králové, Centrum pokročilých studií 3
Published in: Čes. slov. Farm., 2010; 59, 18-22
Category: Original Articles
Overview
Organofosforové pesticidy (OFP) patří do skupiny vysoce toxických ireverzibilních inhibitorů acetylcholinesterasy (AChE). Kauzálními léčivy při intoxikacích OFP jsou oximové reaktivátory AChE. Reaktivační účinnost pěti nově připravených bispyridiniových reaktivátorů acetylcholinesterasy byla otestována na modelu paraoxonem inhibovaného enzymu. Reaktivační účinnost byla testována za pomoci standardního in vitro testu, kde byl jako zdroj acetylcholinesterasy použit homogenát mozku laboratorního potkana. Výsledky byly porovnány s pěti komerčně dostupnými reaktivátory AChE.
Klíčová slova:
acetylcholinesterasa – organofosforový pesticid – reaktivátor – in vitro – SARÚvod
První organofosforové inhibitory acetylcholinesterasy (OFI) byly vyvinuty pro vojenské účely jako bojové chemické látky (BChL) v Německu ve třicátých letech 20. století. Mezi tyto sloučeniny, označované také jako nervově paralytické látky (NPL), patří např. sarin (GB; O‑isopropylmethylfluorofosfonát), soman (GD; O‑pinakolylmethylfluorofosfonát), tabun (GA; O‑ethyldiethylamidokyanofosfát), cyklosarin (GF; cyklohexylmethyfluorofosfonát) a látka VX (O-ethyl-S--2-(diisopropylamino)ethyl-methylthiofosfonát). Strukturně velmi podobné látky jsou používány i jako pesticidy pro zemědělské účely, např. chlorpyrifos (O,O-dimethyl-O-(3,5,6-trichlor-2-pyridyl)-thiofosfát), parathion (O,O-diethyl-O-(4-nitrofenyl)-thiofosfát) atd. Průmyslově se řada méně toxických OFI využívá jako změkčovadel nebo inhibitorů hoření 1–4). Metrifonát (O,O-di-methyl-(2,2,2-trichlor-1-hydroxyethyl)-fosfonát) našel uplatnění při léčbě Alzheimerovy nemoci 5). OFI mohou být potenciálním nebezpečím díky své snadné dostupnosti 6).
OFI inhibují ireverzibilně enzym acetycholinesterasu (AChE, E.C. 3.1.1.7). Toxicita OFI je založena na ireverzibilní fosforylaci, resp. fosfonylaci aktivního místa enzymu (Ser 203) 2). Inhibovaný enzym není schopný štěpit neuromediátor acetylcholin, který se hromadí v centrálním i periferním nervovém sytému a dochází k hyperstimulaci nervových receptorů. Od lokalizace a druhu receptorů se odvíjejí akutní účinky zasažení OFI, jedná se o příznaky nikotinové, muskarinové a centrální. Muskarinové příznaky se projevují miózou, zhoršením akomodace čočky, zvýšeným slzením a sliněním, zúžením bronchů, hypersekrecí bronchiálních žlázek, zvýšenou motilitou střev, poklesem krevního tlaku, bradykardií atd. Nikotinovými příznaky jsou svalová slabost a svalové fascikulace, které postupně přecházejí v tonicko-klonické křeče nebo až v celkovou paralýzu příčně pruhovaného svalstva. Příznaky centrální se projevují bolestí hlavy, úzkostí, neklidem, závratěmi, zmateností atd. Bezprostřední riziko pro osobu zasaženou OFI představuje akutní respirační insuficience daná útlumem dýchacího centra v prodloužené míše a následnou paralýzou dýchacích svalů. Pokud zasažená osoba překoná cholinergní krizi, nastupuje těžká chronická intoxikace způsobená metabolickým rozvratem v důsledku hypoxie a acidózy. Tento stav je charakterizován zvýšenou únavou, poruchami spánku, emoční labilitou a depresemi. Při akutní intoxikaci se mohou organofosfáty (zejména pesticidy) ukládat do depotních tukových tkání. Při odbourávání těchto dep hrozí opětovné vyplavení organofosfátů do systémového oběhu 7, 8). Některé OFI odvozené od kyseliny thiofosforečné jsou méně toxické než jejich kyslíkaté analogy. Jejich přeměna na toxičtější oxoderiváty (s větší afinitou k AChE) probíhá v krevní plazmě a jaterní tkáni, jedná o tzv. letální syntézu (např. metabolická aktivace parathionu na paraoxon) 9, 10).
K léčbě intoxikací OFI se používá řada prostředků. Osobám potenciálně ohroženým zasažením OFI (např. vojáci) se podávají reverzibilní inhibitory AChE (např. pyridostigmin) sloužící k blokování aktivního místa AChE 11). Standardní léčba se skládá z podání anticholinergního léčiva (přednostně se používá atropin), které antagonizuje působení nahromaděného ACh na receptorech, reaktivátoru AChE a diazepamu i.m. jako antikonvulziva. Reaktivátory AChE jsou sloučeniny schopné nukleofilně štěpit kovalentní vazbu mezi OFI a aktivním místem enzymu a obnovit jeho fyziologickou funkci 1, 2, 9). Ve své molekule nesou obvykle 1–2 nukleofilní oximové skupiny 12). Ke komerčně dostupným reaktivátorům patří pralidoxim (1. 2-PAM, 2-hydroxyiminomethyl-1-methylpyridinium-chlorid), trimedoxim (2. bis-1,3-(4-hydroxyiminomethylpyridinium)-propan-dibromid), obidoxim (3. 1,3-bis(4-hydroxyiminomethylpyridinium)-2-oxapropan-dichlorid), HI-6 (4.1-(2-hydroxyiminomethylpyridinium)-3-(4-karbamoylpyridinium)-2-oxapropan-dichlorid) a methoxim (5.bis-(4-hydroxyiminomethylpyridinium)-methan-dichlorid) 13).
Vzhledem k velké variabilitě OFI neexistuje jeden univerzální reaktivátor schopný uspokojivě reaktivovat AChE inhibovanou všemi typy OFI 14). Navíc po expozici OFI dochází k dealkylaci, popř. deaminaci komplexu AChE-OFI. Takto změněný komplex již není reaktivovatelný. Tento proces se nazývá stárnutí enzymu (tzv. „aging“) 15, 16). Účinnost reaktivátorů je mimo jiné dána i rychlostí, s jakou dochází ke stárnutí enzymu. Stárnutí NPL probíhá nejrychleji u somanu, u OF pesticidů dochází ke stárnutí v řádu hodin 17).
Cíl práce
V současné době používané reaktivátory byly vyvinuty jako prostředky antidotní terapie pro případy zasažení NPL. Navzdory stejnému mechanismu inhibice (fosforylace Ser 203) nejsou tyto reaktivátory většinou vhodné pro terapii osob zasažených OF pesticidy. Cílem této práce je nalezení účinných reaktivátorů pro OF insekticidy cestou porovnání reaktivační účinnosti pěti komerčně užívaných reaktivátorů a pěti nově připravených sloučenin, jejichž reaktivační účinnost byla dosud ověřena pouze na modelu tabunem inhibované AChE. Za modelový pesticid byl zvolen insekticid paraoxon pro svoji vysokou inhibiční schopnost. Jeho použití v praxi je již několik desítek let zakázáno, nicméně jeho prekurzor parathion je stále celosvětově používán.
POKUSNÁ ČÁST
Chemikálie
Použité chemikálie byly dodány od firem Fluka a Sigma-Aldrich a použity bez dalšího přečištění. Komerčně dostupné i nové reaktivátory byly dříve připraveny na pracovišti Katedry toxikologie Fakulty vojenského zdravotnictví v Hradci Králové. Jejich čistota byla ověřena pomocí spektrálních metod (NMR, HPLC-MS).
Metodika
Homogenát z mozků laboratorního potkana (0,5 ml) byl smíchán s 20 μl isopropylalkoholového roztoku paraoxonu (10-5 M) a inkubován za teploty 25 °C po dobu 30 minut (pH 7,6). Poté bylo ke směsi přidáno 2,5 ml roztoku chloridu sodného (3 M) a doplněno na celkový objem 23 ml destilovanou vodou. Nakonec byly přidány 2 ml roztoku acetylcholin-jodidu (0,02 M). Enzymová aktivita byla měřena při pH 7,6 a teplotě 25 °C na autotitrátoru RTS 822 (Radiometer, Dánsko). Aktivity intaktního (a) a inhibovaného enzymu (ai) byly odečteny ze závislosti spotřeby roztoku NaOH (0,01 M) na čase. Po inkubaci paraoxonem inhibované AChE (30 min) byl k roztoku přidán reaktivátor (koncentrace 10-3 M nebo 10-5 M) a celá směs byla inkubována po dobu 10 minut. Aktivita reaktivované AChE (ar) byla opět odečtena ze závislosti spotřeby NaOH na čase.
Z naměřených hodnot aktivit bylo vypočítáno množství reaktivované AChE (%) podle vzorce:
Výsledky a diskuze
Vypočítané hodnoty reaktivace jsou průměrem ze dvou nezávislých měření. Výsledky komerčně dostupných a nově připravených reaktivátorů pro paraoxonem inhibovanou AChE jsou uvedeny v tabulce 1 a na obrázcích 1, 2 a 3. Maximální dosažitelná koncentrace reaktivátoru v plazmě je 10-4 M 18). Proto o možnostech dalšího využití více vypovídají výsledky naměřené při koncentraci reaktivátoru 10-5 M. Schopnost oximů reaktivovat OF inhibovanou AChE při této koncentraci by měla být alespoň 10%, aby mohla být ověřena i jejich účinnost in vivo 19).
Table 1. Struktura a reaktivační účinnost použitých reaktivátorů proti paraoxonem inhibované AChE 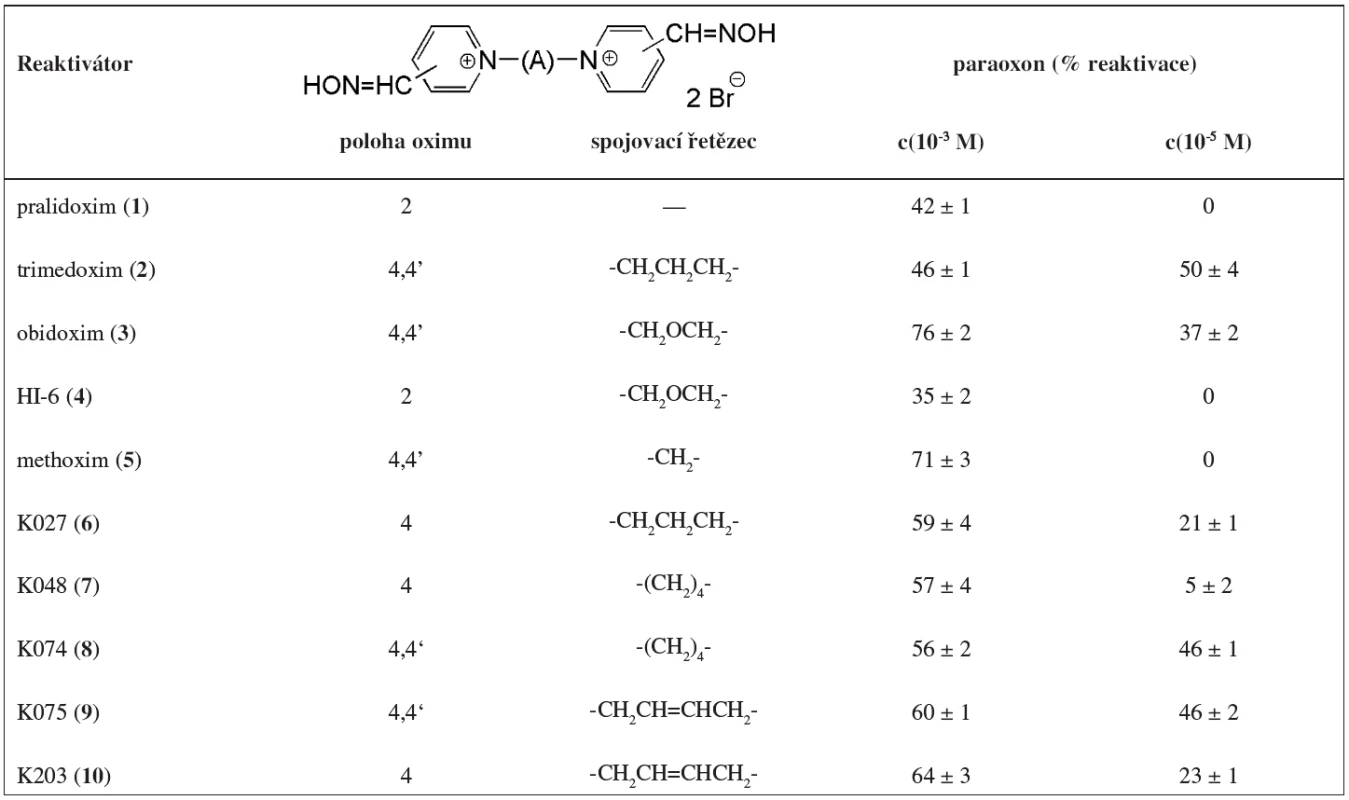
Image 1. Příklady organofosforových inhibitorů acetylcholinesterasy 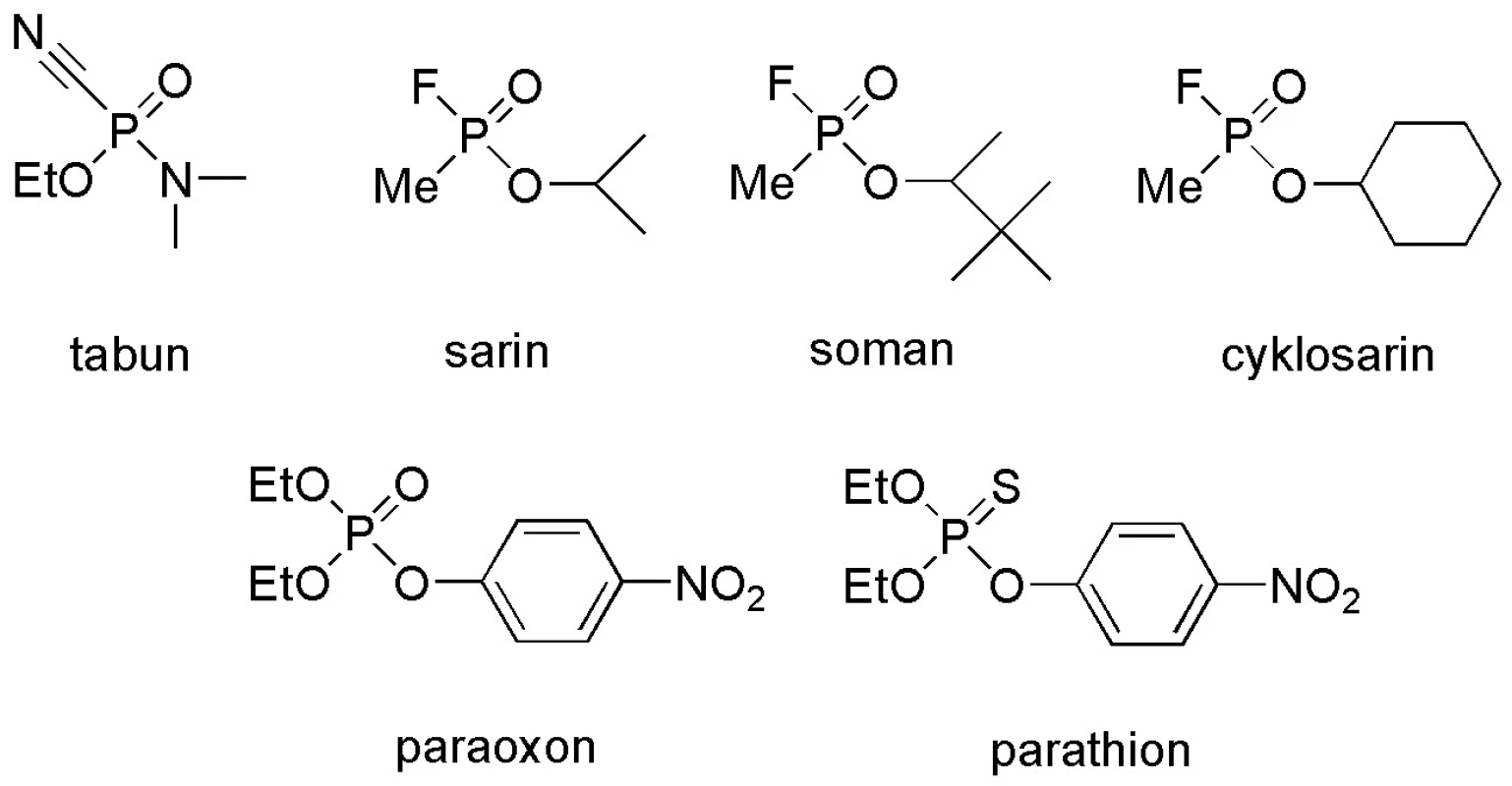
Image 2. Testované komerčně dostupné reaktivátory acetylcholinesterasy 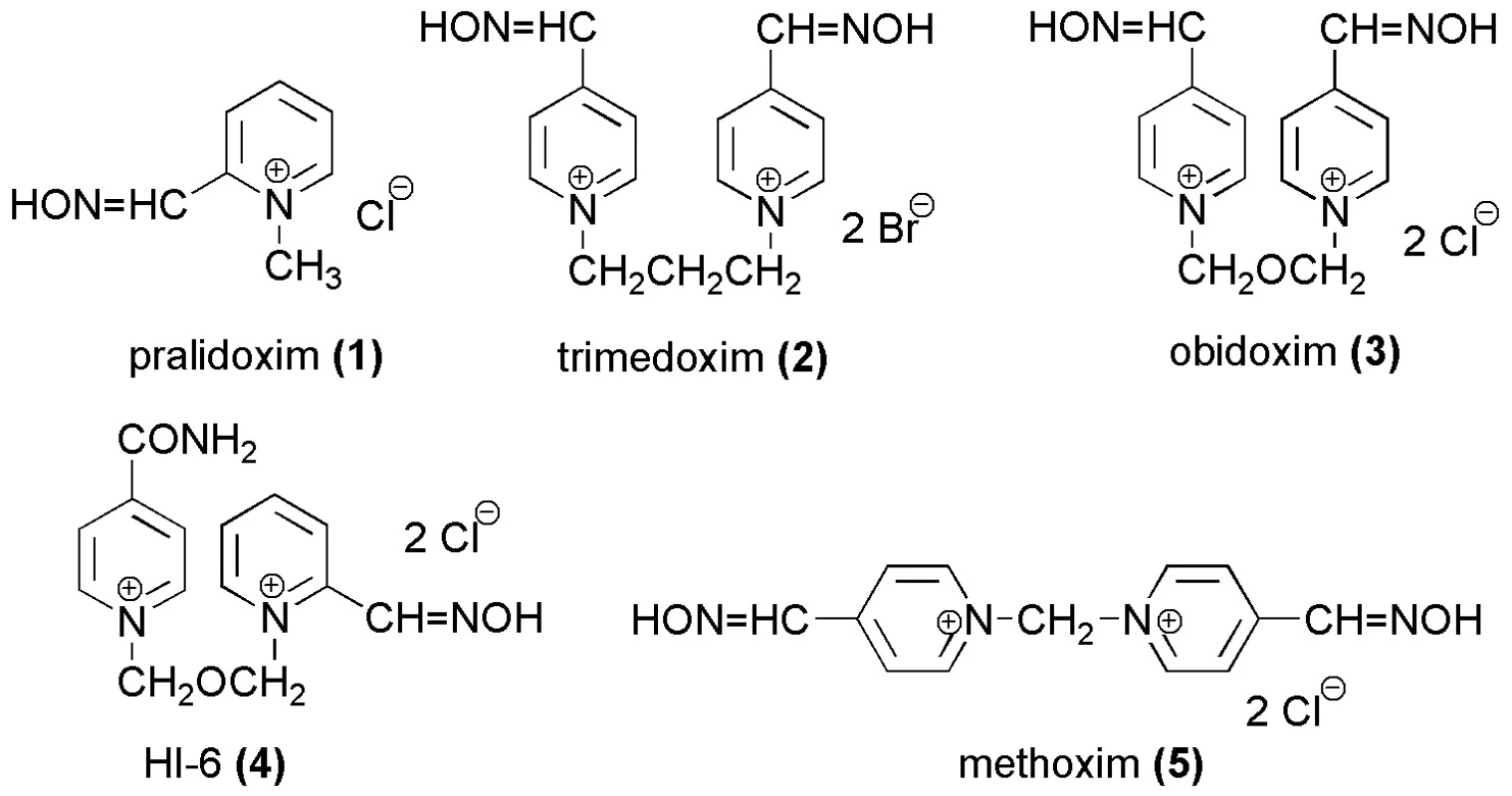
Image 3. Struktury nově testovaných reaktivátorů 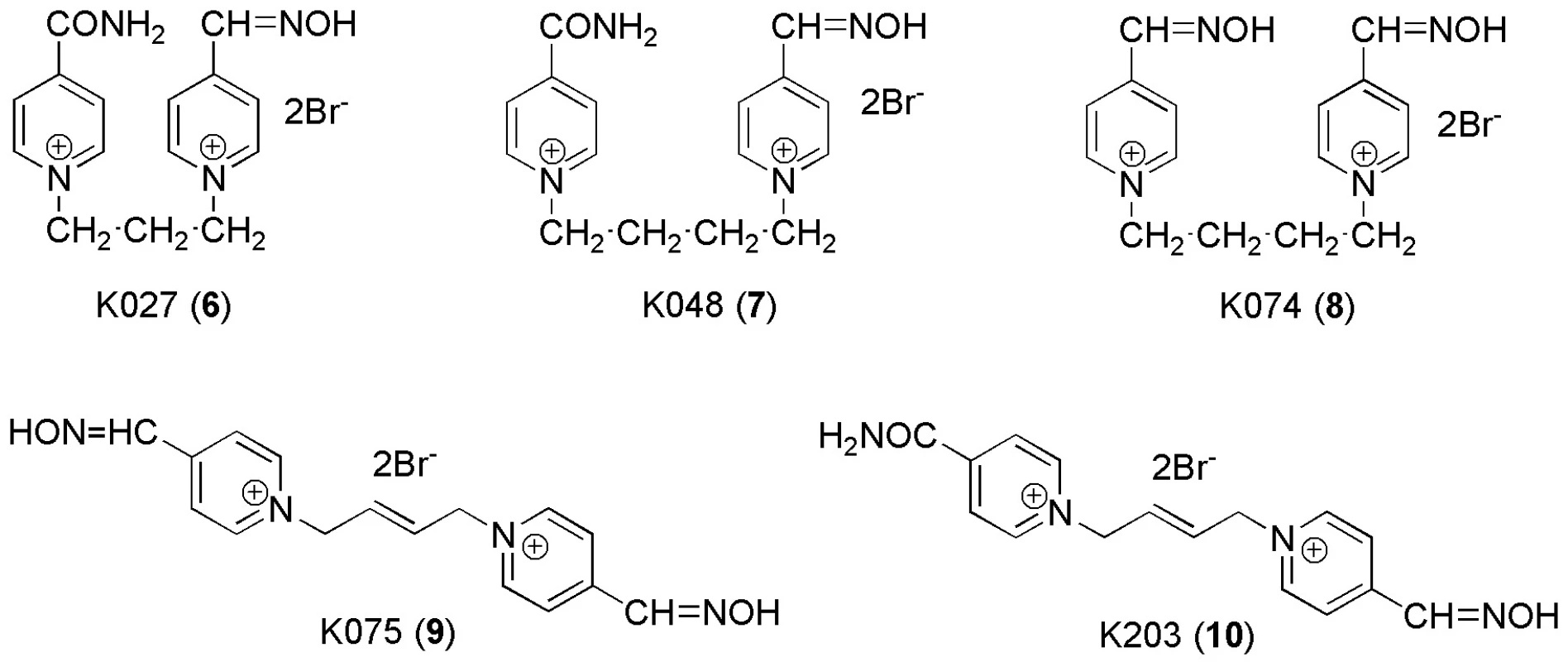
Obecně se dá konstatovat, že v současné době používané reaktivátory mají nízkou reaktivační účinnost proti paraoxonem inhibované AChE, a to zejména při koncentraci 10-5 M, výjimku tvoří trimedoxim a obidoxim 20). Pro reaktivátory ze skupiny komerčně dostupných sloučenin bylo proti paraoxonem inhibované AChE nejlepších výsledků dosaženo s obidoximem (3) a metoximem (5) při koncentraci 10-3 M, při koncentraci 10-5 M měli nejlepší výsledky reaktivace trimedoxim (2) a obidoxim (4). Vyšší toxicita trimedoximu i obidoximu vzhledem dalším komerčním reaktivátorům (např. HI-6) byla však dříve dokázána 21).
Ve skupině nově připravených sloučenin dosáhly nejlepší in vitro reaktivace při koncentraci 10-5 M sloučeniny 8 a 9. Kromě látky 7 bylo při této koncentraci u všech nových sloučenin dosaženo reaktivace vyšší než 10 %. To je základní předpoklad pro postoupení těchto sloučenin dalšímu testování. Pro koncentraci 10-3 M bylo u všech nových reaktivátorů dosaženo reaktivace překračující 50 %.
Při srovnání obou skupin je patrné, že nově připravené reaktivátory mají lepší reaktivační účinnost ve srovnání s dnes používanými standardy. Sloučeniny 8 a 9 se svou reaktivační účinností vyrovnaly trimedoximu (2) a překonali obidoxim (3). Reaktivátory 6 a 10 předčily pralidoxim (1) HI-6 (4) a methoxim (5), avšak svou reaktivační účinnosti se nevyrovnaly obidoximu (2) a trimedoximu (3). Světově nejpoužívanější reaktivátor pralidoxim je pro reaktivaci paraoxonem inhibované AChE nevhodný 22, 23).
Reaktivační účinnost oximových reaktivátorů je závislá na několika strukturních motivech. Je to počet kvarterních pyridinových dusíků, počet a poloha oximových skupin, délka spojovacího řetězce a přítomnost π elektronů ve spojovacím řetězci 12).
Při srovnání monokvarterních a biskvarterních reaktivátorů dosahují lepších výsledků biskvarterní reaktivátory 24). Jejich průchod přes hematoencefalickou bariéru je však omezený 25–27). Pro účinnost reaktivátoru je dále zásadní alespoň jedna oximová skupina v poloze 2 nebo 4 na pyridiniovém jádru 28). Optimum pro délku uhlíkatého spojovacího řetězce leží v rozmezí 3–4 methylenových jednotek. Zavedením jiného strukturního motivu nesoucího volné elektronové páry (např. heteroatom) nebo π elektrony (např. dvojná vazba) dochází ke změnám vlastností reaktivátoru 12). Tyto změny mohou být způsobeny interakcí elektronů se zbytky aminokyselin v aktivním místě AChE 29).
Závěr
Při porovnání výsledků reaktivační účinnosti proti paraoxonem inhibované AChE se komerčně dostupné reaktivátory jeví jako méně vhodné ve srovnání s reaktivátory testovanými v této práci. S výjimkou trimedoximu převyšují nové reaktivátory komerčně dostupné sloučeniny zejména při koncentraci 10-5 M, která je dosažitelná také in vivo.
Adresa pro korespondenci:
PharmDr. Kamil Musílek, Ph.D.
Fakulta vojenského zdravotnictví Univerzity obrany – Katedra toxikologie
Třebešská 1575, 500 01 Hradec Králové
e-mail: musilek@pmfhk.cz
Sources
1. Bajgar, J.: Organophosphates/nerve agent poisoning: mechanism of action, diagnosis, prophylaxis, and treatment. Adv. Clin. Chem., 2004; 38, 151–216.
2. Marrs, T. C.: Organophosphate poisoning. Pharmacol. Therapeut., 1993; 58, 51–66.
3. Patocka, J., Kuca, K., Jun D.: Acetylcholinesterase and butyrylcholinesterase – important enzymes of human body. Acta Medica, 2004; 47, 215–228.
4. Satoh, T., Hosokawa, M.: Organophosphates and their impact on the global environment. Neurotoxicol., 2000; 21, 223–227.
5. Francotte, P., Graindorge, E., Boverie, S., de Tullio, P., Pirotte B.: Curr. Med. Chem., 2004; 11, 1757–1778.
6. Marklund, A., Andersson, B., Haglund, P.: Organophosphorus flame retardants and plasticizers in air from various indoor environments. J. Environ. Monit., 2005; 7, 814–819.
7. Tattersall, J.: Seizure activity post organophosphate exposure. Front. Biosci., 2009; 14, 3688-3711.
8. Patocka, J.: Vojenská toxikologie. 1. vyd. Praha: Grada Publishing a.s., 2004; 180.
9. Bajgar, J., Fusek, J., Kuca, K., Bartosova, L., Jun, D.: Treatment of organophosphate intoxication using cholinesterase reactivators: facts and fiction. Mini-Rev. Med. Chem., 2007; 7, 461–466.
10. Newmark, J.: Nerve agents. Neurologist, 2007; 13, 20–32.
11. Saxena, A., Sun, W., Luo, C., Myers, T. M., Koplovitz, I., Lenz, D. E., Doctor, B. P.: Bioscavenger for protection from toxicity of organophosphorus compounds. J. Mol. Neurosci., 2006; 30, 145–148.
12. Kuca, K., Jun, D., Musilek, K.: Structural requirements of acetylcholinesterase reactivators. Mini-Rev. Med. Chem., 2006; 3, 269–277.
13. Poziomek, E. J., Hackley, B. E., Steinberg, G. M.: Pyridinium aldoximes. J. Org. Chem., 1958; 23, 714–717.
14. Kuca, K., Jun, D., Musilek, K. Bajgar, J.: Reactivators of tabun-inhibited acetylcholinesterase: Structure-biological activity relationship. Front. Drug. Des. Discov., 2007; 3, 381–394.
15. Ekstrom, F., Pang, Y. P., Boman, M., Artursson, E., Akfur, C., Borjegren, S.: Crystal structures of acetylcholinesterase in complex with HI-6, Ortho-7 and obidoxime: structural basis for differences in the ability to reactivate tabun conjugates. Biochem. Pharmacol., 2006; 72, 597–607.
16. Ekstrom, F., Akfur, C., Tunemalm, A. K., Lundberg, S.: Structural changes of phenylalanine 338 and histidine 447 revealed by the crystal structures of tabun-inhibited murine acetylcholinesterase. Biochemistry, 2006; 45, 74–81.
17. Eddelston, M., Dawson, A. H., Buckley, N. A.: Management of acute organophosphorus pesticide poisoning. Lancet, 2008; 371, 597–607.
18. Tattersall, J. E.: Ion channel blockade by oximes and recovery of diaphragm muscle from soman poisoning in vitro. Br. J. Pharmacol., 1993; 108, 1006–1015.
19. Kuca, K., Cabal, J., Musilek, K., Jun, D., Bajgar, J.: Effective bisquaternary reactivators of tabun-inhibited AChE. J. Appl. Toxicol., 2005; 25, 491–495.
20. Musilek, K., Holas, O., Kuca, K., Jun, D., Dohnal, V., Dolezal, M.: Synthesis of asymmetrical bispyridinium compounds bearing cyano-moiety and evaluation of their reactivation activity against tabun and paraoxon-inhibited acetylcholinesterase. Bioorg. Med. Chem. Lett., 2006; 16, 5673–5676.
21. Bartosova, L., Kuca, K., Kunesova, G., Jun, D.: The acute toxicity of acetylcholinesterase reactivators in mice in relation to their structure. Neurotox. Res., 2006; 9, 291–296.
22. Worek, F., Thiermann, H., Szinicz, L., Eyer, P.: Kinetic analysis of interactions between human acetylcholinesterase, structurally different organophosphorus compounds and oximes. Biochem. Pharmacol., 2004; 68, 2237–2248.
23. Racakova, V., Jun, D., Opletalova, V., Kuca, K.: Reactivation of acetycholinesterase inhibited by the pesticide chlorpyrifos. J. Appl. Biomed., 2006; 4, 147–151.
24. Musilek, K., Holas, O., Kuca, K., Jun, D., Dohnal, V., Opletalova, V., Dolezal, M.: Novel series of bispyridinium compounds bearing a (Z)-but-2-ene linker—synthesis and evaluation of their reactivation activity against tabun and paraoxon-inhibited acetylcholinesterase. Bioorg. Med. Chem. Lett., 2007; 17, 3172–3176.
25. Sakurada, K., Matsubara, K., Shimizu, K., Shiono, H., Seto, Y., Tsuge, K., Yoshino, M., Sakai, I., Mukoyama, H., Takatori, T.: Pralidoxime iodide (2-pAM) penetrates across the blood-brain barrier. Neurochem. Res., 2003; 28, 1401–1407.
26. Okuno, S., Sakurada, K., Ohta, H., Ikegaya, H., Kazui, Y., Akutsu, T., Takatori, T., Iwadate, K.: Blood-brain barrier penetration of novel pyridinealdoxime methiodide (PAM)-type oximes examined by brain microdialysis with LC-MS/MS. Toxicol. Appl. Pharmacol., 2008; 227, 8–15.
27. Lorke, D. E., Hasan, M. Y., Nurulain, S. M., Sheen, R., Kuca, K., Petroianu, G. A.: Entry of two new asymmetric bispyridinium oximes (K-27 and K-48) into the rat brain: comparison with obidoxime. J. Appl. Toxicol., 2007; 27, 482–490.
28. Kuca, K., Patocka, J.: Reactivation of cyclosarin-inhibited rat brain acetylcholinesterase by pyridinium-oximes. J. Enzym. Inhib. Med. Chem., 2004; 19, 19–22.
29. Musilek, K., Holas, O., Kuca K., Jun D., Dohnal, V., Opletalova, V., Dolezal, M.: Synthesis of a novel series of non-symmetrical bispyridinium compounds bearing a xylene linker and evaluation of their reactivation activity against tabun and paraoxon-inhibited acetylcholinesterase. J. Enzym. Inhib. Med. Chem., 2007; 22, 425–432.
Labels
Pharmacy Clinical pharmacology
Article was published inCzech and Slovak Pharmacy

2010 Issue 1-
All articles in this issue
- K obsahu národní části Českého lékopisu 2009
- Současné přístupy k farmakoterapii – farmaceutická péče nebo management léků?
- Hodnocení reaktivační účinnosti vybranných reaktivátorů paraoxonem inhibované acetylcholinesterasy in vitro
- Štúdium lokálnych anestetík – časť 191* Optimalizácia zloženia hydrogélov z hľadiska tokových vlastností pre trimekaín a terbinafín
- Příprava a hodnocení hydrofilního krému s propolisovým extraktem
- Spotřeba betablokátorů (ATC C07) se zřetelem na vliv reformy zdravotnictví v roce 1992 na dostupnost léků
- Czech and Slovak Pharmacy
- Journal archive
- Current issue
- Online only
- About the journal
Most read in this issue- K obsahu národní části Českého lékopisu 2009
- Současné přístupy k farmakoterapii – farmaceutická péče nebo management léků?
- Příprava a hodnocení hydrofilního krému s propolisovým extraktem
- Spotřeba betablokátorů (ATC C07) se zřetelem na vliv reformy zdravotnictví v roce 1992 na dostupnost léků
Login#ADS_BOTTOM_SCRIPTS#Forgotten passwordEnter the email address that you registered with. We will send you instructions on how to set a new password.
- Career


