-
Medical journals
- Career
Polosyntetické deriváty celulosy jako základ hydrofilních gelových systémů
Authors: Marika Bajerová 1; J. Gajdziok 1; K. Dvořáčková 1; R. Masteiková 1; P. Kollár 2
Authors‘ workplace: Veterinární a farmaceutická univerzita Brno, Farmaceutická fakulta, Ústav technologie léků 1; Veterinární a farmaceutická univerzita Brno, Farmaceutická fakulta, Ústav humánní farmakologie a toxikologie 2
Published in: Čes. slov. Farm., 2008; 57, 63-69
Category: Review Articles
Overview
V oblasti technologie léků nachází rozsáhlé uplatnění gelové systémy vysokomolekulárních látek, které mají řadu výhod, jako jsou nízká toxicita, dostupnost, ojedinělé fyzikální vlastnosti, biokompatibilita, mukoadhezivita a další. Gelové systémy se používají v oblasti lokální i celkové terapie, v tvarově specifických i tvarově nespecifických lékových formách, v lécích první, druhé i třetí generace. Významnou skupinu gelů, které se používají v oblasti farmacie, tvoří gely hydrofilní, neboli hydrogely, tvořené nejčastěji hydrofilními polymery přírodního, polosyntetického a syntetického původu. Přestože celulosové deriváty jako představitelé polymerů polosyntetického původu se uplatňují ve farmaceutické technologii po dlouhou dobu, v jejich výzkumu se neustává a hledají se další možnosti jejich uplatnění. Mezi jejich přednosti patří zejména bezpečnost, snadná dostupnost a relativně nízká cena. Přehledový článek popisuje vybrané celulosové deriváty, jejich vlastnosti a využití ve farmaceutické technologii se zaměřením na uplatnění v oblasti tvorby gelových systémů.
Klíčová slova:
hydrogel – řízené uvolňování léčiva – celulosové deriváty – oxycelulosaHydrofilní gely se díky svým bioadhezivním, transportním a depotním vlastnostem využívají nejen v systémech s konvenčním, ale i řízeným uvolňováním léčivých látek. Mnohé z nich jsou ve fázi preklinického výzkumu nebo klinického zkoušení, řada z nich se již používá v klinické praxi. Hydrofilní gelové systémy se používají při oční, nosní, vaginální a dermální aplikaci. Jejich potenciální využití je však mnohem širší a zahrnuje také aplikaci rektální, perorální, injekční, transdermální aj 1).
Hydrofilní polymerní gely jsou trojrozměrné složené systémy tvořené propletenou polymerní sítí a v ní inkorporovanou kapalinou, charakterizované bikoherentní povahou a fyzikální integritou. Spojité je tedy nejen disperzní prostředí, ale i dispergovaná fáze. Díky vysokému obsahu vody vykazují tyto materiály výbornou biokompatibilitu. Interakce vody s těmito polymery a její distribuce uvnitř polymerního systému jsou podstatné pro mechanickou odolnost gelu a také jejich schopnost řídit uvolňování léčivé látky 2). Lze je dělit na základě různých kritérií:
1. Podle typu zesíťování (obr. 1)
Image 1. Mikrostruktura gelů 9) 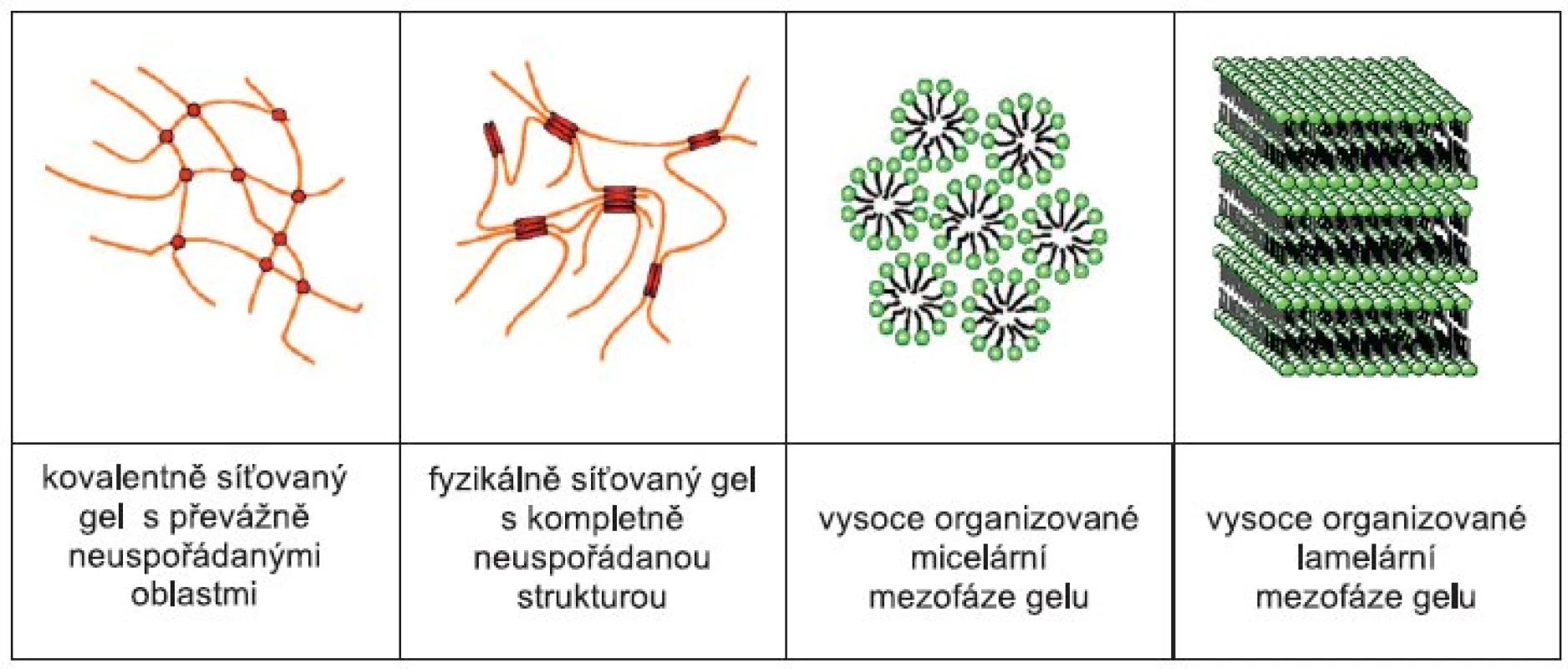
- kovalentní gely – vznikají na podkladě chemických vazeb, jedná se o systémy ireverzibilní, tzn., že nemohou přecházet zpět na roztok polymeru. Tyto hydrogely jsou tvořené převážně syntetickými hydrofilními polymery. Přidáním vhodných síťovacích činidel lze vytvořit také gely z přírodních polymerů 3, 4);
- fyzikálně síťované gely – vznikají spojováním úseků polymerních řetězců v roztoku mezimolekulárním působením fyzikálních sil (Van der Walsových, dipolárních, vodíkových vazeb) nebo vzájemným propletením jednotlivých řetězců polymeru. Jsou to systémy reverzibilní, tzn., vznikne-li gel z roztoku polymeru v důsledku změny podmínek (teploty, pH, elektrického nebo magnetického pole, přídavku elektrolytu), může být ztekucen v opačném směru. Hovoříme o tzv. přechodu sol-gel. Tyto gely jsou tvořeny přírodními polymery, polosyntetickými deriváty celulosy a některými syntetickými hydrofilními polymery 5–8);
- vysoce organizované gely – některé tenzidy a jejich směsi vytváří ve vodě s dlouhými řetězci mastných alkoholů vysoce uspořádané lamelární, kubické, hexagonální a micelární struktury 4).
2. Podle počtu fází
- jednofázové gely – vznikají z přírodních, polosyntetických nebo syntetických polymerů interakcí s vhodnou kapalinou. Ve farmaceutických gelech jde nejčastěji o vodu nebo směs vody s ethanolem nebo jinými alkoholy;
- dvoufázové gely – neboli gely anorganické jsou trojrozměrné systémy tvořené jednotlivými pevnými částicemi koloidní velikosti dispergovanými v kapalině.
3. Podle obsahu disperzního prostředí
- lyogely – systém, který obsahuje disperzní prostředí i dispergovaný podíl;
- xerogely – systém obsahující pouze zesíťovaný dispergovaný podíl, vzniká vysušením lyogelu, tj. odstraněním disperzního prostředí. Xerogely vznikající z reverzibilních lyogelů, jsou kompaktní a bobtnáním se mohou vrátit do původního stavu 10);
- aerogely – odpařením kapalné složky z gelu za nadkritické teploty a tlaku se získá aerogel, který je charakterizován mimořádně nízkou hustotou, pevností a vynikající tepelně izolačními vlastnostmi 11).
4. Podle chování ve vysušeném stavu
- reverzibilní gely – po vysušení zmenšují svůj objem a poskytují kompaktní xerogely. Mohou bobtnat a přecházet zpět do původního stavu přijímáním disperzního prostředí. Příkladem jsou makromolekulární gely, např. gel tragantu;
- ireverzibilní gely – ve vysušeném stavu jsou přibližně objemově stejné jako původní lyogely, avšak pórovité. Jsou sice schopné určité množství kapaliny absorbovat, ale lyogel tím nevzniká. Přeměna ireverzibilního gelu na xerogel je tedy nevratná. Příkladem může být škrobový hydrogel.
Často využívanými látkami pro tvorbu hydrofilních gelových systémů jsou deriváty celulosy. Tvoří jednofázové fyzikálně síťované gely, patří tedy mezi systémy reverzibilní. Mezi ně můžeme zařadit některé ethery celulosy, které vznikají cílenou alkylací hydroxyskupin nativní celulosy, a stávají se tak rozpustnými. Jsou to methyl - (MC), hydroxyethyl - (HEC), hydroxypropyl - (HPC), hydroxypropylmethyl - (HPMC) celulosa a karmelosa sodná sůl (NaCMC). Jednotlivé produkty se liší způsobem alkylace, stupněm substituce a stupněm polymerizace, který se projevuje v průměrné molekulové hmotnosti. Společnou vlastností celulosových derivátů je mukoadhezivita. Terapeutické výhody mukoadhezivních systémů spočívají v možnosti umístit je na určitou dobu na aplikačním místě, kde je absorpce upřednostňována, a dosáhnout rychlého vstřebání léčiva díky přímému kontaktu se sliznicí. Obecně platí, že ve srovnání neiontovými deriváty jsou iontové deriváty lepšími mukoadhezivity. Z etherů celulosy se používá sodná sůl karmelosy, hypromelosa a hydroxypropylcelulosa 12). U některých celulosových derivátů se setkáváme s převrácenou termoreverzibilitou, kdy se gel vytváří s rostoucí teplotou, např. u methylcelulosy a hypromelosy. Převrácená termoreverzibilita je důkazem gelové mikrostruktury, která je způsobená hydrofobnímí interakcemi mezi dehydratovanými molekulami obsahujícími methoxylové skupiny 13, 14).
Mezi deriváty celulosy se řadí i oxycelulosa, která vzniká oxidací celulosy. Tento derivát není, na rozdíl od výše zmíněných látek, ve farmaceutické praxi zcela běžně používanou látkou.
Methylcelulosa (Methocel®, Metolose®, Tylose® SL)
Strukturní vzorec methylcelulosy (MC) ukazuje obrázek 2. Jedná se o nejčastěji používanou gelotvornou látku. MC je po chemické stránce částečně O-methylovaná celulosa. Průměrná molekulová hmotnost se pohybuje v rozmezí 10–220 kDa.
Image 2. Strukturní vzorec methylcelulosy 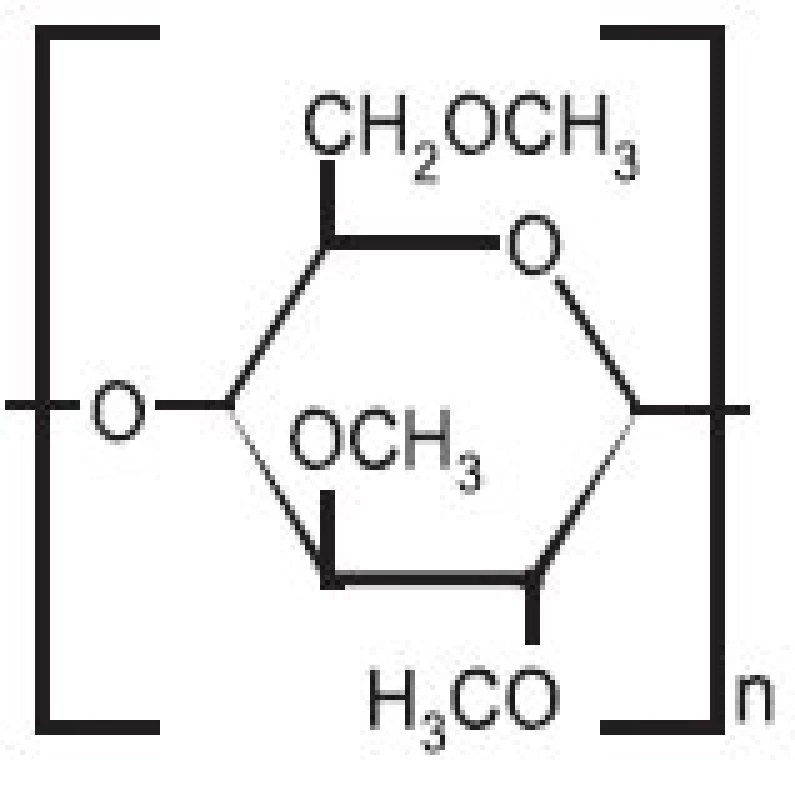
MC obsahuje asi 27–32 % hydroxylových skupin, které jsou ve formě methyletheru. Je prakticky nerozpustná v horké vodě, acetonu, v bezvodém ethanolu a toluenu. Rozpouští se ve studené vodě za vzniku koloidního roztoku. Zahříváním roztoku MC dochází k vytvoření gelové struktury jako výsledek fázové separace. Bod gelace pro MC leží mezi 50–90 °C a lze ho snížit přidáním sacharosy nebo elektrolytů, čímž dojde k redukci hydratace polymerních řetězců Disperze s obsahem MC do 2 % mají charakter slizů, s obsahem okolo 6 % mají charakter gelů 15).
MC je v různých koncentracích široce používanou pomocnou látkou v perorálních i topických přípravcích. MC patří mezi povrchově aktivní látky, které zvyšují viskozitu disperzního prostředí. Tato vlastnost se využívá při stabilizaci emulzí a suspenzí, na úpravu viskozity očních kapek 7). MC s nízkým a středním viskozitním stupněm plní funkci pojiva tablet (přidává se ve formě roztoku nebo prášku), vyšší viskozitní stupeň se pak využívá v topických přípravcích – gelech a krémech – a také jako rozvolňovadlo tablet. Methylcelulosové gely se používají k ošetření popálené tkáně, protože snižují ztráty tekutin a jsou snadno odstranitelné 4). Hydrogely na bázi MC se používají jako nosiče pro systémový přívod léčiv pomocí sonoforézy. Systém se použil pro transport insulinu a vasopresinu – látek polypeptidové povahy v podmínkách in vitro. Z výsledků vyplývá, že použitá metoda přispěla ke zvýšené prostupnosti těchto látek přes kůži 16). Ve fázi výzkumu je také hydrogel na bázi MC s obsahem prostaglandinu E2, který se používá k indukci porodu u žen v termínu 17). MC se využívá při formulaci aktivních mikrosfér připravených koacervačními technikami. Stěna mikročástic se pak následně stabilizuje zesíťováním glutaraldehydem 18). Polymer se používá jako pomocná látka řídící uvolňování léčivé látky v hydrofilních matricových tabletách. Po hydrataci v disolučním médiu vytváří řídící gelovou vrstvu. Roztoky MC se používají pro obalování tablet, kde maskují nepříjemnou chuť léčivé látky a izolují jádra před dražováním 19).
Hydroxypropylcelulosa (Klucel®, Methocel®, Nisso® HPC)
Strukturní vzorec hydroxypropylcelulosy (HPC) ukazuje obrázek 3. Je to částečně O-(2-hydroxypropylovaná) celulosa. Jedná se o inertní, netoxický, neiontový polymer, jehož průměrná molekulová hmotnost se pohybuje v rozmezí 50–1250 kDa. Komerčně je HPC dostupná v různých substitučních stupních charakterizovaných odlišnou viskozitou jejich roztoků 20). Viskozita roztoku klesá s rostoucí teplotou.
Image 3. Strukturní vzorec hydroxypropylcelulosy 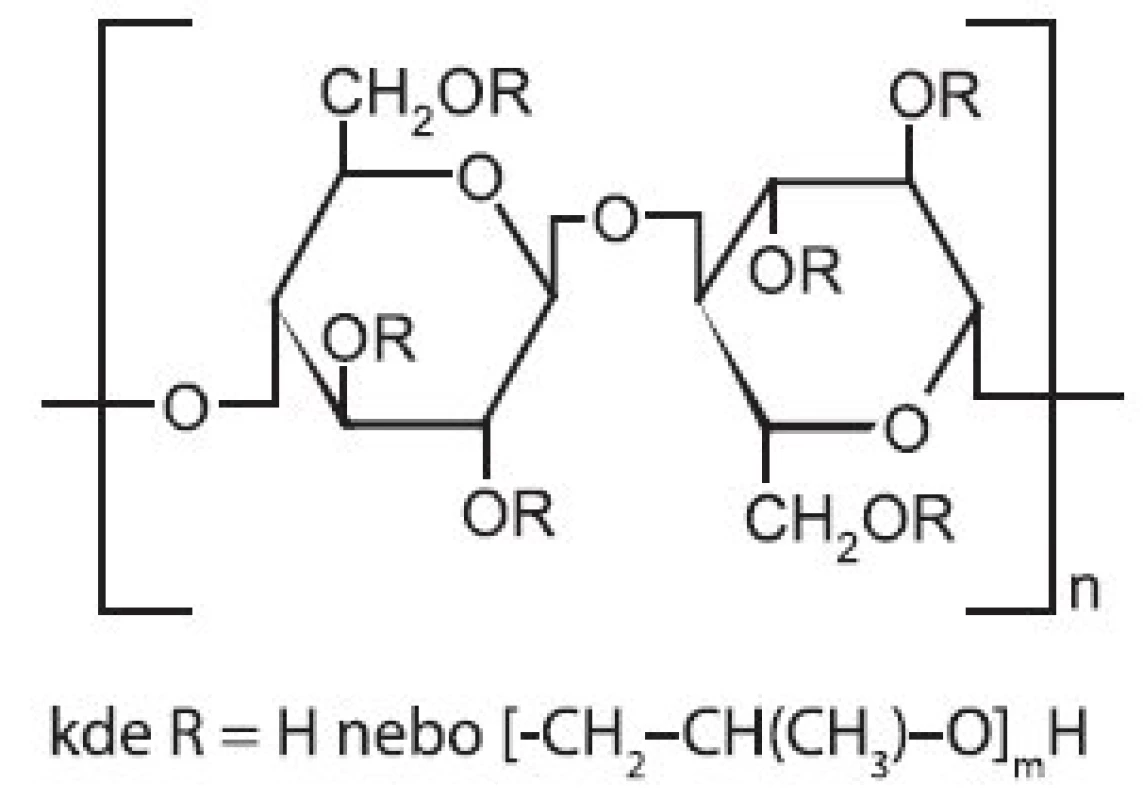
HPC se snadno rozpouští ve vodě pod 38 °C, kde vytváří průhledný, koloidní roztok. Dobře se rozpouští v celé řadě organických rozpouštědel, jako je například methanol, ethanol, propylenglykol, dimethylsulfoxid, dioxan a další. V horké vodě se nerozpouští. Vodné roztoky HPC jsou stabilní při pH 6,0–8,0 21). K tvorbě gelu dochází srážením při teplotě 40–45 °C 22). Srážení je reverzibilní a polymer se může znovu rozpustit pod teplotou 40 °C. Přítomnost solí a organických látek v roztoku může snižovat teplotu, při které dochází ke srážení 21).
HPC se používá jako pomocná látka při formulaci topických a perorálních lékových forem 22). U perorálních léků se používá jako pojivo pro vlhkou granulaci i přímé lisování (v koncentraci 2–6 %), filmotvorná látka a jako nosný polymer pro matricové systémy s prodlouženým uvolňováním léčivé látky (v koncentraci 15–35 %). Rychlost uvolňování závisí na viskozitě vytvořeného gelu. Dalším příkladem mohou být matricové tablety s řízenou rozpadavostí, kde se HPC používá jako rozvolňovadlo. Tento systém je vhodný zejména pro léčiva se špatnou rozpustností ve vodě 23). HPC vykazuje bioadhezivní vlastnosti, kterých se využívá při formulaci bukálních nebo sublinguálních tablet. Příkladem mohou být bukální tablety s obsahem HPC, Carbopolu® 943 a nikotinu pro substituční terapii 24, 25). Pro lokální terapii aftů v dutině ústní jsou na trhu dostupné bioadhezivní tablety Aftach®, které obsahují kromě HPC také kyselinu polyakrylovou a účinnou látku triamcinolon 16). Bioadhezivních vlastností HPC se využívá také při formulaci vaginálních tablet s antimykotickým účinkem 26). HPC našla uplatnění také jako stabilizátor emulzních systémů při přípravě mikročástic koacervační metodou 27). Dále se používá na zvyšování viskozity topických a očních léků a jako pomocná látka v transdermálních systémech 29). Na trhu je dostupný biodegradovatelný oční inzert na bázi hydroxypropylcelulosy – Lacrisert®, který má lubrikační a ochranné účinky. Je indikován u syndromů suchého oka a zánětů rohovky 28).
Hypromelosa (Methocel®, Metolose®, Pharmacoat®)
Strukturní vzorec je na obrázku 4. Chemicky se jedná o částečně O-methylovanou a O-(2-hydroxyethylovanou) celulosu. Jde o neiontový polymer s průměrnou molekulovou hmotností v rozmezí 10–1500 kDa. Na základě svých vlastností, jako jsou stupeň substituce, poměr methoxyl - a hydroxypropyl - skupin, stupeň polymerizace a z toho plynoucí molekulová hmotnost a viskozita, se rozlišují tři skupiny označené E, F a K 29).
Image 4. Strukturní vzorec hypromelosy 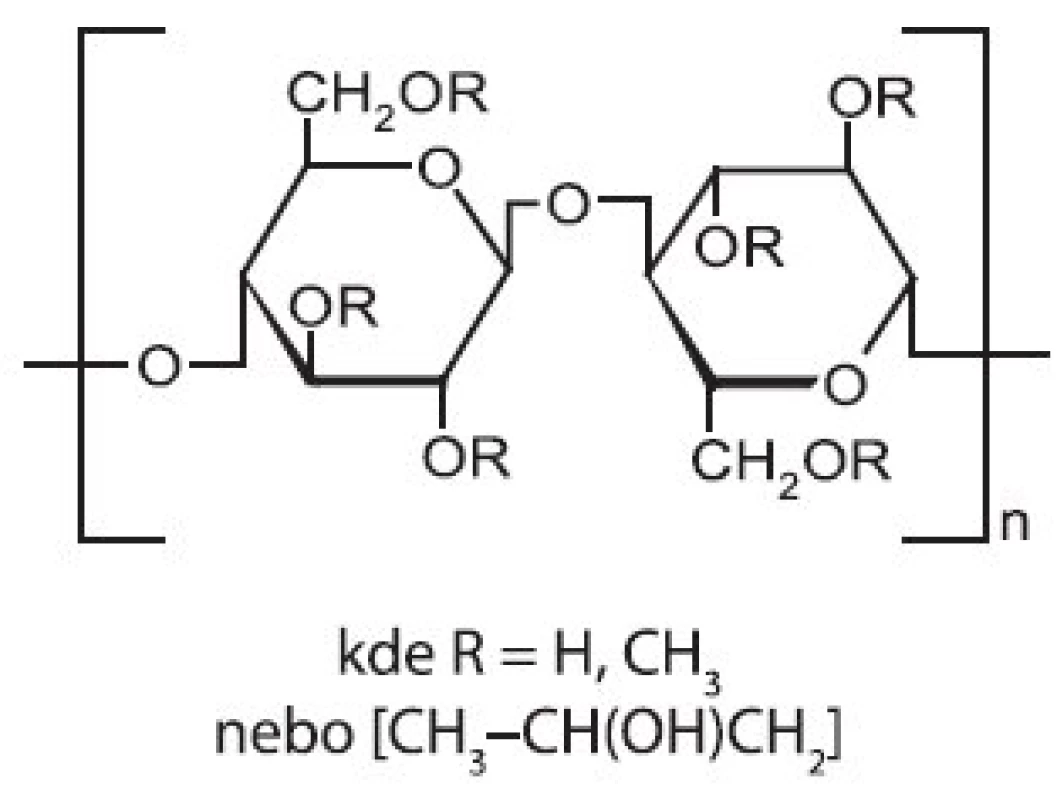
Řetězce HPMC ve studené vodě velmi rychle hydratují a rozpouštějí se za vzniku koloidního roztoku. Je prakticky nerozpustná v horké vodě, v acetonu, v bezvodém ethanolu a toluenu. Roztoky jsou stálé při pH 3–11, odolné vůči působení enzymů, citlivé na mikrobiální kontaminaci. Se zvyšující se teplotou se snižuje viskozita roztoku.
HPMC vytváří stabilní gely, které snižují rychlost uvolňování léčivých látek ve srovnání s ostatními celulosovými deriváty, jako jsou HPC, HEC, MC apod. 19). Pro tvorbu gelu je vhodná koncentrace 4) 2–10 %. V závislosti na typu a koncentraci polymeru leží bod gelace v intervalu 50–90 °C 20). Přidáním ethanolu nebo glykolů bod gelace vzrůstá.Snížením substituce hydroxypropyl - skupinou lze dosáhnout snížení bodu gelace na teplotu kolem 40 °C, což je teplota blízká teplotě lidského těla. HPMC vykazuje převrácenou termoreverzibilitu, k přechodu sol-gel dochází zahříváním. Přechodu sol-gel HPMC lze využít při formulaci gelových systémů in situ. Příkladem jsou tzv. tekuté čípky. Rektálně se pacientovi podá koloidní sol, který při teplotě lidského těla zgelovatí. Aplikace takového systému je pro pacienta příjemnější, snižuje se dráždění rekta a uvolňování léčiva probíhá řízeně. Rektální aplikace gelů se jeví perspektivní pro přívod léčiv proteinové povahy, např. insulinu 30). Roztoky a gely HPMC jsou vysoce transparentní, proto jsou vhodné k použití v očním lékařství. HPMC bývá součástí filmotvorných přípravků nahrazujících nedostatečnou sekreci slz, které se používají k léčbě syndromu suchého oka. V koncentraci 0,45–1,0 % se využívá na zvýšení viskozity očních a ušních kapek 25). Gely na bázi HPMC tvoří základ celé řady topických adhezivních léčivých přípravků s obsahem např. lokálních anestetik, antibiotik, nesteroidních antiflogistik, které mohou být kombinovány s urychlovači absorpce 31, 32).
Hypromelosa nachází uplatnění v perorálních, kožních, očních, ale i vaginálních lécích. Velmi často se využívá jako mukoadhezivní polymer při formulaci lékových forem s cílem prodloužit kontaktní čas se sliznicí, a tím zvýšit biologickou dostupnost léčivé látky 31). Příkladem je vaginální inzert s obsahem HPMC pro řízené uvolňování antimykotika klotrimazolu nebo mukoadhezivní orální tablety na bázi HPMC s obsahem antimykotika nystatinu navržené k léčbě kandidóz dutiny ústní 17, 34). Novinkou v klinické praxi jsou pak vaginální tampony připravené z polosyntetických glyceridů a HPMC určené k přívodu bifosfonátů pro léčbu osteoporózy u žen v menopauze 17). U perorálních léků se uplatňuje jako pojivo (při suché i vlhké granulaci) 2–5 %, filmotvorná látka 2–20 %. HPMC patří mezi nejčastěji používané polymerní látky pro tvorbu gelových matric 35). Ve fázi výzkumu je možnost nahrazení stěny měkkých tobolek doposud vytvářených na bázi želatiny materiálem tvořeným kombinací hypromelosy a carragenu 36).
Karmelosa sodná sůl (Akucell®, Finnfix®, Nymcel®, Tylose® CB)
Strukturní vzorec je na obrázku 5. Chemicky se jedná o sodnou sůl částečně O-karboxymethylované celulosy. Jedná se o aniontový lineární polymer s molekulovou hmotností v rozmezí 90–700 kDa.Stupeň substituce a délka molekuly určují rozpustnost NaCMC, viskozitu a pevnost jejich gelů. Pro farmaceutické účely se využívá NaCMC se substitučním stupněm 0,7 19).
Image 5. Strukturní vzorec sodné soli karmelosy 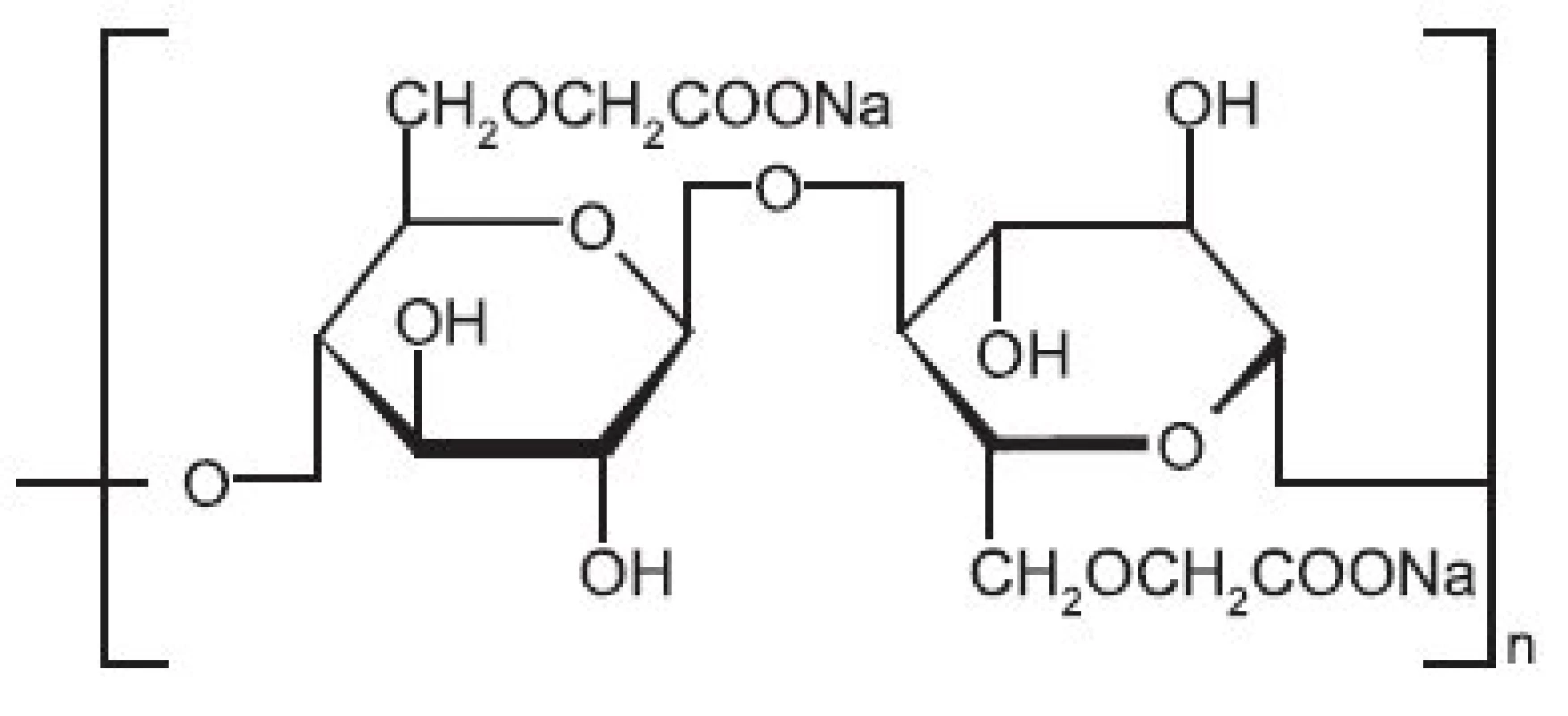
Je rozpustná ve studené i teplé vodě za vzniku koloidních roztoků, prakticky nerozpustná v acetonu. Rozpouští se ve směsi vody s nižšími alkoholy a glycerolem 4). Po vysušení tvoří čiré filmy, které jsou po přidání změkčovadel (glycerol, propylenglykol) pružné 29). S rostoucí molekulovou hmotností vzrůstá při stejné koncentraci polymeru viskozita roztoku. Vodné roztoky jsou stabilní v širokém rozmezí pH 2–10 a také v širokém rozmezí teplot 10–130 °C, maximální stabilita a viskozita je při pH 7 37). Při nižším pH než 2 dochází k vysrážení a při pH > 10 se viskozita roztoku prudce snižuje 19, 21). Změna viskozity může nastat jako důsledek depolymerizace vyvolané růstem mikroorganismů, důležitá je proto přísada protimikrobních látek. Díky své aniontové povaze je NaCMC inkompatibilní s kationtovými látkami a s vícemocnými ionty tvoří nerozpustné soli 15).
Vznik gelů je závislý na koncentraci NaCMC 37). Vhodná koncentrace pro vytvoření gelů je 10–25 %. Pevnost gelu se může zvýšit přidáním vícemocných kationtů, jako například Al3+ nebo Fe2+, výsledkem je vznik iontových můstků mezi kationty a záporně nabitými karboxylovými skupinami. Tyto gely nejsou trvale stabilní 4).
Karmelosa sodná sůl se používá ke stabilizaci emulzí, suspenzí a jako látka zvyšující viskozitu perorálních, parenterálních a topických přípravků. Dále se používá jako pojivo nebo v zesíťované formě jako rozvolňovadlo (kroskarmelosa sodná sůl) perorálních lékových forem. Další využití nachází jako základ gelových matric, ve kterých se používá buď samostatně, nebo v kombinaci s hypromelosou 19). Sliz sodné soli karmelosy se používá na úpravu viskozity očních kapek 15). Gely NaCMC v koncentraci 10–15 % se používají jako základy pro dermální aplikaci léčivých látek. Pro svou stálost v kyselém prostředí se může NaCMC použít pro formulaci vaginálních gelů. Předmětem intenzivního zkoumání jsou NaCMC gely jako nosiče léčiv typu polypeptidů. Příkladem je podávání inzulínu ve formě náplastí určené k aplikaci na střevní sliznici s využitím mukoadhezivních polymerů – sodné soli karmelosy, pektinu a karbomeru. Náplast tvořená matricí s rovnoměrně rozptýlenou léčivou látkou je obalená ze tří stran nerozpustnou ethylcelulosou. Léčivo je do biosystému přiváděno neobalenou stranou matrice, kterou současně přilne ke sliznici GIT 38). Gely na bázi NaCMC se použily jako vehikulum pro rekombinantní růstový faktor pro léčbu špatně se hojících diabetických vředů 4). Výzkum se také zaměřuje na bioadhezivní nosní inzerty 39).
Hyetelosa (Cellosize® HEC, Natrosol®, Tylose® PHA)
Strukturní vzorec je na obrázku 6. Jedná se částečně O-(2-hydroxyethylovanou) celulosu. HEC je dostupná v několika stupních lišících viskozitou vodných roztoků. Jde o neiontový polymer s molekulovou hmotností okolo 120 kDa 40). Je rozpustná v horké i ve studené vodě za tvorby koloidního roztoku. Tento roztok vykazuje vysokou viskozitu a pseudoplastické chování, které závisí na molekulové hmotnosti HEC 41). Roztoky HEC jsou stálé v širokém rozmezí pH 2–12 a jejich viskozita se zvyšuje se snižující se teplotou 42).
Image 6. Strukturní vzorec hyetelosy 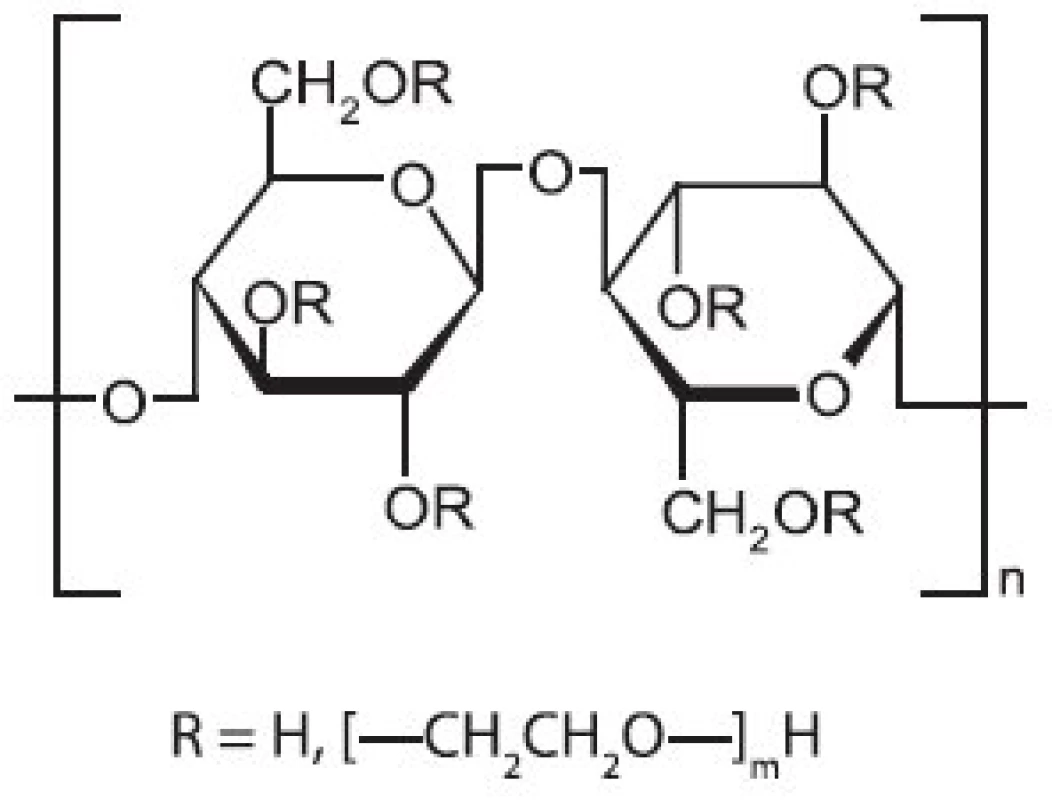
Pro zachování stability se přidávají protimikrobní konzervační látky 3). Díky své neiontové povaze je kompatibilní s ostatními ve vodě rozpustnými polymery, povrchově aktivními látkami a solemi 43).
Zvyšuje viskozitu očních kapek a topických přípravků, používá se také jako pojivo, stabilizující a suspendující pomocná látka, ochranný koloid a filmotvorná látka při výrobě tablet 42). V koncentraci 10 až 15 % vytváří roztíratelné gely, které vykazují bioadhezivní vlastnosti. S rostoucí koncentrací HEC vzrůstá adhezivita i pevnost gelu 25, 44). HEC je součástí očních kapek, které se používají při léčbě syndromu „suchého oka“ způsobeného nedostatkem tvorby slzného filmu. Gely HEC v kombinaci se syntetickým polymerem Carbopolem® se zkoumaly jako potenciální nosiče lipozomů pro vaginální aplikaci léčiv 45). Do klinické praxe se zavádí nová skupina léčiv – mikrobicidy, které zabíjejí nebo blokují HIV virus či další sexuálně přenosné patogeny. Jako základy pro přívod mikrobicidů se používá řada polymerních gelů mezi nimi např. i hydroxyethylcelulosové gely 46). HEC se využívá také při formulaci hydrofilních gelových matric s prodlouženým uvolňováním léčivé látky 44, 47).Ve fázi výzkumu jsou matricové tablety na bázi HEC pro perorální podání heparinu. Pro zvýšení vstřebatelnosti se použil proteolytický enzym papain. Přiin vivotestech se prokázalo zvýšení biodostupnosti takto podaného heparinu o 6,5 %, přesto ve srovnání se subkutánním podáním zůstala biologická dostupnost heparinu nízká 48).
Oxycelulosa
Strukturní vzorec je na obrázku 7. Oxidovaná celulosa je produkt oxidace a degradace přírodní či regenerované celulosy, např. viskosy. Celulosu lze oxidovat různými oxidačními činidly např. oxidem dusičitým, pomocí volných nitroxylových radikálů (tzv. TEMPO oxidací), kyselinou jodistou a další 49–51).
Image 7. Strukturní vzorec oxycelulosy 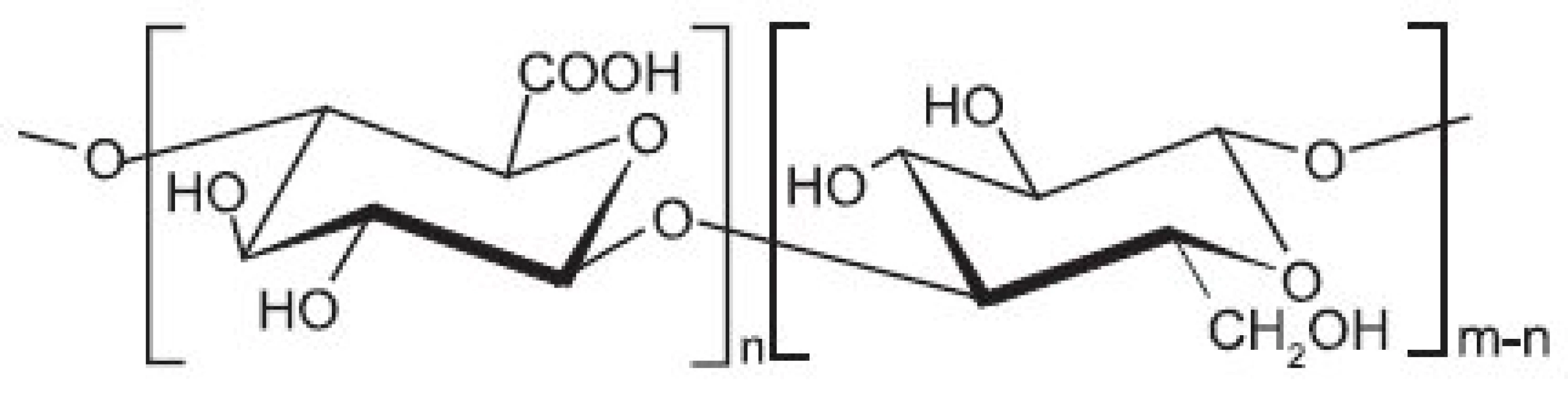
Oxidovaná celulosa je biokompatibilní, bioresorbovatelný a biodegradovatelný materiál. V kyselé formě má bakteriostatické až baktericidní účinky. Jedná se o bělavý prášek, jemného charakteristického zápachu a nakyslé chuti. Obsahuje proměnlivé množství karboxylových skupin (16–24 %), přičemž na jednu glukosovou jednotku připadá v průměru 0,6–0,93 volných karboxylových skupin 52).
Kyselá forma oxycelulosy je nerozpustná ve vodě, kyselinách a organických rozpouštědlech, naopak dobře rozpustná je ve vodných roztocích organických bází, koncentrovaných alkáliích a hydroxidu amonném, ve kterých dochází k tvorbě solí. Oxycelulosa je kompatibilní s celou řadou farmaceutických pomocných látek, jako jsou např. celulosové deriváty, bentonit, povidon, poloxamery, polyakryláty, alginany a další 53).
Možnosti aplikace oxycelulosy závisí na mnoha faktorech, např. stupni polymerizace, obsahu karboxylových skupin, struktuře celulosy použité pro oxidaci a další chemické a fyzikální modifikaci. Částečnou oxidací celulosy se způsobí změny ve struktuře a krystalinitě výsledné molekuly, které ovlivňuje její chemické a fyzikální vlastnosti 54).
Deriváty oxidované celulosy jsou schopny ve vodném prostředí hydratovat a vytvářet gely, které při koncentraci 7,5–20 % polymerní látky vykazují thixotropní chování 55, 56). Kritická koncentrace gelovatění, neboli nejnižší hodnota, při které vzniká gel, je 4 %. V této koncentraci poskytují, tzv. slabé gely, které se chovají elasticky pouze při malých mechanických napětích 57).
Kyselá forma OC není schopna po přidání disperzního prostředí samovolně vytvářet gely. Stabilní gelové systémy lze však připravit použitím vysokootáčkových mixerů (20 000 ot./min). OC stejně jako MCC (mikrokrystalická celulosa) obsahuje ve své struktuře mikrokrystalické oblasti. Pro vznik stabilní disperze je nezbytné rovnoměrné rozptýlení mikrokrystalů v celém objemu, čehož lze dosáhnout použít vysokého střihového napětí generovaného rotor-statorovými homogenizátory. Takto připravené disperze je nutné stabilizovat přídavkem 8–10 % karmelosy sodné soli, která zajistí trvalé oddělení jednotlivých mikrokrystalů. Gely tvořené sodnou solí OC nevyžadují pro přípravu vynaložení tak velké mechanické energie jako v případě kyselé formy. K jejich přípravě lze proto použít nízkoobrátkových mixerů. Tato skutečnost je dána přítomností 4–10 % ve vodě rozpustných složek (v závislosti na stupni oxidace), které se po kontaktu s disperzním prostředím rozpouští, oddalují jednotlivé mikrokrystaly, a plní tak bariérovou funkci karmelosy sodné soli. Připravené gely jsou stabilní a v průběhu dlouhodobého skladování (2 roky) při teplotě 5 °C nedochází k rozvrstvování. Jejich vysoušením se tvoří tenký matný film, který lze snadno převést na prášek. Je třeba zdůraznit, že konzistence gelů sodné soli oxycelulosy závisí nejen na koncentraci polymeru, ale také na podmínkách přípravy, zejména pak na intenzitě homogenizace a době jejího trvání 58, 59). Gely na bázi oxycelulosy je možné využít jako enterosorbenty v gastoenterologii a při detoxikační terapii. Po podání do GIT je oxycelulosa schopná působit jako katex a vyvazovat toxické látky kationtové povahy. V klinických testech se ukázalo, že tyto hydrogely jsou netoxické a vykazují mukoprotektivní a antiulcerózní účinky 60).
Disperze oxycelulosy vytvářejí na pokožce vysoce adhezivní filmy, do kterých je možno inkorporovat široké spektrum těkavých i netěkavých léčivých látek kyselého, bazického i neutrálního charakteru, krystalické i amorfní povahy 56, 60, 61).Práškovaný materiál se může použít v procesu přímého lisování, kde by se mohl uplatnit jako pojivo nebo rozvolňovadlo pevných lékových forem, např. tablet a pelet. Oxycelulosa může najít uplatnění i jako nosič léčivé látky zajišťující časově či místně modifikované uvolňování. Do současnosti se v tomto směru zkoušelo několik chemoterapeutik jako např. methotrexát, hydroxythiamin a cisplatina, u nichž se prokázalo zvýšení účinnosti oproti volně podané léčivé látce62,63). Oproti uhličitanu lithnému tradičně používanému v psychiatrii přináší podání lithia ve formě soli s touto polymerní látkou snížení nežádoucích účinků 59). OC je dále možné využít jako hemostatikum v různých chirurgických odvětvích 64).
Oxidovaná celulosa patří při fyziologickém pH mezi nejrychleji degradovatelné polymery. Degradace probíhá jak samovolnými chemickými, tak enzymatickými katalyzovanými procesy. Při rozkladu v podmínkách in vivo i in vitro dochází k hydrataci oxycelulosy, bobtnání, vytvoření gelu, který se postupně rozpouští, až nakonec během 21 dní zcela vymizí z místa aplikace 65–67).
ZÁVĚR
Hydrofilní gelové systémy jsou považovány za moderní aplikační formy, které zajišťují zvýšenou biologickou dostupnost, účinnost a bezpečnost léčivého přípravku. Své uplatnění nacházejí v systémech s prodlouženým a řízeným uvolňováním léčivé látky. V současnosti se preferují polymery bioresorbovatelné, biodegradovatelné a biokompatibilní. Mnohé tyto vlastnosti splňují právě celulosové deriváty.
Tato práce je součástí projektu ev. Č. 2A – 1TP1/073 realizovaného za finanční podpory z prostředků státního rozpočtu prostřednictvím MPO a grantu IGA VFU Brno 21/007/FaF.
Došlo: 8. ledna 2007
Přijato: 29. ledna 2008
Adresa pro korespondenci:
PharmDr. Martina Bajerová
Ústav technologie léků FaF VFU
Palackého 1–3, 612 42 Brno
e-mail: martina.bajerova@seznam.cz
Sources
1. Kikwai, L. et al.: AAPS PharmSciTech 2005; 6, E565–E572.
2. Baumgartner, S. et al.: AAPS PharmSciTech, 2002; 3, 1–8.
3. Chalupová, Z., Masteiková, R., Savickas, A.: Čes. slov. Farm., 2005; 2, 55–59.
4. Kletch, C. M.: Gels and Jellies. In: Swabrick, L, Boylan, J. C. eds. Encyclopedia of Pharmaceutical Technology, vol. II, New York, Marcel Dekker, 2002, 1327–1344.
5. Bartovská, L., Šišková, M.: Fyzikální chemie povrchů a koloidních soustav. 5. vyd. Praha, VŠCHT, 2005, 244 s.
6. Vodrážka, Z.: Fyzikální chemie pro biologické vědy, 1. vyd. Praha, Academia, 1982, 565 s.
7. Lázničková, A., Ďoubal, S., Gasparič, J., Dittrich, M.: Fyzikální chemie pro posluchače farmacie II. díl, Praha, Karolinum, 1997, 126 s.
8. Zatz, J. L., Kushla, G. P.: Gels, In: Lieberman, E. A., Rieger M. M., Banker G. S.: Pharmaceutical Dosage Forms. vol II., New York – Basel – Hong Kong, Marcel Dekker, 399–420.
9. http://www.dermotopics.de/english/issue_2_02_e/da niels_novelgels_2_02_e.htm, 1. 11. 2007
10. Pouchlý, J.: Fyzikální chemie makromolekulárních a koloidních soustav. Praha, VŠCHT, 1998, 198 s.
11. Karout, A., Pierre, A. C.: J. Non-Cryst. Solids, 2007; 353, 2900–2909.
12. Salamat-Miller, N., Chittchang, M., Johnston, P. T.: Advan. Drug Delivery Rev., 2005; 57, 1666–1691.
13. Wang, Q., Li, L.: Carboh. Polym., 2005; 62, 232–238.
14. Ford, L. J.: Int. J. Pharm., 1999; 179, 209–228.
15. Gruntová, Z.: Hydrogely a slizy. In: Chalabala M. et al.: Lékové formy, 2. vyd. Martin, Osveta 1992, 78-89.
16. Peppas, N. A. et al.: Eur. J. Pharm. Biopharm., 2000; 50, 27–46.
17. Valenta, C.: Advan. Drug Delivery Rev., 2005; 57, 1692–1712.
18. Rokhade, P. A. et al.: Carboh. Polym., 2007; 69, 678–687.
19. Rabišková, M. et al.: Čes. slov. Farm., 2003; 5, 211–217.
20. Handbook of pharmaceutical excipients, Rowe, R. C., Sheskey, P. J.,Owen, C. S. eds. 5th ed, London,The Pharmaceutical Press, 2006, s. 136–138.
21. Nussinovitch, A.: Hydrocolloid applications, Gum technology in the food and other industries. London, Blackie Academic & Professional, 1997, 105–123.
22. Marcelo, G., Saiz, E., Tarazona, P. M.: J. Chromatog. A, 2007; 1165, 45–51.
23. Tahala, N. et al.: J. Control. Release, 2005; 108, 386–395.
24. Pak, C. R., Munday, D. L.: Int. J. Pharm., 2002; 237, 215–226.
25. Jones, D.S., et al.: Int. J. Pharm., 1997; 151, 223–233.
26. Wang, L, Tang, X.: Int. J. Pharm., 2008; 350, 181–187.
27. Dong, W., Bodmeier, R.: Int. J. Pharm., 2006; 326, 128–138.
28. Masteiková, R., Chalupová, Z., Savickas, A.: Čes. slov. Farm., 2004; 5, 211–218.
29. Chalabala, M. et al.: Farmaceutické pomocné látky. In: Komárek, P., Rabišková, M.: Technologie léků, 3. vyd. Praha, Galén, 2006; 139.
30. Fawaz, F. et al.: Int. J. Pharm., 2004; 280, 151–162.
31. Shin, S.-Ch., Cho Ch.-W., Yang, K.-H.: Int. J. Pharm., 2004; 287, 73–78.
32. Shin, S.-Ch. et al.: Int. J. Pharm., 2003; 260, 77–81.
33. Dvořáčková, K., Rabišková, M.: Praktické lékárenství, 2006; 2, 93–97.
34. Llabot, M. J., Manzo, H. R., Allemandi, A. D.: AAPS PharmSciTech, 2002; 3 (3),1–6.
35. Dvořáčková, K. et al.: Čes. slov. Farm., 2007; 56, 129–134.
36. Tuleu, C. et al.: Eur. J. Pharm. Sci., 2007; 30, 251–255.
37. Arion, H.: Eur. J. Plast. Surg., 2001; 24, 172–175.
38. Tao, L. S., Desai, A. T.: Drug Discov. Today, 2005; 10, 909–915.
39. Bertram, U., Bodmeier, R.: Eur. J. Pharm. Sci., 2006; 27, 62–71.
40. Liu, X., Chen, T., Liu, L., Li, G.: Sensor Actuator B‑chem., 2006; 113, 106–111.
41. Kennedy, J. F. et al.: Carboh. Polym., 1995; 26, 31–34.
42. Marcelo, G., Saiz, E., Tarazona, P.: J. Chromatog. A, 2007; 1165, 45–51.
43. Kalayni, S. et al.: Carboh. Polym., 2006; 64, 425–432.
44. Gens, L. et al.: Pharm. Acta Helv., 1999; 74, 43–49.
45. Mourtas, S., Haikou, M., Theodoropoulou, M. et al.: J. Colloid Interface Sci., 2008; 317, 611–619.
46. Sassi, A., Isaacs, Ch., Monela, J. B. et al.: J. Pharm. Sci., 2007; 1–17, publikováno online www3.interscience. wiley.com 11. 3. 2008.
47. Lindell, K., Engstrom, S.: Int. J. Pharm., 1993; 95, 219–228.
48. Grabovac, V. et al.: Pharmaceut. res., 2007; 24, 1001–1006.
49. Havelka, P. et al.: Patentový spis: 298350, 2007.
50. Saito, T. et al.: Carboh. Polym., 2005; 61, 414–419.
51. Nada, A. M. A., Hassan, M. L.: J. Appl. Polym. Sci., 2006; 102, 1399–1404.
52. Zhu, L., Kumar, V., Banker, G. S.: Int. J. Pharm., 2001; 223, 35–47.
53. Banker, S. et al.: United States Patent: 5,414,079, 1995.
54. Chavan, V. B., Sarwade, B. D., Varma, A. J.: Carboh. Polym., 2002; 50, 41–45.
55. Banker, G. S., Kumar, V.: United States Patent: 5,405,953, 1995.
56. Chen, F. L., Seethanathan, P: United States Patent: 4,480,089, 1984.
57. Agoub A. A., Morris E. R.: Carboh. Polym., 2008; 71, 416–427.
58. Gert, E. V. et al.: Cellulose, 2005; 12, 517–526.
59. Kaputski, F. N. et al.: Fibre Chem., 2005; 37, 485–489.
60. Banker, S. G., Kumar, V: United States Patent: 5,780,618, 1998.
61. Varma, A. J., Chavan, V. B.: Polym. Degrad. Stabil., 1995; 49, 245–250.
62. Zhu, L., Kumar, V., Banker, G. S.: AAPS Pharm. Sci Tech., 2004; 5, 1–8.
63. Sheleg, S. V. et al.: J. Neuro-Oncol., 2002; 60, 53–59.
64. Banker, G. S., Kumar, V.: United States Patent: 5,780,618, 1998.
65. Stilwell, R. L. et al.: Handbook of Biodegradable Polymers, Domb, J. A., Kost, J., Wiseman, M. D., Amsterdam, Harwood academic publishers, 1997, 291–306.
66. Dimitrijevich, S. D., Tatarko, M., Gracy, R. W.: Carboh. Res., 1990; 195, 247–256.
67. Dimitrijevich, S. D. et al.: Carboh. Res., 1990; 198, 331–341.
Labels
Pharmacy Clinical pharmacology
Article was published inCzech and Slovak Pharmacy

2008 Issue 2-
All articles in this issue
- Standardní receptura pro přípravu léčivých přípravků v lékárnách I. Suspenze k aplikaci na kůži
- Interakcia 1,4-dihydropyridínov s iónovými kanálmi
- Polosyntetické deriváty celulosy jako základ hydrofilních gelových systémů
- Radioaktivně značené peptidy v diagnostice a terapii nádorů
- Léčivé rostliny a diabetes mellitus
- Moderní instrumentální metody studia isoflavonů
- Laktobacily a ich probiotické vlastnosti
- Přínos alergenové imunoterapie Phostalem v léčbě sezonní alergické rýmy (dva roky aplikace)
- Czech and Slovak Pharmacy
- Journal archive
- Current issue
- Online only
- About the journal
Most read in this issue- Polosyntetické deriváty celulosy jako základ hydrofilních gelových systémů
- Laktobacily a ich probiotické vlastnosti
- Standardní receptura pro přípravu léčivých přípravků v lékárnách I. Suspenze k aplikaci na kůži
- Léčivé rostliny a diabetes mellitus
Login#ADS_BOTTOM_SCRIPTS#Forgotten passwordEnter the email address that you registered with. We will send you instructions on how to set a new password.
- Career

