-
Medical journals
- Career
VYUŽITÍ UMĚLÉ INTELIGENCE V ZÁCHYTU DIABETICKÉ RETINOPATIE. PŘEHLED
Authors: Z. Straňák *; M. Penčák *; M. Veith
Authors‘ workplace: Oftalmologická klinika, 3. lékařská fakulta, Univerzita Karlova, a Fakultní nemocnice Královské Vinohrady, Praha
Published in: Čes. a slov. Oftal., 77, 2021, No. 5, p. 224-231
Category: Review Article
doi: https://doi.org/10.31348/2021/6Overview
Cíl: Práce seznamuje čtenáře s pokroky v hodnocení snímků sítnice pomocí umělé inteligence se zaměřením na screening diabetické retinopatie (DR). Popsány budou základní principy umělé inteligence a algoritmy, které se již dnes v klinické praxi používají nebo jsou krátce před schválením.
Metodika: Literární rešerše zaměřená na charakteristiky a mechanismy jednotlivých přístupů k využití umělé inteligence (artificial intelligence AI). Hodnotili jsme anglicky psané články publikované do června 2020 s užitím klíčových slov: „diabetic retinopathy screening“, „deep learning“, „artificial intelligence“ a „automated diabetic retinopathy system“.
Výsledky: Moderní systémy pro screening diabetické retinopatie využívající hluboké neuronové sítě dosahují ve většině publikovaných studií senzitivity i specificity nad 80 %. Výsledky konkrétních studií se liší v závislosti na definici zlatého standardu, velikosti souboru a hodnocených parametrech.
Závěr: Hodnocení snímků pomocí AI do budoucna zrychlí a zefektivní diagnostiku DR a umožní i při nárůstu pacientů s diabetem bez adekvátního nárůstu počtu oftalmologů zachovat minimálně stávající kvalitu péče.
Klíčová slova:
umělá inteligence – screening – diabetická retinopatie
Prezentováno na kongresu XVIII. Kongresu České vitreoretinální společnosti v Brně 2018 a XXX. Ústeckém oftalmologickém dni v Ústí nad Labem 2019.
ÚVOD
Využití umělé inteligence se v posledních letech dostává na výsluní téměř ve všech oborech humánní medicíny od radiologie až po oftalmologii [1]. Jedním z příkladů, kdy inteligentní program již překonal lidského kolegu, je algoritmus pro detekci rakoviny kůže, který dokáže tuto klinickou jednotku určit přesněji než zkušený dermatolog [2]. Navíc je zde umělá inteligence (AI) rychlejší, efektivnější, a na rozdíl od mnoha let studia a klinické přípravy vyžaduje pouze tréninkové datasety.
V kontextu obrazové analýzy má sítnice podobně vhodné postavení. Již od roku 1926 jsme schopni na komerčně dostupném aparátu (prvenství patří Carl Zeiss Company) získávat fotografie očního pozadí [3]. Se zdokonalující se technikou jsou dnes již dostupné různé typy širokoúhlých kamer nebo například ručních kamer, které nevyžadují mydriázu či řádně zaškoleného oftalmologa, a mohou tak být součástí běžného vybavení například ambulantního diabetologa [4]. Nicméně stále takto získaný snímek musí být odeslán ke zhodnocení mimo ambulanci příslušného diabetologa. Právě užití fotografií fundu v rámci screeningu diabetické retinopatie (DR) je dnes věnována velká pozornost.
DR je závažnou komplikací diabetu. Jedná se o vedoucí příčinu praktické slepoty mezi dospělou populací produktivního věku [5,6]. V České republice bylo v roce 2017 dle dat zveřejňovaných Ústavem zdravotnických informací a statistiky přes 930 000 diabetiků [7]. "DR se prokázala u 10,3 % z nichž mělo 24,9 % závažnou proliferativní formu. 0,24 % ze všech diabetiků mělo zrakovou ostrost na úrovni praktické slepoty.
Zavedení celonárodních programů pro screening DR založených na principech telemedicíny a hodnocení stupně diabetické retinopatie z fotografií očního pozadí vedlo v některých zemích k poklesu incidence slepoty vlivem diabetické retinopatie [5]. Tyto programy umožňují pravidelný a efektivní screening velkého množství pacientů s diabetem. Jsou obvykle založeny na několikastupňovém hodnocení fotografií fundu skupinou speciálně vyškolených hodnotitelů, obvykle nelékařů. Zavedení podobných programů je ovšem finančně i personálně velmi náročné [8,9]. K jejich většímu rozšíření by mohlo přispět zavedení počítačových algoritmů ke zhodnocení fotografií očního pozadí [10,11].
Velký rozvoj v této oblasti nastal v poslední době vlivem rozvoje programů umělé inteligence založených na principech hlubokého učení a hlubokých neuronových sítí. Technika hlubokého učení umožňuje pokročilé zpracování a vyhodnocování obrazových a zvukových informací [12]. Poslední publikované výsledky ukazují, že zavedení těchto programů do klinické praxe by mohlo vést ke snížení počtu potřebných hodnotitelů při zachování potřebné senzitivity a specificity [10]. Cílem tohoto článku je přinést přehled o současných možnostech programů založených na principu hlubokého učení a hlubokých neuronových sítí v diagnostice diabetické retinopatie z fotografií očního pozadí.
CÍL
Seznámit čtenáře se základy hodnocení snímků pomocí umělé inteligence a přiblížit fungování a výsledky dnes nejpoužívanějších systémů.
METODY
Literární rešerše zaměřená na hodnocení snímků v rámci screeningu DR pomocí AI. Hodnotili jsme články publikované do června 2020 s užitím klíčových slov: „diabetic retinophaty screening“, „deep learning“, „artificial intelligence“ a „automated diabetic retinophaty system“. Zaměřili jsme se především na údaje o specificitě a senzitivitě.
Specificita vyjadřuje schopnost testu správně identifikovat negativní nálezy. Je to podíl negativních vůči negativním plus falešně pozitivním. Pokud bude specificita 100 %, pak to znamená, že všechny negativní nálezy byly opravdu negativní. Pokud bude specificita 67 %, pak to znamená, že ze 3 negativních očí (např. pro DR) byly ve skutečnosti označeny jako negativní pouze 2 oči.
Senzitivita vyjadřuje schopnost testu správně identifikovat pozitivní nálezy. Je to podíl pozitivních vůči pozitivním plus falešně negativním. Pokud bude senzitivita 100 %, tak nám neunikl žádný pozitivní nález (např. test označí pozitivně 3 oči a ve skutečnosti budou pozitivní jen 2 oči). Pokud bude senzitivita 67 %, pak to znamená, že ze 3 pozitivních očí test označil pouze 2 pozitivní oči.
VÝSLEDKY
IDx-DR
IDx-DR (Digital Diagnostics, Coralville, USA) je hybridní systém, který používá několik hlubokých neuronových sítí, z nichž každá je vytrénována k detekci určité známky DR – hemoragií, mikroaneurysmat, tvrdých exsudátů apod. [13] Dále obsahuje algoritmus hodnotící kvalitu posuzovaných fotografií fundu. Je určen k využití s non - -mydriatickou fundus kamerou Topcon NW400 (Topcon Corporation, Tokyo, Japonsko). K hodnocení využívá dvě 45° fotografie fundu každého oka – jednu centrovanou na foveu a druhou na zrakový nerv.
Fotografie jsou poté přes internet odeslány na vzdálený server, kde je provedeno vyhodnocení. Program IDx - -DR nejprve posoudí kvalitu fotografií a při dostatečné kvalitě poté provede vyhodnocení a odešle výsledek zpět ošetřujícímu lékaři. Systém hodnotí přítomnost větší než mírné diabetické retinopatie, zrak ohrožující DR a diabetického makulárního edému.
V pilotní studii bylo rekrutováno 900 pacientů, z nichž 819 studii dokončilo a mohlo být plně zhodnoceno. IDx-DR byl testován proti lidským hodnotitelům jako zlatému standardu. IDx-DR prováděl hodnocení ze dvou snímků fundu pro každé oko. V 76,4 % případů bylo dostatečné kvality fotografií dosaženo bez nutnosti farmakologické mydriázy. Lidští hodnotitelé měli k dispozici čtyři stereoskopické snímky ze širokoúhlé fundus kamery pokrývající plochu standardních 7 ETDRS polí a snímek z optické koherentní tomografie (OCT) makuly. Snímky hodnotili 3 zkušení hodnotitelé. Hodnotila se přítomnost větší něž mírné DR, diabetického makulárního edému a zrak ohrožující DR [13]. V této studii dosáhl program senzitivity 87,2 % a specificity 90,7 %. Hodnotitelných bylo 96,1 % všech snímků. Senzitivita u zrak ohrožující diabetické retinopatie byla dokonce 97,4 %. Systém byl také pouze z fotografií fundu schopen detekovat 84 % pacientů s diabetickým makulárním edémem postihujícím makulu přítomným na OCT. Lidští hodnotitelé dokázali ze stereoskopických fotografií fundu identifikovat pouze 34 % těchto pacientů. Na základě této studie byla schválena možnost použití IDx-DR k detekci DR americkou Agenturou pro potraviny a léčiva (FDA). Jedná se o první zdravotnický prostředek využívající umělou inteligenci, který toto schválení získal [14].
Dobré výsledky z pilotní studie byly potvrzeny i při nasazení programu v klinické praxi. Při nasazení v Holandsku dosáhl systém senzitivity 91,0 % a specificity 84,0 % na populaci 1415 diabetiků. Za hodnotitelné označil ovšem systém pouze 66,3 % snímků. Pro zrak ohrožující DR byla senzitivita 62,0 % a specificita 95,0 % [15].
V jiné holandské studii dosáhl systém pro populaci 1616 pacientů senzitivity 79,4 % a specificity 93,8 % pro větší než mírnou DR [16]. Pro zrak ohrožující retinopatii byla senzitivita 100,0 % a specificita 97,8 %. Nehodnotitelných bylo 17,3 % snímků.
Ve studii provedené ve Španělsku dosáhl systém senzitivity 100 % a specificity 82 % pro větší než mírnou DR. Pro zrak ohrožující DR byla senzitivita také 100 %, specificita potom 95 %. Systém označil za dostatečně kvalitní a hodnotitelné 76 % snímků, hodnoceny byly snímky 2680 pacientů [17].
V pilotní studii v Polsku bylo hodnoceno 450 pacientů. Systém IDx-DR byl schopen vyhodnotit 76 % snímků, senzitivita byla 94 % a specificita 95 % [18].
Selena
Selena (EyRIS, Singapur) byla vyvinuta Singapurským očním výzkumným institutem. Kromě DR dokáže Selena identifikovat také pacienty s věkem podmíněnou makulární degenerací a podezřením na glaukom [19]. Systém dokáže vyhodnotit fotografie fundu pořízené různými typy sítnicových kamer. Ve studii byla senzitivita a specificita programu srovnávána s lidskými hodnotiteli – nelékaři, kteří se podílí na hodnocení snímků v rámci telemedicínského programu pro screening diabetické retinopatie, který je v Singapuru zaveden. Zlatým standardem bylo hodnocení sítnicovým specialistou. Program dosáhl senzitivity 90,5 % a specificity 91,6 % pro detekci DR. U lidských hodnotitelů byla senzitiva 91,2 % a specificita 99,3 %. Pro zrak ohrožující DR byla senzitivita programu 100 %, specificita 91,1 %, u lidských hodnotitelů to bylo 88,5 % a 99,6 %.
Na úspěšnost programu neměla vliv rasa, pohlaví ani věk pacientů. Pro detekci suspektního glaukomu byla senzitivita programu 96,4 % a specificita 87,2 %, pro věkem podmíněnou makulární degeneraci byla senzitivita 93,2 % a specificita 88,7 %. Ve studii byly také srovnávány dva scénáře nasazení programu. V plně automatickém scénáři rozhodoval o odeslání pacienta k lékaři program samotný. V poloautomatickém scénáři byli pacienti, kteří byli k ošetření indikování programem, dále zhodnoceni ještě lidskými hodnotiteli. V plně automatickém scénáři byla souhrnná senzitivita pro všechny tři diagnózy 93 % a specificita 77,5 %. U poloautomatického scénáře byla senzitivita 91,3 % a specificita 99,5 %, k hodnocení lidskými hodnotiteli bylo odesláno 25,3 % procenta snímků.
Bosch DR Algorithm
Program byl vytvořen firmou Robert Bosch GmbH (Gerlingen-Schillerhöhe, Německo). Systém rozlišuje tři nálezy – zdravý, s přítomnou DR a neprůkazný. Systém využívá přenosnou non-mydriatickou kameru Bosch. V jediné publikované studii bylo hodnoceno 1128 očí 564 pacientů. Hodnocena byla jedna non-mydriatická fotografie fundu pro každé oko. Zlatým standardem bylo hodnocení stereofotografií očního pozadí v mydriáze ve standardních 7 ETDRS polích. Systém dosáhl senzitivity 91,2 % a specificity 96,9 %. Systém nebyl schopen vyhodnotit 3,9 % všech fotografií. Pouze u 4 pacientů nebyl systém schopen vyhodnotit fotografii ani jednoho oka.
RetmarkerDR
RetmarkerDR (Retmarker, Coimbra, Portugalsko) je nasazen ve screeningovém programu ve středním Portugalsku již od roku 2011. V původní verzi se jednalo o systém k detekci známek DR na základě strojového učení. Program je schopen srovnávat fotografie očního pozadí z různých vizit a hodnotit změny ve výskytu mikroaneurysmat, což by mohl být prediktivní faktor pro rozvoj diabetického makulárního edému [20]. V původní verzi dosáhl systém senzitivity 73 % pro DR, 85 % pro významnou DR a 97,9 % pro proliferativní DR. Specificita pro významnou DR byla 52,3 % [10].
V poslední verzi byly do programu implementovány nové algoritmy založené na technikách hlubokého učení. To vedlo k významnému zlepšení specificity. V testovacím souboru dosáhl inovovaný algoritmus senzitivity 97 % ve srovnání s 96,5 % u původní verze programu. Specificita se zlepšila z 60,2 % u původní verze na 88 % u nové verze programu [21].
Google Inception
Výzkumníci společnosti Google vyvinuli architekturu umělé inteligence s kódovým označením Inception založené na principu hlubokých neuronových sítí, která je speciálně určena k rozpoznávání obrazu [22]. Tato architektura byla poté ještě několikrát vylepšena [23]. Různé generace této architektury byly vytrénovány několika výzkumnými týmy k rozpoznávání známek DR. Gulshan et al. otestovali tento systém na veřejně dostupném souboru fotografií fundu pacientů s diabetem a dále na vzorku fotografií fundu pacientů ze screeningového programu DR v USA a Indii [24]. Systém otestovali ve dvou nastaveních – v jednom pro vysokou senzitivitu, ve druhém pro vysokou specificitu. Zlatým standardem bylo většinové rozhodnutí skupiny certifikovaných oftalmologů. Systém hodnotil přítomnost střední a horší DR, těžké DR (pokročilá neproliferativní a proliferativní DR) a diabetického makulárního edému.
Při hodnocení veřejně dostupného souboru dosáhl program v nastavení pro vysokou specificitu senzitivity 87,0 % a specificity 98,5 %, pro vzorek ze screeningového programu potom senzitivity 90,3 % a specificity 98,1 %. Při nastavení pro vysokou senzitivitu pak byla senzitivita 96,1 % a specificita 93,9 % pro veřejně dostupný soubor, resp. 97,5 % a 93,4 % pro vzorek ze screeningového programu.
Tento algoritmus byl dále vylepšen [25] a otestován v reálném nasazení v rámci screeningového programu diabetické retinopatie v Thajsku [26]. Srovnáván byl výkon programu s lidskými hodnotiteli, kteří se na screeningovém programu v Thajsku podílí. Hodnoceno bylo 29943 fotografií fundu 7517 pacientů. V případě rozdílného hodnocení stupně DR mezi programem a lidskými hodnotiteli byl rozhodující názor mezinárodní skupiny sítnicových specialistů. Program zde dosáhl senzitivity 96,8 % (lidští hodnotitelé 73,4 %) a specificity 95,6 % (lidští hodnotitelé 98,0 %) pro přítomnost střední a horší DR. Pro diabetický makulární edém byla senzitivita 95,3 % (lidští hodnotitelé 62,0 %) a specificita 98,2 % (lidští hodnotitelé 99,2 %). Pro těžké formy DR dosáhl program senzitivity 93,6 % (lidští hodnotitelé 63,5 %) a specificity 98,2 % (lidští hodnotitelé 99,7 %).
Architekturu Inception použili k vývoji systému umělé inteligence i další autoři. Li et al. testovali svůj program na souboru 14 520 fotografií fundu a dosáhli senzitivity 92,5 % a specificity 98,5 % [27]. Salhsten et al. testovali svůj algoritmus na souboru 7118 fotografií a dosáhli senzitivity 89,6 % a specificity 97,4 % [28].
Medios AI
Medios AI (Remidio Innovative Solutions Pvt. Ltd, Bengalúr, Indie) je unikátní systém, který hodnotí fotografie získané přenosnou kamerou na oční pozadí Remidio Non-Mydriatic Fundus on Phone, která využívá k focení vložený chytrý telefon. Algoritmus samotný běží off-line přímo na chytrém telefonu Apple 6 (Apple Inc., Cupertino, Kalifornie, USA), který je připojen k optické části přenosné fundus kamery. V pilotní studii bylo vyšetřeno 231 pacientů. Hodnocení bylo možné provést u 213 z nich a systém zde dosáhl senzitivity 100 % a specificity 88,4 % pro významnou diabetickou retinopatii [29].
Sosale et al. vyšetřili 900 pacientů [30]. Zlatým standardem bylo hodnocení pěti retinálními specialisty. Hodnoceny byly 2 non-mydriatické fotografie fundu každého oka – jedna centrovaná na makulu, druhá na zrakový nerv. V této studii dosáhl systém senzitivity 83,3 % a specificity 95,5 % pro přítomnost jakékoliv DR. Pro významnou DR byla senzitivita 93,0 % a specificita 92,5 %.
V jiné studii bylo vyšetřeno 297 pacientů [31]. Byly hodnoceny tři fotografie v mydriáze pro každé oko – jedna centrovaná na makulu, druhá z nasální části sítnice a třetí ze superotemporální oblasti sítnice. Zlatým standardem bylo hodnocení dvěma zkušenými sítnicovými specialisty. Systém dosáhl senzitivity 86,8 % a specificity 95,5 % pro přítomnost jakékoliv DR. Pro významnou retinopatii byla senzitivita 98,8 % a specificita 86,7 %.
EyeArt
Podobně jako systém RetmarkerDr byl i EyeArt (Eyenuk, Inc., Woodland Hills, Kalifornie, USA) původně vyvinut jako systém pro detekci známek DR na základě strojového učení. V této verzi prokázal systém na souboru 40 542 fotografií fundu 5084 pacientů s diabetem senzitivitu 90,0 % a specificitu 63,2 % [32]. V jiné studii dosáhl senzitivity 94,7 % pro jakoukoliv DR, 93,8 % pro významnou retinopatii a 99,6 % pro proliferativní DR.
Specificita byla ovšem pouze 20,0 % [33]. Ve verzi 2.0 byl systém vylepšen o algoritmy založené na hlubokém učení a hlubokých neuronových sítích. Vylepšený systém byl otestován ve studii, kde hodnotil 850 908 fotografií ze 107 001 screeningových návštěv [34]. 54 481 bylo pořízeno bez mydriázy, 46 580 v mydriáze, u 649 návštěv nebyl stav mydriázy znám. Systém dosáhl pro významnou DR senzitivity 91,3 % a specificity 91,1 %. Výsledky byly srovnatelné pro fotografie pořízené bez mydriázy a v mydriáze (senzitivita 89,6 % resp. 93,0 % a specificita 91,7 % resp. 94,0 %). Nehodnotitelných bylo pouze 0,9 % návštěv.
Podobných výsledků dosáhl systém i v dalších studiích. Heydon et al. v prospektivní studii srovnali výkon systému EyeArt s lidskými hodnotiteli v rámci anglického programu pro screening DR [35]. Hodnoceny byly fotografie ze 30 000 návštěv v rámci screeningového programu. Systém dosáhl senzitivity 95,7 % pro významnou DR, 100 % pro střední až těžkou neproliferativní DR a 100 % pro proliferativní DR. Specificita systému byla 68 %.
Ve dvou studiích byl systém otestován i na fotografiích pořízených přenosnou sítnicovou kamerou. Rajalakshmi et al. otestovali systém Eyart na fotografiích pořízených přenosnou sítnicovou kamerou Remidio Non-Mydriatic Fundus on Phone. Hodnoceno bylo 296 pacientů. Systém dosáhl senzitivity 95,8 % a specificity 80,2 % pro jakoukoliv DR. Pro zrak ohrožující DR byla senzitivita 99,1 % a specificita 80,4 %. Kim et al. otestovali systém na fotografiích pořízených přenosnou sítnicovou kamerou RetinaScope (Retinascope, Purmerend, Nizozemsko). Systém zde dosáhl senzitivity 87,0 % a specificity 78,6 %. Hodnoceno bylo ovšem pouze 119 očí 69 pacientů.
RetCAD
Systém RetCAD (Delft Imaging Systems, ‘s-Hertogenbosch, Nizozemí) dokáže detekovat z fotografie očního pozadí známky DR a věkem podmíněné makulární degenerace. Systém byl otestován na souboru 600 fotografií [36]. Výkon systému byl srovnán s lidským hodnotitelem - optometristou, zlatým standardem bylo hodnocení čtyřmi oftalmology. Systém dosáhl senzitivity 90,1 % a specificity 90,6 % pro významnou DR resp. 91,8 % a 87,5 % pro významnou věkem podmíněnou makulární degeneraci. Lidský hodnotitel dosáhl senzitivity 61,5 % a specificity 97,8 % pro DR, resp. 76,5 % a 96,1 % pro věkem podmíněnou makulární degeneraci.
Ostatní
Jednu z prvních prací na téma využití hlubokých neuronových sítí k detekci DR publikoval Pratt et al. Jejich systém byl vytrénován na souboru 78 000 fotografií očního pozadí. Testování systému poté proběhlo na 5 000 fotografiích, systém dosáhl senzitivity 30 % a specificity 95 %. Gargeya a Leng použili k tréninku svého algoritmu přes 75 000 fotografií fundu. Na dvou veřejně dostupných souborech fotografií očního pozadí pacientů s diabetem dosáhl systém senzitivity 93,0 % a specificity 87,0 %, resp. 90,0 % a 94,0 %. Systém byl schopen vyhodnotit jednu fotografii za 6 vteřin na běžném stolním počítači a za 8 vteřin na chytrém mobilním telefonu.
Riaz et al. publikovali výsledky svého algoritmu, který využívá hluboké a hustě propojené neuronové sítě [37]. Systém byl vytrénován na souboru 72 000 fotografií a otestován na dvou veřejně dostupných souborech fotografií očního pozadí pacientů s diabetem. V prvním souboru bylo 1747 fotografií a systém dosáhl senzitivity 98,0 %, specificity 98,0 %. Druhý testovací soubor obsahoval téměř 18 000 fotografií fundu a systém dosáhl senzitivity 94,0 %, specificity 97,0 %. Jedná se o nejlepší výsledek, kterého umělá inteligence na těchto dvou souborech zatím dosáhla.
DISKUZE
Ultimativním cílem v rámci diagnostiky DR je bezesporu screening co největšího možného souboru diabetiků, ideálně všech, a odeslání na specializované pracoviště ke stanovení dalšího postupu pouze těch pacientů, kteří mají DR stanoveného stupně. Diabetologická ambulance, při dostatečně uživatelsky přívětivé sítnicové kameře, se tak jeví jako nejvýhodnější místo k pořizování snímků.
Pořízené snímky lze v zásadě dále hodnotit pomocí dvou odlišných přístupů. Pomocí oftalmologa, či vyškoleného odborníka, nebo pomocí specializovaných autonomních systémů. Na vývoji obou těchto směrů se podílí i výzkumníci z České republiky.
Projekt s označením „Časný záchyt diabetické retinopatie a makulárního edému u pacientů s diabetem 1. nebo 2. typu CZ.03.2.63/0.0/0.0/15_039/0008165“ je realizován Ústavem zdravotnických informací a statistiky České republiky. Probíhající pilotní projekt časného záchytu DR a makulárního edému je zaměřen na populaci dospělých diabetiků v péči dispenzarizujících lékařů, s cílem zvýšit procento realizovaných oftalmologických vyšetření zavedením vyšetření pomocí non-mydriatické kamery. Pilotní projekt oproti stávající praxi zavádí inovaci v provedení vyšetření sítnice pacienta přímo v ambulanci lékaře odpovědného za dispenzarizaci diabetiků a odeslání snímků k centrálnímu hodnocení spolupracujícím oftalmologem z Oftalmologické kliniky Fakultní nemocnice Královské Vinohrady (FNKV).
Lékař (diabetolog) pořídí snímky sítnice (non-mydriatickou kamerou) a elektronicky snímky odešle do centrálního archivu obrazové dokumentace (tzv. PACS = Picture Archiving and Communication System). PACS je instalován centrálně na serverových prostředcích Ústavu zdravotnických informací a statistiky (ÚZIS) a jsou do něj napojeny kamery ze všech připojených pracovišť. Po uložení snímku do PACSu jsou již data k dispozici očnímu lékaři. Oftalmolog má ke snímkům přístup přes webové rozhraní, díky čemuž se může k vyšetření dostat odkudkoliv. Lékař provede vyhodnocení snímku a závěr uloží pomocí prohlížeče přímo k vyšetření, kde ho má k dispozici dispenzarizující diabetolog. V celém řešení jsou vždy nastavena přístupová práva tak, aby vyšetřující lékaři viděli pouze svoje data, ale zároveň hodnotící lékaři viděli všechna data bez jakéhokoliv omezení. Obrázek 1.
Image 1. Hodnocení snímků přes webové rozhraní, zdroj ÚZIS ČR 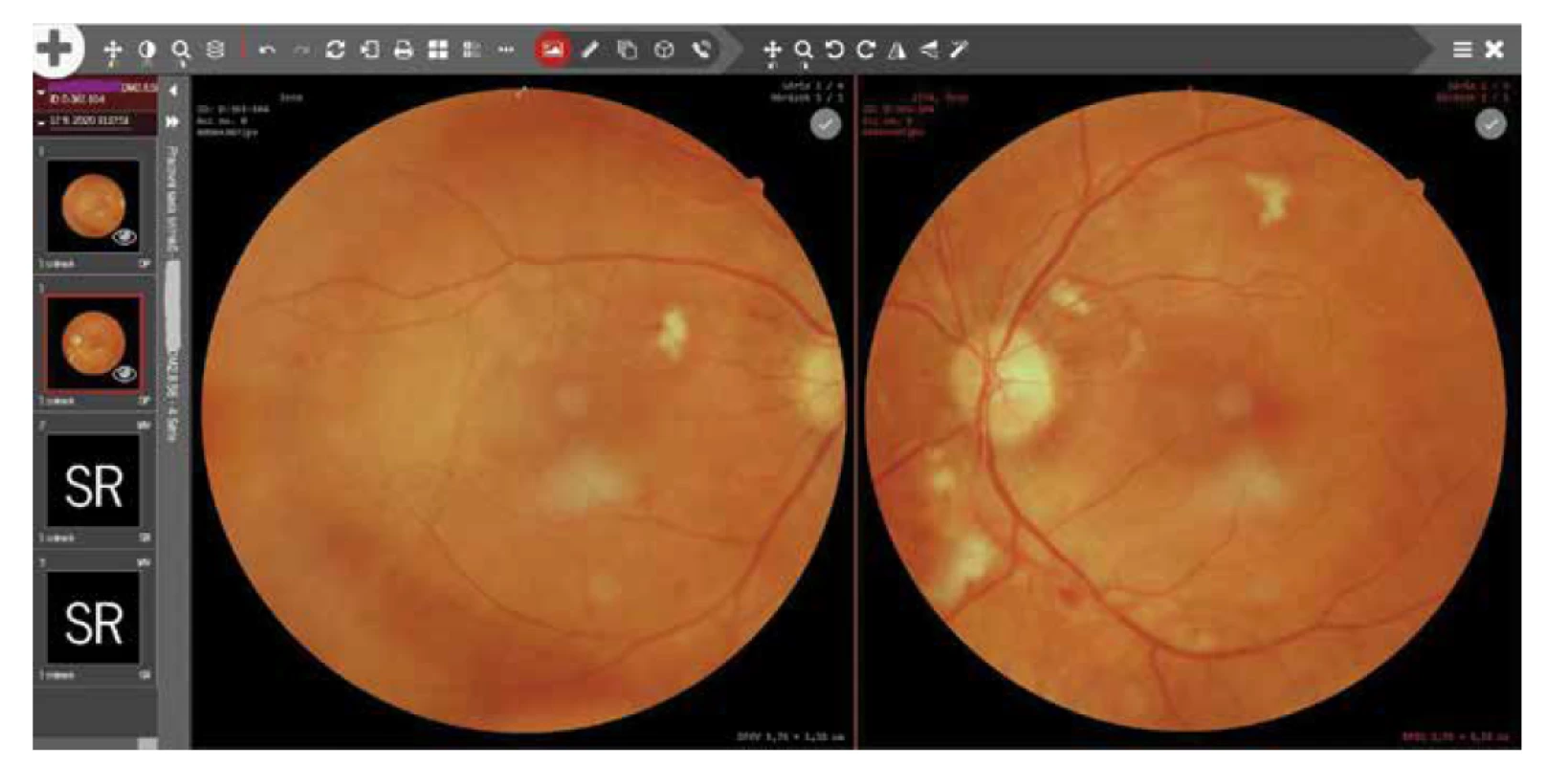
Druhou variantu, tedy hodnocení snímků pomocí umělé inteligence, v České republice reprezentuje například společnost Aireen. Před popisem projektu se ale ještě krátce zastavme nad pojmem umělá inteligence.
Obecně přijímanou definici AI stanovil Marvin Minsky v roce 1967: „Umělá inteligence je věda o vytváření strojů nebo systémů, které budou při řešení určitého úkolu užívat takového postupu, který, kdyby ho dělal člověk, bychom považovali za projev jeho inteligence“. Inteligence napodobující přímo mysl člověka ale není nezbytnou podmínkou, může se jednat i o jednodušší systémy. Nutné procesy k vytvoření takového algoritmu zahrnují učení systému, aplikaci získaných znalostí a opravování sama sebe.
AI většinou rozdělujeme jako silnou a slabou, nebo lépe jako specifickou či obecnou. Specifická AI zahrnuje většinou řešení speciálních úkolů, na kterou je AI předem trénována. Například se jedná o virtuální asistenty typu Siri od společnosti Apple, Alexa od společnosti Amazon. Dalším příkladem by byl systém Deep Blue od IBM, který porazil v roce 1997 šachového velmistra Garryho Kasparova. Jde o systémy, které ve specifické úloze překonají největší lidské talenty, ale pokud by například Deep Blue hrál piškvorky místo šachů, pak bude stroj bezradný. Takové úkoly totiž řeší systémy odtrženě od navazujících problémů a bez zásahů svých tvůrců snadno selžou. Obecná AI by oproti tomu měla být schopna jednat a uvažovat samostatně po vzoru člověka [38].
V procesu tvorby AI je klíčový proces učení. Strojové učení je podobor AI zabývající se tvorbou algoritmů, které za pomoci vstupních dat vytvoří předpoklad výsledné situace. Situace se může v čase měnit. Klasickým příkladem jsou reklamy na internetu. Pokud se například zajímám o nový vůz a navštívím několik stránek s touto tématikou, webový prohlížeč mi bude sám nabízet reklamy na auta místo kabelek tak dlouho, dokud nezaměřím svou pozornost jinam. Nejčastěji se strojové učení dělí na učení „pod dohledem“ (supervised learning) a „samostudium“ (unsupervised learning), ev. zpětnovazebné učení. Učení „pod dohledem“ ze začátku vyžaduje označení správného výsledku daným odborníkem při zadávání vstupních dat. U učení „bez dohledu“ algoritmy samy hledají vzory v datech. Například různé shluky podrobností, přičemž snižují dimenzi dat při zachování informace.
Hluboké učení (deep learning) zpravidla využívá učení pod dohledem – algoritmu se předkládají anotované snímky. Zde se typicky vyskytují neuronové sítě, inspirované zjednodušenou představou chování neuronů v lidském mozku. Hluboké učení se využívá například při rozpoznávání obrazu nebo konverzi řeči. K tomuto typu učení je třeba obrovské množství dat a je svým způsobem výsledkem „big data“ doby. Nevýhodou je pak fenomén černé skříňky (black box), kdy nejsme přesně schopni určit, jak systém k výsledku došel.
Aireen je český počítačový program, který za pomocí strojového učení umožňuje automatickou “strojovou” detekci specifických patologických jevů (lézí) na fotografiích sítnice a tím jako zdravotnický prostředek umožňuje zpřístupnit diagnostiku DR i mimo ordinaci očního lékaře. Kromě vlastního diagnostického závěru poskytuje i přehled detekovaných patologií a lékař má tak k dispozici detailní nález na jehož základě byl závěr učiněn. Obrázek 2.
Image 2. Výsledné hodnocení pomocí AI, zdroj Aireen 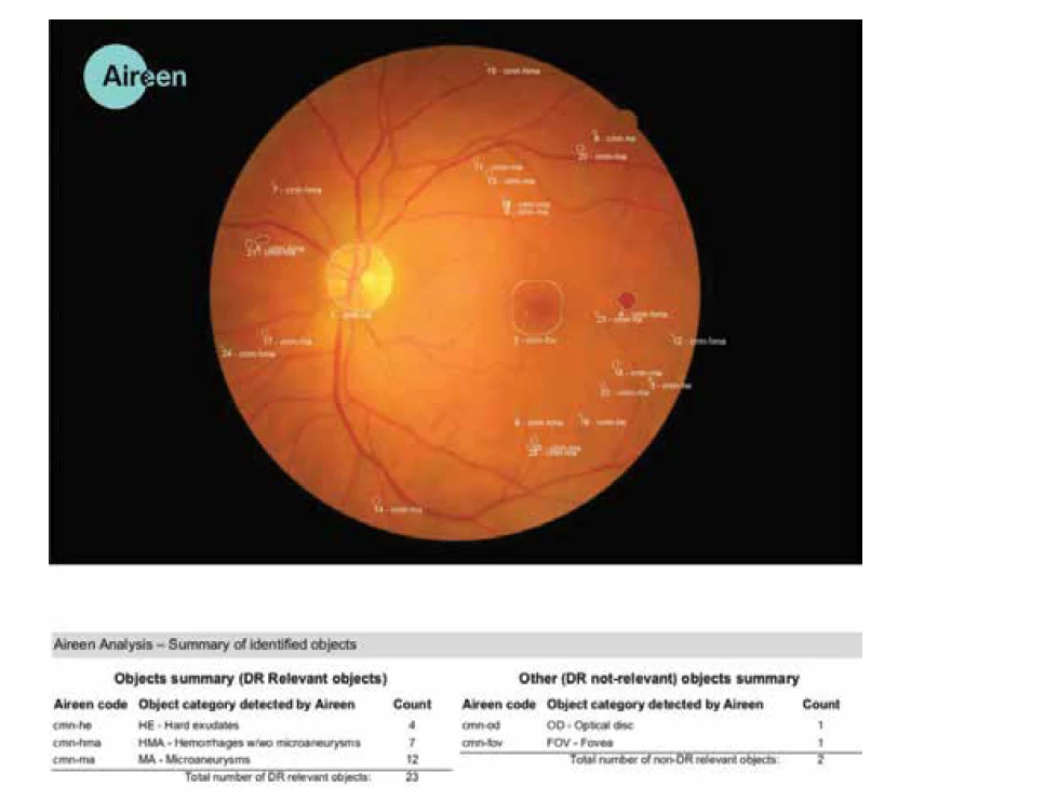
Díky úzké spolupráci s odborníky z řad českých očních lékařů především z Oční kliniky Ústřední vojenské nemocnice (ÚVN), ale i dalších pracovišť, disponuje Aireen unikátním modelem, založeným na více než 12 tisících snímcích s více jak čtvrt milionem označených lézí. Aireen úspěšně absolvovala klinickou zkoušku a je již registrovaným zdravotnickým prostředkem. Projekt byl založen před dvěma lety a je plně financován českým kapitálem. Kromě DR se připravuje diagnostika i dalších, nejen oftalmologických diagnóz.
Přes všechny benefity rodící se AI je třeba věnovat pozornost i problémům, které se s touto technologií pojí. V dnešní době už ani není problémem výpočetní kapacita (to spíše její energetická náročnost), ale více jsou diskutovány otázky etické a právní. Dostáváme se tedy z roviny teoretické a technologické na rovinu praktickou.
Michael J. Rigby se zamýšlí nad etikou užití AI v medicíně a poznamenává tři hlavní výzvy, které je třeba řešit. Jednak otázku vyvážení poměru risk/benefit, kdy rychlé zavedení AI do klinické praxe sice může přinést zvýšení efektivity a teoreticky zvýšit kvalitu poskytované péče, na druhou stranu nejsou stále dotaženy otázky soukromí, mlčenlivosti (tzn. poskytování dat třetí straně) a informovaného souhlasu. Navíc AI zatím nedokáže například odhadnout potenciální míru spolupráce, kterou lékař běžně podvědomě hodnotí například na základě sociálního statusu pacienta, rasy, věku, pohlaví či celkového stavu, což může mít při rozhodování o vhodné terapii klíčovou roli. To jsou mimo jiné důvody pro užití AI spíše jako nástroje pro „druhý názor“ než jako ultimativního diagnostického a léčbu určujícího prvku, který by zcela nahradil ošetřující zdravotníky. Druhým okruhem je vzdělávání lékařů. Existuje oprávněný předpoklad, že budeme nuceni přesunout důraz z vědomostní stránky studia na rozšíření schopností spolupracovat s AI. Již dnes se ve výuce budoucích lékařů používají podobné technologie, ať už jednoduché přístroje typu simulátoru nepřímé oftalmoskopie nebo komplikované algoritmy jako např. virtuální pacient.
Poslední téma souvisí s vlastností „černé skříňky“, kdy nevíme jak a proč došel algoritmus k danému výsledku, na což navazují problémy jak z hlediska lékařské praxe tak z hlediska právního [39].
Právní postavení podobných algoritmů se v jednotlivých zemích liší a v České republice zatím čekáme na první rozsudky a stanovení míry viny v případě selhání algoritmu AI. Nicméně většinou má algoritmus status zdravotnického prostředku, který lze na evropský trh uvádět v souladu s Nařízením Evropského Parlamentu a Rady (EU) 2017/745 o zdravotnických prostředcích. Před uvedením takového zdravotnického prostředku na trh EU musí úspěšně proběhnout posouzení shody s technickými požadavky stanovenými ve všech nařízeních, která se na něj vztahují. Výsledkem je vydání prohlášení o shodě a opatřením stanoveného výrobku označením shody „CE“. Zdravotnický prostředek uváděný na trh v souladu s touto směrnicí musí být řádně certifikován, registrován a výrobce musí mít zaveden systém řízení jakosti. Účel a způsob užití, včetně požadavků na odbornou kvalifikaci uživatele, definuje výrobce a výrobek je tak i certifikován. Zvolený způsob užití má dopad na rizika, která jsou s použitím prostředku spojena, a která výrobce musí adekvátním způsobem ošetřit. Je-li zdravotnický prostředek certifikován a používán k účelu danému výrobcem v souladu se způsobem užití a v souladu s návodem k použití, může uživatel považovat výsledek analýzy takového zdravotnického prostředku za spolehlivý.
Praktický multioborový problém ukázala např. studie hodnocení mamografických nálezů. V souboru těchto pacientů nebyl statisticky významný rozdíl v celkovém hodnocení snímků mezi AI a člověkem, nicméně se prokázalo, že pokud člověk hodnotí snímky po AI, tak má tendenci selhat u snímků, které byly hodnoceny AI jako falešně negativní ve srovnání s tím, pokud by je hodnotil rovnou bez předchozí „nápovědy“. Jinými slovy lékař příliš spoléhá na závěr AI a neplní roli kontrolního mechanismu, pokud má výsledek předem k dispozici [40]. Podobnou situaci s nejasným právním rámcem jsme viděli opakovaně při testování autonomních vozidel, kdy některé automobilky měly potíže s usínáním operátorů/ řidičů za jízdy.
ZÁVĚR
Ve screeningu diabetické retinopatie z fotografií fundu již dnes překoná AI svého lidského kolegu v mnohých aspektech. Většina systémů přesahuje specifitou i senzitivitou 90 % úspěšnost a v kategorii zrak ohrožující DR se blíží 99–100 %. Nicméně je třeba si uvědomit, že AI hodnotí, prozatím, pouze surová data bez navazujícího kontextu a je jasné, že dva stejné nálezy u dvou zcela rozdílných pacientů můžou vyžadovat diametrálně odlišné přístupy. V tuto chvíli se autoři článku těší na zefektivnění celého systému a výraznou diagnostickou podporu využití AI, která bude hrát spíše roli nástroje pro „druhý názor“, než ultimativní diagnostické jednotky bez zásahu člověka.
Do redakce doručeno dne: 19. 10. 2020
Přijato k publikaci dne: 8. 12. 2020
Publikováno on-line: 10. 3. 2021
*První a druhý autor se na článku podíleli stejnou měrou.
Autoři práce prohlašují, že vznik i téma odborného sdělení a jeho zveřejnění není ve střetu zájmů a není podpořeno žádnou farmaceutickou firmou. Práce nebyla zadána jinému časopisu ani jinde otištěna, s výjimkou kongresových abstrakt a doporučených postupů.
MUDr. Zbyněk Straňák
Oftalmologická klinika FNKV
Šrobárova 50
100 34 Praha 10
E-mail: zbynek.stranak@fnkv.cz
Sources
1. Kulkarni S, Seneviratne N, Baig MS, Khan AHA. Artificial Intelligence in Medicine: Where Are We Now? Acad Radiol. leden 2020;27(1):62–70.
2. Esteva A, Kuprel B, Novoa RA, Ko J, Swetter SM, Blau HM, et al. Dermatologist-level classification of skin cancer with deep neural networks. Nature. 2. únor 2017;542(7639):115–118.
3. Witmer MT, Kiss S. Wide-field imaging of the retina. Surv Ophthalmol. duben 2013;58(2):143–154.
4. Piyasena MMPN, Gudlavalleti VSM, Gilbert C, Yip JL, Peto T, MacLeod D, et al. Development and Validation of a Diabetic Retinopathy Screening Modality Using a Hand-Held Nonmydriatic Digital Retinal Camera by Physician Graders at a Tertiary-Level Medical Clinic: Protocol for a Validation Study. JMIR Res Protoc. 10. prosinec 2018;7(12):e10900.
5. Liew G, Michaelides M, Bunce C. A comparison of the causes of blindness certifications in England and Wales in working age adults (16-64 years), 1999-2000 with 2009-2010. BMJ Open. nor 2014;4(2):e004015–e004015.
6. Cheung N, Mitchell P, Wong TY. Diabetic retinopathy. The Lancet. ervenec 2010;376(9735):124–136.
7. Ústav zfravotnických informací a statistiky. ZDRAVOTNICTVÍ ČR: Stručný přehled činnosti oboru diabetologie a endokrinologie za období 2007–2017 NZIS REPORT č. K/1 (08/2018). Ústav zfravotnických informací a statistiky; 2018.
8. Scanlon PH. The English National Screening Programme for diabetic retinopathy 2003-2016. Acta Diabetol. erven 2017;54(6):515–525.
9. Nguyen HV, Tan GSW, Tapp RJ, Mital S, Ting DSW, Wong HT, et al. Cost-effectiveness of a National Telemedicine Diabetic Retinopathy Screening Program in Singapore. Ophthalmology. 1. prosinec 2016;123(12):2571–2580.
10. Tufail A, Kapetanakis VV, Salas-Vega S, Egan C, Rudisill C, Owen CG, et al. An observational study to assess if automated diabetic retinopathy image assessment software can replace one or more steps of manual imaging grading and to determine their cost-effectiveness. Health Technol Assess Winch Engl. prosinec 2016;20(92):1–72.
11. Fleming AD, Goatman KA, Philip S, Prescott GJ, Sharp PF, Olson JA. Automated grading for diabetic retinopathy: a large-scale audit using arbitration by clinical experts. Br J Ophthalmol. 1. prosinec 2010;94(12):1606.
12. LeCun Y, Bengio Y, Hinton G. Deep learning. Nature. 1. květen 2015;521(7553):436–444.
13. Abràmoff MD, Lavin PT, Birch M, Shah N, Folk JC. Pivotal trial of an autonomous AI-based diagnostic system for detection of diabetic retinopathy in primary care offices. NPJ Digit Med. 28. srpen 2018;1 : 39–39.
14. Yang WH, Zheng B, Wu MN, Zhu SJ, Fei FQ, Weng M, Zhang X, Lu PR. An Evaluation System of Fundus Photograph-Based Intelligent Diagnostic Technology for Diabetic Retinopathy and Applicability for Research. Diabetes Ther. 2019 Oct;10(5):1811-1822. doi: 10.1007/s13300-019-0652-0. Epub 2019 Jul 9. PMID: 31290125; PMCID: PMC6778552
15. van der Heijden AA, Abramoff MD, Verbraak F, van Hecke MV, Liem A, Nijpels G. Validation of automated screening for referable diabetic retinopathy with the IDx-DR device in the Hoorn Diabetes Care System. Acta Ophthalmol (Copenh). nor 2018;96(1):63–68.
16. Verbraak FD, Abramoff MD, Bausch GCF, Klaver C, Nijpels G, Schlingemann RO, et al. Diagnostic Accuracy of a Device for the Automated Detection of Diabetic Retinopathy in a Primary Care Setting. Diabetes Care. 1. duben 2019;42(4):651.
17. Shah A, Clarida W, Amelon R, Hernaez-Ortega MC, Navea A, Morales - Olivas J, et al. Validation of Automated Screening for Referable Diabetic Retinopathy With an Autonomous Diagnostic Artificial Intelligence System in a Spanish Population. J Diabetes Sci Technol. 16. březen 2020;1932296820906212.
18. Grzybowski A, Brona P. A pilot study of autonomous artificial intelligence - based diabetic retinopathy screening in Poland. Acta Ophthalmol (Copenh) [Internet]. 3. květen 2019 [citován 6. říjen 2019];0(0). Dostupné z: https://doi.org/10.1111/aos.14132
19. Ting DSW, Cheung CY-L, Lim G, Tan GSW, Quang ND, Gan A, et al. Development and Validation of a Deep Learning System for Diabetic Retinopathy and Related Eye Diseases Using Retinal Images From Multiethnic Populations With Diabetes. JAMA. 12. prosinec 2017;318(22):2211–2223.
20. Ribeiro ML, Nunes SG, Cunha-Vaz JG. Microaneurysm turnover at the macula predicts risk of development of clinically significant macular edema in persons with mild nonproliferative diabetic retinopathy. Diabetes Care. 2012/11/30 vyd. květen 2013;36(5):1254–1259.
21. Ramos JD, Almeida N, Oliveira CM, Neves C, Ribeiro L. 28th Meeting of the European Association for the Study of Diabetes Eye Complications Study Group (EASDec): Belfast Northern Ireland 24th – 26th May 2018. Eur J Ophthalmol. 1. květen 2018;28(1_ suppl):1–38.
22. Szegedy C, Liu W, Jia Y, Sermanet P, Reed S, Anguelov D, et al. Going Deeper with Convolutions. 16. září 2014;
23. Szegedy C, Ioffe S, Vanhoucke V, Alemi A. Inception-v4, inception - -resnet and the impact of residual connections on learning. ArXiv Prepr ArXiv160207261. 2016;
24. Gulshan V, Peng L, Coram M, Stumpe MC, Wu D, Narayanaswamy A, et al. Development and Validation of a Deep Learning Algorithm for Detection of Diabetic Retinopathy in Retinal Fundus Photographs. JAMA. 13. prosinec 2016;316(22):2402–2410.
25. Krause J, Gulshan V, Rahimy E, Karth P, Widner K, Corrado GS, et al. Grader Variability and the Importance of Reference Standards for Evaluating Machine Learning Models for Diabetic Retinopathy. Ophthalmology. 1. srpen 2018;125(8):1264–1272.
26. Raumviboonsuk P, Krause J, Chotcomwongse P, Sayres R, Raman R, Widner K, et al. Deep learning versus human graders for classifying diabetic retinopathy severity in a nationwide screening program. NPJ Digit Med. 10. duben 2019;2 : 25–25.
27. Li Z, Keel S, Liu C, He Y, Meng W, Scheetz J, et al. An Automated Grading System for Detection of Vision-Threatening Referable Diabetic Retinopathy on the Basis of Color Fundus Photographs. Diabetes Care. 1. prosinec 2018;41(12):2509.
28. Sahlsten J, Jaskari J, Kivinen J, Turunen L, Jaanio E, Hietala K, et al. Deep Learning Fundus Image Analysis for Diabetic Retinopathy and Macular Edema Grading. Sci Rep. ervenec 2019;9(1):10750–10750.
29. Natarajan S, Jain A, Krishnan R, Rogye A, Sivaprasad S. Diagnostic Accuracy of Community-Based Diabetic Retinopathy Screening With an Offline Artificial Intelligence System on a Smartphone. JAMA Ophthalmol. 8. srpen 2019;137(10):1182–1188.
30. Sosale B, Aravind SR, Murthy H, Narayana S, Sharma U, Gowda SGV, et al. Simple, Mobile-based Artificial Intelligence Algorithm in the detection of Diabetic Retinopathy (SMART) study. BMJ Open Diabetes Res Care. leden 2020;8(1):e000892.
31. Sosale B, Sosale AR, Murthy H, Sengupta S, Naveenam M. Medios - An offline, smartphone-based artificial intelligence algorithm for the diagnosis of diabetic retinopathy. Indian J Ophthalmol. nor 2020;68(2):391–395.
32. Bhaskaranand M, Ramachandra C, Bhat S, Cuadros J, Nittala MG, Sadda S, et al. Automated Diabetic Retinopathy Screening and Monitoring Using Retinal Fundus Image Analysis. J Diabetes Sci Technol. nor 2016;10(2):254–261.
33. Tufail A, Rudisill C, Egan C, Kapetanakis VV, Salas-Vega S, Owen CG, et al. Automated Diabetic Retinopathy Image Assessment Software: Diagnostic Accuracy and Cost-Effectiveness Compared with Human Graders. Ophthalmology. 1. březen 2017;124(3):343–351.
34. Bhaskaranand M, Ramachandra C, Bhat S, Cuadros J, Nittala MG, Sadda SR, et al. The Value of Automated Diabetic Retinopathy Screening with the EyeArt System: A Study of More Than 100,000 Consecutive Encounters from People with Diabetes. Diabetes Technol Ther. 2019/08/07 vyd. listopad 2019;21(11):635–643.
35. Heydon P, Egan C, Bolter L, Chambers R, Anderson J, Aldington S, et al. Prospective evaluation of an artificial intelligence-enabled algorithm for automated diabetic retinopathy screening of 30 000 patients. Br J Ophthalmol. erven 2020;bjophthalmol - 2020-316594.
36. González-Gonzalo C, Sánchez-Gutiérrez V, Hernández-Martínez P, Contreras I, Lechanteur YT, Domanian A, et al. Evaluation of a deep learning system for the joint automated detection of diabetic retinopathy and age-related macular degeneration. Acta Ophthalmol (Copenh). 2019/11/26 vyd. erven 2020;98(4): 368–377.
37. Riaz H, Park J, Choi H, Kim H, Kim J. Deep and Densely Connected Networks for Classification of Diabetic Retinopathy. Diagn Basel Switz. 2. leden 2020;10(1):24.
38. Goertzel B. Artificial General Intelligence: Concept, State of the Art, and Future Prospects. J Artif Gen Intell. 13. leden 2014;0.
39. Ethical Dimensions of Using Artificial Intelligence in Health Care. AMA J Ethics. 1. únor 2019;21(2):E121–124.
40. Lehman CD, Wellman RD, Buist DSM, Kerlikowske K, Tosteson ANA, Miglioretti DL, et al. Diagnostic Accuracy of Digital Screening Mammography With and Without Computer-Aided Detection. JAMA Intern Med. 1. listopad 2015;175(11):1828–1837.
Labels
Ophthalmology
Article was published inCzech and Slovak Ophthalmology

2021 Issue 5-
All articles in this issue
- VYUŽITÍ UMĚLÉ INTELIGENCE V ZÁCHYTU DIABETICKÉ RETINOPATIE. PŘEHLED
- MODROŽLUTÁ PERIMETRIE U PACIENTŮ S DIABETEM BEZ DIABETICKÉ RETINOPATIE
- OBOUSTRANNÁ AMYLOIDÓZA TŘÍ VÍČEK. KAZUISTIKA
- Prof. MUDr. Anton Gerinec, CSc. – ENCYKLOPÉDIA OFTALMOLÓGIE
- OCT ANGIOGRAFIE U CHOROB VITREORETINÁLNÍHO ROZHRANÍ
- ENDOTHELIAL CELL LOSS AFTER PARS PLANA VITRECTOMY
- SPONTANEOUS REGRESSION OF A PRIMARY IRIS STROMAL CYST IN A PATIENT WITH KERATOCONUS. A CASE REPORT
- Czech and Slovak Ophthalmology
- Journal archive
- Current issue
- Online only
- About the journal
Most read in this issue- VYUŽITÍ UMĚLÉ INTELIGENCE V ZÁCHYTU DIABETICKÉ RETINOPATIE. PŘEHLED
- OBOUSTRANNÁ AMYLOIDÓZA TŘÍ VÍČEK. KAZUISTIKA
- MODROŽLUTÁ PERIMETRIE U PACIENTŮ S DIABETEM BEZ DIABETICKÉ RETINOPATIE
- Prof. MUDr. Anton Gerinec, CSc. – ENCYKLOPÉDIA OFTALMOLÓGIE
Login#ADS_BOTTOM_SCRIPTS#Forgotten passwordEnter the email address that you registered with. We will send you instructions on how to set a new password.
- Career


