-
Medical journals
- Career
EPIGENETICKÉ ZMENY V PATOGENÉZE MALÍGNEHO MELANÓMU UVEY A MOŽNOSTI ICH TERAPEUTICKÉHO OVPLYVNENIA. PRIEHLAĎ
Authors: B. Smolková; L. Demková
Authors‘ workplace: Ústav experimentálnej onkológie, Biomedicínske centrum Slovenskej akadémie vied, Bratislava
Published in: Čes. a slov. Oftal., 76, 2020, No. 2, p. 55-60
Category: Review Article
doi: https://doi.org/10.31348/2020/12Overview
Uveálny melanóm (UM) je závažné onkologické ochorenie, ktoré vedie ku vzniku metastatickej choroby u viac ako 50 % pacientov. Napriek zlepšeniu lokálnej liečby, stále neexistuje efektívna terapia, ktorá by zabránila rozvoju metastáz. Preto si toto ochorenie vyžaduje intenzívny výskum, zameraný na identifikáciu nových liečebných stratégií.
V predklinických modeloch UM bolo dokázané, že epigenetické liečivá zvyšujú senzitivitu rezistentných nádorových buniek na liečbu. Úspešné použitie inhibítorov histón deacetyláz, ktoré u nádorových buniek indukovali zastavenie bunkového cyklu, reprogramovanie konzistentné s melanocytovou diferenciáciou a inhibíciu rastu nádorov v predklinických modeloch, dokazuje úlohu epigenetickej regulácie v metastázovaní UM. Hlbšie pochopenie úlohy epigenetických zmien v patogenéze UM by mohlo prispieť k objaveniu účinnejších liečiv, ktoré v kombinácii s tradičnými prístupmi môžu priniesť lepšie terapeutické výsledky pre pacientov s vysokým rizikom progresie ochorenia.
Klíčová slova:
malígny melanóm uvey – epigenetické zmeny – metylácia DNA – modifikácie histónov – nekódujúce RNA
ÚVOD
Malígny melanóm uvey (UM) je najčastejšie sa vyskytujúci vnútroočný nádor u dospelých. Jeho incidencia na Slovensku je 5,1 na 1 milión obyvateľov, čo znamená 32 až 54 novo-diagnostikovaných pacientov ročne [1]. Tumory najčastejšie vznikajú z melanocytov lokalizovaných v uveálnej vrstve oka, primárne v cievovke (choroidea; 85 %), ale môžu pochádzať aj z vráskovca (corpus ciliare; 5-8 %) alebo z dúhovky (iris; 3-5 %) [2].
Liečba primárneho UM sa v súčasnosti odkláňa od radikálnych postupov. Dominuje liečba ionizujúcim žiarením a kombinované prístupy, možná je liečba protónmi aj fotónmi. V našich podmienkach sa využíva brachyterapia episklerálnymi žiaričmi, napr. Ru106, liečba gama nožom alebo stereotaktická rádiochirurgia na lineárnom urýchľovači [3-5]. Prerastanie melanómu choroidey do očnice vedie k radikálnemu výkonu, nie iba enukleácii očnej gule, ale aj k exenterácii očnice [6]. Pri sledovaní prežívania pacientov po enukleácii a po liečbe ionizujúcim žiarením sa nezistili významné rozdiely [7,8]. Napriek nízkemu výskytu lokálnych rekurencií v súčasnosti nie je k dispozícii žiadna liečba, ktorá by zvyšovala celkové prežívanie metastatických pacientov. Rovnako neexistuje vysvetlenie, týkajúce sa primárnej rezistencie UM voči akejkoľvek systémovej liečbe. V štádiu klinického skúšania sú inhibítory tyrozínkinázy alebo Met (receptorový proteín rastového faktora hepatocytov), inhibítory históndeacetyláz (HDAC) alebo imunoterapia (NCT02068586, NCT02223819, NCT02068586, NCT01585194) [9].
UM metastázuje až u 90 % prípadov do pečene. Mechanizmus, ktorý je základom pečeňového tropizmu, zatiaľ nie je známy. Metastatická choroba, ktorá vzniká u takmer 50 % pacientov, je asociovaná so zlou prognózou. Nedávno publikovaná metaanalýza, uskutočnená v súbore 912 pacientov s metastatickým UM, uvádza medián priemerného prežívania bez progresie 3,3 mesiaca a celkového prežívania 10,2 mesiaca [10]. Riziko vzniku metastáz je asociované s veľkosťou nádoru, extraokulárnym prerastaním, vysokou mitotickou aktivitou a epiteloidným typom nádorových buniek (Tabuľka 1). K najvýznamnejším molekulárnym markerom metastatického rizika patria monozómia chromozómu 3 a špecifický profil expresie mRNA v nádorovom tkanive. Expresný profil panelu 15-tich génov, komerčne dostupný pod názvom DecisionDx-UM, umožňuje rozdelenie pacientov na základe metastatického rizika do 3 skupín: Trieda 1A - veľmi nízke riziko s 2% pravdepodobnosťou metastatického šírenia; Trieda 1B - nízke riziko s 21% pravdepodobnosťou vzniku metastáz; Trieda 2 - vysoké riziko so 72% pravdepodobnosťou metastázovania počas nasledujúcich piatich rokov [11]. Kľúčovú úlohu v metastázovaní zohrávajú somatické mutácie génu BAP1 (BRCA1 - Associated Protein 1), vedúce k zníženiu alebo úplnej strate expresie Bap1 proteínu [12]. BAP1, lokalizovaný v oblasti 3p21, je tumor-supresorový gén, ktorý sa podieľa na epigenetickej regulácii expresie génov, významných počas vývoja a diferenciácie. Jeho inaktivácia vedie ku vzniku buniek, ktoré majú vlastnosti nádorových kmeňových buniek. Takýto fenotyp je asociovaný s agresívnym správaním nádorov a zlou prognózou [13]. S metastatickým rizikom sú spojené aj abnormality chromozómov 1, 6, 8 a 9, spolu so špecifickými mutáciami v ďalších génoch ako sú SF3B1 (Splicing Factor 3B Subunit 1A) alebo EIF1AX (eukaryotic translation initiation factor 1A, X-linked) [14]. Mutácie BRAF (B-Raf Proto-Oncogene, Serine/Threonine Kinase) a NRAS (NRAS Proto-Oncogene, GTPase), ktoré sú typické pre kožný melanóm (40 %–50 % a 15 %–20 %), sa u UM nevyskytujú [15,16].
Table 1. Klinické, histologické a molekulárne markery pre predikciu rizika metastázovania 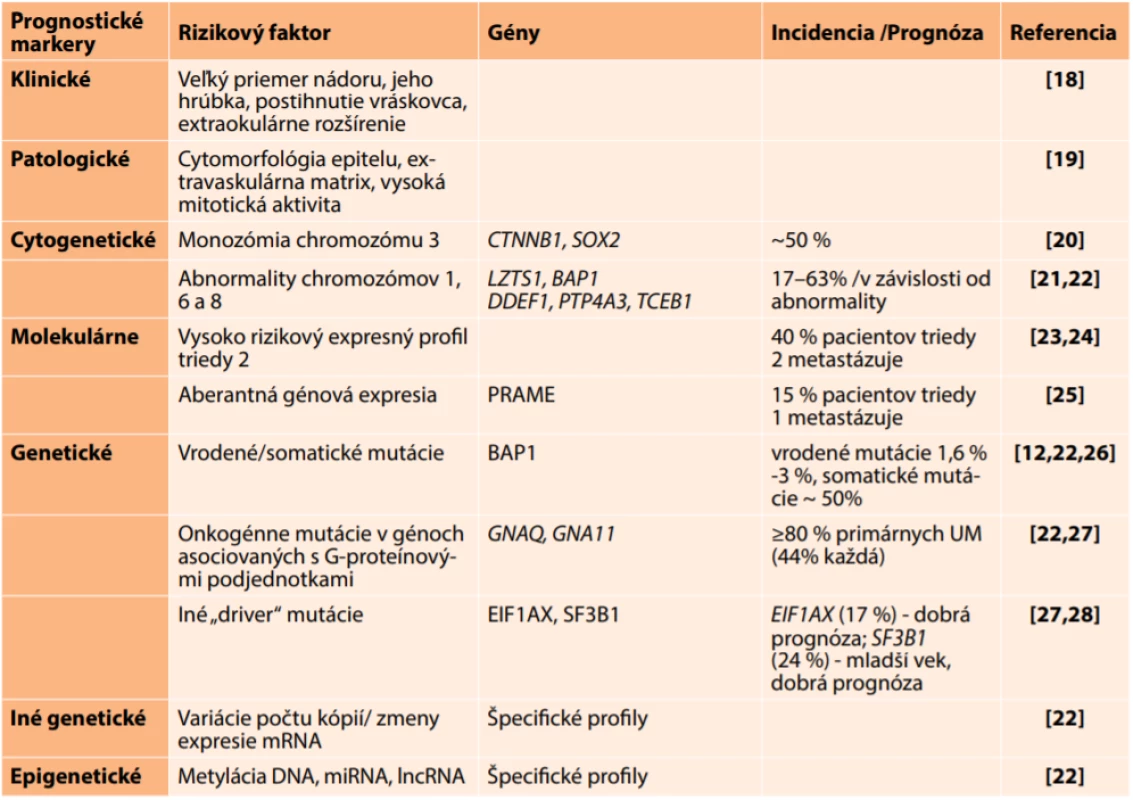
Modifikované podľa [17] Epigenetické mechanizmy
Epigenetické mechanizmy ako sú metylácia DNA, modifikácie histónov a nekódujúce RNA sú esenciálne pre normálny vývin a homeostázu organizmu. Navzájom interagujú a majú kľúčovú úlohu pri udržiavaní tkanivovo-špecifickej expresie génov a ochrane pred genetickou instabilitou. Ich narušenie môže viesť k zmenám vo funkcii génov, malígnej transformácii a môže mať dopad na jednotlivé signálne dráhy podieľajúce sa na metastázovaní. Úlohu epigenetickej deregulácie v patogenéze UM potvrdili výsledky niekoľkých štúdií. Jednou z najvýznamnejších je integrovaná multiplatformová analýza 80 UM, ktorá ukázala, že okrem známych genetických zmien sú so zlou prognózou pacientov asociované aj zmeny v metylácii DNA a expresii viacerých mikroRNA (miRNA) a dlhých nekódujúcich RNA (lncRNA) [22]. U nádorov s vysokým rizikom metastázovania je de-regulovaná aj expresia génov, kódujúcich samotné epigenetické regulačné enzýmy [29]. Epigenetická inaktivácia expresie môže mať zvlášť významnú úlohu predovšetkým v génoch lokalizovaných na chromozómoch s typickými abnormalitami v počte kópií ako sú chromozómy 1, 3, 6 alebo 8. Na chromozóme 3, monozómia ktorého je prítomná približne u 50 % pacientov s UM, je umiestnených niekoľko tumor-supresorových génov a génov, ktoré majú kľúčovú úlohu v hematogénnej diseminácii. Sú tu umiestnené napríklad gény RASSF1A (RAS association domain family 1), FHIT (Fragile Histidine Triad), BAP1 (BRCA1 - Associated Protein 1), CTNNB1 (Catenin Beta 1) alebo SOX2 (Sex-determining region Y (SRY)-Box2).
Metylácia DNA
Metylácia DNA patrí medzi najlepšie preštudované epigenetické mechanizmy. Ide o kovalentné pripojenie metylovej skupiny (-CH3) k bázam DNA, predovšetkým cytozínovému zvyšku v dinukleotidovej sekvencii CpG. Je katalyzovaná enzýmami DNA metyltransferázami (DNMTs) za prítomnosti S-adenozylmetionínu (SAM), ktorý sa uplatňuje ako donor metylovej skupiny. Metylácia / demetylácia je dôležitý mechanizmus na udržanie integrity genómu a zabezpečenie tkanivovo-špecifickej génovej expresie (Obrázok 1). V porovnaní s normálnymi bunkami, nádorové bunky majú narušený metylačný vzorec DNA buď znížením (hypometylácia), alebo zvýšením (hypermetylácia) počtu metylových skupín. V iniciácii onkologických ochorení sú významné predovšetkým hypermetylácia promótorov tumor-supresorových génov, hypometylácia protoonkogénov a globálna hypometylácia (ovplyvňujúca mimogénové a vnútrogénové oblasti), ktorá vedie k zvýšeniu chromozómovej instability. U pacientov s UM bola hypermetylácia DNA identifikovaná ako príčina inaktivácie viacerých génov, z ktorých väčšina sa podieľa na regulácii bunkového cyklu. Patria k nim gény APC, RASSF1A, RARB, LZTS1, CDH1, RB1, CDKN2A, PRAME a iné [17,30].
Image 1. Schematické znázornenie rozdielov v metylácii DNA v promótoroch génov, v mimogénových a vnútrogénových oblastiach u normálnej a nádorovej bunky. Metylácia v mimogénových oblastiach chráni bunku pred chromozómovou instabilitou, nádorová bunka má znížený počet metylových skupín v tejto oblasti. Aktívne gény nemajú metylované promotóry, neprepisované gény ich majú hypermetylované. Metylované CpG dinukleotidy sú označené čiernou guličkou, nemetylované CpG dinukleotidy bielou guličkou. 
Modifikácie histónov
Na aktivitu génov majú veľký vplyv aj chemické modifikácie histónových proteínov, ktoré spolu s tesne ovinutým vláknom DNA tvoria komplex nazývaný nukleozóm. Je to základná jednotka chromatínu, vláknitej štruktúry, ktorá v závislosti od stupňa kondenzácie zohráva kľúčovú úlohu v kontrole expresie génov (Obrázok 2). Tvorba neaktívneho, kondenzovaného heterochromatínu, je viazaná s nízkym stupňom acetylácie a vysokým stupňom metylácie histónových molekúl. Menej kondenzovaný euchromatín je transkripčne aktívny [31]. Pre pochopenie úlohy modifikácií histónov v progresii UM, je prelomový objav úlohy Bap1 proteínu v regulácii diferenciácie zárodočných buniek. Strata expresie Bap1 bráni acetylácii histónu H3K27 v promótoroch kľúčových génov, regulujúcich diferenciáciu ektodermu, mezodermu a neurálnej lišty, čo vedie k zníženiu ich expresie [13]. Rovnováha medzi acetyláciou a deacetyláciou génu je určená relatívnymi aktivitami histón acetyltransferáz a HDAC. Inhibítory HDAC umožňujú re-expresiu epigeneticky inaktivovaných génov.
Image 2. Schematické znázornenie vplyvu modifikácií histónov a metylácie DNA na kondenzáciu chromatínu. Voľná štruktúra chromatínu tzv. euchromatín, s acetyláciou a metyláciou histónových molekúl - bez metylácie DNA, je transkripčne aktívny. Kondenzovaný heterochromatín s metylovanou DNA je transkripčne inaktívny. Metylované CpG dinukleotidy na DNA sú označené čiernou guličkou, nemetylované CpG dinukleotidy bielou guličkou, Ac – acetylácia, Met – metylácia histónov. Upravené podľa [19]. ![Schematické znázornenie vplyvu modifikácií histónov a metylácie DNA
na kondenzáciu chromatínu. Voľná štruktúra chromatínu tzv. euchromatín, s acetyláciou a metyláciou histónových molekúl - bez metylácie DNA, je transkripčne
aktívny. Kondenzovaný heterochromatín s metylovanou DNA je transkripčne
inaktívny. Metylované CpG dinukleotidy na DNA sú označené čiernou guličkou,
nemetylované CpG dinukleotidy bielou guličkou, Ac – acetylácia, Met – metylácia
histónov. Upravené podľa [19].](https://www.prolekare.cz/media/cache/resolve/media_object_image_small/media/image_pdf/41d614cbf5bd8dcf04b2964796ff9ae7.jpeg)
Nekódujúce RNA
Medzi najlepšie preštudované nekódujúce RNA patria malé, 19-25 nukleotidové molekuly RNA, tzv. mikroRNA (miRNA). Primárnym mechanizmom ich fungovania je naviazanie sa na komplementárnu mRNA, čím inhibujú jej transláciu alebo mRNA degradujú (Obrázok 3) [32]. U bunkových línií, v nádorových tkanivách a periférnej krvi pacientov s UM boli popísané zmeny expresie viacerých miRNA, medzi nimi napríklad zvýšená expresia let-7b, miR-20a, miR-125b, miR-143, miR-146a, miR-155, miR-181, miR-193b, miR-199a, miR-223, miR-367, miR-454, miR-652, či znížená expresia miR-9, miR-34b/c, miR-124a, miR-137, miR-144, miR-145, miR-182, miR-204 a iných (viď prehľadový článok [17]). Aberantne exprimované miRNA hrajú dôležitú úlohu pri deregulácii onkogénnych dráh v UM, a môžu podporovať metastatické šírenie [33]. Okrem toho, že môžu byť zaujímavým diagnostickým a prognostickým biomarkerom, ponúkajú nám tiež sľubný terapeutický cieľ. Bolo dokázané, že funkciu špecifických miRNA je možné farmakologicky inhibovať komplementárnymi, chemicky modifikovanými oligonukleotidmi, ktoré sa nazývajú anti-miRs alebo antagomiRs. Preukázali sľubné výsledky v predklinickom vývoji [34] a mohli by kompenzovať zvýšenú expresiu génov onkogénnych dráh a tým pomáhať pri manažmente a liečbe UM. Expresia miRNA môže byť regulovaná prostredníctvom metylácie ich promótorov. Chen a kol. napr. uviedli, že hypometylačné činidlo 5-aza-2’-deoxycytidín (decitabín), umožnilo zvýšenie expresie miR-137 [35]. Podobne bola expresia miR-124a v bunkách UM obnovená po použití decitabínu a inhibítora histón deacetylázy, trichostatínu A [36]. Tieto zistenia sú dôkazom, že jednotlivé epigenetické mechanizmy, okrem plnenia svojej individuálnej úlohy, vzájomne na seba pôsobia na niekoľkých úrovniach a vzájomne interagujú.
Image 3. Mechanizmus pôsobenia miRNA. Naviazaním na komplementárnu sekvenciu v 3’ oblasti cieľovej mRNA zabránia jej prepisu. 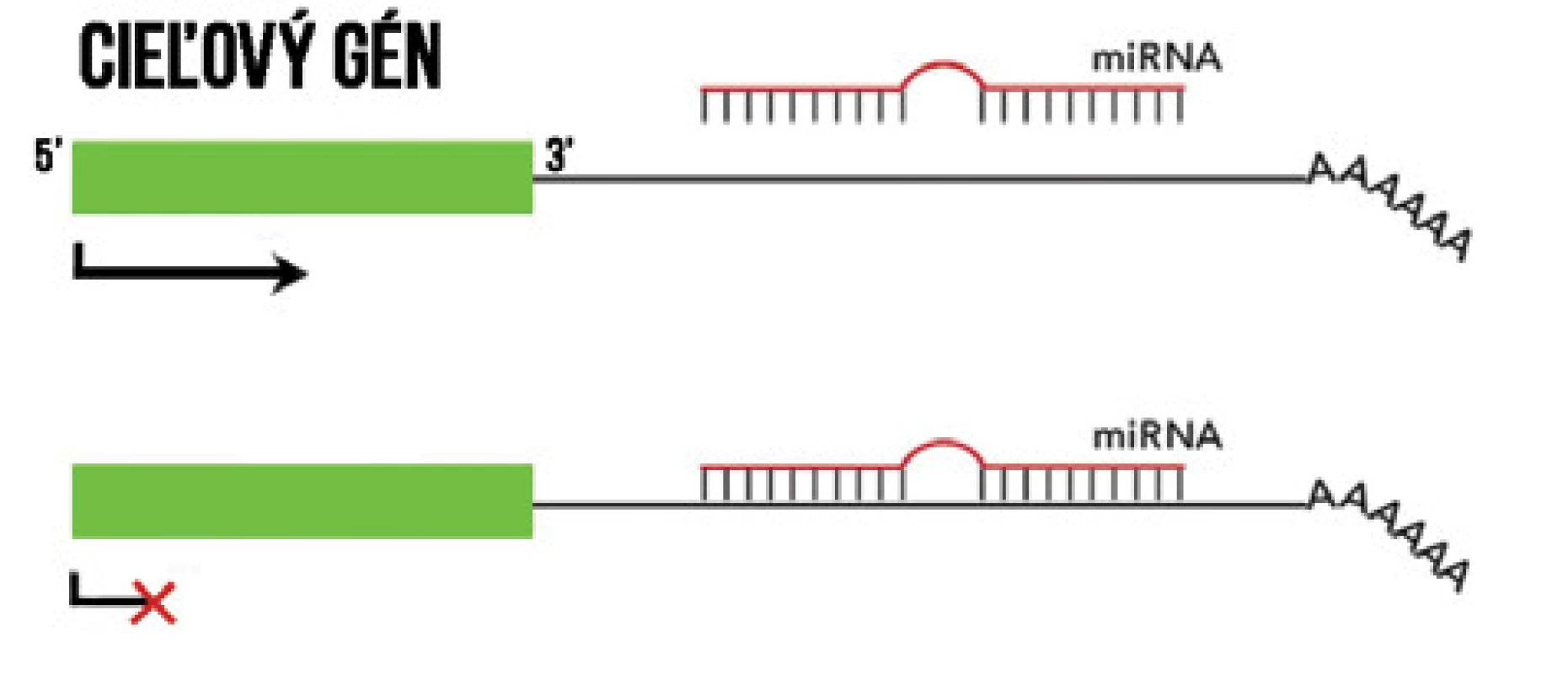
Dlhé nekódujúce RNA sú definované ako transkripty RNA s dĺžkou väčšou ako 200 nukleotidov, bez schopnosti kódovať proteíny. Zasahujú do tumorigenézy nádorov, podieľajú sa na procesoch angiogenézy, bunkovej proliferácie, migrácie a apoptózy. U UM bola popísaná znížená expresia PAUPAR a zvýšená expresia viacerých lncRNA, napríklad ROR, HOXA11-AS, FTH1P3, PVT1, CYTOR, BANCR, PVT1/NEAT1 a MALAT1 (viď prehľadový článok [17]).
Potenciál pre epigenetickú terapiu
Strata BAP1 je spojená so stratou melanocytovej diferenciácie a zvýšeným metastatickým potenciálom. Inhibítory HDAC dokázali zvrátiť fenotypové účinky inaktivácie BAP1 indukciou morfologickej diferenciácie a zmenou vysokorizikového na nízkorizikový profil génovej expresie v bunkách UM [37]. Kyselina valproová, trichostatín A, tenovín-6, depsipeptid, panobinostat (LBH-589), vorinostat (kyselina suberanilohydroxámová) entinostat (MS-275), quisinostat, NaB, JSL-1, MC1568 a MC1575 preukázali sľubné protinádorové účinky aj v ďalších predklinických štúdiách u UM [38]. Môžu blokovať proliferáciu nádorových buniek, indukovať zastavenie ich rastu, terminálnu diferenciáciu, bunkovú smrť a inhibíciu angiogenézy. Ukázalo sa tým, že inhibítory HDAC a DNMT by mohli predstavovať alternatívnu adjuvantnú terapiu na predĺženie nádorovej dormancie. V súčasnosti prebiehajú klinické štúdie s kyselinou valproovou a vorinostatom (NCT02068586, NCT01587352), entinostatom (štúdia PEMDAC s pembrolizumabom, entinostatom, NCT02697630) a inhibítorom bromodomény BRD4 PLX2853 (NCT03297424) [39]. Inhibícia proteínov bromodomény a extraterminálnych (BET) proteínov ponúka nový terapeutický prístup pre UM. Ide o epigenetické regulátory tretej generácie, ktoré ovplyvňujú replikáciu DNA, remodeláciu a transkripciu chromatínu. Napriek regulačným schváleniam na liečbu niektorých hematologických malignít je problematika epigenetickej terapie u solídnych nádorov stále kontroverzná. Podľa niektorých autorov globálna hypometylácia DNA v dôsledku použitia inhibítora DNMT1 5-aza-2′-deoxycytidínu u myší viedla k chromozómovej instabilite a zvýšenému výskytu sekundárnych malignít [40,41]. Hoci boli tvrdenia o riziku spojenom s liečbou hypometylačnými látkami inými autormi kritizované [42], účinnosť prvej generácie epigenetických liečiv u pacientov so solídnymi nádormi bola sklamaním [43]. Vďaka vývoju nových zlúčenín a lepšiemu pochopeniu molekulárnej podstaty nádorových ochorení sa však zdá, že epigenetické liečivá by mohli mať dôležitú úlohu v synergii s klasickými terapeutickými prístupmi [43]. Využitie nanotechnológií by mohlo prispieť k zvýšeniu účinnosti a zníženiu tkanivovej toxicity takejto kombinovanej liečby.
ZÁVER
Epigenetické zmeny zohrávajú významnú úlohu v patogenéze onkologických ochorení. Majú reverzibilnú povahu a sú preto dobrým terapeutickým cieľom. V mnohých predklinických štúdiách bolo dokázané, že epigenetické liečivá umožňujú obnovu expresie aberantne inaktivovaných tumor-supresorových génov a zvyšujú senzitivitu rezistentných nádorových buniek na liečbu. Pre objavenie účinnejších liečiv pre adjuvantnú terapiu UM a liečbu metastatickej choroby je nevyhnutné akceptovanie významu epigenetických zmien a pochopenie ich úlohy v patogenéze a progresii tohoto ochorenia. V kombinácii s tradičnými terapeutickými postupmi ako sú imuno-, chemo - alebo rádioterapia by mohli epigenetické liečivá priniesť lepšie výsledky pre doteraz neliečiteľné, pokročilé štádiá UM.
Poďakovanie
Práca bola finančne podporená grantami APVV-17-0369 a VEGA 2/0052/18.
Prehlásenie
Autori článku prehlasujú, že vznik odborného článku, jeho publikovanie a zverejnenie nie je predmetom stretu záujmov a nie je podporené žiadnou farmaceutickou firmou.
Práca nebola zadaná inému časopisu ani inde vytlačená.
Do redakce doručeno dne: 19. 1. 2020
Do tisku přijato dne: 5. 3. 2020
Mgr. Božena Smolková, Ph.D.
Ústav experimentálnej onkológie, Biomedicínske centrum Slovenskej akadémie vied
Dúbravská cesta 9
845 05 Bratislava
Sources
1. Furdova, A., Olah, Z., Svetlosakova, Z., et al.: The current state of the evidence of malignant tumors of the eye and its adnexa (dg. C69) in the Slovak Republic and in the Czech Republic. Cesk Slov Oftalmol, 68(5);2012;195–201.
2. Vivet-Noguer, R., Tarin, M., Roman-Roman, S., et al.: Emerging Therapeutic Opportunities Based on Current Knowledge of Uveal Melanoma Biology. Cancers, 11(7);2019 : 1019 s.
3. Furdova, A., Sramka, M., Chorvath, M., et al.: Clinical experience of stereotactic radiosurgery at a linear accelerator for intraocular melanoma. Melanoma Res, 27(5);2017 : 463–8.
4. Furdova, A., Sramka, M., Chorvath, M., et al.: Stereotactic radiosurgery in intraocular malignant melanoma--retrospective study. Neuro Endocrinol Lett, 35(1);2014 : 28–36.
5. Furdova, A., Sramka, M., Waczulikova, I., et al.: Stereotactic Rediosurgery for Uveal Melanoma; Postradiation Complications. Cesk Slov Oftalmol, 71(5);2015 : 134–42.
6. Furdová, A., Ferková, A., Krásnik, V., et al.: Exenterácia očnice pre malígny melanóm choroidey v štádiu T4; možnosti epitetického riešenia. Čes a slov Oftal,71(3);2015.
7. Furdova, A., Babal, P., Kobzova, D., et al.: Uveal melanoma survival rates after single dose stereotactic radiosurgery. Neoplasma, 65(6);2018 : 965–71.
8. Furdova, A., Slezak, P., Chorvath, M., et al.: No differences in outcome between radical surgical treatment (enucleation) and stereotactic radiosurgery in patients with posterior uveal melanoma. Neoplasma, 57(4);2010 : 377–81.
9. Yang, J., Manson, D. K., Marr, B. P., et al.: Treatment of uveal melanoma: where are we now? Therapeutic advances in medical oncology, 10;2018 : 1–17.
10. Khoja, L., Atenafu, E. G., Suciu, S., et al.: Meta-Analysis in Metastatic Uveal Melanoma to Determine Progression-Free and Overall Survival Benchmarks: an International Rare Cancers Initiative (IRCI) Ocular Melanoma study. Ann Oncol, 30;2019 : 1370–1380.
11. Onken, M. D., Worley, L. A., Tuscan, M. D., et al.: An accurate, clinically feasible multi-gene expression assay for predicting metastasis in uveal melanoma. J Mol Diagn, 12(4);2010 : 461–8.
12. Harbour, J. W., Onken, M. D., Roberson, E. D., et al.: Frequent mutation of BAP1 in metastasizing uveal melanomas. Science, 330; 2010 : 1410–3.
13. Kuznetsov, J. N., Aguero, T. H., Owens, D. A., et al.: BAP1) regulates epigenetic switch from pluripotency to differentiation in developmental lineages giving rise to BAP1-mutant cancers. Science Advances, 5(9);2019: eaax1738.
14. Dogrusöz, M., Jager, M. J., Damato, B. Uveal melanoma treatment and prognostication. Asia Pac J Ophthalmol (Phila), 6(2); 2017 : 186–96.
15. Horkovicova, K., Markus, J., Krcova, I., et al.: Mutácia BRAF a možnosti identifikácie prognostických markerov metastázovania uveálneho melanómu. Cesk Slov Oftalmol, 72(4); 2016 : 149-56.
16. Cruz, F., 3rd, Rubin, B. P., Wilson, D., et al.: Absence of BRAF and NRAS mutations in uveal melanoma. Cancer Res, 63(18);2003 : 5761–6.
17. Smolkova, B., Horvathova Kajabova, V., Zmetakova, I., et al.: Role of epigenetic deregulation in hematogenous dissemination of malignant uveal melanoma. Neoplasma, 65(6);2018 : 840–54.
18. Shields, C. L., Kaliki, S., Furuta, M., et al.: American Joint Committee on Cancer classification of posterior uveal melanoma (tumor size category) predicts prognosis in 7731 patients. Ophthalmology, 120(10);2013 : 2066–71.
19. Kaliki, S., Shields, C. L., Shields, J. A. Uveal melanoma: Estimating prognosis. Indian Journal of Ophthalmology, 63(2);2015 : 93–102.
20. Damato, B., Coupland, S. E. Translating uveal melanoma cytogenetics into clinical care. Arch Ophthalmol, 127(4);2009 : 423–9.
21. Coupland, S. E., Lake, S. L., Zeschnigk, M., et al.: Molecular pathology of uveal melanoma. Eye (Lond), 27(2);2013 : 230–42.
22. Robertson, A. G., Shih, J., Yau, C., et al.: Integrative Analysis Identifies Four Molecular and Clinical Subsets in Uveal Melanoma. Cancer Cell, 32(2);2017 : 204–20 e15.
23. Tschentscher, F., Husing, J., Holter, T., et al.: Tumor classification based on gene expression profiling shows that uveal melanomas with and without monosomy 3 represent two distinct entities. Cancer Res, 63(10);2003 : 2578–84.
24. Onken, M. D., Worley, L. A., Ehlers, J. P., et al.: Gene expression profiling in uveal melanoma reveals two molecular classes and predicts metastatic death. Cancer Res, 64(20);2004 : 7205–9.
25. Field, M. G., Decatur, C. L., Kurtenbach, S., et al.: PRAME as an Independent Biomarker for Metastasis in Uveal Melanoma. Clinical Cancer Research, 22(5);2016 : 1234–42.
26. Gupta, M. P., Lane, A. M., DeAngelis, M. M., et al.: Clinical Characteristics of Uveal Melanoma in Patients With Germline BAP1 Mutations. JAMA Ophthalmol, 133(8);2015 : 881–7.
27. Decatur, C. L., Ong, E., Garg, N., et al.: Driver mutations in uveal melanoma: associations with gene expression profile and patient outcomes. JAMA ophthalmology, 134(7);2016 : 728–33.
28. Helgadottir, H., Höiom, V. The genetics of uveal melanoma: current insights. The Application of Clinical Genetics, 9;2016 : 147–55.
29. Herlihy, N., Dogrusoz, M., van Essen, T. H., et al.: Skewed expression of the genes encoding epigenetic modifiers in high-risk uveal melanoma. Invest Ophthalmol Vis Sci, 56(3);2015 : 1447–58.
30. Li, Y., Jia, R., Ge, S. Role of Epigenetics in Uveal Melanoma. International journal of biological sciences, 13(4);2017 : 426–33.
31. Svoreňová, M. L., Smolková, M. B. Úloha epigenetickej regulácie v procese epiteliálno-mezenchýmového prechodu, 12;2017 : 410–413.
32. Catalanotto, C., Cogoni, C., Zardo, G. MicroRNA in Control of Gene Expression: An Overview of Nuclear Functions. International journal of molecular sciences, 17(10); 2016 : 1712.
33. Smit, K. N., Chang, J., Derks, K., et al.: Aberrant MicroRNA Expression and Its Implications for Uveal Melanoma Metastasis. Cancers, 11(6);2019 : 815.
34. Chakraborty, C., Sharma, A. R., Sharma, G., et al.: Therapeutic miRNA and siRNA: Moving from Bench to Clinic as Next Generation Medicine. Mol Ther Nucleic Acids, 8;2017 : 132–43.
35. Chen, X., Wang, J., Shen, H., et al.: Epigenetics, microRNAs, and carcinogenesis: functional role of microRNA-137 in uveal melanoma. Invest Ophthalmol Vis Sci, 52(3);2011 : 1193–9.
36. Chen, X., He, D., Dong, X. D., et al.: MicroRNA-124a is epigenetically regulated and acts as a tumor suppressor by controlling multiple targets in uveal melanoma. Invest Ophthalmol Vis Sci, 54(3); 2013 : 2248–56.
37. Landreville, S., Agapova, O. A., Matatall, K. A., et al.: Histone deacetylase inhibitors induce growth arrest and differentiation in uveal melanoma. Clin Cancer Res, 18(2);2012 : 408–16.
38. Moschos, M. M., Dettoraki, M., Androudi, S., et al.: The role of histone deacetylase inhibitors in uveal melanoma: current evidence. Anticancer research, 38(7);2018 : 3817–24.
39. Piperno-Neumann, S., Piulats, J. M., Goebeler, M., et al.: Uveal Melanoma: A European Network to Face the Many Challenges of a Rare Cancer. Cancers (Basel), 11(6);2019 : 817.
40. Gaudet, F., Hodgson, J. G., Eden, A., et al.: Induction of Tumors in Mice by Genomic Hypomethylation. Science, 300(5618);2003 : 489–92.
41. Eden, A., Gaudet, F., Waghmare, A., et al.: Chromosomal Instability and Tumors Promoted by DNA Hypomethylation. Science, 300(5618);2003 : 455.
42. Yang, A. S., Estecio, M. R., Garcia-Manero, G., et al.: Comment on „Chromosomal instability and tumors promoted by DNA hypomethylation“ and „Induction of tumors in nice by genomic hypomethylation“. Science, 302(5648);2003 : 1153.
43. Morel, D., Jeffery, D., Aspeslagh, S., et al.: Combining epigenetic drugs with other therapies for solid tumours - past lessons and future promise. Nat Rev Clin Oncol;2019.
Labels
Ophthalmology
Article was published inCzech and Slovak Ophthalmology

2020 Issue 2-
All articles in this issue
- Zemřela prof. MUDr. Jarmila Boguszaková DrSc.
- Vzpomínka na doc. MUDr. Cigánka, CSc.
- EPIGENETICKÉ ZMENY V PATOGENÉZE MALÍGNEHO MELANÓMU UVEY A MOŽNOSTI ICH TERAPEUTICKÉHO OVPLYVNENIA. PRIEHLAĎ
- PRIMÁRNY INTRABULBÁRNY NEUROFIBRÓM
- ZVYŠUJE INTRAKAMERÁLNÍ APLIKACE TRIAMCINOLON ACETONIDU ÚČINNOST FAKOTRABEKULEKTOMIE? PŘÍPADOVÁ KONTROLNÍ STUDIE
- NEARTERITICKÁ FORMA PŘEDNÍ ISCHEMICKÉ NEUROPATIE OPTIKU - LÉČBA A RIZIKOVÉ FAKTORY
- AFLIBERCEPT V LÉČBĚ VASKULÁRNÍ SERÓZNÍ ABLACE PIGMENTOVÉHO LISTU SÍTNICE: ROČNÍ VÝSLEDKY ANATOMICKÝCH A FUNKČNÍCH ZMĚN
- BETAXOLOL, BRIMONIDIN A CARTEOLOL V LÉČBĚ NORMOTENZNÍCH GLAUKOMŮ.
- Czech and Slovak Ophthalmology
- Journal archive
- Current issue
- Online only
- About the journal
Most read in this issue- NEARTERITICKÁ FORMA PŘEDNÍ ISCHEMICKÉ NEUROPATIE OPTIKU - LÉČBA A RIZIKOVÉ FAKTORY
- Vzpomínka na doc. MUDr. Cigánka, CSc.
- BETAXOLOL, BRIMONIDIN A CARTEOLOL V LÉČBĚ NORMOTENZNÍCH GLAUKOMŮ.
- AFLIBERCEPT V LÉČBĚ VASKULÁRNÍ SERÓZNÍ ABLACE PIGMENTOVÉHO LISTU SÍTNICE: ROČNÍ VÝSLEDKY ANATOMICKÝCH A FUNKČNÍCH ZMĚN
Login#ADS_BOTTOM_SCRIPTS#Forgotten passwordEnter the email address that you registered with. We will send you instructions on how to set a new password.
- Career

