-
Medical journals
- Career
Preimplantační genetická diagnostika a dědičná onemocnění oka
: L. Hlavatá 1,2; Ľ. Ďuďáková 2; M. Trková 3; I. Soldátová 3; P. Skalická 2,4; B. Kousal 2,4; P. Lišková 2,4
: Oční klinika JL, s. r. o., primář MUDr. Ján Lešták, CSc., FEBO 1; Ústav dědičných metabolických poruch 1. LF UK a VFN, Praha, přednosta: prof. MUDr. Viktor Kožich, CSc. 2; GENNET, s. r. o., Praha, vedoucí lékař MUDr. David Stejskal 3; Oční klinika, 1. LF UK a VFN, Praha přednostka doc. MUDr. Jarmila Heissigerová, MBA, Ph. D. 4
: Čes. a slov. Oftal., 72, 2016, No. 5, p. 167-171
: Original Article
Cíl:
Preimplantační genetická diagnostika (PGD) je moderní aplikací genetického testování ve spojení s in vitro fertilizací. Pomocí PGD lze zabránit přenosu geneticky podmíněného onemocnění na potomstvo, kdy v rámci umělého oplodnění je implantováno embryo bez genetické predispozice pro danou chorobu. Jedná se o alternativní metodu k prenatální diagnostice. Práce poskytuje přehled očních onemocnění, pro která se v zahraničí PGD provádí.Metody:
Literární rešerše zaměřená na doporučené postupy, etické otázky, rizika a výsledky PGD u očních onemocnění.Výsledky:
PGD se provádí pro řadu očních chorob, nezbytnou podmínkou pro její aplikaci je však znalost genetické příčiny, tj. kauzální mutace(í) nebo chromozomální aberace. Hlavní výhoda této metody spočívá v tom, že v případě pozitivního nálezu není dvojice vystavena rozhodnutí, zda těhotenství přerušit. Nositelům genetických abnormalit musí být před samotnou PGD poskytnuto kvalifikované poradenství, aby zcela porozuměli riziku vzniku postižení dítěte a důsledkům projevů případného onemocnění, výhodám a omezením navržené metody. Z nesyndromových očních onemocnění a chorob, u kterých oční nález dominuje, byla v evropských zemích PGD provedena pro aniridii, chorioiderémii, kongenitální fibrózu extraokulárních svalů, Leberovu kongenitální amaurózu, okulární albinismus, retinitis pigmentosa, X-vázanou retinoschízu, Stargardtovu chorobu, syndrom blefarofimóza – ptóza – inverzní epikantus a retinoblastom. Selekce pohlaví u chorob vázaných na chromozom X nebo s mitochondriální dědičností byla uskutečněna pro modrý čípkový monochromatismus, chorioiderémii, familiární exsudativní vitreoretinopatii, Leberovu hereditární neuropati optiku, makulární dystrofii (blíže nespecifikována), Norrieho chorobu, X-vázanou kongenitální stacionární noční slepotu, X-vázanou retinoschízu a X-vázaný nystagmus (blíže nespecifikovaný).Závěr:
V posledních letech se zvýšilo potenciální využití technologie PGD, přičemž spektrum vhodných onemocnění, závažné dědičné choroby nevyjímaje, se neustále rozšiřuje.Klíčová slova:
preimplantační genetická diagnostika, monogenně podmíněná onemocnění oka, in vitro fertilizaceÚVOD
Preimplantační genetická diagnostika (PGD) je moderní aplikací genetického testování. Jedná se o preventivní metodu, pomocí které lze v rámci asistované reprodukce zabránit přenosu monogenně dědičné choroby nebo chromozomální abnormality na potomstvo (4, 13).
Podstatou in vitro fertilizace (IVF), je mimotělní oplodnění vajíčka spermií a následná implantace embrya do dělohy matky. V případě PGD je ještě před tímto krokem provedeno genetické laboratorní vyšetření, jehož výsledky napomáhají vybrat vhodná embrya pro přenos (14). Nezbytným předpokladem pro aplikaci PGD je u monogenních chorob znalost příčiny onemocnění na úrovni DNA. Metoda není vhodná pro komplexní onemocnění, byť s významnou genetickou predispozicí. PGD se může použít nejenom k detekci přenosu konkrétního genetického onemocnění, ale i ke zjišťování delecí a duplikací chromozomů u embryí, kde je jeden z rodičů nosičem balancované chromozomální aberace (translokace, inverze). Další alternativou PGD je preimplantační genetický screening (PGS) u embryí rodičů, u nichž není známé, že by trpěli nějakou konkrétní genetickou vadou, ale mají vyšší riziko vzniku embrya s nesprávným počtem chromozomů (opakované těhotenské ztráty, vyšší věk, opakované neúspěchy IVF, prodělaná chemo/radioterapie) (12).
PGD nelze zaměňovat s prenatální diagnostikou, která je souborem diagnostických opatření s cílem rozeznat či vyloučit molekulární, chromozomální, morfologické, strukturální a funkční poruchy embrya či plodu během těhotenství (3). Lékař na základě konkrétních výsledků poučí budoucí rodiče a doporučí další postup. Na rodičích je pak konečné rozhodnutí, zda matka donosí plod, kterému byla diagnostikována určitá vada či geneticky podmíněné onemocnění, nebo se rozhodne pro ukončení těhotenství.
CÍL
Cílem naší práce bylo podat souhrnný přehled o očních onemocněních, pro která se provádí PGD.
METODY
Literární rešerše zaměřená na poradenství, metodiku, etické aspekty, rizika a legislativu pro provedení PGD s cílem zabránit přenosu monogenně podmíněných očních onemocnění.
VÝSLEDKY
Poradenství před PGD
Nositelům genetických abnormalit musí být před samotnou PGD poskytnuto kvalifikované poradenství lékařem se specializovanou způsobilostí v oboru lékařská genetika v souladu s ustanovením Zákona 373/2011 Sb. § 28–29. Cílem této konzultace je vysvětlit princip, přínos, spolehlivost a potencionální rizika PGD včetně neočekávaných nálezů. Pacienti by měli plně porozumět technickým omezením PGD, riziku vzniku chyby a zapojit se do diskuze, zda je PGD nutná a následně podepsat informovaný souhlas.
Běžnými indikacemi k PGD jsou strukturní chromozomální aberace nebo monogenně podmíněná onemocnění, za určitých okolností lze zvážit i indikaci k HLA genotypování. Výběr pohlaví s cílem vybalancovat rodinu je obecně považován za kontroverzní a v ČR se neprovádí. Zcela nevhodné pro indikaci PGD jsou onemocnění bez zjištěné genetické příčiny a testování určitých fenotypových znaků, jako např. barva očí (5).
Metodika PGD
Základním předpokladem aplikace PGD je znalost mutace zapříčiňující danou chorobu. Tuto podmínku v případě onemocnění oka nelze vždy splnit, neboť řada genů např. pro retinitis pigmentosa zůstává neznámá anebo jsou při genetickém screeningu detekovány mutace s neznámým významem, tedy s obtížně prokazatelnou patogenitou vyžadující složité funkční studie.
Detailní popis jednotlivých kroků PGD a používaných metod, včetně jejich výhod a nevýhod, byl nedávno shrnut v českém jazyce ve dvou publikacích (15, 19). Zkráceně, po IVF jsou embrya kultivována do stadia blastocyty, 5.–6. den vývoje embrya je provedena biopsie trofoektodermu, při které se získá 4–10 buněk. Poté je provedena celogenomová amplifikace jejich DNA. U nemocí s monogenní dědičností se většinou využívá metod nepřímé genetické diagnostiky. V současnosti to jsou haplotypová analýza (metoda PCR) využívající jako markery krátké opakující se sekvence (angl. short tandem repeat) (2) a karyomapping (metoda array) využívající jako markery jednonukleotidové záměny (angl. single nucleotide polymorphism) (18). Při obou metodách se v úseku zahrnujícím gen, ve kterém je příčinná mutace, stanovuje tzv. haplotyp (konkrétní sestava markerů). Podmínkou pro PGD je genetické vyšetření obou partnerů a přímého příbuzného s geneticky potvrzenou chorobou. Vyřazena jsou embrya, která nesou společnou(é) alelu(y) (u recesivně dědičných onemocnění lze po informované diskuzi s rodiči akceptovat i nositelství jedné alely s patogenní mutací) s nemocným příbuzným (většinou rodičem nebo sourozencem) identifikovanou(é) pomocí haplotypování.
Při obou metodách je obvykle prováděno jak testování přítomnosti mutace pomocí porovnání haplotypů, tak i vyšetření počtu chromozomů embrya. Výhodou karyomappingu je, že se mohou obě testování provést současně; v případě PCR metody je haplotypová analýza u „zdravých embryí“ doplněna metodou sekvenování nové generace k detekci variací v počtu kopií (10).
U onemocnění s X-vázanou dědičností mohou páry volit i výběr pohlaví.
PGD u geneticky podmíněných očních onemocněních
O PGD uvažují především páry, kdy jeden či oba mají geneticky podmíněné autozomálně dominantní onemocnění nebo páry, kterým se již narodilo postižené dítě.
PGD je v současné době využívána pro řadu onemocnění oka s významným funkčním dopadem na zrakové funkce.
Nejčastější indikací je retinoblastom s autozomálně dominantní dědičností (25). Vzhledem k tomu, že příčinný gen RB1 (retinoblastoma 1) kóduje protein důležitý pro regulaci buněčného cyklu, pacienti s hereditární formou retinoblastomu mají i extrémně vysoké riziko následného vzniku primárních nádorů, a to nejčastěji leiomyosarkomu, osteosarkomu a kožního melanomu (17). PGD byla u této choroby poprvé úspěšně aplikována již v roce 2003 v rodině, ve které otec a dcera trpěli bilaterálním retinoblastomem a zároveň u obou byla identifikována příčinná substituční mutace v genu RB1. PGD byla použita při druhé a třetí graviditě páru a vedla k narození dvou zdravých sourozenců (27).
Ve skupině, kdy otec ani matka očním onemocněním netrpí, ale mají již jedno či více zrakově postižených dětí s autozomálně recesivně dědičnou chorobou a přejí si mít další děti bez zrakového postižení, byl například v literatuře doložen případ aplikace PGD u rodičů, kteří byli nositeli jedné delece v genu RPE65 (Retinal Pigment Epithelium-Specific Protein 65kDa) a měli již dva potomky s Leberovou kongenitální amaurózou. Po implantaci zdravého embrya a jednoho embrya s mutovanou alelou se narodila zdravá dvojčata (9).
S žádostí o prekoncepční screening partnera na přítomnost mutací se lze občas setkat i u dvojic, kdy pouze jeden z partnerů trpí autozomálně recesivně dědičným onemocněním oka. Přestože riziko početí potomka se stejnou chorobou je při vzájemné nepříbuznosti partnerů téměř zanedbatelné, tj. pouze nepatrně vyšší ve srovnání se zdravou populací, nejsou tyto žádosti v určitých případech zcela neopodstatněné. Např. u genu ABCA4 (ATP-Binding Casette, Sub Family A member 4), jehož mutace podmiňují autozomálně recesivně dědičnou Stargardtovu chorobu (1), se odhaduje, každý 870. obyvatel by mohl být nositelem patogenních mutací (20). Publikován byl případ páru, kdy muž vykazoval typické známky Stargardtovy choroby, zatímco oční vyšetření jeho partnerky neodhalilo žádné abnormality. Genetické vyšetření genu ABCA4 vedlo u muže ke zjištění obou patogenních mutací. U partnerky byla ale také nalezena jedna mutace asociovaná se vznikem Stargardtovy choroby, čímž se riziko přenosu na potomstvo u tohoto konkrétního páru zvýšilo na 50 %, a proto byla doporučena PGD, která vedla k narození zdravého dítěte (23).
U X-vázaných onemocnění je riziko přenosu genetické vlohy pro konkrétní chorobu na obě pohlaví 50 %, u mužů však bývá onemocnění vyjádřeno, zatímco ženy jsou často přenašečkami bez klinického nálezu nebo je jejich nález pouze minimální bez vlivu na kvalitu života. V tomto případě se k transferu doporučují embrya ženského pohlaví. V případě některých onemocnění oka, jako např. retinitis pigmentosa, je ale třeba mít na paměti, že ženy mohou vykazovat široké spektrum fenotypových nálezů – od žádných až po závažné včetně úplné slepoty, manifestující se většinou o dekádu či dvě později než u mužů (16).
Evropská společnost pro lidskou reprodukci (European Society of Human Reproduction), která pravidelně vyhodnocuje data z evropských center, ve své zprávě uvedla, že v roce 2010 byl celkový počet provedených cyklů s preimplantačním genetickým vyšetřením 5 651, z toho 2 978 cyklů v rámci PGS a 2 673 cyklů v rámci PGD. Z očních onemocnění bylo provedeno nejvíce cyklů s cílem zabránit přenosu retinoblastomu s autozomálně dominantním typem dědičnosti, následovala Stargardtova choroba a okulokutánní albinismus s autozomálně recesivním typem dědičnosti. U X-vázaných onemocnění byl v řadě případů volen jako prevence transmise onemocnění výběr pohlaví. Nejčastější indikací byla retinitis pigmentosa. Výčet všech očních onemocnění, pro která byla provedena PGD v roce 2010 v některém z 62 evropských center, která jsou součástí PGD konsorcia, je uveden v tabulce 1 (7).
1. Monogenní onemocnění a syndromové choroby s významným očním nálezem, pro která byla v roce 2010 v Evropě provedena PGD 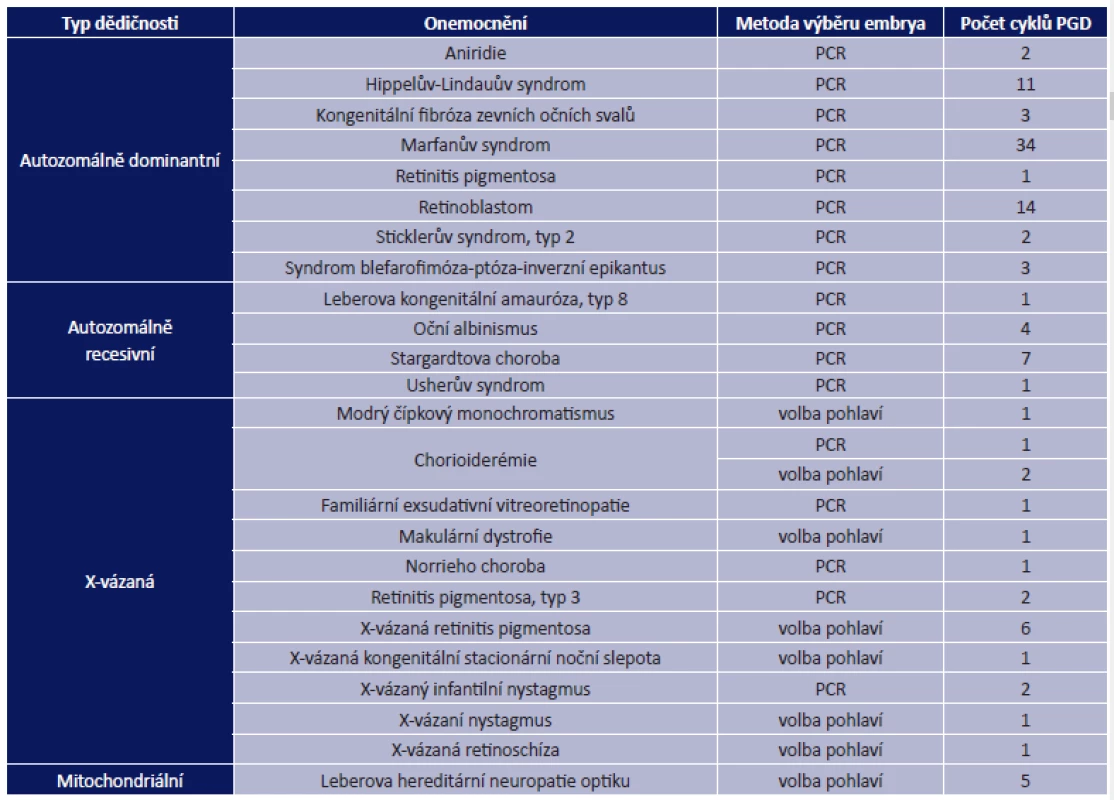
PCR – polymerázová řetězová reakce; PGD – preimplantační genetická diagnostika Internetové stránky zahraničních pracovišť, která nejsou součástí evropského konsorcia, uvádějí poskytování PGD pro řadu dalších očních chorob nebo syndromových onemocnění, kde oční nález může být jedním z dominantních znaků, např. achromatopsie, autozomálně dominantně dědičné atrofie zrakového nervu, Bardetův-Biedlův syndrom, Bestova choroba, mikroftalmus, Seniorův-Lokenův syndrom (11).
Dle informací získaných vyhledáváním na internetu po zadání klíčových slov „preimplantační genetická diagnostika“ je PGD v České republice prováděna minimálně na devíti pracovištích. Jediná podrobná veřejně dostupná výroční zpráva společnosti Gennet z roku 2012 uvádí, že PGD byla připravena z následujících indikací závažných očních chorob nebo chorob, kde oční symptomatologie může svým významem převažovat: zadní polymorfní dystrofie rohovky, X-vázaná retinoschíza, Hippelův-Lindauův syndrom a Marfanův syndrom (26).
Etické aspekty PGD ve vztahu k onemocnění oka
Kromě základních etických aspektů, jako např. selekce embryí a tím výběr žádoucích zdravotních vlastností (22) či možnost záměrné volby pohlaví motivované sociálně kulturním pozadím (21), vyvolává využití PGD v oftalmologii i další etické otázky. PGD by měla být indikována u závažných onemocnění s časnou manifestací. Hranice mezi tím, která onemocnění lze považovat za závažná a která již ne, není ale zcela jasná. V úvahu je navíc třeba brát také individuální nastavení v rodině, kulturní a socioekonomický kontext. Řada dědičných očních onemocnění může mít navíc velmi variabilní věk manifestace, některé vedou ke snížení zrakových funkcí až v dospělosti, přičemž současný vývoj vědy dává naději, že pro řadu dědičných onemocnění oka by mohlo dojít k vývoji cílených terapií.
Rizika PGD
Kromě obecných rizik spojených s procesem IVF, má i PGD své riziko „chyby“, které je obecně udáváno v rozmezí 2–5 % (8). Z tohoto důvodu se doporučuje v graviditě ověřit výsledek PGD prenatální diagnostikou, tzn. vyšetřením z choriových klků nebo plodové vody. Současně je nutné si uvědomit, že při PGD sledujeme pouze konkrétní dědičnou chorobu, jejíž riziko je v rodině známé. Narozené dítě může mít i jiné, námi nesledované genetické onemocnění. Riziko přenosu embrya s chromozomální aneuploidií (např. Downova syndromu) snižujeme však při použití karyomappingu tím, že je současně provedeno vyšetření počtu chromozomů. Aneuploidii je možné detekovat i za použití dat ze sekvenování nové generace, které se provádí po haplotypové analýze u zdravých embryí z důvodu detekce monogenního onemocnění.
Legislativa PGD
K ekonomicky vyspělým evropským zemím, které mají za určitých podmínek legalizováno použití PGD, patří Belgie, Dánsko, Finsko, Francie, Řecko, Nizozemsko, Norsko, Portugalsko, Rakousko, Španělsko a Velká Británie. PGD je indikováno u monogenně podmíněných onemocněních, v některých zemích i u chromozomálních abnormalit a X-vázaných onemocněních. HLA typizace ve smyslu selekce imunokompatibilního embrya pro záchranu příbuzného je povolena v devíti z výše zmiňovaných zemích včetně ČR. V Německu je kvůli přísné legislativě PGD omezena na vyšetření z biopsie polárního tělíska, což přináší velmi omezené diagnostické možnosti. Podobně i ve Švýcarsku je testování povoleno na polárních tělískách jenom v případě závažných a neléčitelných onemocnění. V současné době je regulace PGD v této zemi ve stadiu dalšího přezkoumávaní (6).
V ČR je genetické testování upraveno Zákonem 373/2011 Sb. § 28–29. Laboratoře provádějící PGD by se měly řídit Doporučeným postupem č. 4 (Doporučení k preimplantačnímu genetickému laboratornímu vyšetření) uvedeným na webových stránkách Společnosti lékařské genetiky a genomiky. Zde jsou popsány indikace, u kterých jsou PGD i PGS doporučovány lékařem se specializovanou způsobilostí v lékařské genetice (24).
ZÁVĚR
PGD jako preventivní metoda sice neumožňuje terapii, ale lze pomocí ní vybrat embrya bez genetické vlohy pro určité onemocnění a tím eliminovat riziko přenosu choroby na další generace. Na rozdíl od prenatální diagnostiky není pár v případě pozitivního nálezu vystaven rozhodnutí, zda již započaté těhotenství přerušit. Indikace PGD pro geneticky podmíněná oční onemocnění vyžaduje vysoce individuální přístup. Řada pacientů, u kterých zrakové postižení vzniká postupně až během života, nevnímá svůj stav jako natolik hendikepující, aby PGD z této indikace zvažovalo. Někteří pacienti naopak i přes objektivně méně závažný deficit zrakových funkcí vnímají svojí situaci a psychologické důsledky spojené s léčbou nebo s opakovaným vyšetřováním jako natolik závažné, že pro ně PGD představuje jasnou volbu.
Práce byla podpořena granty GAUK 4315/2015, SVV UK 260256/2016, UNCE 204011 a AZV 16-32341A.
Autorka práce prohlašuje, že vznik i téma odborného sdělení a jeho zveřejnění není ve střetu zájmu a není podpořeno žádnou farmaceutickou firmou.
Do redakce doručeno dne 31. 8. 2016
Do tisku přijato dne 20. 10. 2016
Doc. MUDr. P. Lišková, MD, Ph.D.
Ústav dědičných metabolických poruch
1. lékařská fakulta UK a VFN
Ke Karlovu 2
128 00 Praha 2
petra.liskova@lf1.cuni.cz
http://ocnigenetika.lf1.cuni.cz
Sources
1. Allikmets, R., Singh, N., Sun, H., et al.: A photoreceptor cell-specific ATP-binding transporter gene (ABCR) is mutated in recessive Stargardt macular dystrophy. Nat Genet, 15(3); 1997 : 236–246.
2. Altarescu, G., Zeevi, DA., Zeligson, S., et al.: Familial haplotyping and embryo analysis for Preimplantation genetic diagnosis (PGD) using DNA microarrays: a proof of principle study. J Assist Reprod Genet, 30(12); 2013 : 1595–1603.
3. Bodurtha, J., Strauss, JF.: Genomics and Perinatal Care. N Engl J Med, 366(1); 2012 : 64–73.
4. Braude, P., Pickering, S., Flinter, F. et al.: Preimplantation genetic diagnosis. Nat Rev Genet, 3(12); 2002 : 941–955.
5. Brezina, PR., Kutteh, WH.: Clinical applications of preimplantation genetic testing. BMJ, 350; 2015: g7611.
6. Council of Europe: Background document on preimplantation and prenatal genetic testing. [cit. 28.7.2016]. Dostupné na: http://www.coe.int/t/dg3/healthbioethic/Activities/07_Human_genetics_en/INF(2015)6%20e%20dpi%20dpn.pdf.
7. De Rycke, M., Belva, F., Goossens, V., et al.: ESHRE PGD Consortium data collection XIII: cycles from January to December 2010 with pregnancy follow-up to October 2011. Hum Reprod, 30(8); 2015 : 1763–1789.
8. Dreesen, J., Destouni, A., Kourlaba, G., et al.: Evaluation of PCR-based preimplantation genetic diagnosis applied to monogenic diseases: a collaborative ESHRE PGD consortium study. Eur J Hum Genet, 22(8); 2014 : 1012–1018.
9. Ekmekci, CG., Tac HA., Gulum N., et al.: Birth of a healthy twin after preimplantation genetic diagnosis for Leber congenital amaurosis (RPE65 gene). Reprod Biomed Online, 26, Supplement 1; 2013: S38–S39.
10. Fiorentino, F., Bono, S., Biricik, A., et al.: Application of next-generation sequencing technology for comprehensive aneuploidy screening of blastocysts in clinical preimplantation genetic screening cycles. Hum Reprod, 29(12); 2014 : 2802–2813.
11. Genesis Genetics: What we test for. [cit. 28.7.2016]. Dostupné na: http://genesisgenetics.org/pgd/what-we-test-for/
12. Ginsburg, ES., Baker, VL., Racowsky, C., et al.: Use of preimplantation genetic diagnosis and preimplantation genetic screening in the United States: a Society for Assisted Reproductive Technology Writing Group paper. Fertil Steril, 96(4); 2011 : 865–868.
13. Handyside, AH., Xu, K.: Preimplantation genetic diagnosis comes of age. Semin Reprod Med, 30(4); 2012 : 255–258.
14. Harton, GL., De Rycke, M., Fiorentino, F., et al.: ESHRE PGD consortium best practice guidelines for amplification-based PGD. Hum Reprod, 26(1); 2011 : 33–40.
15. Hüttelová, R., Kleibl, Z., Řezáčová, J., et al.: Předpoklady pro preimplantační genetickou diagnostiku (PGD) u nosičů mutací v nádorových predispozičních genech. Klin Onkol, 22(Suppl); 2009: S69–S74.
16. Kousal, B., Skalicka, P., Valesova, L., et al.: Severe retinal degeneration in women with a c.2543del mutation in ORF15 of the RPGR gene. Mol Vis, 20; 2014 : 1307–1317.
17. MacCarthy, A., Bayne, AM., Brownbill, PA., et al.: Second and subsequent tumours among 1927 retinoblastoma patients diagnosed in Britain 1951-2004. Br J Cancer, 108(12); 2013 : 2455–2463.
18. Natesan, SA., Bladon, AJ., Coskun, S., et al.: Genome-wide karyomapping accurately identifies the inheritance of single-gene defects in human preimplantation embryos in vitro. Genet Med, 16(11); 2014 : 838–845.
19. Putzová, M., Pecnová, L., Hulvert, J., et al.: Preimplantační genetická diagnostika monogenně podmíněných chorob – její možnosti, úskalí a první úspěchy v České republice. Čes-slov Pediat, 63(11); 2008 : 626–633.
20. Riveiro-Alvarez, R., Aguirre-Lamban, J.,. Lopez-Martinez, MA, et al.: Frequency of ABCA4 mutations in 278 Spanish controls: an insight into the prevalence of autosomal recessive Stargardt disease. Br J Ophthalmol, 93(10); 2009 : 1359–1364.
21. Sharp, RR., McGowan, ML., Verma JA., et al.: Moral attitudes and beliefs among couples pursuing PGD for sex selection. Reprod Biomed Online, 21(7); 2010 : 838–847.
22. Shenfield, F.: Ethical aspects of pre-implantation genetic diagnosis. Obstet Gynaecol Reprod Med, 18(11); 2008 : 312–313.
23. Sohrab, MA., Allikmets, R., Guarnaccia, MM., et al.: Preimplantation Genetic Diagnosis for Stargardt Disease. Am J Ophthalmol, 149(4); 2010 : 651–655.
24. Společnost lékařské genetiky a gemoniky: Doporučení k preimplantačnímu genetickému laboratornímu vyšetření. [cit. 28.7.2016]. Dostupné na: https://www.slg.cz/stitky/doporuceni
25. Vogel, F.: Genetics of retinoblastoma. Hum Genet, 52(1); 1979 : 1–54.
26. Výroční zpráva GENNET [cit. 24.8.2016]. Dostupné na: http://docplayer.cz/8121097-Obsah-uvodni-slovo-vedouciho-lekare-5-iv-preimplantacni-diagnostika-pgd-8-v-postnatalni-laboratorni-diagnostika-10-i-uvod.html.
27. Xu, K., Rosenwaks, Z., Beaverson, K., et al.: Preimplantation genetic diagnosis for retinoblastoma: the first reported liveborn. Am J Ophthalmol, 137(1); 2004 : 18–23.
Labels
Ophthalmology
Article was published inCzech and Slovak Ophthalmology

2016 Issue 5-
All articles in this issue
- Preimplantation genetic diagnosis and monogenic inherited eye diseases
- The Tear Osmolarity of PATIENTS with Lagophthalmos
- Comparing of Treatment Results of Monocanalicular and Bicanalicular Intubation in Inborn Lacrimal Duct Obstruction
- Automatic Retinal Oxymetry in Patients with Diabetic Retinopathy
- Blepharophimosis-ptosis-epicanthus inversus syndrome
- Iris melanoma in a child
- Czech and Slovak Ophthalmology
- Journal archive
- Current issue
- Online only
- About the journal
Most read in this issue- Blepharophimosis-ptosis-epicanthus inversus syndrome
- Iris melanoma in a child
- Preimplantation genetic diagnosis and monogenic inherited eye diseases
- The Tear Osmolarity of PATIENTS with Lagophthalmos
Login#ADS_BOTTOM_SCRIPTS#Forgotten passwordEnter the email address that you registered with. We will send you instructions on how to set a new password.
- Career

