-
Medical journals
- Career
Hodnocení efektivnosti léčby neinfekčních uveitid
Authors: J. Krásná 1,2; V. Mezerová 2; J. Krásný 1
Authors‘ workplace: Oční klinika FN Královské Vinohrady, Praha, přednosta prof. MUDr. P. Kuchynka, CSc. 1; Katedra biomedicínské techniky, Fakulta biomedicínského inženýrství ČVUT, Praha, vedoucí katedry prof. Ing. Peter Kneppo, DrSc. 2
Published in: Čes. a slov. Oftal., 69, 2013, No. 3, p. 110-116
Category: Original Article
Předneseno na klinickém vědeckém dni: Den uveitid, Průhonice, listopad 2012
Overview
Autoři porovnali klinickou a ekonomickou efektivitu léčby tohoto onemocnění klasickou terapií kortikosteroidy a moderní léčbou imunosupresivními preparáty či jejich kombinací. Retrospektivní hodnocení provedené v roce 2012 se týkalo předchozích šesti let (2006–2011) u sledovaného souboru 27 pacientů, a to 16 žen a 11 mužů, s postižením 45 očí. Průměrný věk v posledním roce sledování činil 30,2 roku, s rozpětím od 14 do 76 let. Průměrná délka trvání choroby pro celý soubor je 16,5 roku s rozpětím 6 až 36 let. Sledovaný soubor zahrnoval tři základní diagnózy: chronickou iridocyklitidu na 59 % očí, intermediální uveitidu na 30 % očí a sympatickou oftalmii na 11 % očí. Optimální variantu léčby nebylo možno přesně stanovit, avšak kombinovaná kortikosteroidy šetřící léčba byla z hlediska udržení zrakové ostrosti s minimalizací nežádoucích účinků a nákladové náročnosti nejpřínosnější. Úspěšné výsledky léčby byly zaznamenány u intermediální uveitidy, neboť zraková ostrost v průběhu studie se zlepšila o 9 písmen ETDRS. Uspokojivá léčba byla prokázána celkově u chronické iridocyklitidy i soucitného onemocnění, neboť vízus se zlepšil o několik písmen na úrovni stejného řádku ETDRS jako na začátku šestiletého sledování. Průměrná roční cena (zaokrouhlená) za ošetření zahrnující farmakoterapii, ambulantní a hospitalizační péči a laboratorní sledování činila u chronické iridocyklitidy 24 700 Kč, u intermediální uveitidy 7700 Kč a u sympatické oftalmie 38 500 Kč. Farmakoterapie v celkových nákladech převyšovala odbornou péči lékařů včetně hospitalizací.
Klíčová slova:
uveitida, kortikosteroidy, imunosupresiva, efektivita nákladůÚvod
Uveitida je vážné potenciálně oslepující onemocnění, ale jeho ekonomická zátěž a sociální problémy způsobené dočasným, nebo trvalým poškozením zraku jsou však málo známé. Celosvětově postihuje uveitida zejména populaci středního věku (20–40 let). Podle světové literatury je prevalence 38–714 případů na 100 000 obyvatel a incidence 17–52 případů na 100 000 obyvatel ročně [28]. Uveitidy ve svém celku tvoří přibližně dvacetinu etiologií slepoty. Tato čísla jsou pravděpodobně vyšší, neboť jsou statistické údaje uváděny především ze zemí s vyspělou zdravotní péčí [6]. Z celosvětového pohledu má na příčinách oslepnutí či zásadním poklesu vidění v dospělosti zásadní vliv ekonomická a regionálně-etnická situace. V evropských zemích se na první místa příčin oslepnutí řadí především diabetická retinopatie, degenerativní postižení sítnice, vysoká krátkozrakost a atrofie nervus opticus [6].V Japonsku patří uveitidy na čtvrté místo příčin oslepnutí za zmiňovanou vysokou krátkozrakostí, degenerací sítnice a atrofií optiku [11]. V rozvojových zemích je ve více než polovině případů příčinou slepoty šedý zákal či postižení čočky, které jsou v moderních zemích léčitelné. Uveitidy se zde řadí na čtvrté až páté místo příčiny ztráty zraku spolu s neošetřeným traumatem oka [1, 30]. Uvedená fakta dokumentují závažnost tohoto onemocnění, které není letální, avšak četnost výskytu uveitidy s možnými vážnými důsledky výrazně postihuje především produktivní skupinu obyvatelstva. V porovnání s jinými onemocněními, vyvolávajícími slepotu v oftalmologické problematice, musí nemocní s uveitidou navíc čelit mnoha vedlejším účinkům dlouhodobé farmakologické léčby kortikosteroidy nebo imunosupresivy. Možné poškození smyslového orgánu a celková zátěž organismu v průběhu léčby ovlivňuje psychiku nemocného a má výrazný sociálněekonomický dopad na něj samotného i jeho okolí.
Z výše uvedených faktorů vyplývá, že kromě hodnocení klinických výsledků léčby uveitid je podstatné i zhodnocení ekonomického pohledu na léčbu tohoto závažného imunopatologického onemocnění oka i v našem regionu, neboť moderní imunosupresivní léky jsou finančně náročné. Cílem studie bylo posoudit tento vzájemný vztah a pokusit se stanovit možnost optimální léčby z obou pohledů. Předlohou byl probíhající úspěšný projekt AMADEUS pro léčbu vlhké formy věkem podmíněné makulární degenerace [9].
Vlastní sestava a metodika
Do sledovaného souboru byli v roce 2012 retrospektivně zahrnuti pacienti s chronickou formou neinfekční uveitidy vyžadující celkovou kortikosteroidní či imunosupresivní léčbu nebo jejich kombinaci v rozmezí let 2006 až 2011, tzn. od zavedení nového elektronického informačního systému na Oční klinice FNKV. Sledovaná skupina obsahovala 27 pacientů, 16 žen a 11 mužů. Průměrný věk v posledním roce sledování činil 30,2 roku, s rozpětím od 14 do 76 let. Celkem bylo sledováno a léčeno 45 očí, 18 pacientů mělo oboustranné onemocnění a 9 pouze jednostranné. Průměrná délka vlastního trvání choroby pro celý soubor je 16,5 roku s rozpětím 6 až 36 let.
Nejčastěji se vyskytující diagnózou byla chronická iridocyklitida na 19 očích u 16 pacientů, z toho v 9 případech jako součást juvenilní idiopatické artritidy (JIA), zbývající nemocní patřili do skupiny hyperergních uveitid (pozitivní ANA, zvýšený imunoregulační index, atd.) Druhým onemocněním byla intermediální uveitida na 13 očích u 8 pacientů. Prognosticky nezávažnějším onemocněním byla panuveitida pozdně buněčné přecitlivělosti, kterou představovala sympatická oftalmie vždy na jediném oku u tří nemocných.
Pro klinické hodnocení byla zvolena jako hlavní parametr zraková ostrost, byla porovnána vstupní a výstupní hodnota za dobu sledování 6 let. Výsledky byly zaznamenány v dekadické hodnotě ETDRS pro každý rok sledování u každého pacienta samostatně. Až po té byl zhodnocen vývoj vízu v průběhu šestiletého sledování u jednotlivých nemocných a na závěr následovalo celkové posouzení podle jednotlivých třech diagnóz. Za „úspěšnou“ léčbu bylo považováno zlepšení zrakové ostrosti o +0,12 (jedno písmeno z dalšího řádku ETDRS) a více, „uspokojivá“ léčba znamenala udržení zrakové ostrosti na původní vstupní hodnotě, tedy rozmezí Ī 0,05 a konečně „neúspěšná“ léčba byla hodnota -0,12 (jedno písmeno z dalšího řádku ETDRS) a méně.
K dalším sledovaným klinickým parametrům patřily přidružené oční komplikace (ve svých důsledcích se podílely nebo se mohly podílet na hlavním parametru klinického sledování, tedy na poklesu zrakové ostrosti): cystoidní makulární edém (CME), komplikovaná katarakta, sekundární glaukom a keratopatie s možností jejich eventuálního léčebného ovlivnění. Zaznamenávaly se také celkové vedlejší projevy celkové terapie na organismus: akné, Cushingoidní facies, gingivitida, jaterní a renální toxicita a zvýšení krevního tlaku. Nákladové parametry léčby byly rozděleny do třech skupin: ambulantní péče či hospitalizační péče včetně operací a samostatně byla hodnocena celková a lokální medikace.
Z hlediska lékařské péče byly náklady na jednotlivá vyšetření a výkony vypočítány podle seznamu zdravotních výkonů s bodovými hodnotami znásobené hodnotou bodu pro jednotlivé lékařské odbornosti. K výkonům byl připočítán zvláště účtovaný zdravotnický materiál (ZUM). Zdravotnické výkony s bodovým ohodnocením byly kontrolovány v Seznamu zdravotních výkonů podle příslušné vyhlášky Ministerstva zdravotnictví ČR (MZ ČR) pro každý rok. Ve sledovaném období se konkrétně jedná o vyhlášky č. 493/2005, č. 331/2007, č. 439/2008, č. 27/2009, č. 397/2010. Hodnota bodu je stanovena MZ ČR pro odbornosti 705 – oftalmologie, 708 – anesteziologie, resuscitace a intenzivní medicína na 1,02 Kč. Hodnota bodu pro laboratorní a imunologickou odbornost 801, 813 a 818 je stanovena na 0,88 Kč.
V ambulantní péči byly každoročně sledovány celkové počty vyšetření zahrnující převážně cílené oční vyšetření (75022), ojediněle i komplexní oční vyšetření (75021), včetně bezkontaktní tonometrie (75161) a oftamoskopie (75121) jednoho nebo obou očí u dispenzarizované osoby (09532). Další oční vyšetření nebyla prováděna při oftalmologických kontrolách pravidelně, ale v jednotlivých případech podle klinického obrazu a potřeby získání informací pro další léčbu: fluorescenční angiografie (75129), A a B-scan ultrazvukové vyšetření (75147, 75149), fotodokumentace pro každé oko jednotlivě (75155) a eventuálně i YAG laserové ošetření (75433). Po každé bylo toto započítáno nad rámec klasického oftalmologického vyšetření.
Tato vyšetření byla podle potřeby doplněna o vyžádaná laboratorní vyšetření:
- a) Základní imunologické vyšetření pro uveitidu zahrnovalo vyšetření sedimentace erytrocytů (9133), stanovení IgG (91129), stanovení IgA (91131), stanovení IgM (91133), stanovení CRP (91153), stanovení C3 složky komplementu (91159), stanovení C4 složky komplementu (91161), krevní obraz s pěti populačním diferenciálním počtem leukocytů (96167), imunofenotypizace jednotlivých buněčných subpopulací podle povrchových znaků (91439), analýza krevního nátěru panopticky obarveného (96315), stanovení CIK metodou PEG-IKEM (91355), panoptické obarvení nátěru periferní krve nebo aspirátu (96711), zhotovení nátěru (96713) separace séra nebo plazmy (97111).
- b) Speciální imunologické vyšetření pro uveitidu obsahovalo stanovení anti IgA protilátek ENA (91261), stanovení anti SS-A/RO AB ELISA (91263), stanovení anti SSB/ LA AB ELISA (91265), průkaz antinukleárních protilátek (91317), průkaz ANCA IF (91323), stanovení hladin ASLO (91503), určování HLA-B 27 (86217), stanovení revmatoidního faktoru (91501) a separace séra nebo plazmy (97111).
- c) Kontrolní vyšetření krve pro sledování nežádoucích účinků při systémové léčbě zaznamenávalo hodnoty AST (aspartátaminotransferáza) či ALT (alaninaminotransferáza) (81357), konkrement močový kvalitativně (81483), kyselina močová (81523), analýza krevního nátěru panopticky obarveného (96315), panoptické obarvení nátěru periferní krve nebo aspirátu (96711) a zhotovení nátěru (96713).
Péče jiných specialistů jako např. revmatologů, rentgenologů atd. u systémových onemocnění nebyla sledována, neboť nebyla náplní této studie.
Hospitalizační péče ve svém komplexu zahrnovala samotnou hospitalizaci na standardním lůžkovém oddělení Oční kliniky FNKV v ceně paušálu hospitalizačních dnů (1.–3. den za 1046 Kč, 4.–5. den za 876 Kč a 6.–8. den pouze za 707 Kč) a operační výkony v eventuální celkové anestezii. Medikace a laboratorní vyšetření je počítána do paušálu, nebyla proto zahrnuta. Náklady na operační výkony byly brány včetně použitého zvlášť účtovaného zdravotnického materiálu (ZUM), hodnocené v jednotlivých ročních obdobích samostatně. Vzhledem k typu očního onemocnění a jeho projevům se jednalo o tyto výkony: extrakapsulární extrakce katarakty fakoemulzifikační technikou (75345) s implantací měkké nitrooční čočky (75347) či bez implantace, filtrační antiglaukomatózní operace (75339) rozdílnými operačními technikami s použití implantátů, enukleace bulbu (75371) s eventuálním použití orbitálního implantátu a pars plana vitrektomie (75449). Vždy bylo připočítáno použití operačního mikroskopu (71823) podle časové náročnosti. V ceně celkové anestezie pro oftalmologické výkony byly započítány předoperační vyšetření internistou (11021) a anesteziologem (78022), intubace (78820) a anestezie po dobu operačního výkonu a 20 minut (78114).
Medikace pacientů z finančního hlediska byla sledována ambulantně podle preskripce oftalmologa s přesností na jednotlivá celá balení léčiva v každém roce. Ceny jednotlivých léčiv byly převzaty z Brevíře (Medical Tribune) pro každý rok samostatně [17, 18, 19, 20, 21, 22], neboť jejich cena proplácená zdravotními pojišťovnami se průběžně měnila.
U celkové protizánětlivé a imunosupresivní léčby byla hodnocena preskripce (generické názvy): azathioprin, bemethazon, cyclosporin A, methotrexat, metyl-prednisolon, tacrolimus. Celková medikace předepisována jinými specialisty v rámci systémového onemocnění není do studie zahrnuta, neboť ji nebylo možné přesně sledovat a nespadala do finančních nákladů oftalmologa. U lokální léčby se jednalo o kortikosteroidy, nesteroidní antiflogistika, mydriatika a antiglaukomatika (betablokátory, inhibitory karboanhydrázy a sympatomimetika pro léčbu glaukomu či jejich kombinace).
Vlastní analýza dat finančních nákladů byla hodnocena z hlediska jejich složení, meziročního nárůstu s průměrnými ročními náklady na pacienta celkově a pro jednotlivé skupiny diagnóz. Současně byly hodnoceny náklady na kortikosteroidní, imusupresivní a kombinovanou léčbu. Pro porovnání skupin je provedena jednoduchá analýza nákladové efektivity.
Výsledky
Za šest let sledování bylo hospitalizováno 10 pacientů, z toho 6 sledovaných celkem dvakrát a jeden pacient třikrát. Operace katarakty byla provedena na 10 očích, tj. 23 %. Před rokem 2006 byla již katarakta odoperována ve sledovaném souboru u 9 očí, tj. 20 %. Antiglaukomatózní operace byla provedena rozdílnými operačními technikami na 3 očích, tj. 7 % (následně u jedné pacientky musel být implantát pro nekontrolovatelnou hypotenzi explantován). Vitrektomie byla provedena u jedné nemocné pro závažnou jizevnatou sklivcovou reakci. Enukleace bulbu byla indikována dvakrát pro dolorózní slepý bulbus se sekundárním uveitickým drážděním imunokomplexového mechanismu druhého vidoucího oka. Rozdělení operací ve vztahu ke třem sledovaným skupinám diagnóz uvádí tabulka 1. Většina byla provedena u chronické iridocyklitidy, zatímco u intermediální uveitidy nebyl nutný žádný operační výkon. Absolutní četnost operací představovala sympatická oftalmie včetně předchozího období.
Table 1. Přehled očních operací ve vztahu k jednotlivým diagnózám 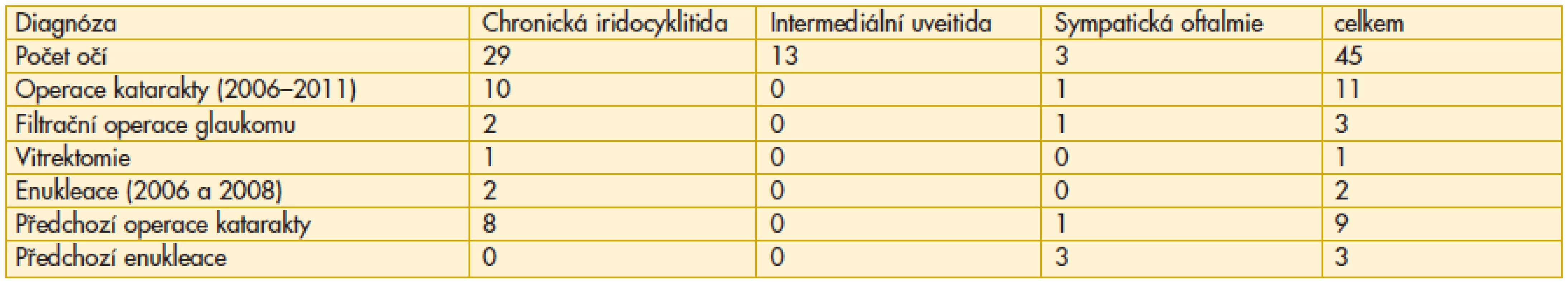
Přidružené oční komplikace, které se výrazně podílely na snížení zrakové ostrosti, se během sledovaného šestiletého období projevily nejvíce pod obrazem: CME na 17 očích (38 %), komplikovaná katarakta provázená různým stupněm poklesu vidění byla diagnostikovaná na 16 očích (36 %) a zonulární keratopatie na 5 očích (11 %). Sekundární glaukom byl odhalen na 10 očích (22 %). Souvislost očních komplikací se sledovanými jednotlivými typy uveitid byl charakterizován zásadními rozdíly. Zatímco CME ovlivňující negativně zrakovou ostrost byl u intermediální uveitidy u 7 očí (69 %), tak pozánětlivá katarakta byla u chronické iridocyklitidy na 14 očích (48 %). Závažná zonulární keratopatie byla diagnostikována pouze u chronické iridocyklitidy. Sekundární glaukom byl diagnostikován na 7 očích u chronické iridocyklitidy (24 %) a jen jednou u intermediální uveitidy (8 %), dvakrát ovlivňoval sympatickou oftalmii.
Z celého sledovaného souboru 27 pacientů, kde bylo léčeno 45 očí, podle zvolených kritérií hodnocení zrakové ostrosti (viz výše), byla léčba úspěšná z 41 %, tj. na 18 očí, uspokojivá z 43 %, tj. na 19 očí a nedostatečná v 16 %, tedy u 7 očí. Z daného souboru bylo 9 pacientů (16 očí) léčeno pouze kortikosteroidy a léčba byla úspěšná a uspokojivá v 93 %. U zbývajících pacientů se samotná léčba kortikosteroidy před sledovaným obdobím nebo i ve sledovaném období ukázala jako nedostatečná a 12 pacientů (18 očí) bylo převedeno na imunosupresivní terapii a 6 osob (10 očí) na kombinovanou formou léčby. Léčba se ukázala alespoň jako uspokojivá u 67 % očí léčených imunosupresivy a u všech léčených kombinovanou formou léčby. V tabulce 2 jsou tyto vztahy uvedeny pro tři jednotlivé diagnózy nitroočních zánětů. V případě intermediální uveitidy u většiny nemocných byla terapie úspěšná s celkově průměrným ziskem 9 písmen ETDRS. U chronické iridocyklitidy byla úspěšná a uspokojivá léčba prakticky u poloviny nemocných, v celkovém hodnocení zůstala úrovni stejného řádku ETDRS. Důležitým faktorem sledování léčebného efektu je vždy uspokojivý vízus u tří nemocných se sympatickou uveitidou, neboť zisk několika písmen ETDRS z dalšího řádku nelze pro počet jen u tří pacientů hodnotit jako úspěšnou léčbu. Ze sledovaných 45 očí jsme zaznamenali slepotu (vízus 0–0,05) u 7 očí (15,5 %), naštěstí ani jednou oboustranně a na druhém oku byl vždy upotřebitelný vízus, přestože se jednalo o rovněž zánětem postižené oko. U těchto nemocných zánět začal v průměru do 6 let věku s průměrnou délkou trvání 19 let, v 71 % byl vázán na juvenilní idiopatickou artritidu. K těmto pacientům je nutno připočíst i tři jednostranné slepoty v rámci enukleace pro soucitné onemocnění v předchozím období.
Celkové nežádoucí účinky léčby se v různé míře během sledovaného období vyskytly u 18 pacientů, pouze 9 léčených zůstalo bez negativních dopadů léčby. Vždy vedlejší účinky léčby provázely agresivní imunosupresivní léčbu u sympatické oftalmie (tab. 2). Ani jednou nebylo nutné přerušení indikované léčby z důvodů závažných důsledků nežádoucích účinků léčby. Zvýšený krevní tlak se v souvislosti s léčbou vyskytl u všech typů léčby, celkově osmkrát. Zvýšené jaterní testy byly zaznamenány u čtyř pacientů, největší podíl měla imunosupresivní léčby cyclosporinem A. Stejně tak se projevil toxický účinek na funkci ledvin, zvýšení kreatininu a urey, který se objevilo u dvou pacientů a gingivitida u třech sledovaných jako vedlejší účinek imunosupresivní léčby. Cushingova facies postihla sedm pacientů pro dlouhodobé užívání kortikosteroidů, stejně jako akné u pěti pacientek.
Průměrné roční náklady na léčbu 27 sledovaných pacientů s neinfekční uveitidou za období 2006 – 2011 jsou 555 960 Kč. Největší část finančních nákladů tvoří ambulantní medikace, tzn. celková i lokální podávání léků v 67 %, nejméně zahrnuje hospitalizační péče včetně nákladů na operace v 9 %. Ambulantní péče oftalmologem i s laboratorním sledováním dosahuje 24 % celkových nákladů. V meziročním srovnání celkových nákladů dosáhly maxima v roce 2007, kdy byly nejvyšší náklady na medikaci i hospitalizační péči, celkově tvořily 699 632 Kč. Oproti tomu nejnižší celkové náklady byly 382 129 Kč v posledním sledovaném roce, kdy všechny položky dosáhly minima (graf 1). Meziroční tendence jednotlivých složek nákladů má klesající charakter (graf 2). Náklady na ambulantní péči vykazují mírný pokles, souvislost k zavedení regulačního poplatku za ambulantní ošetření není prokazatelná, neboť klesl počet kontrolních vyšetření z důvodu postupné remise onemocnění. Nejpřesnější hodnoty o poskytnuté ambulantní péči o pacienty s diagnostikovanou uveitidou v porovnání s ostatními diagnózami se podařilo pochopitelně získat v posledním roce sledování. Veškerá vyšetření pacientů s uveitidou jako hlavní diagnózou i jako doprovodnou diagnózou tvořila v roce 2011 necelé 4 % ze všech 17 000 ambulantních komplexních a cílených vyšetření na Oční klinice FNKV. U námi sledovaného souboru bylo provedeno 138 především cílených vyšetření, tedy 20 % poskytnuté ambulantní péče ze všech uveitických pacientů v daném období, což byl nejnižší počet za jednotlivý rok studie. Nejvyšší počet oftalmologických kontrol v šestiletém sledování uveitid, a to v počtu 179, byl zaznamenán v roce 2006.
Graph 1. Meziroční tendence celkových nákladů 
Graph 2. Meziroční srovnání nákladů na medikaci a ambulantní sledování 
U medikace má na pokles nákladů zřejmý vliv průběžné snižování cen některých celkových imunosupresiv a také snížení preskripce z důvodu stabilizace očního procesu. Přesto v roce 2007 a 2009 vykazují náklady na medikaci přechodný růst podmíněný opakovanou aplikací tacrolimu. Hospitalizační péče nebylo možno meziročně srovnávat, neboť soubor zahrnoval krátká a nepravidelná období, a to pouze u 10 sledovaných osob. V porovnání skupin pacientů léčených jedním typem medikamentózní léčby ze skupin: imunosupresiv, kortikosteroidů a kombinovanou léčbou dosáhla nejvyšších nákladů skupina imunosupresivních preparátů: 30 928 Kč na rok za léčbu jednoho pacienta. Nejlevnější byla léčba kortikosteroidy 2 014 Kč za rok na jednoho pacienta. Roční léčba kombinací imunosupresiv s kortikosteroidními preparáty činila průměrně 17 935 Kč. Při srovnání mezi jednotlivými třemi skupinami diagnóz (tab. 2) vyplývá, že pochopitelně nejdražší léčbu představovala sympatická oftalmie s kombinací imunosupresiv a nejlevnější intermediální uveitida pro vysokou četnost aplikace kortikosteroidů celkově i parabulbárně.
Table 2. Celkové hodnocení úspěšnosti léčby, léčebných nákladů a vedlejších účinků léčby ve vztahu k jednotlivým diagnózám 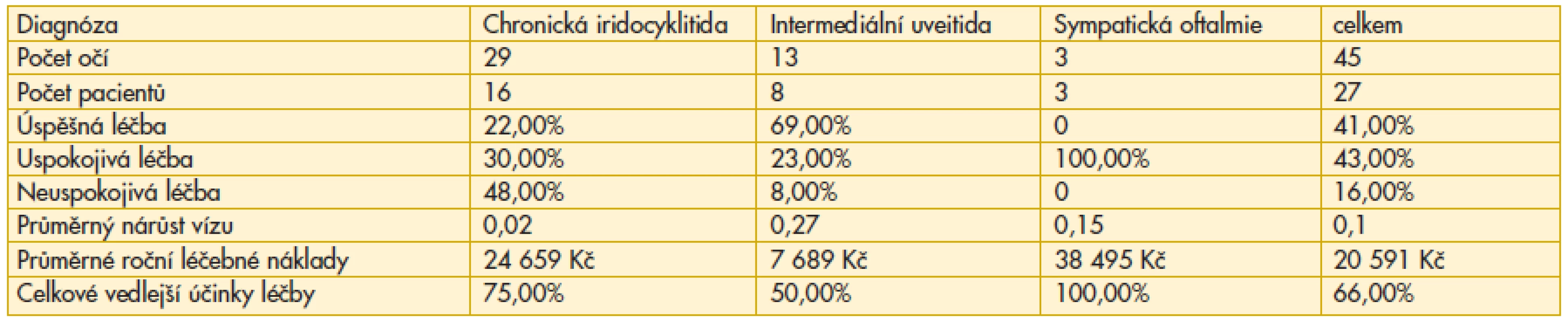
Diskuse
Zrak je nejdůležitějším lidským smyslem, jeho rozvoj probíhá od narození do konce předškolního období. Zánětlivé postižení živnatky představuje závažnou hrozbu již v tomto období. Rozsáhlá polská studie ukazuje, že na významném poklesu vidění u dětí má vliv atrofie optických nervů, retinopatie nedonošených, vysoká krátkozrakost, vrozená katarakta a degenerace sítnice a také k významným etiologickým faktorům patří uveitidy [29]. V našem souboru se uveitida objevila v předškolním období u 8 dětí a ve školním věku do 15 let věku u dalších 12, což významně ovlivňovalo zrakovou ostrost a monokulární slepotu i po letech sledování. V USA byla provedena studie ekonomických dopadů snížení zraku až slepoty, ale nezohledňovala příčiny poškození zraku. Z epidemiologických studií vyplynulo, že 6 % nemocných uveitidou jsou slepí, pak celkové roční náklady pro tyto postižené v USA jsou cca 240 milionů dolarů [10]. Jiná studie zkoumala charakter, typ a dobu trvání ztráty zraku u pacientů s uveitidou s cílem stanovit příčiny ztráty zraku a jejich největší riziko. V průběhu tříletého sledování mělo 70 % pacientů sníženou zrakovou ostrost až po době dvou let trvání onemocnění a trvalá ztráta zraku postihla čtvrtinu nemocných [8]. Na základě zkušeností v souhrnném hodnocení 73 studií [25] jsme za základ klinického hodnocení efektivnosti léčby rovněž zvolili zrakovou ostrost. V hodnocení změny zrakové ostrosti jsme posuzovali získání či ztrátu jednotlivých písmen ETDRS samostatně u jednotlivých pacientů jako u české studie AMADEUS, která vychází ze zahraničních studií VISION, MARINA a na základě doporučení NICE [9]. Signifikantní zhoršení či zlepšení udávají o 15 písmen (tedy tři řádky), mírné zhoršení či zlepšení je do 14 písmen. Celkové zhodnocení se statisticky počítá až ze sumy jednotlivých hodnot všech pacientů, které je vyjádřené v jednotlivých řádcích ETDRS [9]. Doporučení SUN Working Group hodnotí zlepšení či zhoršení zrakové ostrosti u uveitid o dva řádky [12]. V naší studii jsme posuzovali posun změny zrakové ostrosti za šest let v jednotlivých písmenech [9]. Za zcela „uspokojivou“ léčbu jsme považovali zachování vidění v daném řádku. Z toho vyplynula matematická hodnota Ī 0,05, což je celkově 0,1 = jeden řádek ETDRS. Vzhledem k malému počtu pacientů této pilotní studie jsme od hodnocení zlepšení či zhoršení vyjádřených ve dvou řádcích ETDRS [12] upustili, neboť by se zde projevila chyba malých čísel.
Základní a počáteční léčbou neinfekčních uveitid i v současnosti je stále celkové podání kortikosteroidů, které se také využívají periokulárně [5, 23, 27], tato aplikace byla námi zvolena u jednostranných intermediálních uveitid. Na zjištění klinické efektivity léčby uveitidy imunosupresivními preparáty mezi lety 1980 a 2007 [25] byly porovnány výsledky celkem 73 studií. Z toho bylo 12 randomizovaných, 20 prospektivních a 40 retrospektivních studií a 1 nekontrolovaná zaslepená studie. Imunosupresivními léčba hodnotila efektivitu léků ve 4 skupinách T-lymfocytárních inhibitorů, antimetabolitů, alkylačních látek a biologické léčby. Největší efekt byl zaznamenán u biologické léčby [25]. V naší studii byla srovnávána imunosupresivní léčba pomocí cyclosporinu A (inhibitor T-lymfocytů) a antimetabolity zastupoval azathioprin a methotrexat. Tento způsob léčby byl uplatněn i u dětských pacientů s neinfekční formou uveitidy [14, 16]. Posouzení biologické léčby nebylo zařazeno pro malý počet pacientů, neboť tato léčba je v ČR zatím kompetenci pouze revmatologů.
Ve shodě s výše uvedenou studií [25] byl potvrzen dobrý efekt všech tří léků u našich pacientů s neinfekčními uveitidami a také dobrý dopad na léčbu CME pomocí cyclosporinu A u intermediální uveitidy. V časově rozsáhlejší studii s 376 pacienty byla prokázaná vyšší účinnost léčbou cyclosporinem A, neboť po roce léčby bylo dosaženo úplné kontroly zánětu v 52 % nemocných oproti 36 % u terapie kortikosteroidy [13]. Tato zkušenost byla rovněž potvrzena, neboť při nedostatečné účinnosti celkové léčby samotnými kortikosteroidy jsme byli nuceni přejít na imunosupresivní terapii či kombinovanou léčbu. V kombinované léčbě jsme k celkově podávaným kortikosteroidům přidávali antimetabolity, což zvyšuje efektivnost léčby [2]. Právě kombinovaná léčba, která je používaná i v ČR [27, 28], v těch schématech, které šetří kortikosteroidy má dobrý efekt i nižší výskyt celkových vedlejších účinků léčby [2, 16, 24, 31]. Při nedostatečném účinku cyclosporinu A lze zvolit léčbu tacrolimem [15, 31], v našem sledování se jednalo o 3 pacienty, již s kortikorezistentní chronickou iridocyklitidou provázenou sekundárním glaukomem vyprovokovaným právě kortikosteroidy.
Součástí naší studie bylo i sledování nežádoucích účinků léčby na lidský organismus, byla soustředěna na dvě hlavní léčiva a to na celkově podávané kortikosteroidy a cyclosporin A. U kortikosteroidů to bylo akné a Cushingoidní facies, převážně u mladých dívek. Výraznou systémovou hypertenzi, hyperglykémii či nadledvinkovou insuficienci jsme nepotvrdili [23] i vzhledem k nízkému věkovému složení sledovaných nemocných ve studii. U cyclosporinu A byla nejčastější komplikací systémová hypertenze v 25 %, dále byly zaznamenány projevy mírné hepatotoxicity, zvýšení hladin kreatinu a kyseliny močové v hodnocení renálních funkcí a gingivitidu, jak je popisováno i v literatuře [29]. Vzhledem k průběžnému laboratornímu monitorování byly podle situace snižovány dávky léku bez znatelného klinického dopadu. Toxické účinky nebyly nikdy tak výrazné, aby bylo nutné imunosupresivní či kombinovanou léčbu vysadit [13, 25].
Kortikosteroidy podávané celkově, lokálně i periokulárně byly hlavní příčinou vzniku sekundárního glaukomu (22 %), stav byl řešen vysazením kortikosteroidů, pokud to stav dovolil či změnou terapie. Využívaly se především lokální antiglaukomatika: betablokátory a inhibitory karboanhydrázy [27], které byly případně doplněny o sympatomimetika pro glaukom. Tři pacienti museli podstoupit antiglaukomatózní operaci s příznivým výsledkem. Vznik katarakty především vyvolal vlastní zánět jako nejčastější jeho komplikace [27], vedlejší vliv kortikosteroidů byl jen doprovázejícím efektem. Relativně nízký počet komplikujících katarakt (36 %) v naší studii je podmíněn jejich 9 operacemi (tab. 1) v předchozím období. Operační technika se řídila formou komplikované katarakty s implantací nitrooční čočky či bez ní, podmínkou byla remise zánětu nejméně tři měsíce a peroperační intravenózní aplikace metyl-prednisolonu [27].
Farmakoekonomika je poměrně nová vědní disciplína, která se vyvíjí od šedesátých let minulého století, která interdiciplinárně spojuje farmakologické, klinické, ekonomické a epidemiologické metody. Tato vědní disciplína posuzuje celkovou hodnotu farmakoterapeutických intervencí, služeb a programů. Farmakoekonomika hledá odpověď na otázku, jaký přínos je možný získat za jednotku ceny léku. Má také významné sociální a politické aspekty [7]. Analýza nákladové efektivity – Cost-effectiveness analysis (CEA) patří mezi metody farmakoekonomických studií zabývajících se srovnáváním nákladů na léčbu a efektem léčby. CEA je analytická metoda, používaná pro zhodnocení celkových nákladů a dosažených výsledků. Její hlavní funkcí je zviditelnit relativní nákladnost různých intervencí vhledem ke zlepšení zdraví pacienta. Tento typ analýzy je vhodné použít tam, kde se porovnávají postupy s podobným typem výstupů. Výsledkem analýzy jsou náklady na specifickou klinickou jednotku. Nelze ji použít v případě studií nemocí s různými výstupy. Z hlediska nákladů jsou hodnoceny náklady přímé: spojené s léčbou a nepřímé: ovlivňující nemocného a společnosti. Přínosy léčby, nebo-li klinická efektivita, jsou vyjádřeny ve specifických klinických jednotkách. Při srovnávání dvou rozdílných léčebných intervencí u jednoho onemocnění, které mají různé náklady a generují různou míru účinnosti, je nutné určit tzv. inkrementální analýzu nákladů a přínosů. Uvedená analýza říká, co přinese nákladnější léčba a jaká je její účinnost. Výsledkem je Incremental-cost-effectiveness ratio (ICER). Je to poměr rozdílů nákladů a účinnosti, který ukazuje o kolik více prostředků je třeba vynaložit na dosažení dodatečného terapeutického užitku. Nevýhodou CEA je, že rozlišuje pouze mezi různými léčebnými intervencemi v rámci jedné diagnózy, ale není schopna porovnávat nákladovou efektivitu léčebných postupů napříč různými onemocněními. Neumožňuje převedení výsledků léčby na společného jmenovatele, jako je tomu např. u analýzy typu cost-utility (CUA) a také nebere v potaz kvalitu života a pohled pacienta. Problémem je nesourodost jednotek, v kterých jsou náklady a výsledky. Výhodou CEA je vysoká klinická srozumitelnost výsledků, neboť jsou vyjádřeny v reálných praktických veličinách [7, 26].
Průměrné roční náklady na léčbu jednoho pacienta ze sledovaného souboru v ČR jsou 20 591 Kč. Největší podíl z nich tvoří náklady na medikamentózní léčbu, průměrně 13 746 Kč, což je až 67 % z celkových nákladů. Ambulantní péče oftalmologů, imunologického či laboratorního sledování a hospitalizační péče v naší studii tvořily dohromady 6 845 Kč, tedy 33 %. Obdobná pouze jednoroční studie provedená v roce 2008 ve Francii sledovala léčbu a s tím spojené náklady ve čtyřech odborných centrech [3], naše sledování bylo na jedné klinice, ale šestileté. Nejčastější diagnózou francouzské studie byla chronická přední a intermediální uveitida, panuveitida a také zadní uveitida. Průměrné roční náklady na léčbu jednoho pacienta byly přibližně 85 100 Kč (3403 €). Největší podíl z nich tvořila odborná péče lékařů a nemocniční pobyty, celkem až 72 250 Kč (2889 €), což je 85 % z celkových nákladů. Hospitalizační epizody byly velmi časté napříč všemi sledovanými klinikami. Náklady na samotnou medikaci tvoří jen malou část z celkových nákladů, celkem asi 12 850 Kč (514 €), tedy pouhých 15 % celkových nákladů [3]. Je zřejmý rozdíl mezi výší a složením nákladů na léčbu pacientů s uveitidou u nás a ve Francii. Celkově jsou náklady léčbu uveitidy u nás výrazně nižší. Cena indikované medikace je obdobná v porovnání s vyspělou zemí EU, což svědčí pro srovnatelnou úroveň diagnostické i terapeutické odbornosti. Náklady na finanční ocenění odborné péče lékařů a dalších zdravotníků v ambulantní i hospitalizační sféře v ČR se však nedají porovnávat.
Závěr
Optimální variantu léčby nelze přesně doporučit, neboť rozhoduje vlastní diagnóza formy uveitidy. Přesto byla kombinovaná šetřící léčba, zahrnující optimální dávky imunosupresiv (azathioprin, cyclosporin A, methotrexat) a nízké dávky kortikosteroidů z hlediska klinického dopadu na udržení zrakové ostrosti nejpřínosnější zároveň s minimalizací nežádoucích účinků léčby. Nejméně finančně náročná i s dobrými klinickým efektem se jevila léčba intermediální uveitidy. U chronické iridocyklitidy byla rozhodující souvislost s juvenilní idiopatickou artritidou, kde současná přítomnost tohoto celkového systémového onemocnění byla zásadní v nepříliš optimálním klinickém výsledku a efektivitě léčby, která nebyla vždy dostačující. Finanční náklady na lékařskou odbornou péči pacientů jsou v České republice podstatně nižší než cena za vlastní medikamentózní postup.
Do redakce doručeno dne 24. 1. 2013
Do tisku přijato dne 15. 7. 2013
Mgr. Jana Krásná
Santé s.r.o.
Pštrossova 24
110 00 Praha 1
e-mail: jana.krasna@sante.cz
Sources
1. Adeoti, C.: Prevalence and causes of blindness in a tropical African population. West African J Med, 2004; 23 : 249–252.
2. Baker, K.B., Spurrier, N.J., Watkins, A.S.: Retention time for corticosteroid-sparing systemic immunosuppressive agent in patient with inflammatory eye disease. Br J Ophthalmol, 2006, 90 : 1481–1485.
3. Bodaghi, B., Kobet, G., Richard, B.: One year analysis of the cost of uveitis treatment in France: a retrospective chart review. Acta Ophthalmol, 2008, 86 : 101, Abstrakt rešerše NTK.
4. Buch, H., Vinding, T., et al.: Prevalence and causes of visual apartment and blindness among 9980 Scandinavian adults: the Copenhagen city eye study. Ophthalmology, 2004; 111 : 53–61.
5. Cunningham, E. T., Wender, J. D.: Practical approach to the use of corticosteroids in patiens with uveitis. Can J Ophthalmol, 2010; 4 : 352–358.
6. De Smet, M., D., Taylor, S., et al.: Understanding uveitis: The impact of research on visual outcomes. Progress in Retinal and Eye Research, 2011, 30 : 452–470.
7. Doležal, T. a kol.: Základy farmakoekonomiky pro lékaře, lékárníky a další pracovníky ve zdravotnictví, Praha ČFES, 2007; s. 136.
8. Durrani, O.M., Tehrani, N.N., et al.: Degree, duration, and causes of visual loss in uveitis. Br J Ophthalmol, 2004; 88 : 1159–1166.
9. Dušek, L., Pitrová, Š., et al.: Informační zázemí České oftalmologické společnosti ČLS JEP pro monitoring a hodnocení léčby vlhké formy věkem podmíněné makulární degenerace – národní projekt AMADEUS. Čes a slov Oftal, 66; 2010 : 99–109.
10. Frick, K.D., Gower, E.W., et al.: Economic impact of visual impairment and blindness in the United States. Ophthalmology, 2007; 12 : 544–550.
11. Iwase, A., Araie, M., Tomidokoro, A.: Prevalence and causes of low vision and blindness in a Japanes adult population. Ophthalmology, 2006; 113 : 1354 – 1362.
12. Jabs, D.A.., Nussenblatt, R.B. et al.: Standardization of uveitis nomenclature for reporting clinical data. Result of the First International Workshop. Am. J.Ophthalmol., 140, 2005 : 509 –516.
13. Kacmaz, R.O., Kemoen, J.H., et al.: Cyclosporine for ocular infalmmatory diseases. Ophthalmology, 2010; 3 : 576–584.
14. Kilmarin, D. J., Forrester , J. V., Dick, A.D.: Cyclosporin A therapy in refraktory non-infectious childhood uveitis. Br J Ophthalmology, 1998; 82 : 737–742.
15. Lee, W.J., Greenwood, R., Taylor, H. A.: Randomized trial of Tacrolimus versus Tacrolimus and Prednisone for maintance of disease remission in noninfectious uveitis. Ophthalmology, 2009; 2 : 155–163.
16. Malik, A.R, Pavesio, C.: The use low-dose Methotrexate in children with chronic anterior and intermediate uveitis. Br J Ophthalmol, 2005; 89 : 806–808.
17. Brevíř 2006. 15. vydání, Praha, Medical tribune CZ, 2006. (ISBN 80-903708-0-2).
18. Brevíř 2007. 16. vydání, Praha, Medical tribune CZ, 2007. (ISBN 978-80-903708-7-6).
19. Brevíř 2008. 17. vydání, Praha:Medical tribune CZ, 2008.(ISBN 978-80-87135-05-1).
20. Brevíř 2009. 18. vydání, Praha: Medical tribune CZ, 2009. (ISBN 978-80-87135-14-3).
21. Brevíř 2010. 18. vydání, Praha: Medical tribune CZ, 2010. (ISBN 978-80-87135-21-1).
22. Brevíř 2011. 19. vydání, Praha:Medical tribune CZ, 2011. (ISBN 978-80-87135-26-6).
23. Menezo, V., Lau, CH., Comer, M.: Clinical outcome of chronic immunosuppression in patiens with non-infectious uveitis. Clin. and Experiment. Ophthalmol, 2005; 33 : 16–21.
24. Pasadhika, S., Kempen, J.H. et al: Azathioprine for ocular inflammatory disease. Am J Ophthalmol, 2009, 148 : 500 – 509.
25. Pato, E., Munoz-Fernandes, S. et al.: Systematic review of th effectivness of immunosuppressants and biological therapies in the treatment of autoimmune posterior uveitis. Seminars in arthritis and rheumatism, 2011; 4 : 314 – 323.
26. Práznovcová, L., Strnad, L.: Farmakoekonomika pro lékaře, farmaceuty a manažery zdravotnických zařízení. Praha, Maxdorf, 2005, s. 85.
27. Říhová, E., a kol.: Uveitidy., Praha: Grada Publishing, 2009, s. 134.
28. Říhová, E., Šišková, A.: Léčba neinfekční uveitidy. Remedia, 2002; 12 : 179 – 84.
29. Seroczyńska, M., Gralek, M., Kanigowska, K.: Analysis of the changes in the cause of blindness and siginificant vision loos among children and young adult born between 1974 and 2004. Medycyna wieku rozwojowego, 2007; 11 : 193–216.
30. Sherwin, J.C., Dean, W.H., Medcalfe, N.H.: Cause s of blindness at Nkhoma Eye Hospital, Malawi. Europ J Ophthalmol, 2008; 18 : 1002–1006.
31. Sloper, C.M., Powel, R., Dua, H.S.: Tacrolimus (FK 506) in the treatment of posterior uveitis refractory to Cyclosporine. Ophthalmology, 1999; 4 : 723–728.
Labels
Ophthalmology
Article was published inCzech and Slovak Ophthalmology

2013 Issue 3-
All articles in this issue
- Dvouleté výsledky léčby vlhké formy věkem podmíněné makulární degenerace s použitím léků proti vaskulárnímu endotelovému růstovému faktoru
- Chirurgická liečba idiopatickej diery makuly naše skúsenosti
- Nové možnosti léčby vrozených chorob sítnice
- Hodnocení efektivnosti léčby neinfekčních uveitid
- Terapie glaukomu – aktuální přehled dat a informací
- Možnosti využitia včelieho medu v oftalmológii
- Neskorý rozvoj metastáz u pacientov s malým melanómom choroidey – 2 kazuistiky
- Czech and Slovak Ophthalmology
- Journal archive
- Current issue
- Online only
- About the journal
Most read in this issue- Terapie glaukomu – aktuální přehled dat a informací
- Nové možnosti léčby vrozených chorob sítnice
- Možnosti využitia včelieho medu v oftalmológii
- Chirurgická liečba idiopatickej diery makuly naše skúsenosti
Login#ADS_BOTTOM_SCRIPTS#Forgotten passwordEnter the email address that you registered with. We will send you instructions on how to set a new password.
- Career

