-
Medical journals
- Career
Současné přístupy k léčbě neinfekčních uveitid
Authors: prof. MUDr. Jarmila Heissigerová, Ph.D., MBA; E. Říhová; P. Svozílková; M. Brichová; D. Jeníčková
Authors‘ workplace: Oční klinika VFN a 1. LF UK Praha, přednostka doc. MUDr. Bohdana Kalvodová, CSc.
Published in: Čes. a slov. Oftal., 65, 2009, No. 5, p. 162-165
Overview
Tato práce si klade za cíl shrnout současné přístupy k léčbě neinfekčních uveitid. Zaměřuje se na jednotlivé typy imunosupresivní/imunomodulační léčby a zmiňuje její nejčastější nežádoucí účinky.
Klíčová slova:
uveitida, léčba, imunosuprese, imunomodulace, nežádoucí účinkyÚVOD
Nitrooční zánět zadního segmentu oka, jak se zadní uveitida či panuveitida v současné době ve světové literatuře nazývá, je spolu s diabetickou retinopatií hlavní příčinou slepoty v rozvinutých zemích u lidí produktivního věku [39]. Desetiprocentní podíl uveitidy na slepotě v těchto zemích [45, 46] je stále alarmující hlavně proto, že podstatná část uveitid je léčitelná. Příčin postižení zraku u nitroočních zánětů je mnoho, mezi nimi je edém makuly, jizvení v makule, odchlípení sítnice, chorioretinální atrofie, zkalení sklivce, katarakta a vzácněji atrofie zrakového nervu. Hlavní příčinou zhoršení až ztráty zraku je však u uveitid cystoidní makulární edém [32].
Základem léčby u uveitid je stanovení diagnózy, ve které je nutné zvážit etiologii onemocnění a odlišit infekční etiologii od neinfekční. Léčba infekční uveitidy se potom odvíjí od druhu infekčního agens. Systémovou imunosupresivní/imunomodulační léčbu po vyloučení infekční etiologie očního zánětu zvažujeme, jedná-li se o zrak ohrožující onemocnění.
IMUNOSUPRESIVNÍ/IMUNOMODULAČNÍ LÉČBA
Imunosupresivní a imunomodulační léčba ovlivňuje procesy autoimunitní reakce. Imunosupresiva imunitní systém potlačují, zatímco imunomodulátory kromě potlačení některých procesů mohou žádoucí část imunitního systému stimulovat.
Léčbu rozdělujeme na selektivní a neselektivní. Selektivní farmaka jsou zaměřena hlavně na buňky, které se zdají být hlavními účastníky autoimunitního procesu (zejména T lymfocyty). Neselektivní léčiva ovlivňují celou řadu zánětlivých a jiných procesů v těle nebo se zaměřují na všechny rychle se dělící buňky lidského organismu.
Seznam imunosupresiv/imunomodulátorů používaných v léčbě uveitid naleznete v tabulce 1.
Table 1. Imunosupresiva/imunomodulancia používaná k léčbě uveitid 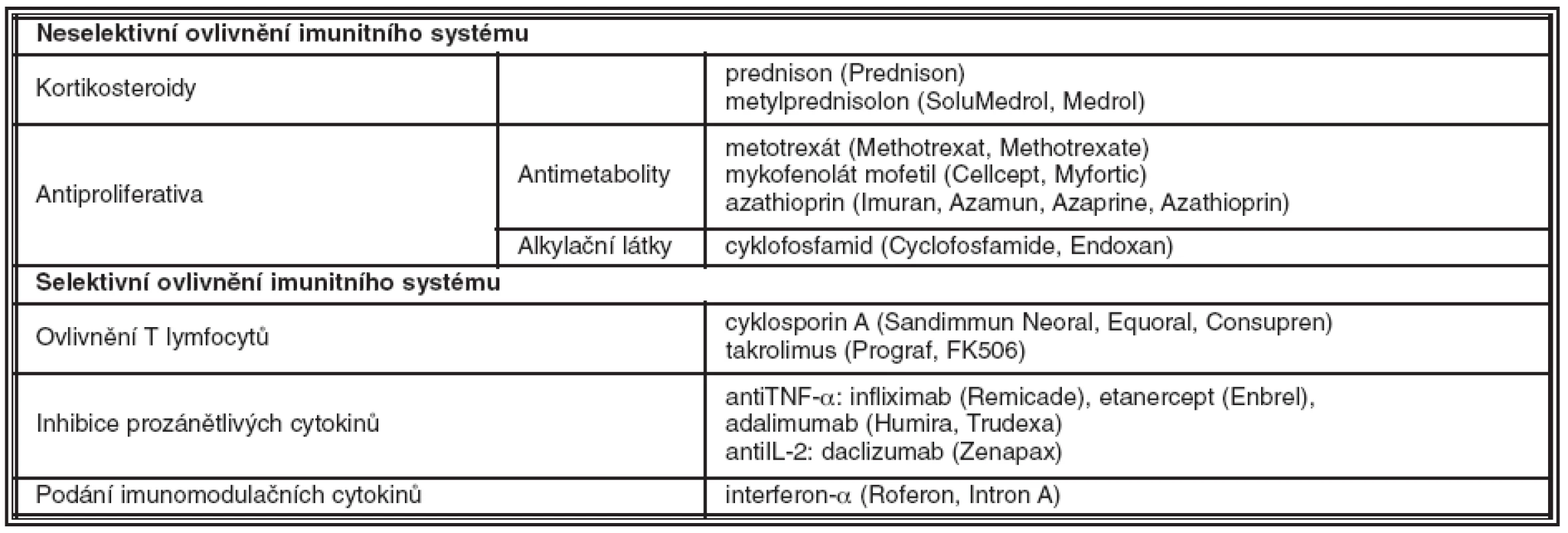
Po diagnostice zrak ohrožujícího autoimunitního onemocnění zadního segmentu oka následuje výběr vhodné léčby, která musí účinně zastavit proces probíhajícího zánětu, ale zároveň musí být pro pacienta co nejšetrnější.
Lokální léčba kapkami je u zánětů zadního segmentu oka neúčinná a používá se pouze k potlačení projevů zánětu na předním segmentu u panuveitid a intermediálních uveitid.
U jednostranných či výrazně asymetrických uveitid je možno zvážit intravitreální aplikaci kortikosteroidů [5, 10, 18, 24, 50] (např. triamcinolon) nebo implantaci jejich nosičů do sklivce (např. fluocinolon) [24]. V literatuřeje doporučována i subtenonská aplikace kortikosteroidů [14, 15, 44], jejíž hlavní výhodou je aplikace mimo sklivcový prostor, a tím snížení rizika endoftalmitidy. V obou případech dojde k dosažení významné hladiny kortikosteroidů ve sklivcovém prostoru, tato hladina však postupně klesá a aplikaci léčiv je nutno proto opakovat až do dosažení remise onemocnění. U triamcinolonu aplikovaného intravitreálně se předpokládá trvání jeho účinku přibližně tři měsíce. Aplikace parabulbární a retrobulbární jsou vzhledem k velkému vstřebávání účinné látky do oběhu v případě zadních uveitid a intermediálních uveitid málo účinné a nelze je k jejich léčbě doporučit.
Nesteroidní antiflogistika
Působí protizánětlivě, antipyreticky, analgeticky a některé z těchto preparátů mají antiagregační účinky. Výrazněji zasahují do akutní fáze zánětu, ale neovlivní progresi chronických zánětů. U některých forem intermediální uveitidy jsou vhodnou doplňkovou léčbou kortikosteroidů.
Kortikosteroidy
Antiedematózní, protizánětlivý a imunosupresivní účinek kortikosteroidů je využíván k léčbě nitroočních zánětů. Ovlivňují všechny typy zánětlivých reakcí bez ohledu na příčinu. Kortikosteroidy jsou prvními léky, které nasazujeme u pacientů s těžkým průběhem přední nebo intermediální uveitidy, panuveitidy, ale i u jednostranné zadní uveitidy ohrožující vidění. Při těžkém akutním stavu či exacerbaci chronického onemocnění je někdy s výhodou terapii zahájit třemi pulzy metylprednisolonu v dávce až 1 g/den, pokud je pacient toleruje z hlediska celkového zdravotního stavu. Po třech pulzech kortikosteroidů je možné pacienta převést na perorální léčbu. Nejčastěji používaným léčivem k perorálnímu podání je prednison v úvodní dávce 0,5–1,5 mg/kg/den. Tuto dávku postupně snižujeme dle klinického obrazu uveitidy i celkového zdravotního stavu pacienta na udržovací denní dávku 5–10 mg prednisonu. Alternativním perorálním kortikosteroidem je metylprednisolon, který nasazujeme v dávce 0,4 mg/kg/den a opět postupně snižujeme. Pokud je nitrooční zánět stabilizován při nejnižší perorální dávce kortikosteroidů po dobu 2–3 měsíců, je možné je vysadit.
Imunosupresiva/imunomodulancia
U těžších zrak ohrožujících uveitid často monoterapie kortikosteroidy není vyhovující. Důvodem jsou četné nežádoucí účinky této léčby i to, že u velkého procenta pacientů nám aktivita zánětu nedovolí dávku steroidů dostatečně snížit. Při léčbě, která vyžaduje dlouhodobější vyšší dávku kortikosteroidů (vyšší než 10 mg/den), přidáváme ke kortikosteroidům s výhodou další imunosupresivum/imunomodulans v dávce dle tabulky 2. Výběr imunosupresiva závisí na typu očního onemocnění a event. i celkové choroby, se kterou se uveitida pojí.
Table 2. Doporučené zahajovací dávky imunosupresiv/imunomodulancií 
Typickým lékem první volby pro většinu autoimunitních uveitid je cyklosporin A. V klinické praxi je již téměř 30 let [1] a s jeho použitím jsou proto dlouhodobé klinické zkušenosti [30, 36]. Cyklosporin A je možno podávat téměř bez rozdílu věku, nejčastěji v zahajovací dávce 3 mg/kg/den (rozdělené do dvou denních dávek). Dávku cyklosporinu A je možné event. zvýšit na 5 mg/kg/den. Výhodou je možné měření hladin cyklosporinu A v séru (závisí na laboratoři, typické rozmezí je mezi 80–250 ng/ml). U očních onemocnění je zkušenost, že i sotva detekovatelná hladina cyklosporinu v séru (< 40 ng/ml) může při korelaci s klidným klinickým nálezem být známkou účinnosti léčby. Vysazení cyklosporinu v takovém případě může vést k relapsu zánětu.
Před nasazením cyklosporinu je doporučeno zejména vyšetření funkce ledvin (např. clearance kreatininu). Nástup účinku lze očekávat až po 7–14 dnech od nasazení první dávky. Je proto vhodné ho nasadit spolu se zahájením intravenózní léčby pulzy kortikosteroidů. Efekt cyklosporinu A může v takovém případě nastoupit již v době, kdy se dávky perorálních kortikosteroidů začínají snižovat.
Při nesnášenlivosti cyklosporinu A je vhodnou alternativou novější lék s podobnými imunosupresivními účinky – takrolimus (FK506). Z klinických studií vyplývá, že může být pacienty lépe snášen [25], i když protizánětlivé účinky jsou s cyklosporinem A srovnatelné [25]. Prodleva nástupu klinického účinku je stejná jako u cyklosporinu A a jeho hladiny v séru je také možno monitorovat.
Lékem se spornějším účinkem v oblasti uveitid je mykofenolát mofetil. V monoterapii se u některých typů uveitid neosvědčil, ale jeho výhodou je menší množství nežádoucích účinků a lepší snášenlivost než u cyklosporinu A a takrolimu [37, 41, 51]. Je ovšem velice vhodný v kombinaci se selektivními imunosupresivy (např. s cyklosporinem A nebo s takrolimem). Jeho nástup účinku je až 8 týdnů, takže je doporučeno po tuto dobu nesnižovat jeho dávku a vyčkat klinického efektu.
U systémových vaskulitid (např. M. Behćet, Wegenerova granulomatóza, revmatoidní atrtritida) s těžším průběhem je doporučeno zahájit terapii cyklofosfamidem [35], někdy i v pulzní formě. Cyklofosfamid je asi nejsilnějším imunosupresivem v našem repertoáru (s nejtěžšími nežádoucími účinky), a proto léčba s ním by neměla být delší než několik měsíců (maximálně dva roky). Po této době ho nahrazujeme udržovacím antiproliferativem, nejčastěji azathioprinem. Cyklofosfamid pro jeho silný antiproliferativní účinek není doporučeno kombinovat s jinými imunosupresivy. Oproti tomu azathioprin je možné kombinovat jak s kortikosteroidy, tak se selektivními imunosupresivy.
Metotrexát je imunosupresivum s dobou nástupu účinku 6-8 týdnů. Je možné ho zvážit jako doplněk kortikosteroidní léčby u sarkoidózy, juvenilní idiopatické artritidy a pars planitidy u dětí.
Novějším lékem, který se používá u zrak ohrožujících uveitid, je monoklonální protilátka proti tumor-nekrotizujícímu faktoru alfa (antiTNF-α). Je k dispozici v několika formách jako infliximab, etanercept a adalimumab. Podává se v infuzích (infliximab) nebo subkutánně (etanercept a adalimumab) podle různých terapeutických schémat. Výborný protizánětlivý účinek u uveitid byl prokázán u infliximabu [13, 16, 33], a to u pacientů s těžkým průběhem systémových vaskulitid (M. Behćet, Wegenerova granulomatóza) [2, 20, 21, 27, 33, 38, 40] nebo u juvenilní idiopatické arthritidy a uveitidy [17, 22, 43]. Etanercept podle mnoha studií včetně srovnávacích s infliximabem tak dobré terapeutické účinky u očních zánětů nemá [12, 43]. Adalimumab je v tomto ohledu slibným biologickým léčivem podle několika recentních pilotních studií [6, 11, 26, 34, 42] a navíc má vzhledem ke své humanizované formě mnohem lepší snášenlivost než ostatní výše zmiňované formy antiTNF-α.
Velmi vzácně je u zrak ohrožujících uveitid nutno zahájit léčbu interferonem alfa. Je jedním z nejnovějších léků použitých v této indikaci [7, 19, 29]. Jde o cytokin s ne-zcela objasněnými mechanismy účinku a řadí se proto do skupiny imunomodulancií. Má velmi slibné účinky na zklidnění očního zánětu, avšak pro některé vážnější nežádoucí účinky je jeho široké použití zatím limitované [29]. Podává se subkutánně, zpočátku denně.
Vyšetření před nasazením léčby a monitorování pacientova stavu
Základní informace o zdravotním stavu pacienta bychom měli mít k dispozici z vyšetření indikovaných pro objasnění etiologie nitroočního zánětu/uveitidy. K těm často patří RTG srdce a plic, sonografie břicha, někdy CT či MR mozku a další.
Před nasazením imunosupresivní léčby je doporučeno provést základní odběry ke kontrole zdravotního stavu pacienta. Patří mezi ně krevní obraz a diferenciální rozpočet leukocytů, biochemické vyšetření séra obsahující ionty (Na, K, Cl, ev. Mg), urea, kreatinin, jaterní testy (ALT, AST, GMT), glykémie, C-reaktivní protein a vyšetření moči (chemicky + sediment).
Stejná vyšetření používáme i k monitorování pacientova stavu během imunosupresivní/imunomodulační léčby a pacientovi měříme pravidelně krevní tlak. Odběry přizpůsobujeme zdravotnímu stavu pacienta a druhu použitého imunosupresiva. Nejčastěji se zpočátku odběry indikují po 4–6 týdnech, potom event. každých 3–6 měsíců.
U některých imunosupresiv je možné sledovat hladinu imunosupresiva v séru (cyklosporin A, takrolimus) a dávku upravit podle dosažené terapeutické hladiny.
Spolupráce s ošetřujícím lékařem pacienta (nejčastěji praktickým lékařem) je při monitorování pacientova stavu žádoucí.
Nežádoucí účinky léčby
Léčba očního onemocnění musí vždy brát v úvahu snášenlivost přípravku podávaného systémově. Naprostá většina imunosupresiv/imunomodulancií má celou řadu nežádoucích účinků – viz seznam níže. Nežádoucí účinky kortikosteroidní léčby jsou dobře známy. Z dalších imunosupresiv/imunomodulancií za zdůraznění stojí nefrotoxicita při léčbě cyklosporinem, potlačení krvetvorby a hemoragická cystitida u cyklofosfamidu, anafylaktická reakce u infliximabu a suicidální tendence u interferonu alfa. Při použití léků ovlivňujících imunitu je s postupem doby stále patrnější riziko vzniku různých typů nádorů.
Jak je patrné, škála nežádoucích účinků je široká a je třeba znát výhody a nevýhody léčiv při zvažování jejich indikace. Při spolupráci s ošetřujícím lékařem pacienta však lze nežádoucí účinky léčby dobře monitorovat.
Kortikosteroidy: zvýšení krevního tlaku, retence tekutin a sodíku, hypokalemická alkakóza, porucha glukózové tolerance až manifestace diabetes mellitus, osteoporóza s rizikem fraktur, riziko avaskulární nekrózy hlavice femuru, inhibice růstu u dětí (léčba delší než 6 měsíců), Cushingův syndrom, zvýšená chuť k jídlu, centripetální obezita, myopatie, tenká fragilní kůže, strie, akné, purpura, hirsutismus, hyperlipidémie, žaludeční vředová choroba, psychiatrické příznaky – deprese, třes, euforie, hyperaktivita, zpomalené hojení ran, zvýšené riziko infekce a/nebo reaktivace latentní infekce (TBC, herpes), potlačení sekrece adrenokortikotropního hormonu – tlumení osy hypotalamus-hypofýza-nadledviny, zvýšení srážlivosti krve, poruchy menstruace, vyšší incidence katarakty a glaukomu.
Cyklosporin A: subjektivní: parestezie, otoky, třes rukou, únava, bolesti hlavy, nauzea, nechutenství, pocity horka v oblasti žaludku; objektivní: zvýšená sedimentace, hypertenze, lehká anémie, hyperurikémie, hepatotoxicita, hydrosadenitida, hirsutismus, nefrotoxicita reverzibilní – kreatinin by neměl být vyšší o 30 % výchozí hodnoty, hypertrofická gingivitida, oportunní infekce, lymfomy.
Takrolimus: subjektivní: parestezie, otoky, třes rukou, únava, bolesti hlavy, nauzea, nechutenství; objektivní: zvýšená sedimentace, hypertenze, lehká anémie, hepatotoxicita, reverzibilní nefrotoxicita, oportunní infekce.
Mykofenolát mofetil: krvetvorba: leukopenie, anémie, trombocytopenie, lymfoproliferativní nádory, krvácení gastrointestinálního traktu, průjem, maligní nádory kůže, vypadávání vlasů, porucha renálních funkcí, hematurie, zvýšené riziko oportunních infekcí (kandidóza kůže a sliznic, cytomegalovirus, herpes simplex a zoster),sepse.
Cyklofosfamid: leukopenie, myeloproliferativní a lymfoproliferativní nádory, hemoragická cystitida, nefrotoxicita, aktivace a reaktivace infekčních chorob, při dlouhodobém podávání zvýšený výskyt nádorů močového měchýře a kožních malignit, dysfunkce gonád, padání vlasů (reverzibilní), syndrom suchého oka.
Azathioprin: leukopenie, anémie, trombocytopenie, artralgie, reverzibilní hepatotoxicita
Metotrexát: orgány krvetvorby: leukopenie, anémie, trombocytopenie, nauzea, zvracení, průjmy, jaterní dysfunkce (fibróza a cirhóza častěji u etyliků), kožní alergické projevy, fibróza plic, ulcerózní stomatitida, gastritida.
AntiTNF-α (infliximab): akutní reakce na infúzi včetně anafylaktického šoku a opožděná hypersenzitivní reakce, virové infekce (chřipkové onemocnění, herpetické infekce), poruchy imunitního systému, bolest hlavy, vertigo, dušnost, tíže na hrudi, únava, nauzea, průjmy, bolesti břicha, dyspepsie, exantém, pruritus, urtikarie, zvýšené pocení, suchost kůže.
Interferon-α: příznaky lehké chřipky, psychické změny: deprese, úzkostlivost či předrážděnost, poruchy spánku, suicidální tendence, leukopenie, lymfopenie, anémie, trombocytopenie, nauzea, zvracení, průjmy, jaterní dysfunkce, exantém, reakce v místě vpichu, dysfunkce štítné žlázy, infekční onemocnění, retinopatie – vatovitá ložiska podél retinálních cév, častěji na zadním pólu oka.
DISKUSE A ZÁVĚR
Autoimunitní nitrooční zánět zadního segmentu oka v mnoha případech dobře reaguje na protizánětlivou a imunosupresivní/imunomodulační léčbu. V případě špatné reakce na léčbu je třeba zvážit několik možností selhání:
- a) Jde opravdu o autoimunitní onemocnění – je možné zcela vyloučit infekční etiologii zánětu? Toto dilema může nastat například v případě Lymské borreliózy, miliární tuberkulózy a podobně. Nutné je i vyloučení maskujících syndromů.
- b) Byla dávka steroidů či jiných imunosupresiv/imunomodulancií dostatečná? Z obavy před nežádoucími účinky systémové terapie dochází k nasazení dávek nižších, neúčinných, nebo k příliš rychlému snižování dávky ještě před možným termínem očekávaného nástupu účinku dané látky (cave pomalý nástup účinku cyklosporinu/takrolimu (až 14 dní), metotrexátu a mykofenolát mofetilu (až 8 týdnů) a podobně).
- c) Nedošlo k nasazení léčby až v okamžiku, kdy opravdové zlepšení vzhledem k nevratnému poškození zrakového nervu či sítnice již nelze očekávat?
Pokud vyloučíme výše uvedené nejčastější možnosti selhání léčby, nabízí se jako řešení zvýšení dávky podávaného imunosupresiva, jeho výměna za jiný přípravek či kombinace s dalšími preparáty s doplňujícími vhodnými vlastnostmi (viz tabulka 3).
Table 3. Možnosti kombinace různých imunosupresiv 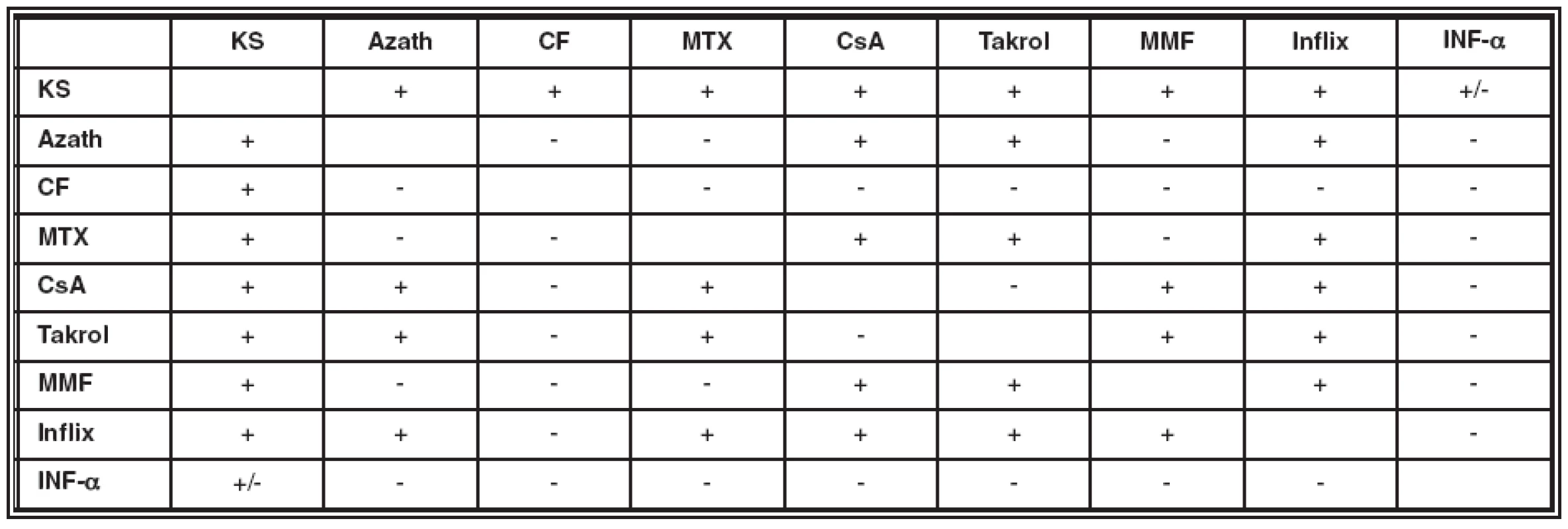
Vysvětlivky: KS – kortikosteroidy, Azath – azathioprin, CF – cyklofosfamid, MTX – methotrexát, CsA – cyklosporin A, Takrol – takrolimus, MMF – mykofenolát mofetil, Inflix – infliximab, INF-α – interferon α Současné možnosti léčby uveitid se neustále rozšiřují. Každým rokem přibývají klinické studie založené na testování nových monoklonálních protilátek, cytokinů, kostimulačních molekul a dalších látek v léčbě autoimunitních onemocnění. Léčba, která se prokáže jako účinná u jiných typů systémové autoimunity (například u roztroušené sklerózy, u systémových vaskulitid a revmatologických onemocnění), často dostává své místo i v léčbě neinfekčních zrak ohrožujících uveitid. Typickým příkladem je nyní již i u nás používaný přípravek inhibující TNF-α.
Dalším lékem, který je nyní ve stadiu druhé a třetí fáze klinických studií léčby autoimunitních uveitid ve světě, je daclizumab (Zenapax). Jde o monoklonální protilátku inhibující účinky interleukinu(IL)-2. Podává se v počáteční intravenózní formě a po dvou dávkách se přechází při dobré toleranci léku na podávání subkutánní. Z pilotních studií se zdá, že je tento lék dobře tolerován a že významně snižuje aktivitu uveitidy [28, 49]. Ve stadiu klinických studií jsou i další biologické léky, zaměřené na ovlivnění kostimulačních a jiných molekul (např. alefacept (fúzní protein LFA-3/IgG1), abatacept (CTLA4-Ig), anakinra (anti-IL-1R), rituximab (anti-CD20), tocilizumab (anti-IL-6R) a řada dalších).
Ve stadiu experimentálním – na experimentálním modelu autoimunitní uveitidy (experimental autoimmune uveitis, EAU) u myši či krysy – je nabídka možných budoucích léků ještě širší. Je zde LX211 (známý i jako voclosporin či ISA247) – kalcineurinový inhibitor nové generace – snižující aktivitu EAU u krysy a inhibující lidské T-lymfocyty [9], farmakologická inhibice aldosa-reduktázy snižující EAU u krysy [48]a mnohé další zahrnující i genové terapie modifikující cytokinový profil hlodavců [3, 4, 8, 23, 31, 47].
Pro praxi je klíčové si uvědomit, že žijeme v době, kdy léčit uveitidu neinfekční etiologie již není nepřekonatelný problém. Účinné léky (jako například cyklosporin A) jsou nám plně k dispozici a to, že jsme „jenom oftalmologové“ nám již zdaleka není výmluvou se lékům se systémovými imunosupresivními/imunomodulačními účinky vyhnout. Základem je mezioborová spolupráce s klinickými imunology, event. ošetřujícími lékaři našich pacientů s jejichž spoluprací je možné nežádoucí účinky imunosuprese snížit na minimum. Naším cílem musí být do budoucna snížit těch magických 10 % pacientů, kteří oslepnou z důvodu těžké, zrak ohrožující uveitidy.
Do redakce doručeno dne 9. 2. 2009
Do tisku přijato dne 1. 9. 2009
As. MUDr. Jarmila Heissigerová, Ph.D.
Centrum pro diagnostiku a léčbu uveitid
Oční klinika VFN a 1. LF UK
U Nemocnice 2, 128 08 Praha 2
E-mail: j. heissigerova@yahoo.co.uk
Sources
1. Cyclosporin a for posterior uveitis? JAMA, 1982; 247 : 569.
2. Accorinti, M., Pirraglia, M.P., Paroli, M.P., et al.: Infliximab treatment for ocular and extraocular manifestations of Behcet’s disease. Jpn J Ophthalmol, 2007; 51 : 191–196.
3. Agarwal, R.K., Caspi, R.R.: Rodent models of experimental autoimmune uveitis. Methods Mol Med, 2004; 102 : 395–419.
4. Agarwal, R.K., Kang, Y., Zambidis, E., et al.: Retroviral gene therapy with an immunoglobulin-antigen fusion construct protects from experimental autoimmune uveitis. J Clin Invest, 2000; 106 : 245–252.
5. Androudi, S., Letko, E., Meniconi, M., et al.: Safety and efficacy of intravitreal triamcinolone acetonide for uveitic macular edema. Ocul Immunol Inflamm, 2005; 13 : 205–212.
6. Biester, S., Deuter, C., Michels, H., et al.: Adalimumab in the therapy of uveitis in childhood. Br J Ophthalmol, 2007; 91 : 319–324.
7. Bodaghi, B., Gendron, G., Wechsler, B., et al.: Efficacy of interferon alpha in the treatment of refractory and sight threatening uveitis: A retrospective monocentric study of 45 patients. Br J Ophthalmol, 2007; 91 : 335–339.
8. Caspi, R.R., Grubbs, B.G., Chan, C.C., et al.: Genetic control of susceptibility to experimental autoimmune uveoretinitis in the mouse model. Concomitant regulation by MHC and non-MHC genes. J Immunol, 1992; 148 : 2384–2389.
9. Cunningham, M.A., Austin, B.A., Li, Z., et al.: LX211 (voclosporin) suppresses experimental uveitis and inhibits human T-cells. Invest Ophthalmol Vis Sci, 2008; [e-pub ahead of print].
10. Cunningham, M.A., Edelman, J.L. Kaushal, S.: Intravitreal steroids for macular edema: The past, the present, and the future. Surv Ophthalmol, 2008; 53 : 139–149.
11. Diaz-Llopis, M., Garcia-Delpech, S., Salom, D., et al.: Adalimumab therapy for refractory uveitis: A pilot study. J Ocul Pharmacol Ther, 2008; 24 : 351–361.
12. Foeldvari, I., Nielsen, S., Kummerle-Deschner, J., et al.: Tumor necrosis factor-alpha blocker in treatment of juvenile idiopathic arthritis-associated uveitis refractory to second-line agents: Results of a multinational survey. J Rheumatol, 2007; 34 : 1146–1150.
13. Greiner, K., Plšková, J.: [TNFalpha inhibitors in the treatment of uveitis]. Ophthalmologe, 2005; 102 : 335–340.
14. Helm, C.J., Holland, G.N.: The effects of posterior subtenon injection of triamcinolone acetonide in patients with intermediate uveitis. Am J Ophthalmol, 1995; 120 : 55–64.
15. Choudhry, S., Ghosh, S.: Intravitreal and posterior subtenon triamcinolone acetonide in idiopathic bilateral uveitic macular oedema. Clin Experiment Ophthalmol, 2007; 35 : 713–718.
16. Imrie, F.R., Dick, A.D.: Biologics in the treatment of uveitis. Curr Opin Ophthalmol, 2007; 18 : 481–486.
17. Kahn, P., Weiss, M., Imundo, L.F., et al.: Favorable response to high-dose infliximab for refractory childhood uveitis. Ophthalmology, 2006; 113 : 860-864 e2, [e-pub ahead of print].
18. Kok, H., Lau, C., Maycock, N., et al.: Outcome of intravitreal triamcinolone in uveitis. Ophthalmology, 2005; 112 : 1916 e11–17 [e-pub ahead of print].
19. Kotter, I., Eckstein, A.K., Stubiger, N., et al.: Treatment of ocular symptoms of Behcet’s disease with interferon alpha 2a: A pilot study. Br J Ophthalmol, 1998; 82 : 488–494.
20. Lamprecht, P., Arbach, O., Voswinkel, J., et al.: [Induction of remission with infliximab in therapy-refractory Wegener’s granulomatosis - follow-up of six patients]. Dtsch Med Wochenschr, 2002; 127 : 1876–1880.
21. Lamprecht, P., Voswinkel, J., Lilienthal, T., et al.: Effectiveness of tnf-alpha blockade with infliximab in refractory Wegener’s granulomatosis. Rheumatology (Oxford), 2002; 41 : 1303–1307.
22. Mangge, H., Heinzl, B., Grubbauer, H.M., et al.: Therapeutic experience with infliximab in a patient with polyarticular juvenile idiopathic arthritis and uveitis. Rheumatol Int, 2003; 23 : 258–261.
23. Mattapallil, M.J., Sahin, A., Silver, P.B., et al.: Common genetic determinants of uveitis shared with other autoimmune disorders. J Immunol, 2008; 180 : 6751–6759.
24. Mohammad, D.A., Sweet, B.V. Elner, S.G.: Retisert: Is the new advance in treatment of uveitis a good one? Ann Pharmacother, 2007; 41 : 449-454.
25. Murphy, C.C., Greiner, K., Plšková, J., et al.: Cyclosporine vs tacrolimus therapy for posterior and intermediate uveitis. Arch Ophthalmol, 2005; 123 : 634–641.
26. Mushtaq, B., Saeed, T., Situnayake, R.D., et al.: Adalimumab for sight-threatening uveitis in Behcet’s disease. Eye, 2007; 21 : 824–825.
27. Niccoli, L., Nannini, C., Benucci, M., et al.: Long-term efficacy of infliximab in refractory posterior uveitis of Behcet’s disease: A 24-month follow-up study. Rheumatology (Oxford), 2007; 46 : 1161–1164.
28. Nussenblatt, R.B., Peterson, J.S., Foster, C.S., et al.: Initial evaluation of subcutaneous daclizumab treatments for noninfectious uveitis: A multicenter noncomparative interventional case series. Ophthalmology, 2005; 112 : 764–770.
29. Plšková, J., Greiner, K., Forrester, J.V.: Interferon-alpha as an effective treatment for noninfectious posterior uveitis and panuveitis. Am J Ophthalmol, 2007; 144 : 55–61.
30. Poch, T., Říhová, E., Michalová, K.: Imunologické mechanismy a jejich ovlivnění imunosupresívní terapií v očním lékařství. Čes Oftalmol, 1993; 49 : 131–138.
31. Rosenzweig, H.L., Martin, T.M., Jann, M.M., et al.: NOD2, the gene responsible for familial granulomatous uveitis, in a mouse model of uveitis. Invest Ophthalmol Vis Sci, 2008; 49 : 1518–1524.
32. Rothova, A., Suttorp-van Schulten, M.S., Frits Treffers, W., et al.: Causes and frequency of blindness in patients with intraocular inflammatory disease. Br J Ophthalmol, 1996; 80 : 332–336.
33. Rudometkin, N., Mandava, N., Deane, K., et al.: Infliximab in uveitis treatment. Arch Ophthalmol, 2006; 124 : 1211; author reply 1211–1212.
34. Rudwaleit, M., Rodevand, E., Holck, P., et al.: Adalimumab effectively reduces the rate of anterior uveitis flares in patients with active ankylosing spondylitis: Results of a prospective open-label study. Ann Rheum Dis, 2008; [e-pub ahead of print].
35. Říhová, E., Boguszaková, J., Michalová, K., et al.: Naše zkušenosti s imunosupresívní léčbou endogenní uveitidy. Čes Oftalmol, 1993; 49 : 139–144.
36. Říhová, E., Poch, T., Boguszaková, J., et al.: První zkušenosti s terapií endogenní uveitidy Consuprenem – českým cyklosporinem A. Čes Oftalmol, 1994; 50 : 302–309.
37. Siepmann, K., Huber, M., Stubiger, N., et al.: Mycophenolate mofetil is a highly effective and safe immunosuppressive agent for the treatment of uveitis : A retrospective analysis of 106 patients. Graefes Arch Clin Exp Ophthalmol, 2006; 244 : 788–794.
38. Sobrin, L., Kim, E.C., Christen, W., et al.: Infliximab therapy for the treatment of refractory ocular inflammatory disease. Arch Ophthalmol, 2007; 125 : 895–900.
39. Suttorp-Schulten, M.S., Rothova, A.: The possible impact of uveitis in blindness: A literature survey. Br J Ophthalmol, 1996; 80 : 844–848.
40. Svozílková, P., Říhová, E., Brichová, M., et al.: Infliximab v léčbě Wegenerovy granulomatózy: kazuistika. Česk Slov Oftalmol, 2006; 62 : 280–286.
41. Teoh, S.C., Hogan, A.C., Dick, A.D., et al.: Mycophenolate mofetil for the treatment of uveitis. Am J Ophthalmol, 2008; [e-pub ahead of print].
42. Tynjala, P., Kotaniemi, K., Lindahl, P., et al.: Adalimumab in juvenile idiopathic arthritis-associated chronic anterior uveitis. Rheumatology (Oxford), 2008; 47 : 339–344.
43. Tynjala, P., Lindahl, P., Honkanen, V., et al.: Infliximab and etanercept in the treatment of chronic uveitis associated with refractory juvenile idiopathic arthritis. Ann Rheum Dis, 2007; 66 : 548–550.
44. Venkatesh, P., Garg, S.P., Verma, L., et al.: Posterior subtenon injection of corticosteroids using polytetrafluoroethylene (PTFE) intravenous cannula. Clin Experiment Ophthalmol, 2002; 30 : 55–57.
45. Wormald, R., Evans, J.: Needs and demands for ophthalmology services. BMJ, 1992; 305 : 1502.
46. Wormald, R.P., Wright, L.A., Courtney, P., et al.: Visual problems in the elderly population and implications for services. BMJ, 1992; 304 : 1226–1229.
47. Xu, H., Wawrousek, E.F., Redmond, T.M., et al.: Transgenic expression of an immunologically privileged retinal antigen extraocularly enhances self tolerance and abrogates susceptibility to autoimmune uveitis. Eur J Immunol, 2000; 30 : 272–278.
48. Yadav, U.C., Srivastava, S.K. Ramana, K.V.: Aldose reductase inhibition prevents endotoxin-induced uveitis in rats. Invest Ophthalmol Vis Sci, 2007; 48 : 4634–4642.
49. Yeh, S., Wroblewski, K., Buggage, R., et al.: High-dose humanized anti-IL-2 receptor alpha antibody (daclizumab) for the treatment of active, non-infectious uveitis. J Autoimmun, 2008; 31 : 91–97.
50. Young, S., Larkin, G., Branley, M., et al.: Safety and efficacy of intravitreal triamcinolone for cystoid macular oedema in uveitis. Clin Experiment Ophthalmol, 2001; 29 : 2–6.
51. Zierhut, M., Stubiger, N., Aboalchamat, W., et al.: [Immunosuppressive therapy with mycophenolate mofetil (Cellcept) in treatment of uveitis]. Ophthalmologe, 2001; 98 : 647–651.
Labels
Ophthalmology
Article was published inCzech and Slovak Ophthalmology

2009 Issue 5-
All articles in this issue
- Diagnostika akantamébovej keratitídy
- Současné přístupy k léčbě neinfekčních uveitid
- Kontrastní citlivost a aberace vyšších řádů po konvenčním LASIKu
- Změny aberací vyšších řádů a kontrastní citlivosti po standardní fotorefrakční keratektomii
- Lucentis v liečbe vlhkej formy vekom podmienenej degenerácie makuly – dvojročné skúsenosti
- Kombinované cievne oklúzie sietnice
- Porovnání prahové interpolační a celořádkové metody při testování zrakové ostrosti na optotypových tabulích logMÚR ETDRS a Snellen
- Benefit chirurgické léčby idiopatické intrakraniální hypertenze – kazuistické sdělení
- Czech and Slovak Ophthalmology
- Journal archive
- Current issue
- Online only
- About the journal
Most read in this issue- Diagnostika akantamébovej keratitídy
- Současné přístupy k léčbě neinfekčních uveitid
- Benefit chirurgické léčby idiopatické intrakraniální hypertenze – kazuistické sdělení
- Kontrastní citlivost a aberace vyšších řádů po konvenčním LASIKu
Login#ADS_BOTTOM_SCRIPTS#Forgotten passwordEnter the email address that you registered with. We will send you instructions on how to set a new password.
- Career

