-
Medical journals
- Career
Imunohistochemická charakterizácia kolagénu IV v zdravých rohovkách a rohovkách pacientov so zadnou polymorfnou dystrofiou
Authors: S. Merjavá 1; P. Lišková 1; K. Jirsová 1,2
Authors‘ workplace: Laboratoř biologie a patologie oka, Institut dědičných metabolických chorob, VFN a 1. LF UK, Praha, vedoucí pracoviště prof. MUDr. Milan Elleder, DrSc. 1; Oční tkáňová banka, VFN a UK, Praha, vedoucí pracoviště MUDr. Marcela Černická, MBA 2
Published in: Čes. a slov. Oftal., 64, 2008, No. 3, p. 115-119
Overview
Cieľ:
Cieľom tejto práce bolo zistiť výskyt jednotlivých reťazcov kolagénu IV (α1, α2, α3, α4, α5 a α6) v kontrolných rohovkách a v rohovkách pacientov so zadnou polymorfnou dystrofiou rohovky (ZPD).Metodika:
Pre experimenty bolo použitých 7 kontrolných rohoviek a 7 rohovkových terčov získaných pri keratoplastike pacientov so ZPD. Jednotlivé reťazce kolagénu IV boli detekované v kryorezoch o hrúbke 7 Ķm pomocou nepriamej fluorescenčnej imunohistochémie.Výsledky:
V kontrolných rohovkách sa v bazálnej membráne epitelu nachádzali reťazce α3, α5 a α6, v strome reťazce α3 a α5. V Descemetovej membráne boli prítomné všetky reťazce kolagénu IV s výnimkou reťazca α1, ktorý bol pozitívny len u jednej kontrolnej rohovky zo siedmych. V bunkách epitelu a endotelu kontrolných rohoviek nebol kolagén IV detekovaný. U rohoviek pacientov so ZPD sa v bazálnej membráne epitelu okrem reťazcov α3, α5 a α6 vyskytoval aj reťazec α2, v strome boli vedľa reťazcov α3 a α5 detekované i reťazce α1, α2 a α4. V Descemetovej membráne rohoviek pacientov so ZPD boli vo zvýšenej (α1, α2, α3), zníženej (α4, α6), alebo nezmenenej (α5) miere oproti kontrolám prítomné všetky reťazce kolagénu IV. V bunkách epitelu a endotelu rohoviek pacientov nebol kolagén IV detekovaný.Záver:
Ľudská rohovka vykazuje značnú heterogenitu vo výskyte reťazcov α kolagénu IV, a to predovšetkým v bazálnej membráne epitelu a v Descemetovej membráne, pre ktoré je prítomnosť kolagénu IV jednou z charakteristických čŕt. U pacientov so ZPD dochádza k zmenám expresie jednotlivých reťazcov kolagénu IV na úrovni Descemetovej membrány a stromy.Kľúčové slová:
kolagén IV, rohovka, nepriama fluorescenčná imunohistochémiaÚVOD
Jedným z charakteristických rysov rohovky je jej transparencia, ktorá je udržiavaná usporiadaním rohovkovej stromy a funkčnosťou endotelu. Základnou extracelulárnou zložkou stromy sú kolagénové vlákna [21, 22].
Kolagén IV sa v rohovke nachádza nielen v strome, ale je predovšetkým základnou stavebnou štruktúrou bazálnych membrán (BM) [8, 10], ktoré hrajúdôležitú úlohu v bunečnej adhézii, diferenciácii a regenerácii [15]. V rohovke sú dve BM: BM epitelu (BME) a Descemetova membrána (DM).
Kolagén IV je proteín tvorený troma reťazcami α zloženými do trojzávitnice. Dodnes bolo identifikovaných 6 rôznych reťazcov α (α1 – α6) kolagénu IV [24]. Triméry [α1]2α2 a [α1]3 sú prítomné vo väčšine BM, zatiaľ čo reťazce α3, α4, α5 a α6 sú minoritnou komponentou BM s obmedzenou tkanivovou distribúciou [8]. Hlavnou funkciou kolagénu IV je tvoriť podpornú sieť. Navyše rôzne domény reťazcov α môžu regulovať bunkové funkcie, akými sú anti-angiogénne a anti-tumorové vlastnosti. Reťazce α1 a α2 podporujú bunečnú migráciu, zatiaľ čo všetky ostatné reťazce majú anti-invazívny charakter [23].
Imunohistochemickou charakterizáciou reťazcov kolagénu IV v normálnej rohovke zistili Ljubimov a kol. [19] vertikálnu a horizontálnu heterogenitu v ich lokalizácii. V BME centrálnej rohovky detekovali reťazce α3 – α5. Intenzita ich signálu klesala smerom k periférii. V strome rohovky detekovali reťazce α3, α4 a α5. V DM sa na stromálnej strane nachádzali reťazce α1 a α2, na strane endotelovej reťazce α3, α4 a α5. Tuori a kol. [26] podobne lokalizovali reťazce α3 a α4 na endotelovej strane DM, ale v BME ich prítomnosť nezistili. Reťazce α5 a α6 detekovali v BME centrálnej rohovky a na endotelovej strane DM. Reťazec α6 pritom vykazoval horizontálnu heterogenitu s poklesom signálu smerom k periférii. Imunoelektrónovou mikroskopiou bol pozorovaný kolagén IV na endotelovej strane DM [20].
Mutácie v génoch pre reťazce α3, α4, α5 a α6 kolagénu IV podmieňujú vznik Alportovho syndrómu, dedičného ochorenia charakterizovaného hematúriou, senzorineurálnou hluchotou a očným postihnutím [16].
Zadná polymorfná dystrofia rohovky (ZPD, posterior polymorphous corneal dystrophy) je bilaterálne ochorenie rohovky s autozomálne dominantnou dedičnosťou, ktoré postihuje primárne endotel a DM [3, 4, 7].
Zmeny na úrovni endotelu pacientov so ZPD (epitelizácia a proliferácia abnormálneho endotelu) boli detailne charakterizované svetelnou a elektrónovou mikroskopiou [2, 7, 13]. Epitelizácia endotelu pacientov so ZPD bola ďalej potvrdená detekciou výskytu širokého spektra cytokeratínov, typických epiteliálnych proteínov, ktoré sa v zdravom endoteli nevyskytujú [9, 25].
Jedným z troch zatiaľ známych mutovaných génov, ktoré asociujú so ZPD, je gén pre reťazec α2 kolagénu VIII (COL8A2) lokalizovaný na 1. chromozóme [1]. U jedného pacienta so ZPD bol popísaný ektopický výskyt reťazca α3 kolagénu IV v bunkách endotelu rohovky v dôsledku mutácie v transkripčnom faktore 8 (TCF8, novšie nazývaný ZEB1), lokalizovanom na 10. chromozóme [12].
V rohovkách pacientov so ZPD môže dochádzať k formovaniu patologickej vrstvy na úrovni DM – zadnej kolagénovej vrstvy (posterior collagenous layer, PCL). Táto vrstva formuje ďalšiu vrstvu medzi zadnou amorfnou vrstvou (posterior non-banded layer) a endotelom. U pacientov so ZPD boli detekované všetky tri typy PCL: prúžkovaná, fibrilárna aj fibrocelulárna. Zadná kolagénová vrstva vzniká aj v rohovkách pacientov, ktorí trpia chorobami s podobnými zmenami na úrovni zadnej časti rohovky ako sa vyskytujú u ZPD, napríklad u kongenitálnej hereditárnej endotelovej dystrofie, Fuchsovej dystrofie alebo iridokorneálneho endotelového syndrómu [27]. Pomocou imunoelektrónovej mikroskopie boli v tejto patologickej vrstve detekované kolagény I, III, V, VI a VIII [17].
Detailná lokalizácia a charakterizácia jednotlivých kolagénov u pacientov so ZPD však doteraz nebola prevedená. Cieľom tejto práce je zmapovať výskyt jednotlivých reťazcov kolagénu IV v normálnych rohovkách a rohovkách získaných od pacientov so ZPD.
PACIENTI A METODIKA
Sedem kontrolných rohovkových terčov (K1 – K7) vylúčených z transplantačného programu (nevyhovujúce kvalitatívne a kvantitatívne parametre endotelu, pozitívne výsledky sérologického vyšetrenia darcu) poskytla Oční tkáňová banka Všeobecné fakultní nemocnice a 1. LF UK. U darcov týchto rohoviek nebolo zaznamenané žiadne ochorenie očí a ich priemerný vek bol 63 rokov.
Sedem rohovkových terčov bolo získaných pri parciálnej perforujúcej keratoplastike pacientov so ZPD (tab. 1).
Table 1. Pacienti so ZPD, od ktorých boli získané rohovkové terče (uvedený vek je vek v dobe prevedenia keratoplastiky, Ž – žena, M – muž) 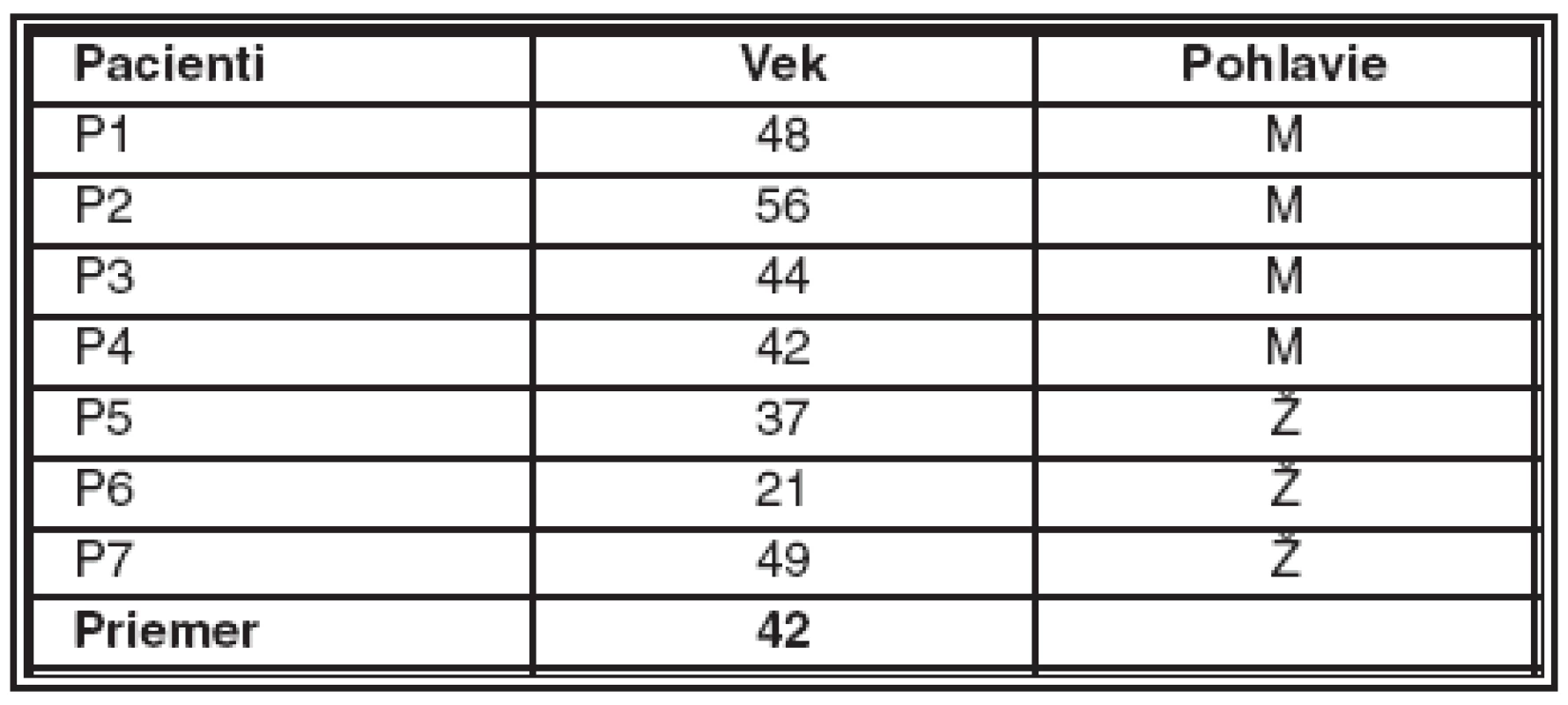
Jedna z týchto rohoviek bola získaná od pacienta pochádzajúceho z rodiny, v ktorej bolo ochorenie mapované na krátke ramienko 20. chromozómu (viď tab. 1; P1), [6]. Ďalších päť rohoviek bolo získaných od piatich pacientov, ktorí pochádzajú z rovnakej geografickej oblasti v juhozápadnej časti Českej republiky a predpokladá sa u nich rovnaká mutácia (viď tab. 1; P2, P4 – P7). Jedna rohovka bola získaná od pacienta s detekovanou mutáciou v ZEB1 géne [18] (viď tab. 1; P3). Jeden z pacientov so ZPD vykazoval na rohovkovej topografii pre keratokonus charakteristické vyvýšenie v inferotemporálnej časti rohovky (viď tab. 1; P5).
Získané rohovky boli rozdelené na tri časti, zaliate do média pre zamrazovanie tkanív (Optimal cutting temperature medium) a uchované pri teplote -70 °C. Pre experimenty boli použité kryorezy o hrúbke 7 Ķm, montované po štyroch na podložné sklíčka. Jeden rez na každom sklíčku bol použitý pre negatívnu kontrolu (vynechaná inkubácia s primárnou protilátkou).
Reťazce α1, α2, α3, α4, α5 a α6 kolagénu IV boli detekované metódou nepriamej fluorescenčnej imunohistochémie. Rezy boli fixované 10 minút v chladenom acetóne a opláchnuté vo fosfátovom pufre (phosphate buffered saline, PBS, pH = 7,4). Následne boli rezy inkubované jednu hodinu s primárnou protilátkou riedenou v PBS s 1% bovínnym sérom albumínom pri izbovej teplote. Boli použité myšie a potkanie monoklonálne protilátky v nasledujúcich koncentráciách: anti-kolagén IV α1 (1 : 50), anti-kolagén IV α3 (1 : 50), anti-kolagén IV α5 (1 : 50), (Wielisa, Wieslab, Švédsko), anti-kolagén IV α2 (1 : 300), (Chemicon International Inc., Temecula, USA), anti-kolagén IV α4 (1 : 25) a anti-kolagén IV α6 (1 : 50), (poskytnuté doktorom Sadom, Japonsko). Po opláchnutí (3 5 minút v PBS) boli rezy inkubované 1 hodinu s anti-myšacou (1 : 500) alebo anti-potkaňou (1 : 100) IgG sekundárnou protilátkou konjugovanou s FITC (fluorescein isothiocyanate), (Jackson ImmunoResearch Laboratories, West Grove, USA). Pre zhotovenie preparátov bolo použité montovacie médium Vectashield s propidium iodidom pre vizualizáciu bunkových jadier (Vector Laboratories, Inc. Burlingame, USA). Všetky experimenty boli prevedené dvakrát.
Rezy boli pozorované pod fluorescenčným mikroskopom Olympus BX 51 pri zväčšení 100–400-krát. Pre fotografickú dokumentáciu sme použili Vosskühler VDS CCD – 1300 kameru (VDS Vosskühler GmbH, Nemecko) a pre hodnotenie vzorkov program LUCIA 4.8 (Laboratory Imaging, ČR). Intenzita signálu bola hodnotená jednou osobou pomocou škály: – negativita, + slabá pozitivita, ++ stredná pozitivita, +++ silná pozitivita.
VÝSLEDKY
Intenzita signálu pre jednotlivé reťazce kolagénu IV a ich lokalizácia v kontrolných rohovkách a rohovkách pacientov so ZPD je zobrazená v tabuľke 2.
Table 2. Prítomnosť reťazcov Š kolagénu IV v bazálnej membráne epitelu (BME), v strome (S) a v escemetovej membráne (DM) zdravých rohoviek (K) a rohoviek pacientov so ZPD (P) 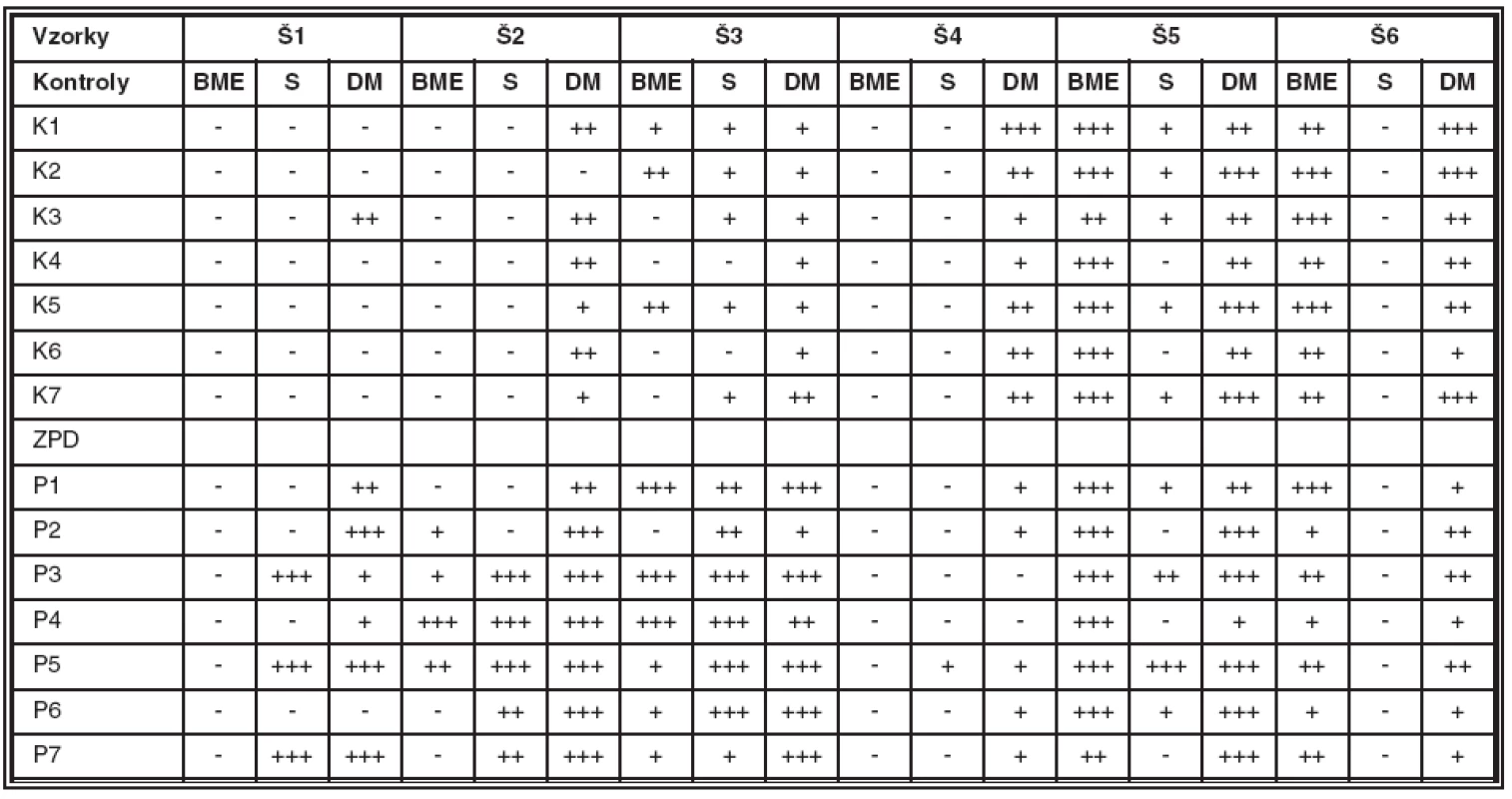
Intenzita signálu: – negativita, + slabá pozitivita, ++ stredná pozitivita, +++ silná pozitivita signálu. Reťazec α1 kolagénu IV nebol detekovaný ani v BME, ani v strome kontrolných rohoviek. Pozitívny signál bol zaznamenaný v BM limbusu a spojovky (dáta neuvedené). V jednom prípade bol reťazec α1 detekovaný na stromálnej strane DM v jednej línii na periférii rohovky (K3).
BME pacientov so ZPD bola negatívna. Stroma troch pacientov bola silno pozitívna predovšetkým v zadnej časti (1/5 – 1/3 stromy). Prechod medzi silno pozitívnou a kompletne negatívnou časťou stromy bol veľmi výrazný. U šiestich pacientov so ZPD bol reťazec α1 slabo až silno pozitívny na endotelovej strane DM v jednej línii na periférii rohovky (P1, P2) alebo prerušovane po celej dĺžke DM (P3, P4). U pacientov P5 a P7 bola táto línia zdvojená (obr. 1A).
Image 1. Výskyt reťazcov α1, α2 a α3 kolagénu IV v rohovkách kontrol a pacientov so ZPD. Popis: Reťazec α1 (A) bol detekovaný len v zadnej strome a na endotelovej strane Descemetovej membrány u pacientov so ZPD. Reťazec α2 (B) bol u pacientov so ZPD prítomný v bazálnej membráne epitelu, v zadnej časti stromy a na endotelovej strane Descemetovej membrány. Výskyt reťazca α3 (C) sa príliš nelíšil medzi kontrolnou a patologickou rohovkou (pozitivita v bazálnej membráne epitelu, na endotelovej strane Descemetovej membrány; u pacienta so ZPD zdvojená línia). Signál pre všetky reťazce α je zelený (FITC – Fluorescein isothiocyanate) a jadrá sú zviditeľnené propidium jodidom (PI). Mierka znázorňuje 10 μm 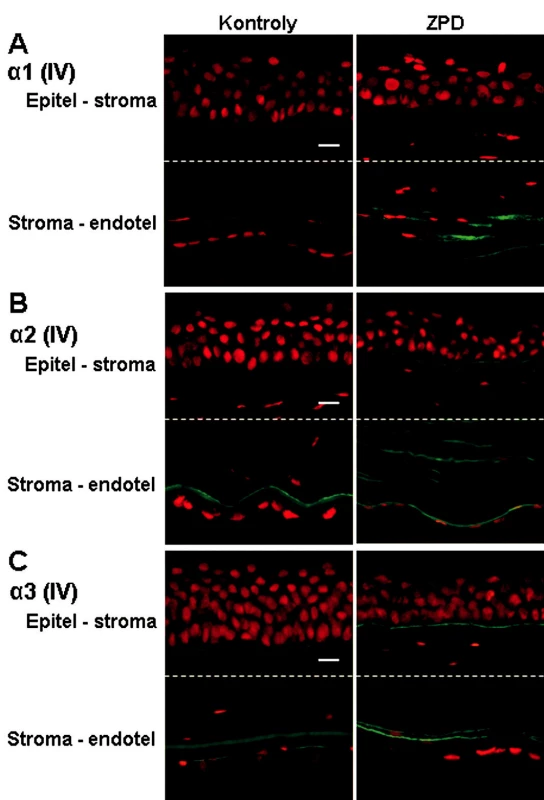
Reťazec α2 kolagénu IV nebol detekovaný v BME ani v strome kontrolných rohoviek. Pozitívny signál pre reťazec α2 sa objavil v BM limbusu a spojovky (dáta neuvedené) a v DM šiestich kontrolných rohoviek, a to vo všetkých prípadoch na stromálnej strane (K1, K3 – K7) a v dvoch prípadoch aj na endotelovej strane DM (K1, K4).
U pacientov so ZPD bola v štyroch rohovkách slabo až silno pozitívna BME. U piatich pacientov bola silno pozitívna zadná (1/10 – 1/3) časť stromy, ktorá bola ostro ohraničená od negatívnej časti stromy. DM všetkých pacientov bola po celej dĺžke pozitívna v jednej línii, u šiestich pacientov na endotelovej strane (P1 – P5, P7), u dvoch pacientov na endotelovej aj stromálnej strane (P3, P5) a u jedného pacienta len na stromálnej strane (P6) (viď obr. 1B).
Reťazec α3 kolagénu IV bol slabo až stredne pozitívny v BME troch kontrolných rohoviek. Táto pozitivita sa strácala smerom k periférii rohovky. Stroma vykazovala slabú difúznu pozitivitu v piatich a DM vo všetkých kontrolných rohovkách, a to na endotelovej strane v jednej línii po celej dĺžke rohovky.
BME bola slabo až silno pozitívna v šiestich rohovkách od pacientov so ZPD. Stroma štyroch pacientov (P2 – P5) bola silno pozitívna len v zadnej časti (1/5 – 1/3). Stroma troch pacientov (P1, P6 a P7) vykazovala slabú až silnú difúznu pozitivitu po celej dĺžke stromy. DM bola slabo až silno pozitívna u šiestich pacientov v jednej línii po celej dĺžke endotelu. U pacienta P3 bola táto línia zdvojená (obr. 1C).
Reťazec α4 kolagénu IV nebol detekovaný v BME ani v strome kontrolných rohoviek. DM všetkých kontrolných rohoviek vykazovala slabú až silnú pozitivitu na endotelovej strane po celej dĺžke rohovky.
Reťazec α4nebol prítomný ani v BME, ani v strome rohoviek získaných od pacientov so ZPD (okrem slabo pozitívnej zadnej 1/3 stromy pacienta P5). Na endotelovej strane DM piatich rohoviek bol detekovaný slabý signál pre reťazec α4. V dvoch rohovkách signál nebol prítomný.
Reťazec α5 kolagénu IV vykazoval silnú pozitivitu v BME a strednú až silnú pozitivitu na endotelovej strane DM kontrol. Stroma piatich kontrolných rohoviek vykazovala slabú difúznu pozitivitu po celej dĺžke stromy.
Stredne až silno pozitívny signál bol prítomný aj v BME a na endotelovej strane DM patologických rohoviek. U pacientov P3 a P5 sa objavilo zdvojenie línie v DM. Stroma pacientov P3 a P5 bola silno pozitívna len v zadnej časti (1/5 – 1/3), stroma pacientov P1 a P6 vykazovala slabú difúznu pozitivitu po celej dĺžke a stroma ostatných pacientov bola negatívna.
Reťazec α6 kolagénu IV bol stredne až silno exprimovaný v BME kontrolných rohoviek. Pozitívna bola aj BM limbusu, spojovka bola negatívna (dáta neuvedené). Stroma všetkých kontrolných rohoviek bola negatívna. DM vykazovala slabú až silnú pozitivitu na endotelovej strane v jednej línii po celej dĺžke rohovky.
BME a DM väčšiny rohoviek pacientov so ZPD boli slabo až stredne pozitívne, stroma bola negatívna.
V bunkách endotelu a epitelu nebol prítomný žiaden z detekovaných reťazcov kolagénu IV.
DISKUSIA
Cieľom tejto štúdie bolo charakterizovať výskyt reťazcov α1 – α6 kolagénu IV v kontrolných rohovkách a rohovkách pacientov so ZPD. Charakterizácia lokalizácie jednotlivých reťazcov kolagénu IV v normálnej rohovke je dôležitá ako pre poznanie štruktúry zdravej rohovky, tak aj pre zistenie prípadných rozdielov v prítomnosti a lokalizácii kolagénov v patologických rohovkách.
Výskyt jednotlivých reťazcov α kolagénu IV v našich kontrolných rohovkách je takmer zhodný so zverejnenými výsledkami lokalizácie kolagénu IV [19, 26]. Na rozdiel od nás detekovali Ljubimov a kol. [19] reťazec α1 na stromálnej strane DM a reťazec α4 v BME a strome. Naopak Tuori a kol. [26] podobne ako my reťazec α4 v BME nedetekovali. Rozličné výsledky môžu byť spôsobené hlavne použitím odlišných protilátok a modifikáciami v prevedení imunohistochemickej metódy.
Za zásadný nález považujeme oproti kontrolám značne zvýšený výskyt reťazca α1 v DM väčšiny rohoviek pacientov so ZPD. Prítomnosť reťazca α1 kolagénu IV bola zaznamenaná aj v zadnej strome troch pacientov so ZPD. Reťazec α2 sme oproti negatívnej strome všetkých kontrolných rohoviek detekovali v strome väčšiny rohoviek pacientov so ZPD. Oproti kontrolám sme zaznamenali aj zosilnenie intenzity signálu reťazca α2 aj v DM a BME. Lokalizácia reťazcov α1 a α2 bola na rozdiel od kontrolných rohoviek (pozitivita na stromálnej strane DM) zaznamenaná na endotelovej strane DM, ktorá sa tvorí v dospelosti a môže vypovedať o zmenách vznikajúcich na základe abnormálnej sekrécie patologického endotelu.
Keďže reťazce α1 a α2 sa u kontrol exprimujú predovšetkým v BM limbusu a spojovky, v oblastiach s vysokou proliferačnou činnosťou, domnievame sa, že ich zvýšený výskyt na endotelovej strane DM u pacientov so ZPD môže byť spojený s proliferačnou kapacitou patologického endotelu, v ktorom sa nachádzajú bunky exprimujúce proliferačný marker Ki67 (dáta neuvedené). Navyše promigračné vlastnosti reťazcov α1 a α2 boli už popísané [23]. Bolo preukázané, že zmeny v zložení BM môžu navodiť zmeny v expresii cytokeratínov v bunkách ležiacich na BM [14]. Môžeme si predstaviť, že zmeny v zložení DM vedú k zmenám fenotypu endotelových buniek (epitelizácii endotelu), k jeho patologickej sekrécii, a tím spätne k ďalším zmenám v štruktúre DM.
Akumulácia reťazcov α1 a α2 a strata reťazcov α3 a α5 kolagénu IV bola popísaná aj v BME rohoviek pacientov s keratokonusom [5, 11, 26]. K strate reťazcov α3 a α5 ani k akumulácii reťazca α1 u nášho pacienta so ZPD a s keratokonusom (P5) nedošlo. U tohto pacienta sme v BME detekovali reťazec α2, ten sa ale vyskytoval aj v BME troch ďalších pacientov so ZPD (P2 – P4) bez prítomnosti keratokonusu. Z toho dôvodu akumuláciu reťazca α2 v BME nemôžeme jednoznačne dávať do súvislosti s prítomnosťou keratokonusu. To, či dochádza k akumulácii reťazca α2 v BME niektorých pacientov so ZPD v dôsledku ZPD, je treba overiť na väčšom súbore kontrolných aj patologických rohoviek.
Vyššiu intenzitu signálu pre reťazec α3 kolagénu IV v rohovkách získaných od pacientov so ZPD sme oproti kontrolám detekovali na úrovni BME, stromy a DM. Výskyt reťazca α3 v endoteli rohovky jedného pacienta so ZPD v dôsledku mutácie génu TCF8 bol popísaný Krafchakom [12]. V našich experimentoch sme prítomnosť žiadneho zo sledovaných reťazcov kolagénu IV v endoteli pacientov nepreukázali, aj napriek tomu, že mutácia v ZEB1 géne bola preukázaná u jedného nášho pacienta (P3), [18]. Zaujímavé je, že aj pacienti bez detekovanej mutácie v tomto géne vykazujú podobné zmeny v zastúpení a lokalizácii jednotlivých reťazcov kolagénu IV.
Táto štúdia charakterizuje výskyt jednotlivých reťazcov kolagénu IV v rohovkách pacientov so ZPD. U ZPD dochádza k akumulácii reťazcov α1 a α2 predovšetkým v DM a rohovkovej strome. Zmeny v zložení a lokalizácii reťazcov kolagénu IV spolu s intracelulárnymi zmenami patologického endotelu môžu byť podkladom morfologických zmien aj proliferačnej kapacity, ku ktorým dochádza (zatiaľ bez preukázateľnej korelácie ku zmenám na molekulárne-genetickej úrovni) v rohovkách pacientov so ZPD.
ZÁVER
Reťazce kolagénu IV v zdravej rohovke vykazujú značnú heterogenitu v lokalizácii v jednotlivých vrstvách rohovky.
Z našich výsledkov vyplýva, že u pacientov so ZPD dochádza k zmenám v zastúpení a lokalizácii jednotlivých reťazcov kolagénu IV na úrovni DM, stromy ale aj BME. K akumulácii dochádza u reťazca α1 v DM a strome a u reťazca α2 v DM, strome aj BME. Mechanizmus vzniku týchto zmien, ktoré môžu podporovať proliferačnú kapacitu a morfologické zmeny patologického endotelu na molekulárne genetickej príčine zatiaľ nebol zistený.
Poďakovanie
Táto práca bola podporovaná z výskumného zámeru Ministerstva školstva, mládeže a tělovýchovy MSM 0021620806/20610011.Autori ďakujú Dr. Sadovi za poskytnutie protilátok proti reťazcom α4 a α6 kolagénu IV, MUDr. Viere Veselej a Šárke Kalašovej za pomoc pri technickej príprave experimentov.
Mgr. Stanislava Merjavá
Laboratoř biologie a patologie oka,
Institut dědičných metabolických chorob
VFN a 1. LF Univerzity Karlovy
U Nemocnice 2
128 08 Praha
merjava@centrum.cz
Sources
1. Biswas, S., Munier, F.L., Yardley, J., et al: Missense mutations in COL8A2, the gene encoding the α2 chain of type VIII collagen, cause two forms of corneal endothelial dystrophy. Hum. Mol. Genetics, 21, 2001 : 2415–2423.
2. Boruchoff, S.A., Kuwabara, T.: Electron microscopy of Posterior polymorphous degeneration. Am. J. Ophthalmol., 72, 1971 : 879–887.
3. Cibis, G.W., Krachmer, J.H., Phelps, C.D., et al.: Iridocorneal adhesion in Posterior polymorphous corneal dystrophy. Trans. Am. Acad. Ophthalmol. Otolaryngol., 81, 1976 : 770–777.
4. Cibis, G.W., Krachmer, J.H., Phelps, C.D., et al.: The clinical spectrum of Posterior polymorphous dystrophy. Arch. Ophthalmol., 95, 1977 : 1529–1537.
5. Deng, Y., Liu, S., Cai, R.: Immunohistochemistry research on keratoconus. Yan Ke Xue Bao, 17, 2001 : 65–67, 75.
6. Gwilliam. R., Liskova. P., Filipec. M., et al.: Micro heterogenity in Czech families with Posterior polymorphous corneal dystrophy mapping to chromosome 20p11.2 and the exclusion of the candidate gene VSX1. Invest. Ophthalmol. Vis. Sci., 46, 2005 : 4480–4484.
7. Hogan, M.J., Bietti, G.: Hereditary deep dystrophy of the cornea (Polymorphous). Am. J. Ophthalmol., 68, 1969 : 777–788.
8. Hudson, B.G., Reeders, S.T., Tryggvason, K.: Type IV collagen: structure, gene organization, and role in human diseases. Molecular basis of Goodpasture and Alport Syndromes and diffuse leiomyomatosis. J. Biol. Chem., 268, 1993 : 26033–26036.
9. Jirsova, K., Merjava, S., Martincova, R., et al.: Immunohistochemical characterization of cytokeratins in the abnormal corneal endothelium of posterior polymorphous corneal dystrophy patients. Exp. Eye Res., 84, 2007 : 680–686.
10. Kefalides, N.A.: Structure and biosynthesis of basement membranes. Int. Rev. Connect. Tissue Res., 6, 1973 : 63–104.
11. Kenney, M.C., Nesburn, A.B., Burgeson, R.E., et al: Abnormalities of the extracellular matrix in keratoconus corneas. Cornea, 16, 1997 : 345–351.
12. Krafchak, C.M., Pawar, H., Moroi, S.E., et al.: Mutations in TCF8 cause posterior polymorphous corneal dystrophy and ectopic expression of COL4A3 by corneal endothelial cells. Am. J. Hum. Genet., 77, 2005 : 694–708.
13. Krachmer, J.H.: Posterior polymorphous corneal dystrophy: A disease characterized by epithelial-like endothelial cells which influence management and prognosis. Trans. Am. Ophthalmol. Soc., 83, 1985 : 413–475.
14. Kurpakus, M.A., Stock, E.L., Jones, J.C.: The role of the basement membrane in differential expression of keratin proteins in epithelial cells. Dev. Biol., 150, 1992 : 243–255.
15. Leinonen, A., Mariyama, M., Mochizuki, T., et al: Complete primary structure of the human type IV collagen alpha4(IV) chain. J. Biol. Chem., 269, 1994 : 26172–26177.
16. Lemmink, H.H., Schroder, C.H., Monnens, L.A.H., et al.: The clinical spectrum of type IV collagen mutations. Hum. Mutat., 9, 1997 : 477–499.
17. Levy, S.G., McCartney, A. C. E., Sawada, H., et al.: Descemet’s membrane in the Iridocorneal-endothelial syndrome: morphology and composition. Exp. Eye Res., 61, 1995 : 323–333.
18. Liskova, P., Tuft, S.J., Gwilliam, R., et al.: Novel mutations in the ZEB1 gene identified in Czech and British patients with posterior polymorphous corneal dystrophy. Hum. Mutat., 28, 2007 : 638.
19. Ljubimov, A.V., Burgeson, R.E., Butkowski, R.J., et al.: Human corneal basement membrane heterogeneity: topographical differences in the expression of type IV collagen and laminin isoforms. Lab. Invest., 72, 1995 : 461–473.
20. Marshall, G.E., Konstas, A.G., Lee, W.R.: Immunogold fine structural localization of extracellular matrix components in aged human cornea. Graefe’s Arch. Clin. Exp. Ophthalmol., 229, 1991 : 157–163.
21. Michelacci, Y.M.: Collagens and proteoglycans of the corneal extracellular matrix. Braz. J. Med. Biol. Res., 36, 2003 : 1037–1046.
22. Nishida, T.: Cornea. In: Krachmer, J.H., Mannis, M.J., Holland, E.J. (eds.): Cornea (2nd edition). Elsevier MOSBY Inc., 2005, 3–26.
23. Ortega, N., Werb, Z.: New functional roles for non-collegenous domains of basement membrane collagens. J. Cell Sci., 22, 2002 : 4201–4214.
24. Prockop, D.J., Kivirikko, K.I.: Collagens: molecular biology, diseases, and potentials for therapy. Annu. Rev. Biochem., 64, 1995 : 403–434.
25. Rodrigues, M.M., Sun, T.T., Krachmer, J.H., et al.: Epithelization of the corneal endothelium in Posterior polymorphous dystrophy. Invest. Ophthalmol. Vis. Sci., 19, 1980 : 832–835.
26. Tuori, A.J., Virtanen, I., Aine, E., et al.: The immunohistochemical composition of corneal basement membrane in keratoconus. Curr. Eye Res., 16, 1997 : 792–801.
27. Waring, G.O.: Posterior collagenous layer of the cornea: ultrastructural classification of abnormal collagenous tissue posterior to Descemetęs membrane in 30 cases. Arch. Ophthalmol., 100, 1982 : 122–134.
Labels
Ophthalmology
Article was published inCzech and Slovak Ophthalmology

2008 Issue 3-
All articles in this issue
- Pooperační výsledky expandibilní nitrooční čočky ACQUA (Mediphacos)
- Oboustranná simultánní dakryocystorinostomie a konjunktivocystorinostomie
- První zkušenosti s aplikací zlatých víčkových implantátů při obrně lícního nervu
- Chirurgie Duanova retrakčního syndromu I:Srovnání jednostranné retropozice a resekce s oboustrannou retropozicí mediálních přímých svalů
- D-test: nová alternativa Bagoliniho testu pro mladší děti
- Poruchy hemokoagulační kaskády u retinálních venózních okluzí
- Vaskulitída sietnicových ciev pri pľúcnej tuberkulóze – kazuistika
- Imunohistochemická charakterizácia kolagénu IV v zdravých rohovkách a rohovkách pacientov so zadnou polymorfnou dystrofiou
- Czech and Slovak Ophthalmology
- Journal archive
- Current issue
- Online only
- About the journal
Most read in this issue- Oboustranná simultánní dakryocystorinostomie a konjunktivocystorinostomie
- D-test: nová alternativa Bagoliniho testu pro mladší děti
- Chirurgie Duanova retrakčního syndromu I:Srovnání jednostranné retropozice a resekce s oboustrannou retropozicí mediálních přímých svalů
- První zkušenosti s aplikací zlatých víčkových implantátů při obrně lícního nervu
Login#ADS_BOTTOM_SCRIPTS#Forgotten passwordEnter the email address that you registered with. We will send you instructions on how to set a new password.
- Career

