-
Medical journals
- Career
Artériovenózna dekompresia pri parciálnej oklúzii centrálnej vény sietnice so zlúpnutím vnútornej membrány sietnice pre edém makuly
Authors: V. Krásnik; P. Strmeň; J. Štefaničková; P. Krajčová
Authors‘ workplace: Klinika oftalmológie LF UK, Bratislava, prednosta prof. MUDr. Peter Strmeň, CSc.
Published in: Čes. a slov. Oftal., 64, 2008, No. 2, p. 57-61
Overview
Cieľ práce:
V retrospektívnej štúdii analyzovať anatomické a funkčné výsledky mikrochirurgickej liečby parciálnej oklúzie centrálnej vény sietnice s artériovenóznou dekompresiou a so zlúpnutím vnútornej hraničnej membrány sietnice pre edém makuly.Materiál a metodika:
Súbor tvorí 11 pacientov (11 očí), 5 mužov a 6 žien vo veku od 34 do 74 rokov, v priemere 59,18 roka. Pacienti boli operovaní na Oftalmologickej klinike FNsP a LFUK v Bratislave od 1. 6. 2000 do 31. 5. 2006. Doba pozorovania k 31. 5. 2007 je 14 až 72 mesiacov, v priemere 28,5 mesiaca. Po absolvovaní fluoresceínovej angiografii boli pacienti indikovaní k artériovenónej dekompresii so zlúpnutím vnútornej hraničnej membrány sietnice pre edém makuly. Pacienti s rubeózou dúhovky neboli zaradení do súboru a vstupná centrálna zraková ostrosť s korekciou bola 0,3 a menej. Kompletné oftalmologické vyšetrenie pozostávajúce z vyšetrenia centrálnej zrakovej ostrosti s korekciou, vnútroočného tlaku aplanačne, vyšetrenie predného segmentu štrbinovou lampou, očného pozadia Volkovými šošovkami +60 a +90 dioptrií a fluoresceínová angiografia, boli realizované pred operáciou, v prvom roku po operácii v 3–4-mesačných a neskôr v 6–9-mesačných intervaloch. Anatomické výsledky boli hodnotené na základe fluoresceínovej angiografie 3 mesiace po operácii. Za zlepšenie anatomického stavu sa považovalo, ak došlo k zlepšeniu prietoku periférne od artériovenóznej dekompresie, zmenšeniu dilatácie ciev, hyperfluorescencie a rozsahu edému makuly. Pri hodnotení funkčných výsledkov sa porovnávali zmeny centrálnej zrakovej ostrosti s korekciou pred operáciou a v pravidelných intervaloch po operácii.Výsledky:
Zlepšenie anatomického stavu bolo u 8 (72,73 %) pacientov, u dvoch sa nález stabilizoval, bol bez zmeny, a u jedného pacienta bolo pozorované rozšírenie neperfúznej zóny.
Pred operáciou bola priemerná centrálna zraková ostrosť s korekciou 0,16 (± 0,1070), v 3. mesiaci 0,2909 (± 0,2264) a pri poslednej kontrole 0,3818 (± 0,3178). Štatisticky Studentovým T-testom bol potvrdený významný rozdiel v porovnaní pred operáciou a v 3. mesiaci po operácii (p = 0,0271) a pri poslednej kontrole (p = 0,0137). Pri poslednej kontrole centrálna zraková ostrosť s korekciou zlepšená o +2 a viac riadkov bola u 6 (54,54 %) pacientov, nezmenená (± 1 riadok) u 4 (36,36 %) a zhoršená o -2 a viac riadkov u jedného (9,09 %) pacienta.Záver:
Mikrochirurgická liečba parciálnej oklúzie centrálnej žily sietnice rozširuje liečebné postupy u tohto závažného ochorenia. Pri parciálnej oklúzii indikovanej k artériovenóznej dekompresii sa výrazne pozitívne ovplyvňuje anatomický a funkčný výsledok.Kľúčové slová:
parciálna oklúzia centrálnej vény sietnice, artériovenózna dekompresia, zlúpnutie vnútornej hraničnej membrány sietniceÚvod
Žilové oklúzie ciev sietnice sú druhým najčastejším postihnutím ciev sietnice po diabetickej retinopatii [1]. Prevalencia parciálnej oklúzie centrálnej vény sietnice (branch retinal vein occlusion, BRVO) je 0,6 % v USA a Austrálii a stúpa s vekom [12,14]. Podľa Branch vein occlusion study group sa prevalencia pohybuje od 0,7 po 1,6 % [2]. Najčastejšie sú postihnuté osoby v 5. až 7. dekáde života, bez viazanosti na pohlavie a rasu [18,21]. Heier a Morley [11] v 4-ročnom pozorovaní uvádzajú výskyt 5,36 ochorení na 1000 pacientov starších ako 64 rokov. BRVO sa typicky objavuje na artériovenóznom (AV) krížení [5, 22, 23] a to v 98 % temporálne od terča zrakového nervu a v 68 % superotemporálne. Inferotemporálne postihnutie je najmenej zastúpené zo všetkých prípadov BRVO. Oklúzia sa zriedkavo objavuje na malých cievach, ktoré drénujú oblasť makulárnej krajiny, kde sa vyskytuje v 17 % z celkového počtu BRVO [10]. Nízky výskyt BRVO (1–9 %) nazálne od terča zrakového nervu je pravdepodobne závislý od veľmi zriedkavých a nevýrazných klinických symptómov a výskyt ochorenia je v týchto kvadrantoch pravdepodobne častejší ako je v skutočnosti dokumentovaných. Na druhom oku sa oklúzia centrálnej vény sietnice vyskytuje v 5–10 % [1,6].
AV kríženie, kde arteriola leží nad venulou je rizikovým faktorom pre vznik BRVO [19,24]. Anatomicky v bode AV kríženia adventícia arterioly a glia venuly sú zlúčené do spoločného obalu (sheat, pošvy). Obe cievy od seba oddeľujú iba endotelové bunky s bazálnou membránou. Kompresia venuly arteriolou v tomto bode sa môže uplatniť pri hypertenzii a ateroskleróze. Tento mechanizmus sa neuplatní v prípade, ak arteriola leží pod venulou. Elasticita venuly a jej pružnosť zabezpečia posunutie venuly smerom k sklovcovej dutine. V opačnej pozícii, keď je venula bližšie k sietnici a arteriola leží nad ňou, môže byť venula tlačená smerom k bunkám sietnice, čo vedie k zúženiu priemeru venuly. Následkom toho vznikajú hemodynamické zmeny, turbulencia krvného toku venulou a vývoj trombu s oklúziou cievy.
Staurenghi a spol. [19] u BRVO popísali stav, kde arteriola ležala nad venulou v 88 %, oproti 60 % u kontrolného súboru. Tento rozdiel bol signifikantne významný. Podobné pozorovania popísali aj Weinberg a spol. [23], kde arteriolu nad venulou u BRVO pozorovali v 97,6 %, v 2,4 % bol anatomický pomer opačný. Autori získané údaje porovnali, jednak s druhým okom pacienta a jednak s kontrolným súborom. Na druhých očiach bolo AV kríženie, kde arteriola ležala nad venulou, prítomné v 70,6 % a pri kontrolnom súbore to bolo v 67,0 %. Autori zistili štatisticky významný rozdiel medzi skupinou očí s BRVO jednak v porovnaní s druhým okom a aj s kontrolnou skupinou očí.
Materiál a metodika
Na I. oftalmologickej klinike FN a LF UK v Bratislave bolo od júla 2000 do konca roku 2006 operovaných štandardnou 3-vstupovou pars plana vitrektómiou (PPV) pre rôzny typ a/alebo komplikáciu oklúzie centrálnej vény sietnice 34 pacientov (34 očí). Vek pacientov sa pohyboval od 34 do 82 rokov, s priemerom 64,5 roka. Mužov bolo 15 (44,1 %) a žien 19 (55,9 %).
Do retrospektívnej štúdie boli zaradení pacienti s BVRO, ktorí spĺňali nasledovné podmienky:
- dobra trvania ochorenia menej ako 3 mesiace,
- vstupná centrálna zraková ostrosť 0,3 a menej,
- nález edému makuly bez predchádzajúcej laserkoagulačnej liečby,
- neprítomnosť rubeózy dúhovky,
- doba sledovania po primárnej PPV viac ako 12 mesiacov.
Vyššie uvedené a nami požadované podmienky spĺňalo 11 pacientov (11 očí), 5 mužov a 6 žien, vo veku od 34 do 74 rokov, v priemere 59,18 roka (tab. 1). Pacienti boli operovaní od 1. 6. 2000 do 31. 5. 2006. Doba pozorovania k 31. 5. 2007 je od 14 do 72 mesiacov, v priemere 28,5 mesiaca. Pacienti boli operovaní pre BRVO cestou PPV so zlúpnutím vnútornej hraničnej membrány sietnice (membrana limitans interna, MLI) a AV dekompresiou. Zároveň u týchto pacientov išlo o jediný chirurgický liečebný postup. Diagnóza BRVO bola stanovená na základe klinického oftalmologického vyšetrenia, pričom najväčší dôraz sa kládol na vyšetrenie cievnej cirkulácie sietnice fluresceínovou angiografiou (FAG), ktoré ukázalo stop, spomalené plnenie venuly periférne od AV kríženia a edém makuly. Objektívne oftalmologické vyšetrenie ďalej pozostávalo z merania vnútroočného tlaku aplanačne, vyšetrenia predného segmentu oka, šošovky a sklovca biomikroskopiou pomocou štrbinovej lampy. Očné pozadie bolo vyšetrené pomocou Volkových šošoviek + 60 D a + 90 D. Vyšetrenia boli realizované pred operáciou, v 1. roku po operácii v 3–4-mesačných intervaloch, neskôr v 6–9-mesačných. Funkčné výsledky boli hodnotené zmenou najlepšej centrálnej zrakovej ostrosti (CZO) po korekcii na Snellenových optotypoch pred operáciou a ďalej pri každej kontrole, ktorej sa pacient zúčastnil. Anatomické výsledky operácie boli hodnotené k 3. mesiacu po operácii:
- časové zmeny prietoku cez venózny odvodný systém periférne od miesta AV dekompresie,
- zmeny náplne ciev, ich dilatácia, presakovanie z ciev, novozistená neovaskularizácia, vývoj kolaterál,
- veľkosť a zmeny edému makuly.
Table 1. Použitie zriedeného expanzného plynu pri primárnej PPV. (SF6 hexafluorosulfát, C3F8 perfluoropropán) 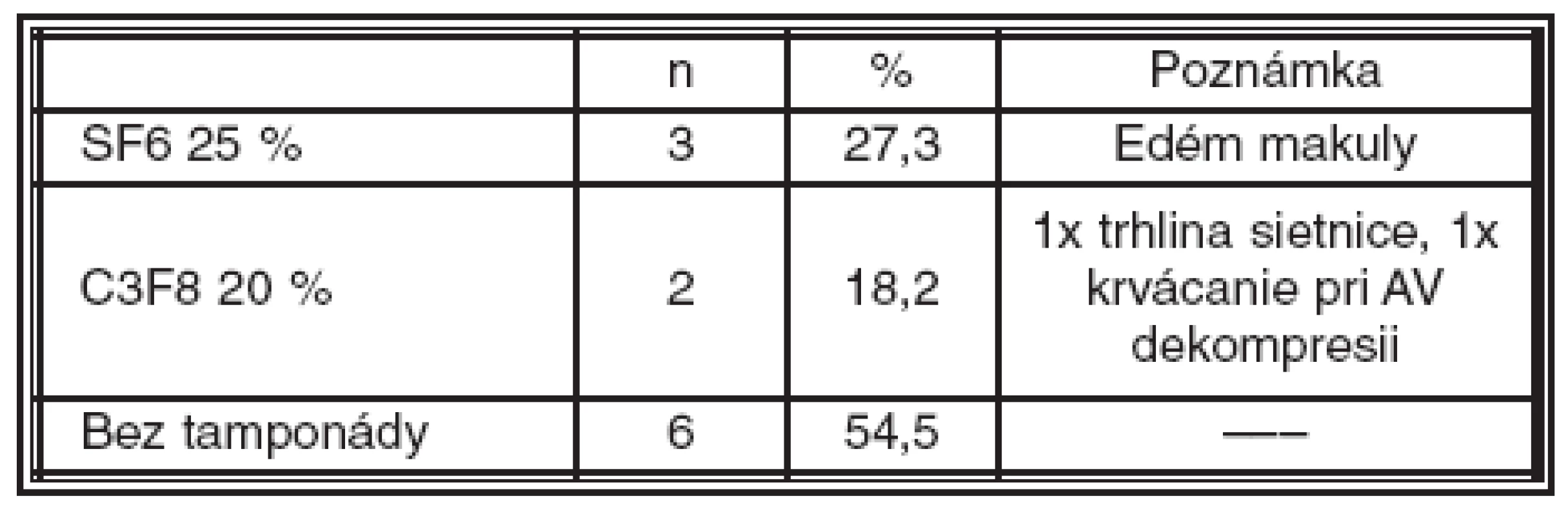
Za pozitívne bolo považované, ak aspoň 2 z uvedených zmien boli výrazne pozitívne, alebo jedna výrazne a 2 čiastočne. Za nepriaznivý výsledok boli považované zmeny, ktoré nespĺňali uvedené podmienky.
Jeden pacient bol v minulosti operovaný pre sivý zákal s implantovanou umelou vnútroočnou šošovkou, t.j. 9,09 %.
Epimakulárna membrána sa peroperačne odstránila u jedného oka (9,09 %). U všetkých očí bola odstránená MLI po predchádzajúcom ofarbení trypánovou modrou.
Drobné krvácania, ktoré vznikli pri odstraňovaní epimakulárnej membrány a/alebo pri zlúpnutí MLI nebolo nutné aktívne ošetriť. Rozsiahlejšie krvácanie nastalo počas mikrošpachtlou realizovanej AV dekompresii, kde krvácanie bolo stabilizované tlakom Charlesovej kanyly.
Peroperačne počas PPV pri revízii periférie sietnice a kryopexii bola odhalená jedna (9,09 %) trhlina sietnice pod sklerotómiou, ktorá bola ošetrená kryopexiou ihneď počas PPV.
Pri primárnej PPV bola tamponáda sietnice zriedeným expanzným plynom použitá spolu v 5 (45,5 %) prípadoch, z toho 30 % SF6 3-krát a 20 % C3F8 2-krát. Bez tamponády bolo ponechaných spolu 6 (54,5 %) očí. Tamponáda plynom sa použila v týchto prípadoch: 1-krát pre trhlinu sietnice na periférii pri jej revízii, 1-krát pre krvácania vzniknuté pri AV dekompresii a 3-krát pre edém makuly (tab. 1).
Reoperácia bola realizovaná u jedného pacienta 6 mesiacov po primárnej PPV pre proliferatívnu vitreoretinopatiu. Reoperáciou sa odstránili zbytky sklovca okolo bázy a trakčné pruhy, sietnica bola tampónovaná 20 % C3F8.
Z celého súboru, podľa interného predoperačného vyšetrenia, malo hypertonickú chorobu alebo hypertonickú chorobu kombinovanú s iným celkovým ochorením 8 pacientov (72,72 %) v čase operácie. Je pozoruhodné, že jeden pacient až rok po operácii mal diagnostikovanú hypertonickú chorobu a zároveň mu bola nasadená antihypertenzná liečba, takto sa celkový počet pacientov s hypertonickou chorobou zvýšil na 9 (81,81 %) (tab. 2).
Table 2. Charakteristika súboru a interný nález. (DM – diabetes mellitus, ICHS – ischemická choroba srdca, IM – infarkt myokardu) 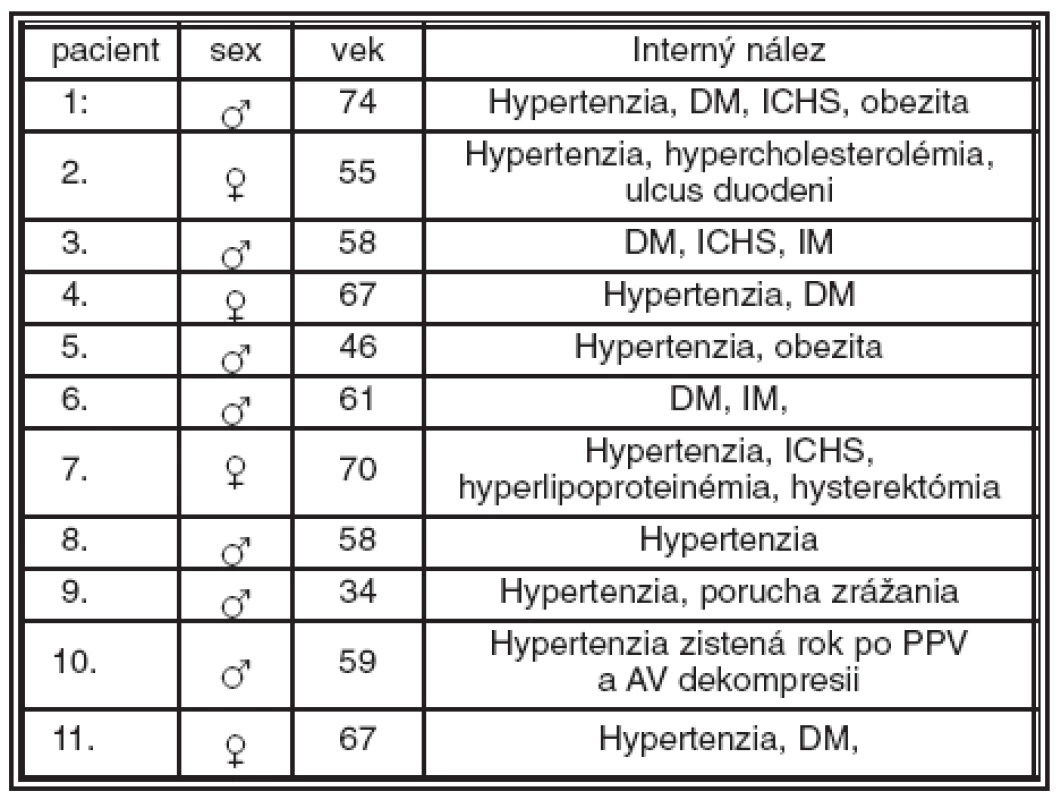
Výsledky
Anatomické výsledky operácie boli hodnotené k 3. mesiacu po operácii. Zlepšený anatomický stav bol u 8 pacientov (72,73 %), dvaja boli bez zmeny (18,18 %) a jeden pacient mal zhoršený anatomický nález (9,09 %). Išlo o pacienta s krvácaním vzniknutým peroperačne počas AV dekompresie (tab. 3). Opakované FAG vyšetrenia pacientov, ktoré boli realizované po 3. mesiaci, už nepreukázali ďalšie pozitívne alebo nepriaznivé zmeny. Takisto u pacienta, ktorý bol po reoperácii PPV s vnútornou tamponádou sietnice zriedeným expanzným plynom pre proliferatívnu vitreoretinopatiu sa nález na FAG nemenil.
Table 3. Anatomické výsledky hodnotené podľa fluoresceínovej angiografie k 3. mesiacu 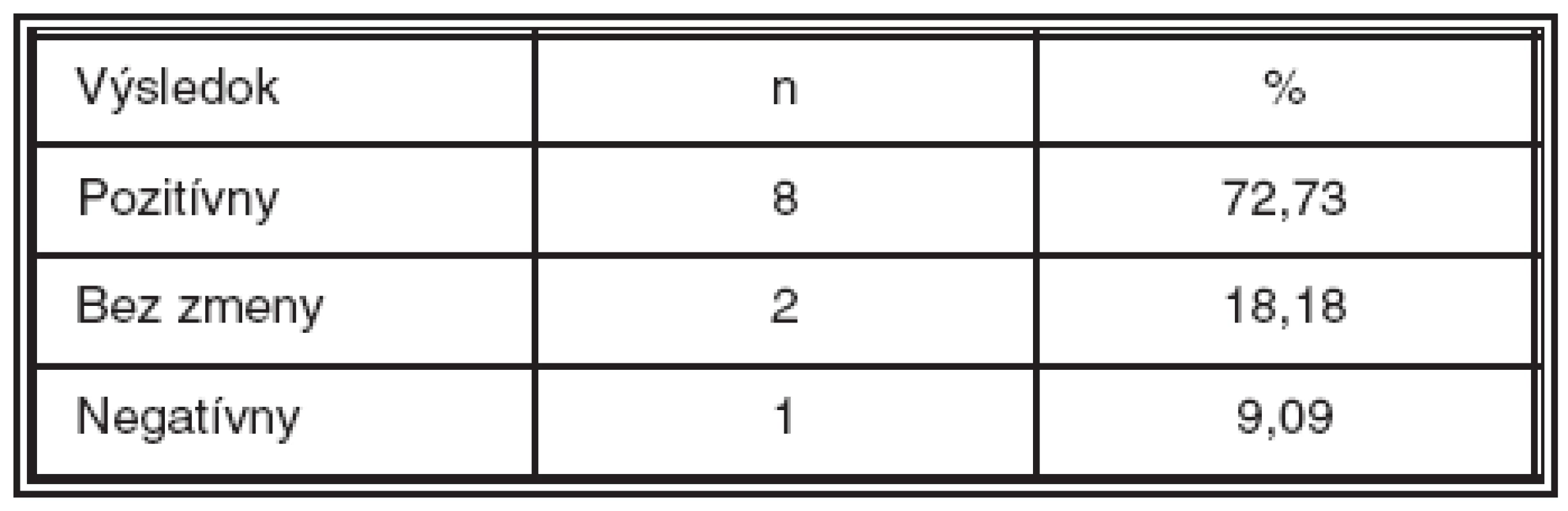
Priemerná CZO s korekciou pred operáciou bola 0,16 (± 0,1070). Táto hodnota v 3. mesiaci po operácii výrazne stúpla na 0,29 (± 0,2264), čo dokumentuje aj fakt, že tento vývoj je podľa T-testu štatisticky významný (p = 0,0271). V 12. mesiaci to bolo 0,34 (± 0,2700; p = 0,0141) a pri poslednej kontrole 0,38 (± 0,3178; p = 0,0137) (tab. 4, graf. 1).
Table 4. Vývoj centrálnej zrakovej ostrosti 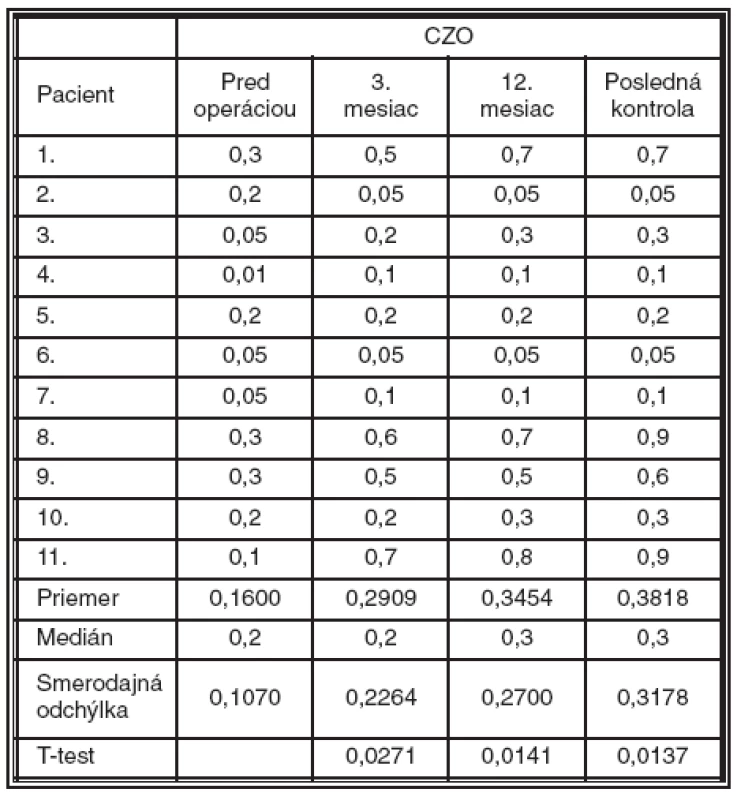
Graph 1. Porovnanie centrálnej zrakovej ostrosti pred operáciou a pri poslednej kontrole 
CZO zlepšená o +2 a viac riadkov bola v 3. mesiaci u 6 pacientov, nezmenená (stabilizovaná, ± 1 riadok) u 4 pacientov a zhoršená o -2 a viac riadkov u jedného pacienta. Takéto rozloženie funkčnej úspešnosti pretrvávalo počas celej doby pozorovania až do poslednej kontroly (tab. 5). Štyria (36,36 %) pacienti mali ku koncu pozorovania CZO lepšiu ako 0,5 a 2 (18,18 %) pacienti dosiahli CZO 0,9. Pokles CZO bol zaznamenaný u pacienta, u ktorého nastalo počas AV dekompresie krvácanie.
Table 5. Zlepšenie, stabilizácia a zhoršenie centrálnej zrakovej ostrosti 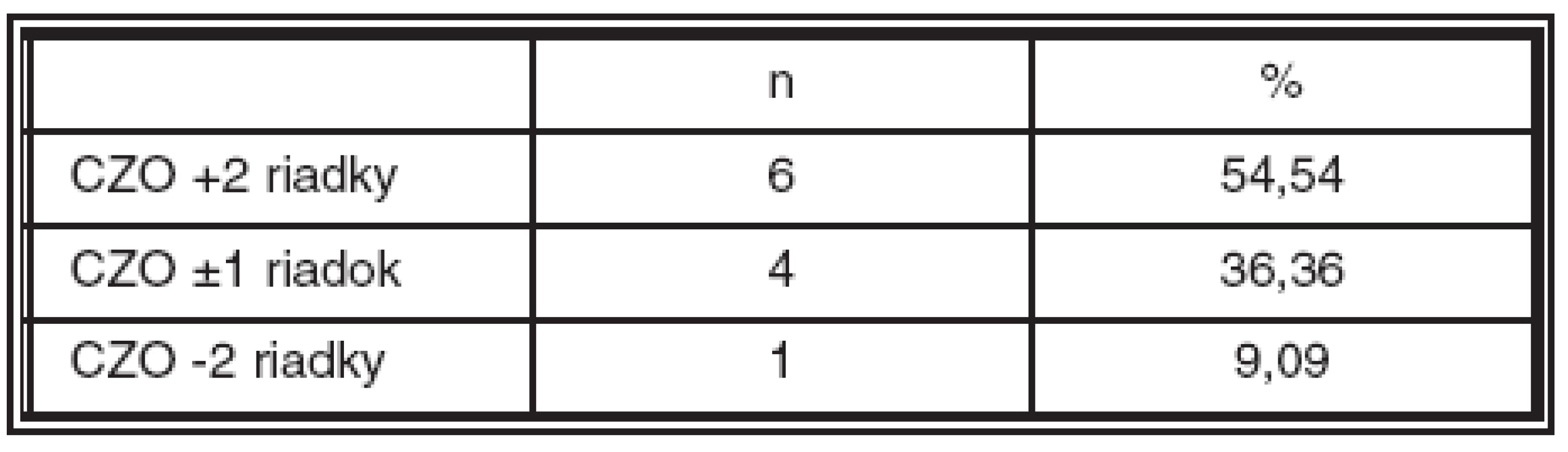
Diskusia
Osterloh a Charles [16] už v roku 1988 referovali o jednom pacientovi, u ktorého realizovali AV dekompresiu pri BRVO, pričom CZO sa zlepšila z 20/200 na 20/25 osem mesiacov po operácii. Dokumentovali vstrebanie intraretinálnych krvácaní a edému makuly.
Opremcak a Bruce [15] v roku 1999 v časopise Retina uverejnili svoju prospektívnu štúdiu o výsledkoch AV dekompresie pri BRVO u 15 pacientov. Vstupná CZO bola u pacientov horšia ako 20/70 na Snellenových optotypoch. Ischémiu makuly s BRVO malo 46 % pacientov. Pacienti po mriežkovej laserkoagulácii makuly neboli zaradení do súboru. Priemerný vek bol 69 rokov (od 47 do 84 rokov), hypertenznú chorobu malo 13 (86,0 %) pacientov. Doba trvania zrakových funkčných ťažkostí u pacientov bola od 1 do 12 mesiacov, s priemerom 3,3 mesiaca. Peroperačne u dvoch pacientov bolo pozorované krvácanie počas AV dekompresie, ktoré bolo priamo ošetrené intraokulárnou diatermiou. Pooperačná výsledná CZO bola nezmenená alebo zlepšená u 12 pacientov (80 %), u 10 pacientov (67 %) sa v priemere zlepšila o 4 riadky (od 1 do 9). U troch pacientov bola výsledná CZO zhoršená v priemere o 2 riadky.
Dotřelová a spol. [4] referovali o 3 pacientoch s BRVO a edémom makuly, u ktorých publikovali anatomické a funkčné výsledky. U dvoch pacientov sa CZO zlepšila a u jedného stabilizovala. Autori záverom doporučujú indikovať AV dekompresiu u pacientov s BRVO, edémom makuly a súčasne výrazným znížením zrakových funkcií. U týchto pacientov je nutné pred operáciou detailne zhodnotiť biomikroskopický a FAG nález.
Yamaji a spol. [25] podľa nami dostupnej literatúry, doteraz ako jediní pomocou videoangiografie kvantitatívne hodnotili zmeny cirkulačných časov distálne od AV postihnutého kríženia pred a po AV dekompresii pre BRVO, ktoré porovnávali s cirkulačnými časmi na nepostihnutej venule v rovnakej vzdialenosti od terča zrakového nervu. Z 18 pacientov (18 očí) u 11 zaznamenali zlepšenie cirkulácie o 20 % a viac, pričom u 5 očí sa pooperačné cirkulačné časy priblížili k časovým hodnotám nameraných na nepostihnutej venule.
Kube a spol. [13] u skupiny 22 pacientov (22 očí) hodnotili artériovenózny cirkulačný čas v postihnutej a kontrolnej vetve pred a po AV dekompresie. Rozdiel cirkulácie pred operáciou bol signifikantne znížený v postihnutej vetve oproti kontrole. Uvedený rozdiel sa pri kontrolách 6 týždňov, 3 a 6 mesiacov signifikantne znižoval.
Garcia-Arumi a spol. [8] u 40 očí s BRVO po AV dekompresii a tamponáde vzduchom injikovali 25 mg tkanivového plazmínového aktivátoru nad oblasť postihnutej venuly. U 11 očí peroperačne uvoľnili trombus, pričom u tejto skupiny pacientov zaznamenali lepšiu výslednú CZO ako u skupiny očí bez uvoľnenia trombu.
Otázka zlúpnutia MLI pri edéme makuly nielen u BRVO, ale aj pri iných klinických entitách (edém makuly pri diabetickej retinopatii, Irwine – Gass syndróm, vitreomakulárny trakčný syndróm a ďalšie) zostáva stále otvorená. V literatúre viac autorov [3,7,9,17,20] podrobne rozdiskutovali problematiku zlúpnutia MLI pri diabetickom edéme makuly. Ich závery možno stručne zhrnúť do nasledovných faktov:
Prečo zlúpnuť MLI?
- dôjde k mobilizácii sietnice s uvoľnením tangenciálnej trakcie,
- uľahčí sa vstrebávanie tekutiny zo sietnice,
- zhrubnutá MLI tvorí bariéru pre difúziu cytokínov,
- zabraňuje formácii epimakulárnej membránky po operácii,
- zvyšuje efekt tamponády.
V čom je riziko zlúpnutia MLI:
- môže dôjsť k mechanickému poškodenie vrstvy nervových vlákien,
- v rôznej miere je prítomné poškodenie Műllerových buniek,
- dochádza k stimulácii glie,
- po zlúpnutí MLI sú lepšie anatomické ako funkčné výsledky.
Na našom pracovisku pri zlupovaní MLI dodržiavame tieto pravidlá:
- nikdy sa zlupovanie nezačína v papilo-makulárnom zväzočku alebo v jeho blízkosti, spravidla sa začína dole temporálne od makuly,
- používame techniku „šúpania jablka“,
- dodržiavame smer zlupovania smerom od periférii do centra, aby vektorové sily ktoré pri zlupovaní pôsobia a ťahajú sietnicu, nenapínali centrálnu časť, čím sa predchádza jej možnému poškodeniu.
Záver
Mikrochirurgická liečba BRVO s edémom makuly rozširuje liečebné postupy u tohto závažného ochorenia. Z našich skúseností a aj z literárnych údajov je to vhodná alternatíva k laserkoagulačnej liečbe. Parciálna oklúzia s edémom makuly indikovaná k artériovenóznej dekompresii so zlúpnutím MLI výrazne pozitívne ovplyvňuje anatomický a funkčný výsledok.
MUDr. Vladimír Krásnik, Ph.D.
Klinika Oftalmológie LFUK
Nemocnica Ružinov
Ružinovská 6
822 06 Bratislava
e-mail: krasnik@ruzinov.fnspba.sk
Sources
1. Branch vein occlusion study group: Argon laser photocoagulation for macular edema in branch retinal vein occlusion. Am. J. Ophthalmol., 98, 1984 : 271–282.
2. Branch vein occlusion study group: Argon laser scatter photocoagulation for prevention of neovascularisation and vitreous haemorrhage in branch vein occlusion. Arch. Ophthalmol., 104, 1986 : 34–41.
3. Dillinger, P., Mester, U.: Vitrectomy with removal of the internal limiting membrane in chronic diabetic macular oedema. Graefeęs Arch. Clin. Exp. Ophthalmol., 242, 2004 : 630–637.
4. Dotřelová, D., Dubská, Z., Kuthan, P. et al.: První zkušenosti s chirurgickou dekompresí žíly u větvové retinální okluze. Čes. a slov. Oftal., 57, 2001 : 359–366.
5. Feist, R.M., Ticho, B.M., Shapiro, M.J., et al.: Branch retinal vein occlusion and quadratic variation in arteriovenous crossing. Am. J. Ophthalmol., 113, 1992 : 664–668.
6. Finkelstein, D., Kumball, A.: Risk factors of branch retinal vein occlusion. Arch. Ophthalmol., 104, 1986 : 795.
7. Fišer, I., Handlová, R., Bedřich, P. et al.: Peeling MLI v léčbě chorob vitreomakulárního rozhraní. 8. Vejdovského olomoucký vědecký den, 24. 3. 2007, Abstrakta: 38–42.
8. Garcia-Arumi, J., Martinez-Castillo, V., Bioxadera, A. et al.: Management of macular edema in branch retinal vein occlusion with sheathotomy and recombinant tissue plasminogen activator. Retina, 24, 2004 : 530–540.
9. Gandorfer, A., Messmer, E.M., Ulbig , M.W. et al.: Resolution of diabetic macular edema after surgical removal of the posterior hyaloid and the inner limiting membrane. Retina, 20, 2000 : 126–133.
10. Joffe, L., Goldberg, R.E., Magargal, L.E. et al.: Macular branch vein occlusion. Ophthalmology, 87, 1980 : 91–98.
11. Heier, J. S., Morley, M.G.: Venous obstructive disease of the retina. Chapter 18, 18.1.–18.8. v: Yanoff, M., Duker, J.S.: Ophthalmology, Mosby, London, 1999, 1616 p.
12. Klein, R., Klein, B.E., Moss, S.E. et al.: The epidemiology of retinal vein occlusion: the Beaver Dam eye study. Trans. Am. Ophthalmol., 98, 2000 : 133–140.
13. Kube, T., Feltgen, N., Pache, M. et al.: Angiographic findings in arteriovenous dissection (sheathotomy) for decompression of branch retinal vein occlusion. Graefeęs Arch. Clin. Exp. Ophthalmol., 243, 2005 : 334–338.
14. Mitchell, P., Smith, W., Chang, A.: Prevalence and associations of retinal vein occlusion in Australia. The Blue Mountains eye study. Arch. Ophthalmol., 114, 1996 : 1243–1247.
15. Opremcak, E.M., Bruce, R.A.: Surgical decompression of branch retinal vein occlusion via arterivenous crossing sheathotomy. Retina, 19, 1999 : 1–5.
16. Osterloh, M.D., Charles, S.: Surgical decompression of branch retinal vein occlusion. Arch. Ophthalmol. 106, 1988 : 1469–1471.
17. Recchia, F.M., Ruby, A.J., Carvalho Recchia C.A.: Pars plana vitrectomy with removal of the internal limiting membrane in the treatment of persistent diabetic macular edema. Am. J. Ophthalmol., 139, 2005 : 447–454.
18. Shah, G.K.: Adventitial sheathotomy for treatment of macular edema associated with branch retinal vein occlusion. Current Opinion in Ophthalmology, 11, 2000 : 171–174.
19. Staurenghi, G., Lonati, Ch., Aschero, M. et al.: Arteriovenous crossing as a risk factor in branch retinal vein occlusion. Am. J. Ophthalmol., 117, 1994 : 211–213.
20. Stolba, U., Binder, S., Gruber, D. et al.: Vitrectomy for persistent diffuse diabetic macular edema. Am. J. Ophthalmol., 140, 2005 : 295–301.
21. The eye disease case-control study group: Risk factor for branch retinal vein occlusion. Am. J. Ophthalmol., 116, 1993 : 286–296.
22. The eye disease case-control study group (II): Arteriovenous crossing patterns in branch retinal vein occlusion. Ophthalmology, 100, 1993 : 423–428.
23. Weinberg, D.: Arteriovenous crossing as a risk factor in branch retinal vein occlusion. Am. J. Ophthalmol. 118, 1994 : 263–265.
24. Weinberg, D., Dodwell, D.G., Fern, S.A.: Anatomy of arteriovenous crossing in branch retinal vein occlusion. Am. J. Ophthalmol., 109, 1990 : 298–302.
25. Yamaji, H., Shiraga, F., Tsuchida, Y. et al.: Evaluation of arteriovenous crossing sheathotomy for branch retinal vein occlusion by fluorescein videoangiography and image analysis. Am. J. Ophthalmol. 137, 2004 : 834–841.
Labels
Ophthalmology
Article was published inCzech and Slovak Ophthalmology

2008 Issue 2-
All articles in this issue
- Využití DNA diagnostiky u pacientů s povrchovou keratitidou virového původu
- Aplikace autologního séra-očních kapek vede ke statisticky významnému zlepšení stavu spojivky pacientů se syndromem suchého oka – pilotní studie
- Artériovenózna dekompresia pri parciálnej oklúzii centrálnej vény sietnice so zlúpnutím vnútornej membrány sietnice pre edém makuly
- Spontánne premakulárne krvácanie
- Léčba recidivujících pterygií
- GDx pred a po LASIK u strednej a vyššej myopie
- Výskyt syndromu suchého oka a rohovkových komplikací u pacientů s revmatoidní artritidou a jeho souvislost s polymorfismem -174 genu pro interleukin 6
- Czech and Slovak Ophthalmology
- Journal archive
- Current issue
- Online only
- About the journal
Most read in this issue- Aplikace autologního séra-očních kapek vede ke statisticky významnému zlepšení stavu spojivky pacientů se syndromem suchého oka – pilotní studie
- Léčba recidivujících pterygií
- Spontánne premakulárne krvácanie
- Využití DNA diagnostiky u pacientů s povrchovou keratitidou virového původu
Login#ADS_BOTTOM_SCRIPTS#Forgotten passwordEnter the email address that you registered with. We will send you instructions on how to set a new password.
- Career

