-
Medical journals
- Career
Současný management pacientů s degenerativní kompresí krční míchy
Authors: Z. Kadaňka Jr.; T. Horák; J. Bednařík
Authors‘ workplace: Neurologická klinika LF MU a FN Brno
Published in: Cesk Slov Neurol N 2019; 82(6): 632-636
Category: Review Article
doi: https://doi.org/10.14735/amcsnn2019632Overview
Degenerativní cervikální myelopatie (DCM) je nejzávažnější komplikací spinální cervikální stenózy (CS) a degenerativní krční míšní komprese. Mícha je však značně rezistentní zejména k pozvolnému, chronickému útlaku. Asymptomatická degenerativní komprese krční míchy (asymptomatic degenerative cervical cord compression; ADCCC), která je charakterizována přítomností prokázané cervikální míšní komprese pomocí zobrazovacích metod, avšak bez klinických známek myelopatie, je tak velmi častá. V případě prokázané těžké či středně těžké formy DCM je jednoznačně preferováno operační řešení. U lehčích forem DCM a u ADCCC však neexistuje jasný, vědecky podložený konsenzus managementu a léčebného algoritmu. V současnosti byla identifikována řada prediktorů vyššího rizika progrese ADCCC do stadia klinicky manifestní DCM a část spondylochirurgických pracovišť považuje časnou chirurgickou dekompresi u těchto rizikových pacientů s ADCCC za indikovanou. K lepšímu pochopení významu těchto prediktorů jsou však potřeba další studie. Navíc existují určité metodologické a etické aspekty, které brání provedení multicentrické randomizované studie u pacientů s ADCCC a lehkou formou DCM.
Klíčová slova:
degenerativní cervikální myelopatie – asymptomatická degenerativní komprese krční míchy – spinální cervikální stenóza
Úvod
Degenerativní cervikální myelopatie (DCM) je nejzávažnější komplikací spinální cervikální stenózy (CS) a degenerativní krční míšní komprese. Je nejčastější příčinou paraparézy dolních končetin u dospělých jedinců nad 50 let a nejčastější příčinou míšního postižení vůbec [1]. Patofyziologie DCM je komplexní, ale klíčovým faktorem jejího vzniku je mechanická komprese krční míchy. Mícha je však značně rezistentní, zejména k pozvolnému, chronickému útlaku. Pacienti s míšní kompresí tak mohou být kompletně asymptomatičtí nebo mohou mít jen projevy lokálních segmentových bolestí či známky kořenové komprese, avšak bez jasných známek myelopatie. U těchto jedinců užíváme termín asymptomatická degenerativní komprese krční míchy (asymptomatic degenerative cervical cord compression; ADCCC) či lépe nemyelopatická degenerativní komprese krční míchy (non-myelopathic degenerative cervical cord compression; NMDCCC), která přesněji vystihuje výskyt radikulární iritace u některých pacientů.
Současná prevalence ADCCC není známa a literární údaje se značně liší. Míšní cervikální komprese byla nalezena u 27 % pacientů, kteří byli náhodně vyšetřeni na MR; u pacientů starších 64 let v 30 % [2]. Naše data prokázala výskyt ADCCC dokonce ještě vyšší, ve vzorku populace nad 40 let dosahovala 50 % [3,4]. Vzhledem k jejímu vysokému výskytu je v současné době důležitou klinickou výzvou vytipování těch pacientů, u kterých můžeme předpokládat rozvoj symptomatické myelopatie. Bohužel i v případě, kdy se je podaří najít, neexistuje žádný jednotný postup, jak by tito rizikoví pacienti měli být léčeni; zda by měla být preferována konzervativní léčba s observací klinického stavu, či zda by měla být provedena odložená operace (při event. rozvoji míšních příznaků), event. zda by měli být profylakticky léčeni již v presymptomatické fázi, abychom se tak vyhnuli budoucím myelopatickým komplikacím.
V této práci podáváme přehled současných doporučení managementu pacientů s různým stupněm degenerativního krčního míšního postižení, od zcela asymptomatických až po pacienty s těžkou formou DCM.
Etiopatogeneze degenerativní míšní komprese
Základním patofyziologickým mechanizmem CS a DCM je věkově vázaná degenerace tkání páteřního kanálu a opakované dynamické zatížení při páteřní hypermobilitě [5]. Strukturální změny zahrnují:
- degeneraci intervertebrálních disků, obratlových těl a facetových kloubů;
- hypertrofii ligamentum flavum;
- osifikaci zadního podélného ligamenta.
Tyto změny zužují páteřní kanál a mohou vést až k míšní kompresi. Ta může nastartovat řadu patologických procesů, které mohou zhoršit neurologický deficit a způsobit nevratné cytologické, biochemické a histologické změny:
- ischemii a změny cévní architektury;
- postižení endoteliálních buněk a porušení hematoencefalické bariéry;
- zánětlivé změny;
- apoptózu neuronů a oligodendrocytů [6].
Klinické projevy degenerativní míšní komprese
Pacienti s míšní kompresí mohou vykazovat celou škálu neurologických příznaků. Někteří mohou být zcela asymptomatičtí, jiní trpí velmi těžkou paretickou a senzitivní symptomatikou a poruchou sfinkterů. Příznakům míšní komprese často předcházejí lokalizované bolesti krční páteře či příznaky komprese míšních kořenů, event. se s nimi kombinují (cervikální radikulomyelopatie) [7]. Vlastní komprese míchy se v iniciálním stadiu manifestuje nejčastěji poruchami chůze s nejistotou a pády, neobratností rukou s dominujícím postižením drobných pohybů ruky a pozitivními či negativními senzitivními symptomy [7]. K převážně subjektivním obtížím se při pokračující tíži komprese přidávají výpadové motorické příznaky charakteru spastické paraparézy dolních končetin a chabé či smíšené paraparézy horních končetin, poruchy senzitivity charakteru hypestezie na končetinách a trupu a sfinkterové poruchy [8]. DCM je diagnostikována v případě, kdy klinické známky myelopatie korelují s průkazem míšní komprese pomocí zobrazovacích metod (dnes prakticky výhradně pomocí MR) [9]. V současnosti je standardem pro stanovení klinické diagnózy přítomnost alespoň jednoho subjektivního a jednoho objektivního klinického příznaku míšní komprese [8].
Subjektivní příznaky:
- porucha chůze;
- neobratnost rukou;
- Lhermitteův příznak;
- bilaterální parestezie horních končetin;
- slabost horních nebo dolních končetin;
- močová urgence nebo inkontinence.
Objektivní příznaky:
- poruchy kortikospinální dráhy:
- hyperreflexie/ klonus;
- spasticita;
- pozitivní pyramidové příznaky (Babinského nebo Hoffmanův příznak);
- spastická paréza jakékoliv končetiny (nejčastěji spastická paraparéza dolních končetin);
- chabá paréza jedné nebo dvou horních končetin v plurisegmentální distribuci;
- atrofie svalů ruky;
- porucha senzitivity v různé distribuci na horních či dolních končetinách (vždy plurisegmentální);
- ataxie chůze.
K hodnocení klinického stavu (u pacientů s již manifestní DCM) se používají různé škály. Nejčastěji je to škála Japonské ortopedické asociace modifikovaná Benzelem pro země s evropskou kulturou (mJOA), která hodnotí hybnost horních a dolních končetin, poruchu senzitivity horních končetin a sfinkterovou dysfunkci [10]. Někdy se užívá Nurickova škála neschopnosti a celá řada dalších testů [11].
Vývoj doporučení managementu pacientů se spondylogenní kompresí krční míchy
V historicky prvních publikacích o predikci vývoje DCM byl přirozený průběh choroby považován za téměř uniformní postupné zhoršování neurologického deficitu. V roce 1955 Clarke a Robinson [12] popsali typický průběh onemocnění zařazením pacientů do několika možných „vzorců“: 5 % pacientů mělo mít prudký nástup symptomů, následovaný dlouhým obdobím remise; 20 % pacientů postupný funkční pokles klinického stavu a u 75 % mělo být zhoršení skokové. V průběhu let však řada prací prokázala, že přirozený průběh choroby je velmi individuální a variabilní a že řada pacientů zůstává stabilních i po mnoho let. Naopak poměrně velké množství z nich progreduje, pokud není včas léčeno.
Na sympoziu Cervical Spine Research Society (CSRS) v roce 1988 byla formulována následující doporučení léčby pacientů s DCM:
- operační řešení předním či zadním přístupem vede k míšní dekompresi a záleží na anatomických poměrech každého nemocného, které metodě dát přednost;
- optimální načasování operace není známo, ale obecně se soudí, že by se mělo operovat v případě progresivního průběhu;
- není jasné, zda pouhá přítomnost myelopatie je indikací k operaci, protože není přesně znám přirozený průběh choroby [13].
V roce 2009 se chopila iniciativy Kloubní sekce Americké asociace neurochirurgů na Kongresu o postižení míchy a periferních nervů (Disorders of The Spine and Peripheral Nerves) s cílem vytvořit doporučení pro léčbu degenerativních onemocnění krční páteře. Panel expertů vydal doporučení stran managementu těchto pacientů a přiřadil k nim jednotlivou sílu důkazů [9].
S narůstajícím povědomím o frekventním výskytu nemyelopatických stadií míšní komprese publikovala expertní skupina severoamerických spondylochirurgů za podpory AOSpine North America [14] metaanalýzu potenciálně relevantních 388 prací týkajících se této problematiky. Bylo identifikováno pouhých 5 publikací, které splňovaly stanovená metodologická inkluzní kritéria. Tři z nich zahrnovaly asijskou populaci a zabývaly se převážně osifikací zadního podélného ligamenta, zbývající dvě práce pocházely z našeho pracoviště [15,16]. Studovali jsme v nich kohortu 199 jedinců se spondylogenní či diskogenní kompresí krční míchy se změnou nebo beze změny signálu na MR krční míchy, se segmentovými bolestmi či známkami krční radikulopatie (která však byla zvládnuta konzervativně), bez přítomnosti jakýchkoliv známek míšního postižení. Na začátku studie byli pacienti klinicky vyšetřeni, absolvovali elektrofyziologické a radiologické vyšetření. První 2 roky byli prospektivně sledováni každých 6 měsíců, následně pak jednou ročně. Na začátku studie mělo 70,9 % pacientů (141/ 199) ve škále mJOA 18 bodů a 29,1 % jedinců (58/ 199) 16 nebo 17 bodů. Myelopatie byla definována jako rozvoj klinických známek či symptomů DCM s poklesem skóre mJOA alespoň o jeden bod. Klinické známky prvního rozvoje DCM byly nalezeny u 22,6 % pacientů (45/ 199), s mediánem sledování 44 měsíců (rozsah 24 – 144 měsíců). V univariantní analýze bylo zjištěno, že EMG známky léze předních rohů míšních (RR: 2,4; 95% CI: 1,5 – 3,9), prolongované somatosenzitivní evokované potenciály (SEP; RR: 2,9; 95% CI: 1,7 – 5,1), prolongované motorické evokované potenciály (MEP; RR: 3,2; 95% CI: 1,9 – 5,6), hyperintenzita na MR (RR: 1,7; 95% CI: 1,0 – 2,7) a klinicky symptomatická radikulopatie (RR: 3,0; 95% CI: 2,0 – 4,4) byly spojeny s rozvojem myelopatie. Potenciální rizikové faktory, které nebyly spojeny s rozvojem DCM, zahrnovaly věk, pohlaví, typ komprese (osteofyty a/ nebo herniace disku), počet stenotických rovin, Pavlovův index pod 0,8, kompresní poměr 0,4 či méně a příčná plocha míchy ≤ 70 mm2. Navíc se u 8 % jedinců (16/ 199) rozvinula symptomatická myelopatie během 12 měsíců od začátku studie a doba, ve které 25 % jedinců progredovalo do klinicky manifestní myelopatie, byla 48,4 měsíců. Multivariantní Coxův proporcionální regresní model pak odhalil, že prolongované SEP (p = 0,007) a MEP (p = 0,033), klinicky symptomatická radikulopatie (p = 0,007) a nepřítomnost hyperintenzity na MR (p = 0,036) byly spojeny s časným (≤ 12 měsíců) rozvojem CSM. V další naší studii z roku 2011, která se zaměřila na vliv menšího traumatu krční páteře na rozvoj DCM u pacientů s ASCCC [16], jsme nenašli statisticky signifikantní asociaci (RR: 0,9; 95% CI: 0,3 – 3,2) mezi traumatem a rozvojem DCM.
Na základě výše uvedených výsledků publikovala severoamerická expertní skupina v roce 2013 přehled doporučení managementu pacientů s cervikální míšní kompresí, která klasifikovala jako „silná“ [14]:
Bod 1: Podle současných poznatků u pacientů s CS a spondylogenní míšní kompresí bez známek myelopatie přibližně v 8 % (v průběhu jednoho roku) a v 23 % (v průběhu 44 měsíců) dojde k rozvoji klinických známek myelopatie.
Bod 2: U pacientů s CS a spondylogenní míšní kompresí, bez klinických známek myelopatie, absence T2 hyperintenzity na MR predikuje rozvoj časné myelopatie (do 12 měsíců sledování) a přítomnost této hyperintenzity predikuje rozvoj myelopatie pozdní (průměrně 44 měsíců sledování). Vzhledem k této diskrepanci nemůže být stanoveno jasné doporučení (ohledně tohoto radiologického parametru) v predikci rozvoje myelopatie.
V současné době jsme aktualizovali náš prediktivní model rozvoje DCM u ADCCC: použili jsme reprezentativnější vzorek jedinců s ADCCC, který zahrnoval jedince kompletně asymptomatické s lehkou míšní kompresí a zapracovali jsme též nové radiologické parametry jako MR DTI (diffusion tensor imaging) [17,18]. Identifikovali jsme příčnou plochu míchy < 70,1 mm2 a kompresní poměr < 0,4 jako nezávislé signifikantní radiologické prediktory rozvoje ADCCC do DCM [19]. Na základě těchto výsledků je tedy nyní možné lépe odhadnout míru rozvoje symptomatické DCM u jedinců s ADCCC a vyselektovat podskupinu pacientů s vyšším rizikem nepříznivého vývoje.
V roce 2017 výše uvedená severoamerická expertní skupina doplnila svoje doporučení jednak ve vztahu k současným metodologickým standardům, dále doplnila názory odborníků z oblasti chirurgie páteře, rehabilitace, neurologie, revmatologie a v neposlední řadě zahrnula i pacientovy preference, rizika a benefity prováděných operací i ekonomický dopad jednotlivých způsobů léčby. Vydala tato doporučení [9]:
- pacient s těžkou DCM (mJOA 0 – 11): doporučuje se chirurgická intervence (doporučení: silné; průkaz: střední) (obr. 1);
- pacient se středně těžkou DCM (mJOA 12 – 14): doporučuje se chirurgická intervence (doporučení silné; průkaz střední) (obr. 2);
- pacient s mírnou DCM (mJOA 15 – 17): doporučuje se nabídnout chirurgickou intervenci nebo strukturovanou rehabilitaci s monitorací klinického stavu. Pokud neproběhne v iniciálním stadiu operace, tak se doporučuje chirurgická intervence v případě, že se stav pacienta neurologicky horší či se po konzervativní léčbě nelepší (doporučení slabé; průkaz velmi nízký) (obr. 3);
- pacient s míšní kompresí bez známek radikulopatie: nedoporučuje se profylaktická operace. Pacient by měl být poučen o potenciálních rizicích a symptomech myelopatie a měl by být klinicky sledován (doporučení slabé; průkaz žádný – založeno na expertním názoru autorů doporučení) (obr. 4);
- pacient s míšní kompresí s klinickými a/ nebo radiologickými známkami radikulopatie: jsou se vyšším riziku rozvoje myelopatie, měla by být zvážena možná rizika. Doporučuje se nabídnout chirurgickou intervenci nebo neoperativní léčbu sestávající z časných kontrol a strukturované rehabilitace. V případě rozvoje myelopatie by měl být pacient léčen podle výše uvedených doporučení (doporučení: slabé; průkaz nízký).
Image 1. Pacient s těžkou degenerativní cervikální myelopatií, klinicky těžká kvadruparéza s poruchami čití a sfi nkterů, dle mJOA 8; indikováno operační řešení, pacient souhlasil. T2-vážené sekvence, vlevo sagitální řez, vpravo axiální řez v úrovni maximální komprese
. mJOA – modifikovaná škála Japonské ortopedické asociace Fig. 1. Patient with a severe degenerative cervical myelopathy, clinically severe quadriparesis with sensory loss and bladder dysfunction, mJOA 8; surgical intervention was recommended, patient consented. T2-weighted sagittal scan on the left side, axial scan at the level of maximal compression on the right side. mJOA – the modified Japanese Orthopaedic Association scale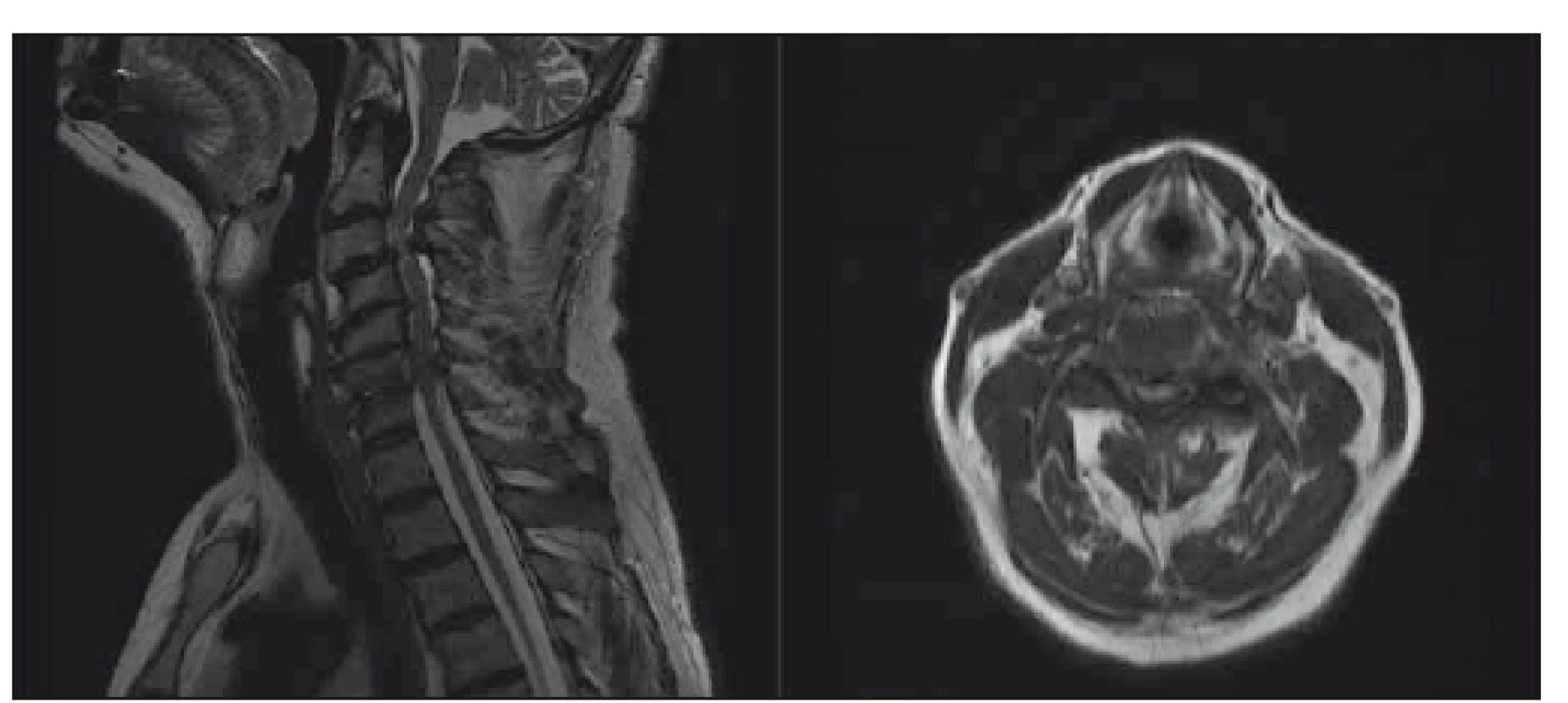
Image 2. Pacient se středně těžkou degenerativní cervikální myelopatií, klinicky lehká kvadruparéza (lehce neobratné ruce, parestézie rukou, lehce nejistá chůze), dle mJOA 12; pacient sám již řadu let stabilní, operaci odkládá. T2-vážené sekvence, vlevo sagitální řez, vpravo axiální řez v úrovni maximální komprese. mJOA – modifikovaná škála Japonské ortopedické asociace
Fig. 2. Patient with moderate degenerative cervical myelopathy, clinically mild quadriparesis (clumsy hands, paresthesias of the hands, light gait ataxia), mJOA 12; surgical intervention offered, patient prefers conservative treatment, neurologic status is stable for years. T2-weighted sagittal scan on the left side, axial scan at the level of maximal compression on the right side. mJOA – the modified Japanese Orthopaedic Association scale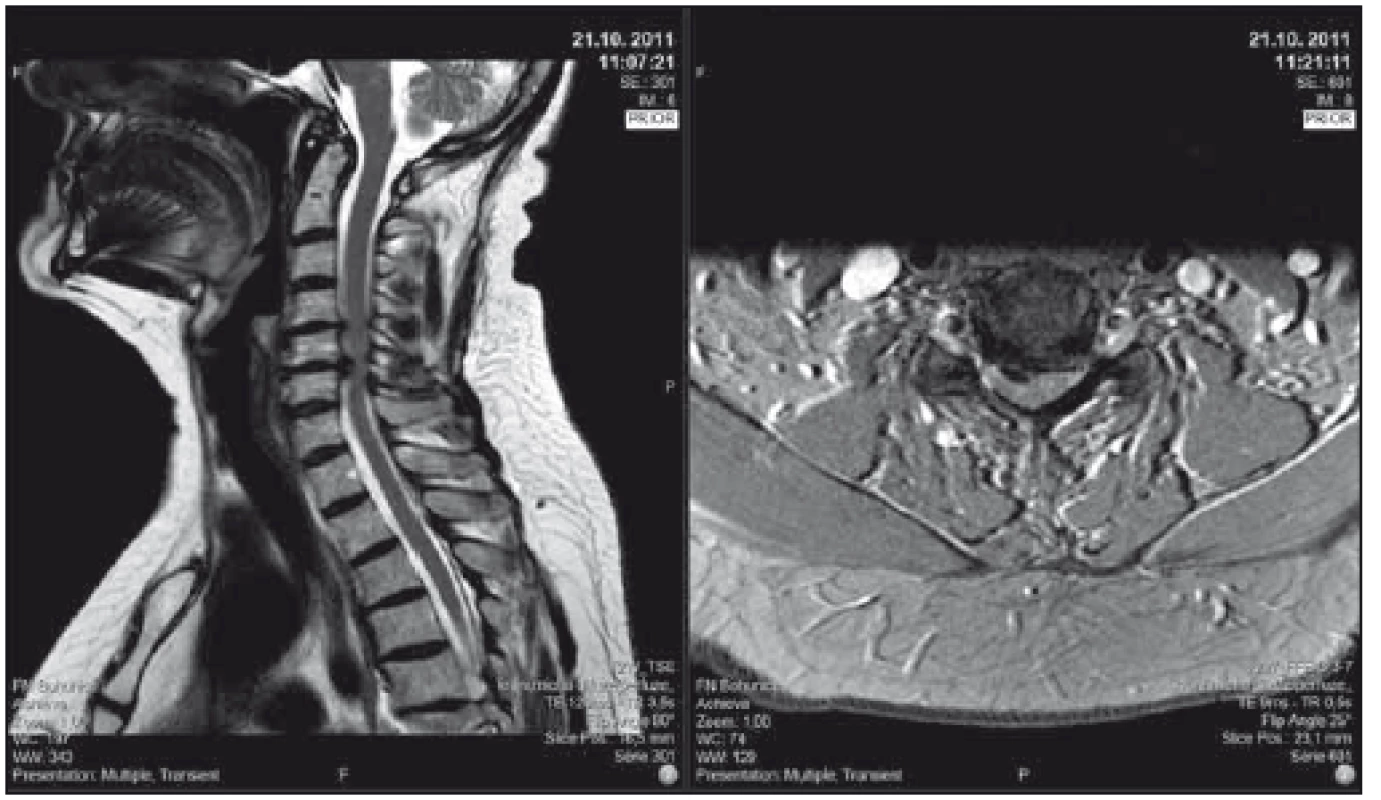
Image 3. Pacient s lehkou degenerativní cervikální myelopatií, klinicky pouze lehká neobratnost rukou, dle mJOA 16; navrhováno operační řešení, které pacient odkládá. T2-vážené sekvence, vlevo sagitální řez, vpravo axiální řez v úrovni maximální komprese. mJOA – modifikovaná škála Japonské ortopedické asociace
Fig. 3. Patient with mild degenerative cervical myelopathy, clinically only discrete clumsy hands, mJOA 16; surgical intervention was recommended, patient postpones the surgery. T2-weighted sagittal scan on the left side, axial scan at the level of maximal compression on the right side. mJOA – the modified Japanese Orthopaedic Association scale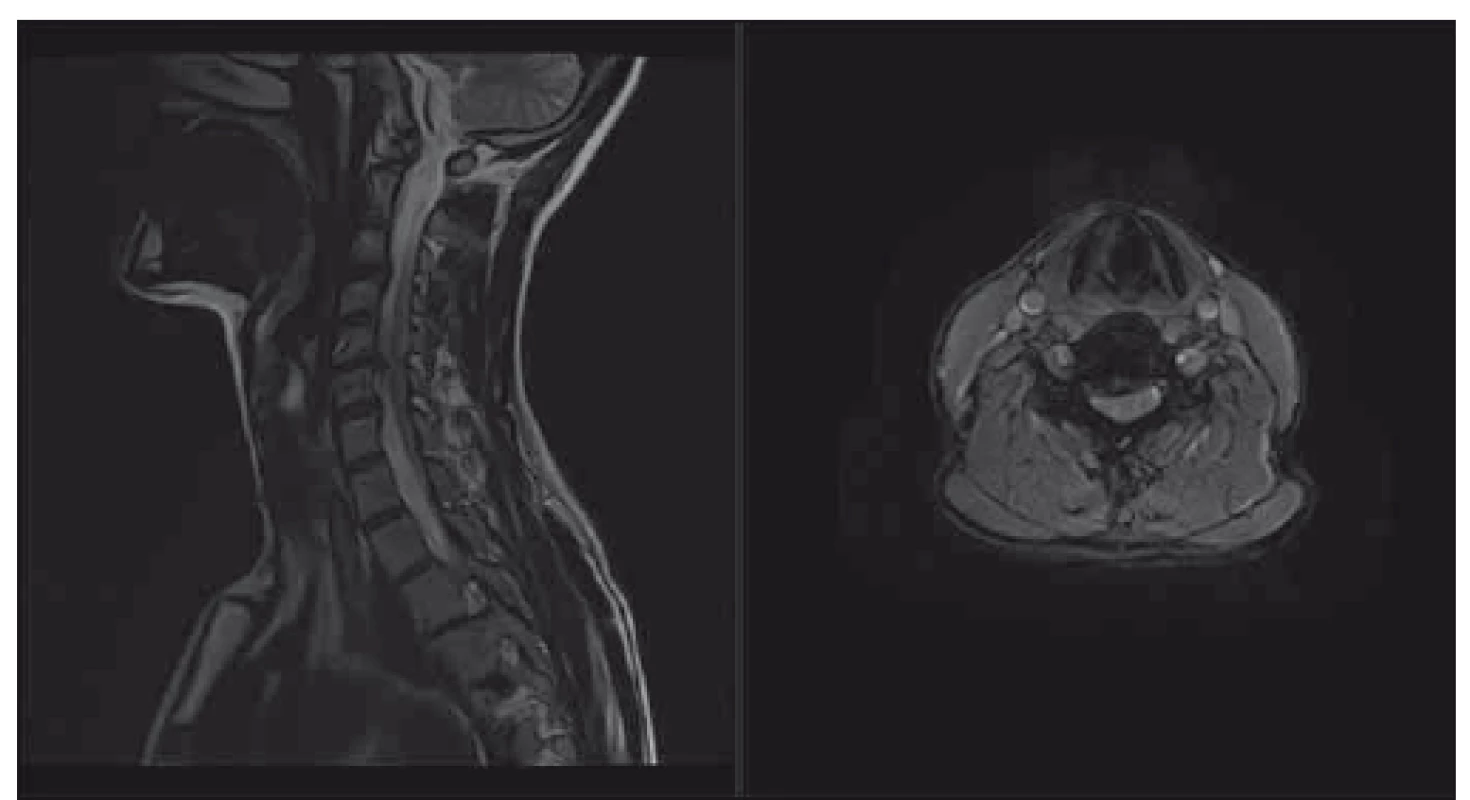
Image 4. Pacient s míšní kompresí bez klinických známek myelopatie či radikulopatie, dle mJOA 18; pacient poučen o možných rizicích a klinicky sledován. T2-vážené sekvence, vlevo sagitální řez, vpravo axiální řez v úrovni maximální komprese. mJOA – modifikovaná škála Japonské ortopedické asociace
Fig. 4. Patient with cervical spine compression with no signs of myelopathy or radiculopathy, mJOA 18; patient was educated about possible risks and is followed clinically. T2-weighted sagittal scan on the left side, axial scan at the level of maximal compression on the right side. mJOA – the modified Japanese Orthopaedic Association scale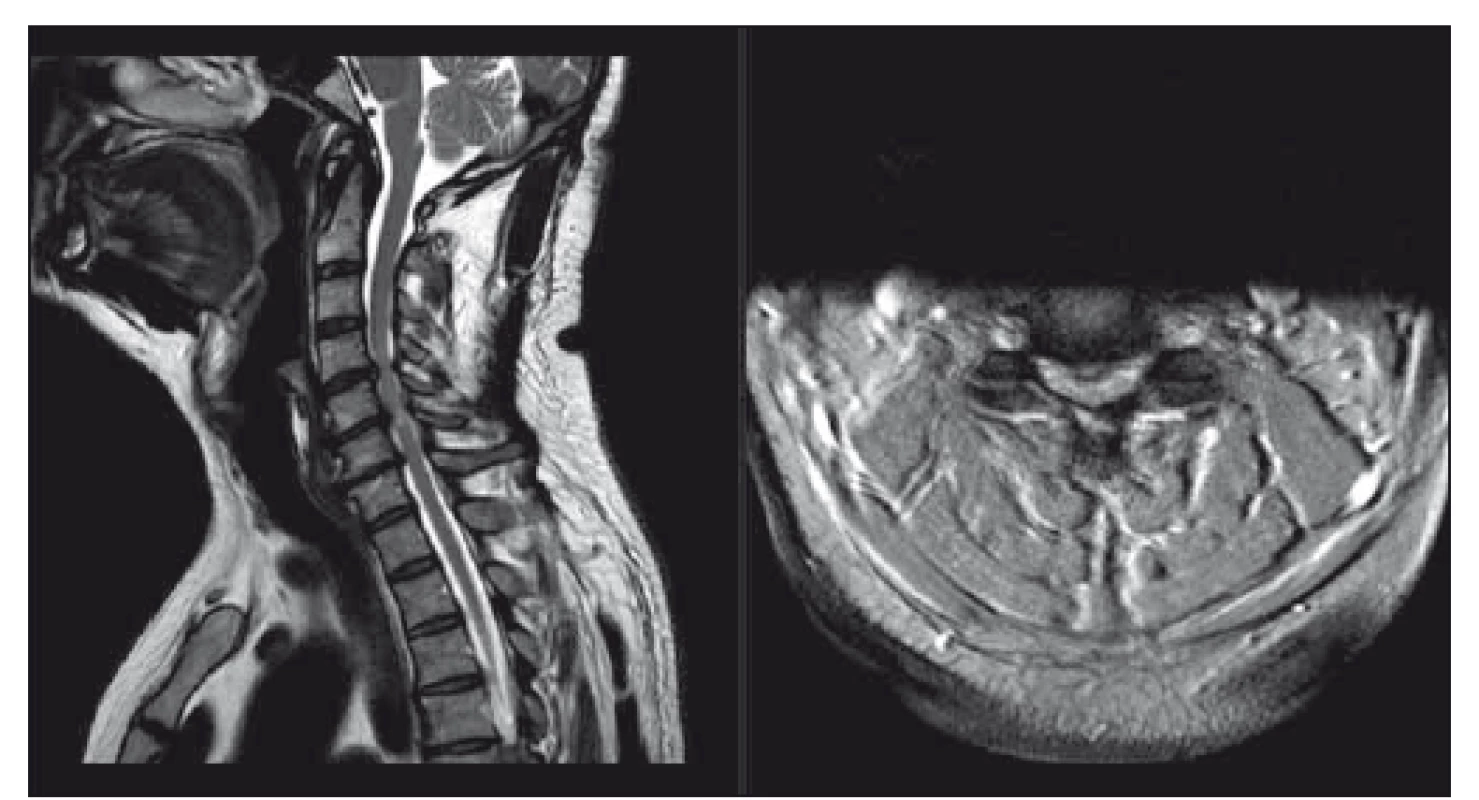
Vidíme tedy, že i nadále neexistuje přesvědčivý a jasný konsenzus ohledně algoritmu managementu vysoce rizikových pacientů s ADCCC. Někteří autoři předpokládají, že jedinci s CS či ADCCC mají zvýšené riziko rozvoje akutní myelopatie v případě, že prodělají i menší trauma [20,21]. To vedlo některé chirurgy k doporučení provádět dekompresní operace za účelem prevence traumatem navozené myelopatie u ohrožených jedinců [22], což je ovšem názor značně kontroverzní. Murphy et al si položili otázku, zda jsou pacienti s ADCCC ve zvýšeném riziku míšního postiženi po menším traumatu krční páteře a zda mohou profitovat z preventivní dekompresní operace [23]. Nenašli však žádnou prospektivní studii, která by jasně prokázala, že riziko míšního postižení je u pacientů s ADCCC vyšší. Nenašli též žádnou relevantní práci, která by zhodnotila efekt chirurgické intervence u asymptomatických pacientů se spondylogenní cervikální míšní kompresí. Zjistili, že frekvence vážných komplikací či mortalita u chirurgicky léčených pacientů se symptomatickou myelopatií je obecně cca 1 %. Postoperační komplikace byly komplikacemi zákroků samotných, nikoliv projevy myelopatie, není tedy pravděpodobné, že by škála komplikací byla jiná u pacientů asymptomatických v porovnání se symptomatickými.
Nicméně jiní autoři jsou ještě radikálnější a přímo doporučují, aby pacienti s jakoukoliv formou DCM byli operováni co nejčasněji, jednak jako prevence budoucích komplikací, jednak i proto, abychom poskytli pacientům co nejdelší potenciál k uzdravení [24]. Zhang et al prokázali zlepšení ve všech chirurgicky léčených věkových skupinách, a to jak cca týden, tak i půl roku po zákroku. Nenašli též rozdíl mezi věkovými skupinami ve frekvenci pooperačních komplikací [25]. Na druhou stranu však v plánování chirurgických výkonů musíme brát do úvahy i možná rizika pooperačních komplikací. Tetrault et al v dosud nejrozsáhlejší metaanalýze dokumentovali, že jedinými významnými prediktory méně příznivého výsledku operační dekomprese DCM s vyšším procentem pooperačních komplikací jsou vyšší věk a delší trvání operačního výkonu (vč. zákroků ve dvou a více etážích) [26]. Potřeba vědeckého průkazu dlouhodobého klinického benefitu chirurgické dekomprese u lehkých forem DCM a vysoce rizikových pacientů s ADCCC však naráží na řadu metodologických i etických úskalí realizace multicentrické randomizované studie.
Závěr
Podle současných doporučení jsou k chirurgické intervenci jednoznačně indikováni pacienti s těžkou (mJOA 0 – 11) a středně těžkou formou (mJOA 12 – 14) DCM.
Přestože existují některá data, která monitorují četnost a rizikové faktory progrese ADCCC do symptomatické DCM, neexistuje jasný, vědecky podložený konsenzus managementu a léčebného algoritmu zejména u pacientů s mírnou myelopatií či asymptomatickou cervikální míšní kompresí, který by zahrnoval i eventuální prospěšnost chirurgické dekomprese u vysoce rizikových pacientů s ADCCC. Jsou potřeba další studie, aby bylo možno definovat načasování chirurgického zákroku a nalézt další prediktory rozvoje DCM u prozatím asymptomatických jedinců.
Tato práce byla podpořena grantem MZ ČR č. NV18-04-00159.
Autoři deklarují, že v souvislosti s předmětem studie nemají žádné komerční zájmy.
Redakční rada potvrzuje, že rukopis práce splnil ICMJE kritéria pro publikace zasílané do biomedicínských časopisů.
MUDr. Zdeněk Kadaňka Jr.
Neurologická klinika
LF MU a FN Brno
Jihlavská 20
625 00 Brno
e-mail: kadanka.zdenek2@fnbrno.cz
Přijato k recenzi: 30. 7. 2019
Přijato do tisku: 3. 10. 2019
Sources
1. Montgomery DM, Brower RS. Cervical spondylotic myelopathy. Clinical syndrome and natural history. Orthop Clin North Am 1992; 23(3): 487 – 493.
2. Teresi LM, Lufkin RB, Reicher MA et al. Asymptomatic degenerative disk disease and spondylosis of the cervical spine: MR imaging. Radiology 1987; 164(1): 83 – 88. doi: 10.1148/ radiology.164.1.3588931.
3. Kovalova I, Kerkovsky M, Kadanka Z et al. Prevalence and imaging characteristics of nonmyelopathic and myelopathic spondylotic cervical cord compression. Spine (Phila Pa 1976) 2016; 41(24): 1908 – 1916. doi: 10.1097/ BRS.0000000000001842.
4. Adamova B, Bednarik J, Andrasinova T et al. Does lumbar spinal stenosis increase the risk of spondylotic cervical spinal cord compression? Eur Spine J 2015; 24(12): 2946 – 2953. doi: 10.1007/ s00586-015-4049-0.
5. Shamji MF, Ames CP, Smith JS et al. Myelopathy and spinal deformity: relevance of spinal alignment in planning surgical intervention for degenerative cervical myelopathy. Spine (phila Pa 1976) 2013; 38 (22 Suppl 1): S147 – S148. doi: 10.1097/ BRS.0b013e3182a7f521.
6. Karadimas SK, Gatzounis G, Fehlings MG. Pathobiology of cervical spondylotic myelopathy. Eur Spine J 2015; 24 (Suppl 2): 132 – 138. doi: 10.1007/ s00586-014-3264-4.
7. Tracy JA, Bartleson JD. Cervical spondylotic myelopathy. Neurologist 2010; 16(3): 176 – 187. doi: 10.1097/ NRL.0b013e3181da3a29.
8. Kalsi-Ryan S, Karadimas SK, Fehlings MG. Cervical spondylotic myelopathy: the clinical phenomenon and the current pathobiology of an increasingly prevalent and devastating disorder. Neuroscientist 2013; 19(4): 409 – 421. doi: 10.1177/ 1073858412467377.
9. Fehlings MG, Tetreault LA, Riew KD et al. A Clinical practice guideline for the management of patients with degenerative cervical myelopathy: recommendations for patients with mild, moderate, and severe disease and nonmyelopathic patients with evidence of cord compression. Global Spine J 2017; 7 (3 Suppl): 70S – 83S. doi: 10.1177/ 2192568217701914.
10. Benzel EC, Lancon J, Kesterson L et al. Cervical laminectomy and dentate ligament section for cervical spondylotic myelopathy. J Spinal Disord 1991; 4(3): 286 – 295.
11. Vitzthum HE, Dalitz K. Analysis of five specific scores for cervical spondylogenic myelopathy. Eur Spine J 2007; 16(12): 2096 – 2103. doi: 10.1007/ s00586-007-0512-x.
12. Clarke E, Robinson PK. Cervical myelopathy: a complication of cervical spondylosis. Brain 1956; 79(3): 483 – 510. doi: 10.1093/ brain/ 79.3.483.
13. Kadaňka Z. Spondylogenní cervikální myelopatie. Cesk Slov Neurol N 2010; 73/ 106(3): 209 – 226.
14. Wilson JR, Barry S, Fischer DJ et al. Frequency, timing, and predictors of neurological dysfunction in the nonmyelopathic patient with cervical spinal cord compression, canal stenosis, and/ or ossification of the posterior longitudinal ligament. Spine (Phila Pa 1976) 2013; 38 (22 Suppl 1): S37 – S54. doi: 10.1097/ BRS.0b013e3182a7f2e7.
15. Bednarik J, Kadanka Z, Dusek L et al. Presymptomatic spondylotic cervical myelopathy: an updated predictive model. Eur Spine J 2008; 17(3): 421 – 431. doi: 10.1007/ s00586-008-0585-1.
16. Bednařík J, Sládková D, Kadaňka Z et al. Are subjects with spondylotic cervical cord encroachment at increased risk of cervical spinal cord injury after minor trauma? J Neurol Neurosurg Psychiatry 2011; 82(7): 779 – 781. doi: 10.1136/ jnnp.2009.198945.
17. Keřkovský M, Bednařík J, Dušek L et al. Magnetic resonance diffusion tensor imaging in patients with cervical spondylotic spinal cord compression: correlations between clinical and electrophysiological findings. Spine (Phila Pa 1976) 2012; 37(1): 48 – 56. doi: 10.1097/ BRS.0b013e31820e6c35.
18. Keřkovský M, Bednařík J, Jurová B et al. Spinal cord MR diffusion properties in patients with degenerative cervical cord compression. J Neuroimaging 2017; 27(1): 149 – 157. doi: 10.1111/ jon.12372.
19. Kadanka Z, Adamova B, Kerkovsky M et al. Predictors of symptomatic myelopathy in degenerative cervical spinal cord compression. Brain Behav 2017; 7(9): e00797. doi: 10.1002/ brb3.797.
20. Emery SE. Cervical spondylotic myelopathy: diagnosis and treatment. J Am Acad Orthop Surg 2001; 9(6): 376 – 388.
21. Shedid D, Benzel EC. Cervical spondylosis anato-my: pathophysiology and biomechanics. Neurosurgery 2007; 60 (1 Suppl 1): S7 – S13. doi: 10.1227/ 01.NEU.0000215430.86569.C4.
22. Epstein NE. Laminectomy for cervical myelopathy. Spinal Cord 2003; 41(6): 317 – 327. doi: 10.1038/ sj.sc.3101477.
23. Murphy DR, Coulis CM, Gerrard JK. Cervical spondylosis with spinal cord encroachment: should preventive surgery be recommended? Chiropr Osteopat 2009; 17 : 8. doi: 10.1186/ 1746-1340-17-8.
24. Gibson J, Nouri A, Krueger B et al. Degenerative cervical myelopathy: a clinical review. Yale J Biol Med 2018; 91(1): 43 – 48.
25. Zhang RJ, Shen CL, Zhang JX et al. Clinical features and surgical outcomes of cervical spondylotic myelopathy in patients of different ages: a retrospective study. Spinal Cord 2018; 56(1): 7 – 13. doi: 10.1038/ sc.2017.91.
26. Tetreault L, Ibrahim A, Côté P et al. A systematic review of clinical and surgical predictors of complications following surgery for degenerative cervical myelopathy. J Neurosurg Spine 2016; 24(1): 77 – 99. doi: 10.3171/ 2015.3.SPINE14971.
Labels
Paediatric neurology Neurosurgery Neurology
Article was published inCzech and Slovak Neurology and Neurosurgery

2019 Issue 6-
All articles in this issue
- Střelná poranění mozku
- Predstavujú ticagrelor a prasugrel alternatívu v protidoštičkovej liečbe ischemických CMP? ANO
- Představují tikagrelor a prasugrel alternativu v protidestičkové léčbě ischemických CMP? NE
- Predstavujú ticagrelor a prasugrel alternatívu v protidoštičkovej liečbe ischemických CMP?
- Klinické syndromy z oblasti cervikálního plexu
- Neurorehabilitace poruch chůze s využitím funkční elektrické stimulace – aktuální poznatky z randomizovaných klinických studií
- Úskalí při respektování autonomie u pacientů s Parkinsonovou nemocí
- Současný management pacientů s degenerativní kompresí krční míchy
- Chirurgická terapie oboustranné farmakorezistentní Menièrovy choroby
- Mechanická trombektómia v liečbe akútnej ischemickej cievnej mozgovej príhody v detskom veku
- Doporučení pro mechanickou trombektomii akutního mozkového infarktu – verze 2019
- Osmdesátiny doc. MU Dr. Jiřího Bauera, CSc.
- Krvácení do aterosklerotického plátu u symptomatické a asymptomatické progredující stenózy vnitřní karotidy – pilotní studie
- Významné rizikové faktory pádu v osobnej anamnéze u hospitalizovaných pacientov s neurologickým ochorením
- Spinální meningiomy – 92 pacientů operovaných na našem pracovišti
- Civilní a válečná střelná poranění hlavy
- Epidurální aplikace kortikoidů Část 1 – Profil pacientů před aplikací
- Rekonstrukce lícního nervu štěpem z nervus auricularis magnus při resekci recidivujícího bazaliomu parotideomasseterické krajiny
- Porovnání perioperačního měření tlaku ve vaku aneuryzmatu a v mateřské tepně u prasklých a neprasklých aneuryzmat
- Systematická analýza klinické efektivity stabilizace sakroiliakálního skloubení v rámci terapie bolestí zad
- Mění se při Parkinsonově nemoci tloušťka cévnatky?
- Konzervativní management prasklé Galassi III arachnoideální cysty střední jámy lební
- Czech and Slovak Neurology and Neurosurgery
- Journal archive
- Current issue
- Online only
- About the journal
Most read in this issue- Klinické syndromy z oblasti cervikálního plexu
- Doporučení pro mechanickou trombektomii akutního mozkového infarktu – verze 2019
- Mechanická trombektómia v liečbe akútnej ischemickej cievnej mozgovej príhody v detskom veku
- Střelná poranění mozku
Login#ADS_BOTTOM_SCRIPTS#Forgotten passwordEnter the email address that you registered with. We will send you instructions on how to set a new password.
- Career

