-
Medical journals
- Career
Zhodnocení dlouhodobého prospívání pacientů po operaci intramedulárního kavernomu
Authors: N. Svoboda 1; O. Bradáč 1; V. Beneš 1
Authors‘ workplace: Neurochirurgická a neuroonkologická klinika 1. LF UK a ÚVN – VFN Praha 1
Published in: Cesk Slov Neurol N 2017; 80/113(5): 564-568
Category: Original Paper
doi: https://doi.org/10.14735/amcsnn2017564Overview
Úvod:
Kavernomy jsou vzácné cévní malformace postihující celý centrální nervový systém (CNS). Své nositele zatěžují výraznou morbiditou. Jediná léčebná možnost je resekce kavernomu.Cíl:
Retrospektivní zhodnocení prospívání pacientů po operaci intramedulárního kavernomu (IMK).Metodika:
Vyhodnotili jsme výsledky pacientů, kteří byli na naší klinice operováni pro IMK v letech 1998 – 2016. Porovnali jsme klinický stav pacientů a grafický nález na magnetické rezonanci v době příjmu, 3 měsíce a 2 roky po operaci.Výsledky:
Provedli jsme 20 operací u 17 pacientů pro histologicky ověřený IMK. Poměr muži/ženy byl 13 : 4, průměrný věk 43 let. U 13 pacientů (65 %) se IMK vyskytoval v hrudní, u sedmi pacientů (35 %) v krční míše. Průměrný objem IMK byl 1,3 ml (0,2–6 ml). U šesti pacientů (35 %) byla na MR zachycena vícečetnost kavernomů CNS, u jednoho pacienta (6 %) dědičná mutace genu CCM1. Nejčastější příznaky IMK byly motorické u 14 pacientů (70 %), senzitivní u 13 pacientů (65 %) a sfinkterové obtíže u tří pacientů (15 %). U devíti pacientů (45 %) šlo o akutní neurologické zhoršení, u tří pacientů (15 %) o skokové neurologické zhoršení a u osmi pacientů (40 %) o progresivní neurologické zhoršování. Průměrné roční riziko krvácení bylo 2,6 %. Dlouhodobé zlepšení jsme zaznamenali u sedmi pacientů (35 %), stejný stav u 12 pacientů (60 %) a jeden pacient (5 %) se zhoršil.Závěr:
Ve shodě s obecnými pravidly operování intramedulárních lézí jsme došli k závěru, že je vhodné operovat pacienty v počátku rozvoje neurologického deficitu a nečekat na zhoršení stavu.Klíčová slova:
kavernom – kavernózní hemangiom – centrální nervový systém – cévní onemocnění míchyÚvod
Kavernomy jsou cévní malformace postihující celý centrální nervový systém (CNS). Celkově se v populaci vyskytují s prevalencí 0,4–0,7 % [1,2], konkrétně intramedulární kavernomy (IMK) jsou vzácné. Ze všech intraspinálních cévních malformací se IMK vyskytují v 5–12 % [3,4].
Histologicky se jedná o shluk cév od tenkých po velmi tlusté a hyalinizované. Jsou atypické stavbou své cévní stěny, která je tvořena pouze endotelem a subendoteliálním stromatem bez buněk hladké svaloviny či elastických vláken. IMK bývají obklopeny gliální tkání [5], která usnadňuje resekci.
IMK se vyvíjejí a mohou se v čase zvětšovat. Buďto dochází k postupnému růstu na podkladě drobného krvácení, hyalinizace vaskulárních kanálů, intraluminální trombózy, mikrocirkulačních změn, anebo kapilární proliferace [5,6]. Tento postupný růst IMK se typicky projevuje vznikem progresivního neurologického deficitu. Jinou možností zvětšení léze je zakrvácení přímo do míšní tkáně, což odpovídá rozvoji akutního/ skokového neurologického deficitu [5 – 7].
Léčba IMK je založena na chirurgickém vynětí ložiska. Dodnes ale nejsou přesně stanovena indikační kritéria, kdy a za jakých okolností přistoupit k operaci. Pohled na načasování operace se proto liší v závislosti na pracovišti a místních zvyklostech.
V roce 2014 jsme publikovali naše chirurgické výsledky u kortiko-subkortikálních [8] a kmenových kavernomů [9]. Tato práce prezentuje zbývající, doposud nezpracovaný soubor chirurgických výsledků u pacientů s IMK.
Metodika
Populace pacientů
V časovém rozmezí v letech 1998 – 2016 bylo na naší klinice provedeno 20 operací u 17 pacientů pro výskyt symptomatického IMK.
Klinické příznaky jsme v době příjmu třídili podle typu na senzitivní, motorické a sfinkterové obtíže. Průběh rozvoje příznaků jsme rozdělili do tří tříd: 1. třída zahrnuje akutní neurologické zhoršení, 2. třída opakující se skokové zhoršení a 3. třída progresivní neurologické zhoršování. Procentuální zastoupení tříd v našem souboru pacientů jsme porovnali s pěti pracemi, jež pojímají v současnosti nejvíce pacientů (metaanalýzy: Badhiwala et al [7] 632 pacientů, Gross et al [10] 352 pacientů a jednotlivé práce: Liang et al [3] 96 pacientů, Mitha et al [11] 80 pacientů, Labauge et al [12] 53 pacientů). Klinický stav pacienta jsme opakovaně hodnotili dle McCormickovy škály (tab. 1) [13], a to v době příjmu za 3 měsíce a po 2 letech od operace. Zlepšení nebo naopak zhoršení stavu pacienta po operaci jsme charakterizovali jako posun při vyšetření alespoň o 1 stupeň a pacienty, kteří v čase posun nejevili, jsme označili jako „stejný stav“. Do skupiny pacientů se zakrvácením do IMK jsme zahrnuli ty pacienty, jejichž snímky prokazovaly v T1 vážených snímcích hyperintenzní signál a u kterých byl zaznamenán odpovídající klinický nález. S využitím těchto údajů jsme vypočítali roční riziko krvácení podle následné rovnice:
riziko krvácení = počet všech krvácivých příhod/součet let pacientů v době krvácení
Radiologické metody
Z radiologických metod jsme hodnotili vyšetření MR v T1 vážených sekvencích, a to jak předoperačně, po 3 měsících a po 2 letech od operace (obr. 1). Objem kavernomu jsme měřili na T1 vážených sagitálních a axiálních snímcích podle rovnice:
S (objem elipsoidu) = 4/3 π * abc (délky poloos elipsoidu)
Image 1. Pacient s intramedulárním kavernomem C6/7 před resekcí (vlevo) a po resekci (vpravo). Fig.1. Patient harbouring intramedullary cavernoma at C6/7 level. Pre-op (left) and post-op (right) MRI scans. 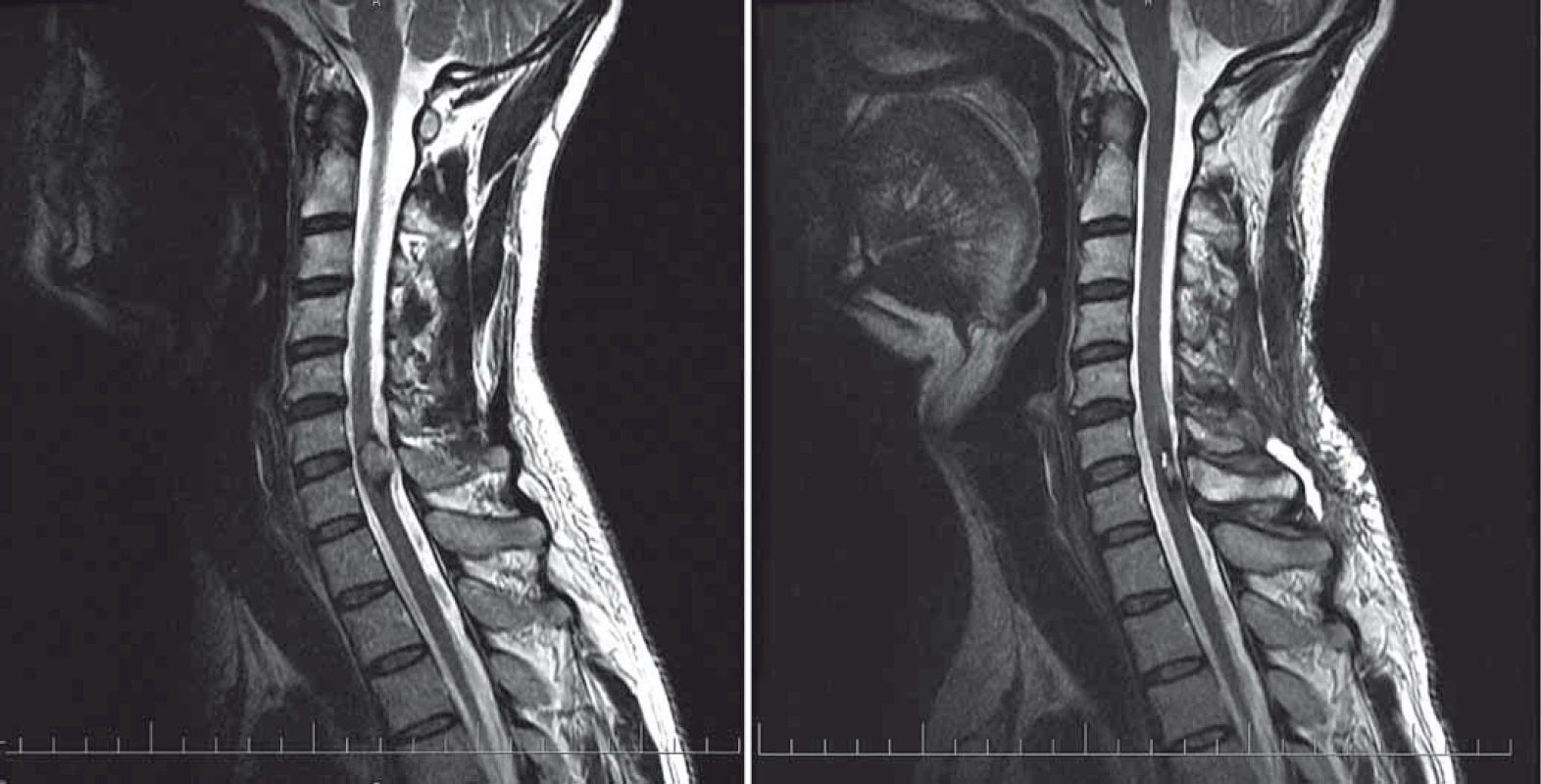
Operační přístup
Ve všech 20 případech jsme jako operační přístup zvolili laminotomii, tj. operační přístup, u kterého jsou dočasně odebrány příslušné vertebrální oblouky a po vyjmutí IMK následně navráceny do původní polohy při fixaci kostním stehem, či pomocí miniplates. Během všech operací jsme rutinně prováděli intraoperační monitoraci (tj. snímání motorických – MEP a somatosenzorických evokovaných potenciálů –nSSEP). Po otevření tvrdé pleny míšní a následně arachnoidey jsme postupovali střední myelotomií tupou separací k IMK. Pokud byl IMK viditelný skrze měkkou plenu, zvolili jsme jako přístupový bod dostupný vrchol IMK. Opatrnou preparací podél gliální tkáně obkroužením cévní malformace jsme uvolnili ložisko, které bylo následně vyňato in toto. Totální resekce jsme dosáhli u všech operovaných.
Sledování
Pacienty jsme dlouhodobě sledovali. Po 3 měsících a po 2 letech od operace bylo provedeno kontrolní ambulantní vyšetření, které sestávalo z klinického a MR vyšetření. U těch pacientů, kteří byli sledováni po dobu kratší než 2 roky, jsme hodnotili jejich výsledné pooperační prospívání při poslední zaznamenané kontrole.
Výsledky
V průběhu 18 let, od roku 1998 do roku 2016, jsme na naší klinice provedli 165 operací pro intramedulární expanzi, z toho 20 (12 %) u 17 pacientů s histologicky ověřenou diagnózou IMK.
Operovali jsme 13 mužů a čtyři ženy, přičemž průměrný věk v době operace byl 43 let. U 13 pacientů (65 %) se IMK vyskytoval v hrudních míšních segmentech, u sedmi pacientů (35 %) v krčních segmentech míšních. Ani jeden z našich pacientů neměl IMK uložen v bederních míšních segmentech. Průměrný objem IMK byl 1,3 ml s rozmezím 0,2–6 ml.
U šesti pacientů (35 %) byly zachyceny vícečetné kavernomy centrálního nervového systému. U dvou pacientů byly nalezeny souběžně dva míšní kavernomy bez intrakraniálního výskytu. U čtyř pacientů jsme zároveň zaznamenali výskyt kavernomů intrakraniálně. U dvou pacientů se jednalo se o tři a pět intrakraniálních lézí, u zbylých dvou pacientů jsme zaznamenali mnohočetné intrakraniální kavernomy. U jednoho pacienta (6 %) byla potvrzena dědičná mutace genu CCM1.
Nejčastějším projevem IMK byly motorické příznaky u 14 pacientů (70 %), senzitivní příznaky jsme zaznamenali u 13 pacientů (65 %) a konečně sfinkterové obtíže u tří pacientů (15 %). U devíti pacientů (45 %) se jednalo o akutní neurologické zhoršení, u tří pacientů (15 %) se IMK projevil jako opakující se skokové neurologické zhoršení a u osmi pacientů (40 %) jako progresivní neurologické zhoršování. Procentuální zastoupení charakteru příznaku v našem souboru pacientů jsme porovnali s dalšími pracemi (tab. 2). Celkový počet krvácivých epizod byl v našem souboru 14. Roční riziko krvácení jsme podle výše uvedeného vztahu stanovili na 2,6 %.
Table 2. Porovnání průběhu rozvoje příznaků IMK dle různých autorů. 
Pozorovali jsme zhoršení u dvou pacientů 3 měsíce po operaci IMK, stav se však u obou vlivem fyziatrické péče zlepšoval a při kontrole za 2 roky od operace se jejich zdravotní stav upravil na stejný jako před operací. Dva roky po operaci nebo při poslední kontrole jsme zlepšení na McCormickově škále zaznamenali u sedmi pacientů (35 %). U 12 pacientů (60 %) nedošlo ke změně neurologického nálezu po operaci a u jednoho pacienta (5 %) jsme zjistili zhoršení stavu o 1 stupeň (obr. 2).
Image 2. Pooperační průběh stavu pacientů po resekci IMK. Hodnoceno dle McCormickovy škály v době příjmu, 3 měsíce a 2 roky po operaci. Zvýrazněně (červeně) jediný dlouhodobě zhoršený pacient. Fig. 2. Post-op clinical course after intramedullary cavernoma resection according to McCormick grading system. Time points are at admission, 3 months and 2 years post surgery. The only long-term neurologically deteriorated patient is shown in bold red. 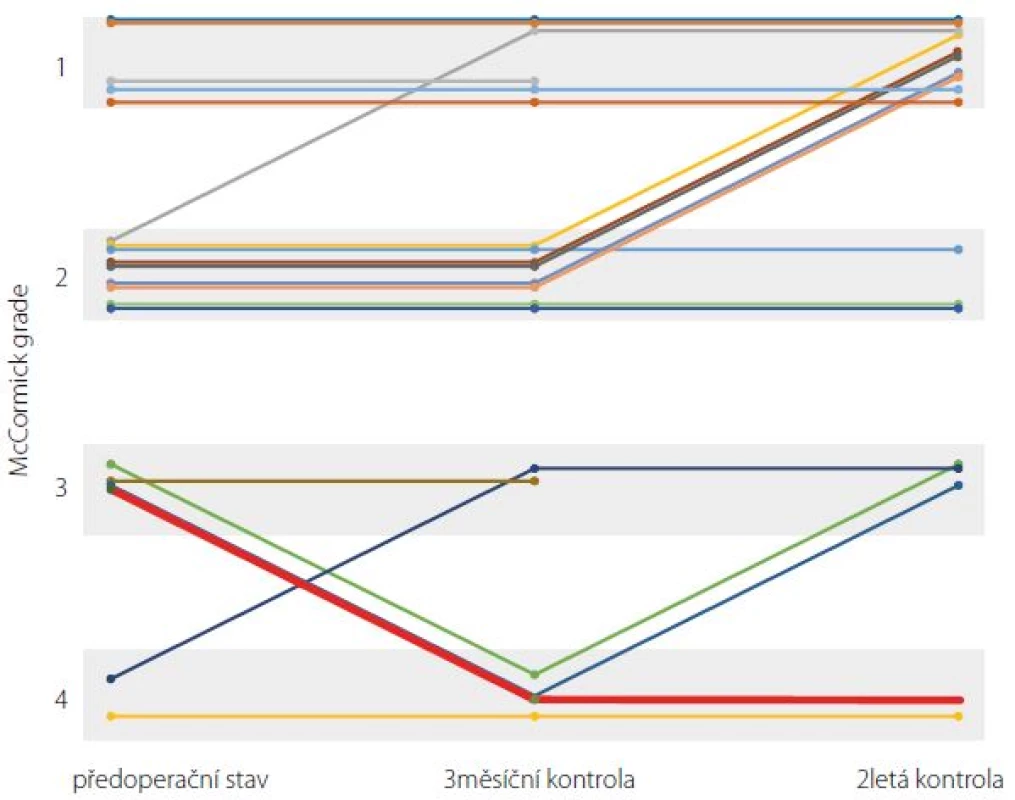
Diskuze
Dodnes nejsou určena přesná indikační kritéria, kdy přistoupit k resekci IMK. Jedná se o onemocnění poměrně vzácné, tj. 5–12 % z celkového počtu intraspinálních cévních malformací [3,4] a asi 5 % ze všech kavernózních malformací [11]. Pro nízkou četnost výskytu IMK vznikají především studie s nízkým počtem pacientů. Zároveň jsou studie nesourodé, co se metodiky týče, a ve svých výsledcích se významně liší. Volba léčebného postupu je tak založena především na zvycích pracoviště a zkušenostech operatéra.
Zajímavé je, že v původních studiích byla popisována zvýšená prevalence u žen – poměr výskytu muži/ženy byl 1,5–2,2/1 [14,15]. Tento poměr muži/ ženy se později vyrovnal, dokonce v nedávných studiích [3,16 – 21] lze sledovat mírné navýšení prevalence u mužů. Průměrný věk při stanovení diagnózy IMK je udáván ve velkých souborech jako 39,1 let [7] (s rozmezím 27–57 let) [17,22]. Vícečetný výskyt kavernomů CNS u pacientů s IMK se liší podle autora od 0 [3] po 62 % [19]. Familiární výskyt IMK se ve většině studií pohybuje kolem 12 % [7,10,12]. V naší práci byla potvrzena dědičná mutace u jedné pacientky (7 %), při vyšetření dětí pacientky se mutace potvrdila i u obou dcer, u syna prokázána nebyla.
Nejvíce se IMK vyskytují v hrudní míše 57 % (v naší práci 65 %), následuje krční 38 % (v naší práci 35 %) a nejméně často jsou přítomny v bederní míše 4 % [10] (v naší práci 0). IMK se nejčastěji projevují rozvojem motorického deficitu 60 % (v naší práci 70 %), v 57 % se projevují senzitivním deficitem (v naší práci 65 %), z toho bolestí ve 34 %. Nejméně často se vyskytují příznaky sfinkterové 24 % [7] (v naší práci 15 %).
Nejvhodnější zobrazovací metoda pro detekci kavernomu je v dnešní době MR [23]. Při vypočítávání rizika zakrvácení jsou publikovány různé výsledky. Důvodem jsou především odlišné definice pro zakrvácení (u některých založené na klinickém vývoji, u jiných podložené MR vyšetřením). Výsledky se tak pohybují mezi 1,4 a 6,8 % rizikem krvácení za rok [7]. Badhiwala et al se svou rozsáhlou studií stanovili průměrné riziko krvácení za rok na 2,1 %. S tímto výsledkem se shoduje i výsledek naší práce 2,6 %, který je založen jak na klinickém vývoji, tak na MR snímcích v T1 vážené sekvenci [7].
Mnozí autoři se shodují, že operace je vhodná u symptomatických pacientů, jejichž IMK se nachází povrchově. Jiné práce dodávají, že nezáleží pouze na přítomnosti příznaků, ale také na délce trvání příznaků před operací. V práci Cantore et al [24] zaznamenali horší prospívání pacientů s delším trváním příznaků. Zevgaridis et al [15] toto potvrdili. Dle jejich výsledků pacienti s trváním příznaků méně než 3 měsíce mají statisticky významně lepší prognózu po operaci. Mnohé následné práce však toto nepotvrdily [7].
Ne všichni jsou ale zastánci chirurgického přístupu. Například Kharkar et al [19] shledávají, že IMK jsou méně progresivní, než se odborná komunita domnívá. Ve své práci sledují 10 pacientů s IMK po dobu v průměru 80 měsíců. V průběhu studie byli všichni zařazení pacienti klinicky stabilní. Kim et al [25] ve své práci sledovali dlouhodobou účinnost resekce IMK vzhledem k předoperačním bolestem. Hodnotili prospívání 21 pacientů se senzitivním deficitem léčených chirurgicky, doba sledování byla v průměru 44,5 měsíce. U 18 pacientů (78 %) došlo po operaci ke zmírnění bolestí, toto zlepšení však přetrvalo jen u 11 (52 %) pacientů při dlouhodobém sledování. Docházejí k závěru, že resekce IMK má dobrý efekt na léčbu bolesti. Ten je nicméně často krátkodobý a u mnohých pacientů dochází k opětovnému návratu obtíží. Deutsch et al [26] ve své práci sledují v průměru 5 let pět pacientů po operaci pro IMK. Závěrem shledávají, že je sice u pacientů prokazatelné zlepšení stavu bezprostředně po operaci, toto ale není trvalé. Při dlouhodobém sledování (déle než rok) se klinický stav pacientů postupně zhoršuje. Domnívají se, že důvodem krátkodobého pooperačního zlepšení je dorzální myelotomie, kdy dochází k přerušení dorzálních viscerálních drah pro bolest. Ve své práci dochází k závěru, že většinu IMK je nejlépe léčit konzervativně, jelikož resekce IMK je zatížena značnou morbiditou, která převažuje nad dočasnými výhodami operace. Operaci jako vhodnou metodu léčby doporučují u pacientů s velkými bolestmi.
Výrazným počinem se stala metaanalýza Badhiwala et al [7]. Hodnotila 40 studií o celkovém počtu 632 pacientů, z nichž 567 pacientů (89,9 %) bylo léčeno chirurgicky a 64 pacientů (10,1 %) konzervativně. Výsledkem bylo, že pacienti s rozvojem příznaků kratším než 3 měsíce před operací mají statisticky významně lepší pooperační výsledky. Horších výsledků po operaci dosahují pacienti s chronickým rozvojem příznaků na rozdíl od těch s akutním/ skokovým zhoršením. Lepší terapeutický efekt má resekce IMK u pacientů s motorickým deficitem než se senzitivním. Navzdory očekávání nebyl potvrzen horší pooperační průběh u operovaných pacientů s IMK uloženým v hloubce. Ti, kteří podstoupili chirurgickou resekci, prospívali lépe než ti, kteří byli pouze sledováni.
Jak již bylo uvedeno, chirurgická resekce kavernomu je jediná terapeutická možnost. V největších publikovaných souborech pacientů po operaci IMK, jako jsou práce Mitha et al [11] (80 pacientů) či Liang et al [3] (96 pacientů), dosahují jejich operační výsledky dlouhodobého zlepšení u 23 a 36 % (35 % naše výsledky), stejného stavu jako před operací u 68 a 55 % (60 % naše výsledky), u 6 a 9 % zhoršení (5 % naše výsledky).
V české literatuře jsme bohužel nenašli práci zaobírající se výlučně tématikou míšních kavernomů. Vyhledali jsme sice několik prací, které se o míšních kavernomech zmiňují, ale bohužel jen v podobě vedlejšího tématu [27,28]. Nemohli jsme proto porovnávat naše výsledky.
Specifickým případem je hodnocení sfinkterových obtíží u pacientů po operaci IMK. Bohužel právě sfinkterové obtíže nejsou ve většině prací hodnoceny. Badhiwala et al se ve své metaanalýze věnují této problematice. Z celkového počtu 567 pacientů bylo možné hodnotit vývoj sfinkterových funkcí po operaci IMK pouze u 48 pacientů. Zlepšení sfinkterových obtíží zaznamenali u 31 (65 %) pacientů, u 13 (27 %) pacientů stejný stav a zhoršení u čtyř (8 %) pacientů po operaci IMK. V našem souboru pacientů jsme zjistili sfinkterové obtíže u tří (15 %) pacientů, z nichž jednomu (5 %) se po operaci močová inkontinence upravila, zbylí dva (10 %) pacienti měli 2 roky po operaci stejné sfinkterové obtíže jako před operací. U žádného pacienta jsme nezaznamenali zhoršení stran sfinkterových funkcí.
Při rozboru našich výsledků jsme dospěli k závěru, že pacienti mají rozdílný přínos z operace v závislosti na jejich klinickém stavu před operací. Zjistili jsme, že žádný z pacientů, jehož neurologický stav byl při příjmu roven 3 nebo 4 na McCormickově škále, nejevil v čase zlepšení nad McCormick 3. Naopak pacienti, kteří byli v době příjmu ohodnoceni McCormick 1 nebo 2, se pooperačně nezhoršili pod McCormick 2. Podobných výsledků dosahují Brotchi et al [29]. Ve své práci vyhodnotil prospívání více než 260 pacientů po 300 operacích pro intramedulární tumory. Po operaci pacientů s McCormick 1 došlo ke zhoršení u 5 %, 95 % zůstalo stejných. U pacientů s McCormick 2 se zhoršilo 5 %, 86 % zůstalo stejných a 9 % se zlepšilo. U pacientů s McCormick 3 došlo ke zhoršení u 17 %, 53 % zůstalo stejných a 30 % se zlepšilo. Všichni pacienti s McCormick 4 zůstali pooperačně stejní. Z toho vyplývá, že je vhodné operovat pacienty co nejdříve po rozvinutí příznaků, je-li tumor resekovatelný, a nečekat na zhoršení stavu pacienta.
Závěr
Výsledky naší práce jsou ve shodě s obecně přijímanými pravidly léčby míšních tumorů. Operací jsme dosáhli lepších výsledků u těch pacientů, kteří měli lehké neurologické postižení (McCormick 1 nebo 2). Pacienti s těžkým neurologickým deficitem (McCormick 3 a 4) se pooperačně nezlepšili a jejich stav byl buďto stejný nebo horší než před operací. V závislosti na těchto výsledcích doporučujeme co nejčasnější resekci symptomatického IMK, dokud nedojde ke zhoršení stavu pacienta.
Práce byla podpořena Institucionální podporou MO 1012 a projektem PRVOUK-P27/ LF1/ 7.
Autoři deklarují, že v souvislosti s předmětem studie nemají žádné komerční zájmy.
Redakční rada potvrzuje, že rukopis práce splnil ICMJE kritéria pro publikace zasílané do biomedicínských časopisů.
MUDr. RNDr. Ondřej Bradáč, Ph.D.
1. LF UK a ÚVN – VFN Praha
U Vojenské nemocnice 1200
169 02 Praha 6
e-mail: ondrej.bradac@uvn.cz
Přijato k recenzi: 16. 3. 2016
Přijato do tisku: 27. 7. 2017
Sources
1. Del Curling O Jr, Kelly DL Jr, Elster AD, et al. An analysis of the natural history of cavernous angiomas. J Neurosurg 1991;75(5):702 – 8.
2. Robinson JR, Awad IA, Little JR. Natural history of the cavernous angioma. J Neurosurg 1991;75(5):709 – 14.
3. Liang JT, Bao YH, Zhang HQ, et al. Management and prognosis of symptomatic patients with intramedullary spinal cord cavernoma: clinical article. J Neurosurg Spine 2011;15(4):447 – 56.
4. Jellinger K. Pathology of Spinal Vascular Malformations and Vascular Tumors. In: Pia HW, Djindjian R, eds. Spinal Angiomas: Advances in Diagnosis and Therapy. Berlin: Springer Berlin Heidelberg 1978 : 18 – 44.
5. Ogilvy CS, Louis DN, Ojemann RG. Intramedullary cavernous angiomas of the spinal cord: clinical presentation, pathological features, and surgical management. Neurosurgery 1992;31(2):219 – 29; discussion 229 – 30.
6. Bian LG, Bertalanffy H, Sun QF, Shen JK. Intramedullary cavernous malformations: clinical features and surgical technique via hemilaminectomy. Clin Neurol Neurosurg 2009;111(6):511 – 7. doi: 10.1016/ j.clineuro.2009.02.003.
7. Badhiwala JH, Farrokhyar F, Alhazzani W, et al. Surgical outcomes and natural history of intramedullary spinal cord cavernous malformations: a single-center series and meta-analysis of individual patient data: Clinic article. J Neurosurg Spine 2014;21(4):662 – 76. doi: 10.3171/ 2014.6.SPINE13949.
8. Májovský M, Netuka D, Bradáč O, et al. Chirurgická léčba supratentoriálních kortiko-subkortikálních kavernomů. Cesk Slov Neurol N 2014;110(5):631 – 37.
9. Bradac O, Majovsky M, de Lacy P, et al. Surgery of brainstem cavernous malformations. Acta Neurochir (Wien) 2013;155(11): 2079 – 83. doi: 10.1007/ s00701-013-1842-6.
10. Gross BA, Du R, Popp AJ, et al. Intramedullary spinal cord cavernous malformations. Neurosurg Focus 2010;29(3):E14. doi: 10.3171/ 2010.6.FOCUS10144.
11. Mitha AP, Turner JD, Abla AA, et al. Outcomes following resection of intramedullary spinal cord cavernous malformations: a 25-year experience. J Neurosurg Spine 2011;14(5):605 – 11.
12. Labauge P, Bouly S, Parker F, et al. Outcome in 53 patients with spinal cord cavernomas. Surg Neurol 2008;70(2):176 – 81; discussion 181. doi: 10.1016/ j.surneu. 2007.06.039.
13. McCormick PC, Torres R, Post KD, et al. Intramedullary ependymoma of the spinal cord. J Neurosurg 1990;72(4):523 – 32.
14. Canavero S, Pagni CA, Duca S, et al. Spinal intramedullary cavernous angiomas: a literature meta-analysis. Surg Neurol 1994;41(5):381 – 8.
15. Zevgaridis D, Medele RJ, Hamburger C, et al. Cavernous haemangiomas of the spinal cord. A review of 117 cases. Acta Neurochir (Wien) 1999;141(3):237 – 45.
16. Aoyama T, Hida K, Houkin K. Intramedullary cavernous angiomas of the spinal cord: clinical characteristics of 13 lesions. Neurol Med Chir (Tokyo) 2011;51(8):561 – 6.
17. Endo T, Aizawa-Kohama M, Nagamatsu K, et al. Use of microscope-integrated near-infrared indocyanine green videoangiography in the surgical treatment of intramedullary cavernous malformations: report of 8 cases. J Neurosurg Spine 2013;18(5):443 – 9. doi: 10.3171/ 2013.1.SPINE12482.
18. Jallo GI, Freed D, Zareck M, et al. Clinical presentation and optimal management for intramedullary cavernous malformations. Neurosurg Focus 2006;21(1):e10.
19. Kharkar S, Shuck J, Conway J, et al. The natural history of conservatively managed symptomatic intramedullary spinal cord cavernomas. Neurosurgery 2007;60(5):865 – 72; discussion 865 – 72.
20. Lu DC, Lawton MT. Clinical presentation and surgical management of intramedullary spinal cord cavernous malformations. Neurosurg Focus 2010;29(3):E12. doi: 10.3171/ 2010.6.FOCUS10139.
21. Tong X, Deng X, Li H, et al. Clinical presentation and surgical outcome of intramedullary spinal cord cavernous malformations. J Neurosurg Spine 2012;16(3):308 – 14. doi: 10.3171/ 2011.11.SPINE11536.
22. Odom GL, Woodhall B, Margolis G. Spontaneous hematomyelia and angiomas of the spinal cord. J Neurosurg 1957;14(2):192 – 202.
23. Marusič P. Diagnostika epileptických záchvatů. Cesk Slov Neurol N 2015;78(111):253–62.
24. Cantore G, Delfini R, Cervoni L, et al. Intramedullary cavernous angiomas of the spinal cord: report of six cases. Surg Neurol 1995;43(5):448 – 51; discussion 451 – 2.
25. Kim LJ, Klopfenstein JD, Zabramski JM, et al. Analysis of pain resolution after surgical resection of intramedullary spinal cord cavernous malformations. Neurosurgery 2006;58(1):106 – 11; discussion 106 – 11.
26. Deutsch H. Pain outcomes after surgery in patients with intramedullary spinal cord cavernous malformations. Neurosurg Focus 2010;29(3):E15. doi: 10.3171/2010.6.FOCUS10108.
27. Andrašinová T. Spinální arteriovenózní malformace – dvě kazuistiky. Cesk Slov Neurol N 2014;77(110):505 – 509.
28. Smrčka M. Problematika indikace operační léčby u intramedulárních lézí. Cesk Slov Neurol N 2010;73(106):393 – 397.
29. Brotchi J. Intrinsic spinal cord tumor resection. Neurosurgery 2002;50(5):1059–63.
Labels
Paediatric neurology Neurosurgery Neurology
Article was published inCzech and Slovak Neurology and Neurosurgery

2017 Issue 5-
All articles in this issue
- Terapia pokročilých štádií Parkinsonovej choroby invazívnymi postupmi
- Neurorehabilitace chůze po cévní mozkové příhodě
- Esenciální tremor – vzniká nový nozologický koncept?
- Leberova hereditární neuropatie optiku
- Funkce lícního nervu po mikrochirurgické léčbě vestibulárního schwannomu
- Prevalence kouření u středoevropských pacientů s narkolepsií s kataplexií, narkolepsií bez kataplexie a idiopatickou hypersomnií
- Zhodnocení dlouhodobého prospívání pacientů po operaci intramedulárního kavernomu
- Statiny indukovaná nekrotizující autoimunitní myopatie
- Elektrostimulace suprahyoidních svalů u pacientů po cévní mozkové příhodě s dysfagií
- Intraventrikulární meningiomy – retrospektivní studie 19 případů
- Varianta p.Val66Met v genu pro mozkový neurotrofní faktor (BDNF) v české populaci
- Dva případy atypického teratoidního rhabdoidního tumoru CNS a přehled literatury
- Teplotní management u pacientů podstupujících plánovaný spondylochirurgický výkon v pronační poloze – prospektivní randomizovaná studie
- Aminoguanidin podávaný subchronicky intrahipokampálně zlepšuje u diabetických potkanů plnění úkolů pasivního vyhýbání a expresi genů z rodiny Bcl-2
- Kazuistika meningitidy dospělých způsobená bakterií Escherichia coli
- Czech and Slovak Neurology and Neurosurgery
- Journal archive
- Current issue
- Online only
- About the journal
Most read in this issue- Esenciální tremor – vzniká nový nozologický koncept?
- Leberova hereditární neuropatie optiku
- Statiny indukovaná nekrotizující autoimunitní myopatie
- Terapia pokročilých štádií Parkinsonovej choroby invazívnymi postupmi
Login#ADS_BOTTOM_SCRIPTS#Forgotten passwordEnter the email address that you registered with. We will send you instructions on how to set a new password.
- Career


