-
Medical journals
- Career
Selhání peroperační videoangiografie s využitím indocyaninové zeleně při detekci uzávěru mozkového aneuryzmatu klipem – kazuistika
Authors: V. Přibáň 1; I. Holečková 1; J. Mraček 1; V. Runt 1; D. Štěpánek 1; F. Šlauf 2
Authors‘ workplace: LF UK a FN Plzeň Neurochirurgické oddělení 1; LF UK a FN Plzeň Klinika zobrazovacích metod 2
Published in: Cesk Slov Neurol N 2013; 76/109(6): 773-778
Category: Case Report
Overview
Peroperační videoangiografie s využitím indocyaninové zeleně (ICG videoangiografie) dosáhla vzhledem ke spolehlivosti a bezpečnosti širokého využití v chirurgii mozkových aneuryzmat. Dokáže posoudit průchodnost magistrálních tepen, perforátorů a uzávěr vaku klipem. Selhání vyšetření ICG videoangiografie může nastat při obtížném zobrazení aneuryzmatu a tepen v hloubi zorného pole. Autoři prezentují případ neprasklého, velkého aneuryzmatu arteria cerebri media vlevo u 65leté pacientky, u které ICG videoangiografie chybně zobrazila vyřazení výdutě z cirkulace po zaklipování. Průchodnost mateřské tepny byla ověřena peroperačně flowmetrem. ICG angiografie potvrdila průtok v magistrálních tepnách a perforátorech, vak za svorkou se kontrastem neplnil. Punkce vaku způsobila krvácení s následným naplněním vaku kontrastem. Přidáváním dalších klipů do konečného počtu pěti se podařilo eliminovat vtok krve do vaku. Autoři zdůrazňují nutnost otevření vaku po zaklipování. Spolehnutí se na ICG videoangiografii by mohlo vyústit v nesprávné ošetření výdutě s nejistým dlouhodobým výsledkem.
Klíčová slova:
mozková aneuryzmata – kliping – indocyaninová zeleň – videoangiografiePodpořeno grantem MZ ČR ‑ RVO (Fakultní nemocnice Plzeň ‑ FNPL, 00669806).
Úvod
Mikrochirurgická operační léčba má své pevné postavení v terapii mozkových aneuryzmat [1]. Cílem výkonu je kompletní vyřazení výdutě z cirkulace klipem při zachování průtoku v magistrálních a perforujících tepnách. Potenciální komplikace operace spočívají zejména v neúplném uzavření vaku s možností krvácení nebo recidivy krvácení, v okluzi/ stenóze magistrální tepny klipem a v iatrogenním uzávěru nebo poranění perforujících tepének. Recidivující krvácení z inkompletně uzavřené výdutě mívá často fatální důsledky. Okluze/ stenóza magistrální tepny může způsobit ischemii v jejím povodí. Okluze perforátorů může rezultovat v ischemii hlubokých struktur mozku s následnou kontralaterální hemiparézou. Proto je v současnosti naprosto zásadní využití peroperačních metod, které dokáží včas diagnostikovat technickou chybu během klipování výdutě. Peroperační diagnostika dává potenciál k redukci morbidity/ mortality operační léčby mozkových aneuryzmat. V minulosti byla v této indikaci využívána peroperační digitální subtrakční angiografie a mikrovaskulární dopplerovská ultrasonografie. Nicméně v současnosti získala při kontrole bezpečného operování mozkových aneuryzmat velkou oblibu infračervená videoangiografie s indocyaninovou zelení (ICG videoangiografie). Důvodem této obliby je jednoduchost provedení, bezpečnost, vysoké rozlišení, reprodukovatelnost a vysoká spolehlivost vyšetření. Vyšetření je rychlé, relativně levné a nevyžaduje přerušení operace s odstraněním mikroskopu z operačního pole. Nevýhodou je naopak zobrazení úzkého zorného pole s vizualizací pouze přímo osvícených struktur.
ICG videoangiografie byla v chirurgii mozkových aneuryzmat užita poprvé v roce 2003 [2], a jak již bylo uvedeno, dosáhla velmi rychle širokého využití v klinické praxi. Indocyaninová zeleň (ICG) je látka s vlastností fluorescence při aplikaci infračervené části spektra světla s maximem na vlnové délce 805 nm. Látka je aplikována intravenózně, do několika sekund se navazuje na globuliny v séru a je kompletně vyloučena játry s poločasem rozpadu 3 – 4 min. Doporučená dávka je 0,2 – 0,5 mg/ kg, maximální denní dávka je 5 mg/ kg. Operační pole je před aplikací ICG ozářeno zdrojem světla o vlnové délce 700 – 850 nm. Optický filtr zamezí záznamu excitačního a ambientního světla. ICG fluorescence je nahrána na videokameru integrovanou v mikroskopu. Na videoangiografii v reálném čase rozlišujeme arteriální, kapilární a venózní fázi. Velmi cenná je následná analýza záznamu ihned po proběhlém peroperačním vyšetření. ICG videoangiografie umožňuje posoudit vyřazení výdutě z cirkulace (absence kontrastu ve vaku po uzavření klipem) a kvalitativní hodnocení průtoku krve v magistrálních tepnách. Ve srovnání s ostatními metodami dokáže posoudit průtok krve v perforátorech. Tato vlastnost je mimořádně cenná. Limit ICG videoangiografie vyplývá z toho, že se jedná o záznam pohledu zorného pole operatéra. Při velkém zvětšení je tak zobrazena jen malá část pole v okolí výdutě. U masivního subarachnoidálního krvácení, ateroskleróze vaku, intraluminárních trombech a komplexních tlustostěnných výdutích nemusí být kvalita zobrazení dostatečná. Podobná situace nastává při srůstech arachnoidey po předchozích operacích a u hluboko uložených lézí (bazilární aneuryzma). Reziduum vaku zakryté svorkou se pochopitelně také nezobrazí, je‑li mimo zorné pole operatéra [3].
Pokud tyto limity vyšetření ICG videoangiografie nejsou přítomny, pak je vyšetření spolehlivé. Dosud byl zaznamenán pouze jeden literární zdroj, který dokumentoval absenci kontrastu ve vaku po zasvorkování při trvajícím průtoku krve do vaku [4].
Autoři uvádějí vlastní kazuistiku, při níž došlo k falešně negativnímu záznamu ICG videoangiografie při trvajícím vtoku krve do vaku po zaklipování. Vyšetření bylo přitom technicky dokonalé a aneuryzma povrchní.
Kazuistika
Pětašedesátiletá pacientka, hypertonička v anamnéze prodělala kolapsový stav. Následně byla hospitalizována na spádovém interním oddělení. Bylo provedeno CT vyšetření, které prokázalo kulovité hyperdenzní ložisko vlevo ve střední jámě lební hodnocené jako meningeom nebo aneuryzma na arteria cerebri media. Zároveň bylo doporučeno vyšetření CT angiografie. Ta zobrazila výduť na střední mozkové tepně vlevo velikosti 13 × 11 × 10 mm (obr. 1).
Image 1. CT angiografie – prokázala výduť na střední mozkové tepně vlevo velikosti 13 × 11 × 10 mm. 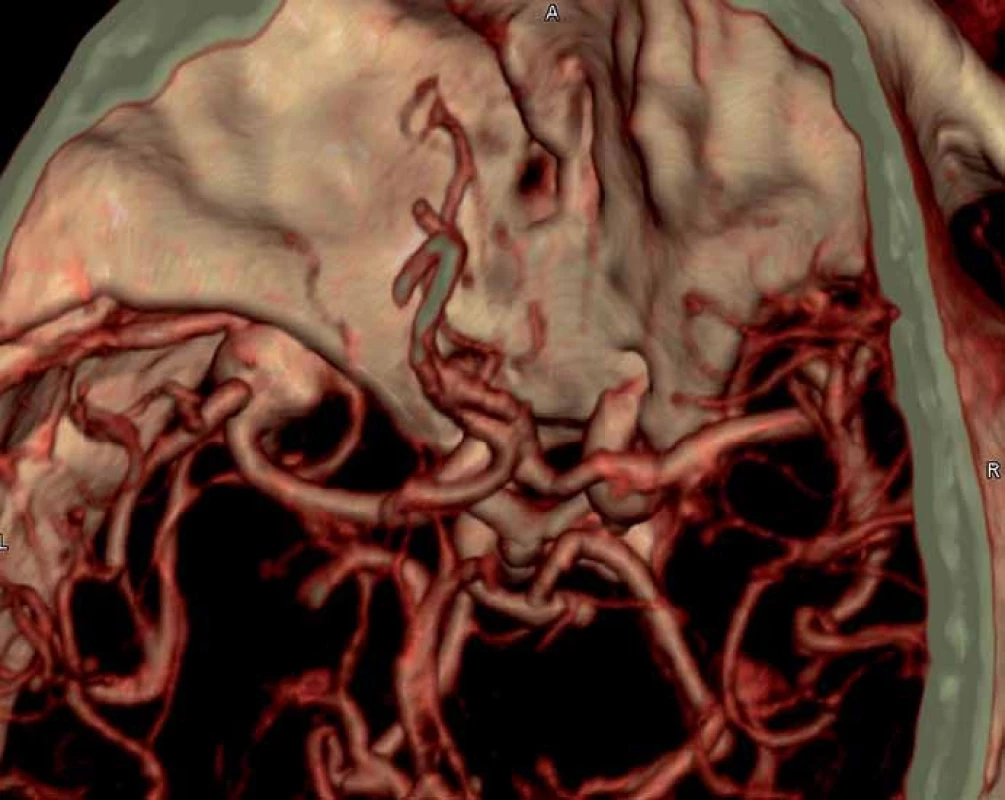
Pacientka byla přijata na Neurochirurgické oddělení FN Plzeň. Při příjmu byla bez potíží, topický neurologický nález byl v normě. Byla provedena digitální subtrakční angiografie (DSA) s nálezem široce nasedajícího aneuryzmatu ve větvení M1/ 2 úseku střední mozkové tepny vlevo velikosti 19 mm, směřující dopředu. Krček aneuryzmatu byl 8 mm široký. Vzhledem k růstu aneuryzmatu byla indikována intervence. Otevřená operační léčba byla zvolena s ohledem na lokalizaci aneuryzmatu, jeho velikost a poměr krčku vůči vaku (obr. 2).
Image 2. Digitální subtrakční angiografie potvrdila nález široce nasedajícího aneuryzmatu ve větvení M1/2 vlevo s fundem směřujícím dopředu. Krček aneuryzmatu je široký 8 mm. 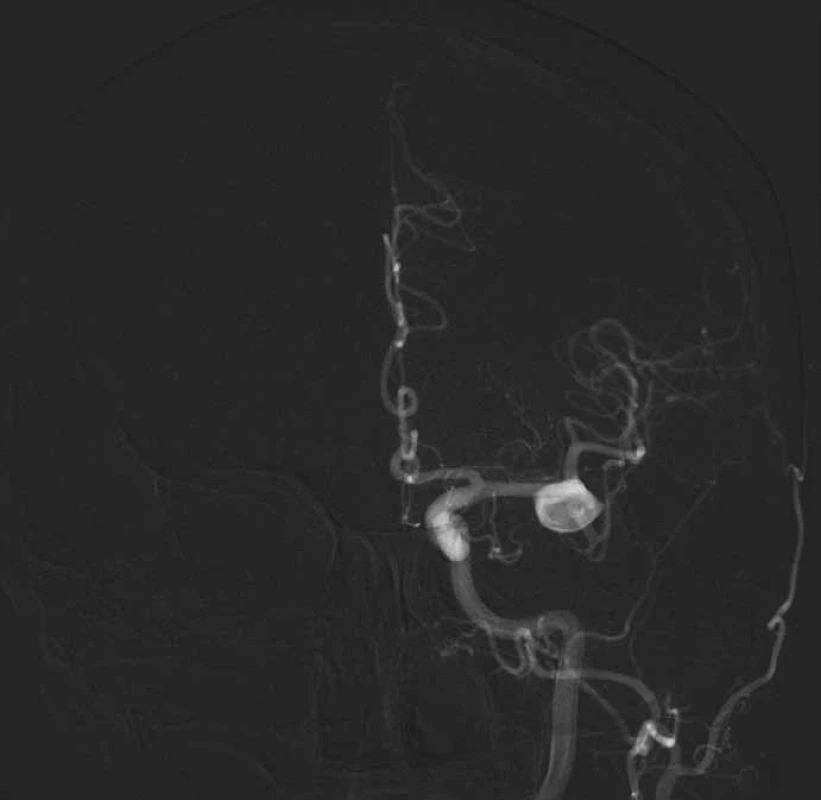
Operační nález
V poloze na zádech byla provedena pterionální kraniotomiie vlevo. Po otevření pleny bylo proniknuto direktně k výduti. Nejprve byly patrny obě větve M2. Na krčku v odstupu frontální větve M2 byla přítomna ateroskleróza a na temporální větvi M2 sklerotický plát 5 mm v odstupu od krčku. Vak byl komplexní a tlustostěnný. Krček nebyl vydefinován a splýval se širokým fundem (obr. 3). Flowmetrie před zaklipováním: temporální větev M2 35 ml/ min, frontální větev M2 22 ml/ min. Dočasný uzávěr kmene M1 2 × 5 min s intervalem uvolnění svorky na 5 min umožnil finální preparaci krčku a deliberaci perforujících lentikulostriátních tepének. Poté byl uzavřen krček výdutě klipem FE 760 Aesculap (obr. 4a). Kontrolní parametry flowmetrie byly příznivé s reperfuzním zvýšením toku: temporální větev M2 60 ml/ min, frontální větev M2 70 ml/ min.
Image 3. Peroperační nález aneuryzmatu. Krček není vydefinován a splývá se širokým fundem. 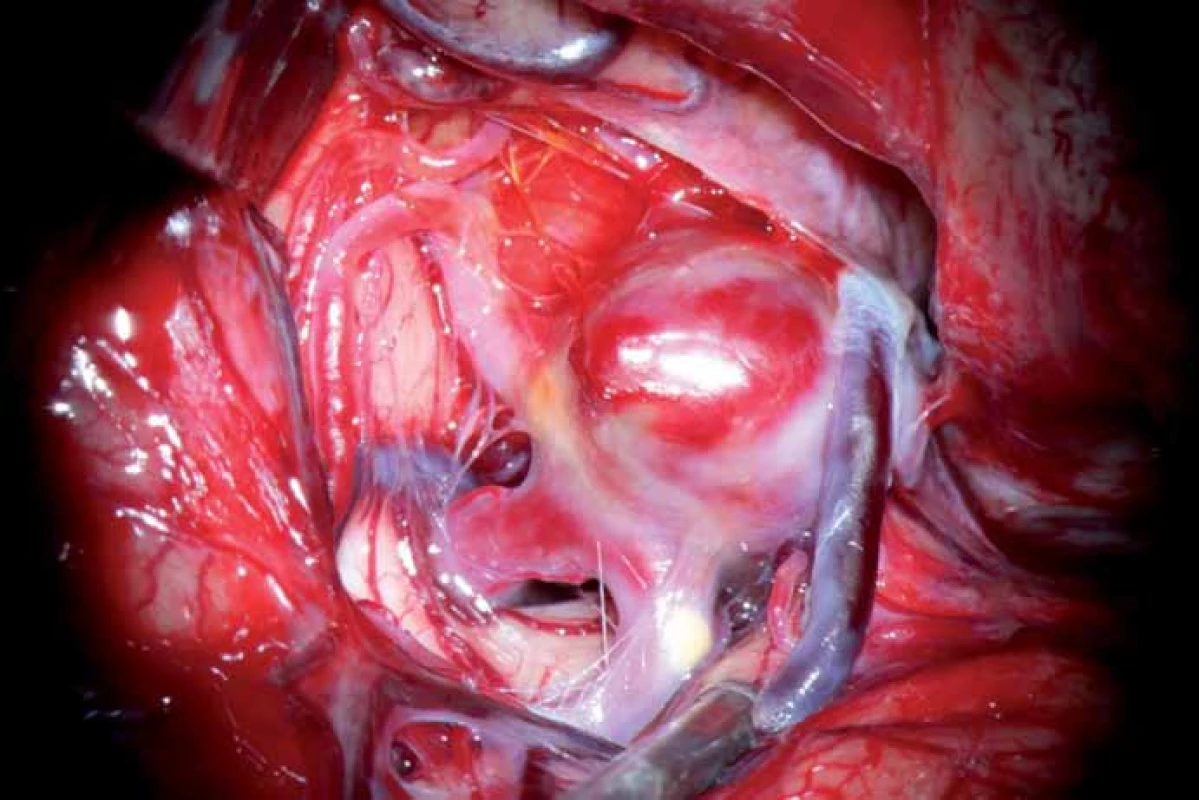
Obr. 4a) Stav po zaklipování krčku vaku. 
Obr. 4b) ICG videoangiografie s absencí kontrastu ve vaku. 
Obr. 5a) Krvácení po punkci vaku. 
Obr. 5b) Navazující ICG videoangiografie prokazuje plnění vaku kontrastem. 
V této fázi byla provedena videoangiografie s využitím indocyaninové zeleně (ICG videoangiografie) s dobrou průchodností kmene M1 a obou větví M2 a průkazem neplnění vaku (!) v plném časovém rozsahu ICG vyšetření včetně doby venózní fáze (obr. 4b).
Následně byl vak punktován. Krvácení z místa vpichu nepřestávalo a bylo zjevné, že svorka nevyřadila výduť z cirkulace (obr. 5a). Na opakované ICG videoangiografii bylo nově patrno plnění vaku kontrastem včetně úniku punkčním otvorem mimo vak (obr. 5b). Proto byl přidán klip FE 760 – nadále docházelo k průsaku krve po opakované punkci vaku. Byl doplněn klip FE 660, trvalo prosakování krve mimo vak. Nakonec byl aplikován na stěnu vaku 2krát klip FE 750 (obr. 6). Prosakování již nenastávalo. ICG videoangiografie byla negativní. Pooperační průběh byl zpočátku bez komplikací, nicméně po kontrolní angiografii (3. pooperační den) vznikla lehká centrální pravostranná hemiparéza a smíšená fatická porucha. Klinická symptomatologie ustoupila během 24 hod a pacientka byla propuštěna v dobrém stavu domů. Kontrolní DSA potvrdila vyřazení výdutě z cirkulace (obr. 7).
Image 4. Vyřazení výdutě z cirkulace pěti klipy. 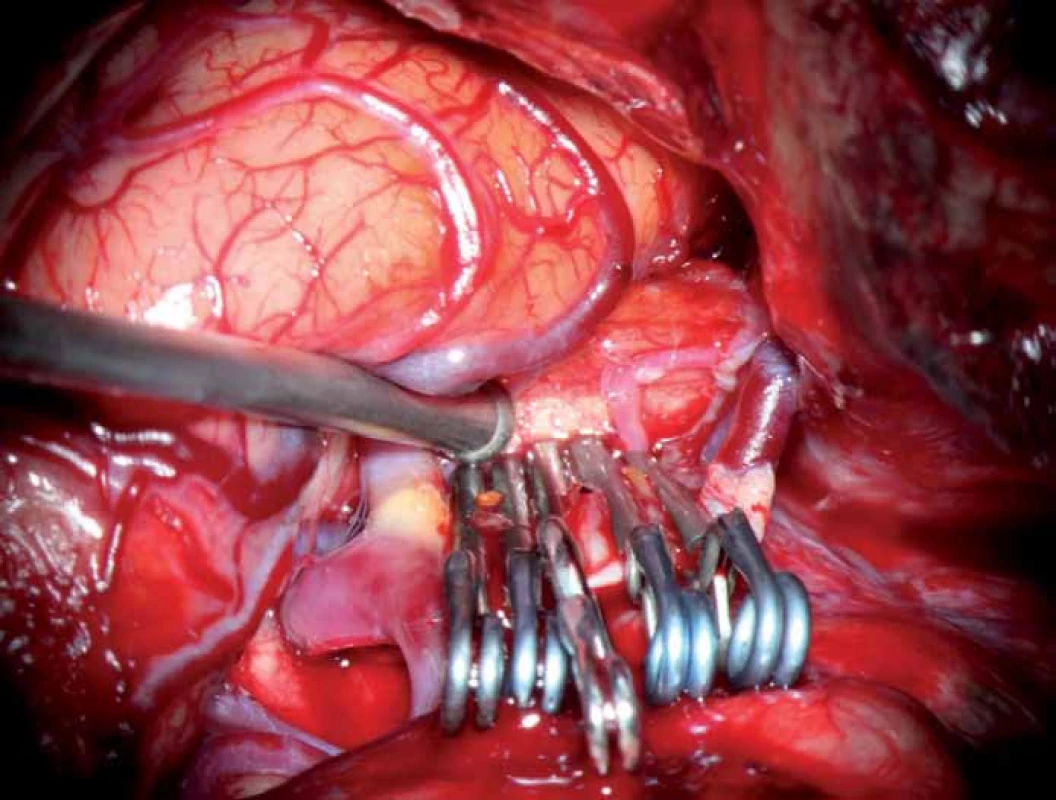
Image 5. Příznivá pooperační angiografie bez plnění vaku. 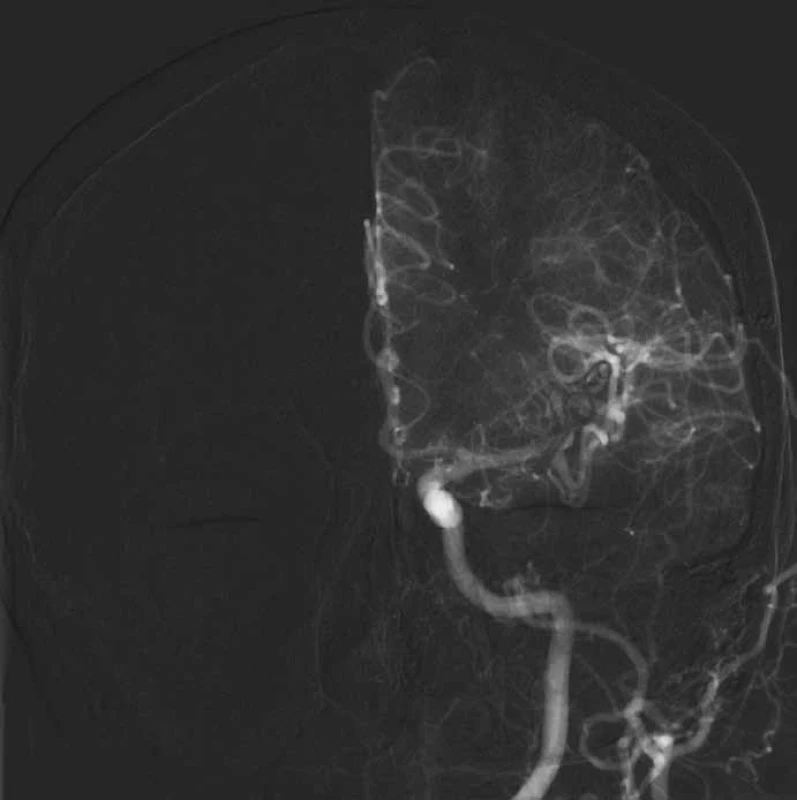
Diskuze
Riziko reziduálního plnění zasvorkovaného aneuryzmatu se pohybuje mezi 2 a 8 % a riziko okluze/ stenózy magistrální tepny v intervalu 4 – 12 %, jak vyplývá z pooperačních angiografických kontrol [5 – 8]. Proto bylo žádoucí zavedení rychlé, jednoduché a především spolehlivé metody peroperační kontroly správné aplikace klipu. Tyto požadavky z velké míry naplnila ICG angiografie. Využití ICG videoangiografie v cerebrovaskulární chirurgii bylo poprvé publikováno Raabem v roce 2003 [2]. Ve velmi krátké době došlo k jejímu širokému uplatnění v neurochirurgické obci [3,9]. Kromě operací aneuryzmat byla prokázána užitečnost metody v operativě arteriovenózních malformací, kde lze identifikovat přívodné tepny, drénující žíly a tepny „en passage“, a dále při hodnocení průchodnosti mozkových bypassů [10,11]. Murai et al využili ICG videoangiografii k odlišení přívodných tepen a drénujících žil při operacích hemangioblastomů [12].
Předností ICG videoangiografie při operacích aneuryzmat je vysoká spolehlivost spojená s uživatelskou přívětivostí. Raabe et al srovnávali prospektivně ICG videoangiografii s peroperační a pooperační DSA u 114 pacientů. Nedostatečně kvalitní ICG zobrazení zaznamenali ve 4,3 %. Příčinou bylo difuzní krvácení v operačním poli, hluboko uložené aneuryzma s omezením zorného pole a aterosklerotické kalcifikace tepen. V 95,7 % byla kvalita zobrazení adekvátní. ICG vedla u 10 pacientů (9 %) k nutnosti korekce polohy klipu. V šesti případech šlo o reziduální plnění vaku, u tří pacientů o okluzi/ stenózu magistrální tepny a v jednom případě o okluzi perforátorů. Korelace mezi ICG a peroperační a pooperační DSA nastala v 90 % případů. V případě neshody se obvykle jednalo o hemodynamicky nevýznamnou stenózu magistrální tepny, nalezenou na DSA, bez klinického dopadu a nutnosti operační revize. Ve dvou případech bylo na DSA zjištěno reziduum vaku. V obou případech byla zvolena observace. Autoři zdůraznili výhody ICG ve srovnání s DSA. Ocenili rychlost, jednoduchost a bezpečnost provedení ICG ve srovnání s DSA. Další předností byla vysoká rozlišovací schopnost, která umožnila zobrazit i perforující arterie. Nevýhodu ICG viděli v nemožnosti vyloučit reziduum vaku, pokud se nachází mimo zorné pole (např. zakryto svorku, koagulem, mozkovou tkání). Limit vyšetření ICG je i v případě tlustostěnných, sklerotických stěn vaku a cév, u kompletně trombózovaných výdutí a zejména u gigantických aneuryzmat. Tam je DSA metodou volby [3]. Dashti et al hodnotili patentnost větví a reziduum vaku po klipingu u 190 pacientů s 239 ošetřenými výdutěmi. Reziduum vaku nalezli v 6 % a okluzi magistrálních tepen v 6 % případů při hodnocení na pooperační CT angiografii. ICG hodnotí jako nevhodnou u gigantických a hluboko uložených výdutí. Mimořádně kladně naopak hodnotili možnost zobrazení perforátorů a možnost pečlivého opakovaného hodnocení smyčky záznamu k vyloučení retrográdního toku nebo reziduální fluorescence [9].
Přesnější hodnocení ICG poskytuje grafická analýza intenzity fluorescence v časové závislosti (FLOW 800). Vyšetření diagramu odliší reziduální plnění od zbytkové fluorescence v případě krátkého intervalu opakovaného podání. Druhý případ nevyžaduje chirurgickou korekci [13]. Další zlepšení přináší využití endoskopu při ICG videoangiografii. Přidaná hodnota metody spočívá v zobrazení perforátorů mimo zorné pole mikroskopu [14]. Technika je zatím ve fázi experimentální.
Mery et al zaznamenali dva případy, kdy ICG videoangigrafie falešně určila vyřazení výdutě z cirkulace. V obou případech punkce vaku způsobila extravazaci a nález si vyžádal repozici klipu. Nález u prvního pacienta byl hodnocen jako inkompletní kliping širokého krčku za obtížné vizualizace. Ve druhém případě byl v oblasti krčku přítomen sklerotický plát, který znemožnil kompletní uzávěr. Autoři doporučují incizi vaku po zaklipování. V prvním případě jde selhání metody zjevně na vrub omezení vyplývajících z hodnocení omezeného zorného pole. Autoři nicméně nepodávají vysvětlení, proč nenastalo plnění vaku kontrastem při inkompletním klipingu ve druhém případě [4]. Následný osud výdutě v případě minimálního reziduálního plnění je nejistý. Může dojít k definitivní trombóze ve vaku, ale zrovna tak může dojít k růstu a následné ruptuře. Takto byl dokumentován případ růstu gigantického aneuryzmatu vertebrální tepny po Hunteriánské ligatuře s opakovanými negativními nálezy na DSA [15].
U naší pacientky jsme měli při ICG videoangiografii dokonalé zobrazení zorného pole u povrchně uložené výdutě. Krček vaku byl široký, stěna tlustá s přítomným plátem. Síla uzávěru svorky nejspíše nebyla dostatečná. Nicméně vak se kontrastem neplnil. Lze spekulovat, zda by nám diagram intenzity fluorescence poskytl doplňující informaci o reziduálním plnění vaku.
Důvod selhání ICG videoangiografie není zcela jednoznačně vysvětlitelný. Nabízíme toto hypotetické vysvětlení: tlak ve výduti byl v okamžiku zasvorkování stejný jako v přívodné tepně. Při minimální komunikaci tedy krev neproudila a kontrast se nestačil za krátký čas oběhu kontrastu v krvi difuzí do výdutě dostat. Po perforaci vaku byl tlak v perforované výduti nulový, a krev s kontrastem tedy i při minimální komunikací mohla proudit do výdutě v dostatečném množství pro následnou detekci na ICG videoangiografii.
Závěr
ICG videoangiografie u naší pacientky s velkou výdutí střední mozkové tepny falešně určila vyřazení výdutě z oběhu klipem při reziduálním plnění. Autoři na základě této zkušenosti proto doporučují paušální otevření vaku po okluzi klipem bez ohledu na nález ICG videoangiografie.
Autoři deklarují, že v souvislosti s předmětem studie nemají žádné komerční zájmy.
Redakční rada potvrzuje, že rukopis práce splnil ICMJE kritéria pro publikace zasílané do biomedicínských časopisů.
MUDr. Vladimír Přibáň, Ph.D
Neurochirurgické oddělení LF UK a FN Plzeň
Alej Svobody 80
304 60 Plzeň
e-mail: v.priban@centrum.cz
Přijato k recenzi: 31. 5. 2013
Přijato do tisku: 29. 7. 2013
Sources
1. Yasargil MG. Microneurosurgery. Vol. II. Stuttgart. New York: Georg Thieme Verlag 1984.
2. Raabe A, Beck, J, Gerlach R, Zimmermann M, Seifert V. Near ‑ infrared indocyanine green video angiography: a new method for intraoperative assessment of vascular flow. Neurosurgery 2003; 52(1): 132 – 139.
3. Raabe A, Nakaji P, Beck J, Kim LJ, Hsu FPK, Kamerman JD et al. Prospective evaluation of surgical microscope ‑ integrated intraoperative near ‑ infrared indocyanine green videoangiography during aneurysm surgery. J Neurosurg 2005; 103(6): 982 – 989.
4. Mery FJ, Amin‑Hanjani S, Charbel FT. Is angiographically obliterated aneurysm always secure? Neurosurgery 2008; 62(4): 979 – 982.
5. Feuerberg I, Lindquist C, Lindquist M, Steiner L. Natural history of postoperative aneurysm rest. J Neurosurg 1987; 66(1): 30 – 34.
6. Macdonald RL, Wallace MC, Kestle JR. Role of angiography following aneurysm surgery. J Neurosurg 1993; 79(6): 826 – 832.
7. Meyer B, Urbach H, Schaller C, Baslam M, Nordblom J, Schramm J. Immediate postoperative angiography after aneurysm clipping – implications for quality control and guidance of further management. Zentralbl Neurochir 2004; 65(2): 49 – 56.
8. Thorton J, Bashir Q, Aletich VA, Debrun GM, Ausmann JI, Charbel FT. What percentage of surgically clipped intracranial aneurysms have residual necks? Neurosurgery 2000; 46(6): 1294 – 1300.
9. Dashti R, Laakso A., Niemelä M, Porras M, Hernesniemi J. Microscope ‑ integrated near ‑ infrared indocyanine green videoangiography during surgery of intracranial aneurysms: the Helsinki experience. Surg Neurol 2009; 71(5): 543 – 550.
10. Snyder LA, Spetzler RF. Current indications for indocyanine green angiography. World Neurosurg 2011; 76(5): 405 – 406.
11. Balamurugan S, Agrawai A, Kato Y, Sano H. Intraoperative indocyanine green video‑angiography in cerebrovascular surgery: An overview with review of literature. Asian J Neurosurg 2011; 6(2): 88 – 93.
12. Murai Y, Adachi K, Matano F, Tateyama K, Teramoto A. Indocyanine green videoangiography study of hemangioblastomas. Can J Neurol Sci 2011; 38(1): 41 – 47.
13. Oda J, Kato Y, Chen SF, Sodhiya P, Watabe T, Imizu S et al. Intraoperative near ‑ infrared indocyanine green ‑ videoangiography (ICG ‑ VA) and graphic analysis of fluorescence intensity in cerebral aneurysm surgery. J Clin Neurosci 2011; 18(8): 1097 – 1100.
14. Nishiyama Y, Kinouchi H, Senbokuya N, Kato T, Kanemaru K, Yoshioka H et al. Endscopic indocyanine green video angiography in aneurysm surgery: an innovative method for intraoperative assessment of blood flow in vasculatuer hidden from microscopic view. J Neurosurg 2012; 117(2): 302 – 308.
15. Komotar RJ, Mocco J, Lavine SD, Solomon RA. Angiographically occult, progressively expanding, giant vertebral artery aneurysm. J Neurosurg 2006; 105(3): 468 – 471.
Labels
Paediatric neurology Neurosurgery Neurology
Article was published inCzech and Slovak Neurology and Neurosurgery

2013 Issue 6-
All articles in this issue
- Komorbidita migrény a deprese – metaanalytická studie
- Okulofaryngeální muskulární dystrofie v populaci České republiky
- Telemetrický monitoring intrakraniálního tlaku v diagnostice hydrocefalu a nitrolební hypertenze
- Zlomeniny kondylu okciputu
- Distální fuziformní aneuryzma arteria temporalis anterior – kazuistika
- Magnetická rezonance v diagnostice kraniotraumat – kazuistika
- Idiopatická herniace míchy – kazuistika
- Mnohočetné extraneurální metastázy anaplastického astrocytomu – kazuistika
- Maligní tumor z pochvy periferního nervu v oblasti cervikálního plexu – kazuistika
- Neurologické diagnózy v diferencované hospicové péči – dvě kazuistiky
- Idiopatická superficiální sideróza – kazuistika
- Tuberózní skleróza u dětí sledovaných od novorozeneckého věku pro prenatální nález rhabdomyomů srdce – dvě kazuistiky
- Spondylodiscitida s abscesy v paravertebrálních svalech způsobená Streptococcus suis – kazuistika
- Selhání peroperační videoangiografie s využitím indocyaninové zeleně při detekci uzávěru mozkového aneuryzmatu klipem – kazuistika
- Expanze pineální krajiny
- Frontotemporálna lobárna degenerácia z pohľadu nových klinicko‑patologických korelácií
- Postižení kognitivních funkcí v časných fázích roztroušené sklerózy
- Předoperační psychosociální proměnné jako prediktory výsledku operace zad
- Vplyv prostredia virtuálnej reality počas roboticky asistovaného lokomočného tréningu na motorické funkcie pacientov s detskou mozgovou obrnou
- Czech and Slovak Neurology and Neurosurgery
- Journal archive
- Current issue
- Online only
- About the journal
Most read in this issue- Frontotemporálna lobárna degenerácia z pohľadu nových klinicko‑patologických korelácií
- Tuberózní skleróza u dětí sledovaných od novorozeneckého věku pro prenatální nález rhabdomyomů srdce – dvě kazuistiky
- Expanze pineální krajiny
- Zlomeniny kondylu okciputu
Login#ADS_BOTTOM_SCRIPTS#Forgotten passwordEnter the email address that you registered with. We will send you instructions on how to set a new password.
- Career

