-
Medical journals
- Career
Expanze pineální krajiny
: P. Buchvald; P. Suchomel; V. Beneš lll; M. Kaiser; R. Fröhlich
: Neurochirurgické oddělení, Krajská nemocnice Liberec, a. s.
: Cesk Slov Neurol N 2013; 76/109(6): 667-678
: Minimonography
Oblast kvadrigeminální cisterny s přilehlými anatomickými strukturami, v jejímž centru se nachází glandula pinealis, je obecně označována jako pineální krajina. Seznam možných místních expanzí je vzhledem k významné cytologické heterogenitě této lokality poměrně široký. Začíná nezhoubnými pineálními cystami a končí vysoce zhoubnými nádory. Tumory, které je možné rozdělit zhruba do tří základních skupin, představují asi 1 % všech intrakraniálních nádorů. Nejpočetnější zastoupení mají germinální nádory. Pineální parenchymatózní nádory představují druhou skupinu a do třetí jsou řazeny ostatní nádory vyrůstající z tkání okolních anatomických struktur (gliomy, ependymomy, meningeomy, metastázy, dermoidní a epidermoidní cysty a další). Optimální léčba a prognóza může být stanovena pouze na základě jejich histologického vyšetření. Chirurgické řešení je vzhledem k centrální lokalizaci těchto lézí a jejich vztahu k životně důležitým nervovým a cévním strukturám velmi obtížné. Perioperační morbidita a mortalita byla v současné době významně redukována díky rozvoji mikrochirurgických technik. Také byla prodloužena doba přežití u maligních forem díky agresivní adjuvantní léčbě.
Klíčová slova:
glandula pinealis – nádory pineální krajiny – germinální nádory – pineální parenchymatózní nádory – chirurgické přístupy – radioterapie – chemoterapieÚvod
Vzhledem k významné buněčné rozmanitosti přítomných tkání je v pineální krajině možné očekávat celou škálu patologických expanzí počínaje benigními cystami a konče vysoce maligními nádory s velmi špatnou prognózou. Od expanzivních procesů je třeba v rámci diferenciální diagnostiky odlišit cévní léze, především aneuryzmatické malformace Galenovy žíly, jejichž problematika překračuje rámec této minimonografie. Hluboká centrální lokalizace expanzí a jejich vztah k životně důležitým strukturám a velkým cévním komplexům logicky odůvodňují, proč byly počáteční snahy o jejich chirurgické řešení spojeny s neúnosnou až 90% mortalitou. Teprve zavedení operačního mikroskopu do neurochirurgické operativy v 70. letech 20. století a dále rozvoj bioptických technik, endoskopie, neuroanestezie a neurointenzivní péče vedly k významnému zlepšení výsledků chirurgické léčby.
Anatomie
Pineální krajina (PK) odpovídá anatomicky oblasti kvadrigerminální cisterny, která je kraniálně ohraničena kalózním spleniem a tela chorioidea III. mozkové komory, kaudálně čtverohrbolím tekta mezencefala (lamina tecti s colliculi superiores et inferiores quadrigemini), ventrálně se otevírá do zadní partie III. mozkové komory a dorzálně se klene vermis mozečku. Boční stěny tvoří pulvinary thalamů a parahipokampální gyry (obr. 1). Pod spleniem se směrem k sinus rectus obloukovitě vine vena cerebri magna (Galeni, VMG), která vzniká soutokem čtyř magistrálních žil, rostrálních vv. cerebri internae a kaudálních vv. basales Rosenthali. Dále do ní ústí párové vv. occipitales posteriores a nepárová vena precentralis cerebelli (obr. 2). Tepenné zásobení oblasti zajišťují větve arteria cerebri posterior, především kvadrigeminální, thalamická, postero‑mediální a postero‑laterální chorioideální arterie, které anastomozují navzájem i se stejnojmennými tepnami druhé strany. Centrem oblasti je glandula pinealis (šišinka, epifýza, GP), jež představuje dorzálně směřující 5 – 8 mm výchlipku mezimozku rostrodorzálně nad colliculi superiores mezencefala [1,2].
1. Anatomický pohled na pineální krajinu zezadu. 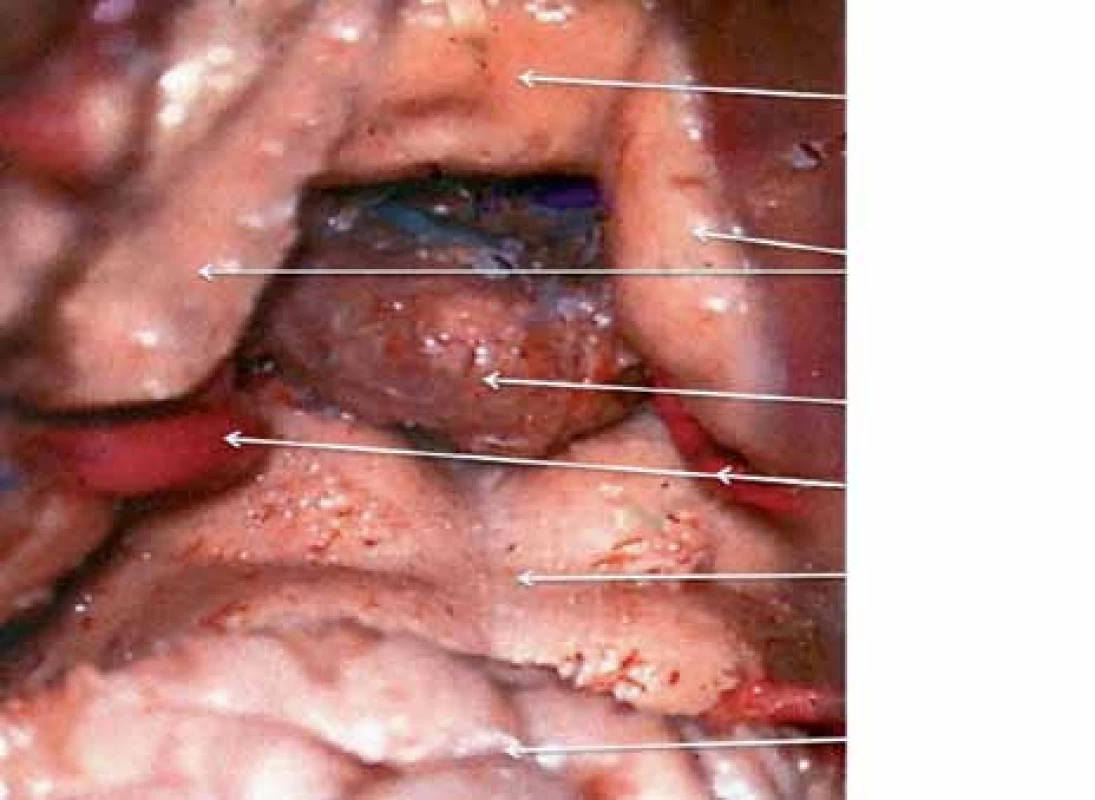
2. Zadní pohled na cévy pineální krajiny. 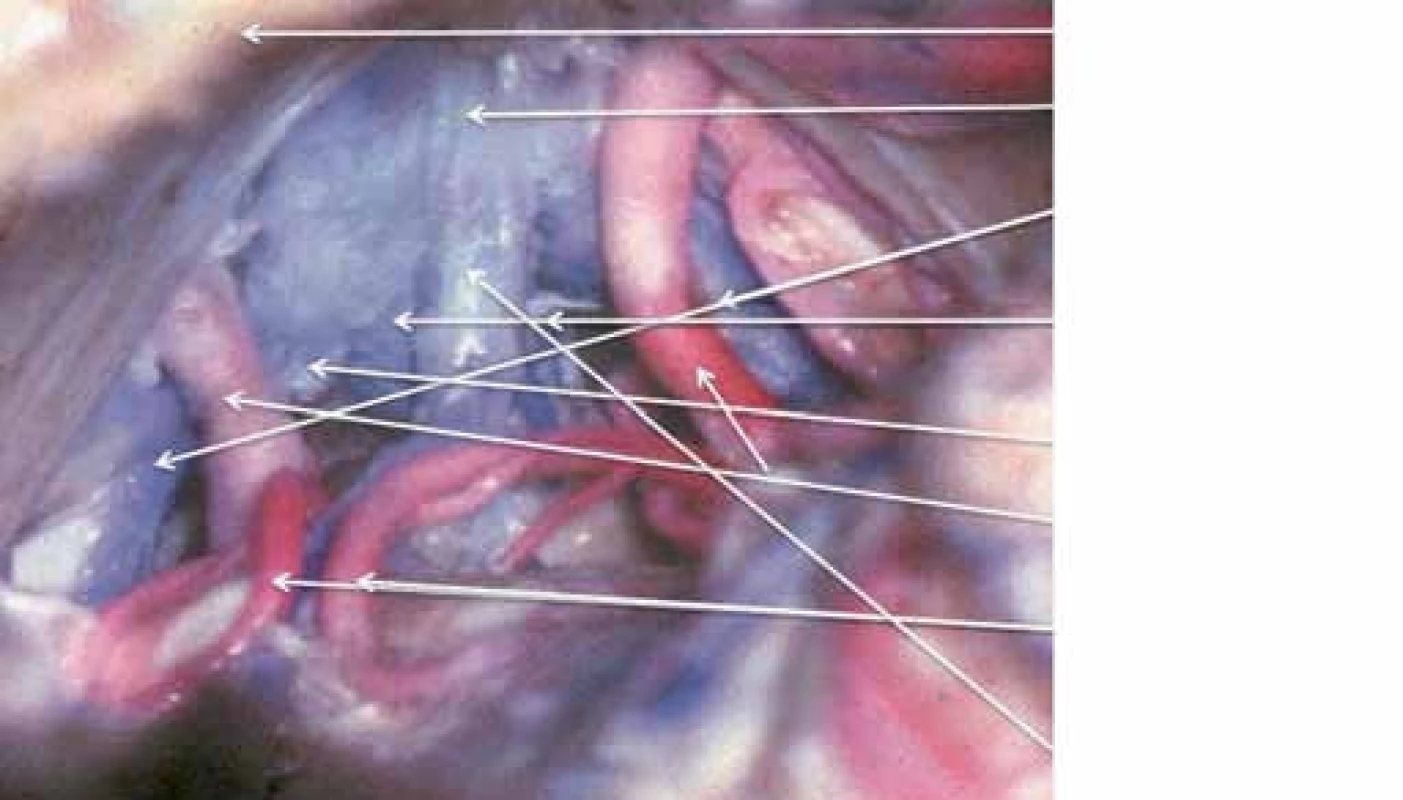
Epidemiologie a klasifikace
Zatímco nenádorové pineální cysty tvoří poměrně častý nález, který se vyskytuje zcela náhodně asi v 10 % všech grafických vyšetřeních mozku magnetickou rezonancí (MR) [3], nádory pineální krajiny jsou relativně vzácné. V dětském věku představují 3 – 8 % všech mozkových nádorů, v dospělosti pak tato hodnota klesá pod 1 % [4 – 6]. Z hlediska patologického spektra je možné nádory PK rozdělit do tří skupin, přehledně uspořádaných s ostatními expanzemi v tab. 1.
1. Přehled nádorových a nenádorových expanzí majících vztah k pineální krajině [3]. Procento vyjadřuje zastoupení mezi nádory CNS, případně v rámci konkrétní skupiny. ![Přehled nádorových a nenádorových expanzí majících vztah k pineální krajině [3]. Procento vyjadřuje zastoupení mezi nádory CNS, případně v rámci konkrétní skupiny.](https://www.prolekare.cz/media/cache/resolve/media_object_image_small/media/image/0ec4138119ee03322f051c441bd10f83.png)
Patofyziologie a klinické příznaky
Glandula pinealis je žláza s vnitřní sekrecí, která vzniká ve druhém gestačním měsíci jako výchlipka diencefalického stropu III. mozkové komory. Je tvořena pinealocytickými buňkami produkujícími hormon melatonin, jehož sekrece je závislá na diurnálním rytmu. K maximu vylučování dochází během spánku, naopak světlo jeho tvorbu snižuje. Nejčastější známkou hormonální poruchy bývá u dětí předčasná puberta, která je pravděpodobně vyvolána útlumem antigonadotropního působení žlázy, případně ektopickou produkcí pohlavních hormonů. Vzácněji se vlivem útlaku hypothalamo ‑ hypofyzární osy může vyskytovat diabetes insipidus či hypogonadizmus [3]. Vedle endokrinních poruch se symptomatické expanze pineální krajiny mohou projevovat nespecifickými bolestmi hlavy, epileptickými záchvaty a dále příznaky vyvolanými útlakem okolních mozkových struktur. Blokádou odtoku moku ze III. mozkové komory do Sylviova mokovodu vzniká obstrukční hydrocefalus se symptomy nitrolební hypertenze (cefalea, nauzea, zvracení, porucha vědomí). Útlakem čtverohrbolí dochází k rozvoji Parinaudova syndromu charakterizovaného obrnou pohledu vzhůru, poruchou konvergence, fotoreakce a akomodace. Přímá komprese vermis mozečku rezultuje v mozečkový syndrom (ataxie, dysmetrie, hypotonie). Vzdálené implantační metastázy maligních nádorů v páteřním kanále mohou být spojeny s různým stupněm poruchy hybnosti a čití.
Přehled jednotlivých nádorových skupin
1. Germinální nádory (nádory ze zárodečných buněk)
Germinální nádory (GN) jsou s výjimkou vyzrálých dobře diferencovaných teratomů vysoce maligní expanze s tendencí k likvorovému a hematogennímu rozsevu. Vyskytují se převážně v dětském a mladším dospělém věku, přičemž v pineální oblasti postihují více mužské pohlaví (2 : 1). Jejich další predilekční výskyt v supraselární oblasti má naopak převahu u žen [7]. Geograficky je z dosud neznámých důvodů udáván 3 - až 5krát vyšší výskyt v asijských zemích [8]. Grafické CT a MR nálezy nejsou natolik specifické, aby jednotlivé nádorové typy bylo možné diagnostikovat bez histologického vyšetření. Detekce zvýšených hladin některých nádorových markerů v krevním séru a likvoru předznamenává některý secernující typ GN (tab. 2) [9]. Vyšetřením jejich hladiny před operací a po operaci jsou také získány výchozí hodnoty umožňující predikci recidivy nádorového růstu.
2. Hladiny onkologických markerů u jednotlivých germinálních nádorů v séru a moku. Alfa-fetoprotein je glykoprotein fyziologicky produkovaný buňkami fetálního žloutkového váčku. Beta-humánní choriogonadotropin je glykoprotein secernovaný placentárními trofoblastickými buňkami. Placentární alkalická fosfatáza je izoenzym exprimovaný v placentárním syncitiotrofoblastu. Jejich průkaz v nádorových buňkách je možné stanovit imunohistochemicky. 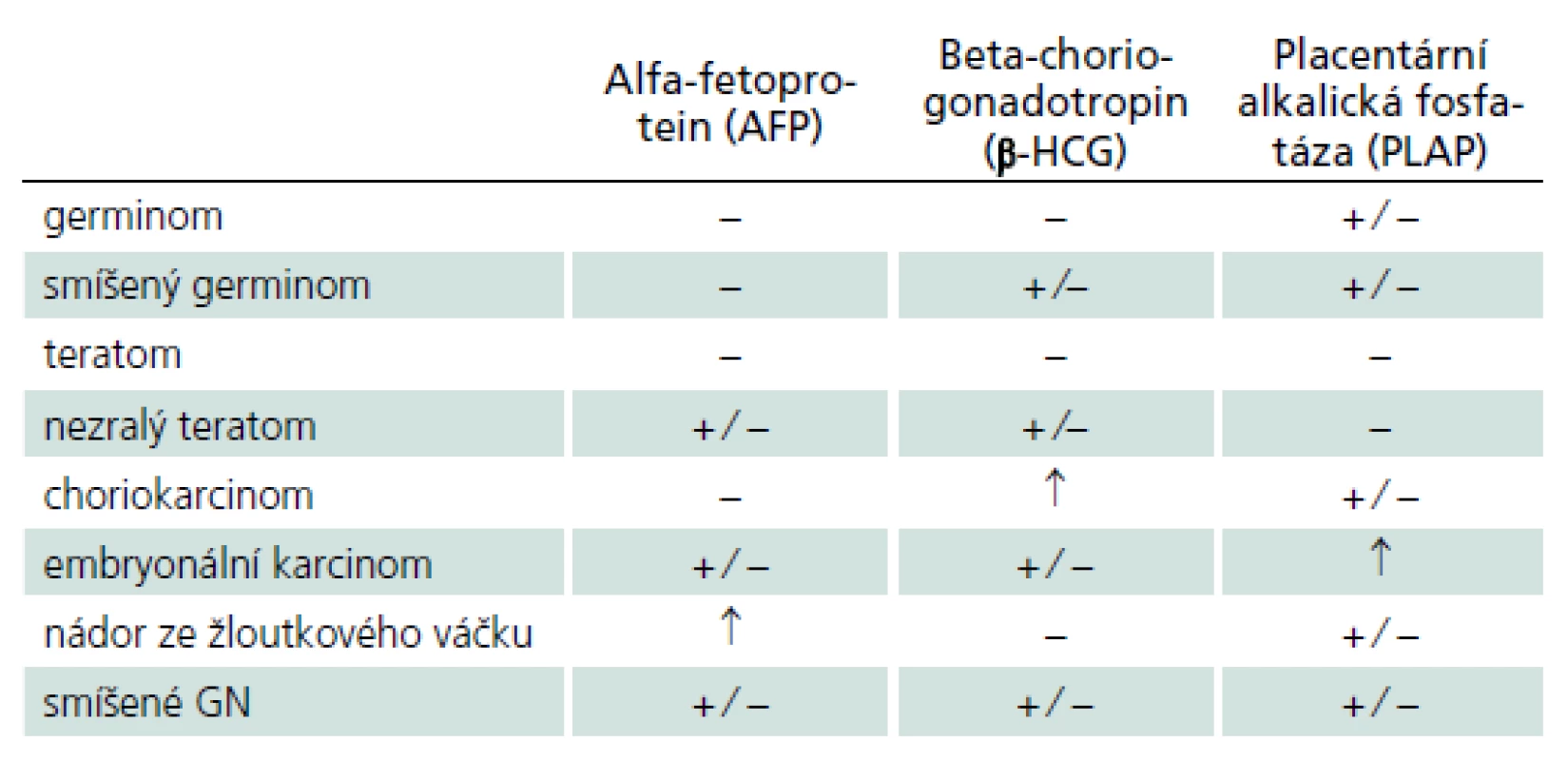
1.1. Germinom
Germinom, někdy také označovaný jako extragonadální seminom mužů nebo dysgerminom žen, je nejčastější nádor PK (50 %) s hlavní incidencí ve druhé dekádě života. Neuraxiální moková diseminace je udávána okolo 10 – 20 % v době stanovení diagnózy [10]. Z onkomarkerů může být patrné zvýšení placentární alkalické fosfatázy (PLAP) [11]. Germinomy mají o něco lepší prognózu než ne ‑ germinomatózní nádory a jsou dobře citlivé na léčbu frakcionovaným zářením. Ta může být zcela postačující z hlediska dlouhodobé kontroly nádorového růstu [12,13]. Někteří autoři ale preferují bezpečné chirurgické odstranění nádoru, případně jeho zmenšení (cytoredukci) jako iniciální krok zvyšující efektivitu adjuvantní léčby [14]. Pokud jsou odhaleny implantační metastázy, je třeba přistoupit k ozáření celé kraniospinální osy. Podle různých studií se 10leté přežití udává v 65 – 90 % případů [12,14]. U dětí je snaha snížit riziko postiradiačních komplikací redukcí dávky záření (minimální účinná dávka je 50 Gy) a zvýšené riziko recidivy nádorového růstu eliminovat pomocí kombinace s chemoterapií (kombinace PEI – platina, etopozid, ifosfamid) [15 – 17]. U dětí do tří let věku je vzhledem k riziku závažné postiradiační poruchy vývoje preferována pouze chemoterapie.
1.2. Ne ‑ germinomatózní germinální nádory (NGGN)
1.2.1. Teratom
Teratomy tvoří asi 15 % všech nádorů PK s převahou výskytu v dětství a u mladých dospělých, přičemž z hlediska sexuální predilekce jsou o něco častější u mužů [7]. Mohou se nacházet v různém stupni diferenciace – od zralých až po velmi nezralé, agresivně rostoucí malignity. Zralý teratom je ohraničený, dobře diferencovaný nezhoubný nádor složený z komponent všech tří embryonálních zárodečných vrstev (ektodermu – přítomny elementy kůže a mozku; mezodermu – kost, chrupavka, tuk, sval; endodermu – kousky epitelu plic, střev aj.). Nezralý teratom (teratokarcinom) obsahuje jak diferencované tkáně, tak nediferencované embryonální elementy s vysokým růstovým potenciálem a ojediněle se zcela nespecificky zvýšenou sekrecí alfa‑fetoproteinu (AFP). Metodou léčby je u zralých teratomů radikální resekce s nadějí na 10leté přežití u 80 – 93 % pacientů [12]. U maligních forem je preferovaná metoda léčby maximální bezpečná resekce nádoru s následným ozářením a chemoterapií, kdy 10leté přežití je uváděno podle různých studií mezi 45 a 85 % [12,14,18].
1.2.2. Choriokarcinom
Jedná se o nádorové bujení buněk extraembryonální trofoblastové řady s typickou produkcí choriového gonadotropinu (b ‑ HCG) a placentárního laktogenu (PL). Nádor je vysoce maligní s tendencí k systémovému metastazování, především do jater a plic. Relativně typickým grafickým znakem bývají známky proběhlého krvácení uvnitř nádoru.
1.2.3. Embryonální karcinom
Je vzácný vysoce maligní nádor z nezralých embryonálních buněk s časnou systémovou generalizací. Mezi nádory ze zárodečných buněk se vyznačuje nejnižším stupněm diferenciace a často bývá složkou smíšených forem GN. Zvýšení hladin AFP a b ‑ HCG je spíše ojedinělé, může být zvýšena sekrece PLAP [13].
1.2.4. Nádor ze žloutkového váčku (nádor endodermálního sinu, yolk sac tumor)
Extraembryonální forma nádorového růstu cytologicky připomínající endodermální buňky žloutkového váčku s charakteristickou produkcí AFP [19]. Nádor má vysoce maligní povahu a často se vyskytuje ve smíšených formách s ostatními GN.
Názory na léčbu maligních NGGN (s výjimkou zralého teratomu) se různí a dosud nebyl přijat obecně uznávaný léčebný protokol. Citlivost NGGN na samostatnou iradiaci je výrazně nižší než u germinomů [7,20,21]. V řadě evropských zemí je v současné době preferován protokol podle SIOP CNS ‑ GCT 96 studie [15], kdy po čtyřech cyklech chemoterapie (PEI: carbo ‑ platina, etopozid, ifosfamid) následuje bezpečná resekce a poté fokální radioterapie. V případě mokové diseminace se ještě doplňuje kraniospinální ozáření. Pětileté přežití je deklarováno u 20 – 75 % pacientů [12,14,15,17]. U smíšených GN závisí prognóza na objemu maligní složky a po komplexní terapii je tříleté přežití dle studií uváděno v širokém rozmezí 10 – 94 % [12,17,22].
2. Pineální parenchymatózní nádory (PPN)
Nádory vyrůstající z pinealocytárních buněk vlastní tkáně GP tvoří přibližně 15 % všech nádorů PK. WHO klasifikace definuje tři typy těchto lézí [23].
2.1. Pinealocytom
Pinealocytom se zastoupením asi 45 % mezi PPN představuje benignější typ nádoru (WHO gr. II) postihující převážně mladé dospělé. Může se ovšem vyskytovat v kterémkoliv věku bez významné sexuální predispozice [24]. Jedná se o dobře diferencovaný ohraničený tumor s pomalou růstovou aktivitou a téměř bez tendence k tvorbě implantačních metastáz. Léčba spočívá v radikální resekci nádoru s udávaným pětiletým přežitím v 86 – 91 % případů [12,14]. K lokální iradiaci (50 – 55 Gy) nebo radiochirurgické léčbě gama nožem jsou určena jeho pooperační rezidua či recidivy růstu. Reyns et al, Hasegawa et al a Kano et al ale konstatují, že radiochirurgie může být i efektivní samostatná léčebná modalita v terapii pineocytomů [25 – 27].
2.2. Pineální tumor středního stupně diferenciace
Tvoří meziskupinu mezi benigní a maligní variantou (WHO gr. II a III) se zastoupením asi 10 % mezi PPN. Léčebný protokol zatím není jednoznačně stanoven. U II. stupně rozhodnutí o pooperační iradiaci záleží na velikosti rezidua, u III. stupně by vždy po maximální bezpečné resekci mělo následovat ozáření a chemoterapie [28]. Lutterbach et al uvádějí přežití pěti let u 80 % a 10 let u 72 % pacientů [29].
2.3. Pinealoblastom
Pinealoblastom, jehož výskyt mezi PPN je asi 45 %, je vysoce maligní varianta (WHO gr. IV) převážně postihující děti a mladé dospělé bez pohlavní predominance. Histologicky je řazen spolu s meduloblastomem, retinoblastomem, neuroblastomem aj. do skupiny primitivních neuroektodermálních nádorů (PNET) [23]. Tyto agresivně rostoucí expanze časně metastazují mokem i krevní cestou. Cílem léčby je maximální bezpečná resekce, následovaná iradiací a chemoterapií (obr. 3a–f). Citlivost k adjuvanci je u pineoblastomu o něco nižší než u germinálních nádorů. Z chemoterapeutik jsou používány různé kombinace vinkristinu, lomustinu, platiny, cyklofosfamidu, aktinomycinu D a metotrexátu [30]. Prognóza je obecně nepříznivá. Podle Konovalova et al i jiných autorů je roční přežití asi u 88 %, pětileté u 44 – 58 % a 10leté u 0 – 23 % léčených pacientů [14, 31].
3. Pineoblastom. Obr. 3a) MR v transverzální rovině řezu. Obr. 3b) MR v sagitální rovině řezu. Obr. 3c) Peroperační pohled na tumor. Obr. 3d) Pohled do III. komory po exstirpaci nádoru. Obr. 3e) Pooperační MR kontrola. Obr. 3f) Implantační metastáza v levé postranní komoře detekovaná s odstupem jednoho roku po operaci. 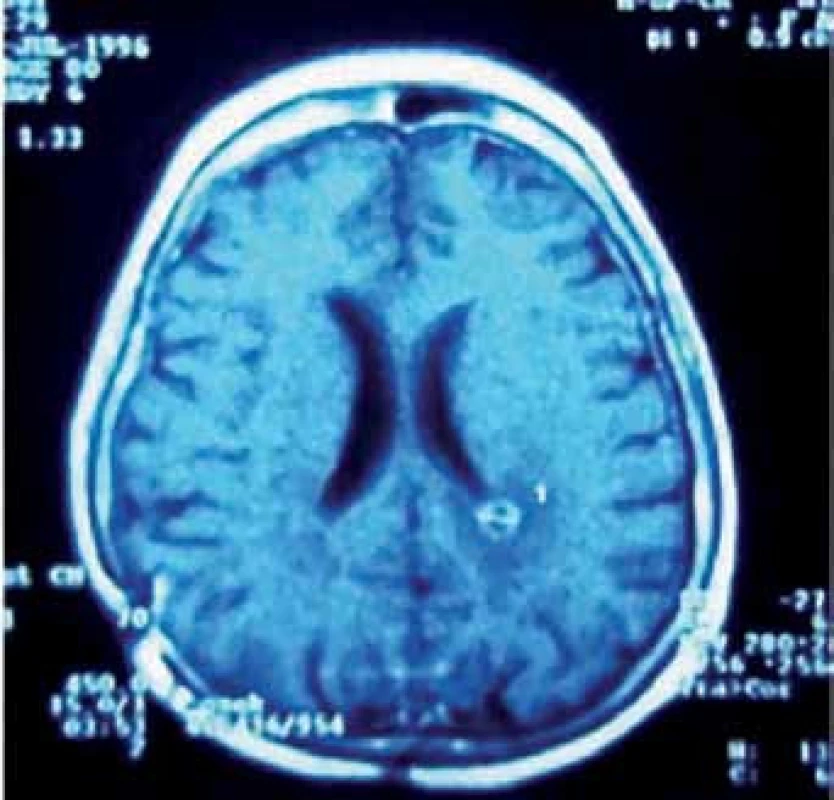
3. Ostatní nádory pineální krajiny
3.1. Papilární tumor pineální krajiny
Poměrně vzácný nádor popsaný Jouvetem až v roce 2003 a zařazený do WHO klasifikace v roce 2007 [23,32]. Vyrůstá z ependymocytů v linii zadní komisury a bývá někdy obtížně odlišitelný od jiných nádorů PK. Na stupnici malignity je označován jako stupeň II. V léčbě se doporučuje maximální bezpečná resekce a pooperační iradiace, o níž se stále diskutuje. Vzhledem k tendenci nádoru recidivovat se jeví jako zcela opodstatněná [33,34]. Pětileté přežití je možné očekávat u 73 % pacientů [32].
3.2. Gliomy a ependymomy
Gliomy a ependymomy tvoří početnější skupinu nádorů PK, u dětí dokonce druhou nejčastější (až 30 %), s poměrem zhruba 3 : 1 v neprospěch ependymomů.
Gliomy vyrůstají z gliálního stromatu GP (často cystické) nebo z neurogliální tkáně struktur přilehlých k PK (spíše solidní). Z histologického hlediska jde o nízkostupňové i vysokostupňové formy od pilocytického astrocytomu až po glioblastom. Ependymomy pocházejí z výstelky III. mozkové komory. Názory na léčbu gliálních nádorů nejsou zcela jednotné. U malých nádorů bez závažné symptomatologie obecně převládá názor upřednostnit observaci (řešit pouze hydrocefalus zkratovou operací) a teprve při známkách progrese růstu expanze provést stereotaktickou či endoskopickou biopsii s následným ozářením a chemoterapií podle histologického nálezu [35,36]. Konovalov et al ovšem referovali velmi dobré výsledky u chirurgické resekce high-grade gliomů s jejich následným ozářením, kdy pětileté přežití bylo zaznamenáno u 80 % a 10leté u 50 % případů. Dodává dále, že gliomy vycházející z GP mají lepší naději na radikálnější resekci vzhledem k lepšímu ohraničení proti okolním strukturám ve srovnání s gliomy vycházejícími z okolní neuroglie [14].
3.3. Meningeomy
Meningeomy vykazují po radikálním odstranění velmi dobrou prognózu. Jejich růst vychází nejčastěji z falko ‑ tentoriálního úhlu nebo ze zadního okraje tentoriální incisury. Vzhledem k tomu, odkud expandují, bývá jejich typická pozice kraniálně nad hlubokým žilním systémem. Kompletní resekce je někdy nesnadná až nemožná pro pevné adheze pouzdra k venóznímu komplexu. Vzhledem k benigní povaze nádoru není správné riskovat poranění s fatálními následky [37].
3.4. Dermoidní a epidermoidní cysty
Dermoidy jsou v této středočárové oblasti mnohem častější než epidermoidy. Jedná se o benigní expanze rostoucí ze zbytků ektodermálních buněk kdekoliv v CNS. Radikální odstranění celého útvaru včetně pouzdra je někdy obtížné vzhledem k jeho pevným srůstům s mozkovými a cévními strukturami [38]. Po letech proto není vyloučena možnost jejich lokální recidivy. Na CT jsou tyto cysty typicky výrazně hypodenzní, na MR v T1 obraze hypointenzní a v T2 typicky výrazně hyperintenzní.
3.5. Metastázy
Vzhledem k absenci hematolikvorové bariéry je GP jedním z predilekčních míst sekundárního výsevu vzdálených maligních nádorů. Jejich léčba závisí na zhodnocení rozsahu generalizace. Jedná‑li se o solitární metastázy, je metoda volby stereorataktická radiochirurgie [39]. V případě dobře kontrolovaného onemocnění a dobré kondice pacienta je na zvážení i otevřená intervence.
Z dalších nádorů se v PK vzácně může vyskytovat papilom chorioideálního plexu, jenž se projevuje nejčastěji obstrukcí mokových cest. Jeho radikální resekce vede obvykle k úplnému vyléčení [40]. Lipom, pokud nevede k hydrocefalu, je spíše určen k observaci. Raritní je výskyt pineálního lymfomu [41] a některých dalších nádorů, jejichž manifestaci dokumentují pouze ojedinělé kazuistiky [42 – 44]. Nenádorové asymptomatické pineální a arachnoideální cysty by měly být sledovány. Pokud vedou k hydrocefalu či jiné symptomatologii, je nutné přistoupit k endoskopickému nebo otevřenému řešení, případně zkratové operaci [45].
Současné principy diagnostiky a léčby NPK, algoritmus postupu
Zjednodušený algoritmus postupu diagnostiky a léčby NPK je uveden na schématu (tab. 3). Pacienti s příznaky nitrolební hypertenze musí podstoupit CT k odhalení hydrocefalu. Pokud to závažnost situace žádá, je nezbytné ihned přistoupit k derivaci moku. Každý pacient s podezřením na expanzivní proces v pineální krajině musí následně absolvovat vyšetření MR s podáním kontrastní látky. U potvrzené patologické léze podá toto vyšetření zásadní informace o její velikosti, tvaru, homogenitě, vztahu k mozkovým a cévním strukturám a pomáhá odhalit případné šíření nádoru v likvorovém systému. V dalším diagnostickém postupu by mělo následovat vyšetření hladiny nádorových markerů v krevním séru a mozkomíšním moku, které naznačí přítomnost některého secernujícího germinálního nádoru [46]. Cytologií moku mohou být odhaleny patologické buňky předznamenávající tumorózní diseminaci v mokovém prostoru. O léčebném postupu jakožto i o prognóze by měl rozhodnout odběr biopsie některou z níže uvedených metod podle zkušeností pracoviště [47]. Stereotaktická biopsie je máloinvazivní metoda, kterou je možné provést i v lehké sedaci a lokální anestezii u pacienta rizikového pro celkovou narkózu. Diagnostická výtěžnost je udávána mezi 87 a 97 % [48 – 50]. Ač je odběr z této oblasti teoreticky spojen s vyšším rizikem závažných komplikací (dramatické krvácení, poškození vitálních struktur), signifikantní statistický rozdíl oproti stereobioptickým odběrům z jiných částí mozku literární zdroje neuvádí (perioperační mortalita < 2 %, permanentní morbidita < 1 %, dočasná lehká morbidita < 9 %) [6,51 – 53]. Kreth at al poukázali na výhody CT navigované stereotaktické biopsie [54]. Její použití není vhodné v případech, kdy se předpokládá radikální resekce suspektního benigního tumoru. Endoskopická biopsie nese stejné výhody i rizika jako stereotaktická biopsie, se srovnatelnou morbiditou a mortalitou [55,56]. Při endoskopickém provedení ventrikulostomie III. mozkové komory je možné v jedné době vyřešit rozvinutý obstrukční hydrocefalus [55,57,58]. Yamini at al ve svém souboru byli nuceni finálně zavést ventrikulo ‑ peritoneální zkrat pouze u 15 % takto řešených pacientů [56]. Mikrochirurgická technika provedená z klasické kraniotomie umožňuje oproti výše popsaným metodám odběr skutečně reprezentativního vzorku tkáně. U ohraničených nádorů dovoluje v jedné době provést radikální resekci (př. pineocytom, zralý teratom, meningeom, dermoidní cysta aj.), u maligních forem alespoň bezpečnou cytoredukci. V neposlední řadě je přímým odstraněním expanze možné obnovit průchodnost likvorových cest. Pokud je z grafického nálezu podezření na germinom, pak je vhodné provést pouhou biopsii, nejlépe některou z méně invazivních metod. Pro vysokou radiosenzitivitu germinomů jejich další léčba spočívá v iradiaci, případně v její kombinaci s chemoterapií bez nutnosti dalšího chirurgického řešení [59]. Dosud nebyl jednoznačně potvrzen pozitivní dopad rozsahu resekce na následný efekt adjuvantní léčby a délku přežití u maligních nádorů PK, i když některé studie tento vztah dokládají [51]. Řada autorů přesto preferuje u všech primárních maligních nádorů PK (germinom, nezralý teratom a další maligní ne ‑ germinomatózní nádory, pineoblastom) takzvanou maximální „bezpečnou“ resekci (cytoredukci) před radioterapií a chemoterapií [14,51]. U expanzí známých svým šířením mozkomíšním mokem je nutné doplnit kontrastní MR vyšetření celého páteřního kanálu a provést cytologický rozbor mozkomíšního moku. Při odhalení implantačních metastáz následuje ozáření celé kraniospinální osy. Radiochirurgie je možná a bezpečná primární léčebná modalita u pacientů s pinealocytomem. U pinealoblastomů může být součástí komplexní léčby a je též vhodná pro léčbu reziduí benigních i maligních nádorů do průměru 3 cm. Neměla by být volena bez histologické verifikace nádoru, protože její efekt na vysoce maligní léze je velmi omezený [25,26].
3. Zjednodušený algoritmus diagnostického a terapeutického postupu u NPK. 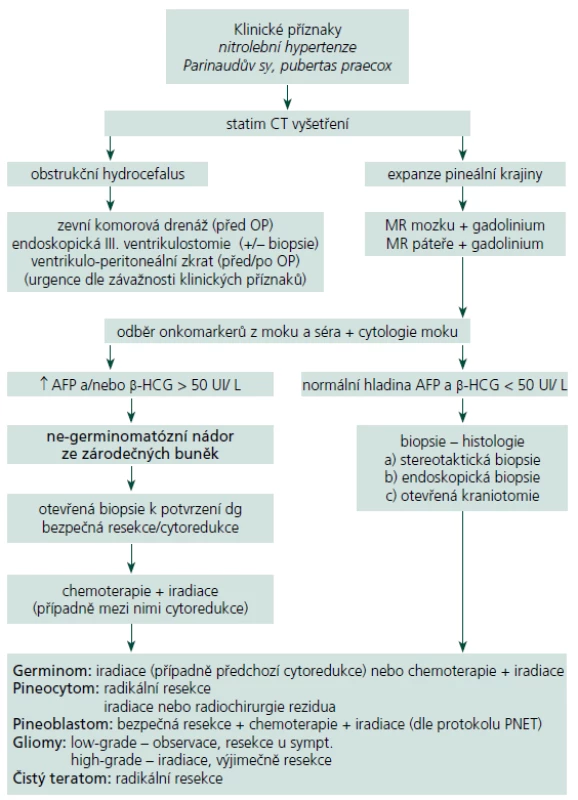
Perioperační strategie
Léčba hydrocefalu
Více než u poloviny pacientů s nádorem v PK je v době jeho odhalení přítomen obstrukční hydrocefalus z uzávěru mokovodu. Pokud se jedná o mírný stupeň bez dramatických klinických projevů a zvláště existuje‑li naděje na peroperační obnovení průchodnosti mokových cest, je možné jeho řešení odložit. Symptomatický hydrocefalus se stává prioritou v léčebném zajištění pacienta s nádorem PK. První krok je derivace moku mimo uzavřený komorový systém, což je možné provést několika způsoby (dle preference pracoviště):
- zevní komorová drenáž (ZKD) se provádí nejčastěji punkcí předního rohu postranní komory nedominantní hemisféry z klasického prekoronárního přístupu. Zpravidla se ponechává i v pooperačním období, a pokud pacient uzavření drenáže netoleruje, je třeba ji nahradit uzavřeným ventrikulo ‑ peritoneálním zkratovým systémem, jakmile to likvorový nález umožní (vymizení příměsi krve, nízká hodnota mokové bílkoviny, negativní zánětlivé markery).
- endoskopicky provedená ventrikulostomie III. mozkové komory – její výhodou je možnost současného odběru nádorové biopsie a také fakt, že pacient se nestává zbytečně závislým na zkratu, pokud hydrocefalus po operaci regreduje [52].
- zavedení ventrikulo ‑ peritoneálního zkratu může být metoda volby, ovšem s rizikem známých zkratových komplikací (obstrukce, předrénování, infekce) či diseminace nádorových buněk do peritoneální dutiny (prevencí jsou nádorové filtry). Přistupujeme k němu zpravidla také tam, kde ventrikulostomie selhala nebo její provedení je spojeno s neúnosnými riziky.
Operační přístupy k expanzím pineální krajiny
Přístupová cesta k expanzím PK u pacientů indikovaných k operačnímu řešení je volena podle velikosti nádoru, směru jeho šíření a vztahu k hlubokému žilnímu systému. Dalším faktorem je preference operujícího neurochirurga vycházející z jeho odborných zkušeností. Upřednostněn by měl být některý z extracerebrálních přístupů před invazivními transcerebrálními přístupy. Jejich přehled je uveden v tab. 4, schéma těch nejčastěji používaných pak na obr. 4.
4. Přehled operačních přístupů k pineální krajině. 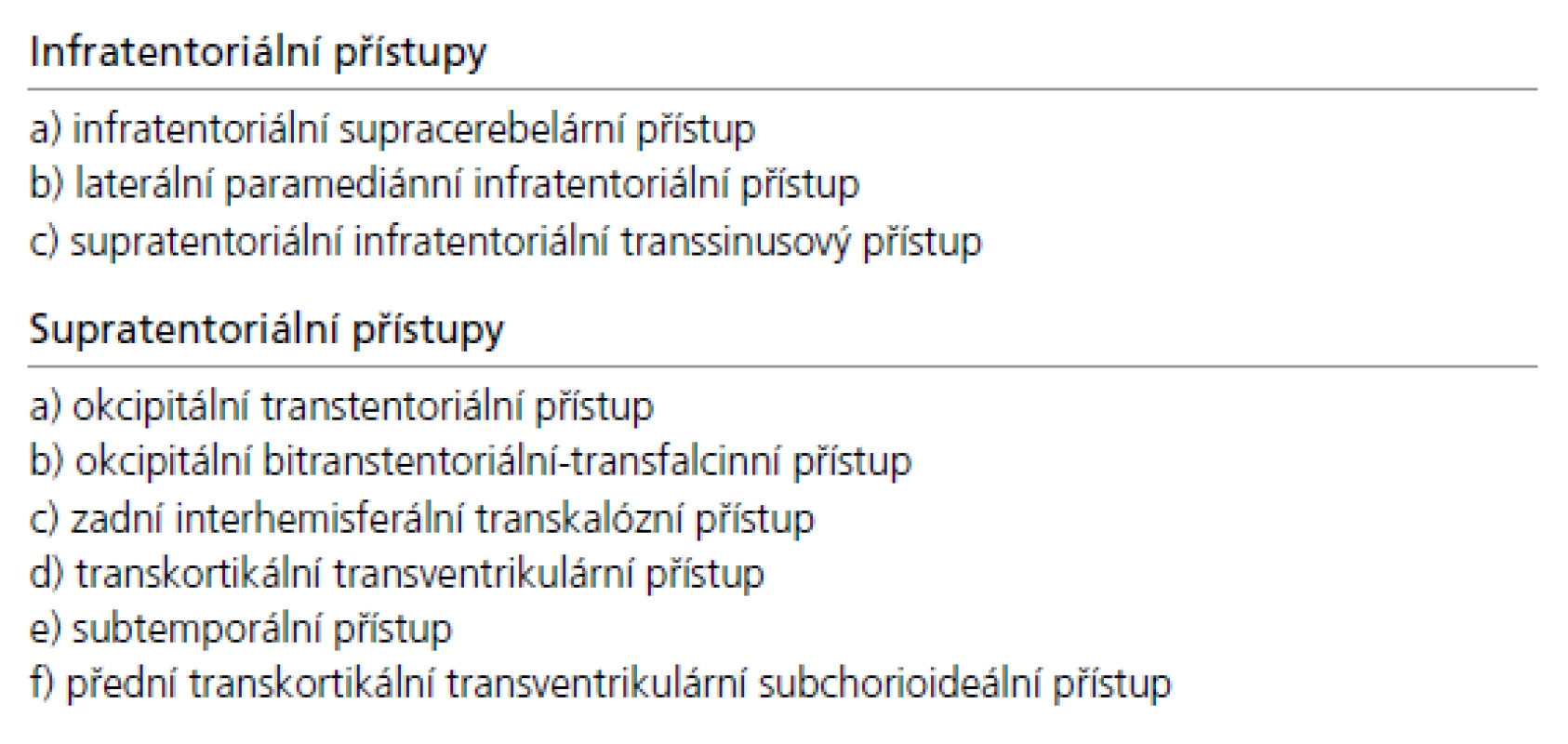
4. Schéma nejčastěji používaných přístupů k pineální krajině. 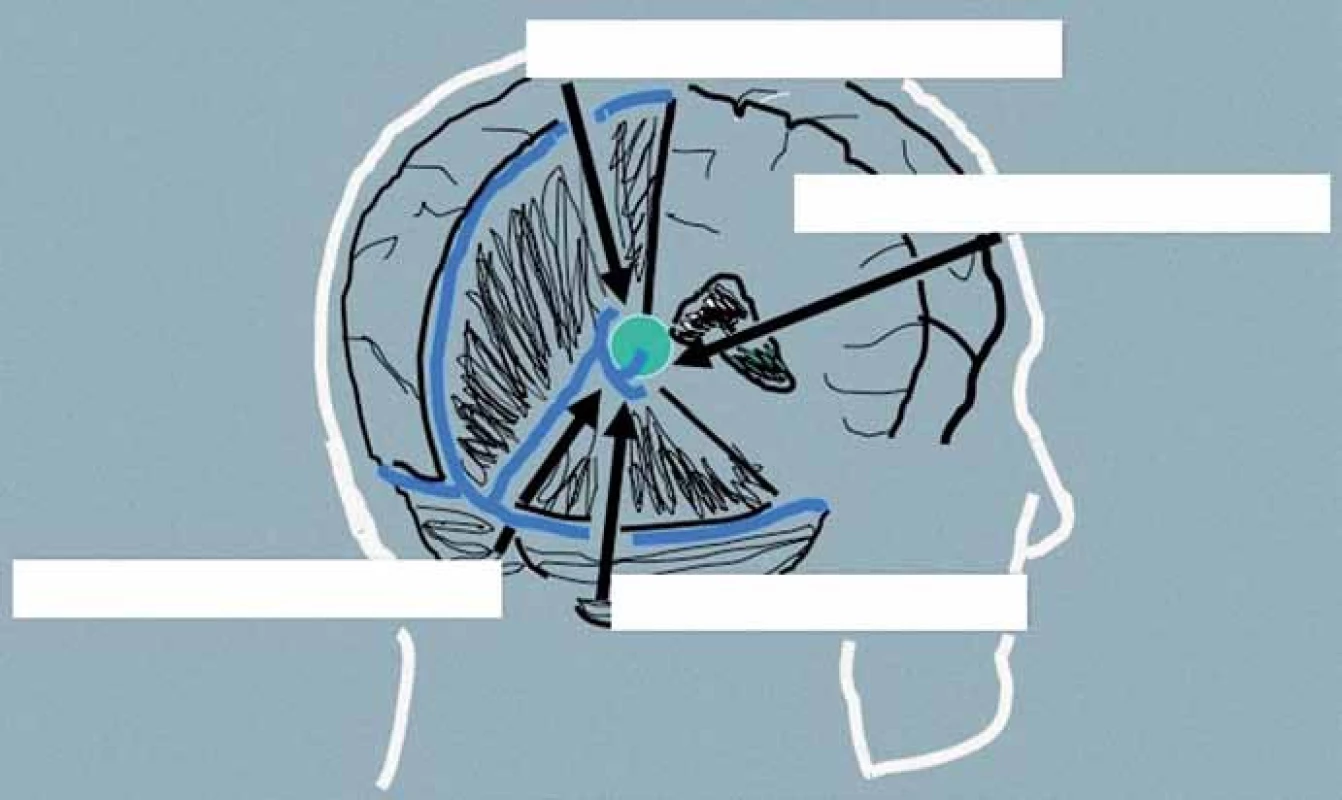
Volba polohy pacienta při operaci
Operační poloha pacienta by měla odpovídat zvolenému operačnímu přístupu (obr. 5). Pro nejčastěji používaný infratentoriální supracerebelární přístup je obvykle volena sedící poloha [60,61]. Její výhodou je gravitační opadnutí mozečku od tentoria a tím minimální potřeba jeho mechanické retrakce. Přístup zároveň umožňuje volné odtékání krve, moku a výplachové tekutiny z rány, což přispívá k udržení přehlednosti operačního pole. Nevýhodou může být určitý diskomfort operatéra při práci s dlouhodobě elevovanými horními končetinami. Negativní tlak v žilním systému této oblasti umožňuje nežádoucí nasátí vzduchu přes otevřené žíly v kalvě a tvrdé pleně, případně přes přemosťující žíly a splavy, s rizikem vzniku vzduchové embolie. Možnou prevencí této nebezpečné komplikace je polohování dolních končetin pacienta do úrovně jeho srdce před začátkem výkonu, okamžité uzavírání otevřených žil bipolární koagulací či kostním voskem za kontinuálního ovlažování oblasti výplachovou tekutinou. K peroperační detekci vzduchových bublin v oblasti pravé srdeční síně je vhodný kontinuální echokardiální monitoring pomocí transezofageální sondy s možným okamžitým odsáváním nasátého vzduchu síňovým katetrem zavedeným před výkonem [62]. Další komplikací může být vznik pneumocefalu (zvláště při zavedeném komorovém katetru), případně při ruptuře přemosťující žíly vlivem kolapsu hemisféry po odpuštění moku může dojít k rozvoji akutního subdurálního hematomu. Pacienti s osteochondrotickým onemocněním krční páteře by měli být uchráněni enormního předklonu hlavy vzhledem k nebezpečí rozvoje akutní cervikální myelopatie [63]. Pro okcipitální transtentoriální přístup bývá kromě této polohy volena rovněž sedící poloha nebo výhodněji laterální poloha na boku s hlavou ukloněnou lehce k podlaze [64], případně 3/ 4 pronační pozice se 45° úklonem hlavy [65]. Cílem těchto pozic je opadnutí distálněji situované nedominantní hemisféry od falko ‑ tentoriálního spojení vlivem gravitace. Tato poloha je komfortnější pro operatéra, ovšem vzhledem k šikmé poloze hlavy pacienta může být poněkud zhoršena prostorová orientace. Čistě pronační poloha s lehce flektovanou hlavou je určena pro supratentoriální přístupy, hlavně u dětí [18]. Její nevýhodou je stagnování tekutého obsahu v operačním poli s potřebou kontinuálního ovlažování a odsávání pro udržení přehlednosti. Anatomický pohled je pro operatéra pracujícího za hlavou pacienta obrácený proti sedící poloze. Variací pronační polohy je tzv. Concord pozice, kdy hlava je navíc rotována o 15° ze strany kraniotomie. Operatér při ní stojí bokem k pacientovi, čímž získává normální kraniokaudální anatomický pohled. Tato poloha umožňuje provádět infratentoriální supracerebelární přístup s eliminací rizik sedící polohy [66].
5. Operační polohy používané při operacích pineální krajiny. 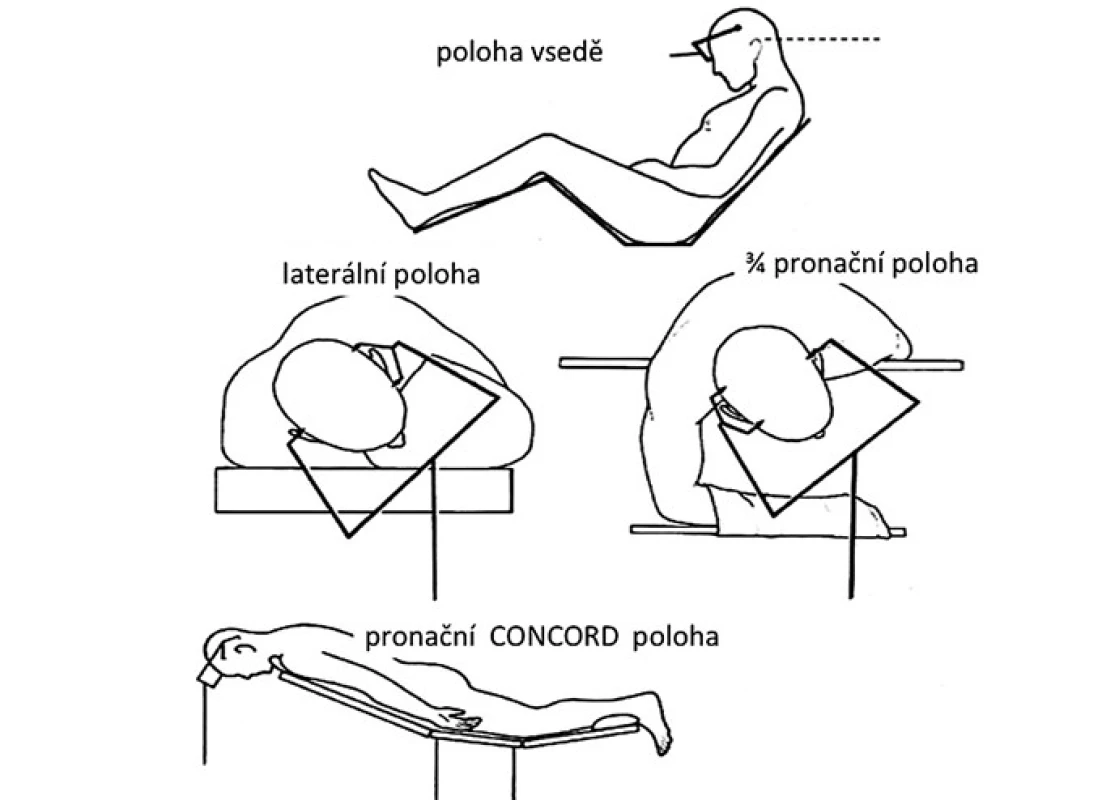
Infratentoriální supracerebelární přístup (ITSCP)
Poprvé byl proveden Horsleyem v roce 1910, ovšem popsán byl až Krausem v roce 1926 [67]. V roce 1958 se o jeho modifikaci zasloužil Zapletal [68]. Stein již s pomocí mikroskopu dále rozvíjel techniku ITSCP a v roce 1971 dokumentoval významné zlepšení morbidity a mortality operovaných pacientů [69]. Jedná se o středočárový extracerebrální přístup, pro který je preferovanou pozicí sedící poloha. Je určen hlavně pro expanze dislokující hluboký venózní systém kraniálně. Modifikací ITSCP je laterální paramediánní infratentoriální přístup popsaný Van den Berghem v roce 1990 [70]. Ten dobře otevírá stan tentoria, přičemž není třeba rušit mediální mozečkové žíly, jejichž uzavření může vést, byť výjimečně, k závažné venózní infarzaci a následné expanzi cerebelárních hemisfér. Navíc je doporučen pro laterální polohu, která redukuje rizika komplikací polohy v sedě.
Okcipitální transtentoriální přístup
Tento přístup, původně navržený Foersterem v roce 1928 a posléze popsaný Poppenem v roce 1966, rozpracoval a popularizoval především Jamieson počátkem 70. let 20. století [71,72]. Představuje alternativu k ITSCP s výhodou jeho užití v případech, kdy je anatomicky nízko položené konfluens nebo kde má nádor větší laterální či supratentoriální šíření, protože jeho trajektorie dobře odhaluje oba kompartmenty. Ačkoliv výkon byl původně vypracován pro sedící polohu, je v současné době preferována spíše pronační 3/ 4 poloha, která umožňuje samovolnou retrakci okcipitálního laloku [73]. Jeho volba je také vhodná u nádorů s větší distální expanzí do cerebello ‑ mezenfalické cisterny. Širší přístup k oblasti zadní incizury je umožněn protětím přilehlé části falxu a kontralaterální části tentoria. Pak je označován jako okcipitální bitranstentoriální ‑ transfalcinní přístup [74]. Většina expanzí PK dislokuje komplex velkých žil z pohledu operatéra kraniodorzálně, proto je nejprve operatér musí identifikovat a vlastní resekci nádoru pak provést mezi nimi. Méně vhodná je dislokace komplexu ventrokaudálně, nejčastěji expanzemi vycházejícími od falko ‑ tentoriální junkce (meningeomy) a z tela choriodea (gliomy), kde žilní systém je pro operatéra skryt za nádorem.
Zadní interhemisferální transkalózní přístup (ZITP)
V roce 1921 popsal Dandy parietální parasagitální transkalózní přístup, který je dodnes používán u nádorů expandujících proximálně proti kalóznímu tělesu [75] (obr. 6). Hluboký žilní komplex je v těchto případech dislokován kaudálně. Je možné jej provádět v jakékoli popsané pozici, přičemž výhodou pronační polohy nebo polohy na zádech s předkloněnou hlavou je přímá středočárová trajektorie, výhodou laterální a 3/4 polohy zase samovolné opadnutí hemisféry. Neurologickou komplikací tohoto přístupu může být vznik kognitivního deficitu či syndromu rozpojení po protětí zadní části těla kalózního tělesa. Po přístupu přes splenium je možné očekávat hemialexii.
6. Meningeom v PK s expanzí do kalózního tělesa. 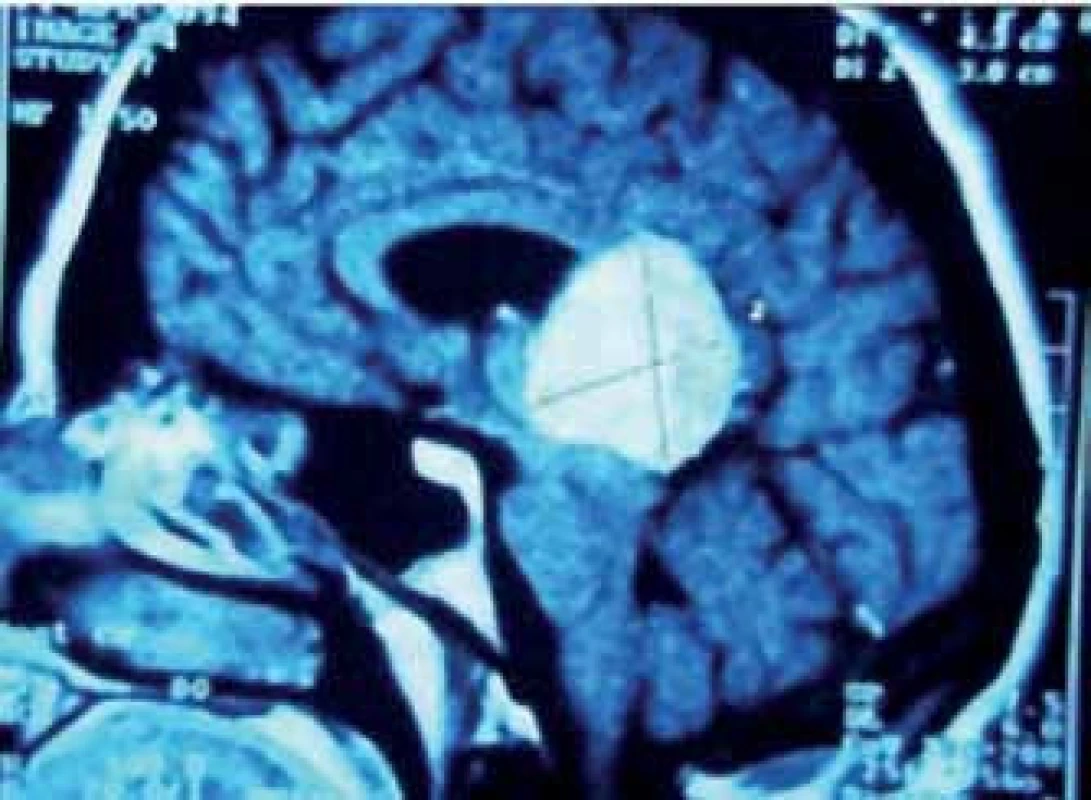
Transkortikální transventrikulární přístup (TTP)
Tento invazivní přístup popsaný Van Wagenenem v roce 1931 je dnes používán pouze pro excentrické tumory s laterální expanzí do postranní komory při rozvinutém hydrocefalu [76]. Kortikální incize je u něho vedena v zadní partii gyrus temporalis superior s následným proniknutím do okcipitálního rohu postranní komory. Po exstirpaci chorioideálního plexu se odhalí nádor a jeho resekce se provádí mezi vv. internae (kraniálně) a vv. basales (kaudálně). Přístup se nedoporučuje aplikovat z dominantní strany pro nebezpečí fatické poruchy.
Ostatní přístupy
Široký supra/ infratentoriální transsinusový přístup dle Sekhara a Goela (1992) a Ziyala (1998) má jen zcela výjimečné použití u objemných nádorů PK [77,78]. Protíná se při něm nedominantní sinus transversus. Přední transkortikální transventrikulární subchorioideální přístup směřující z frontální oblasti transkortikálně přes frontální roh postranní komory nedominantní hemisféry k foramen Monro a dále protětím choriodeální fizury k zadní partii III. komory by měl být omezen pouze na nádory expandující do přední části III. komory. Proto je u expanzí PK volen jen velmi ojediněle. Obtížně se při něm kontroluje zadní partie nádoru a žilní struktury. Není vhodný, pokud chybí hydrocefalické rozšíření komor s alespoň částečnou dilatací foramen Monro [79]. Zadní subtemporální přístup lze použít pouze u nádorů, které se šíří do PK z oblasti laterální partie incisury tentoria (jedná se téměř výhradně o meningeomy). Pro ostatní nádory PK nemá širší využití. Přístup je spojen s vysokým rizikem porušení Labbého žíly směřující z povrchu mozku do transverzního splavu a z trakčního poškození temporálního laloku [80].
Naše zkušenosti a preference
V průběhu téměř dvaceti let (1994 – 2013) bylo na Neurochirurgickém oddělení Krajské nemocnice v Liberci operováno 21 pacientů pro expanzivní proces v PK. Soubor sestává z 12 žen a 9 mužů, průměrného věku 37,6 roku (rozmezí 15 – 66 let). Iniciálními příznaky byla u 14 pacientů nitrolební hypertenze, u pěti okohybná porucha, u jednoho pacienta pouze zmatenost a v jednom případě se jednalo o náhodný nález. Hydrocefalus byl odhalen u 16 pacientů, přičemž k akutní derivaci moku zevní komorovou drenáží jsme museli přistoupit v osmi případech. Spektrum operovaných expanzí, způsob léčby, recidiva nádorového růstu, kvalita života podle Karnofského škály [81], pooperační závislost na ventrikulo ‑ peritoneálním zkratu a celková délka přežití je uvedena v tab. 5. Kromě tří pacientů byl ve všech případech aplikován infratentoriální supracerebelární přístup v sedící poloze. Jeden pacient s meningeomem expandujícím proximálně proti spleniu byl operován zadním transkalózním přístupem (obr. 6). U pacienta s nádorem invadujícím laterálně do rozšířené postranní komory jsme uplatnili transkortikální transventrikulární přístup. Vzhledem k laterální expanzi dermoidní cysty se v jednom případě jevil jako nejvýhodnější okcipitální transtentoriální přístup. Dva pacienti s pinealoblastomem zemřeli v průběhu sledování na progresi nádorového růstu s komorovou diseminací. Pacientka s metastázou střevního adenokarcinomu v PK zemřela na plicní komplikace několik týdnů po výkonu. Vzhledem k perzistenci hydrocefalu po operaci bylo u šesti pacientů nezbytné konvertovat dočasnou komorovou drenáž na permanentní ventrikulo ‑ peritoneální zkrat (28,5 %). U dvou pacientů jsme museli vyřešit dočasnou ranou likvoreu, která byla v jednom případě komplikována následnou meningitidou. Ta byla úspěšně zvládnuta antibiotiky. Při operacích v sedící poloze vždy provádíme kontinuální transezofageální echokardiografický monitoring, který vede kardiolog přímo na sále. Ve čtyřech případech došlo k detekci vzduchových bublin v pravé srdeční síni. Okamžitým snížením polohy hlavy pacienta a odsáváním vzduchu centrálním žilním katétrem zavedeným preoperačně do pravé síně jsme se ihned snažili eliminovat riziko vzniku vzduchové embolie. Všichni čtyři pacienti byli po výkonu zcela bez příznaků této komplikace. Ve všech řešených případech jsme upřednostnili otevřenou biopsii s rychlým histologickým zhodnocením zmrazeného preparátu a ihned jsme navázali resekčním výkonem s využitím neuronavigace a ultrazvukového aspirátoru. U benigních, dobře ohraničených expanzí jsme prakticky ve všech případech dosáhli radikálního odstranění nádoru. Pouze u dermoidů jsme byli nuceni ponechat malé zbytky pouzdra pevně adherovaného k cévám. U maligních lézí, včetně germinomů, jsme se snažili o maximální bezpečnou resekci nádoru v závislosti na jeho ohraničení, šíření a vazbě k žilnímu systému s následnou adjuvantní radioterapií a chemoterapií. Kromě dvou zemřelých pacientů s pinealoblastomem (obr. 3a–f) nebyly u nikoho detekovány implantační metastázy v likvorovém systému. Perioperační mortalita souboru je 5 % (jeden pacient zemřel měsíc po operaci na plicní komplikace). Trvalá morbidita žijících pacientů je 28 %, přičemž zásadně není zhoršena kvalita jejich života (index 80 – 90 dle Karnofského škály). Kromě zmíněného souboru dlouhodobě dispenzarizujeme několik pacientů s asymptomatickými lipomy a benigními cystami PK.
5. Soubor operovaných pacientů na Neurochirurgickém oddělení Krajské nemocnice Liberec (1994–2013). 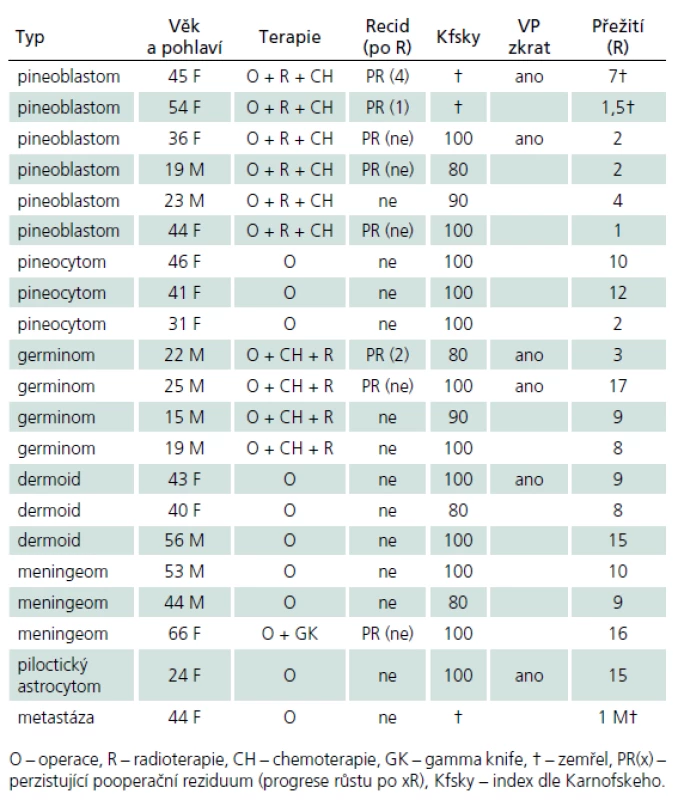
Závěr
Asi třetina nádorů PK je benigní povahy. Jejich radikálním chirurgickým odstraněním je možné dosáhnout úplného vyléčení. Agresivní chirurgická resekce u maligních nádorů není zcela opodstatněná. Histologicky verifikované radiosenzitivní germinomy je možné úspěšně léčit pouhou iradiací, případně podpořenou chemoterapií. Některé studie ovšem proklamují korelaci mezi délkou přežití a rozsahem resekce maligních nádorů vzhledem k vytvoření lepších podmínek pro uplatnění adjuvantní terapie. V těchto případech ale platí pravidlo omezit výkon na bezpečnou parciální resekci s dokonalou hemostázou bez rizika závažného poškození zdraví pacienta. Tyto složité zákroky patří do rukou nejzkušenějších neurochirurgů s adekvátní praxí a dobrou znalostí anatomie operované oblasti. Operatér musí v perioperačním období úzce spolupracovat s anesteziologem, kardiologem, histopatologem a intenzivistou. Nové technologie, operační techniky, možnosti moderní neuroanestezie a neurointenzívní péče významně snižují rizika perioperačních komplikací. Díky výše uvedeným faktorům byla redukována perioperační mortalita a závažná morbidita u expanzí PK z historických 90 – 100 % na současných 10 – 25 % [82,83]. Další posun je možné očekávat od postupujícího rozvoje endoskopie a radiochirurgie. V léčbě maligních expanzí pak od pokroků v neuroonkologii, především v oblasti chemoterapie a biologické léčby.
Autoři deklarují, že v souvislosti s předmětem studie nemají žádné komerční zájmy.
Redakční rada potvrzuje, že rukopis práce splnil ICMJE kritéria pro publikace zasílané do biomedicínských časopisů.
MUDr. Pavel Buchvald
Neurochirurgické oddělení
Krajská nemocnice Liberec a.s.
Husova 10
460 63 Liberec
e-mail: pavel.buchvald@nemlib.cz
Přijato k recenzi: 31. 8. 2013
Přijato do tisku: 24. 10. 2013
Recenzenti
prof. MUDr. Vladimír Beneš, DrSc.
prof. MUDr. Martin Sameš, Ph.D.
prof. MUDr. Vladimír Smrčka, CSc.
MU Dr. Pavel Buchvald
Pavel Buchvald studoval v letech 1984 – 1990 LF UK v Hradci Králové (obor všeobecné lékařství). Od roku 1990 je zaměstnancem Krajské nemocnice Liberec, kde nejprve tři roky působil na traumatologickém oddělení a v roce 1994 nastoupil na nově založené Neurochirurgické oddělení, kde již řadu let působí na pozici zástupce přednosty neurochirurgie a neurocentra. Atestoval v roce 1993 z oboru chirurgie a v roce 1998 složil atestaci z neurochirurgie. Je absolventem čtyřletého mezinárodního neurochirurgického kurzu EANS a dále pobýval na odborných stážích v USA, Německu, Švédsku, Finsku a Holandsku. Je členem České a Slovenské neurochirurgické společnosti a České spondylochirurgické společnosti ČLS JEP. Od roku 2011 přednáší na Lékařské fakultě Masarykovy univerzity a na katedře biomechaniky Technické univerzity v Liberci. Je autorem a spoluautorem více než 30 článků publikovaných v odborných monografiích nebo v časopisech s IF. Věnuje se celému spektru neurochirurgické a spondylochirurgické operativy, hlavní oblastí zájmu je cévní neurochirurgie a chirurgie lební baze.
Sources
1. Ringertz N, Nordenstam H, Flyger G. Tumors of the pineal region. J Neuropathol Exp Neurol 1954; 13(4): 540 – 561.
2. Rhoton AL jr, Yamamoto I, Peace DA. Microsurgery of the third ventricle: Part 2. Operative approaches. Neurosurgery 1981; 8(3): 357 – 373.
3. Gaillard F, Jones J. Masses of the pineal region: clinical presentations and radiographic features. Postgrad Med J 2010; 86(1020): 597 – 607.
4. Lapras C. Surgical therapy of pineal region tumors. In: Neuwelt EA (ed). Diagnosis and treatment of pineal region tumors. Philadeplhia: Lippincott Williams & Wilkins 1984 : 289 – 299.
5. Bruce JN. Management of pineal region tumors. Neurosurg Quart 1993; 3 : 103 – 119.
6. Regis J, Bouillot P, Rouby ‑ Volot F, Figarella ‑ Branger D,Dufour H, Peragut JC. Pineal region tumors and the role of stereotactic biopsy: review of the mortality, morbiditi and diagnostic rates in 370 cases. Neurosurgery 1996; 39(5): 907 – 912.
7. Sugiyama K, Uozumi T, Kiya K, Mukada K, Arita K, Kurisu K et al. Intracranial germ ‑ cell tumor with synchronous lesions in the pineal and suprasellar regions: case report of six cases and review of the literature. Surg Neurol 1992; 38(2): 114 – 120.
8. Sano K, Matsutani M. Microsurgery of teratoma and germinoma involving the diencephalon and the brain stem. Neurosurg Rev 1983; 6(2): 51 – 55.
9. Packer RJ, Cohen BH, Cooney K. Intracranial germ cell tumors. Oncologist 2000; 5(4): 312 – 320.
10. Jennings MT, Gelman R, Hochberg F. Intracranial germ ‑ cell tumors: natural history and pathogenesis. J Neurosurg 1985; 63(2): 155 – 167.
11. Rueda ‑ Pedraza ME, Heifetz SA, Sesterhenn SA, Clark GB. Primary intracranial germ cell tumors in the first two decades of life. A clinical, light ‑ microscopic and imunohistochemical analysis of 54 cases. Prospect Pediatr Pathol 1987; 10 : 160 – 207.
12. Regueiro CA. Treatment of intracranial germ cell tumors and other tumors of the pineal region. Neurocirurgia 2003; 14(2): 127 – 139.
13. Brastianos HC, Brastianos PK, Blakeley JC. Pineal region tumors. In: Norden AD, Deardon DA, Wen PYC (eds). Primary central nervous system tumors. Pathogenesis and therapy. New York: Humana Press 2011 : 435 – 455.
14. Konovalov AN, Pitskhelauri DI. Principles and treatment of the pineal region tumors. Surg Neurol 2003; 59(4): 250 – 268.
15. Calaminus G, Kortmann R, Worch J, Nicholson JC, Alapetite C, Garré ML et al. SIOP CNS GCT 96: final report of outcome of a prospective, multinational nonrandomized trial for children and adults with intracranial germinoma, comparing craniospinal irradiation alone with chemotherapy followed by focal primary site irradiation for patients with localized disease. Neuro Oncol 2013; 15(6): 788 – 796.
16. Nicholson J. SIOP CNS GCT II: Prospective trial for the diagnosis and treatment of children, adolescents and young adults with intracranial germ cell tumors. Phase III clinical trial grants. Cancer Research UK CRUK/ 10/ 038 2012 – 2019.
17. Bamberg M, Kortmann RD, Calaminus G, Becker G, Meisner C, Harms D et al. Radiation therapy for intracranial germinoma: results of the German cooperative prospective trials MAKEI 83/ 86/ 89. J Clin Oncol 1999; 17(8): 2585 – 2592.
18. Bruce JN, Ogden AT. Surgical strategies of treating patients with pineal region tumors. J Neurooncol 2004; 69(1 – 3): 221 – 236.
19. Itoyama Y, Kochi M, Kuratsu J, Takumara S, Kitano I, Marubayshi T et al. Treatment of intracranial nongerminomatous malignant germ cell tumors producing alpha ‑ fetoprotein. Neurosurgery 1995; 36(3): 459 – 464.
20. Haas ‑ Kogan DA, Misset BT, Wara WM, Donaldson SS, Lamborn KR, Prados MD et al. Radiation therapy for intracranial germ cell tumors. Int J Radiat Oncol Biol Phys 2003; 56(2): 511 – 518.
21. Fuller BG, Kapp DS, Cox R. Radiation therapy of pineal region tumors: 25 new cases and a review of 208 previously reported cases. Int J Radiat Oncol Biol Phys 1994; 28(1): 229 – 245.
22. Echevarría ME, Fangusaro J, Goldman S. Pediatric central nervous system germ cell tumors: a review. Oncologist 2008; 13(6): 690 – 699.
23. Louis DN, Ohgaki H,Wiestler OD, Cavenee WK, Burger PC, Jouvet A et al. The 2007 WHO classification of tumors of the central nervous system. Acta Neuropathol 2007; 114(2): 97 – 109.
24. Kozler P. Pineální parenchymové nádory. In: Kozler Pet al (eds). Intrakraniální nádory. Praha: Galén 2007 : 110 – 112.
25. Reyns N, Hayashi M, Chinot O, Manera L, Péragut JC, Blond S et al. The role of Gamma Knife radiosurgery in the treatment of pineal parenchymal tumors. Acta Neurochir 2006; 148(1): 5 – 11.
26. Hasegawa T, Kondziolka D, Hadjipanayis C, Flickinger J, Lunsford LD. Stereotactic radiosurgery for CNS nongerminomatous germ cell tumors. Pediatr Neurosurg 2003; 38(6): 329 – 333.
27. Kano H, Niranjan A, Kondziolka D, Flickinger JC, Lunsford D. Role of stereotactic radiosurgery in the management of pineal parenchymal tumors. Prog Neurol Surg 2009; 23 : 44 – 58.
28. Anan M, Ishii K, Nakamura T, Yamashita M, Katayama S, Sainoo M et al. Postoperative adjuvant treatment for pineal parenchymal tumor of intermediate differentiation. J Clin Neurosci 2006; 13(9): 965 – 968.
29. Lutterbach J, Fauchon F, Schield SE, Chang SM, Pagenstecher A, Volk B et al. Malignant pineal parenchymal tumors in adult patients: patterns of care and prognostic factors. Neurosurgery 2002; 51(1): 44 – 55.
30. Schild SE, Scheithauer BW, Schomberg PJ, Hook CC, Kelly PJ, Frick L et al. Pineal parenchymal tumors. Clinical, pathologic and therapeutic aspects. Cancer 1993; 72(3): 870 – 880.
31. Chang AH, Fuller GN, Debnam JM, Karis JP, Coons SW, Ross JS et al. MR imaging of papillary tumor of the pineal region. AJNR Am J Neuroradiol 2007; 29(1): 187 – 189.
32. Júnior GV, Dellaretti M, de Carvalho GT, Brandao RA, Mafra A, de Souza AA. Papillary tumor of the pineal region. Brain Tumor Pathol 2011; 28(4): 329 – 334.
33. Févre‑Montagne M, Hasselblatt M, Figarell ‑ Branger D,Chauveinc L, Champier L, Saint ‑ Pierre G et al. Prognosis and histopatologic features in papillary tumors of the pineal region: a retrospective multicenter study of 31 cases. J Neuropathol Exp Neurol 2006; 65(10): 1004 – 1011.
34. Pavelka Z, Smrčka M, Křen L, Keřkovský M, Skotáková J, Šlampa P et al. Papilární nádor pineální oblasti u dítěte – kazuistika. Cesk Slov Neurol N 2012; 75/ 108(6): 754 – 756.
35.Daglioglu E, Cataltepe O, Akalan N. Tectal gliomas in children: the implications for natural history and management strategy. Pediatr Neurosurg 2003; 38(5): 223 – 231.
36. Fadrus P, Lakomý R, Hübnerová P, Slabý O, Keřkovský M, Svoboda T et al. Intrakraniální nádory – diagnostika a terapie. Interní Med 2010; 12(7 – 8): 376 – 381.
37. Yasargil MG. Meningiomas. In: Yasargil GM (ed). Microneurosurgery IVB. New York: Georg Thieme Verlag 1996 : 137.
38. Konovalov AN, Spallone A, Pitzkhelauri DI. Pineal epidermoid cysts: diagnosis and management. J Neurosurg 1999; 91(3): 370 – 374.
39. Lassman AB, Bruce JN, Fettel MR. Metastasis to the pineal gland. Neurology 2006; 67(7): 1303 – 1304.
40. Nakano I, Kondo A, Iwasaki K. Choroid plexus papilloma in the posterior third ventricle: case report. Neurosurgery 1997; 40(6): 1279 – 1282.
41. Freedman SJ, Pantanowitz L, Joseph JT, WU J, Wong ET, Dezube BJ. Unusual locations for lymphomas. Case 2. Pineal lymphoma. J Clin Oncol 2001; 19(11): 2960 – 2963.
42. Smith WT, Hughes B, Ermocilla R. Chemodectoma of the pineal region, with observations on the pineal body and chemoreceptor tissue. J Pathol Bacteriol 1966; 92(1): 69 – 76.
43. Suzuki T, Yasumoto Y, Kumami K, Matsumura K, Kumami M, Mochizuki M et al. Primary pineal melanocytic tumor. Case report. J Neurosurg; 2001; 94(3): 523 – 527.
44. Usanov EI, Hatomkin DM, Nikulina TA, Gorban NA. Craniopharyngioma of the pineal region. Childs Nerv Syst 1999; 15(1): 4 – 7.
45. Engel U, Gottschalk S, Niehaus L, Lehmann R, May C,Vogel S et al. Cystic lesions of the pineal region – MRI and pathology. Neuroradiology 2000; 42(6): 399 – 402.
46. Vervenne WL, Bakker PJ, Stalpers LJ, Bosch DA. Malignant intracranial germ cell tumor treated with chemotherapy and radiotherapy without histopatological confirmation. Ned Tijdschr Geneeskd 2000; 144(11): 527 – 531.
47. Blakeley JO, Grossman SA. Management of pineal region tumors. Curr Treat Options Oncol 2006; 7(6): 505 – 516.
48. Popovic EA, Kelly PJ. Stereotactic procedures for lesions of the pineal region. Mayo Clin Proc 1993; 68(10): 965 – 970.
49. Chandrasama PT, Smith MM, Apuzzo ML. Stereotactic biopsy in the diagnosis of brain masses: comparison of results of biopsy and resected surgical specimen. Neurosurgery 1989; 24(2): 160 – 165.
50. Chrastina J, Novák Z, Jančálek R, Říha I, Slaná B, Hermanová M et al. Úloha stereotaktické biopsie v diagnostice tumoru mozku. Onkologie 2011; 5(1): 49 – 52.
51. Moise G, Ogden AT, Bruce JN. Pineal gland tumors. In: Metha MP (ed). Principles and practice of Neuro‑Oncology. New York: Demos Medical 2011 : 485 – 495.
52. Bruce JN, Ogden AT. Surgical strategies for treating patients with pineal region tumors. J Neurooncol 2004; 69(1): 221 – 236.
53. Field M, Witham TF, Flickinger JC, Kondziolka D, Lunsford LD. Comprehensive assessment of hemorrhage risks and outcomes after stereotactic brain biopsy. J Neurosurg 2001; 94(4): 545 – 551.
54. Kreth FW, Schätz CR, Pagenstecher A, Faist M, Volk B,Ostertag CB. Stereotactic management of lesions of the pineal region. Neurosurgery 1996; 32(2): 289 – 291.
55. Buxton N, Ho KJ, Macarthur D, Vloeberghs M, Punt J,Robertson I. Neuroendoscopic third ventriculostomy for hydrocephalus in adults: report of a single unit’s experience with 63 cases. Surg Neurol 2001; 55 : 74–78.
56. Yamini B, Refai D, Rubin CM, Frim DM. Initial endoscopic management of pineal region tumors and associated hydrocephalus: clinical series and literature review. J Neurosurg 2004; 100 (Suppl 5): 437 – 441.
57. Cipri S, Gangemi A, Cafarelli F, Messina G, Iacopino P, Al Sayyad S et al. Neuroendoscopic management of hydrocephalus secondary to midline and pineal leasions. J Neurosurg Sci 2005; 49(3): 97 – 106.
58. Pople IK, Athanasiou TC, Sandeman DR, Coakham HB. The role of endoscopic biopsy and third ventriculostomy in the management of pineal region tumors. J Neurosurg 2001; 15(4): 305 – 311.
59. De Tribolet N. Management of pineal region tumors. In: Sindou M (ed). Practical handbook of neurosurgery. From leading neurosurgeons. Wien ‑ New York: Springer 2009 : 287 – 300.
60. Bruce JN, Stein BM. Supracerebellar approach in the pineal region. In: Apuzzo MLJ (ed). Brain surgery: complication avoidance and management. New York: Churchill ‑ Livingstone 1993 : 511 – 536.
61. Porter JM, Pidgeon C, Cunningham AJ. The sitting position in neurosugery: a critical appraisal. Br J Anaesth 1999; 82(1): 117 – 128.
62. Motomatsu H, Adachi H, Uno T, Kikuta I, Uehara K. Evaluation of catheter placement for treatment of venous air embolism in the sitting position. Fukuoka Igaku Zasshi 1979; 70(3): 66 – 71.
63. Haisa T, Kondo T. Midcervical flexion myelopathy after posterior fossa surgery in the sitting position: case report. Neurosurgery 1996; 38(4): 819 – 821.
64. McComb J, Apuzzo M. The lateral decubitus position for the surgical approach to pineal location tumors. Concepts Pediat Neurosurg 1988; 8 : 186 – 199.
65. Ausman JI, Malik GM, Dujovniy M, Mann R. Three ‑ quarter prone approach to the pineal ‑ tentorial region. Surg Neurol 1988; 29(4): 298 – 306.
66. Kobayashi S, Sugita K, Tanaka Y, Kyoshima K. Infratentorial approach to the pineal region in prone position: Concord position. J Neurosurg 1983; 58(1): 141 – 143.
67. Krause F. Operative freilegung der vierhugel, nebst beobachrunger uber hirndruch und decompression. Zentralbl Chir 1926; 53 : 2812 – 2819.
68. Zapletal B. Surgical approach to the region of incisura tentorii. Zentralbl Neurochir 1956; 16(2): 64 – 69.
69. Stein BM. The infratentorial supracerebellar approach to the pineal lesions. J Neurosurg 1971; 35(2): 197 – 202.
70. Van den Bergh R. Lateral ‑ paramedian infratentorial approach in lateral decubitus for pineal tumours. Clin Neurol Neurosurg 1990; 92(4): 311 – 316.
71. Poppen JL. The right occipital approach to a pinealoma. J Neurosurg 1966; 25(6): 706 – 710.
72. Jamieson KG. Excision of pineal tumors. J Neurosurg 1971; 35(5): 550 – 553.
73. Moshel YA, Parker EC, Kelly PJ. Occipital transtentorial approach to the precentral cerebellar fissure and posterior incisural space. Neurosurgery 2009; 65(3): 554 – 564.
74. Kawashima M, Rhoton AL Jr, Matsushima T. Comparison of posterior approaches to the posterior incisural space: microsurgical anatomy and proposal of a new method, the occipital bi ‑ transtentorial/ falcine approach. Neurosurgery 2002; 51(5): 1220 – 1221.
75. Dandy WE. An operation for removal of pineal tumors. Surg Gynec Obstet 1921; 33 : 113 – 119.
76. Van Wagenen WP. A surgical approach for removal of certain pineal tumors: report of a case. Surg Gynecol Obstet 1931; 53 : 216 – 220.
77. Sekhar LN, Goel A. Combined supratentorial and infratentorial approach to large pineal ‑ region meningioma. Surg Neurol 1992; 37(3): 197 – 201.
78. Ziyal IM, Sekhar LN, Salas E, Olan WJ. Combined supra/ inratentorial ‑ transsinus approach to large pineal region tumors. J Neurosurg1998; 88(6): 1050 – 1057.
79. Viale GL, Turtas S. The subchorioidal approach to the third ventricle. Surg Neurol 1980; 14(1): 71 – 74.
80. Samii M, Carvalho G, Tatagiba M, Mathies C, Vorkapic P. Meningiomas of the tentorial notch: surgical anatomy and management. J Neurosurg 1996; 84(3): 375 – 381.
81. Karnofsky DA, Burchenal JH. The clinical evaluation of chemotherapeutic agents in cancer. In: MacLeod CM (ed). Evaluation of chemotherapeutic agents. New York: Columbia University Press 1949 : 196.
82. Hernesniemi J, Romani R, Albayrak BS, Lehto H, Dashti R, Ramsey C et al. Microsurgical management of pineal region lesions: personal experience with 119 patients. Surg Neurol 2008; 70(6): 576 – 583.
83. Beneš V. Poznámky k diagnostice a léčbě v oblasti pinealis. Cesk Pediatr 1981; 36(10): 566 – 569.
Labels
Paediatric neurology Neurosurgery Neurology
Article was published inCzech and Slovak Neurology and Neurosurgery

2013 Issue 6-
All articles in this issue
- Comorbidity of Migraine and Depression – a Meta-analysis
- Oculopharyngeal Muscular Dystrophy in the Population of the Czech Republic
- Telemetric Monitoring of Intracranial Pressure in Diagnostics of Hydrocephalus and Intracranial Hypertension
- Occipital Condyle Fractures
- Distal Fusiform Aneurysms of the Anterior Temporal Artery – a Case Report
- Magnetic Resonance Imaging in Traumatic Brain Injury – a Case Report
- Idiopathic Spinal Cord Herniation – a Case Report
- Multiple Extraneural Metastases of an Anaplastic Astrocytoma – a Case Report
- Malignant Peripheral Nerve Sheath Tumour of Cervical Plexus – a Case Report
- Neurological Diagnoses in a Hospice Care – Two Case Reports
- Idiopathic Superficial Siderosis – a Case Report
- Tuberous Sclerosis Complex in Children Followed from Neonatal Period for Prenatally Diagnosed Cardiac Rhabdomyoma – Two Case Reports
- Spondylodiscitis with Abscess Formation in Paravertebral Muscles due to Streptococcus suis – a Case Report
- Failure of Intraoperative Indocyanine Green (ICG) Videoangiography to Detect a Clip Occlusion of an Aneurysm – a Case Report
- Pineal Region Expansions
- Frontotemporal Lobar Degeneration from the Perspective of the New Clinical‑ Pathological Correlations
- Cognitive Impairment in Early Stages of Multiple Sclerosis
- Preoperative Psychosocial Variables as Predictors of a Spinal Surgery Outcome
- The Effect of Virtual Reality Environment during Robotic‑Assisted Locomotor Training on Gross Motor Functions in Patients with Cerebral Palsy
- Czech and Slovak Neurology and Neurosurgery
- Journal archive
- Current issue
- Online only
- About the journal
Most read in this issue- Frontotemporal Lobar Degeneration from the Perspective of the New Clinical‑ Pathological Correlations
- Tuberous Sclerosis Complex in Children Followed from Neonatal Period for Prenatally Diagnosed Cardiac Rhabdomyoma – Two Case Reports
- Pineal Region Expansions
- Occipital Condyle Fractures
Login#ADS_BOTTOM_SCRIPTS#Forgotten passwordEnter the email address that you registered with. We will send you instructions on how to set a new password.
- Career







