-
Medical journals
- Career
Elektrofyziologické vyšetření pánevního dna
: Z. Kadaňka Jr
: Cesk Slov Neurol N 2013; 76/109(2): 155-161
: Review Article
EMG vyšetření pánevního dna je užíváno často pro výzkumné účely, bývá však nezřídka indikováno i v rutinní klinické praxi. Článek podává přehled elektrofyziologických technik, které se užívají v diagnostice lézí pánevního dna, a zaměřuje se na jejich klinickou užitečnost a diagnostickou výtěžnost.
Klíčová slova:
pánevní dno – neurofyziologie – anální sfinkterÚvod
Diagnostika chorob lokalizovaných v oblasti pánevního dna a elektromyografické (EMG) vyšetření této krajiny nejsou mezi elektromyografisty ani neurology příliš rozšířeny, přestože se užívají již téměř půl století. Stále však patří spíše na okraj neurologického vyšetřovacího algoritmu, pacienti jsou nezřídka odesíláni mezi specialisty různých odborností, jako jsou urologové, neurologové, gynekologové, sexuologové, a často bývá diagnostický závěr velmi vágní a nejasný. V této práci podáváme přehled současných metod, které se klinicky i experimentálně používají v elektrofyziologii pánevního dna, popisujeme nejčastější indikace těchto vyšetření a zaměřujeme se na jejich smysluplnost a zejména výtěžnost.
Anatomie
Svalové dno pánevní sestává ze čtyř anatomických vrstev. První z nich je endopelvikální fascie, což je vazivová membrána, která obaluje diaphragma pelvis a střeva.
Druhou vrstvou, funkčně nejvýznamnější, je tzv. diaphragma pelvis. Tvoří ji dva svaly – m. levator ani a m. coccygeus. M. levator ani je funkčně nejvýznamnější sval pánevního dna tvořený širokou svalovinou, která je ventrálně uchycena k os pubis a šíří se laterálně až ke spina ischiadica. Dělí se na m. iliococcygeus, pubococcygeus a pubovisceralis (obr. 1). Funkčně tvoří pružnou spodinu pánve, podpírá pánevní orgány, působí kontrakci vaginy a elevaci zadní stěny poševní u žen, u mužů se uzávěrem konečníku účastní procesu defekace. Sval je inervován somatickými nervovými vlákny, která vycházejí zejména z kořene S3, méně i S4 a minimálně i S2, a následně tvoří n. levator ani. M. coccygeus je v podstatě jen muskulotendinózní vnitřní povrch sakrospinózního ligamenta a na aktivním pohybu se nikterak nepodílí.
1. Druhá vrstva svalů pánevního dna – diaphragma urogenitale. Autor děkuje MgA. Marianě Marešové za poskytnutí obrázku. 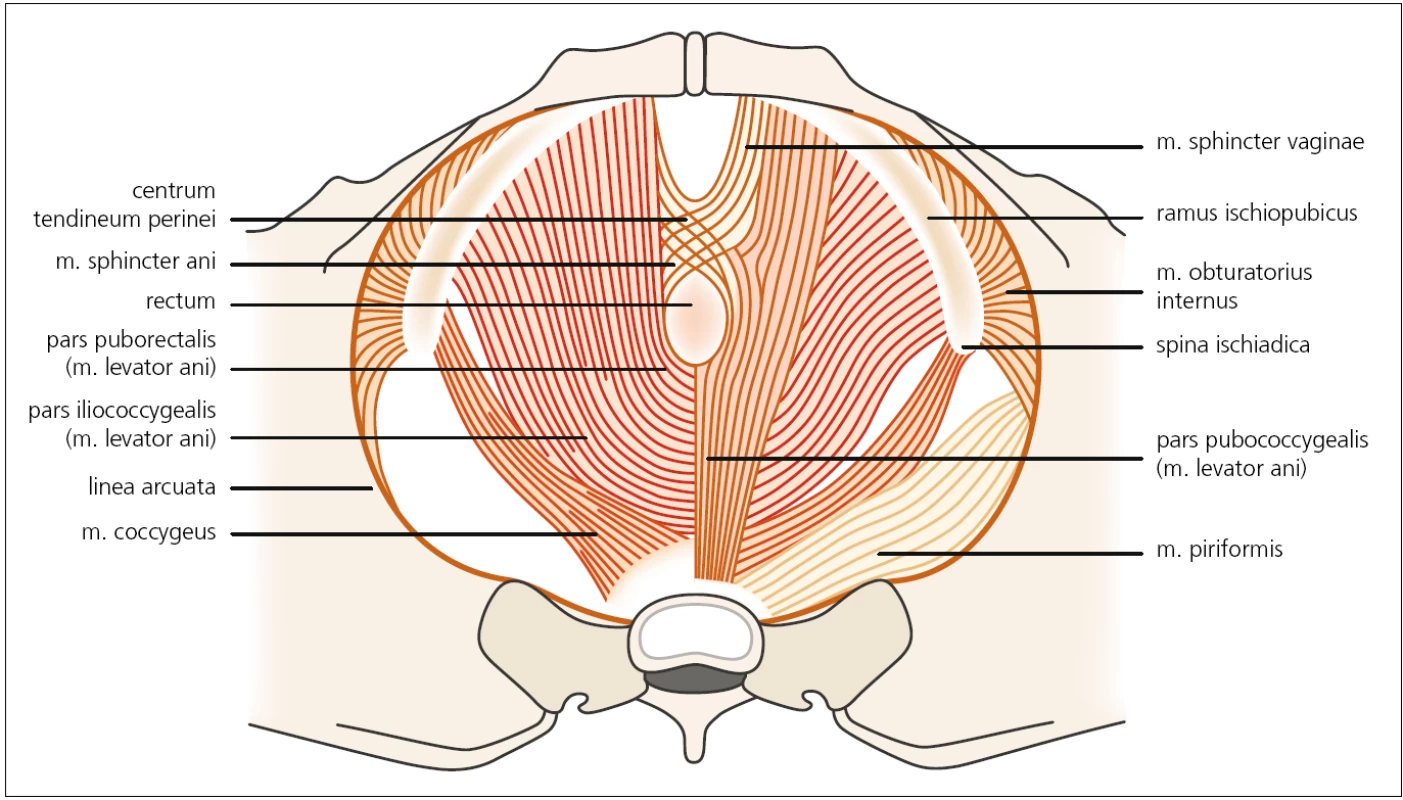
Třetí vrstvou je diaphragma urogenitale, která bývá popisována jako trilaminární struktura s hlubokými transverzálními perineálními svaly mezi vnitřní a zevní fascií.
Čtvrtá vrstva je z elektromyografického pohledu nejzajímavější, neboť je uložena nejvíce povrchově, a tím nejlépe dostupná (obr. 2). Sestává z m. transversus perinei (podpůrná funkce), m. bulbospongiosus (-cavernosus) a ischiocavernosus (odpovědné za sexuální funkce) a zejména m. phincter ani externus, což je zdaleka nejčastěji vyšetřovaný sval. Čtvrtá vrstva je kompletně inervována pudendálním nervem.
2. Čtvrtá vrstva svalů pánevního dna – zevní genitální svaly. Autor děkuje MgA. Marianě Marešové za poskytnutí obrázku. 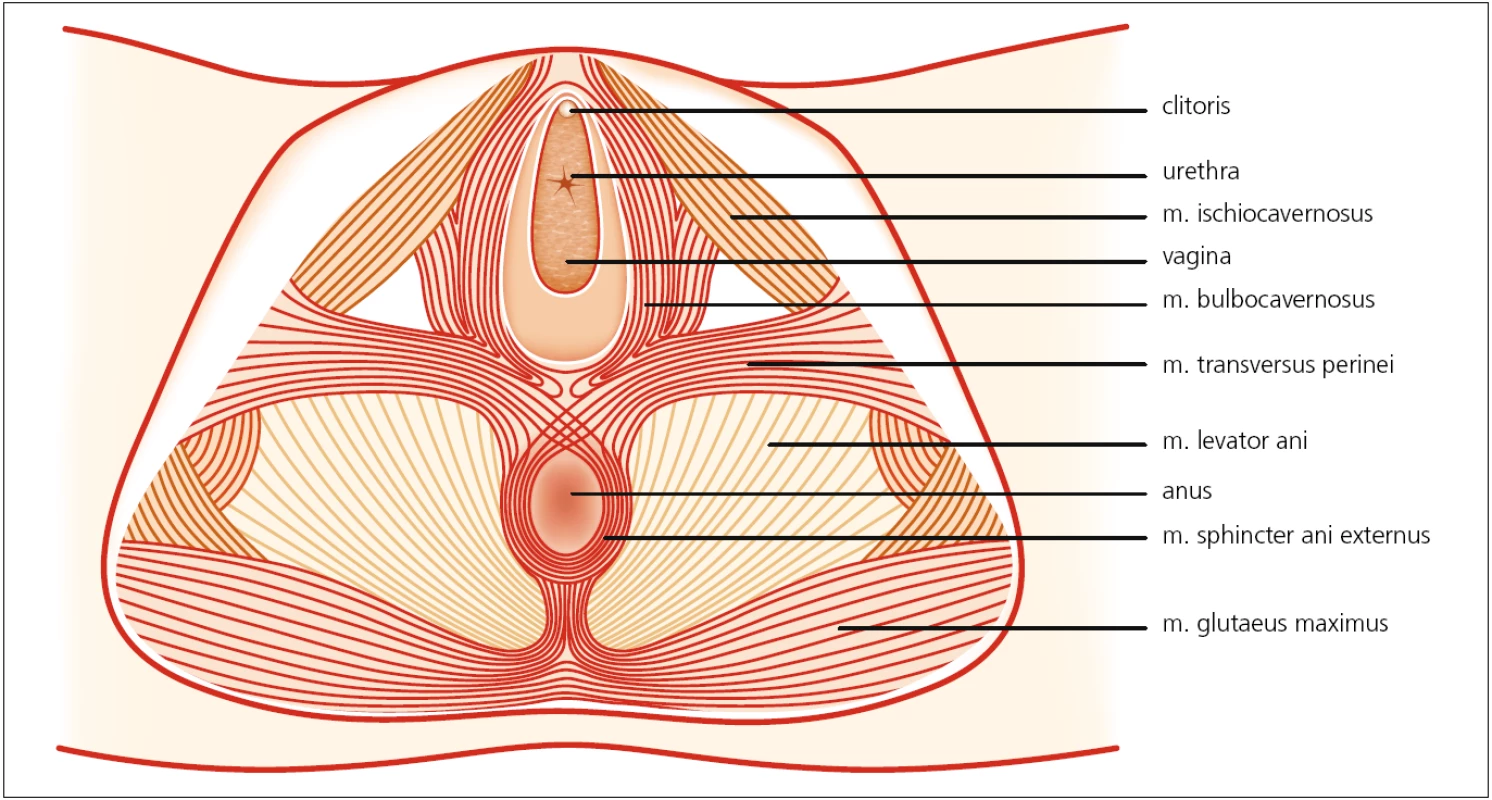
Praktický postup při vyšetření
Před vlastním elektromyografickým vyšetřením odebereme anamnézu se zaměřením na vertebrogenní, sexuální, močové a anorektální potíže. U žen je velmi důležité zjištění počtu porodů, zda probíhaly přirozenou cestou či císařským řezem. Následuje stručné vysvětlení vlastního EMG vyšetření.
V objektivním vyšetření se zaměříme na reflexy a eventuální parézy na dolních končetinách, čití (včetně perianogenitálního), vybavujeme anální a bulbokavernózní reflex a palpačně zhodnotíme tonus zevního análního svěrače.
EMG vyšetření provádíme v poloze na levém boku (Simova poloha), event. v poloze „na čtyřech“ s flektovanými horními i dolními končetinami, která se nám však jeví méně praktická.
Vyšetření obvykle začínáme jehlovou EMG zevního análního svěrače, jež bývá klinicky nejvíce výtěžná, pak následují další testy dle diagnostického problému.
Elektrofyziologické metody
Existuje celá řada testů, které se používají, ať již experimentálně (uvádíme v textu kurzivou), či v rutinní elektromyografické praxi.
- testy motorického nervového systému: jehlová EMG, měření terminální motorické latence, motorické evokované potenciály (MEP),
- testy senzitivního systému: senzitivní neurografie, somatosenzitivní evokované potenciály (SEP),
- vyšetření reflexů,
- testy sympatických a parasympatických autonomních drah.
1. Testy k hodnocení stavu motorického nervového systému
Jehlová EMG zevního análního sfinkteru
Vzhledem k relativně snadnému přístupu, dostatečně objemné svalové hmotě je zevní anální sfinkter nejčastěji vyšetřovaným svalem pánevního dna [1,2].
Při hodnocení EMG záznamu ze zevního análního sfinkteru je velmi důležité si uvědomit, že na rozdíl od končetinových svalů, kde je ve zdravém relaxovaném svalu přítomno elektrické ticho, ve svěračích některé motorické jednotky pálí kontinuálně. Můžeme pak pozorovat dva typy populací motorických jednotek a jejich potenciálů (MUP): reflexně (nebo volně) aktivované vysokoprahové MUP a kontinuálně aktivní nízkoprahové MUP.
Při jehlové EMG zevního análního svěrače nejprve vyšetřujeme podkožní porci svalu, kdy je jehla aplikována 1 cm od okraje análního otvoru do hloubky asi 3–6 mm. Následně vyšetřujeme hlubší část svalu tím, že pokračujeme v pohybu jehlou v úhlu asi 30 stupňů (k ose análního kanálu) až do hloubky 1–3 cm. Zevní anální sfinkter vždy vyšetřujeme oboustranně.
Jehlová EMG zevního análního sfinkteru koncentrickou jehlovou elektrodou sestává z observace spontánní aktivity, hodnocení parametrů motorických jednotek a vyhodnocení interferenčního vzorce (tab. 1).
1. Jehlová EMG zevního análního sfinkteru – praktický postup. 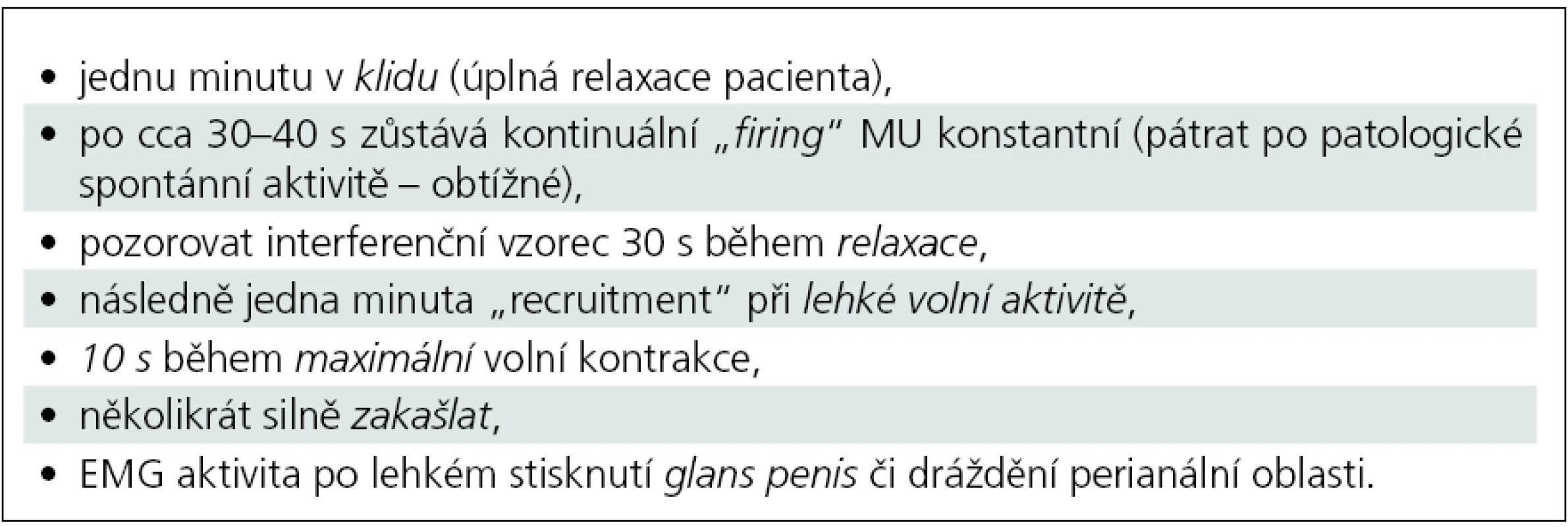
V normálním svalu svěrače vyvolává pohyb jehlou krátký výboj inzerční aktivity, daný mechanickou stimulací excitabilních membrán. Absence této aktivity znamená kompletní svalovou atrofii (např. při kompletní lézi míšního konu či kaudy ekviny) [2].
Při úplné denervaci svalu v prvních dnech veškerá motorická aktivita vymizí a ve svalu je přítomno elektrické ticho (kromě inzerční aktivity). Přibližně za 10–20 dní se objevuje abnormní spontánní aktivita ve formě fibrilací a pozitivních ostrých vln. V průběhu reinervace se postupně začínají objevovat nejprve krátké MUP s nízkou amplitudou nascent units, bi - až trifázické, následované polyfázickými, prolongovanými potenciály motorických jednotek.
Pokud dojde k parciální denervaci svalu, některé potenciály motorických jednotek zůstávají výbavné. Protože jsou i za fyziologického stavu krátkého trvání a většinou trifázické (podobně jako fibrilace), mohou se mísit s abnormní spontánní aktivitou a často bývají elektrofyziologicky nerozeznatelné. V tomto případě je přínosné vyšetření m. bulbocavernosus, který postrádá kontinuální svalovou aktivitu nízkoprahových MUP (na rozdíl od sfinkterů) a je inervován z téhož nervu (n. pudendus) [3].
Při déletrvající parciální denervaci bývají přítomny i komplexní repetitivní výboje (CRD), které mohou být vyvolány buď pohybem jehlou, svalovou kontrakcí, či se objevují spontánně, rytmicky. V parciálně denervovaných sfinkterech bývá přítomna též ztráta motorických jednotek, kterou však lze velmi obtížně kvantifikovat.
Určitý typ repetitivních výbojů zvaný „decelerating burst“ a CRD může být nalezen v zevním uretrálním sfinkteru některých mladých žen s tzv. syndromem Fowlerové (viz níže). Tato aktivita může být tak častá, že způsobí mimovolní svalové kontrakce a močovou retenci [4].
Při vyšetření svalů pánevního dna můžeme použít dva typy elektrod – koncentrickou jehlovou elektrodu nebo Single--Fibre EMG elektrodu (SFEMG).
Koncentrická jehlová elektroda se používá standardně v běžné praxi. K analýze potenciálů motorických jednotek lze kromě vizuálního hodnocení využít sofistikované techniky, jako jsou multi-MUP analýza a analýza interferenčního vzorce metodou turn/amplitude. Průměrná hodnota amplitudy MUP bývá uváděna 0,37 mV ± 0,13 trvání 8,27 ms ± 2,5, počet fází 3,77 ± 0,9, area 0,36 mV/ms ± 0,2 [5] či amplituda 0,609 ± 0,093, trvání 5,5 ms ± 1,12, area 0,356 ± 0,135 mV/ms, počet fází 3,02 ± 0,36 [6].
Single-fibre EMG jehla snímá elektrickou aktivitu 1–3 svalových vláken stejné motorické jednotky. SFEMG parametr, který reflektuje morfologii MU, je hustota svalových vláken (fiber density), což je průměrný počet svalových vláken, jež náleží k jedné motorické jednotce ve vyšetřovaném poli. Normální svalová hustota zevního análního sfinkteru je méně než 2 [7]. SF EMG elektrodou se dá též měřit instabilita MUP – tzv. jitter, toto měření se však u svalů pánevního dna rutinně neužívá. Svalová hustota bývá vyšší u reinervovaných svalů, SF EMG tak může vzhledem ke své vysoké senzitivitě odhalit poměrně diskrétní reinervační změny, k detekci spontánní aktivity však příliš vhodná není.
V běžné EMG praxi ale zůstává metodou vyšetření svalů pánevního dna stále koncentrická jehlová elektroda, SF elektroda není doporučována pro rutinní vyšetření a zůstává zatím spíše metodou experimentální.
Motorická kondukční studie nervus pudendus
Jediný elektrofyziologický parametr, který může být kondukčními studiemi v oblasti pánevního dna měřen, je terminální motorická latence pudendálního nervu (PNTML). Tato latence změří však pouze nejrychleji vedoucí vlákna a jejím nedostatkem je to, že nezískáme informaci o velikosti axonální ztráty. Využití velikosti amplitudy M vlny (které se s úspěchem využívá k detekci axonální ztráty na končetinových svalech) se u zevního análního sfinkteru nebo jiných svalů pánevního dna neukázalo být přínosné.
Nejrozšířenější metodou měření PNTML je užití pudendální elektrody (z Nemocnice svatého Marka v Londýně) (obr. 3) [8]. Ta sestává z bipolární stimulující elektrody upevněné na špičce ukazováku (v rukavici) a snímací elektrody uchycené 8 cm proximálně na bázi prstu. Prst se vsune do konečníku a stimulace se provádí v místě spina ischiadica. Tímto způsobem bývají získány hodnoty latencí typicky 2 ms (1,55–2,54 ms) [9].
Prolongace PMTL byla prokázána u žen se stresovou močovou inkontinencí [10], u žen krátce [11], ale i pět let po vaginálním porodu [12]. Prolongace se nachází též u pacientů s prolapsem pánevního dna [13]. Jaký typ abnormity prolongace této latence představuje, zůstává nejasné. Rozhodně tím není vyjádřena míra denervace, jak se někdy mylně uvádí.
Prodloužení PNTML, pokud je prokázáno, bývá velmi malé (0,1 až 0,3 ms) [14] a nelze předpokládat, že by toto zpomalení vedení způsobilo výraznou funkční změnu.
Obecně se měření PNTML nepovažuje za příliš přínosné v diagnostice postižení pánevního dna. Výbavnost CMAP v těchto svalech může být užitečná u pacientů s kombinovanou lézí horního a dolního motoneuronu, u kterých není zaznamenána žádná MUP aktivita, avšak přítomnost CMAP nervus pudendus vylučuje kompletní axonální lézi.
Stimulace předních sakrálních kořenů
Elektrická či magnetická stimulace depolarizuje okolní nervové struktury, a dochází tak k aktivaci několika svalů, které jsou inervovány příslušným lumbosakrálním segmentem. Motorické odpovědi z gluteálních svalů bývají většinou nepřesné, proto se doporučuje užívat snímací povrchové elektrody ze zevních sfinkterů [15]. Klinický význam této metody je dosud předmětem výzkumu.
Motorické evokované potenciály svalů pánevního dna
Při mechanické či elektrické stimulaci motorického kortexu může být též získána odpověď ze svalů pánevního dna – a to m. sphincter ani externus a m. bulbocavernosus. Průměrné hodnoty jsou od 30 do 35 ms [15,16].
Delší centrální kondukční čas byl prokázán u pacientů s roztroušenou sklerózou a míšními lézemi, avšak u těchto pacientů již bylo postižení jasně klinicky vyjádřeno [17]. V běžné klinické praxi se toto vyšetření neužívá.
2. Testy senzitivního nervového systému
Pudendální somatosenzitivní evokované potenciály (SEP)
Pudendální SEP se dají poměrně jednoduše vybavit po elektrické stimulaci n. dorsalis penis či clitoridis [14].
Mohou být vyšetřovány u pacientů s neurogenní erektilní dysfunkcí, diabetem, roztroušenou sklerózou a u stavů po míšních traumatech.
Senzitivita vyšetření je však nízká [18], dokonce se ukazuje přínosnější klasické neurologické vyšetření [19].
Klinický význam této metody bude muset být ještě upřesněn dalšími studiemi.
Neurografie nervus dorsalis penis
Tímto vyšetřením získáme informaci o stavu senzitivních drah dolních sakrálních segmentů.
Stimulační elektroda se přikládá na oblast glans penis a snímá se odpověď v oblasti kořene penisu. Amplituda SNAP bývá cca 10 µV a rychlost vedení kolem 27 m/s, je však výrazně závislá i na natažení penisu. Předpokládalo se, že metoda bude užitečná v diagnostice erektilní dysfunkce způsobené senzorickou penilní neuropatií [20], avšak praktické problémy při měření vzdálenosti vedení nervem způsobily, že se užívá jen zřídka.
Elektroneurografie dorzálních sakrálních kořenů
Při stimulaci n. dorsalis penis či clitoridis může být snímán SNAP při peroperačním odhalení sakrálních kořenů. To se ukázalo být užitečné pro následné zachování perineální cítivosti u dětí, které prodělaly dorzální rizotomii a výbavnost SNAP pravděpodobně koreluje s nižší incidencí postoperačních defekačních komplikací [21]. Mimo operační sál se tato metoda neužívá.
Cerebrální SEP při elektrické stimulaci uretry, močového měchýře a análního kanálu
Jsou více relevantní než pudendální SEP, protože senzorická A-delta vlákna, která vedou impulzy z měchýře a proximální uretry, doprovází autonomní vlákna pelvických nervů.
Klinická užitečnost toho vyšetření však prokázána nebyla.
3. Vyšetření sakrálních reflexů
Jsou to reflexy, které vyvolávají motorickou odpověď svalů pánevního dna po stimulaci senzitivních vláken v urogenitální oblasti. Vyšetřujeme anální a bulbokavernózní reflex – oba mají aferentní i eferentní dráhu v pudendálním nervu a jsou inervovány segmentem S2–S4.
Můžeme použít buď elektrickou [22], mechanickou [23], nebo magnetickou [24] stimulaci. V klinické praxi se však užívá pouze elektrická a mechanická stimulace.
Sakrální reflex vyvolaný stimulací n. dorsalis penis či n. clitoridis má dvě komponenty. První z nich, lépe vybavitelná (o latenci cca 33 ms) je stabilní, nepodléhá habituaci a předpokládá se, že se jedná o oligosynaptický reflex. Druhá komponenta reflexu je delší a předpokládá se, že jde o polysynaptický reflex. Vybavení reflexů bývá často obtížné a odpověď jde ozřejmit užitím dvojitého elektrického stimulu [25]
Odpověď sakrálního reflexu by měla být analyzována na obou stranách zevního análního sfinkteru (či z obou mm. bulbocavernosi), jednostranné či asymetrické léze totiž bývají poměrně časté.
Většinou se užívá povrchová stimulační elektroda umístěná na kořen penisu (či na klitoris), aplikuje se deset (0,2 ms trvajících) stimulů o frekvenci 0,5 Hz [3]. Snímací jehlová (event. povrchová) elektroda je zavedena do zevního análního sfinkteru či bulbokavernózního svalu.
Vybavení sakrálních reflexů má největší význam u pacientů se syndromem kaudy ekviny a jiných lézí dolního motoneuronu. Bylo zkoušeno i jejich využití v diagnostice erektilní dysfunkce, avšak specificita a senzitivita byla malá [26].
Abnormně krátká latence reflexu může znamenat abnormálně nízké uložení konu či suprasakrální míšní lézi [27,28].
Vyšetření sakrálních reflexů je jedním z nejdůležitějších vyšetření pánevního dna.
Jejich elektrofyziologické vybavení je senzitivní způsob zjištění kontinuity reflexního oblouku S2–S4. Výsledky musí korelovat s klinickým nálezem, což však platí pro elektrofyziologické testy obecně.
4. Testování autonomního nervového systému
Většina lokálních lézí nervového systému v sakrální oblasti zahrnuje somatická i autonomní vlákna. Některé lokální patologické léze však mohou vést k izolovanému postižení autonomního nervového systému (radikální prostatektomie, mezorektální excize karcinomu). V těchto případech jsou testy autonomní nervové soustavy velmi užitečné.
Sympatická kožní odpověď (SSR)
Sympatický nervový systém zahrnuje i aktivitu potních kožních žláz a změny aktivity těchto žláz mění i kožní rezistenci. Změna potenciálu tak může být zaznamenána v oblasti dlaní i chodidel a bylo prokázáno, že se jedná o užitečný parametr v diagnostice neuropatie tenkých vláken. Sympatická kožní odpověď může být zaznamenána i z perineální oblasti a z penisu. Latence SSR po stimulaci nervus medianus na zápěstí kolísá od 1,5 do 2,3 sekundy u zdravých jedinců [29]. Odpověď rychle podléhá habituaci a výrazně též závisí na endogenních i exogenních faktorech včetně teploty kůže. Pouze absence SSR tak může být brána jak abnormita.
Prozatím však neexistuje konsenzus klinického využití SSR v testování sakrální dysfunkce.
Jehlová EMG corpus cavernosum
Byla zkoušena jen raritně [30]. Tato velmi bolestivá metoda si své místo v diagnostice postižení pánevního dna hledá.
Indikace EMG vyšetření pánevního dna
Neurofyziologické techniky při vyšetření pánevního dna bývají používány pro výzkumné účely, ale jsou relativně často indikovány i v každodenní neurologické praxi. Indikace mohou být poměrně široké, avšak pouze u určitých typů onemocnění mohou tato často nepříjemná vyšetření přispět k upřesnění diagnózy a stanovení dalšího terapeutického postupu. World Health Organization (WHO) vydala konsenzus, jenž určuje, u kterých pacientů mají tato vyšetření jednoznačný přínos. Jedná se o pacienty s předpokládanou lézí periferního nervového systému v oblasti pánevní, u pacientů s multisystémovou atrofií a u žen s močovou retencí [3]. Ostatní indikace většinou mnoho informací, které by přispěly ke zpřesnění diagnostického a léčebného postupu, nepřinesou.
Jednoznačně přínosné indikace EMG pánevního dna
Parkinsonizmus
Neuropatické změny byly opakovaně prokázány ve sfinkterech u pacientů s multisystémovou atrofií (MSA) [31–34]. MSA je progresivní neurodegenerativní onemocnění, které bývá (zejména v časných stadiích) zaměňováno za Parkinsonovu nemoc. Močová inkontinence (u obou pohlaví) a erektilní dysfunkce často předchází začátek typických neurologických příznaků [35]. Jako část neurodegenerativního procesu je přítomna ztráta motorických jednotek v Onufově jádře, objevuje se parciální, ale progresivní denervace v musculus sphincter ani externus [31] a bulbocavernosus, postupně se známkami reinervace [32].
Jehlová EMG sfinkteru je tedy prospěšná v diferenciální diagnostice Parkinsonovy choroby a MSA [32]. Nemusí však být pozitivní v počátku onemocnění [31], není specifická po pěti letech trvání parkinsonizmu [36] a může být přítomna i u jiných parkinsonských syndromů (progresivní supranukleární paralýza) [37].
Jehlová EMG zevního análního sfinkteru s pátráním po abnormní spontánní aktivitě [33] a multiMUP analýza [32,34] jsou tedy jednoznačně indikovány u pacientů s podezřením na MSA.
Syndrom kaudy ekviny a léze conus medullaris
Tyto léze často způsobují dysfunkci svalů pánevního dna. Nejčastější příčinou je zúžení páteřního kanálu hernií disku, zlomeninou obratle, epidurálním hematomem, tumory, ale i iatrogenně – operací hernií disků. Při podezření na syndrom kaudy rutinně provádíme jehlovou EMG zevního análního sfinkteru a vyšetření bulbokavernózního reflexu. Abnormní spontánní aktivita se ve svalech pánevního dna objevuje přibližně tři týdny po traumatu. Většina lézí způsobuje parciální denervaci, kompletní denervace je pravděpodobně přítomna pouze u traumatických lézí lumbosakrální páteře a zejména pánve [38]. Velmi důležitá je i jehlová EMG m. bulbocavernosus – zvláště k průkazu abnormní spontánní aktivity, která je v zevním análním sfinkteru jen obtížně prokazatelná.
Močová retence u mladých žen (syndrom Fowlerové)
Dlouhou dobu se předpokládalo, že izolovaná močová retence u mladých žen je buď psychogenního původu, anebo se jedná o první symptom roztroušené sklerózy. Jehlová EMG zevního uretrálního sfinkteru u těchto pacientek však prokázala časté CRD a tzv. decelerating bursts („pseudomyotonické“ bizarní repetitivní výboje pocházející pravděpodobně z efaptické transmise vzruchu mezi svalovými vlákny – nikoliv mezi terminálními axony) [4,39]. Proč tato aktivita vzniká, není prozatím jasné. Tato jednotka, poprvé popsána v roce 1985, bývá spojena s polycystickými ovarii. Byla nazvána po své objevitelce prof. Clare J. Fowlerové [40]. Typicky se jedná o mladé ženy pod 30 let. Abnormní spontánní aktivita během močení může způsobovat potíže ve smyslu retence [41]. Někteří autoři doporučují, aby EMG uretrálního sfinkteru bylo prováděno u všech žen s močovou retencí [4,41].
EMG indikace, které mají zejména výzkumný význam a jejich klinický přínos je malý
Močová inkontinence
Obecně se předpokládá role denervačních procesů oblasti pánevního dna v patofyziologii vzniku stresové inkontinence. Studie se single-fibre EMG elektrodou měřily svalovou denzitu zevního análního sfinkteru a její zvýšení bylo skutečně zjištěno u pacientek trpících močovou inkontinencí [42]. Parciální denervace či reinervace byly též prokázány u žen s močovou inkontinencí a genitálním prolapsem. Byly zjištěny výraznější denervační a reinervační změny v závislosti na věku [43,44]. Při užití koncentrické jehlové EMG m. pubococcygeus bylo prokázáno signifikantní prodloužení trvání MUP po vaginálním porodu [45] – tyto změny byly markantní zejména u žen, které trpěly inkontinencí i osm týdnů po porodu, měly prodlouženou druhou dobu porodní a ty, které rodily děti o vyšší hmotnosti [46,47]. Vaginální porod způsobuje známky denervace až u 80 % žen. Pokud však byly provedeny srovnávací IP a MUP analýzy sfinkterů mezi ženami-rodičkami a ženami-nerodičkami, tak byl sice prokázán vyšší podíl neuropatických změn u rodiček, nebyl však signifikantní. Dokonce jedna skupina rodiček (s mírnými inkontinenčními potížemi) měla nižší počet neuropatických MUP, než nulipary [48]. Z těchto poznatků byl tedy vyvozen závěr, že vaginální porod pravděpodobně způsobí neuropatické změny ve svalech pánevního dna, ale ty jsou často malé a klinicky nevýznamné. Byla též prokázána prolongace PMTL u žen po porodu, což je dáno pravděpodobně postižením pudendálního nervu při porodu či výrazným abdominálním tlakem při užití břišního lisu [49], klinický význam této prolongace je rovněž pochybný.
V zevním uretrálním svalu bývají neuropatické změny vyjádřeny ještě více – signifikantně více fibrilací, méně MUP, vyšší procento polyfázií. Role EMG uretrálního sfinkteru pacientů s močovou inkontinencí však přesto zůstává nejasná. Ačkoliv se tato indikace zdá být velmi logická – zejména u pacientek s močovou inkontinencí suspektně „neurogenního původu“ –, tak u mnoha inkontinentních žen-rodiček zbývá pouze malé množství svalové tkáně tohoto svěrače, sval bývá často i vazivově změněn [39]. To pochopitelně výrazně snižuje kvalitu toho bolestivého vyšetření.
Přínos vyšetření v této indikaci je tedy velmi malý. Při EMG vyšetření pánevního dna u inkontinentních starších žen-rodiček (jichž se tato problematika v drtivé většině týká) zjistíme s vysokou pravděpodobností v zevním análním i uretrálním sfinkteru chronické denervační a reinervační změny. Výsledek vyšetření však většinou neovlivní léčebný ani diagnostický postup.
Inkontinence stolice
Inkontinence stolice nejasné příčiny je indikace, u které se předpokládá, že jehlová EMG zevního análního sfinkteru bude pro pacienta diagnosticky přínosná (poté, co je zobrazovacími vyšetřeními vyloučena lokální strukturální léze).
U těchto pacientů bychom však měli klinicky i elektrofyziologicky pátrat zejména po známkách generalizovaného (např. MSA) či lokalizovaného (léze kaudy či konu) procesu. Neexistuje žádný konsenzus o užitečnosti neurofyziologických testů u pacientů s anální inkontinencí a normálním klinickým neurologickým nálezem.
Chronická obstipace
Obstipace je velmi heterogenní syndrom, který je v populaci poměrně častý (záleží ovšem, jaká kritéria pro definici obstipace použijeme). Při užití single-fibre EMG a multiMUP analýz byly prokázány elekrofyziologické změny zevního análního sfinkteru u pacientů s těžkou obstipací (nejedná se však o univerzální nález) [50]. Postižení inervace pánevního dna je pravděpodobně dáno opakovaným zvýšeným napětím způsobeným břišním lisem. V jedné studii nebyl prokázán vztah mezi mírnou obstipací a změnami v zevním análním sfinkteru [1].
Zobrazovací metody jsou v diagnostice chronické obstipace mnohem užitečnější. Ukážou jednak mechanizmus obstipace (prolongovaný transport přes kolon) či abnormální pohybový vzorec svalů pánevního dna.
Erektilní dysfunkce
V této indikaci byla testována celá řada neurofyziologických technik.
Uvažovalo se o senzorické penilní neuropatii jako o příčině erektilní dysfunkce, byla prováděna senzitivní kondukční studie n. dorsalis penis i elektrické testování bulbokavernózního reflexu. Senzitivita a specificita těchto vyšetření však byla nízká, protože mnoho pacientů s klinicky jasnou erektilní dysfunkcí mělo vyšetřované hodnoty v normě. Naopak pacienti (např. s HSMN typu I) – bez sexuálních problémů – vykazovali prolongaci měřených odpovědí [51].
U pacientů s diabetem a erektilní dysfunkcí se ukázaly mnohem užitečnější kondukční studie periferních nervů než vyšetření bulbokavernózního reflexu [52]. Autonomní funkční testy a SSR se též zdají být mnohem přínosnější než pudendální SEP a BCR [53]. Jehlová EMG kavernózních těles zůstává velmi kontroverzní [30].
Konsenzus společnosti pro erektilní dysfunkci je ten, že EMG techniky jsou vhodné pouze u velmi malého počtu pacientů, kde se předpokládá velmi pravděpodobná neurologická příčina potíží [54].
Závěr
EMG vyšetření pánevního dna má v neurologickém diagnostickém algoritmu bezpochyby své místo. Musí však být indikováno racionálně s cílem ovlivnit další terapeutický či diagnostický postup. Jednoznačné indikace jsou diferenciální diagnostika Parkinsonovy choroby a MSA, močová retence u mladých žen a syndrom kaudy ekviny či míšního konu. Další indikace bývají sporné a většinou neznamenají žádný přínos.
Nejčastěji bývá prováděna koncentrickou jehlovou elektrodou EMG zevního análního (či uretrálního) sfinkteru, vyšetření bulbokavernózního reflexu elektrickou stimulací, vzácně i stanovení terminální motorické latence pudendálního nervu. Mezi EMG metody pánevního dna můžeme zařadit i testy autonomních funkcí (SSR), kondukční studie periferních nervů na dolních končetinách a SEP n. tibialis – vše v diagnostice erektilní dysfunkce.
Autor deklaruje, že v souvislosti s předmětem studie nemá žádné komerční zájmy.
Redakční rada potvrzuje, že rukopis práce splnil ICMJE kritéria pro publikace zasílané do biomedicínských časopisů.
MUDr. Zdeněk Kadaňka jr
Neurologická klinika LF MU a FN Brno
Jihlavská 20
625 00 Brno
e-mail: zdenek.kadanka@fnbrno.cz
Přijato k recenzi: 22. 6. 2012
Přijato do tisku: 8. 10. 2012
Sources
1. Podnar S, Vodusek DB. Standardization of anal sphincter electromyography: uniformity of the muscle. Muscle Nerve 2000; 23(1): 122–125.
2. Podnar S, Rodi Z, Lukanovic A, Trsinar B, Vodusek DB. Standardisation of anal sphincter EMG: technique of needle examination. Muscle Nerve 1999; 22(3): 400–403.
3. Fowler CJ, Benson JT, Craggs MD et al. Clinical neurophysiology. In: Abrams P, Cardozo L, Khoury S et al (eds). Incontinence. Plymouth UK: Health Publication 2002 : 389–424.
4. Fowler CJ, Kirby RS, Harrison MJ. Decelerating bursts and complex repetitive discharges in the striated muscle of the urethral sphincter, associated with urinary retention in women. J Neurol Neurosurg Psychiatry 1985; 48(10): 1004–1009.
5. Weidner AC, Sanders DB, Nandedkar SD, Bump RC. Quantitative electromyographic analysis of levator ani and external anal sphincter muscles of nulliparous women. Am J Obstet Gynecol 2000; 183(5): 1249–1256.
6. Podnar S. Criteria for neuropathic abnormality in quantitative anal sphincter electromyography. Muscle Nerve 2004; 30(5): 596–601.
7. Vodusek DB, Janko M. SF EMG in striated sphincter muscle. Muscle Nerve 1981; 4(3): 252.
8. Kiff ES, Swash M. Normal proximal and delayed distal conduction in the pudendal nerve of patients with idiopathic (neurogenic) faecal incontinence. J Neurol Neurosurg Psychiatry 1984; 47(8): 820–823.
9. Olsen AL, Ross M, Stansfield RB, Kreiter C. Pelvic floor nerve conduction studies: establishing clinically relevant normative data. Am J Obstet Gynecol 2003; 189(4): 1114–1119.
10. Snooks SJ, Barnes PR, Swash M, Henry MM. Damage to the innervation of the pelvic floor musculature in chronic constipation. Gastroenterology; 89(5): 977–981.
11. Snooks SJ, Swash M, Setchell M, Henry MM. Injury to innervation of pelvic floor sphincter musculature in childbirth. Lancet 1984; 2(8402): 546–550.
12. Snooks SJ, Swash M, Mathers SE, Henry MM. Effect of vaginal delivery in the pelvic floor: a 5-year follow-up. Br J Surg 1990; 77(12): 1358–1360.
13. Benson T, McClellan E. The effect of vaginal dissection on the pudendal nerve. Obstet Gynecol 1993; 82(3): 387–389.
14. Haldeman S, Bradley WE, Bhatia N. Evoked responses from the pudendal nerve. J Urol 1982; 128(5): 974–980.
15. Vodusek DB, Zidar J. Perineal motor evoked responses. Neurourol Urodynamic 1988; 7 : 236–237.
16. Thiry AJ, Deltrenre PF. Neurophysiological assessment of the central motor pathway to the external urethral sphincter in man. Br J Urol 1989; 63(5): 515–519.
17. Eardley I, Nagendran K, Lecky B, Chapple CR, Kirby RS, Fowler CJ. Neurophysiology of the striated urethral sphincter in multiple sclerosis. Br J Urol 1991; 68(1): 81–88.
18. Rodi Z, Vodusek DB, Denislic M. Clinical uro-neurophysiological investigation in multiple sclerosis. Eur J Neurol 1996; 3(6): 574–580.
19. Delodovici ML, Fowler CJ. Clinical value of the pudendal somatosensory evoked potential. Electroencephalogr Clin Neurophysiol 1995; 96(6): 509–515.
20. Bradley WE, Lin JT, Johnson B. Measurement of the conduction velocity of the dorsal nerve of the penis. J Urol 1984; 131(6): 1127–1129.
21. Deletis V, Vodusek DB, Abbott R, Epstein FJ, Turndorf H. Intraoperative monitoring of dorsal sacral roots: minimizing the risk of iatrogenic micturition disorders. Neurosurgery 1992; 30(1): 72–75.
22. Ertekin C, Reel F. Bulbocavernosus reflex in normal men and in patients with neurogenic bladder and/or impotence. J Neurol Sci 1976; 28(1): 1–15.
23. Dykstra D, Sidi A, Cameron J, Magness J, Stradal L, Portugal J. The use of mechanical stimulation to obtain the sacral reflex latency: a new technique. J Urol 1987; 137(1): 77–79.
24. Loening-Baucke V, Read NW, Yamada T, Barker AT. Evaluation of the motor and sensory components of the pudendal nerve. Electroencephalogr Clin Neurophysiol 1994; 93(1): 35–41.
25. Rodi Z, Vodusek DB. The sacral reflex studies: the single versus double pulse electrical stimulation. Neurourol Urodyn 1995; 14 : 496–497.
26. Takmann W, Vogel P, Porst H. Somatosensory evoked potentials after stimulation of the dorsal penile nerve: normative data and results from 145 patients with erectile dysfunction. Eur Neurol 1987; 27(4): 245–250.
27. Hanson P, Rigaux P, Gilliard C, Biset E. Sacral reflex latencies in tethered cord syndrome. Am J Phys Med Rehabil 1993; 72(1): 39–43.
28. Bilkey WJ, Awad EA, Smith AD. Clinical application of sacral reflex latency. J Urol 1983; 129(6): 1187–1189.
29. Opsomer RJ, Pesce FR, Abi Aad AS, van Cangh PJ, Rossini PM. Electrophysiologic testing of motor sympathetic pathways: normative data and clinical contribution in neurourological disorders. Neurourol Urodynamic 1993; 12 : 336.
30. Colakoglu Z, Kutluay E, Ertekin C. The nature of spontaneous cavernosal activity. BJU Int 1999; 83(4): 449–452.
31. Stocchi F, Carbone A, Inghilleri M, Monge A, Ruggieri S, Berardelli A et al. Urodynamic and neurophysiological evaluation in Parkinson’s disease and multiple system atrophy. J Neurol Neurosurg Psychiatry 1997; 62(5): 507–511.
32. Palace J, Chandiramani VA, Fowler CJ. Value of sphincter EMG in the diagnosis of multiple system atrophy. Muscle Nerve 1997; 20(11): 1396–1403.
33. Schwarz J, Kornhuber M, Bischoff C, Straube A. Electromyography of the external anal sphincter in patients with Parkinson’s disease and multiple system atrophy: frequency of abnormal spontaneous activity and polyphasic motor unit potentials. Muscle Nerve 1997; 20(9): 1167–1172.
34. Vodusek DB. Sphincter EMG and differential diagnosis of multiple system atrophy. Mov Disord 2001; 16(4): 600–607.
35. Beck RO, Betts CD, Fowler CJ. Genitourinary dysfunction in multiple system atrophy: clinical features and treatment in 62 cases. J Urol 1994; 151(5): 1336–1341.
36. Libelius R, Johansson F. Quantitative electromyography of the external anal sphincter in Parkinson’s disease and multiple system atrophy. Muscle Nerve 2000; 23(8): 1250–1256.
37. Valldeoriola F, Valls-Solé J, Tolosa ES, Marti MJ. Striated anal sphincter denervation in patients with progressive supranuclear palsy. Mov Disord 1995; 10(5): 550–555.
38. Podnar S, Vodusek DB, Stålberg E. Comparison of quantitative techniques in anal sphincter electromyography. Muscle Nerve 2002; 25(1): 83–92.
39. Hale DS, Benson JT, Brubaker L, Heidkamp MC, Russell B. Histologic analysis of needle biopsy of urethral sphincter from women with normal and stress incontinence with comparison of electromyographic findings. Am J Obstet Gynecol 1999; 180(2): 342–348.
40. Fowler CJ, Christmas TJ, Chapple CR, Parkhouse HF, Kirby RS, Jacobs HS. Abnormal electromyographic activity of the urethral sphincter, voiding dysfunction, and polycystic ovaries: a new syndrome? BMJ 1988; 297(6661): 1436–1438.
41. Deindl FM, Vodusek DB, Bischoff C, Hofmann R, Hartung R. Dysfunctional voiding in women: which muscles are responsible? Br J Urol 1998; 82(6): 814–819.
42. Anderson RS. A neurogenic element to urinary genuine stress incontinence. Br J Obstet Gynaecol 1984; 91(1): 41–45.
43. Smith AR, Hosker GL, Warrell DW. The role of partial denervation of the pelvic floor in the aetiology of genitourinary prolapse and stress incontinence of urine. A neurophysiological study. Br J Obstet Gynaecol 1989; 96(1): 24–28.
44. Dimpfl T, Jaeger C, Mueller-Felber W, Anthuber C, Hirsch A, Brandmaier R et al. Myogenic changes of the levator ani muscle in premenopausal women: the impact of vaginal delivery and age. Neurourol Urodyn 1998; 17(3): 197–205.
45. Allen RE, Hosker GL, Smith AR, Warrell DW. Pelvic floor damage and childbirth: a neurophysiological study. Br J Obstet Gynaecol 1990; 97(9): 770–779.
46. Sultan AH, Kamm MA, Hudson CN, Bartram CI. Third degree obstetric anal sphincter tears: risk factors and outcome of primary repair. BMJ 1994; 308(6933): 887–891.
47. Wood J, Amos L, Rieger N. Third degree anal sphincter tears: risk factors and outcome. Aust N Z J Obstet Gynaecol 1998; 38(4): 414–417.
48. Podnar S, Lukanovic A, Vodusek DB. Anal sphincter electromyography after vaginal delivery: neuropathic insufficiency or normal wear and tear? Neurourol Urodyn 2000; 19(3): 249–257.
49. Lubowski DZ, Swash M, Nicholls RJ, Henry MM. Increase in pudendal nerve terminal motor latency with defaecation straining. Br J Surg 1988; 75(11): 1095–1097.
50. Vaccaro CA, Cheong DM, Wexner SD, Nogueras JJ, Salanga VD, Hanson MR et al. Pudendal neuropathy in evacuatory disorders. Dis Colon Rectum 1995; 38(2): 166–171.
51. Vodusek DB, Zidar J. Pudendal nerve involvement in patients with hereditary motor and sensory neuropathy. Acta Neurol Scand 1987; 76(6): 457–460.
52. Vodusek DB, Ravnik-Oblak M, Oblak C. Pudendal versus limb nerve electrophysiological abnormalities in diabetics with erectile dysfunction. Int J Impot Res 1993; 5(1): 37–42.
53. Kunesch E, Reiners K, Müller-Mattheis V, Strohmeyer T, Ackermann R, Freund HJ. Neurological risk profile in organic erectile impotence. J Neurol Neurosurg Psychiatry 1992; 55(4): 275–281.
54. Lundberg PO, Brackett LB, Denys P. Neurological disorders: erectile and ejaculatory dysfunction. In: Jardin A, Wagner G, Khoury S et al (eds). Erectile Dysfunction. Plymouth: Plymbridge 2000.
Labels
Paediatric neurology Neurosurgery Neurology
Article was published inCzech and Slovak Neurology and Neurosurgery

2013 Issue 2-
All articles in this issue
- Creutzfeldt-Jacob disease
- Electrophysiological Examination of the Pelvic Floor
- Significance and Limitations of Visual Evoked Potentials in the Study of Pathophysiology of Migraine
- Habituation is more Accentuated by Motion-Onset Stimuli than Compared with Pattern Reversal Stimuli – a Pilot Study
- Evaluation of Epidemiological Stroke Data from the IKTA Register. Stroke Incidence in the Zlin District
- The Role of a Neurootologist in Identification of Post-radiation Complications in Patients with Vestibular Schwannoma Treated with Leksell Gamma Knife
- Torticollis at Grisel’s Syndrome – Case Reports
- X-adrenoleukodystrophy
- X-linked Myotubular Myopathy: a Novel Mutation in the MTM-1 Gene – Case Reports
- A Rare Cause of Obstructive Sleep Apnoea Syndrome – Morbus Madelung. Case Reports
- Ultrasound-guided Brain Cavernoma Surgery
- Endoscopic Third Ventriculostomy in Previously Shunted Children
- Meningioma Diagnosis, Therapy and Follow-up at the Neurosurgery Clinic, University Hospital Brno between 2005 and 2010
- Normal Pressure Hydrocephalus – Overdrainage Complications and their Dependence on the Used Valve
- Spinocerebellar Ataxia 7 – a Case Report
- Lyme Borreliosis as a Cause of Bilateral Neuroretinitis with Pronounced Unilateral Stellate Maculopathy in a 8-Year Old Girl
- Differences in the Modulation of Cortical Activity in Patients Suffering from Upper Arm Spasticity Following Stroke and Treated with Botulinum Toxin A
- Late-onset Tay-Sachs Disease Can Mimic Spinal Muscular Atrophy Type III – Two Case Reports
- Czech and Slovak Neurology and Neurosurgery
- Journal archive
- Current issue
- Online only
- About the journal
Most read in this issue- Creutzfeldt-Jacob disease
- Spinocerebellar Ataxia 7 – a Case Report
- Lyme Borreliosis as a Cause of Bilateral Neuroretinitis with Pronounced Unilateral Stellate Maculopathy in a 8-Year Old Girl
- Electrophysiological Examination of the Pelvic Floor
Login#ADS_BOTTOM_SCRIPTS#Forgotten passwordEnter the email address that you registered with. We will send you instructions on how to set a new password.
- Career


