-
Medical journals
- Career
Využití kontinuálního monitoringu průtoku krve mozkem po těžkém mozkovém poranění
Authors: A. Mrlian 1; M. Smrčka 1; M. Duba 1; R. Gál 2; P. Ševčík 2
Authors‘ workplace: LF MU a FN Brno Neurochirurgická klinika 1; LF MU a FN Brno Klinika anesteziologie, resuscitace a intenzivní medicíny 2
Published in: Cesk Slov Neurol N 2010; 73/106(6): 711-715
Category: Short Communication
Overview
Úvod:
Intenzivní léčba pacientů po těžkém poranění mozku je v časné posttraumatické fázi zásadní s hlediska prognózy pacientů. Těžká poranění mozku jsou zatížena vysokou mortalitou. Dle výsledků některých studií 40 až 60 % pacientů ukončí léčbu s neuspokojivým výsledkem. Komplexní invazivní monitoring umožní detailnější zhodnocení aktuálního stavu pacientů a pomůže včas zahájit adekvátní terapii. Materiál a metody: V rámci pilotní studie byla použita unikátní metoda přímého kontinuálního měření průtoku krve mozkem (CBF), srovnávali jsme benefit této metody v korelaci s jinými, již zavedenými metodami. Celkem bylo analyzováno pět pacientů po těžkém poranění mozku, u kterých jsme ihned po příjmu kontinuálně invazivně monitorovali intrakraniální tlak, mozkový perfuzní tlak, průtok krve mozkovou tkání a hladinu tkáňového kyslíku. Pacienti byli léčeni konzervativně i operačně. V rámci skupiny jsme analyzovali vliv jednotlivých monitorovacích modalit a jejich kombinací na léčebnou strategii u těchto pacientů, přičemž jsme se zaměřili na přínos přímého kontinuálního měření CBF. Výsledky: Všechny sledované parametry vzájemně korelovaly, vzestup ICP byl následován poklesem CPP, mozkové perfuze (CBF) a hladin tkáňového kyslíku (p < 0,01). Sledované parametry reagovaly na změnu terapie a patologické hodnoty byly indikátorem neurochirurgické intervence. Závěr: Komplexní monitoring pacientů po těžkém poranění mozku zkvalitňuje intenzivní léčbu těchto pacientů a podává ucelenější obraz o procesech běžících v poškozené mozkové tkáni. Přímé měření CBF napomáhá zhodnocení stavu pacienta a v kombinaci s dalšími metodami by mohlo urychlit výběr vhodné léčebné modality, což by v konečném důsledku mohlo zlepšit celkový výsledek léčby.Klíčová slova:
těžká poranění mozku – multimodální monitoring – průtok krve mozkemÚvod
Těžká poranění mozku jsou zatížena vysokou morbiditou a mortalitou. Dle výsledků některých studií 40–60 % pacientů ukončí léčbu s neuspokojivým výsledkem. Mortalita těchto poranění je přibližně 40 % [1]. Neméně důležité jsou i finanční náklady spojené s kraniocerebrálními traumaty [2]. Nejvíce finančních prostředků je vynaloženo na diagnostiku, léčbu, časnou a následnou rehabilitační péči. Další nemalé finanční ztráty vznikají v důsledku pracovní neschopnosti a dočasné nebo trvalé invalidizace pacienta [3]. V 50–60 % jsou kraniocerebrální poranění sdružena s poraněním jiných orgánů (polytraumata), což samozřejmě zvyšuje jejich závažnost a mortalitu [4]. Zavádění modernějších metod do diagnostiky a terapie poranění mozku způsobilo mírný pokles mortality u kraniocerebrálních poranění (KCP) i přes jejich narůstající závažnost. Komplexní invazivní monitoring umožní detailnější zhodnocení skutečného klinického stavu pacientů a pomůže včas zahájit adekvátní terapii [3]. Zvyšování efektivity komplexní péče a mezioborová kooperace zůstává nadále hlavním předpokladem poklesu mortality a dalších negativních důsledků KCP.
V současnosti se terapeutické úsilí soustředí hlavně na předcházení sekundárního poškození mozkové tkáně, k němuž dochází při poklesu průtoku krve mozkem zejména pod vlivem vysokého ICP. Navíc se v patogenezi sekundárního poškození uplatňují i některé systémové změny, jako hypotenze a hypoxie [5,6]. Chesnut et al již v roce 1993 prokázali dvojnásobně vyšší mortalitu pacientů po těžkém KCP při poklesu systolického tlaku pod 90 mmHg [7]. Nejcitlivější na ischemické poškození jsou terminální okrsky cévního zásobení (watershed zones).
Používání klasických metod měření intrakraniálního tlaku (ICP) a počítání mozkového perfuzního tlaku (CPP), invazivního měření krevního tlaku a krevních plynů nám přináší pouze nepřímé informace o celkové situaci v centrální nervové tkáni. Informace o průtoku krve mozkem (CBF) získáváme pouze nepřímou metodou. Do jisté míry se řídíme se hodnotou perfuzního tlaku (CPP), kterou získáme výpočtem (rozdíl mezi hodnotou středního arteriálního tlaku – MABP a hodnotou intrakraniálního tlaku, ICP).
Průtok krve se řídí principy Poiseuilleova zákona, kde objemový tok viskózní tekutiny při laminárním proudění trubicí kruhového průřezu je přímo úměrný tlakovému spádu a čtvrté mocnině poloměru trubice a nepřímo úměrný dynamické viskozitě.
V bílé a šedé mozkové hmotě se velikost průtoku krve liší. V lépe prokrvené mozkové kůře je cca 80 ml/100 g/min-1, v bíle hmotě je cca 25–35 ml/100 g/min-1. Průměrná hodnota průtoku krve mozkovou tkání je 55 ml/100 g/min-1. Za minutu proteče mozkem cca 825 ml krve, čímž se řadí mezi nejvíce prokrvené orgány.
Průtok krve mozkem je do jisté míry ovlivňován cerebrovaskulární rezistencí, tedy i perfuzním tlakem, kdy za normálních okolností při CPP 40 mmHg dochází k maximální vazodilataci cévního řečiště v mozkové tkáni a k maximálnímu průtoku krve. Další pokles perfuzního tlaku nezvýší vazodilataci, naopak průtok krve mozkovou tkání se sníží. U pacientů po těžkém kraniotraumatu se hraniční hodnota CPP posouvá na 60–70 mmHg. V intenzivní léčbě těchto pacientů se proto snažíme udržovat hodnoty ICP maximálně do 20 mmHg sloupce, více se soustředíme na hodnoty CPP [8].
Poslední dobou se ale v monitoringu uplatňují nové metody zaměřující se na přímé sledování biochemických změn mozkové tkáně. Jedná se zejména o přímé sledování některých metabolitů (laktát, pyruvát), excitatorních aminů (glutamát, noradrenalin) nebo hladiny tkáňového kyslíku [9]. Jednou z nových nadějných metod je i přímé kontinuální měření průtoku krve mozkem. Na průtoku krve mozkem přímo závisí přísun živin a transport metabolitů v mozkové tkáni [10]. Přímé kontinuální měření průtoku krve mozkem (CBF) by mohla být unikátní metoda zlepšující monitoring, a tudíž i intenzivní léčbu pacientů.
Soubor a metodika
V období od dubna do srpna 2008 jsme v rámci přímého monitorování průtoku krve mozkem zařadili do pilotního souboru pět pacientů po těžkém poranění mozku (GCS při příjmu < 8) (tab. 1). Záměrem našeho výzkumu bylo ověřit přínos přímého monitorování CBF a zjistit korelaci hodnot průtoku krve mozkem s naměřenými hodnotami ICP, CPP a hodnotami parciálního tlaku kyslíku v mozkové tkáni (PbtO2).
Table 1. Korelační koeficienty. 
Všichni pacienti byli od příjmu kontinuálně tlumeni a byli na řízené ventilaci. V rámci multimodálního kontinuálního 24hodinového monitoringu jim bylo implantováno ICP čidlo, čidlo na invazivní měření arteriálního tlaku, čidlo na měření hladiny tkáňového kyslíku (LICOX) a čidlo na přímé měření průtoku krve mozkem (Hemedex).
Přímé měření CBF pomocí přístroje Hemedex je založeno na principu konduktivity mozkové tkáně. Součástí čidla jsou dva termistory. Jeden termistor slouží na měření teploty mozkové tkáně, druhý se zahřeje na teplotu cca o dva stupně vyšší, než je aktuální naměřená teplota, a CBF se pomocí software vypočítá na základě teplotního gradientu vzniklého mezi těmito termistory. Pokud stoupla teplota pacienta nad 38 °C, došlo k automatickému vypnutí přístroje, aby se předešlo případnému termickému poškození mozkové tkáně. Přímé měření teploty mozkové tkáně nám sloužilo mimo jiné i k optimalizaci terapie pomocí mírné řízené hypotermie. Hned po implantaci čidla a dále během měření přibližně jednou za 60 až 120 minut docházelo k automatické rekalibraci přístroje. Rekalibrace trvala přibližně tři minuty, během této periody neprobíhalo měření CBF. K rekalibraci docházelo rovněž i po změně polohy čidla v mozkovém parenchymu.
Všechna tři čidla jsme implantovali do tří malých trepanačních otvorů, vzdálených od sebe cca 3 mm. Čidla jsme se vždycky snažili aplikovat do oblasti penumbry, případně do hemisféry, kde jsme předpokládali vyšší pravděpodobnost sekundárního poškození mozku. Např. u operovaných pacientů to byla strana, kde proběhla evakuace hematomů, případně dekompresní kraniektomie. Implantaci předcházelo CT vyšetření hlavy, na základě kterého jsme mohli přesněji vybrat monitorovanou oblast. Sledované parametry se analyzovaly v hodinových intervalech.
Celkem pět pacientů jsme podrobili multimodálnímu monitoringu a další analýze. Tři pacienti byli operováni, dva byli léčeni konzervativně. Operace byla indikována na základě CT vyšetření, případně hodnoty ICP. Snažili jsme se udržovat hodnotu ICP v přijatelném rozmezí (cca do 20 mmHg), hodnota cerebrálního perfuzního tlaku (CCP) byla udržována alespoň na 65–70 mmHg. Pokud selhaly konzervativní metody ovlivňování ICP a CPP, přikročili jsme k implantaci ventrikulostomie. K léčbě jinak neovlivnitelné nitrolební hypertenze byla využita aplikace mírné řízené celotělové hypotermie s dosaženou cílovou tělesnou teplotou 34 °C (přístroj Blanketrol, Cincinnati, USA). Použití hypotermie předcházelo případné dekompresní kraniektomii. Cerebrální perfuze byla dále podle potřeby udržována prostřednictvím katecholaminů, které byly podávány kontinuálně.
Ze všech sledovaných parametrů jsme další analýze podrobili hodnoty ICP, CPP, CBF a PbtO2 které byly monitorovány kontinuálně. Pacienty jsme rozdělili do dvou skupin. V první skupině byli konzervativně léčení pacienti, do druhé skupiny jsme zařadili operované pacienty. Evakuace hematomů neboli vnitřní dekomprese má dle našich zkušeností výraznější vliv na pokles ICP. Stejný fenomén jsme předpokládali i u CBF a PbtO2. U jednoho pacienta jsme provedli dekompresní kraniektomii. Tento typ operace měl mít podle našeho názoru nejzásadnější vliv na změny hodnot sledovaných parametrů.
Při statistickém zpracování sledovaných parametrů jsme využili t-testu. Hodnoty ICP a CBF také ICP a PbtO2 byly dále statisticky vyhodnoceny pomocí výpočtu korelačního koeficientu.
Výsledky
Průměrná doba multimodálního monitoringu byla 7,7 dne (medián 8), nejdelší 9 dnů. Čidla byla vyjmuta při odtlumení a zlepšení pacientů nebo maximálně 9. den v rámci prevence infekčních komplikací.
Průměrná hodnota CBF během prvních 24 hodin byla nízká (18,33 ml/100 g/min-1, medián 17 ml/100 g.min-1). Hodnoty ICP byly zpočátku vyšší s průměrnou hodnotou 22,17 mmHg za prvních 24 hod (medián 22 mmHg). Hodnoty všech sledovaných parametrů se postupně zlepšovaly v průběhu léčby (grafy 1–3) (p < 0,01). Hodnoty CPP se měnily v závislosti od hodnot ICP a hodnot středního arteriálního tlaku (p < 0,01). Změny CBF v průběhu dalšího sledování ve všech skupinách u všech pacientů negativně korelovaly s hodnotami ICP a CPP (p < 0,01). Průměrné hodnoty PbtO2 byly rovněž ve všech skupinách během prvních 24 hod nízké (PbtO2 13,33 mmHg) a vykazovaly postupné zlepšování. Maximální hodnota průtoku krve mozkem (CBF) byla 37 ml/100g/min-1. Průměrná hodnota CBF ve všech skupinách během další sledované periody (24–183 hod). byla 31,17 ml/100 g/min-1. Hodnoty PbtO2 se zvyšovaly v korelaci s poklesem ICP a nárůstem CBF s maximální dosaženou hodnotou 37 mmHg a průměrnou hodnotou 24,66 mmHg.
Graph 1. Změny ve sledovaných modalitách u konzervativně léčených pacientů. 
K další analýze jsme pacienty rozdělili do dvou částí. Prvně jsme hodnotili konzervativně léčené pacienty (graf 1), pak jsme zhodnotili operované pacienty (graf 2). Očekávali jsme, že u operovaných pacientů dochází k výraznějším a rychlejším změnám monitorovaných parametrů.
Graph 2. Změny ve sledovaných modalitách u operovaných pacientů. Červené šipky znázorňují moment intervence. 
Konzervativně léčení pacienti vykazovali během sledované periody postupné zlepšování ICP, CPP, CBF i PbtO2 (graf 1). U pacienta 4 naměřené hodnoty korelovaly se zlepšujícím se klinickým stavem a ke konci sledováni vykazovaly fyziologické hodnoty. U pacienta 5 došlo také ke zlepšování hodnot, nicméně monitorování bylo ukončeno 9. den v rámci prevence vzniku infekčních komplikací.
Graph 3. Změny ve sledovaných modalitách u pacienta po dekompresivní kraniektomii. Šipkou je označena elevace ICP na hodnotu 32 mmHg, jež byla indikací k provedení dekompresní kraniektomie. 
U operovaných pacientů jsme pozorovali obdobné výsledky (graf 2). Před neurochirurgickou intervencí byla zaznamenána elevace ICP výrazně nad horní hranici fyziologického intervalu (graf 2). Okamžitě bylo provedeno kontrolní CT, které u pacienta 3 prokázalo progresi velikosti kontuzního ložiska. Kontrolní CT u pacienta 1 nevykazovalo dramatické zhoršení nálezu, nicméně u obou pacientů byla indikována okamžitá operace a odstranění hematomu, resp. kontuze. Po operaci jsme v obou případech zaznamenali signifikantní pokles ICP a nárůst CPP, CBF a PbtO2 (p < 0,001). Během další sledované periody se hodnoty postupně normalizovaly. U pacienta 1 jsme čidla extrahovali 8. den kvůli překladu na spádové pracoviště.
U pacienta 2 bylo na základě elevace ICP až k hodnotě 32 mmHg a odpovídajícímu poklesu CPP a CBF v 25. hodině provedeno kontrolní CT s nálezem progrese edému mozkové tkáně. Poté byla provedena dekompresní kraniektomie. Po operaci jsme zaznamenali signifikantní pokles ICP a nárůst CPP, CBF a PbtO2 (p < 0,001), nicméně během další sledované periody hodnoty monitorovaných parametrů kolísaly (graf 3).
Hodnoty ICP a CBF a také ICP a PtiO2 byly statisticky vyhodnoceny pomocí výpočtu korelačního koeficientu. U obou sledovaných dvojic parametrů (ICP + CBF, ICP + PtiO2) byla zjištěna statisticky významná korelace u všech skupin pacientů (tab. 1). Dle našich zjištění existuje závislost mezi ICP, CBF a PtiO2 a tato závislost má lineární charakter. Pro statistickou významnost postačuje hodnota korelačního koeficientu r rovno alespoň 0,2565 (nesmí být menší) pro hladinu významnosti 0,01 a pro 100 hodnocených bodů. Námi hodnocený počet bodů byl dokonce vyšší (120, resp. 129).
Všechny sledované parametry a jejich změny vykazovaly těsnou vzájemnou závislost. Největší shoda byla pochopitelně mezi ICP a CPP, shoda mezi hodnotami ICP a CBF byla 81 %, hodnoty ICP a PtiO2 byly ve vzájemné shodě v 88 %.
Po třech měsících jsme zhodnotili výsledek léčby pomocí GOS (Glasgow outcome score). Dva pacienti ukončili naše sledování s dobrým výsledkem (GOS 4), čtyři pacienti ukončili naše sledování se špatným výsledkem (GOS 2 a 3) (tab. 2).
Table 2. Charakteristika jednotlivých pacientů. 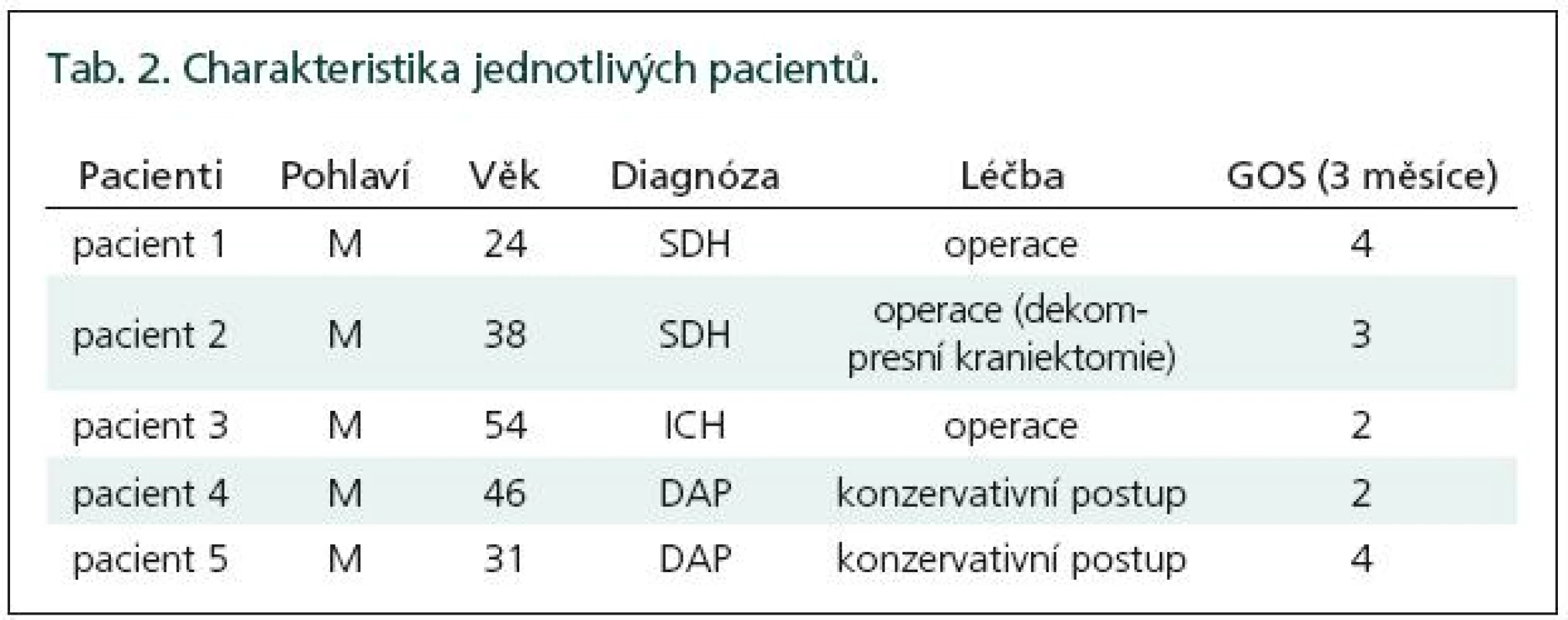
Diskuze
V poslední době zaznamenáváme nárůst mnoha nových monitorovacích metod, které by měly zkvalitnit péči o intenzivně léčené pacienty po těžkém poranění mozku [10]. Neznamená to ale ústup široce používaných metod, jako měření ICP, CPP, invazivní měření krevního tlaku atd., ale jistý posun ke sledování metabolizmu mozku během časné posttraumatické fáze [11]. Jistou nevýhodou monitoringu metabolizmu mozkové tkáně je její prostorová ohraničenost. Měření hladin glukózy, pyruvátu a dalších metabolitů pomocí mikrodialýzy nám podává informace pouze o malé části tkáně [12]. Zdá se, že i měření CBF vykazuje obdobné prostorové limity. Velkým přínosem bylo, pokud se nám povedlo zavést čidla do tzv. penumbry, a reagovat tak na metabolické změny v této potenciálně zachranitelné tkáni [13]. Zachytit tuto oblast je ovšem poměrně obtížné. Zdá se, že tuto nevýhodu má i měření tkáňového kyslíku, i když některé práce popisují korelaci mezi změnami tkáňového kyslíku a globálními změnami v mozku [14]. Tento vztah jsme pozorovali i v naší sledované skupině, kdy změny PbtO2 korelovaly se změnami ICP.
Hodnota arteriální tenze kyslíku ve fyziologickém pásmu neovlivňuje CBF, ale hypoxemie, případně v kombinaci s poklesem pH při nadprodukci laktátu v důsledku anaerobního metabolizmu je silným stimulem vedoucím k vazodilataci mozkových cév. Ke zvýšení CBF dochází při poklesu PaO2 pod 6,7 kPa. Na druhé straně nepoměr mezi vysokou dodávkou kyslíku a jeho nižší potřebou (metabolickými požadavky) vede k situacím, kdy v oblastech s hyperemií a vysokým PaO2 vzniká fenomén tzv. luxusní perfuze. Zvýšený objem krve může též vést k vzestupu ICP.
Na průtok krve mozkem mají kromě hypotenze a hypoxie vliv další systémové změny, jako hyperkapnie a hypokapnie. Hyperkapnie za normálních okolností vede k dilataci mozkových kapilár, průtok krve a látková výměna narůstají. Permeabilita cév zůstává nezměněna. V poškozené tkání se vlivem selhání autoregulačních procesů zvyšuje permeabilita cévní stěny a dochází k extravazaci tekutiny. Mozkový edém progreduje a to dále snižuje perfuzi mozku [15].
Naopak příliš nízká hodnota PaCO2 (hypokapnie) může způsobit nechtěnou vazokonstrikci a pokles mozkové perfuze, zejména v nepostižených částech mozku. Snížený průtok krve způsobí ischemické poškození i těchto původně nepostižených oblastí [15].
Poslední výzkumy naznačují důležitost dalších laboratorních parametrů při hodnocení výsledku léčby [16]. Analýzou dat získaných ve studii IMPACT se zjistila významná korelace horšího výsledku léčby s příliš nízkou, ale i příliš vysokou hladinou sodíku, nízkou koncentrací hemoglobinu, nízkým pH a vysokou koncentrací protrombinu [16]. Z uvedených skutečností vyplývá důležitost udržování homeostázy a integrity organizmu v časné posttraumatické fázi.
Přímé měření průtoku krve mozkem využívající princip konduktivity mozkové tkáně by také mohlo být vnímáno jako metoda odrážející pouze lokální změny. Konduktivita mozkové tkáně je vlastnost determinovaná mnoha lokálními, ale i systémovými vlivy a je relativně konstantní i pro větší okrsek mozkové tkáně. Dle našich zjištění hodnoty CBF naměřené pomocí přístroje Hemedex korelovaly s jinými, již osvědčenými monitorovacími metodami. Tento vztah potvrdili před námi Steiner a Jaeger et al [17,18]. I když náš počet pacientů je nízký, vzhledem k množství zaznamenaných hodnot lze vysledovat poměrně jednoznačný vztah mezi hodnotami ICP, CPP, PbtO2 a CBF.
Zatím jediným zjištěným negativem metody byla hluchá perioda během opakované kalibrace přístroje, kdy jsme neměli žádné informace o CBF. Tato perioda trvala přibližně 5 minut a opakovala se přibližně jednou za 1,5 hodiny. Analogická situace nastává při vysokých teplotách, kdy v rámci ochrany mozkové tkáně před rizikem termického poškození se přestává zahřívat proximální termistor čidla, a tudíž je měření znemožněno. K této situaci u nás vzhledem k rutinnímu používání mírné řízené hypotermie nedocházelo.
Závěr
Přínos přímého kontinuálního monitorování CBF metody spočívá ve získání ucelenějšího obrazu o změnách v traumatizované mozkové tkáni. Změny hodnot CBF korelovaly se změnami pozorovanými lokálně (PbtO2) i globálně (ICP, CPP) až do výše kolem 90 %. Přímé kontinuální měření průtoku krve mozkem lze tudíž považovat za relativně spolehlivou metodu, kterou můžeme začlenit do rozšiřující se palety možností multimodálního monitoringu. Je to metoda hodnověrná a relevantně odrážející změny v homeostáze mozkové tkáně hlavně na lokální úrovni. Napomáhá zhodnocení stavu pacienta a v kombinaci s dalšími metodami urychlí výběr vhodné léčebné modality. Nicméně nedosahuje významu detekce vazospazmů u pacientů po subarachnoideálním krvácení pomocí monitorování PtiO2 [19]. Na druhé straně u pacientů po těžkém KCP nenacházíme ekvivalent k výskytu vazospazmů po subarachnoideálním krvácení.
Důležitým atributem této metody je možnost přímého měření teploty mozku, což jsme v našem případě využili k přesnějšímu nastavení čidla sloužícího k měření tkáňového kyslíku a k regulaci mírné řízené hypotermie jako léčebné metody u některých pacientů po těžkém KCP v rámci terapie jinak nezvládnutelné intrakraniální hypertenze.
Jako mírné negativum této metody se jeví kalibrační periody, během kterých nedostáváme žádné informace o průtoku krve ve sledované oblasti. Z tohoto hlediska je nutné uvedenou metodu kombinovat s jinou monitorovací modalitou a tím vykrýt období, kdy CBF není možné sledovat.
MUDr. Andrej Mrlian, Ph.D.
Neurochirurgická klinika
LF MU a FN Brno
Jihlavská 20
625 00 Brno
e-mail: andrejmrlian@email.czPřijato k recenzi: 8. 12. 2009
Přijato do tisku: 28. 6. 2010
Sources
1. Andrew IR, Maas AM, Murray GD, Teasdale GM, Steyerberg EW. Prognosis and Clinical Trial Design in Traumatic Brain Injury: The IMPACT Study. J Neurotrauma 2007; 24(2): 232–238.
2. Marshall LF, Gautille T, Klauber MR, Eisenberg HM, Jane JA, Luerssen TG et al. The outcome of severe closed head injury. J Neurosurge 1991; 75 : 28–36.
3. Smrčka M. Poranění mozku. 1st ed. Praha: Grada Publishing 2001.
4. Sarrafzadeh AS, Peltonen EE, Kaisers U, Kuchler I, Lanksch WR, Unterberg AW. Secondary insults in severe head injury – do multiply injured patients do worse? Crit Care Med 2001; 29(6): 1116–1123.
5. Butcher I, Maas AI, Lu J, Marmarou A, Murray GD, Mushkudiani NA et al. Prognostic value of admission blood pressure in traumatic brain injury: results from the IMPACT study. J Neurotrauma 2007; 24(2): 294–302.
6. Moeschler O, Boulard G, Ravussin P. Concept of secondary cerebral injury of systemic origin. Ann Fr Anesth Reanim 1995; 14(1): 114–121.
7. Chesnut RM, Marshall LF, Klauber MR, Blunt BA, Baldwin N, Eisenberg HM, et al. The role of secondary brain injury in determining outcome from severe head injury. J Trauma 1993; 34(2): 216–222.
8. Hlatky R, Valadka AB, Robertson CS. Intracranial hypertension and cerebral ischemia after severe traumatic brain injury. Neurosurg Focus 2003; 14(4): e2.
9. Bhatia A, Gupta AK. Neuromonitoring in the intensive care unit. II. Cerebral oxygenation monitoring and microdialysis. Intensive Care Med 2007; 33(8): 1322–1328.
10. Bhatia A, Gupta AK. Neuromonitoring in the intensive care unit. I. Intracranial pressure and cerebral blood flow monitoring. Intensive Care Med 2007; 33(7): 1263-1271.
11. Soustiel JF, Sviri GE. Monitoring of cerebral metabolism: non-ischemic impairment of oxidative metabolism following severe traumatic brain injury. Neurol Res 2007; 29(7): 654–660.
12. Matz PG, Pitts L. Monitoring in traumatic brain injury. Clin Neurosurg 1997; 44 : 267–294.
13. Mulvey JM, Dorsch NW, Mudaliar Y, Lang EW. Multimodality monitoring in severe traumatic brain injury: the role of brain tissue oxygenation monitoring. Neurocrit Care 2004; 1(3): 391–402.
14. Ďuriš K, Smrčka M, Ševčík P, Gál R, Juráň V, Neuman E et al. Možnosti využití tkáňové oxymetrie v detekci vazospazmů u pacientů po SAK. Anest Intenziv Med 2009; 20(2), 102–106.
15. Soukup J, Bramsiepe I, Brucke M, Sanchin L, Menzel MJ. Evaluation of a bedside monitor of regional CBF as a measure of CO2 reactivity in neurosurgical intensive care patients. Neurosurg Anesthesiol 2008; 20(4): 249–255.
16. Van Beek JG, Mushkudiani NA, Steyerberg EW, Butcher I, McHugh GS, Lu J et al. Prognostic value of admission laboratory parameters in traumatic brain injury: results from the IMPACT study. J Neurotrauma 2007; 24(2): 315–328.
17. Steiner LA, Andrews PJ. Monitoring the injured brain: ICP and CBF Review. Br J Anaesth 2006; 97(1): 26–38.
18. Jaeger M, Soehle M, Schuhmann MU, Winkler D, Meixensberger J. Correlation of continuously monitored regional cerebral blood flow and brain tissue oxygen. Acta Neurochir (Wien) 2005; 147(1): 51–56.
19. Vajkoczy P, Horn P, Thome C, Munch E, Schmiedek P. Regional cerebral blood flow monitoring in the diagnosis of delayed ischemia following aneurysmal subarachnoid hemorrhage. J Neurosurg 2003; 98(6): 1227–1234.
Labels
Paediatric neurology Neurosurgery Neurology
Article was published inCzech and Slovak Neurology and Neurosurgery

2010 Issue 6-
All articles in this issue
- Autizmy
- Mechanizmy neurodegenerácie pri Parkinsonovej chorobe
- Syndrom obstrukční spánkové apnoe a kardiovaskulární komplikace – úloha mezioborové spolupráce
- Poruchy metabolizmu biogenních aminů v dětském věku a možnosti jejich diagnostiky
- Spektrální analýza variability srdeční frekvence – normativní data
- Dotazník Bristolská škála aktivit denního života BADLS-CZ pro hodnocení pacientů s demencí
- Endovaskulární rekanalizace při léčbě akutních uzávěrů mozkových tepen
- Srovnání přínosu lumbálního infuzního testu a lumbální drenáže v indikaci léčby hydrocefalu
- Validita mezinárodní škály pro pacienty s ataxií
- Monitoring ptiO2 a změny frakce kyslíku ve vdechované směsi u pacientů po těžkém subarachnoidálním krvácení
- Léze radiálního nervu a možnosti pozdní rekonstrukce funkce šlachovým transferem
- Kraniálne defekty neurálnej rúry
- Využití kontinuálního monitoringu průtoku krve mozkem po těžkém mozkovém poranění
- Naše zkušenosti s MR monitorováním pacientů s roztroušenou sklerózou v klinické praxi
- Spontánní regrese sekvestru při lumbální herniaci disku – soubor tří kazuistik
- Lymfomatózní neuropatie (neurolymfomatóza) – kazuistika
- Posuzování zdravotního stavu a pracovní schopnosti osob po cévní mozkové příhodě – kazuistiky
- Fibrózní dysplazie žeber a páteře: multioborové řešení – kazuistika
- Czech and Slovak Neurology and Neurosurgery
- Journal archive
- Current issue
- Online only
- About the journal
Most read in this issue- Spontánní regrese sekvestru při lumbální herniaci disku – soubor tří kazuistik
- Posuzování zdravotního stavu a pracovní schopnosti osob po cévní mozkové příhodě – kazuistiky
- Dotazník Bristolská škála aktivit denního života BADLS-CZ pro hodnocení pacientů s demencí
- Autizmy
Login#ADS_BOTTOM_SCRIPTS#Forgotten passwordEnter the email address that you registered with. We will send you instructions on how to set a new password.
- Career

