-
Medical journals
- Career
Sedace kombinací dexmedetomidin-ketamin - midazolam pro endovaskulární léčbu mozkových arteri ovenózních malformací a stenóz karotických tepen
Authors: J. Schreiberová 1; L. Hess 2; A. Krajina 3; Miroslav Lojík 3
Authors‘ workplace: Klinika anestezi ologi e, resuscitace a intenzivní medicíny LF UK a FN Hradec Králové 1; Institut klinické a experimentální medicíny Praha, IPVZ Praha 2; Radi ologická klinika LF UK a FN Hradec Králové 3
Published in: Cesk Slov Neurol N 2008; 71/104(4): 446-452
Category: Original Paper
Studie byla podpořena grantem IGA MZ ČR č. NR 8508-3
Overview
Úvod:
Nehybnost, analgezi e, anxi olýza, amnézi e, zachovaná spolupráce s nemocným a hemodynamická stabilita bez útlumu dýchání jso u požadavky na sedaci pro endovaskulární léčbu mozkových arteri ovenózních malformací a stenóz krkavice. Cílem studi e bylo zhodnotit sedaci kombinací dexmedetomidin‑ketamin‑midazolam k tomuto užití a porovnat ji s běžno u sedací kombinací sufentanil-midazolam.Metodika:
62 paci enti indikovaných k elektivní endovaskulární léčbě byli randomizováni k sedaci do dvo u skupin. Skupina A: bolusové intravenózní podání dexmedetomidinu 0,5 µg/ kg, ketaminu 0,25 mg/ kg a midazolamu 0,02 mg/ kg během pěti minut, následované kontinuální infuzí dexmedetomidinu 0,25 µg/ kg/ hod a ketaminu 0,25 mg/ kg/ hod. Skupina B: bolusové podání sufentanilu 10 µg a midazolamu 0,02 mg/ kg. Sedace byla následně titrována tak, aby byl paci ent sedován, ale re agoval na slovní výzvu. Sledované parametry: systémový krevní tlak, EKG křivka, saturace hemoglobinu kyslíkem, dechová frekvence, arteri ální tenze oxidu uhličitého, hlo ubka sedace, nežádo ucí účinky, komplikace, zotavení. Spolupráci s nemocným (výborná/ dostačující/ špatná) hodnotil radi olog neznalý užité metody sedace. Statistická analýza: t-test, χ2 test, ANOVA.Výsledky:
Pokles krevního tlaku a srdeční frekvence byl signifikantně větší ve skupině A (p < 0,001), ačkoliv počet epizod hypotenze či bradykardi e se významně nelišil. Hodnoty krevního tlaku vykazovaly menší intraindividuální vari abilitu ve skupině A (p < 0,05). Spolupráce s nemocným byla lepší ve skupině A (p < 0,001). Další statisticky významné rozdíly nebyly nalezeny. Nevyskytly se klinicky závažné komplikace.Závěr:
Sedace kombinací dexmedetomidin‑ketamin‑midazolam je bezpečná a vhodná metoda pro endovaskulární ne uro intervence. Zajišťuje velmi dobro u spolupráci s nemocným, hemodynamicko u stabilitu a netlumí dýchání.Klíčová slova:
endovaskulární ne uro intervence – sedace – kombinace dexmedetomidin - ketamin - midazolamÚvod
Rozvoj endovaskulárních ne uro intervenčních postupů přináší výrazný nárůst počtu výkonů, u kterých je zajištění anestezi ologické péče jedno u z podmínek jejich re alizace. Anestezi olog musí znát povahu jednotlivých výkonů, aby mohl zajistit bezpečnost paci enta a vyhovět požadavkům jak ze strany paci enta, tak výkon provádějícího radi ologa. Ne uro intervenci lze provést v celkové anestezii nebo monitorované sedaci [1]. Výhody a nevýhody obo u postupů shrnuje tab.1 a 2 [2].
Table 1. Výhody a nevýhody celkové anestezie. 
Table 2. Výhody a nevýhody monitorované sedace. 
Monitorovaná sedace (Monitored Anaesthesi a Care) je technika, která spočívá v systémové aplikaci látek s analgetickým a sedativním účinkem, přičemž jso u adekvátními metodami monitorovány vitální funkce paci enta. Na rozdíl od celkové anestezi e však nedochází ke ztrátě vědomí, paci ent je dle stupně sedace schopen komunikace, je výrazně psychicky uvolněn, zbaven strachu, úzkosti a bolesti, na výkon má amnézii. Při monitorované sedaci dochází k menšímu ovlivnění funkce kardi ovaskulárního systému, zůstává zachována spontánní ventilace a ochranné reflexy dýchacích cest [3]. Monitorovaná sedace je v praxi využívána při endovaskulární léčbě mozkových arteri ovenózních malformací (mAVM) a stenóz karotických tepen (SK) perkutánní angi oplastiko u se zavedením stentu a protekcí vůči embolizaci. Kromě obecného požadavku na motorický klid, hemodynamicko u stabilitu, dostatečno u spontánní ventilaci, sedaci, anxi olýzu a analgezii je nezbytné vyvarovat se systémové hypertenze a zachovat dobrý kontakt s nemocným umožňující ori entačně zhodnotit ne urologický stav a provést funkční ne urologické testy. Ide ální látka k sedaci zatím nebyla nalezena. K monitorované sedaci se využívá kombinace látek se sedativně - hypnoticko - anxi olytickými, analgetickými a sympatolytickými účinky (tab. 3).
Table 3. Látky užívané k monitorované sedaci 
Sedace kombinací opi o idů s midazolamem nebo propofolem patří v so učasné době k nejužívanějším. Hlavní nevýhodo u těchto kombinací je riziko vzniku dechové deprese. Proto pokračuje hledání nové kombinace farmak vhodné k monitorované sedaci. Jedním z hlavních kandidátů je agonista alfa2A adrenoreceptoru dexmedetomidin, který je po užíván ke krátkodobé sedaci na jednotkách intenzivní péče [4]. Sedace dexmedetomidinem je charakteristická tím, že nemocný nevyrušován pospává, ale jakmile je aplikován taktilní nebo zvukový podnět, rychle se probo uzí a je schopen re akce a adekvátní komunikace [5,6]. Dexmedetomidin má slabý analgetický účinek, který může být potencován ketaminem [7], a méně výrazný anxi olytický a amnestický účinek než benzodi azepiny [8]. Ačkoliv je dexmedetomidin úspěšně užíván k sedaci při „awake“ krani otomi ích [9], o jeho po užití pro ne uro intervenční výkony jso u po uze kazuistická sdělení [10]. Jako vhodné se jeví doplnění sedace dexmedetomidinem podáním ketaminu (analgetická dávka prohlubující slabý analgetický účinek dexmedetomidinu) a midazolamu (předpokládané prohlo ubení anxi olytického a amnestického účinku). Užití kombinace dexmedetomidin-ketamin - midazolam pro ne uro intervenční výkony nebylo dosud v literatuře uvedeno. Cílem naší studi e bylo poso udit bezpečnost a vhodnost užití sedace kombinací dexmedetomidin‑ketamin‑midazolam pro endovaskulární léčbu mozkových AVM a SK jako alternativy sedace s opi o idní složko u a provést srovnání s rutinní sedací kombinací sufentanilu s midazolamem.
Materi ál a metodika
So ubor
Po obdržení so uhlasu Etické komise Fakultní nemocnice a Lékařské fakulty UK v Hradci Králové bylo do studi e zařazeno 62 paci entů obojího pohlaví ve věku nad 18 let podstupujících elektivní endovaskulární léčbu mozkových AVM nebo SK. Vstupní kritéri a byla: 1. fyzický stav paci enta ASA 1 – 3 (dle klasifikace Americké anestezi ologické společnosti); 2. obdržení informovaného so uhlasu s účastí ve studii. Vylučovací kritéri a byla: 1. vstupní Glasgow Coma Scale (GCS) < 15; 2. nekorigovaná arteri ální hypertenze (TK > 160/ 90 mm Hg); 3. psychické onemocnění v anamnéze; 4. epilepsi e nekorigovaná léčbo u; 5. arytmi e (atri oventrikulární blok II. a III. stupně, sick sinus syndrom, závažné komorové arytmi e); 6. alergi e na jako ukoliv z podávaných látek.
Randomizace
Randomizace paci entů do skupin k sedaci byla provedena obálkovo u metodo u: 1. sedace kombinací dexmedetomidin-ketamin‑midazolam (skupina A); 2. sedace kombinací sufentanil-midazolam (skupina B).
Premedikace, peroperační monitoring a zajištění
45 min před začátkem výkonu byla paci entům podána premedikace – bisulepin (Dithi aden, Léčiva) 2 mg p.o. Na operačním sále byl zaveden periferní žilní katétr (18 G) do kubitální žíly a zahájeno kontinuální podávání fyzi ologického roztoku rychlostí 100 ml/ hod. Do podpažní jamky byl zaveden digitální teploměr. Monitor vitálních funkcí (SC 6002 XL, Si emens) byl užit k monitorování EKG – reprezentativní svod II, saturace hemoglobinu kyslíkem – pulzní oxymetrické čidlo na prstu horní končetiny, dechové frekvence a neinvazivnímu měření tlaku krve oscilometricky manžeto u na horní končetině v intervalu 5 min. Nosními brýlemi byl podáván zvlhčený kyslík průtokem 4 l/ min po celo u dobu výkonu.
Vedení sedace
Skupina A: Indukce sedace byla provedena podáním midazolamu (Dormicum, Roche) v dávce 0,02 mg/ kg intravenózně (i.v.), za 2 min poté dexmedetomidinu (Precedex, Abbott) v dávce 0,5 µg/ kg a po dalších 2 min ketaminu (Narkamon 1%, Spofa) v dávce 0,25 mg/ kg i.v. Navazovalo kontinuální podání dexmedetomidinu (injekční pumpa ID 20/ 50, Chirana) infuzní rychlostí 0,25 µg/ kg/ hod spolu s ketaminem rychlostí 0,25 mg/ kg/ hod. Farmaka byla podávána v jedné injekční stříkačce, 100 µg dexmedetomidinu a 100 mg ketaminu bylo naředěno do 20 ml fyzi ologického roztoku. Rychlost infuze byla přizpůsobována tak, aby byl udržován stupeň sedace 1 – 2 dle Ramsaye (sedovaný nemocný re agující na slovní výzvu). V případě potřeby byla rychlost zvýšena či snížena vždy o 50 % nastavené aktuální rychlosti.
Skupina B: Indukce sedace byla provedena podáním midazolamu v dávce 0,02 mg/ kg i.v. a sufentanilu (Sufenta, Janssen-Cilag) v dávce 10 µg i.v. Navazovalo bolusové podání sufentanilu v jednotlivé dávce 5 µg/ kg i.v. a midazolamu 1 mg i.v. tak, aby byl udržován stupeň sedace 1 – 2 dle Ramsaye.
Sledované parametry
Během výkonu byly sledovány následující parametry: 1. hlo ubka sedace dle Ramsaye (stupeň 0 – 5) hodnocená po 5 min; 2. systolický a di astolický TK (mmHg) měřený po 5 min; 3. srdeční frekvence (SF/ min); 4. saturace hemoglobinu kyslíkem (sat O2 %); 5. dechová frekvence (DF/ min); 6. parci ální tlak oxidu uhličitého v arteri ální krvi (paCO2 [kPa] – jednorázový odběr 30 min po zahájení sedace).
Sledovali a zaznamenávali jsme výskyt (počet) nežádo ucích účinků: 1. bradykardi e (SF < 45/ min); 2. tachykardi e (SF > 100/ min); 3. jiných arytmi í; 4. hypotenze (pokles o více než 20 % výchozích hodnot středního arteri álního TK nebo systolický TK < 90 mmHg); 5. hypertenze (vzestup o více než 30 % výchozích hodnot středního arteri álního TK nebo systolický TK > 160 mmHg); 6. bradypnoe (DF < 10/ min); 7. hypoxi e (sat O2 < 90 %); 8. hyperkapni e (paCO2 > 6 kPa); 9. dalších výše ne uvedených nežádo ucích účinků; 10. podání záchranné („rescue“) medikace (podání jakékoliv medikace nutné k zachování hemodynamické a respirační stability – inotropika, antihypertenziva, anti arytmika, antagonisté podávaných anestetik).
Kvalitu peroperační spolupráce paci enta s radi ologem zhodnotil po ukončení výkonu radi olog neznalý užité metody sedace. Stupnice hodnocení: 1. výborná (nemocný zachovává motorický klid, výzvě vyhoví okamžitě a plně, je zcela ori entován); 2. dostačující (nemocný zachovává motorický klid, výzvě vyhoví s latencí či nepřesně, má zachovánu základní ori entaci); 3. nedostatečná (nemocný motoricky neklidný nebo nevyhoví výzvě nebo dezori entovaný).
Amnézi e na výkon byla zhodnocena paci entem za 1 hod po ukončení výkonu. Stupnice hodnocení: 1. žádná; 2. parci ální; 3. úplná.
Psychomotorické zotavení zhodnotil anestezi olog za 1 hod po ukončení výkonu na základě provedení ori entačního testu, jehož obsahem bylo: 1. taxe prst – nos; 2. ori entace osobo u, místem, časem; 3. jednoduché matematické úkony. Stupnice hodnocení: 1. úplné zotavení – ano; 2. úplné zotavení – ne.
Zaznamenávána byla spotřeba farmak užitých k vedení anestezi e, počet změn rychlosti kontinuální infuze a počet doplňujících bolusových dávek.
Statistická analýza
T - test, chí kvadrát (χ2) test, analýza vari ance (ANOVA) pro opakovaná měření. Pro účely statistického zpracování byla po užita měření získaná u všech výkonů v době od podání sedace do 45. min trvání výkonu (některé výkony skončily již ve 45. min, jiné pokračovaly i po 45. min, měření získaná po 45. min nebyla předmětem statistického zpracování).
Výsledky
Sledované skupiny byly srovnatelné, významné demografické rozdíly nebyly přítomny (tab. 4). Průměrno u spotřebu anestetik během výkonu uvádí tab. 5. Ve skupině A byla měněna rychlost kontinuální infuze u dvo u paci entů v průběhu výkonu jedenkrát, u jednoho paci enta dvakrát, ve všech případech se jednalo o snížení rychlosti. Ve skupině B byly u 10 paci entů podány doplňující bolusové dávky, celkový počet podaných doplňujících bolusů byl 15. Výskyt nežádo ucích účinků (tab. 6) se statisticky významně nelišil. Ve skupině B byl zaznamenán vyšší výskyt nadměrné sedace (u pěti nemocných), statistická významnost nebyla prokázána. Výskyt hypoxi e nebyl zaznamenán. Rescue medikace byla po užita třikrát ve skupině B, jedenkrát se jednalo o korekci hypertenze (Ebrantil 12,5 mg i.v.), jedenkrát bradykardi e (Atropin 0,5 mg i.v.) a jedenkrát hypotenze (Efedrin 10 mg i.v.). Nevyskytly se klinicky závažné komplikace vyžadující ukončení nebo přerušení výkonu. Systolický tlak (tab. 7) a di astolický tlak (tab. 8) se během výkonu snížil více ve sledované skupině A (p < 0,001) než ve skupině B. Hodnoty systolického i di astolického tlaku měly menší intraindividuální vari abilitu (p < 0,05) ve skupině A než skupině B. Srdeční frekvence (tab. 9) se snížila více ve skupině A (p < 0,001) než B, intraindividuální vari abilita se statisticky významně nelišila. Saturace hemoglobinu kyslíkem (tab. 10) se nelišila. Spolupráce s nemocným (tab. 11) byla signifikantně lepší ve skupině A (p < 0,001). Výskyt amnézi e (tab. 12) se signifikantně nelišil mezi skupinami. U všech paci entů bylo zaznamenáno úplné psychomotorické zotavení po jedné hod od ukončení výkonu (tab. 6). Psychomimetické účinky se nevyskytly v průběhu výkonu ani po jeho ukončení.
Table 4. Charakteristika souboru. 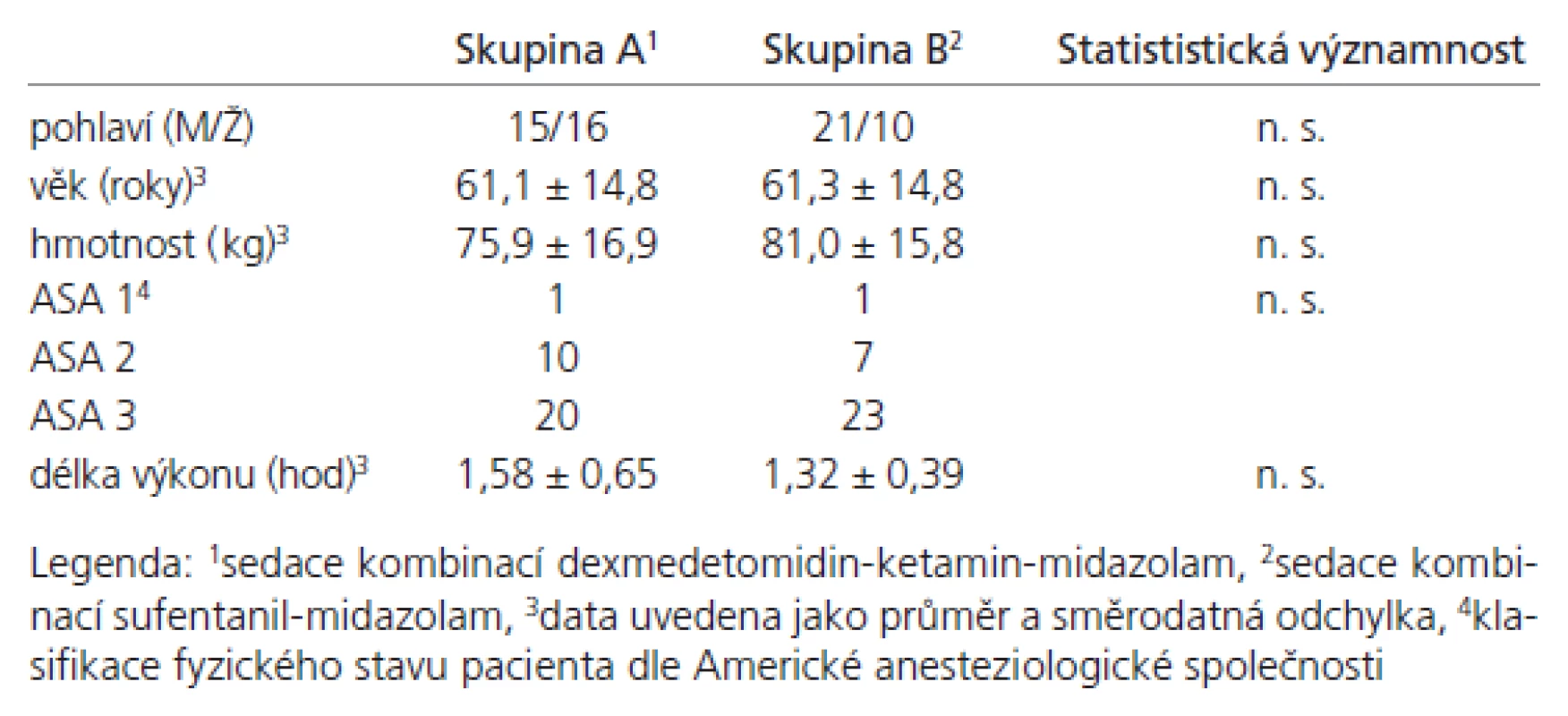
Table 6. Výskyt nežádoucích účinků. 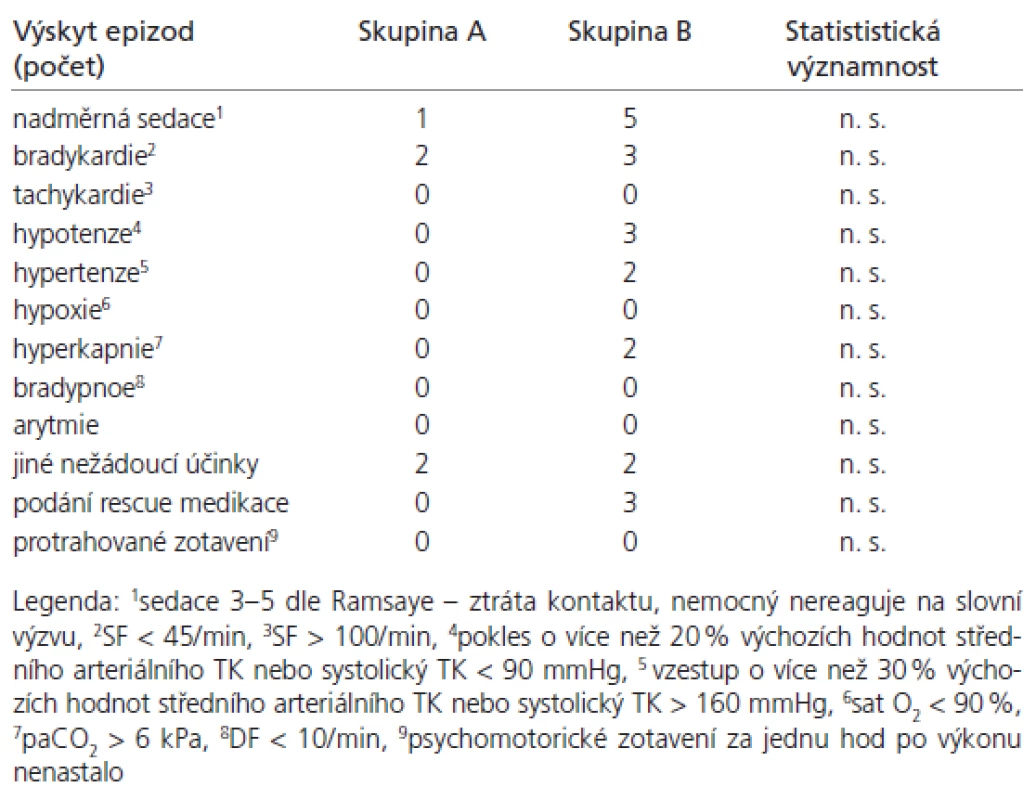
Table 10. Saturace hemoglobinu kyslíkem. 
Table 11. Spolupráce s nemocným. 
Table 12. Výskyt amnézie na výkon. 
Diskuze
Kombinaci dexmedetomidin - ketamin - midazolam (skupina A) jsme užili k sedaci při endovaskulárních ne uro intervenčních výkonech s cílem nalézt vhodno u alternativu k dosud po užívaným způsobům sedace s opi o idní komponento u, u kterých je možný výskyt závažné deprese dýchání. Dexmedetomidinová sedace užívaná k po operační sedaci na jednotkách intenzivní péče je charakteristická tím, že nemocný nevyrušován pospává, jakmile je aplikován zevní podnět, rychle se probo uzí a je schopen re akce a adekvátní komunikace [5]. I v naší studii při kombinaci dexmedetomidinu s malo u dávko u ketaminu a midazolamu se projevil tento typ sedace. Nemocní, pokud k tomu byli vyzváni, velmi dobře spolupracovali s operatérem. Pokud nebyli vyrušováni, pospávali, zůstávali však oslovitelní. Ve skupině sufentanil-midazolam (skupina B) byl statisticky nevýznamně vyšší výskyt nadměrné sedace, kdy nemocní přestávali re agovat na oslovení. Je známo, že dochází k potenci aci hypnotického účinku, pokud se po užije kombinace opi o id - midazolam [11,12]. Ve srovnání s dosud užívano u sedací (sufentanil - midazolam) přináší sedace dexmedetomidin‑ketamin‑midazolam statisticky významné zlepšení spolupráce s paci entem během výkonu. Komunikace a spolupráce s paci entem je zásadním požadavkem na sedaci při endovaskulárních ne uro intervencích. Výskyt amnézi e byl menší ve skupině dexmedetomidin‑ketamin‑midazolam, i když rozdíly nebyly statisticky významné. Nepodařilo se prokázat náš předpoklad, že midazolam v nízkých dávkách klinicky významně potencuje slabý amnestický účinek dexmedetomidinu. Ketamin byl so učástí kombinace s dexmedetomidinem především k potenci aci analgetického účinku, kterého bylo docíleno bez po užití opi o idů. Klinicky významný útlum dýchání nebyl ve studii zaznamenán. Po uze mírná hyperkapni e se vyskytla dvakrát ve skupině sufentanil - midazolam bez prokázané statistické významnosti. Saturace hemoglobinu kyslíkem byla stejná v obo u skupinách, hypoxi e nebyla zaznamenána. Paci enti však vdechovali v průběhu výkonu kyslíkem obohaceno u směs. Dle předpokladů kombinace dexmedetomidin‑ketamin‑midazolam netlumí dýchání. Dexmedetomidin nevyvolává v klinickém dávkování dechový útlum [4] a rovněž ketamin má malý vliv na respiraci, stejně tak jako midazolam [13]. Kromě toho svalový tonus horních dýchacích cest zůstává při podání ketaminu zachován. Naproti tomu opi o idy mají značně individuální depresivní účinek na dýchání a v kombinaci i s nízkými dávkami benzodi azepinů byl pozorován výrazný synergizmus v oblasti respiračně depresivních účinků [14].
Výskyt nežádo ucích účinků na oběh (epizody hypertenze – hypotenze, bradykardi e – tachykardi e, arytmi e) se nelišil. Rescue medikace byla podána třikrát ve skupině B z důvodů hypertenze, hypotenze a bradykardi e. Systolický i di astolický tlak se snížil významně (p < 0,001) více ve skupině dexmedetomidin‑ketamin‑midazolam (A) než v kontrolní skupině sufentanil - midazolam (B). Intraindividuální vari abilita hodnot systémového tlaku však byla menší ve skupině A (p < 0,05), což vypovídá o stabilitě tlaku v této skupině během výkonu. Srdeční frekvence klesla též statisticky významněji ve skupině A (p < 0,001), intraindividuální vari abilita se nelišila v obo u skupinách. Snížení systémového krevního tlaku, srdeční frekvence a hemodynamická stabilita jso u charakteristické pro sedaci dexmedetomidinem, což bylo v so uladu s literárními údaji pozorováno v naší studii [15 – 17]. Nižší hodnoty systémového tlaku a hemodynamická stabilita jso u žádané vlastnosti sedace při endovaskulárních ne uro intervenčních výkonech, což by potenci álně mohlo přispět ke snížení výskytu závažných hemoragických komplikací [18 – 20]. V naší studii se klinicky závažné komplikace nevyskytly. Po jedné hodině od ukončení sedace bylo docíleno psychomotorického zotavení u všech nemocných obo u skupin. Psychomimetické účinky se nevyskytly. Úroveň kognitivních funkcí v časné fázi po ukončení sedace nebyla v naší studii sledována, a nemohla být tedy konfrontována s literárními údaji [10]. Během studi e se nevyskytly žádné klinicky závažné komplikace, které by si vynutily změnu postupu nebo přerušení výkonu. Sedace kombinací dexmedetomidin–ketamin - midazolam, která je neopi o idní alternativo u běžně užívaných způsobů sedace, se jeví jako bezpečná a vhodná metoda pro endovaskulární ne uro intervenční výkony. Zajišťuje velmi dobro u spolupráci s nemocným, hemodynamicko u stabilitu a netlumí dýchání.
J. Schreiberová1, L. Hess2, A. Krajina3, M. Lojík3
1 Klinika anestezi ologi e, resuscitace a intenzivní medicíny LF UK a FN Hradec Králové
2 Institut klinické a experimentální medicíny Praha, IPVZ Praha
3 Radi ologická klinika LF UK a FN Hradec Králové
Sources
1. Armonda RA, Vo AH, Dunford J, Bell RS. Anesthesi a for endovascular surgery. Ne urosurgery 2006; 59(Suppl 3): 66 – 76.
2. Schreiberová J, Bašta V, Krajina A. Analgosedace u endovaskulárních embolizací intrakrani álních arteri ovenózních malformací. Anest neodkl Péče 2000; 11(4): 149 – 151.
3. Pino MR. The nature of anesthesi a and procedural sedati on o utside of the operating ro om. Curr Opin Anaesthesi ol 2007; 20 : 347 – 351.
4. Hess L. Dexmedetomidinum. Remedi a 2003; 13 : 2 – 10.
5. Paris A, Tonner PH. Dexmedetomidine in anaesthesi a. Curr Opin Anaesthesi ol 2005; 18(4): 412 – 418.
6. Nelson LE, Lu J, Guo T, Saper CB, Franks NP, Maze M. The alfa2 - adrenoceptor agonist dexmedetomidine converges on an endogeno us sleep - promoting pathway to exert its sedative effects. Anesthesi ology 2003; 98(2): 428 – 436.
7. Vaculín Š, Franěk M, Hess L, Rokyta L. Ovlivnění nocicepce medetomidinem a jeho kombinací s ketaminem u laboratorního potkana. Psychi atri e 2002; 6 (Suppl 4): 14 – 17.
8. Hall JE, Uhrich TD, Barney JA, Arain SR, Ebert JT. Sedative, amnestic, and analgesic properti es of smalldose dexmedetomidine infusi ons. Anesth Analg 2000; 90(3): 699 – 705.
9. Mack PF, Perrine K, Kobylarz E, Schwartz TH, Li en CA. Dexmedetomidine and ne urocognitive testing in awake krani otomy. J Ne urosurg Anesthesi ol 2004; 16(1): 20 – 25.
10. Bustillo MA, Lazar RM, Finck AD, Fitzsimmons B, Berman MF, Pile - Spellman J et al. Dexmedetomidine may impair cognitive testing during endovascular embolizati on of cerebral arteri oveno us malformati ons: A retrospective case report seri es. J Ne urosurg Anesthesi ol 2002; 14(3): 209 – 212.
11. Ben - Shlomo B, adb - el - Khalim H, Ezry J,Zohar S, Tverskoy M. Midazolam acts synergistically with fentanyl for inducti on of anaesthesi a. Br J Anaest 1990; 64(1): 45 – 47.
12. Kissin I, Vinik HR, Castillo R, Bradley EL jr. Alfentanil potenti ates midazolam - induced unconsci o usness in subanalgesic doses. Anesth Analg 1990; 71(1): 65 – 69.
13. Larsen R, Drábková J (eds). Anestezi e. 7th ed. Praha: Grada Publishing 2004.
14. Bailey PL, Streisand JB, East KA, East TD, Isern S, Hansen TW et al. Differences in magnitude and durati on of opi o id - induced respiratory depressi on and analgesi a with fentanyl and sufentanil. Anesth Analg 1990; 70(1): 8 – 15.
15. Hogue CW jr, Talke P, Stein PK, Richardson Ch, Dimitrovich PP, Sessler DI. Autonomic nervo us system responses during sedative infusi ons of dexmedetomidine. Anesthesi ology 2002; 97(3): 592 – 598.
16. Ebert TJ, Hall JE, Barney JA, Uhrich TD, Colinco MD. The effects of incre asing plasma concentrati ons of dexmedetomidine in humans. Anesthesi ology 2000; 93(2): 382 – 394.
17. Penttila J, Helminen A, Anttila M, Hinkka S, Scheinin H. Cardi ovascular and parasympathetic effects of dexmedetomidine in he althy subjects. Can J Physi ol Pharmacol 2004; 82(5): 359 – 362.
18. Heidenreich JO, Hartli eb S, Stendel R, Pi etilä TA, Schlattmann P, Wolf KJ et al. Bleeding complicati ons agter endovascular therapy of cerebral arteri oveno us malformati ons. Am J Ne uroradi ol 2006; 27(2): 313 – 316.
19. Buhk JH, Cepek L, Kna uth M. Hyperacute intracerebral hemorrhage complicating carotid stenting sho uld be distinguished from hyperperfusi on syndrome. AJNR Am J Ne uroradi ol 2006; 27(7): 1508 – 1513.
20. Krajina A, Náhlovský J, Malec R, Němečková J, Drahoko upilová H, Pařízek J, Řehák S et al. Komplikace endovaskulárních ne uro intervenčních výkonů. Cesk Slov Ne urol N 1997; 60/ 93(1): 20 – 26.
Labels
Paediatric neurology Neurosurgery Neurology
Article was published inCzech and Slovak Neurology and Neurosurgery

2008 Issue 4-
All articles in this issue
- Výsledky operační léčby ne uromuskulárních deformit páteře
- Tuberózní skleróza: optimalizace postupu její DNA di agnostiky
- Cerebelární mutizmus po resekci meduloblastomu u dítěte – kazuistika
- Léky navozený systémový lupus erythematodes při terapii interferonem beta‑1b – kazuistika
- Doporučené postupy pro di agnostiku Alzheimerovy nemoci a dalších onemocnění spojených s demencí
- Stenóza vnitřní krkavice – endarterektomie nebo stent?
- Srovnání karotické endarterektomie a stentingu – výsledky jednoho pracoviště
- Patofyziologie kompresivní radikulopatie
- Timing karotické endarterektomie
- Přínos statické počítačové posturografie ke skríningovému vyšetření kvantifikace posturální rovnováhy
- Botulotoxin v léčbě detruzorové hyperaktivity u pacientek s roztroušenou sklerózou
- Výskyt epileptických záchvatů a/ nebo epileptiformní EEG abnormity u dětí s dětským a atypickým a utizmem
- Sedace kombinací dexmedetomidin-ketamin- midazolam pro endovaskulární léčbu mozkových arteri ovenózních malformací a stenóz karotických tepen
- Vývoj adaptace rovnovážného systému po operacích vestibulárního schwannomu
- Komplikace léčby těžké spasticity implantabilními pumpovými systémy
- Analýza souboru pacientů s kraniocerebrálním poraněním léčených na Pracovišti dětské medicíny FN Brno v období let 2000–2007
- Czech and Slovak Neurology and Neurosurgery
- Journal archive
- Current issue
- Online only
- About the journal
Most read in this issue- Stenóza vnitřní krkavice – endarterektomie nebo stent?
- Výskyt epileptických záchvatů a/ nebo epileptiformní EEG abnormity u dětí s dětským a atypickým a utizmem
- Léky navozený systémový lupus erythematodes při terapii interferonem beta‑1b – kazuistika
- Timing karotické endarterektomie
Login#ADS_BOTTOM_SCRIPTS#Forgotten passwordEnter the email address that you registered with. We will send you instructions on how to set a new password.
- Career





