-
Medical journals
- Career
Stenóza vnitřní krkavice – endarterektomie nebo stent?
: V. Beneš 1; D. Netuka 1; F. Charvát 2; M. Mohapl 1; F. Kramář 1; S. Ostrý 1; J. Mašková 2; J. Lacman 2
: Neurochirurgická klinika 1. LF UK, IPVZ a ÚVN Praha 1; Radiodiagnostické oddělení ÚVN Praha 2
: Cesk Slov Neurol N 2008; 71/104(4): 388-399
: Minimonography
Podpořeno IGA MZCR NR/9435-3.
V posledních letech získává stenting stenóz vnitřní krkavice (Carotid Artery Stenting, CAS) velikou oblibu. Metodika se rychle šíří a odborná i laická veřejnost nabývá dojmu, že nahradí karotickou endarterektomii (Carotid Endarterectomy, CEA). Řešení karotických stenóz není těžké technicky, ale musí probíhat programově a týmově. Považujeme proto za vhodné formou minireview shrnout studie porovnávající efekt CEA a konzervativní terapie u pacientů se stenózou krkavice a doporučení American Heart Association (AHA) k dané problematice. Dále se věnujeme randomizovaným studiím, které porovnávají rizika CEA a CAS. Z literárních údajů shrnujeme, že CAS je vhodný jako alternativní metoda ve specifických situacích. Definitivní hodnocení můžeme udělat až po ukončení právě probíhajících randomizovaných studií, které porovnávají CEA a CAS. Do té doby by se CAS neměl vyjma specifických situací indikovat mimo randomizované studie a registry CAS. Naše současné indikace CEA: nemocní, na které se vztahují doporučení AHA. Léčebná modalita první volby. Současné indikace CAS: 1. restenóza krkavice, 2. disekce, 3. významná tandemová stenóza krkavice, 4. postiradiační stenóza a stenóza u nemocných po velkých operacích v oblasti krku, 5. nemocní s chirurgicky nepříznivou anatomickou situací.
Klíčová slova:
stenóza krkavice – endarterektomie – stentingÚvod
Vzhledem k vysoké incidenci stenóz krkavice představují léčebné zákroky na této tepně velmi důležité téma. Karotická endarterektomie (CEA) představuje klasickou techniku řešení stenózy krkavice. Karotický stenting (CAS) představuje novější techniku ošetření stenózy krkavice. Počty provedených CAS každý rok v ČR stoupají. Otázkou je, zda je dramatický vzestup CAS opodstatněný a počty CEA budou postupně klesat nebo zda by se měl CAS indikovat pouze ve vybraných případech a CEA by měla zůstat hlavní léčebnou modalitou. Řešení karotických stenóz není těžké technicky, ale musí probíhat programově a týmově. Považujeme proto za vhodné formou minireview shrnout současné znalosti o CEA a CAS.
CEA je nejdetailněji studovaný chirurgický výkon. Je to dáno preventivním charakterem operace, velkým počtem nemocných a homogenitou populace. Velké studie, které začaly být populární od 80. let minulého století, byly iniciovány neurology. Vcelku logicky, oni řešili komplikace operace a nekomplikované nemocné obvykle ani neviděli. Nabyli tak dojmu, že operace je indikována příliš často a mnohdy zbytečně. Položili si správnou otázku – má opravdu operace význam v prevenci iktu? Je opravdu lepší poměrně riziková operace v porovnání s přirozeným průběhem a nejlepší konzervativní léčbou? Pro odpověď jsou rozhodující zejména čtyři hlavní multicentrické randomizované mezinárodní studie – NASCET [1–4], ECST [5–8], ACAS [9] a ACST [10] (vysvětleno dále). Jsou stanovena vcelku velmi přesná chirurgická kritéria, nejen stupeň stenózy, kdy CEA je indikována, ale i procento přijatelných komplikací. Byla opakovaně publikována doporučení American Heart Association ohledně léčebného postupu u aterosklerotického postižení krkavic [11–14], poslední v roce 2006 [15]. Přesto na tomto místě považujeme za vhodné tyto studie a kritéria popsat znovu, neboť jsou zásadní nejen při indikacích CEA, ale i CAS. Za hlavní metodiku měření stenózy na DSA (digitální subtrakční angiografie) pokládáme metodiku ze studie NASCET (metodika porovnávající nejužší místo tepny s místem vnitřní krkavice dostatečně distálně za postenotickou dilatací této tepny).
Základní randomizované studie CEA verzus konzervativní terapie
NASCET (North American Symptomatic Carotid Endarterectomy Trial) je nejvýznamnější ze studií zabývajících se karotickou endarterektomií. Byla zahájena v roce 1987 [1–4] byli do ní zařazeni nemocní, kteří měli v anamnéze tranzitorní ischemickou příhodu (Transient Ischemic Attack, TIA) či malý iktus („nondisabling stroke“) v předchozích 120 dnech a na selektivní angiografii byla prokázána 30–99% stenóza vnitřní karotidy. Pacienti byli randomizováni do dvou větví. První spočívala v provedení endarterektomie a medikamentózní léčbě. Druhá větev byla léčena pouze konzervativně. V roce 1991 byla přerušena randomizace nemocných se stenózou 70–99 % [2]. U těchto pacientů jednoznačně převažoval efekt operace nad pouhou medikamentózní léčbou. Celkem bylo takto randomizováno 331 nemocných do konzervativní a 328 nemocných do chirurgické větve se stenózou 70–99 %. V chirurgické větvi 30denní M/M dosáhla 5,8 % (2,4 % pro velký iktus, 0,6 % pro smrt). Během dalšího, a to dvouletého sledování bylo riziko vzniku velkého iktu (event. i s následkem smrti) pouze 1,6 %/rok! V konzervativní větvi 30denní M/M 3,3 % (0,3 % pro velký iktus, 0,9 % pro smrt) a za stejný dvouletý časový interval dosáhlo totéž riziko 12,2 %/rok. Celkem tedy při dvouletém sledování bylo riziko iktu či smrti u chirurgicky léčených pacientů 9 %, v konzervativní větvi 26 %, tj. došlo ke snížení rizika o 17 procentních bodů (95% CI, 10–24 %). Tedy i přes rizika spojená s chirurgickou léčbou je efekt výkonu již po dvouletém sledování jednoznačný, vysoce statisticky významný.
Nadále byli randomizováni pacienti se stenózou krkavice 30–69 %. V roce 1998 byly publikovány výsledky u pacientů zařazených do této skupiny [4]. V chirurgické větvi to bylo celkem 1 108 nemocných, v konzervativní 1 118. Riziko iktu či smrti do 30 dnů od operace pacientů se stenózou karotidy 50–69 % bylo 6,7 %, riziko smrti 1,2 %. V konzervativní větvi byla tato rizika 2,4 %, resp. 1,4 %. V pětiletém sledování činilo riziko vzniku cévní mozkové příhody (CMP) v operované skupině 15,7 %, kdežto u konzervativně léčených pacientů dosáhlo 22,2 %. Přestože rozdíl není velký a vyplývá z něj potřeba operovat 12 nemocných se symptomatickou stenózou 50–69 %, aby bylo zabráněno vzniku jednoho iktu, jedná se o rozdíl statisticky významný a značí, že by tito nemocní měli být léčeni chirurgicky. Ve skupině 30–49 % byla nalezena tato rizika v pětiletém sledování: operovaní pacienti – 14,9% riziko iktu či smrti, konzervativně léčení pacienti – riziko 18,7 %. Tyto výsledky nejsou statisticky rozdílné.
Další významnou studií je ECST (European Carotid Stenosis Trial), která byla zahájena již v roce 1981 [5–8]. Protokol studie byl velmi obdobný jako u studie NASCET, zařazeni byli nemocní s TIA, malým iktem či amaurosis fugax v posledních šesti měsících, pokud na angiografickém vyšetření byla prokázána stenóza, u níž místní neurolog spolu s chirurgem nebyli schopni odpovědně rozhodnout, zda takovému nemocnému doporučit karotickou endarterektomii. Na rozdíl od NASCET byli sledováni nemocní se stenózou 0–99 %. Pacienti byli rozděleni do dvou skupin. V první skupině byla provedena endarterektomie. Druhá skupina byla léčena konzervativně. Ve výsledcích byly vedeny pouze fatální nebo těžké cévní mozkové příhody, ale do analýzy byly zahrnuty i malé ikty, které se neupravily do sedmi dnů. V roce 1991 byly publikovány první výsledky této studie [5]. Sdělení se týkalo 1 152 nemocných, a to jednak těch se stenózou 0–29 % (219 v chirurgické větvi a 155 v konzervativní) a jednak těch, kde stenóza dosahovala 70–99 % (455 v. 323). Ze studie jednoznačně vyplynula výhoda operace oproti konzervativní léčbě pro pacienty se stenózou karotidy 70–99 % v prevenci smrtelné či těžce invalidizující ipsilaterální CMP. V chirurgické větvi bylo 30denní riziko 7,5 %, avšak poté již jen 2,8 %. V konzervativní větvi bylo toto riziko 16,8 % po dvou letech. Po třech letech byla rizika 12,3 % v chirurgické větvi ku 21,9 % v konzervativní větvi. Naproti tomu u nemocných se stenózou 0–29 % nebyl preventivní účinek endarterektomie prokázán. V roce 2003 byla publikována reanalýza dat z ECST – celkem bylo randomizováno 3 018 pacientů, střední doba sledování činila 73 měsíce [16]. Pro zjednodušení srovnání výsledků této studie a studie NASCET byly všechny angiografie přeměřeny dle metodiky použité ve studii NASCET. V chirurgické větvi bylo nalezeno snížení rizika iktu či smrti při pětiletém sledování o 5,7 % (95% CI, 0–11,6 %) u pacientů se symptomatickou stenózou krkavice 50–69 %. U pacientů se stenózou nad 70 % byla výše zmíněná rizika snížena o 21,2 % (95%CI, 12,9–29,4 %). Stejný efekt byl prokázán i v 10letém sledování. Nutno ještě podotknout, že ze skupiny pacientů se stenózou nad 70 % byli vyřazeni pacienti s preookluzí krkavice (125 pacientů) – ti byli hodnoceni samostatně a v této skupině nebyl nalezen statisticky významný efekt operace. Pro pacienty se stenózou 30–49 % nebyl efekt chirurgického výkonu prokázán. Operace poškodila pacienty se stenózou pod 30 %.
Rothwell et al v roce 2003 provedli reanalýzu dat z NASCET, ECST a Veterans Affairs Trial [17]. Sloučením dat z těchto tří studií byl získán soubor 6 092 pacientů, celkový follow‑up činil 35 000 pacient-roků. Výsledky byly obdobné: negativní efekt operace u stenóz ≤ 30 %, významně pozitivní efekt u stenóz ≥ 70 %, nulový efekt operace stenóz 30–49 % a hraniční pozitivní efekt operace u stenóz 50–69 %. U pseudookluze byl zjištěn pozitivní efekt při dvouletém sledování, při pětiletém sledování nebyl efekt operace statisticky signifikantní.
Alamowitch et al provedli analýzu dat ze studie NASCET a ACE [18]. Hodnocen byl zejména vztah pohlaví k efektu operace. 30denní M/M byla mírně vyšší u žen, nejednalo se však o statisticky signifikantní rozdíl. Muži měli benefit z operace stenózy ≥ 50 %, ženy měly benefit z operace stenózy ≥ 70 %, nebyl prokázán efekt CEA u žen se stenózou 50–69 %. Hlavním důvodem je, že ženy v této skupině mají riziko recidivy iktu oproti mužům nižší. Byly identifikovány tyto faktory, které zvyšovaly pravděpodobnost efektu operace u této skupiny žen: hemisferální příhoda, dokončený iktus, diabetes mellitus, věk nad 70 let.
V souvislosti se studiemi zaměřenými na symptomatické nemocné vznikl rovněž požadavek na studie zabývající se asymptomatickými stenózami. Takto vznikly: Veterans Affairs Cooperative Study Group [19–20] a Mayo Study Group [21]. Tyto studie skončily předčasně bez jasného výsledku nebo byly přerušeny pro příliš vysoké interní komplikace chirurgického výkonu.
Až studie ACAS (Asymptomatic Carotid Atherosclerosis Study) zabývající se asymptomatickými stenózami prokázala efekt endarterektomie již u 60% stenózy: pětileté riziko vzniku CMP bylo sníženo o polovinu [9]. Tato studie trvala sedm let a byla opakovaně zpochybňována. Všichni nemocní užívali denně kyselinu acetylsalicylovou, zároveň byli léčeni pro současné rizikové faktory jako hypertenze, hypercholesterolemie a diabetes mellitus (pokud tyto faktory byly přítomny).
U 25 % nemocných byla v anamnéze proběhlá CMP či TIA z jiného povodí, než kde byla přítomna stenóza. Celkem byla operace provedena u 825 nemocných. Průměrná doba sledování byla 2,7 roku. Dopočítané pětileté riziko vzniku CMP dosáhlo v chirurgické skupině 5,1 %, zatímco ve skupině léčené konzervativně to bylo 11 %. Karotická endarterektomie vedla u operovaných nemocných ke snížení agregovaného rizika vzniku CMP o 53 %. Zajímavá byla redukce rizika CMP z hlediska pohlaví. Zatímco u mužů dosáhla až 66 %, u žen pouze 17 %.
V roce 2004 byly publikovány výsledky evropské studie asymptomatických stenóz krkavice [10]. Jedná se o ACST (Asymptomatic Carotid Stenosis Trial). V období 1993–2003 bylo celkem randomizováno 3 120 pacientů. Pacienti randomizovaní do této studie nesměli mít minimálně šest měsíců žádnou, ani tranzitorní ataku v povodí dané krkavice. Stenóza musela být minimálně 60% dle ultrazvukového vyšetření. Nebyla však jednoznačně stanovena kritéria, podle kterých se určoval stupeň stenózy, s odvoláním na místní kritéria v centrech participujících na randomizované studii. 30denní riziko iktu či smrti v chirurgické větvi studie bylo 3,1 % (95% CI, 2,3–4,1 %).
Srovnání rizik v chirurgické větvi (včetně perioperačních rizik) s riziky pacientů léčených konzervativně při pětiletém sledování pacientů vycházejí následovně:
- riziko jakéhokoliv iktu: 6,4 ku 11,8 %, čistý zisk 5,4 % (95% CI: 3,0–7,8 %)
- riziko těžkého iktu či následné smrti: 3,5 ku 6,1 %, čistý zisk 2,5 % (95% CI, 0,8–4,3 %)
- riziko iktu, který způsobil smrt: 2,1 ku 4,2 %, čistý zisk 2,1 % (95% CI, 0,6 –3,6 %).
Procenta stenózy byla dle ultrazvuku obvykle hodnocena po celých desítkách procent. Separátně byly vyhodnoceny výsledky u pacientů se stenózou pod 80 % (1 284 pacienti, průměrná stenóza 69 %) a u pacientů se stenózou nad 80 % procent (1 836 pacientů, průměrná stenóza 87 %). U pacientů v první skupině bylo pětileté riziko jakéhokoliv iktu (mimo období 30 dnů od randomizace) 2,1 ku 9,5 %, ve druhé skupině byla rizika 3,2 ku 9,6 %. Překvapivě ve druhé skupině nebylo vyšší riziko u konzervativně léčených pacientů než v první skupině (9,6 ku 9,5 %), tj. riziko iktu po pěti letech bylo prakticky identické bez ohledu na stenózu dle dopplerovské ultrasonografie (UZ). Efekt chirurgické intervence byl signifikantní jak pro nemocné mladší 65 let, tak pro věkovou skupinu 66–75 let, nikoliv pro pacienty nad 75 let. U mužů byl opět větší efekt endarterektomie než u žen, kde je hraniční. Velmi překvapivě nebyla prokázána vyšší rizika u pacientů s echolucentními aterosklerotickými pláty.
Obr. 1 zachycuje stenózu krkavice dle CT-angiografie, obr. 2 peroperační pohled na vypreparovanou a. carotis communis, a. carotis interna, klipy na a. carotis externa, a. thyroidea superior, obr. 3 stěnu tepny po odstranění aterosklerotického plátu a obr. 4 kontrolní pooperační CT-angiografii.
1. Symptomatická stenóza krkavice dle CT-angiografie. 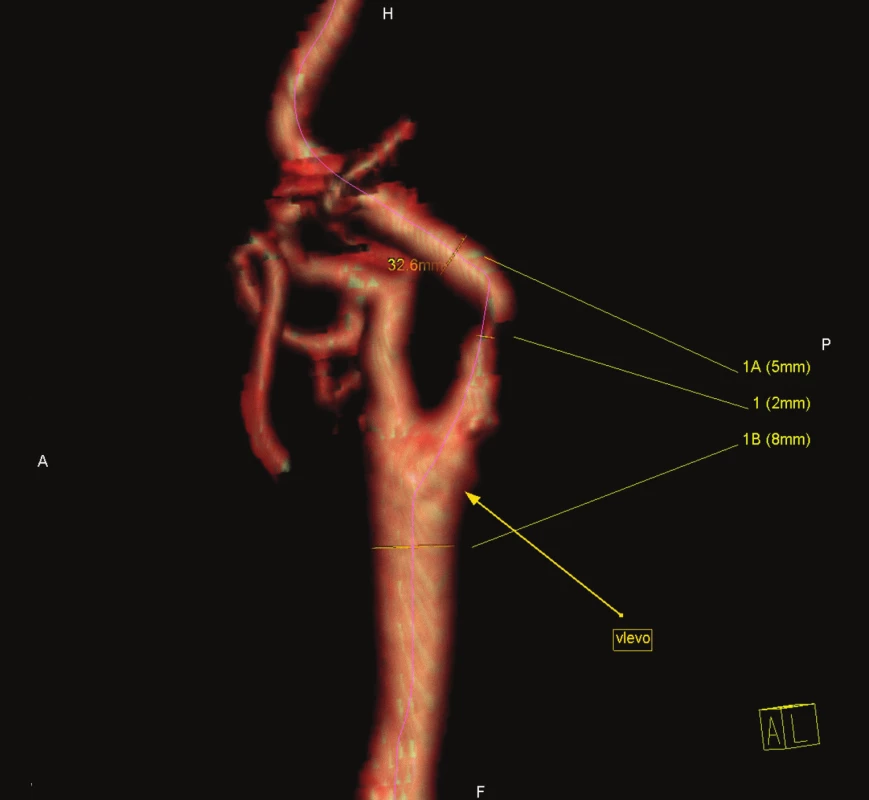
2. Operační foto: vypreparována a. carotis communis, a. carotis interna, klipy na a. carotis externa, a. thyroidea superior 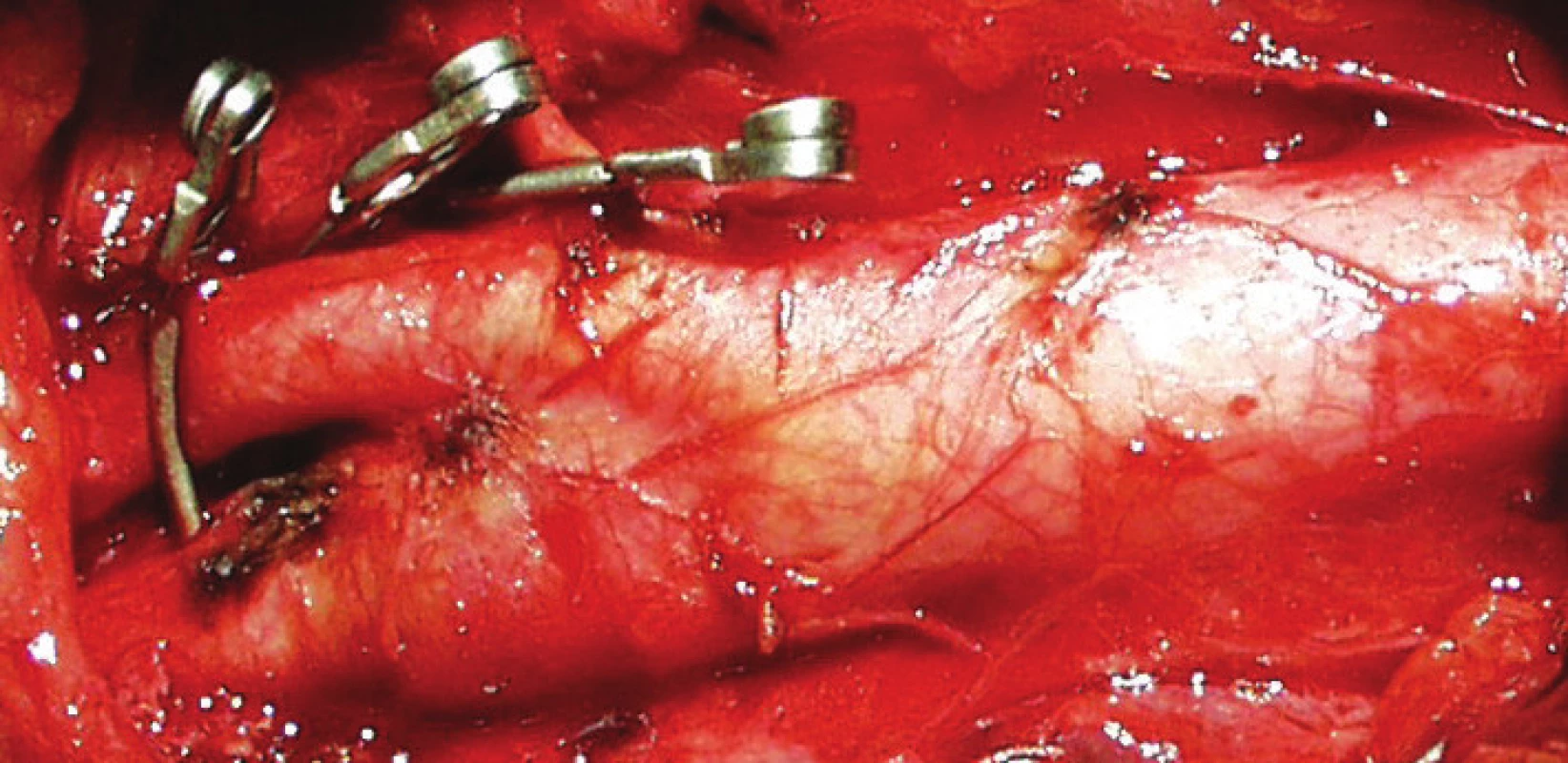
3. Stěna tepny po odstranění aterosklerotického plátu. 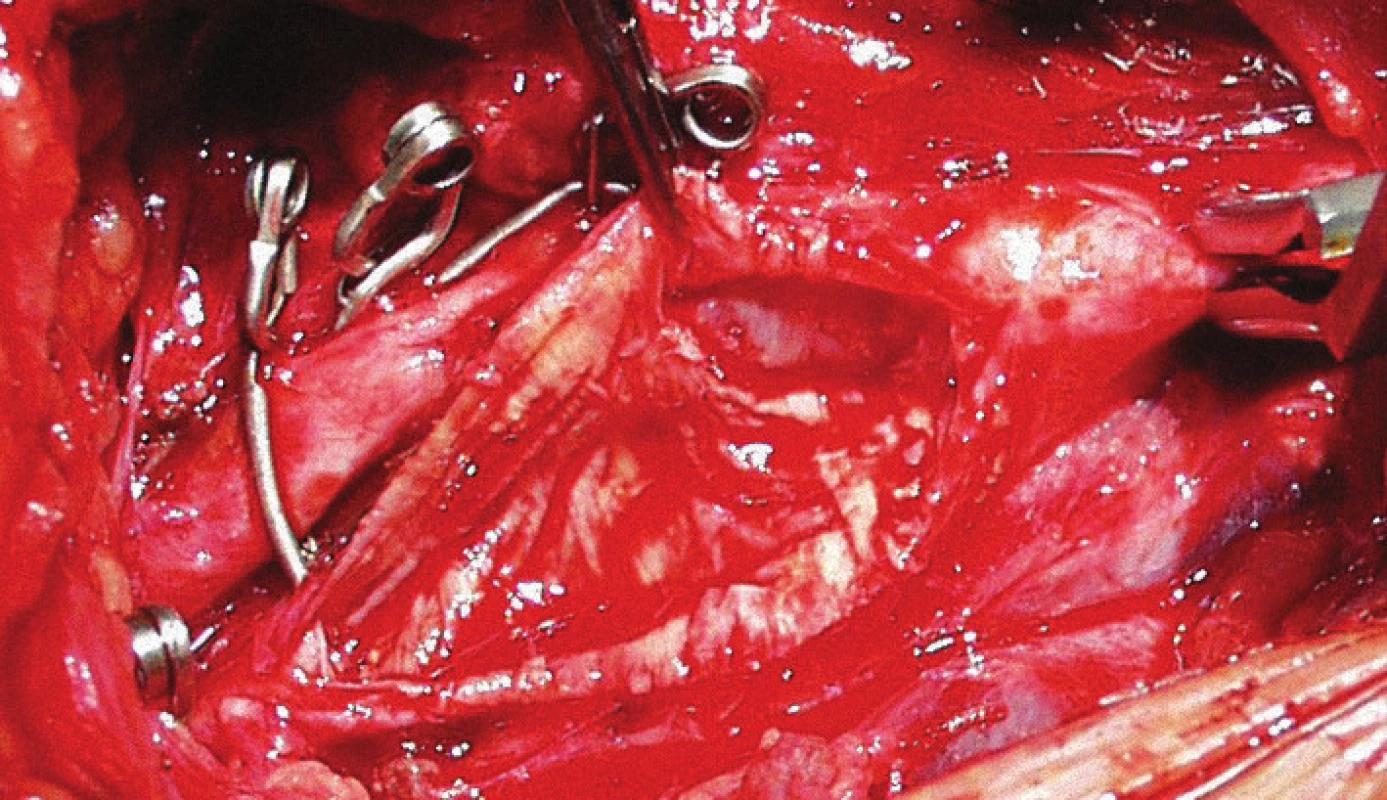
4. Kontrolní pooperační CT-angiografie. 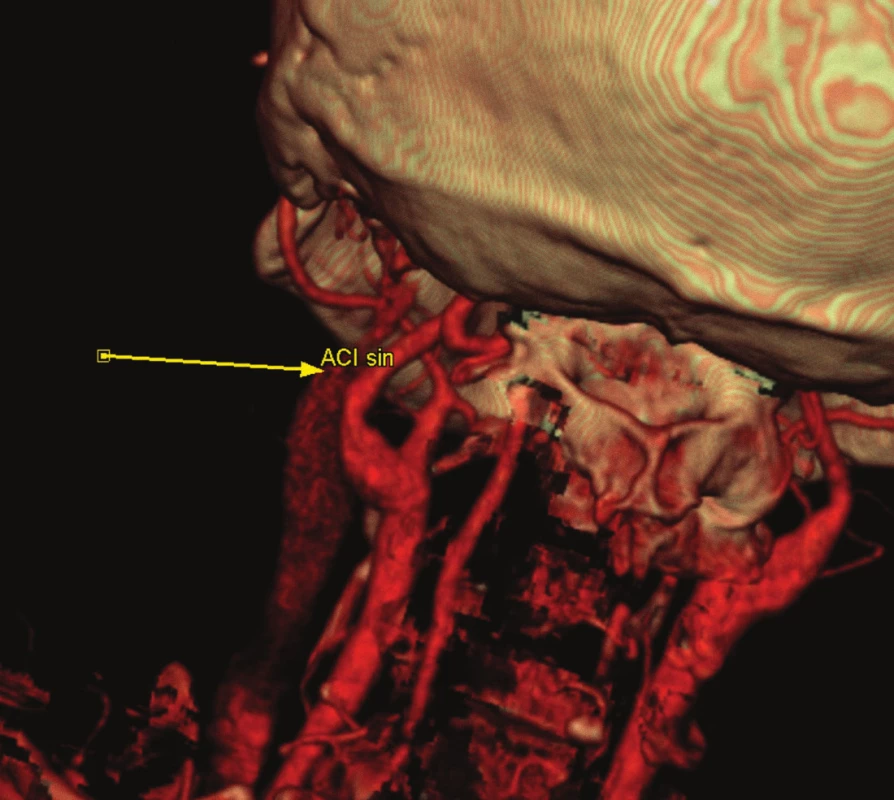
Načasování operace
Bond et al provedli důkladnou analýzu prací zabývajících se CEA v období 1980–2000 [22]. Nejvyšší riziko CEA bylo ve skupině pacientů s rozvíjejícím se iktem, poté ve skupině restenóz. Nejnižší riziko bylo nalezeno u asymptomatických stenóz, jen mírně vyšší ve skupině symptomatických stenóz, jejichž klinickým projevem byla amaurosis fugax, a opět mírně vyšší u hemisferálních příhod. Velmi významný je fakt, že riziko CEA není vyšší u stabilního pacienta se symptomatickou stenózou, který je operován do tří týdnů od iktu oproti odložené operaci.
Rothwell et al publikovali zcela zásadní práci, která se zabývala analýzou vztahu TIA a CMP [23]. Celkem tento vztah hodnotil u 2 416 pacientů s CMP. TIA předcházela iktu v 26 % případů. Pokud se nejprve vyskytla TIA, poté následoval iktus stejný den v 17 % případů, následující den v 9 % a do týdne v celkem 43 % případů.
V roce 2004 publikovali Rothwell et al analýzu dat ze studií NASCET a ECST, ve které se zaměřili na vztah načasování operace a jednotlivých podskupin pacientů ve vztahu k efektu operace [24]. Nejvyšší efekt operace byl prokázán u mužů, obecně u pacientů nad 75 let a u pacientů, u kterých byla CEA provedena do dvou týdnů od iniciální ataky.
Velmi významnou práci publikovali Alamowitch et al, kteří se zabývali efektem CEA dle věku pacienta [25]. Vycházeli přitom z dat ze studie NASCET. Nejvyšší efekt CEA byl zaznamenán u pacientů starších než 75 let, menší u pacientů 65–74 a nejmenší u pacientů mladších 65 let. Ve skupině pacientů starších 75 let se stenózou ≥ 70 % je třeba provést CEA u tří pacientů k tomu, abychom zabránili jednomu ipsilaterálnímu iktu, u pacientů se stenózou 50 až 69 % je nutné provést operaci šesti pacientům. Nejvyšší efekt CEA u starých pacientů je dán nízkou perioperační M/M ve studii NASCET (dokonce mírně nižší než u mladších pacientů) a nejvyšším rizikem recidivy iktu (významně vyšší než u pacientů mladších 65 let).
Doporučení American Heart Association
Na základě výše zmíněných multicentrických randomizovaných studií publikovala AHA doporučení ohledně optimální léčby pacientů s aterosklerotickým postižením vnitřní krkavice. Nejnovější doporučení, která byla publikována v roce 2006, jsou shrnuta v tab. 1 [15]. V roce 1998 byla též vydána doporučení k léčbě pacientů s asymptomatickou stenózou krkavice [13], která shrnujeme v tab. 2.
1. AHA doporučení u symptomatických stenóz krkavice. 
2. AHA doporučení u asymptomatických stenóz krkavice. 
Endovaskulární techniky
Od 90. let je patrný rychlý nástup endovaskulárních technik. Jejich atraktivita je pochopitelná – žádný řez, žádná operace, pouze vpich v třísle. Výtečně zapadají do dnešního trendu minimální invazivity a zkracování hospitalizace. Samozřejmě jedna z prvních oblastí, kde se v neurologické problematice endovaskulární techniky prosadily, byla právě oblast bifurkace karotidy. Stenting karotidy je výkon rychlý, pro nemocné i lékaře atraktivní, zdánlivě šetrný a bezpečný. I chirurg cítí, že endovaskulární přístup je šetrnější. Je to však skutečně pravda?
Jak již jsme se zmínili, intervenční radiologové přijali indikační kritéria CEA a aplikovali je na CAS. Domníváme se, že je to legitimní, ale považujeme za vhodné na tento fakt upozornit. Jde o dvě diametrálně odlišné metody. Při CEA tepnu otevíráme a odstraňujeme aterosklerotický plát, výsledkem je hladký a nesmáčivý povrch bez cizího materiálu. Při CAS vytváříme podélnou disekci plátu a víceméně jej rozevíráme i se stěnou (nedochází k symetrickému rozšíření). Stent pak působí jako podpora lumina tepny, aterosklerotický plát zůstává zevně stentu, stent zůstává v tepně trvale.
Na obr. 5 je zachycena stenóza krkavice dle DSA, obr. 6 zobrazuje příznivý nález po karotickém stentingu.
5. Symptomatická stenóza krkavice dle DSA. 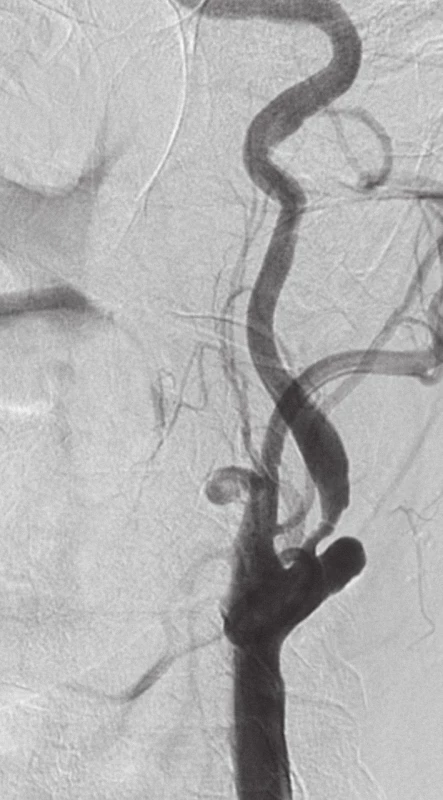
6. Příznivý nález po provedeném karotickém stentingu. 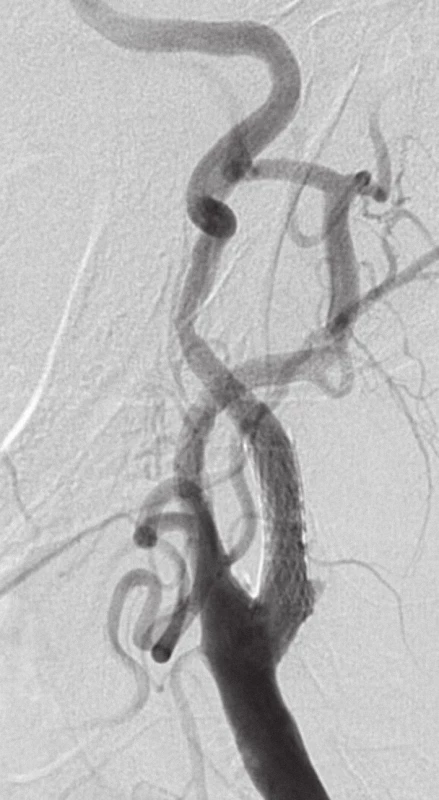
Ve starších randomizovaných studiích byl CAS prováděn bez použití cerebrální protekce. V současné době je CAS prováděn rutinně s cerebrální protekcí. U CAS je nutná vyšší antiagregační léčba před výkonem a po něm než u CEA. Rozbor této problematiky však přesahuje rámec textu.
Co se tedy týká stupně stenózy, jsou indikace stejné jako u CEA. Nelze však opomenout fakt, že níže uvedené studie se zabývaly srovnáním krátkodobých výsledků CEA v. CAS (obvykle srovnávají 30denní, nebo jednoroční výsledky). Pozitivní efekt CEA u symptomatických stenóz 50–69 % (ve vybraných případech, viz výše) a u asymptomatických stenóz je však prokázán až při pětiletém sledování. Tato data o CAS zatím chybí.
Jeden ze zdrojů informací o rizicích stentingu představují registry, které se zaměřily na rizikové pacienty se stenózou krkavice. Dosažená 30denní M/M se pohybuje mezi 5,8 [26] a 8,3 % [27]. V roce 2007 byly publikovány výsledky „CAPTURE“ registru, kde i při rutinním použití distální protekce 30denní M/M dosahovala 6,3 % [28], ve studii „CASES-PMS“ 5 % [29]. Na tomto místě je nutné zdůraznit, že do těchto studií jsou zařazeni též asymptomatičtí pacienti. Dle AHA je indikace k CEA u asymptomatického pacienta jasná pouze v případě, že riziko výkonu je nižší než 3 %. Této mety ani jedna výše uvedená studie nedosahuje.
Je vhodné se zároveň zmínit o studii CaRESS (Karotická revaskularizace pomocí endarterektomie nebo stentingu) [30]. Tato nerandomizovaná prospektivní studie se zaměřila na pacienty se symptomatickou stenózou > 50 % nebo s asymptomatickou stenózou > 75 %. Celkem bylo sledováno 397 pacientů (254 CEA a 143 CAS). Pouze 32 % stenóz bylo symptomatických. Nebyl nalezen statisticky signifikantní rozdíl nebezpečí smrti nebo iktu 30 dní po výkonu (riziko 3,6 % ve skupině CEA, 2,1 % u CAS) nebo rok po výkonu (13,6 % CEA, 10,0 % CAS).
Z klinického pohledu jsme měli vcelku jednoduchou a logickou představu, že CAS je lepší u interně nemocných pacientů a u starších nemocných, CEA se svojí časem ověřenou trvanlivostí je pak vhodnější u mladších nemocných bez rizikových faktorů. Zhruba s touto představou pracovaly některé z randomizovaných studií, které srovnávaly CEA a CAS. Poté, co byla do praxe zavedena distální protekce, se zdálo, že CAS snadno předčí CEA. I to byl jeden z důvodů, proč byly zorganizovány studie srovnávající CEA a CAS. Až dosud proběhlo osm randomizovaných studií, jejich popis a výsledky uvádíme v následujících odstavcích.
Randomizované studie CEA verzus CAS
Nejstarší randomizovaná studie pochází z roku 1998. Tehdy byla nuceně ukončena studie, kterou vedli Naylor et al v Leicesteru (Velká Británie) [31]. U prvních 10 pacientů ve skupině CEA nebyl zaznamenán ani jeden iktus, ve skupině endovaskulární došlo k iktu u pěti ze sedmi pacientů.
Randomizovaná studie Wallstent byla předčasně ukončena po randomizaci 219 symptomatických pacientů se stenózou krkavice 60 až 90 % [32]. CAS byla prováděna bez distální protekce, nebyla podávána duální antiagregační terapie a zkušenost intervenčních radiologů byla výrazně menší než zkušenost chirurgů provádějících CEA. Primárním hodnotícím kritériem bylo riziko iktu ipsilaterálně ke stenóze krkavice a riziko smrti z vaskulárních příčin. Ve skupině CEA bylo toto riziko 3,6 %, ve skupině CAS 12,1 %. Riziko jakéhokoliv iktu nebo smrti bylo 4,5 % po CEA a 12,1 % po CAS. Vzhledem k dosaženým výsledkům byla tato studie předčasně ukončena. Velmi kuriózní je, že dosud byly výsledky této studie publikovány pouze formou abstraktu, ale nikdy nebyly zveřejněny kompletní výsledky této studie.
Brooks et al již v roce 2001 publikovali výsledky tzv. Kentucky A studie, která se zabývala pouze symptomatickými stenózami nad 70 % [33]. Randomizováni byli 104 pacienti. Nebyly nalezeny významné statistické rozdíly mezi CEA a CAS.
V roce 2004 Brooks et al publikovali výsledky tzv. Kentucky B randomizované studie srovnávající CEA a CAS u asymptomatických pacientů. V této studii nebyla použita cerebrální protekce během výkonu. Celkem bylo do studie zařazeno pouze 85 pacientů a nebyl nalezen rozdíl mezi výsledky CEA a CAS [34].
CAVATAS (Endovaskulární verzus chirurgická léčba u pacientů se stenózou krkavice ve studii karotické a vertebrální transluminální angioplastiky) [35]: v této studii byli randomizováni 504 pacienti (251 pacient v endovaskulární skupině, stenting proveden pouze v 26 % případů, nikdy nebyla použita protekce embolizace během výkonu, angioplastika v 74 %, 253 pacienti ve skupině CEA). Riziko smrti nebo těžkého iktu v 30 dnech od výkonu bylo 6,4 % v endovaskulární skupině, 5,9 % v chirurgické větvi. Riziko jakéhokoliv perioperačního iktu, trvajícího déle než sedm dní, bylo 10,0 % v endovaskulární skupině, v chirurgické skupině 9,9 %. Rozdíl nebyl statisticky signifikantní. Ve skupině CEA bylo logicky více poranění hlavových nervů (8,7 v. 0 %) a více lokálních hematomů (6,7 v. 1,2 %). Ve skupině CEA bylo statisticky méně restenóz jeden rok po výkonu (4 v. 14 %). Při hodnocení této studie nesmíme opomenout fakt, že M/M byla vysoká v obou zkoumaných skupinách.
SAPPHIRE (Karotický stenting s protekcí verzus endarterektomie u vysoce rizikových pacientů) [36]: v této studii byla již použita cerebrální protekce během CAS. Celkem byli randomizováni 334 pacienti, pouze 30 % stenóz bylo symptomatických. Pacienti měli závažné komorbidity (srdeční selhání ve 20 % případů, závažné koronární onemocnění v 16 %, těžká angina pectoris v 15 %). Technická úspěšnost CAS byla 95,6 %. Riziko iktu, infarktu myokardu nebo smrti rok od výkonu bylo po CAS 12 %, ve skupině CEA 20,1 %. Ve skupině symptomatických stenóz bylo toto riziko 16,8 v. 16,5 %. Hlavní rozdíl mezi CAS a CEA byl ve výskytu non-Q infarktů myokardu. Když odečteme tyto příhody, nebyl rozdíl ve výsledcích signifikantní (5,5 v. 8,4 %). Riziko iktu do tří let po výkonu bylo po CAS 6,7 %, po CEA 7,1 %, další výkon pro restenózu byl proveden v 7,1 % po CAS, v 3,0 % po CEA. Tato studie zkoumala, zda je jedna metodika horší než druhá. Ukázalo se, že u pacientů s výraznou komorbiditou není CAS horší než CEA.
SPACE (studie stentingu s protekcí verzus karotická endarterektomie u pacientů se symptomatickou stenózou krkavice) [37]: tato studie probíhala v Německu, Rakousku a Švýcarsku. CAS byl proveden v 605, CEA v 595 případech symptomatické stenózy ≥ 50 % dle metodiky NASCET. Cerebrální protekce nebyla podmínkou CAS, byla použita v 26,6 % případů. Nyní jsou k dispozici výsledky 30denní morbidity/mortality, dlouhodobější výsledky nejsou k dispozici. Riziko iktu nebo smrti bylo 6,8 % ve skupině CAS, 6,3 % ve skupině CEA. Cílem studie bylo prokázat, že CAS není horší léčebnou modalitou než CEA. V případě pozitivního výsledku studie by závěrem studie bylo zjištění, že CAS a CEA jsou ekvivalentní metody. Toto se však nepodařilo.
EVA-3S (Endarterektomie verzus stenting u pacientů se symptomatickou těžkou stenózou krkavice) [38]: do této studie byli zahrnuti pouze pacienti se symptomatickou stenózou krkavice > 60 %. Cerebrální protekce byla použita u 91,9 % pacientů. Tato velmi dobře propracovaná studie musela být předčasně ukončena po randomizaci 527 pacientů z důvodu bezpečnosti léčebného postupu pro další pacienty. 30denní riziko iktu nebo smrti bylo ve skupině CEA 3,9 %, ve skupině CAS 9,6 %, relativní riziko iktu nebo smrti bylo 2,5krát vyšší ve skupině CAS oproti skupině CEA. 30denní riziko těžkého iktu nebo smrti bylo ve skupině CEA 1,5 %, ve skupině CAS 3,4 %, relativní riziko těžkého iktu nebo smrti bylo 2,2krát vyšší ve skupině CAS oproti skupině CEA. Riziko iktu nebo smrti šest měsíců po výkonu bylo ve skupině CEA 6,1 %, ve skupině CAS 11,7 %. Ve skupině CEA bylo více závažných lokálních komplikací a více interních komplikací oproti CAS, rozdíl však nebyl statisticky signifikantní. Tato studie prokázala, že CAS dosahuje horších výsledků než CEA.
V současné době probíhají tři významné studie, které by měly přinést další informace o tom, která z léčebných metodik dosahuje lepších výsledků. Jedná se o studie ICSS (International Carotid Stenting Study) [44] a CREST (Carotid Revascularization Endarterectomy Versus Stenting Trial) [45]. Studie ACST-2 (Asymptomatic Carotid Surgery Trials-2) [46], která se zabývá asymptomatickými stenózami krkavice, začala randomizovat pacienty teprve 15. 1. 2008.
Kastrup et al publikovali v roce 2007 velmi kvalitní review současných randomizovaných studií CEA v. CAS a též provedli analýzy dvou podskupin pacientů: 1. staří pacienti a 2. pacienti s okluzí kontralaterální krkavice [39]. Léčebné výsledky u starých pacientů jsou k dispozici ze studií NASCET, ECST a SPACE. Studie NASCET prokázala největší benefit CEA u pacientů nad 75 let. U těchto pacientů je největší riziko recidivy iktu při konzervativní léčbě a zároveň perioperační riziko iktu nebo smrti bylo mírně nižší než u mladších pacientů.
ECST tyto výsledky potvrzuje. Naproti tomu studie SPACE prokázala vyšší riziko CAS u pacientů nad 75 let. Z těchto výsledků lze učinit tento závěr: samotný věk není rizikovým faktorem pro CEA. Pokud budeme doporučovat výkon pro stenózu krkavice u staršího pacienta (samozřejmě po zvážení jeho celkového stavu), měli bychom preferovat CEA.
U pacientů s kontralaterální okluzí krkavice je situace jiná: perioperační M/M u těchto pacientů byla ve studii NASCET 14,3 %. Přesto byl efekt CEA i v této studii signifikantní vzhledem k vysokému riziku iktu ipsilaterálně k symptomatické stenóze krkavice (69,4 % během 2 let!). Perioperační M/M byla ve studii ECST v této skupině pacientů též vysoká (12,5 %). Ve studiích EVA-3S nebyla v této skupině pacientů pozorována vyšší M/M (avšak nelze opomenout fakt, že počet pacientů s kontralaterální okluzí byl malý, 1,2 % u CEA a 5 % u CAS). V roce 2005 publikoval Mozes review na téma vysokoriziková CEA [40]. V uveřejněných studiích je ve většině případů CEA riskantnější než CAS. Proto je dle našeho názoru vhodné zvážit CAS u těchto pacientů.
Luebke et al publikovali též v roce 2007 metaanalýzu studií porovnávající CEA a CAS. Došli k závěru, že v současné době je CEA bezpečnější a CAS by měl být indikován v rámci randomizovaných studií [41].
Závěrem lze říci, že je dostatek důkazů o efektu CEA u symptomatických stenóz karotidy (viz výše). V současné době jednoznačný důkaz o tom, že CAS dosahuje minimálně identických výsledků jako CEA, chybí.
Nevyjasněné otázky
Načasování operace a počet pacientů, u kterých je třeba provést intervenci k zabránění jednoho iktu
Dle Rothwella et al u 23 % nemocných předcházela vlastnímu iktu TIA. Celkem v 17 % TIA proběhla ve stejný den jako iktus, ve 43 % do týdne před iktem. Jde o čísla z NASCET a tito nemocní jsou spolu s chirurgickými komplikacemi příčinou iniciálního poklesu Kaplan-Meyerovy křivky [23]. Pokud bychom k TIA přistupovali správně – jako k akutní situaci – a s nemocnými opravdu jednali akutně, významně bychom snížili iniciální pokles. Tím bychom zmenšili počet nemocných, které musíme odoperovat k prevenci jednoho iktu u symptomatických nemocných [24].
Již výše jsme se zmínili, že CEA má větší efekt oproti konzervativní terapii u mužů, u pacientů s hemisferálním lehkým iktem, nebo TIA. Menší efekt je u žen, u pacientů s amaurosis fugax.
Indikace mimo AHA
V předchozích odstavcích jsme pouze poukázali na několik nejistot, které máme. Nezmínili jsme se vůbec o otázkách charakteru plátu, korelace vyšetřovacích metod a anatomického nálezu stupně stenózy, problematice velmi těsných stenóz a pseudookluzí [42,43]. Je patrné, že indikace nejsou tak jednoznačné a že AHA doporučení jsou pouze obecným rámcem, jakousi mapou či dopravními značkami. Chtěli jsme hlavně dokumentovat, že randomizované studie nejsou dogmata, že neodpovídají na všechny otázky a nejsou aplikovatelné na všechny nemocné. Vždy je nutné hodnotit i řadu individuálních faktorů. To platí pro indikaci výkonu jako takového i pro výběr typu výkonu (CEA v. CAS). A vždy je také zcela nezbytné znát potenciál a výsledky vlastního pracoviště. Teprve na základě souhrnu všech tří parametrů – literatura, individuální faktory nemocného a schopnosti vlastního pracoviště – lze indikovat zodpovědně a s nejmenší možnou mírou rizik.
Závěry, naše doporučení
Z výše uvedených literárních údajů i z našeho materiálu lze shrnout, že CAS je vhodný jako alternativní metoda v některých specifických situacích. Definitivní hodnocení můžeme udělat až po ukončení právě probíhajících studií (CREST, ICSS, ACST-2). Do té doby by se CAS neměl vyjma specifických situací indikovat mimo tyto randomizované studie a registry.
Současné indikace CEA: nemocní, na které se vztahují doporučení AHA. Léčebná modalita první volby.
Současné indikace CAS: obecně situace, kdy nelze použít doporučení AHA:
- restenóza (u myointimální hyperplazie i u nového aterosklerotického procesu)
- disekce (jiná nozologická jednotka)
- významná tandemová léze (obě stenózy lze řešit najednou)
- postiradiační stenóza a stenóza u nemocných po velkých operacích v oblasti krku (vzácné)
- nemocní s chirurgicky nepříznivou anatomickou situací (subjektivní hledisko).
Budoucnost
Současné požadavky medicíny, založené na důkazech velkých randomizovaných studií, jsou právě v případě CEA a CAS zcela nezastupitelné. Bez nich dnes nelze spolehlivě stanovit správný typ léčby a ani správné specifické indikace. Před ukončením probíhajících studií však lze určit jednu základní podmínku: Nemocní se stenózou karotidy by měli být zásadně ošetřováni na pracovištích s vysokým objemem nemocných (minimum 80–100 nemocných ročně) a pracoviště by mělo mít k dispozici obě metodiky, chirurgii i endovaskulární techniky. Úvahy, že tito nemocní by měli být ošetřováni kardiology, jaksi navíc ke koronárním tepnám, jsou zcela chybné, a je třeba je odmítnout. Tyto závěry můžeme publikovat a přednášet, ale naneštěstí nemáme žádnou možnost je zavést do jiné než vlastní praxe. Tuto možnost však mají zdravotní pojišťovny.
prof. MUDr. Vladimír Beneš, DrSc.
Neurochirurgická klinika 1. LF UK, IPVZ a ÚVN
U vojenské nemocnice 1200
169 02 Praha 6
e-mail: vladimir.benes@uvn.cz
Přijato k recenzi: 25. 6. 2008
Přijato do tisku: 25. 6. 2008
Recenzenti:
prof. MUDr. Antonín Krajina, CSc.
doc. MUDr. Dagmar Krajíčková, CSc.
MUDr. Vladimír Přibáň, Ph.D.
prof. MUDr. Vladimír Beneš, DrSc.
Od promoce v roce 1978 pracoval na neurochirurgickém oddělení Masarykovy nemocnice v Ústí nad Labem, od roku 1996 jako jeho přednosta. Od 1. 10. 1997 je přednostou neurochirurgické kliniky 1. LF UK a ÚVN v Praze. Od února 1998 pracuje jako vedoucí subkatedry neurochirurgie IPVZ. Je autorem těchto vědeckých prací: kandidátská práce (Experimentální poranění míchy, 1987), habilitační práce (Chirurgie mozkových aneuryzmat, 1993), doktorská práce (Arteriovenózní malformace mozku, 1998). V roce 2002 byl jmenován profesorem neurochirurgie (Chirurgické a intervenční léčení ischemie mozku). Prof. Beneš je členem České neurochirurgické společnosti, od roku 2002 je jejím předsedou. Dále je členem České neurologické společnosti, České spondylochirurgické společnosti, Evropské asociace neurochirurgických společností, působí v Training Committee a Administrative Council od roku 1994, resp. od roku 1999. V letech 2003–2007 pracoval jako viceprezident asociace, od 2007 je předseda Training Committee EANS. Je členem International Society for Pediatric Neurosurgery, European Society for Pediatric Neurosurgery, European Skull Base Society, od 2001 Executive Committee, od 2005 president elect a od 2007 prezident. Je člen American Association of Neurological Surgeons. Prof. Beneš pracuje v redakcích časopisů Česká a slovenská neurologie a neurochirurgie (od roku 2001), Bolest (od 1998) a Acta Neurochirurgica (od 2003), Neurosurgery (od 2008). Je autor 200 publikací, 300 abstrakt, řešitel devíti grantů IGA MZ (cena ministra 2005), spoluřešitel 13 grantů. Účastnil se šesti mezinárodních studií.
Vědomostní test
1. Stenóza krkavice v naprosté většině případů způsobuje klinickou symptomatologii:
- a) hemodynamickými změnami
- b) intermitentní okluzí krkavice dle polohy hlavy
- c) embolizací
- d) vždy je asymptomatická
2. Studie NASCET prokázala efekt operace symptomatické stenózy krkavice vyšší než:
- a) 75 %
- b) 30 %
- c) 60 %
- d) 50 %
3. Operace symptomatické stenózy krkavice (nad 50 %) po TIA je indikována:
- a) s odstupem minimálně šesti týdnů
- b) semiurgentně (nejlépe do týdne)
- c) vždy v den TIA
- d) nikdy
4. U starších nemocných se symptomatickou stenózou krkavice je dle současných literárních údajů spíše doporučován:
- a) karotický stenting
- b) endarterektomie (po zvážení komorbidit nemocného a odhadu životní prognózy pacienta)
- c) vždy endarterektomie
- d) PTA
5. U pacientů se symptomatickou stenózou krkavice a kontralaterální okluzí krkavice je dle současné literární evidence spíše doporučován:
- a) karotický stenting
- b) endarterektomie
- c) nikdy není indikována intervence
- d) PTA
6. Studie EVA-3S prokázala lepší výsledky:
- a) endarterektomie
- b) stentingu
- c) konzervativní terapie
- d) identické výsledky bez ohledu na typ intervence
7. Studie SAPPHIRE prokázala:
- a) lepší výsledky stentingu než endarterektomie
- b) že stenting není z krátkodobého hlediska (rok po výkonu) horší alternativou než endarterektomie u pacientů s těžkými komorbiditami
- c) lepší výsledky endarterektomie
- d) horší výsledky stentingu
8. Karotická endarterektomie je prováděna:
- a) jedině v lokální anestezii (v cervikálním bloku)
- b) jedině v lokální anestezii (po zavedení epidurálního katétru)
- c) jedině v celkové anestezii
- d) v typu anestezie dle zkušenosti daného pracoviště
9. Karotický stenting doporučují autoři textu indikovat (u klasické stenózy krkavice):
- a) u mladých pacientů
- b) u starých polymorbidních pacientů
- c) v rámci randomizovaných studií a mezinárodních registrů
- d) u asymptomatických stenóz krkavice
10. Karotický stenting doporučují autoři textu provádět v centrech:
- a) která disponují možností endarterektomie i stentingu
- b) na kardiologiích
- c) která nemají k dispozici možnost chirurgické léčby
- d) na každém radiologickém oddělení
11. Karotická endarterektomie je indikována (na pracovišti s M/M menší než 3 %) u pacienta (s životní prognózou větší než 5 let) s asymptomatickou stenózou krkavice větší než:
- a) 30 %
- b) 50 %
- c) 60 %
- d) 75 %
12. Studie SPACE:
- a) prokázala, že stenting dosahuje lepších výsledků než endarterekotomie
- b) měla za cíl prokázat, že stenting není horší než endarterektomie. Toto nebylo prokázáno
- c) prokázala jednoznačně lepší výsledky endarterektomie
- d) se karotickým stentingem nezabývala
13. Endarterektomie symptomatické stenózy krkavice je indikována pouze na pracovištích, kde 30denní M/M výkonu je menší než:
- a) 12 %
- b) 15 %
- c) 1 %
- d) 6 %
14. Endarterektomie asymptomatické stenózy krkavice je indikována pouze na pracovištích, kde 30denní M/M výkonu je menší než:
- a) 3 %
- b) 0,5 %
- c) 7 %
- d) 6 %
15. Pokud indikujeme výkon pro restenózu krkavice, poté doporučujeme:
- a) reoperaci bez použití štěpu
- b) reoperaci s použitím štěpu
- c) endovaskulární výkon
- d) vždy pouze medikamentózní terapii
16. Při selhání konzervativní terapie disekce krkavice autoři textu doporučují:
- a) stenting
- b) pouze PTA
- c) chirurgickou intervenci
- d) observaci
17. Dle autorů textu je vhodný následující postup stran antiagregační terapie u pacientů se symptomatickou stenózou krkavice:
- a) nevysazovat před endarterektomií, po endarterektomii ponechat trvale
- b) nevysazovat před endarterektomií, po endarterektomii ponechat šest měsíců
- c) vysadit před endarterektomií, po endarterektomii ponechat trvale
- d) vysadit před endarterektomií, po endarterektomii ponechat šest měsíců
18. Dle autorů textu je CEA primární léčebnou alternativou v této situaci:
- a) restenóza krkavice
- b) zdravý pacient se symptomatickou stenózou krkavice
- c) disekce krkavice
- b) postiradiační stenóza krkavice
19. Dle autorů textu je CAS primární léčebnou alternativou v této situaci:
- a) zdravý pacient s 80% asymptomatickou stenózou krkavice
- b) 75letý pacient (schopný podstoupit chirurgický výkon) se 70% symptomatickou stenózou krkavice
- c) významná tandemová stenóza krkavice
- d) 30% stenóza krkavice
20. CEA ve studii NASCET snížila dvouleté riziko iktu o:
- a) 1%
- b) 32%
- c) 13%
- d) 17%
správná je jedna nebo více odpovědí
Za správné vyřešení testu získá řešitel 5 kreditů ČLK.
Test můžete vyplnit na:
www.csnn.eu
Sources
1. North American Symptomatic Carotid Endarterectomy Trial. Methods, patient characteristics, and progress. Stroke 1991; 22(6): 711–720.
2. North American Symptomatic Carotid Endarterectomy Trial Collaborators. Beneficial effect of carotid endarterectomy in symptomatic patients with high-grade carotid stenosis. N Engl J Med 1991; 325(7): 445–453.
3. Gasecki AP, Eliasziw M, Ferguson GG, Hachinski V, Barnett HJ, North American Symptomatic Carotid Endarterectomy Trial (NASCET) Group. Long-term prognosis and effect of endarterectomy in patients with symptomatic severe carotid stenosis and contralateral carotid stenosis or occlusion: results from NASCET. J Neurosurg 1995; 83(5): 778–782.
4. Barnett HJ, Taylor DW, Eliasziw M, Fox AJ, Ferguson GG, Haynes RB et al (North American Symptomatic Carotid Endarterectomy Trial Collaborators). Benefit of carotid endarterectomy in patients with symptomatic moderate or severe stenosis. N Engl J Med 1998; 339(20): 1415–1425.
5. European Carotid Surgery Trialists‘ Collaborative Group. European Carotid Surgery Trial: interim results for symptomatic patients with severe (70–99%) or mild (0–29%) carotid stenosis. Lancet 1991; 337(8752): 1235–1243.
6. Warlow CP. Symptomatic patients: the European Carotid Surgery Trial (ECST). J Mal Vasc 1993; 18(3): 198–201.
7. European Carotid Surgery Trialists‘ Collaborative Group. Endarterectomy for moderate symptomatic carotid stenosis: interim results from the MRC European Carotid Surgery Trial. Lancet 1996; 347(9075): 1591–1593.
8. European Carotid Surgery Trialists‘ Collaborative Group. Randomised trial of endarterectomy for recently symptomatic carotid stenosis: final results of the MRC European Carotid Surgery Trial (ECST). Lancet 1998; 351(9113): 1379–1387.
9. Executive Committee for the Asymptomatic Carotid Atherosclerosis Study. Endarterectomy for asymptomatic carotid stenosis. JAMA 1995; 273(18): 1421–1428.
10. Halliday A, Mansfield A, Marro J, Peto C, Peto R, Potter J et al (Asymptomatic Carotid Surgery Trial (ACST) Collaborative Group). Prevention of disabling and fatal strokes by successful carotid endarterectomy in patients without recent neurological symptoms: randomised controlled trial. Lancet 2004; 363(9420): 1491–1502.
11. Moore WS, Mohr JP, Najafi H, Robertson JT, Stoney RJ, Toole JF. Carotid endarterectomy: practice guidelines. Report of the Ad Hoc Committee to the Joint Council of the Society for Vascular Surgery and the North American Chapter of the International Society for Cardiovascular Surgery. J Vasc Surg 1992; 15(3): 469–479.
12. Moore WS, Barnett HJ, Beebe HG, Bernstein EF, Brener BJ, Brott T et al. Guidelines for carotid endarterectomy: a multidisciplinary consensus statement from the Ad Hoc Committee, American Heart Association. Circulation 1995; 91(2): 566–579.
13. Biller J, Feinberg WM, Castaldo JE, Whittemore AD, Harbaugh RE, Dempsey RJ et al. Guidelines for carotid endarterectomy: a statement for healthcare professionals from a Special Writing Group of the Stroke Council, American Heart Association. Circulation 1998; 97(5): 501–509.
14. Albers GW, Hart RG, Lutsep HL, Newell DW, Sacco RL. AHA Scientific Statement. Supplement to the guidelines for the management of transient ischemic attacks: A statement from Ad Hoc Committee on Guidelines for the Management of Transient Ischemic Attacks, Stroke Council, American Heart Association. Stroke 1999; 30(11): 2502–2511.
15. Sacco RL, Adams R, Albers G, Alberts MJ, Benavente O, Furie K et al. Guidelines for prevention of stroke in patients with ischemic stroke or transient ischemic attack: a statement for healthcare professionals from the American Heart Association/American Stroke Association Council on Stroke: co-sponsored by the Council on Cardiovascular Radiology and Intervention: the American Academy of Neurology affirms the value of this guideline. Stroke 2006; 37(2): 577–617.
16. Rothwell PM, Gutnikov SA, Warlow CP; European Carotid Surgery Trialist‘s Collaboration. Reanalysis of the final results of the European Carotid Surgery Trial. Stroke 2003; 34(2): 514–523.
17. Rothwell PM, Eliasziw M, Gutnikov SA, Fox AJ, Taylor DW, Mayberg MR et al. Analysis of pooled data from the randomised controlled trials of endarterectomy for symptomatic carotid stenosis. Lancet 2003; 361(9352): 107–116.
18. Alamowitch S, Eliasziw M, Barnett HJ; North American Symptomatic Carotid Endarterectomy Trial (NASCET); ASA Trial Group; Carotid Endarterectomy (ACE) Trial Group. The risk and benefit of endarterectomy in women with symptomatic internal carotid artery disease. Stroke 2005; 36(1): 27–31.
19. Mayberg MR, Wilson E, Yatsu F, Weiss DG, Messina L, Hershey LA et al (Veterans Affairs Cooperative Studies Program 309 Trialist Group). Carotid endarterectomy and prevention of cerebral ischaemia in symptomtic carotid stenosis. JAMA 1991; 266(23): 3289–3294.
20. Hobson RW 2nd, Weiss DG, Fields WS, Goldstone J, Moore WS, Towne JB et al. Efficacy of carotid endarterectomy for asymptomatic carotid stenosis. The Veterans Affairs Cooperative Study Group. N Engl J Med 1993; 328(4): 221–227.
21. Mayo Asymptomatic Carotid Endarterectomy Study Group: Results of a randomized controlled trial of carotid endarterectomy for asymptomatic carotid stenosis. Mayo Clin Proc 1992; 67(6): 513–518.
22. Bond R, Rerkasem K, Rothwell PM. Systematic review of the risks of carotid endarterectomy in relation to the clinical indication for and timing of surgery. Stroke 2003; 34(9): 2290–2301.
23. Rothwell PM, Warlow CP. Timing of TIAs preceding stroke: time window for prevention is very short. Neurology 2005; 64(5): 817–820.
24. Rothwell PM, Eliasziw M, Gutnikov SA, Warlow CP, Barnett HJ (Carotid Endarterectomy Trialists Collaboration). Endarterectomy for symptomatic carotid stenosis in relation to clinical subgroups and timing of surgery. Lancet 2004; 363(9413): 915–924.
25. Alamowitch S, Eliasziw M, Algra A, Meldrum H, Barnett HJ (North American Symptomatic Carotid Endarterectomy Trial (NASCET) Group). Risk, causes, and prevention of ischaemic stroke in elderly patients with symptomatic internal–carotid–artery stenosis. Lancet 2001; 357(9413): 1154–1160.
26. White CJ, Iyer SS, Hopkins LN, Katzen BT, Russell ME (BEACH Trial Investigators). Carotid stenting with distal protection in high surgical risk patients: the BEACH trial 30 day results. Catheter Cardiovasc Interv 2006; 67(4): 503–512.
27. Gray WA, Hopkins LN, Yadav S, Davis T, Wholey M, Atkinson R et al (ARCHeR Trial Collaborators). Protected carotid stenting in high-surgical-risk patients: the ARCHeR results. J Vasc Surg 2006; 44(2): 258–268.
28. Fairman R, Gray WA, Scicli AP, Wilburn O, Verta P, Atkinson R et al (CAPTURE Trial Collaborators). The CAPTURE registry: analysis of strokes resulting from carotid artery stenting in the post approval setting: timing, location, severity, and type. Ann Surg 2007; 246(4): 551–556.
29. Katzen BT, Criado FJ, Ramee SR, Massop DW, Hopkins LN, Donohoe D et al (CASES-PMS Investigators). Carotid artery stenting with emboli protection surveillance study: thirty-day results of the CASES-PMS study. Catheter Cardiovasc Interv 2007; 70(2): 316–323.
30. CaRESS Steering Committee. Carotid Revascularization Using Endarterectomy or Stenting Systems (CaRESS) phase I clinical trial: 1-year results. J Vasc Surg 2005; 42(2): 213–219.
31. Naylor AR, Bolia A, Abbott RJ, Pye IF, Smith J, Lennard N et al. Randomized study of carotid angioplasty and stenting versus carotid endarterectomy: a stopped trial. J Vasc Surg 1998; 28(2): 326–334.
32. Alberts MJ. Results of a multicenter prospective randomized trial of carotid artery stenting vs. carotid endarterectomy. Stroke 2001; 32(6): 325.
33. Brooks WH, McClure RR, Jones MR, Coleman TC, Breathitt L. Carotid angioplasty and stenting versus carotid endarterectomy: randomized trial in a community hospital. J Am Coll Cardiol 2001; 38(6): 1589–1595.
34. Brooks WH, McClure RR, Jones MR, Coleman TL, Breathitt L. Carotid angioplasty and stenting versus carotid endarterectomy for treatment of asymptomatic carotid stenosis: a randomized trial in a community hospital. Neurosurgery 2004; 54(2): 318–324.
35. Endovascular versus surgical treatment in patients with carotid stenosis in the Carotid and Vertebral Artery Transluminal Angioplasty Study (CAVATAS): a randomised trial. Lancet 2001; 357(9270): 1729–1737.
36. Yadav JS, Wholey MH, Kuntz RE, Fayad P, Katzen BT, Mishkel GJ et al (Stenting and Angioplasty with Protection in Patients at High Risk for Endarterectomy Investigators). Protected carotid-artery stenting versus endarterectomy in high-risk patients. N Engl J Med 2004; 351(15): 1493–1501.
37. Ringleb PA, Allenberg J, Brückmann H, Eckstein HH, Fraedrich G, Hartmann M et al (SPACE Collaborative Group). 30 day results from the SPACE trial of stent-protected angioplasty versus carotid endarterectomy in symptomatic patients: a randomised non-inferiority trial. Lancet 2006; 368(9543): 1239–1247.
38. Mas JL, Chatellier G, Beyssen B, Branchereau A, Moulin T, Becquemin JP et al (EVA-3S Investigators). Endarterectomy versus stenting in patients with symptomatic severe carotid stenosis. N Engl J Med 2006; 355(16): 1660–1671.
39. Kastrup A, Gröschel K. Carotid endarterectomy versus carotid stenting: an updated review of randomized trials and subgroup analyses. Acta Chir Belg 2007; 107(2): 119–128.
40. Mozes G. High-risk carotid endarterectomy. Semin Vasc Surg 2005; 18(2): 61–68.
41. Luebke T, Aleksic M, Brunkwall J. Meta-analysis of randomized trials comparing carotid endarterectomy and endovascular treatment. Eur J Vasc Endovasc Surg 2007; 34(4): 470–479.
42. Benes V, Netuka D, Mandys V, Vrabec M, Mohapl M, Kramár F et al. Comparison between degree of carotid stenosis observed at angiography and in histological examination. Acta Neurochir (Wien) 2004; 146(7): 671–678.
43. Netuka D, Benes V, Mandys V, Hlásenská J, Burkert J, Benes V jr. Accuracy of angiography and Doppler ultrasonography in the detection of carotid stenosis: a histopathological study of 123 cases. Acta Neurochir (Wien) 2006; 148(5): 511–520.
44. The International Carotid Stenting Study Website [online]. Last revision 24th April 2008. Dostupné z: <http://www.ion.ucl.ac.uk/cavatas_icss/index2.htm>.
45. Carotid Revascularization Endarterectomy Versus Stenting Trial (CREST) [online]. Last revision 9th July 2008. Dostupné z: <http://clinicaltrials.gov/ct/show/NCT00004732>.
46. Asymptomatic Carotid Surgery Trial-2 (ACST) [online]. Dostupné z: <http://www.acst.org.uk/>.
Labels
Paediatric neurology Neurosurgery Neurology
Article was published inCzech and Slovak Neurology and Neurosurgery

2008 Issue 4-
All articles in this issue
- Results of Surgical Tre atment of Ne uromuscular Deformiti es of the Spine
- Tuberous Sclerosis: Optimisati on of its DNA Di agnosing Procedure
- Cereberal Mutism after Resecti on of a Medulloblastoma – a Case Report
- Drug- Induced Systemic Lupus Erythematodes in Interferon Beta-1b Therapy – a Case Report
- Recommendati ons for the Di agnosis and Management of Alzheimer’s Dise ase and Other Disorders Associ ated with Dementi a
- Carotid Artery Stenosis – Endarterectomy or Stenting?
- Results of a Comparison between Carotid Endarterectomy and Carotid Stenting – Single Institution Experience
- Pathophysiology of Compressive Radiculopathy
- The Timing of Carotid Endarterectomy
- Static Computed Posturography (SCPG) and its Contribution to Quantification of Postural Equilibrium
- Botulinum Toxin in the Treatment of Detrusor Overactivity in Woman Patients with Multiple Sclerosis
- The Incidence of Epileptic Seizures and/ or Epileptiform EEG Abnormaliti es in Children with Childhood and Atypical Autism
- Dexmedetomidine- Ketamine- Midazolam Combinati on for Sedati on in Endovascular Tre atment of Cerebral Arteri o- Veno us Malformati ons and Carotid Artery Stenosis
- The Process of Adaptati on of the Balance System after Vestibular Schwannoma Surgery
- Complicati ons of Tre atment of Severe Spasticity with Implantable Pump Systems
- An Analysis of a Set of Patients with Craniocerebral Injury Treated at the Pediatric Medicine Centre of the Teaching Hospital in Brno from 2000 to 2007
- Czech and Slovak Neurology and Neurosurgery
- Journal archive
- Current issue
- Online only
- About the journal
Most read in this issue- Carotid Artery Stenosis – Endarterectomy or Stenting?
- The Incidence of Epileptic Seizures and/ or Epileptiform EEG Abnormaliti es in Children with Childhood and Atypical Autism
- Drug- Induced Systemic Lupus Erythematodes in Interferon Beta-1b Therapy – a Case Report
- The Timing of Carotid Endarterectomy
Login#ADS_BOTTOM_SCRIPTS#Forgotten passwordEnter the email address that you registered with. We will send you instructions on how to set a new password.
- Career


