-
Medical journals
- Career
Účinnost sonotrombotripse a sonotrombolýzy v akceleraci rekanalizace střední mozkové tepny u pacientů s akutní mozkovu ischemií
Authors: D. Školoudík 1,2; M. Bar 2; O. Škoda 3; D. Václavík 4; P. Hradílek 1; K. Langová 5; R. Herzig 2; P. Kaňovský 2
Authors‘ workplace: Neurologická klinika FNsP Ostrava-Poruba, Ostrava 1; Iktové centrum, Neurologická klinika LF UP a FN, Olomouc 2; Neurologické oddělení Nemocnice Pelhřimov 3; Neurologické oddělení Vítkovické nemocnice, Ostrava 4; Oddělení biometrie, Ústav lékařské biofyziky LF UP, Olomouc 5
Published in: Cesk Slov Neurol N 2007; 70/103(3): 248-252
Category: Original Paper
Výsledky studie byly prezentovány formou přednášky na 38th Danube Symposium, Brno, 7. 4. 2006, 32. Česko-slovenském cerebrovaskulárním sympoziu ve Zlíně 17. 6. 2006 a formou posteru na 11th Meeting of ESNCH SRN 15. 5. 2006 v Düsseldorfu, SRN.
Overview
Úvod:
Recentní studie prokázaly pravděpodobný efekt transkraniálního ultrazvukového monitoringu na akceleraci rekanalizace intrakraniálních tepen, a to jak u pacientů léčených systémovou trombolýzou (sonotrombolýza, S-lýza) tak v kombinaci s antiagregační terapií (sonotrombotripse, S-tripse). Cílem bylo srovnat účinnost S-lýzy a S-tripse na rekanalizaci okluze a. cerebri media (ACM) u pacientů s akutní mozkovou ischemií.Pacienti a metody:
Do studie byli zařazeni pacienti a akutní okluzí ACM (M1 nebo M2). S-lýzou bylo léčeno do 3 hodin 24 pacientů (5 mužů, věk 58,7±12,9 let, medián NIHSS 17±5,1, 18 okluzí M1) a S-tripsí do 12 hodin od začátku příznaků 62 pacientů (41 mužů, věk 62,9±12,5 let, medián NIHSS 14,0±5,7, 44 okluzí M1). Diagnostická transkraniální duplexní sonografie (TCCS) byla provedena při přijetí, 1 hodinu od začátku terapie, 6 a 24 hodin od začátku příznaků s hodnocením okluze tepny a její následné parciální nebo kompletní rekanalizace.Výsledky:
Ve skupině S-lýzy versus S-tripse byly zjištěny: kompletní/parciální rekanalizace 1 hodinu od zahájení terapie v 42 %/25 % vs 26 %/ 56% (p>0,05); kompletní rekanalizace za 6/24 hodin od začátku příznaků v 61 %/71 % vs 52 %/65 % (p>0,05); symptomatické intracerebrální krvácení u 1(4 %) vs 1(2 %) pacienta; soběstačnost po 90 dnech (mRS 0-2) u 50 % vs 44 % pacientů (p>0,05). Rychlost rekanalizace nebyla závislá na věku, pohlaví, času do začátku terapie ani použití echokontrastu.Závěr:
Pacienti léčeni kombinací systémové trombolýzy a transkraniálního ultrazvukového monitoringu dosáhli nesignifikantně vyššího počtu plných rekanalizací mozkové tepny v prvních 24 hodinách než pacienti léčeni pouze sonotrombotripsí.Klíčová slova:
transkraniální ultrazvuk, trombolýza, cévní mozková příhoda, rekanalizace, a. cerebri mediaÚvod
V současnosti je nejúčinnější terapií pro pacienty s akutní ischemickou cévní mozkovu příhodou (iCMP) časná rekanalizační terapie [1]. V posledních letech je již standardně užívána systémová intravenózní trombolýza (IVT) s použitím rtPA v dávce 0,9 mg/kg [1-3]. Vzhledem k tomu, že účinnost IVT je relativně nízká, a to především při okluzi karotické nebo kmene střední mozkové tepny (a. cerebri media - ACM), jsou experimentálně zkoušeny nejen intraarteriální aplikace trombolytik, ale i nová trombolytika a mechanické metody rekanalizace [1,3-11].
Menší studie in vitro a in vivo prokázaly urychlení rozpadu trombu při použití ultrazvukového vlnění o frekvencích 20 kHz až 2 MHz v kombinaci s trombolytiky [12-15]. Od roku 2000 je experimentálně studováno urychlení rekanalizace uzávěru ACM pomocí monitoringu okludované tepny transkraniální sondou [16,17].
Cílem studie bylo srovnat účinnost ultrazvukového monitoringu v kombinaci s aplikací IVT (sonotrombolýza, S-lýza) s ultrazvukovým monitoringem jen v kombinaci se standardní antiagregační terapií (sonotrombotripse, S-tripse) na rychlost rekanalizace okluze ACM u pacientů s akutní mozkovou ischemií.
Pacienti a metodika
Soubor pacientů a provedená vyšetření
V období od ledna 2002 do května 2005 bylo do studie zařazeno ve 3 centrech v České republice celkem 86 pacientů s akutní iCMP do 12 hodin od rozvoje příznaků, u nichž byla pomocí transkraniální duplexní sonografie (TCCS) detekovaná okluze kmene nebo M2-větve ACM s jasným neurologickým deficitem (minimálně 4 body v NIHSS škále). U všech pacientů bylo provedeno vyšetření mozku výpočetní tomografií (CT) s vyloučením intrakraniální hemoragie či necévní příčiny neurologické symptomatiky.
Pacienti, kteří splnili SITS-MOST kritéria, byli léčeni pomocí IVT [18]. Pacientům indikovaným k časné antikoagulační terapii dle doporučení EUSI byla v prvních 24 hodinách nasazena plná antikoagulační terapie [19]. Při vstupním neurologickém vyšetření byla stanovena tíže neurologického deficitu s využitím NIHSS škály. Kontrolní CT mozku byla u pacientů léčených IVT standardně provedena za 22-36 hodin od zahájení IVT, u ostatních pacientů mezi 3. a 10. dnem. U všech pacientů byla standardně provedena následující vyšetření: krevní obraz, biochemie, koagulace, EKG, RTG srdce a plic, interní vyšetření; individuálně byla doplněna další vyšetření (např. echokardiografické vyčetření včetně jícnové echokardiografie či vyšetření trombofilních stavů) k určení etiopatogenetické příčiny iCMP. Byly zaznamenány všechny závažné nežádoucí účinky v průběhu prvních 7 dní se zhoršením neurologického deficitu o minimálně 4 body v NIHSS škále.
Kontrolní neurologické vyšetření bylo provedeno za 7 a 90 dní od rozvoje příznaků se stanovením tíže neurologického deficitu pomocí NIHSS škály 7. den a soběstačnosti pomocí modifikované Rankinovy škály (mRS) 90 dní od rozvoje příznaků.
Provedení ultrazvukového monitoringu
U všech pacientů byl provedeno TCCS vyšetření s detekcí místa okluze v barevném nebo energetickém modu. Do místa okluze byl umístěn 10mm vzorkovací objem s kontrolou polohy pomocí zachytitelných „kliknutí“" v dopplerovském modu. Echokontrast (Levovist nebo Optison) byl použit intravenózně v bolusovém podání ke zlepšení kvality zobrazení intrakraniálních tepen s opakováním bolusového podání po minimálně 20 minutách.
Místo okluze tepny bylo monitorováno v dopplerovském modu po dobu do dosažení rekanalizace tepny nebo maximálně po dobu 45 minut. Každých 5 minut byl hodnocen dopplerovský signál a nález v barevném nebo energetickém módu k detekci rekanalizace tepny. Při monitorování bylo použito maximálni diagnostické energie (mechanický index MI = 1,3).
Celkem byly použity 3 ultrazvukové přístroje ve třech centrech - Esaote AU4 (Esaote, Genova, Italy) se sondou 2,25 MHz, Toshiba CoreVision Pro (Toshiba, Tokio, Japan) s 2,5 MHz sondou a ATL HDI 3000 (ATL, Bothel, U.S.A.) se sondou 2-4 MHz.
Detekce rekanalizace tepny
Kontrolní TCCS vyšetření bylo provedeno 1 hodinu od začátku ultrazvukového monitoringu a 24 hodin od začátku terapie. Pacientům, u kterých byla zahájena terapie do 6 hod od rozvoje příznaků, bylo provedeno TCCS vyšetření také 6 hodin od rozvoje příznaků. Rekanalizace tepny byla hodnocena podle TIBI kritérií [20].
Statistické hodnocení
Statisticky byly srovnány počet rekanalizovaných tepen 1 hodinu od začátku terapie, 24 ev 6 hodin od rozvoje příznaků a výskyt závažných nežádoucích účinků.
Při výpočtech byly použity Studentův t-test, Mann-Whitneyův test, Kruskalův-Willisův test, ANOVA a test mnohonásobného srovnávání. Statistické výpočty byly provedeny pomocí programu SPSS verze 8.0 (SPSS Inc., Chicago, U.S.A.).
Výsledky
V období 41 měsíců bylo do studie zařazeno celkem 86 pacientů (46 mužů, 40 žen, ve věku 24 - 81, průměrně 60,1 ± 12,2 let). 24 pacientů bylo léčeno S-lýzou a 64 pacientů S-tripsí. Základní charakteristiky obou skupin jsou uvedeny v tab.1 . Signifikantní rozdíl mezi oběma skupinama byl kromě zastoupení mužů a žen také v čase do zahájení ultrazvukového monitoringu, což bylo dáno nutností zahájení terapie ve skupině S-lýzy do 3 hodin od rozvoje příznaků oproti 12 hodinám ve skupině S-tripse.
Table 1. Základní charakteristiky pacientů zařazených do skupiny S-lýzy a S-tripse. 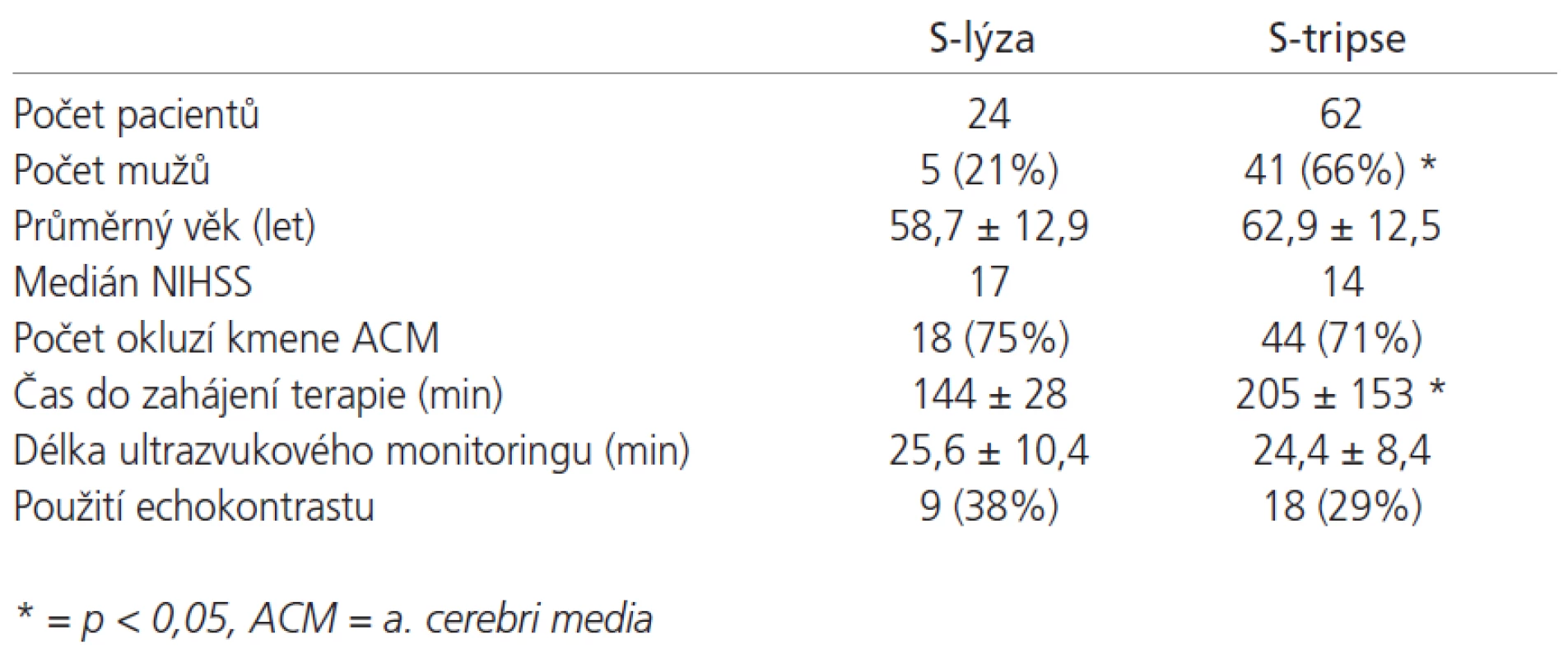
Výsledky rekanalizace střední mozkové tepny v obou skupinách jsou uvedeny v tab. 2. Stav rekanalizace 6 hodin od rozvoje příznaků ve skupině S-tripse byl hodnocen jen u pacientů se zahájením S-tripse do 5 hodin od rozvoje příznaků. Rozdíly v počtu plně a částečně rekanalizovaných tepen při jednotlivých časových kontrolách nebyly statisticky signifikantní (p > 0,05). Rekanalizace nebyla závislá na věku, pohlaví, času do zahájení terapie ani použití echokontrastní látky (p > 0,05, ANOVA test).
Table 2. Počet dosažených kompletních a částečných rekanalizací u pacientů léčených S-lýzou a S-tripsí. 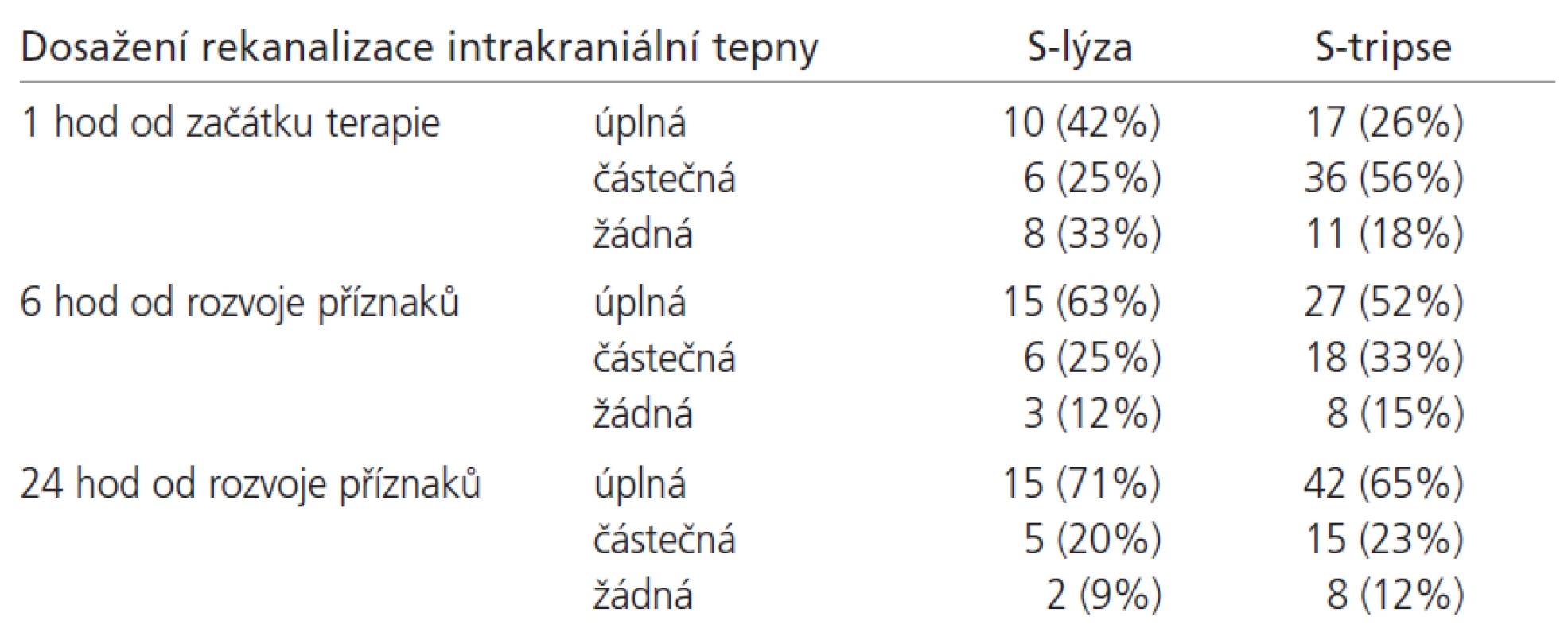
Graf 1 zobrazuje zlepšení neurologického deficitu v prvních 7 dnech. Soběstačnosti (mRS 0-2) po 90 dnech dosáhlo 50 % pacientů ve skupině S-lýzy a 44 % pacientů ve skupině S-tripse (p > 0,05).
Graph 1. Úprava neurologického deficitu (medián NIHSS) v prvních 7 dnech u pacientů léčených S-lýzou a S-tripsí. 
Symptomatické intracerebrální krvácení bylo detekováno u 1 pacienta (4 %) ve skupině S-lýzy a 1 pacienta (2 %) ve skupině S-tripse, symptomatický edém mozku u 1 pacienta (4 %) ve skupině S-lýzy a 2 pacientů (4 %) ve skupině S-tripse. Nebyly zaznamenány žádné jiné nežádoucí účinky terapie.
Diskuse
Výsledky studie Clotbust jako první prokázaly účinnost transkraniálního dopplerovského monitoringu na urychlení rekanalizace tepny u pacientů léčených IVT [17]. Výsledky první české studie pak ukázaly na pravděpodobný efekt transkraniálního ultrazvukového monitoringu také u pacientů, kteří nesplnili kritéria aplikace IVT [21]. Pozdější výsledky Thrombotripsy study, která byla studií případů a kontrol s výběrem kontrol z databáze observační studie NAIS, ukázaly na velmi podobnou účinnost transkraniálního ultrazvukového monitoringu v kombinaci s IVT nebo jen antiagregační terapií [22]. Podobné výsledky byly následně publikovány také Eggersem et al [23]. Výsledky naší prospektivní nerandomizované studie prokázaly vysoký počet rekanalizací ACM již 1 hodinu od začátku transkraniálního ultrazvukového monitoringu, přičemž při všech 3 kontrolách byl nesignifikantně vyšší počet úplných rekanalizací ve skupině S-lýzy, zato ve skupině S-tripse byl vyšší počet parciálních rekanalizací . Ačkoli pro relativně malý počet pacientů ve studii výsledky nedosáhly hladiny statistické významnosti, tendence k vyššímu počtu plných rekanalizací při kombinaci transkraniálního ultrazvukového monitoringu s podáním IVT odpovídá výsledkům dřívějších studií s IVT, které prokázaly vyšší účinnost trombolýzy u pacientů s okluzí větví ACM ve srovnání s pacienty s okluzí kmene ACM anebo vnitřní karotidy [1,24]. Z těchto výsledků lze usuzovat, že transkraniální ultrazvukový monitoring může být účinnější v rekanalizaci uzávěrů větších mozkových tepen (především kmene ACM). Kombinace s IVT pak vede k urychlení rekanalizace také drobných větví. Pokud se použije ultrazvukový monitoring samostatně, dojde pravděpodobně častěji jen k parciální rekanalizaci s přetrvávájící okluzí drobných větví.
Výsledky studie neprokázaly, že S-lýza S-tripse jsou stejně účinné metody terapie pro téměř dvojnásobný počet kompletních rekanalizací 1 hodinu od začátku terapie při kombinaci IVT s transkraniálním dopplerovským monitoringem. Tento výsledek ukazuje na pravděpodobně rychlejší kompletní rekanalizaci mozkové tepny. Vzhledem k tomu, že obě sledované skupiny nebyly shodné ve vstupní charakteristice, výsledný počet rekanalizací 6 a 24 hodin od začátku příznaků byl téměř shodný v obou skupinách a ve skupině S-lýzy bylo zaznamenáno dvojnásobné riziko SICH, lze srovnání obou způsobů terapie provést pouze pomocí nové randomizované prospektivní studie.
Z výsledků klinického zlepšení a dosažení soběstačnosti po 90 dnech v obou sledovaných terapeutických skupinách nelze vyvozovat žádné závěry, protože se obě terapeutické skupiny významně lišily dobou do zahájení terapie, což je jedním z důležitých faktorů, který ovlivňuje efektivitu terapie a pravděpodobnost úpravy neurologického deficitu [25].
Na rozdíl od hodnocení účinku terapie na klinický stav pacienta jsme v naší studii nepozorovali vliv časového faktoru na pravděpodobnost a rychlost dosažení rekanalizace tepny. Také nebyl pozorován vliv věku, pohlaví ani použití echokontrastu. Ačkoli menší studie in vivo ukazují na pravděpodobné zvýšení efektu transkraniálního ultrazvukového monitoringu při podání echokontrastní látky, první studie, která hodnotí tento přídatný efekt ultrazvukového vlnění, byly teprve zahájeny [26,27]. Navíc se předpokládá, že efekt nastává jen při jejím kontinuálním podání. V naší studii jsme všem pacientů podali echokontrastní látku jen v bolusově z diagnostických a nikoliv terapeutických důvodů.
Hlavním omezením naší studie však je volba mezi zařazením do skupiny S-lýzy či S-tripse jen podle splnění kritérií SITS-MOST [18] a ne standardní randomizace. Mezi oběma skupinami tak může být signifikantní rozdíl v dalších, námi nesledovaných faktorech, které mohly významně ovlivnit výsledky. Přesto jsou velmi vysoké počty dosažených rekanalizací ACM v obou skupinách pozitivním impulzem pro uspořádání dalších randomizovaných studií, které by rozdíl mezi S-lýzou a S-tripsí dále upřesnily. Naše práce je navíc přes všechna svá omezení celosvětově první, která přímo srovnává účinek transkraniálního ultrazvukového monitoringu na rekanalizaci mozkové tepny mezi pacienty léčenými IVT a pacienty léčenými jen antiagregační terapií.
Závěr
Transkraniální ultrazvukový monitoring se zdá být bezpečnou metodou, která dle výsledků pilotních studií urychluje rekanalizaci mozkové tepny v prvních 12 hodinách od rozvoje příznaků. U pacientů léčených kombinací IVT a transkraniálního ultrazvukového monitoringu bylo dosaženo nesignifikantně vyššího počtu plných rekanalizací mozkové tepny v prvních 24 hodinách ve srovnání s pacienty léčenýmii jen sonotrombotripsí. K potvrzení tohoto přídatného efektu ultrazvukového vlnění bude nutné provedení randomizovaných studií.
Přijato k recenzi:27. 9. 2006
Přijato do tisku: 30. 12. 2006
Adresa ke korespondenci:
MUDr. David Školoudík
S. K. Neumanna 609/8
702 00 Ostrava 1
e-mail: skoloudik@hotmail.com
Sources
1. Molina CA, Saver JL. Extending Reperfusion Therapy for Acute Ischemic Stroke. Emerging Pharmacological, Mechanical, and Imaging Strategie. Stroke 2005; 36 : 2311-20.
2. The National Institute of Neurological Disorders and Stroke rt-PA Stroke Study Group. Tissue Plasminogen Activator for Acute Ischemic Stroke. N Engl J Med 1995; 333 : 1581-7.
3. Mikulík R. Historie, současnost a budoucnost trombolytické terapie mozkového infarktu Česk Slov Neurol N 2002; 98 : 223–31.
4. Rha J-H, Saver JL. Recanalization as a surrogate outcome measure in thrombolytic clinical trials: a meta-analysis. Stroke 2003; 34 : 317 [abstract]..
5. Del Zoppo GJ, Higashida RT, Furlan AJ, Pessin MS, Rowley HA, Gent M. PROACT: a phase II randomized trial of recombinant pro-urokinase by direct arterial delivery in acute middle cerebral artery stroke. Stroke 1998; 29 : 4–11.
6. Ng PP, Higashida RT, Cullen SP, Malek R, Dowd CF, Halbach VV. Intraarterial Thrombolysis Trials in Acute Ischemic Stroke. J Vasc Int Radiol. 2004; 15 (Suppl. 1): 77-85.
7. Mahon BR, Nesbit GM, Barnwell SL, Clark W, Marotta TR, Weill A et al. North American clinical experience with the EKOS MicroLysUS infusion catheter for the treatment of embolic stroke. AJNR Am J Neuroradiol 2003; 24 : 534 –8.
8. Nesbit GM, Luh G, Tien R, Barnwell SL. New and future endovascular treatment strategies for acute ischemic stroke. J Vasc Interv Radiol 2004; 15 (Suppl. 1): 103–10.
9. Qureshi AI, Siddiqui AM, Suri MF, Kim SH, Ali Z, Yahia AM et al. Aggressive mechanical clot disruption and low-dose intra-arterial thirdgeneration thrombolytic agent for ischemic stroke: a prospective study. Neurosurgery 2002; 51 : 1319 –27.
10. Ringer AJ, Qureshi AI, Fessler RD, Guterman LR, Hopkins LN. Angioplasty of intracranial occlusion resistant to thrombolysis in acute ischemic stroke. Neurosurgery 2001; 48 : 1282–8.
11. Starkman S, MERCI Investigators. Results of the combined MERCI I-II (Mechanical Embolus Removal in Cerebral Ischemia) Trials. Stroke 2004; 35 : 240.
12. Daffertshofer M, Fatar M. Therapeutic ultrasound in ischemic stroke treatment: experimental evidence. Eur J Ultrasound 2002; 16 : 121-30.
13. Francis CW, Onundarson PT, Carstensen EL, Blinc A, Meltzer RS, Schwarz K et al. Enhancement of fibrinolysis in vitro by ultrasound. J Clin Invest 1992; 90 : 2063-68.
14. Ishibashi T, Akiyama M, Onoue H, Abe T, Furuhata H. Can transcranial ultrasonication increase recanalization flow with tissue plasminogen activator. Stroke 2002; 33 : 917-25.
15. Francis CW, Behrens S. Ultrasonic thrombolysis. In: Hennerici M, Meairs S. Cerebrovascular ultrasound. Cambridge University Press 2001 : 404-15.
16. Alexandrov AV, Demchuk AM, Felberg RA, Christou I, Barber PA, Burgin WS et al. High rate of complete recanalisation and dramatic clinical recovery during tPA infusion when continuously monitored with 2-MHz transcranial Doppler monitoring. Stroke 2000; 31 : 610-4.
17. Alexandrov AV, Demchuk AM, Burgin WS, Robinson DJ, Grotta JC. Ultrasound-enhanced thrombolysis for acute ischemic stroke: phase I. Findings of the CLOTBUST trial. J Neuroimaging 2004; 14 : 113–7.
18. Toni D, Lorenzano S, Puca E, Prencipe M. The SITS-MOST registry. Neurol Sci 2006; 27 (Suppl 3): 260-2.
19. The European Stroke Initiative Executive Committee and the EUSI Writing Committee. European Stroke Initiative recommendations for stroke management - update 2003. Cerebrovasc Dis 2003; 16 : 311-37.
20. Demchuk, AM, Burgin, SW, Christou, I., Felberg RA, Barber PA, Hill MD et al. Thrombolysis in brain ischemia (TIBI) transcranial Doppler flow grades predict clinical severity, early recovery, and mortality in patients treated with intravenous tissue plasminogen activator. Stroke 2001; 32 : 89–93.
21. Školoudík D, Bar M, Škoda O, Václavík D, Hradílek P, Šimíčková K. Bezpečnost a účinnost trombotripse – akcelerace trombolýzy pomocí ultrazvuku. Česk Slov Neurol N 2004 : 99; 157–61.
22. Školoudík D, Bar M, Škoda O, Václavík D. Thrombotripsy study – case control study. Cerebrovasc Dis 2005: Suppl. 1 : 14.
23. Eggers J, Koch B, Meyer K, Konig I, Seidel G. Effect of ultrasound on thrombolysis of middle cerebral artery occlusion. Ann Neurol 2003; 53 : 797–800.
24. Rubiera M, Ribo M, Delgado-Mederos R, Santamarina E, Delgado P, Montaner J et al. Tandem internal carotid artery/middle cerebral artery occlusion: an independent predictor of poor outcome after systemic thrombolysis. Stroke 2006; 37 : 2301-5.
25. The NINDS t-PA Stroke Study Group. Generalized Efficacy of t-PA for Acute Stroke: Subgroup Analysis of the NINDS t-PA Stroke Trial. Stroke 1997; 28 : 2119-25.
26. Molina CA, Ribo M, Rubiera M, Montaner J, Santamarina E, Delgado-Mederos R et al. Microbubble administration accelerates clot lysis during continuous 2-MHz ultrasound monitoring in stroke patients treated with intravenous tissue plasminogen activator. Stroke 2006; 37 : 425-9.
27. Alexandrov AV. Ultrasound enhanced thrombolysis for stroke. International J Stroke 2006; 1 : 26–9.
Labels
Paediatric neurology Neurosurgery Neurology
Article was published inCzech and Slovak Neurology and Neurosurgery

2007 Issue 3-
All articles in this issue
- Efekt 1- a 2segmentové krční diskektomie s mezitělovou náhradou: prospektivní 1roční studie
- Změny hladin IgE protilátek v séru u těžkého poranění mozku
- MRI zobrazení mozku u pacientů s myotonickou dystrofií DM 1
- Přínos existence iktové jednotky ke zlepšení diagnostiky u pacientů s cévními mozkovými příhodami
- Ozáření kraniospinální osy u dětí s meduloblastomy v supinační poloze - dlouhodobé výsledky
- Epileptochirurgické řešení kavernózního hemangiomu asociovaného s fokální kortikální dysplazií při sekundární temporální epilepsii: kazuistika
- Osmotický demyelinizační syndrom – diagnostika magnetickou rezonancí: kazuistika
- Pozdní manifestace Wilsonovy choroby: kazuistika
- Metastáza velkobuněčného neuroendokrinního karcinomu tymu do mozku
- Variace mozkového průtoku v zobrazovacích metodách
- Účinnost sonotrombotripse a sonotrombolýzy v akceleraci rekanalizace střední mozkové tepny u pacientů s akutní mozkovu ischemií
- Srdeční myxomy jako příčina embolizace do centrálního nervového systému: desetileté zkušenosti
- Hydrocefalus po subarachnoidálním krvácení – vliv modality léčby aneuryzmatu
- Osteoplastická dekompresivní kraniotomie
- Dekompresivní kraniotomie u kraniocerebrálních poranění – hodnocení přežití a jeho kvality po jednom roce od úrazu
- Chiariho malformace – vlastní zkušenosti
- Akutní choreatický syndrom – kazuistika
- Czech and Slovak Neurology and Neurosurgery
- Journal archive
- Current issue
- Online only
- About the journal
Most read in this issue- Chiariho malformace – vlastní zkušenosti
- Osmotický demyelinizační syndrom – diagnostika magnetickou rezonancí: kazuistika
- MRI zobrazení mozku u pacientů s myotonickou dystrofií DM 1
- Osteoplastická dekompresivní kraniotomie
Login#ADS_BOTTOM_SCRIPTS#Forgotten passwordEnter the email address that you registered with. We will send you instructions on how to set a new password.
- Career

