-
Medical journals
- Career
Adnátní streptokoková infekce jako stále aktuální téma
Authors: K. Pinterová; M. Čadová; A. Mocková; M. Matas
Authors‘ workplace: Neonatologické oddělení, FN Plzeň
Published in: Čes-slov Neonat 2022; 28 (2): 131-137.
Category: Case Reports
Overview
Streptococcus agalactiae je fyziologickou součástí vaginální mikroflóry, jeho kolonizace může být trvalá i tranzientní. V České republice byl pro záchyt nosičství GBS (group B Streptococcus) zaveden plošný screening pomocí vaginorektálního stěru u všech těhotných v 35.−37. gestačním týdnu. Pozitivně testovaným těhotným je následně udělen status GBS a po posouzení dalších rizikových faktorů je porod veden za intrapartální antibiotické profylaxe (IAP).
Kazuistika pojednává o průběhu časné GBS sepse u lehce nezralého novorozence narozeného v centru intermediární péče. Vzhledem k negativitě rutinního GBS screeningu byl vaginální porod veden bez IAP. U dítěte se rozvíjí fulminantní GBS infekce a je v kritickém stavu transportováno do perinatologického centra. Případ je prezentován na rizikových faktorech samotné gravidity, je diskutováno shrnutí prenatálního screeningu GBS u nás a ve světě, strategie podávání IAP a změny v monitoringu rizikových novorozenců v rámci prevence a záchytu časné GBS infekce.
Klíčová slova:
Streptococcus agalactiae – časná sepse – prenatální GBS screening – intrapartální antibiotická profylaxe
ÚVOD
Streptococcus agalactiae je jako součást fyziologické vaginální mikroflóry přítomen až u 40 % těhotných a většinou se jedná o zcela inaparentní kolonizaci [1]. Standardní metodou detekce GBS u všech rodiček mezi 35.−37. týdnem těhotenství je kultivační vyšetření vaginorektálního stěru, jehož výsledek získáváme do 48 hodin. Kultivace na selektivních půdách umožňuje zjištění také antibiotické (ATB) citlivosti. Rychlé diagnostické testy, jako jsou molekulárně-genetické metody (např. nucleic acid amplification test, NAAT), jsou prováděny ante - či intrapartálně a výsledek je zpravidla k dispozici do 2 hodin. Jsou však finančně náročnější, nemají výhodu stanovení ATB citlivosti a pro riziko falešně negativních výsledků se rutinně nepoužívají [2, 3].
K časnému vertikálnímu přenosu GBS na novorozence může dojít až v 50 % případů, u 1−2 % z nich se následně rozvine časná sepse. Cílem plošného screeningu GBS je správné rozhodnutí o aplikaci IAP v indikovaných případech a eliminace rozvoje invazivní novorozenecké infekce. Přesto GBS zůstává jedním z nejčastějších patogenů časné novorozenecké sepse, s incidencí 0,23/1000 živě narozených [1, 4].
Definice neonatální sepse zatím není jednoznačně stanovená. Primární překážkou jsou nespecifické klinické projevy a laboratorní nálezy v rámci sepse, absence skórovacího systému orgánového poškození nebo problematické prokazování infekčního agens [5]. Novorozenecká sepse je tedy nejčastěji formulována jako klinický syndrom systémového onemocnění provázeného bakteriemií [5, 6]. V souvislosti s dobou manifestace příznaků se rozlišuje sepse časná a pozdní.
Sdělení prezentuje fulminantní průběh časné novorozenecké sepse podmíněné GBS u lehce nezralého novorozence.
KAZUISTIKA
V centru intermediární péče se narodil lehce nezralý novorozenec (35+4 t. g.) s porodní hmotností 3010 g. Jednalo se o čtvrtou, sledovanou, dosud fyziologickou graviditu. Klasické kultivační vyšetření vaginorektálního stěru GBS bylo u matky negativní. Porod provázel předčasný odtok čiré plodové vody v délce 18 hodin, intrapartálně pak odtékala zkalená plodová voda. Plodové ozvy byly fyziologické. Během porodu byla rodička subfebrilní (37,9 °C), IAP jí nebyla aplikována. Z dostupné dokumentace nebylo více informací o rodičce, jejích laboratorních výsledcích a průběhu porodu k dispozici.
Porod proběhl spontánně, záhlavím, narodil se novorozenec s dobrou bezprostřední poporodní adaptací (Apgar skóre 9, 10, 10 b., pupečníkové pH 7,33).
Po 11. minutě věku však došlo k rozvoji dyspnoe a gruntingu, dítě bylo proto z porodního sálu časně převezeno na novorozeneckou JIP, kde se postupně rozvinula a progredovala dechová tíseň, opakovaně se objevovaly desaturace vyžadující zahájení inhalační oxygenoterapie. Stav dále provázela tachykardie a špatně prokrvená periferie, vstupně byla u novorozence zjištěna febrilie (39,1 °C). Alterace stavu se odrazila i v hodnotách acidobazické rovnováhy (ABR), kde postupně došlo k prohlubování smíšené acidózy, pH se dostalo až na hodnotu 6,92 (tab. 1). I přes to, že dítě prezentovalo klinické známky septického stavu, nebyly kromě ABR provedeny žádné laboratorní testy, neproběhl odběr hemokultury a nebyla zahájena ATB terapie.
Table 1. Vývoj hodnot acidobazické rovnováhy v průběhu 8 hodin po narození 
Na rtg snímku (obr. 1) byla patrná oboustranně snížená transparence plic, odpovídající změnám v rámci rozvoje syndromu dechové tísně. Pro rychle se zvyšující nároky na oxygenoterapii při neinvazivní plicní ventilaci byl novorozenec ve věku 6 hodin endotracheálně intubován a byla zahájena konvenční umělá plicní ventilace (UPV) s FiO2 1,0. Z endotracheální kanyly byl odsáván krvavý sekret a následně byla aplikována první dávka surfaktantu.
Image 1. Vstupní rtg snímek plic časně po narození, oboustranně snížená transparence plic při rozvoji RDS 
Respirační insuficienci provázela hypotenze (40/24 torr, střední arteriální tlak 29 torr), byla tedy zahájena kombinovaná oběhová podpora s kontinuálním podáváním katecholaminů (adrenalin 0,4 μg/kg/min, dobutamin 7 μg/kg/min). Přetrvávala febrilie, dítěti byl podán paracetamolový čípek, ATB terapie zahájena nebyla. Pro závažný klinický stav byl domluven překlad na naše pracoviště. Letecký transport novorozence na Jednotku intenzivní a resuscitační péče (JIRP) proběhl až ve věku 9 hodin, převoz trval 30 minut.
Na JIRP našeho oddělení byl novorozenec přijat ve věku 10 hodin. Saturace při plném nastavení konvenční ventilace dosahovaly maximálně 60 %, dítě jevilo známky šoku, bylo bledocyanotické, mramorované, s poruchou vědomí.
Po přijetí byla po odběru kultivačních materiálů okamžitě zahájena terapie sepse ve zvyklé kombinaci ATB – ampicilin (ve zvýšené dávce 100 mg/kg), gentamicin (4 mg/kg), do terapie byl následně přidán i cefotaxim (50 mg/kg). Přechodné zlepšení saturace nastalo po aplikaci druhé dávky exogenního surfaktantu.
Příjmový rtg snímek plic (obr. 2) byl s progresí nálezu oboustranně snížené transparence plic v rámci zánětlivé infiltrace plicního parenchymu. Na bedside echokardiografii byla prokázána těžká dysfunkce komor při suprasystémové plicní hypertenzi, které odpovídaly i vysoké hodnoty kardiomarkerů (tab. 2). Při navyšovaném obratu katecholaminů (adrenalin 0,5 μg/kg/min, dobutamin 10 μg/kg/min) dále přetrvávala těžká hypotenze s tachykardií. Sonografie mozku ukázala intraventrikulární hemoragii 2. stupně vlevo.
Image 2. Rtg snímek po přijetí na JIRP-NEO FN Plzeň, progrese zánětlivé infiltrace plicní tkáně 
Table 2. Výsledky laboratorního vyšetření krve po přijetí na JIRP-NEO FN Plzeň ve věku 11 hodin
Kritická leukopenie, zvýšené časné markery zánětu, hypoproteinemie, elevace kardiomarkerů, patologický hemokoagulační screening.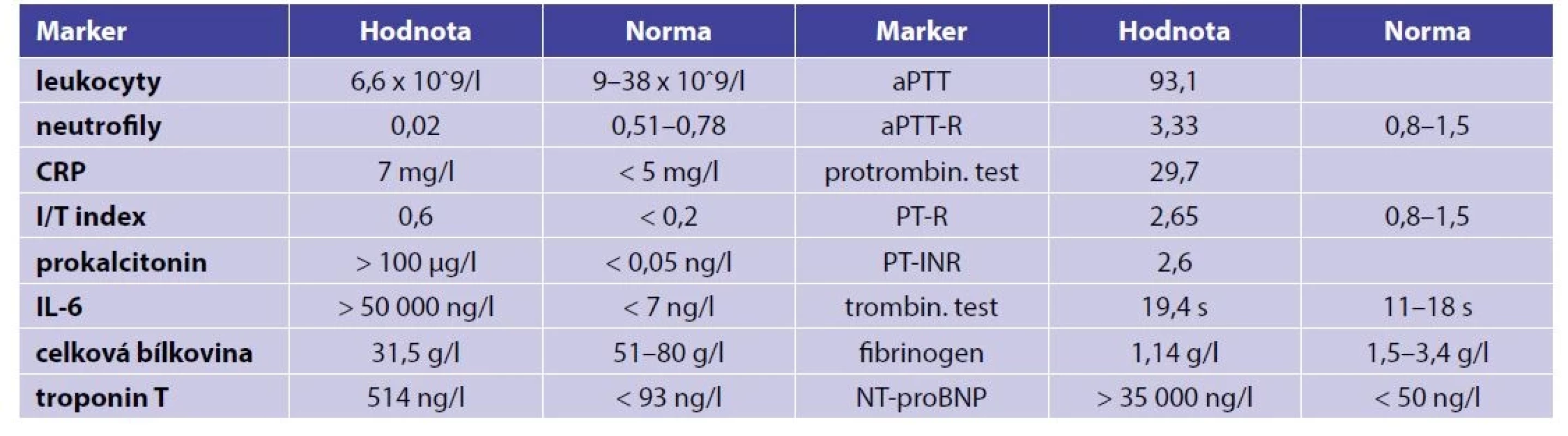
Ve vstupní laboratoři byly patrné významně zvýšené časné markery sepse a neutropenie (tab. 2). Pro hypoproteinemii byla podána plazma. Přítomen byl i patologický hemokoagulační screening při rozvoji diseminované intravaskulární koagulace. Krátce poté i mikrobiologická laboratoř hlásila pozitivitu odebraného tracheálního aspirátu na grampozitivní koky.
I přes maximální nastavení konvenčního režimu UPV se nedařilo zlepšit oxygenaci (SpO2 60 % při FiO2 1,0), proto byla dechová podpora změněna na vysokofrekvenční oscilační ventilaci (HFOV). Ani terapie inhalačním oxidem dusnatým (iNO, 20 ppm), stejně jako nekonvenční ventilace, neměla efekt na zlepšení ventilačních parametrů a především saturace.
Ve věku 12 hodin došlo k dalšímu zhoršení stavu s těžkou bradykardií. Kardiopulmonální resuscitace byla rozšířena o bolusovou aplikaci adrenalinu. Krátce byla prováděna i nepřímá srdeční masáž, po které se srdeční akce upravila, ale stále přetrvávala kritická hypotenze.
Závažná bradykardie se ve věku 13 hodin opakovala i přes intenzivní péči s vysokými dávkami oběhové podpory (adrenalin 0,75 μg/kg/min, dobutamin 20 μg/kg/min), aplikaci adrenalinu bolusově, podávání bikarbonátu a po nepřímé srdeční masáži nastává ve věku 14 hodin, tedy 4 hodiny od přijetí, exitus letalis.
Kultivační vyšetření definitivně potvrdila přítomnost Streptococcus agalactiae ve všech vyšetřovaných vzorcích (krk, ucho, stolice, tracheální aspirát, hemokultura) a post mortem byl GBS prokázán i v plicní tkáni. Potvrzena byla dobrá citlivost na penicilin, ampicilin a klindamycin. Stejný kultivační nález byl následně potvrzen i u matky (pochva, hemokultura).
DISKUSE
Na rozdíl od dospělých, kdy je sepse popisována jako život ohrožující orgánová dysfunkce způsobená dysregulovanou odpovědí organismu na přítomnost infekce, nelze neonatální sepsi jednoznačně definovat. Za časnou formu označujeme sepsi manifestovanou nejčastěji během prvních 72 hodin života (v určitých případech do 1 týdne věku), za formu pozdní rozvoj sepse po 72 hodinách věku (respektive po 7 dnech). Při prokázané sepsi provází klinické příznaky i pozitivní hemokultura. U klinické sepse není patogen potvrzen, kromě klinických jsou přítomny i laboratorní známky infekce [5].
Ve světě existují dva přístupy k prevenci rozvoje neonatální GBS infekce s následným managementem podávání IAP (tab. 3) [7]. V ČR, podobně jako v USA, Kanadě či Austrálii [2, 4, 8], je zaveden již výše zmíněný plošný screening pomocí vaginorektálního stěru během 35.−37. týdne těhotenství. Z dostupných studií je známo, že 5−7 % původně GBS negativních rodiček se intrapartálně ukáže jako GBS pozitivních [1].
Table 3. Srovnání přístupů k aplikaci IAP u nás a ve světě
Risk-based approach staví aplikaci IAP na přítomnosti uvedených rizikových faktorů provázejících porod, konkrétní indikační hodnoty (např. PROM, prematurita) jsou v jednotlivých zemích různé.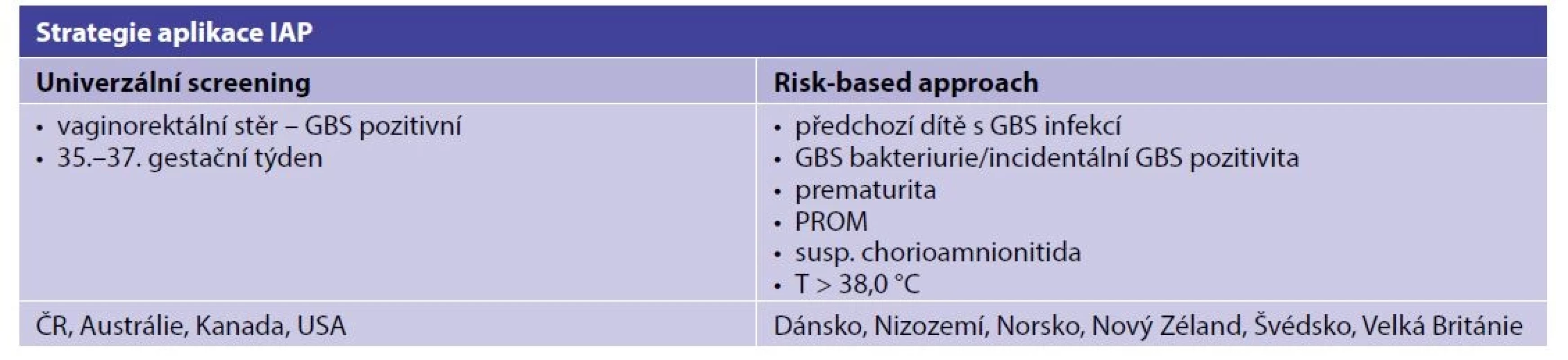
V severských zemích [9,10], Velké Británii [11] a na Novém Zélandu [12] univerzální screening neprobíhá, IAP je zahajována dle přítomnosti rizikových faktorů. Jedná se o tzv. risk-based approach. I v tomto přístupu jsou v jednotlivých zemích nuance, např. v hodnocení předčasného porodu vzhledem ke gestačnímu věku. Dále se jedná i o lokální incidenci nosičství GBS, incidenci rozvoje časné sepse a vznikající ATB rezistenci s přerůstáním gramnegativní mikroflóry v případě eradikace GBS.
Strategii prevence a záchytu časné novorozenecké sepse v ČR shrnuje schéma doporučeného postupu České neonatologické společnosti (ČNeoS) (schéma 1) [1]. Kromě údajů o klinickém stavu novorozence při počínající sepsi je nutné mít informace k posouzení perinatálních rizikových faktorů, které se na rozvoji septického stavu mohou podílet. Pro určení rizika rozvoje časné sepse existuje i online kalkulátor (např. early onset sepsis risk calculator) [13]. Ten kromě gestačního věku a GBS statusu rodičky klade důraz i na další perinatální údaje, jako je délka předčasné ruptury membrán (premature rupture of membranes, PROM), tělesná teplota (TT) rodičky během porodu, aplikace IAP a místně-specifická incidence časné sepse. Kalkulátor vypočítává pravděpodobnost rozvoje sepse a následně určí:
Schéma 1. Doporučený postup ČNeoS k profylaxi a léčbě infekcí vyvolaných Streptococcus agalactiae, 2020 
• s jakou intenzitou observovat vitální funkce novorozence,
• kdy provést odběr hemokultury,
• kdy zahájit ATB terapii.
Se stupněm nezralosti se zvyšuje mortalita, u novorozenců nad 35. gestační týden je přibližně 2 %, zatímco u prematurit pod 35. týden narůstá až na 20 % [7]. Příznaky časné neonatální sepse jsou zpravidla nespecifické, tj. respirační, oběhové, gastrointestinální, neurologické, hematologické a další [6].
Časně zahájená ATB terapie při suspektní neonatální sepsi snižuje morbiditu i mortalitu a dle dostupných guidelines by měla být zahájena do 1 hodiny od stanovení diagnózy [6]. První volbou ATB terapie je empirická kombinace ampicilinu s gentamicinem. Ta pokrývá nejčastější vyvolavatele časné sepse (GBS, Escherichia coli, Listeria monocytogenes). Při pochybnostech o účinku zavedené terapie lze ATB dále rozšířit např. o cefalosporiny III. generace. Stejně tak platí, že při zjištění vyvolávajícího agens by měla být ATB terapie cílená. Ampicilin se při podezření na GBS infekci podává ve zvýšené dávce (100 mg/kg), gentamicin a další ATB standardně dle gestačního stáří.
Jedním z nejzávažnějších maternálních faktorů, které mají pro rozvoj sepse u novorozenců velký význam, je akutní chorioamnionitida. Známkami klinické chorioamnionitidy jsou zvýšená tělesná teplota rodičky > 37,8 °C a nejméně dva z následujících příznaků:
• tachykardie rodičky > 100/min,
• tachykardie plodu > 160/min,
• hnisavý vaginální fluor/zkalená či zapáchající plodová voda,
• citlivost dělohy/bolestivost břicha,
• mateřská leukocytóza/elevace CRP [14].
Příznaky jsou manifestací lokálních i systémových zánětlivých procesů jako odpověď fetomaternální jednotky na mikrobiální invazi amniální dutiny. Přestože klinická chorioamnionitida je při přijetí rodičky k porodu vzácná, může se rozvinout s latencí. Jako histologickou chorioamnionitidu označujeme difuzní infiltraci kterékoli části placenty, plodových obalů či pupečníku neutrofilními granulocyty [15].
Z literatury je patrné, že IAP významně snižuje incidenci časné neonatální sepse. IAP je v indikovaných případech zahajována intravenózním podáváním krystalického penicilinu 2krát po 4 hodinách a dále každých 6 hodin. V ČR je výhodou výborná citlivost GBS na penicilin. Akceptovatelnou alternativou je ampicilin aplikovaný v 6hodinových intervalech, popřípadě klindamycin pro těhotné s alergií na betalaktamová ATB. Jako dostatečná IAP je považována aplikace ATB více než 4 hodiny před porodem [1, 16].
Po shrnutí rizikových faktorů námi uváděného těhotenství (35. týden těhotenství, PROM 18 hodin, intrapartální odtok zkalené plodové vody, subfebrilie rodičky) při negativitě kultivačního vyšetření GBS nebyla dle doporučení ČNeoS IAP indikována (viz schéma 1). Vzhledem k nepřítomnosti či nejednoznačnosti údajů o průběhu porodu (PROM přesně 18 hod, chybějící údaj o tachykardii těhotné) a hraničním klinickým známkám infekce u rodičky (TT 37,9 °C) nemůžeme správnost intrapartálního managementu jednoznačně hodnotit. Při rozvinuté porodní činnosti po 35. týdnu těhotenství a při prokázané GBS negativitě má být totiž dle doporučených postupů České gynekologicko-porodnické společnosti (ČGPS) indikace IAP zvažována dle klinického stavu rodičky [16]. Podávají se stejná ATB jako při GBS profylaxi. V případě rozvinuté klinické chorioamnionitidy se doporučuje empirická dvojkombinace ATB (ampicilin, gentamicin).
Otázkou zůstává, jakým způsobem by v našem případě ovlivnila aplikace IAP a okamžité zahájení ATB terapie novorozence další průběh popisované závažné neonatální infekce. Z našeho pohledu se jednalo o velmi masivní GBS kolonizaci novorozence.
ZÁVĚR
Příklad časné novorozenecké GBS sepse uvádíme jako důležité memento hodnocení rizikových faktorů provázejících spontánní předčasný porod, a to i v případě negativity prenatálního GBS stěru a nejednoznačně vyjádřených klinických příznaků infekce u rodičky. Zda se jednalo o rozvinutou klinickou chorioamnionitidu, nelze zpětně s určitostí posoudit.
Nevylučujeme, že pozdní aplikace ATB terapie mohla mít v našem případě vliv na prudký rozvoj neonatální sepse. Infekční etiologie tohoto kritického stavu by měla být zvažována. ATB terapie byla podána až po přijetí na naše oddělení. Je však otázkou, zda by i při časnějším zahájení léčby nedošlo k fatálnímu průběhu.
Obecně lze shrnout, že dostatečná informovanost o průběhu porodu, intenzivní monitoring vitálních funkcí novorozence, elevace časných parametrů zánětu, hodnocení přítomnosti klinických známek infekce a zvážení zahájení ATB terapie jsou z pozice neonatologa hlavní atributy dalšího managementu.
I přes negativitu GBS statusu je tedy důležité nepodcenit přístup ke spontánnímu předčasnému porodu, zvláště pokud je provázen i dalšími uvedenými rizikovými faktory. Vzhledem k tomu, že časná sepse se až v 80 % případů projeví do 6 hodin života [1], je důsledný monitoring novorozence základním předpokladem prevence rozvoje a fulminantního průběhu GBS infekce.
Ačkoli incidence rozvoje GBS infekce není vysoká a vlivem zavedení IAP se snížila, stále zůstává aktuálním tématem neonatologie.
Konflikt zájmu: žádný.
Došlo do redakce: 1. 8. 2022
Adresa pro korespondenci:
MUDr. Kateřina Pinterová
Neonatologické oddělení FN Plzeň
Alej Svobody 80
304 60 Plzeň
e-mail: pinterovak@fnplzen.cz
Sources
1. Doporučený postup k profylaxi a léčbě infekcí vyvolaných Streptococcus agalactiae (GBS) 2020. Dostupné z: http://neonatologie. cz/doporucene-postupy
2. Money D, Allen VM. The prevention of early-onset neonatal group B streptococcal disease. J Obstet Gynaecol Can 2018; 40(8): 665−674.
3. Diagnostika a léčba streptokoků skupiny B v těhotenství a za porodu – doporučený postup ČGPS ČLS JEP 2013. Dostupné z https://www.gynultrazvuk.cz/uploads/recommendedaction/71/ doc/p-2013-diagnostika-a-lecba-streptokoku-skupiny-b-v-tehotenstvi. pdf
4. Puopolo KM, Lynfield R, Cummings JJ; Comittee on fetus and newborn, comittee on infectious disease. Management of infants at risk for group B streptococcal disease. Pediatrics 2019; 144(2): e20191881.
5. Boráková K, Straňák Z. Aktuální diagnostická kritéria neonatální sepse a systémové zánětlivé odpovědi u plodu a novorozence. Čes-slov Pediat 2021; 76(1): 46−54.
6. Gomella TL, et al. Gomella’s Neonatology, 8th edition. Baltimore: McGraw-Hill Education 2020; 1175−1184.
7. Le Doare K, Heath PT, Plumb J, Owen NA, Brocklehurst P, Chappell LC. Uncertainties in screening and prevention of group b streptococcus disease. Clin Infect Dis 2019; 69(4): 720−725.
8. Queensland Clinical Guidelines. Early onset group B streptococcal disease. Guideline No. MN16.20-V4-R21. Queensland Health 2020. Dostupné z: http://www.health.qld.gov.au/qcg
9. Hakansson S, Axemo P, Bremme K, Bryngelsson AL, Wallin MC, Ekstrom CM, Granlund M, Jacobsson B, Källén K, Spetz E, Tessin I; Swedish working group for the prevention of perinatal group B streptococcal infections. Group B streptococcal carriage in Sweden: a national study on risk factors for mother and infant colonisation. Acta Obstet Gynecol Scand 2008; 87(1): 50−58.
10. Fjalstad JW, Stensvold HJ, Bergseng H, Simonsen GS, Salvesen B, Rønnestad AE, Klingenberg C. Early-onset sepsis and antibiotic exposure in term infants: a nationwide population-based study in Norway. Pediatr Infect Dis J 2016; 35(1): 1−6.
11. Hughes RG, Brocklehurst P, Steer PJ, Heath P, Stenson BM. Prevention of early-onset neonatal group B streptococcal disease. Green-top Guideline No. 36. BJOG 2017; 124 : 280−305.
12. Darlow B, Campbell N, Austin N, et al. The prevention of early onset neonatal group B streptococcus infection. New Zealand Consensus Guidelines 2014. N Z Med J 2015; 128(1425): 69−76.
13. Early onset sepsis risk calculator. Dostupné z: https://neonatalsepsiscalculator. kaiserpermanente.org/
14. Conde-Agudelo A, Romero R, Jung EJ, Garcia Sanchez AJ. Management of clinical chorioamnionitis: an evidence-based approach. Am J Obstet Gynecol 2020; 223(6): 848−869.
15. Kacerovský M, Musilová I. Management předčasného odtoku plodové vody s ohledem na zánětlivé komplikace – naše zkušenosti. Ceska Gynekol 2013; 78(6): 509−513
16. Sbírka doporučených postupů ČGPS ČLS JEP 2017. Spontánní předčasný porod. Dostupné z: https://www.gynultrazvuk.cz/ uploads/recommendedaction/46/doc/p-2017-spontanni-predcasny - porod.pdf
Labels
Neonatology Neonatal Nurse
Article was published inCzech and Slovak Neonatology

2022 Issue 2-
All articles in this issue
- EDITORIAL
- Streptococcus agalactiae v neonatologii
- Celoplošný screening sluchu novorozenců v České republice – databáze a nová metodika
- Screening novorozenecké glykemie a jeho úskalí
- Vliv léčby matky SSRI/SNRI v graviditě na poporodní adaptaci donošeného novorozence
- Hyperbilirubinemie – čas na změnu?
- Kojení v České republice v roce 2020
- Kongenitální a postnatální cytomegalovirové infekce
- Kongenitální toxoplazmóza jako součást neonatologické problematiky
- Problematika plánovaných domácích porodů z pohledu neonatologa
- Hmotnostní úbytek donošeného fyziologického novorozence
- Adnátní streptokoková infekce jako stále aktuální téma
- Czech and Slovak Neonatology
- Journal archive
- Current issue
- Online only
- About the journal
Most read in this issue- Hyperbilirubinemie – čas na změnu?
- Screening novorozenecké glykemie a jeho úskalí
- Hmotnostní úbytek donošeného fyziologického novorozence
- Streptococcus agalactiae v neonatologii
Login#ADS_BOTTOM_SCRIPTS#Forgotten passwordEnter the email address that you registered with. We will send you instructions on how to set a new password.
- Career

