-
Medical journals
- Career
Kongenitální a postnatální cytomegalovirové infekce
Authors: D. Smíšková 1; P. Hubáček 2
Authors‘ workplace: Klinika infekčních nemocí, 2. LF UK a FN Bulovka, Praha 1; Ústav lékařské mikrobiologie, 2. LF UK a FN Motol, Praha 2
Published in: Čes-slov Neonat 2022; 28 (2): 112-116.
Category: Reviews
Overview
Kongenitální cytomegalovirová infekce je celosvětově nejčastější vrozenou infekcí (0,2−6 % živě narozených dětí, v zemích s vyšším ekonomickým standardem 0,2−0,6 %). Jedná se o nejčastější příčinu geneticky nepodmíněné senzorineurální ztráty sluchu, má významný podíl na neurologických vývojových poruchách. Rizika přenosu na plod se zásadně liší u primoinfekce (30−35 %) a u reaktivace nebo reinfekce (1,1−1,7 %). Zhruba 90 % novorozenců je v době porodu asymptomatických, avšak u 10−15 % se objevuje v prvních letech života porucha sluchu nebo psychomotorická retardace.
Prenatálními klinickými projevy jsou růstová retardace, ventrikulomegalie, mikrocefalie, intrakraniální kalcifikace, postnatálně je nejčastěji patrná nízká porodní hmotnost, mikrocefalie, hypotonie, petechiální exantém, blueberry muffins, hepatosplenomegalie, trombocytopenie, neutropenie, hepatopatie, hyperbilirubinemie, porucha sluchu, chorioretinitida.
Diagnóza by měla být stanovena co nejdříve, doporučovaným screeningovým testem je vyšetření slin nebo moči (PCR), s následným kvantitativním stanovením viremie a virurie.
Léčba je zahajována v prvních 4 týdnech života u novorozenců s gestačním věkem nad 32 týdnů, vždy při postižení centrální nervové soustavy a/nebo závažném postižení dalších orgánů (játra, kostní dřeň, plíce, oko). Základním virostatikem je intravenózní ganciklovir nebo perorálně podávaný valganciklovir, který by měl být preferován. Doba léčby je 6 měsíců, v indikovaných případech až 1 rok.
Dispenzarizace dětí s kongenitální CMV infekcí by měla probíhat minimálně do 4 let věku, nezbytné jsou pravidelné kontroly sluchu, psychomotorického vývoje a zraku.
Klíčová slova:
cytomegalovirus – kongenitální infekce – postnatální infekce – senzorineurální ztráta sluchu – ganciklovir – valganciklovir
ÚVOD
Lidský cytomegalovirus (CMV) je obalený DNA virus z čeledi Herpesviridae. Je celosvětově rozšířený, séroprevalence u dospělých obyvatel je v rozvinutých zemích odhadována na 50 %, v rozvojových zemích prodělá CMV primoinfekci již v dětském věku naprostá většina obyvatel. Kongenitální cytomegalovirová infekce (cCMV) je v současné době celosvětově nejčastější popsanou vrozenou infekcí, jedná se o nejčastější příčinu geneticky nepodmíněné senzorineurální ztráty sluchu a významně přispívá i k neurologickým vývojovým poruchám [1].
Séroprevalence CMV u gravidních žen se v zemích západní Evropy pohybuje kolem 60 %. Přibližně polovina (52 %) kongenitálních infekcí následuje po primoinfekci matky, zbylých 48 % je následek reaktivace nebo reinfekce [2]. Výskyt cCMV je celosvětově uváděn u 0,2−6 % živě narozených dětí, v zemích s vyšším ekonomickým standardem se pohybuje mezi 0,2−0,6 % [1−3]. Data o výskytu cCMV v ČR v současné době nejsou k dispozici.
Klinicky významnou vlastností cytomegaloviru je schopnost dlouhodobé perzistence v organismu s občasnými reaktivacemi. Přenáší se nejčastěji kontaktem se slinami nebo jinými tělními tekutinami asymptomatické osoby s probíhající (obvykle klinicky němou) reaktivací viru. Při viremii u těhotné ženy přechází virus hematogenní cestou na plod, a to jak při primoinfekci, tak při reaktivaci latentní infekce. Protože nejprve dochází k infekci placenty a následně k postupu infekce na plod, jsou jako jedny z prvních projevů cCMV příznaky spojené s poruchami funkce placenty. Infekce navíc vede k přerušení tvorby nových kotyledonů, a tak zaostává také plocha placenty nutná pro normální vývoj plodu. Kromě toho vede biologické chování CMV k zánětům endotelu a myelosupresi se všemi patofyziologickými dopady. Typická je například trombocytopenie, dále zvětšení jater a sleziny, případně vaskulitida s následnou kalcifikací [4, 5]. Rizika přenosu na plod se významně liší u primoinfekce (30−35 %) a u reaktivace nebo reinfekce (1,1−1,7 %) [6]. K symptomatické infekci dojde u 10−15 % infikovaných novorozenců, téměř polovina z nich má dlouhodobé následky. Obvykle jsou to děti matek, u kterých proběhla sérokonverze v prvním trimestru gravidity [7]. Ostatní novorozenci jsou při porodu asymptomatičtí, nicméně u 8−15 % se symptomy (zejména sluchové postižení) objevují s latencí 1−5 let, podle některých studií i později [8−10].
Ascendentní intrauterinní infekce je vzácná, k onemocnění novorozence může však dojít také postnatálně, zejména u předčasně narozených dětí s nedokonale vyzrálým gastrointestinálním traktem. Vehikulem nejčastěji bývá mateřské mléko při asymptomatické reaktivaci infekce u matky, vzácně pak vaginální sekret z porodních cest matky.
KLINICKÉ PROJEVY KONGENITÁLNÍ CMV INFEKCE
Některé z klinických symptomů mohou být zjevné z ultrazvukového (UZ) vyšetření již v prenatálním období, častěji je diagnóza stanovena až na základě patologií zjištěných po porodu. Přehled klinických projevů a nejčastějších laboratorních patologických nálezů je uveden v tabulce 1.
Table 1. Klinické a laboratorní projevy kongenitální a postnatální CMV infekce 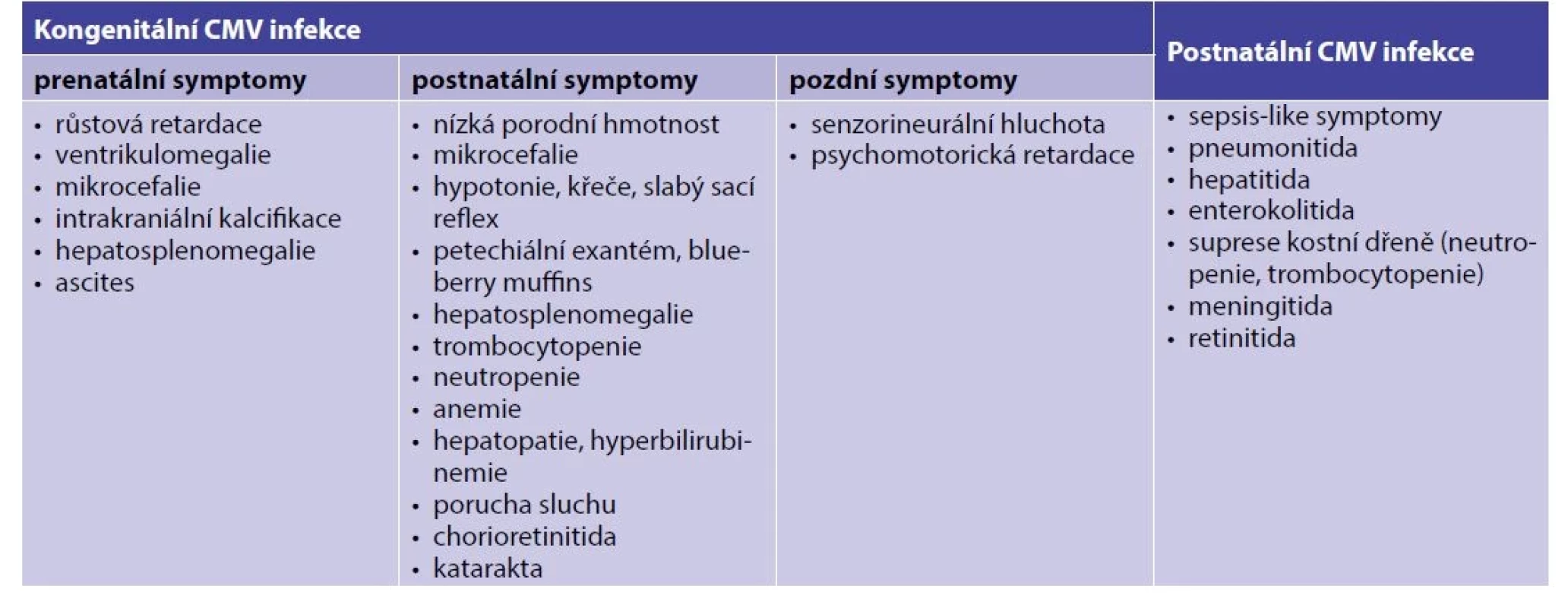
Za závažnou symptomatickou infekci je považováno postižení CNS nebo dvou a více dalších orgánů, oligosymptomatická infekce má jeden nebo dva izolované projevy, obvykle přechodné [1]. Život ohrožující komplikací může být sepsis-like onemocnění, myokarditida a hemofagocytární lymfohistiocytóza, přičemž rizikoví jsou především nezralí novorozenci [11].
Přibližně 90 % novorozenců je v době porodu asymptomatických, avšak u 10−15 % se rozvíjí v prvních letech života senzorineurální porucha sluchu. Studie, které sledovaly pacienty až do 18 let, uvádí poruchu sluchu dokonce až u 25 % [8, 12].
KLINICKÉ PROJEVY POSTNATÁLNÍ INFEKCE
Zatímco u donošených dětí nedochází při postnatálně získané CMV infekci (pCMV) k rozvoji závažného onemocnění, u těžce nezralých novorozenců může dojít k těžkým komplikacím. Klinické příznaky se u předčasně narozených dětí rozvíjí obvykle v druhém nebo třetím měsíci po porodu. Klinický obraz je značně variabilní, od asymptomatické viremie až po život ohrožující infekci s rizikem multiorgánového selhání (viz tab. 1). Na rozdíl od kongenitální infekce však nejsou pozorovány pozdní následky (senzorineurální porucha sluchu, opožděný psychomotorický vývoj) [13].
DIAGNOSTIKA
Všechny symptomy − prenatální a postnatální, klinické i laboratorní − by měly být indikací k provedení diagnostických testů. Vyšetření je indikováno také u dětí matek s prokázanou CMV primoinfekcí nebo nejasným horečnatým onemocněním v graviditě. Uvedená opatření však nevedou k odhalení asymptomatických infikovaných novorozenců, to umožňuje pouze plošný novorozenecký screening, který v současné době není v ČR zaveden.
Diagnostika v graviditě
Primoinfekce u matky je potvrzena sérologickým vyšetřením (pozitivita IgM a IgG s nízkou aviditou), případně zachycením viremie (PCR) při probíhajícím horečnatém infektu. Jednoznačné odlišení primární infekce od reaktivace je však komplikováno nízkou senzitivitou IgM protilátek. Některé morfologické projevy fetální CMV infekce mohou být zachyceny na USG, přesnější diagnostickou metodou je průkaz CMV DNA v amniové tekutině. Nejvyšší senzitivitu a specificitu poskytuje amniocentéza provedená ve 20.−21. týdnu gravidity, nejlépe alespoň 8 týdnů od předpokládané primoinfekce matky.
Postnatální diagnostika
Pro stanovení kongenitální infekce je nezbytné vyšetření v prvních 21 dnech života, později je již komplikované odlišit cCMV infekci od postnatální nákazy [14]. Vhodným materiálem pro základní screeningové vyšetření pomocí PCR jsou sliny. Vzorek by však neměl být odebírán přímo na porodním sále pro riziko kontaminace CMV z cervikovaginálních sekretů a následně nikdy dříve než 1 hodinu po kojení pro možnost kontaminace z mateřského mléka. Vysoká virová nálož je i v moči, nicméně odběr je o něco složitější [1]. V případě pozitivního nálezu je třeba doplnit kvantitativní PCR v plné periferní krvi v EDTA, případně i v mozkomíšním moku, je-li klinické podezření na postižení CNS. Hladiny protilátek proti CMV jsou u novorozence značně variabilní a obtížně interpretovatelné. Vyšetření suché kapky (Guthrieho kartička) se pro nižší senzitivitu nepovažuje za vhodnou screeningovou metodu, lze ji však využít retrospektivně při suspekci na kongenitální infekci u novorozenců starších 3 týdnů [15, 16]. Negativní výsledek však kongenitální infekci zcela nevylučuje. Limity metody jsou také v tom, že u novorozenců infikovaných v prvních týdnech gravidity už nemusí být v době porodu viremie detekovatelná. Následky a rozsah postižení nelze jednoznačně predikovat z virové nálože, nicméně novorozenci s úvodní viremií nad 100 000 cp/ml mají téměř ve 100 % případů střední až závažné symptomy [17].
U novorozenců s laboratorně potvrzenou cCMV je dále indikováno UZ nebo MR vyšetření centrální nervové soustavy (CNS), které může zobrazit kalcifikace, periventrikulární cysty, dilatace komor, okrsky germinolýzy, abnormality bílé hmoty, cerebelární hypoplazie nebo vaskulopatie a. lenticulostriata. Nezbytné je opakované zhodnocení sluchu vyšetřením evokovaných sluchových potenciálů (BERA), neurologické a oftalmologické vyšetření.
Při podezření na postnatálně získanou infekci je doporučováno vyšetření mateřského mléka na přítomnost CMV (PCR).
LÉČBA KONGENITÁLNÍ INFEKCE
Podle recentních studií vede léčba kongenitální CMV infekce k signifikantnímu zlepšení sluchového postižení i neurologického vývoje, je-li zahájena v prvních 4 týdnech života [18, 19]. K léčbě jsou indikovaní novorozenci s virologicky konfirmovanou symptomatickou infekcí a gestačním věkem nad 32 týdnů. Je zahajována ihned po stanovení diagnózy, vždy při postižení CNS, nebo při závažném postižení dalších orgánů (játra, kostní dřeň, plíce, oko). K léčbě jsou indikováni rovněž novorozenci s primárním imunodeficitem. V současné době neexistuje jednotné stanovisko ohledně léčby dětí s izolovanou poruchou sluchu a zároveň bez postižení CNS a dalších symptomů, nadále se však provádějí studie. Někteří autoři doporučují zvážit léčbu také u izolované závažné poruchy sluchu, je-li zjištěna v prvních 4 týdnech života [6]. Léčba asymptomatických dětí bez poruchy sluchu v současné době indikována není.
Základním virostatikem pro léčbu kongenitální i postnatální CMV infekce je intravenózní ganciklovir nebo jeho prodrug, perorálně podávaný valganciklovir (u malých dětí zpravidla v sirupu). Valganciklovir v dávce 16 mg/kg podávaný 2krát denně by měl být preferován. Pouze u závažných klinických stavů, kdy není možný nebo dobře tolerovaný p.o. příjem, je indikován intravenózní ganciklovir v dávce 6 mg/kg podávaný 2krát denně. Dávku virostatika je dále třeba upravovat podle váhy dítěte, protože subterapeutické dávky napomáhají rozvoji rezistence. U dětí se závažnou CMV asociovanou retinitidou může být nutná také lokální léčba.
Délka terapie je dle recentních doporučení 6 měsíců. Delší doba léčby (až 1 rok) může být přínosná u dětí s perzistující viremií, retinitidou nebo přetrvávající hepatální lézí [19].
Vzhledem k řadě možných vedlejších účinků léčby, zejména myelotoxicitě, je nezbytná laboratorní monitorace. Krevní obraz s diferenciálním rozpočtem leukocytů je v úvodu kontrolován jednou týdně, následně 1−2krát měsíčně. Nejčastějším problémem je neutropenie popisovaná asi u 20 % dětí po valgancikloviru a u 25−60 % po gancikloviru (nejčastěji v prvních 4 týdnech léčby) [18]. Při poklesu počtu neutrofilů pod 0,5 x 109/l je doporučeno přerušení léčby. Trombocytopenie (méně než 50 x 109/l) je udávána u cca 6 % dětí léčených ganciklovirem, může však být také projevem probíhající CMV infekce. Přerušení léčby je doporučeno i při elevaci jaterních transamináz nad 4 μkat/l, při poruše renálních funkcí je nutná úprava dávky. Dlouhodobé následky léčby nebyly doposud pozorovány, na zvířecích modelech je vzácně dokumentována gonadální toxicita a infertilita [20]. Pro zvýšení bezpečnosti a efektivity terapie je vhodné monitorování hladin gancikloviru. První kontrola je doporučována na konci 1. týdne terapie, 1 hodinu před aplikací by hladina gancikloviru měla být v intervalu 0,5−1,0 mg/l, další kontroly jsou indikovány na základě výsledků.
Odpověď na léčbu je hodnocena podle poklesu viremie, u závažných klinických stavů je doporučeno hodnocení virové nálože v krvi po zahájení terapie jednou týdně, následně jednou měsíčně; u ostatních pacientů na začátku terapie, po 3 měsících a před ukončením léčby. Za projev selhání terapie je považován signifikantní nárůst virové nálože po dvou týdnech terapie nebo po úvodním poklesu kdykoli v průběhu další léčby. Selhání může být způsobeno rezistencí na virostatikum nebo nedostatečným dávkováním léku.
LÉČBA POSTNATÁLNÍ INFEKCE
Léčba je indikována u novorozenců se sepsis-like příznaky, hepatitidou, závažnou intestinální manifestací nebo pneumonitidou. Dávkování virostatik je stejné jako u kongenitální infekce a stejně tak by měl být preferován p.o. valganciklovir, umožní-li to klinický stav. Doba léčby obvykle nepřesahuje 8 týdnů, někteří autoři doporučují dvoutýdenní blok léčby, po kterém následuje zhodnocení klinické odpovědi a virové nálože. Nedochází-li ke klinickému zlepšení a ústupu viremie, je indikován další blok [13].
SLEDOVÁNÍ DĚTÍ S CMV PO UKONČENÍ LÉČBY
Děti s cCMV by měly být sledovány minimálně do 4 let věku specializovaným pediatrem nebo dětským infektologem. Důležité jsou pravidelné kontroly sluchu, tj. v prvním roce života alespoň 3krát, dále po 6 měsících do 2 let věku a následně jednou ročně do 4−5 let věku, některé studie doporučují kontroly až do 18 let [12]. Pravidelně má být kontrolován také psychomotorický vývoj a zrak.
PREVENCE
Vzhledem k tomu, že k rozvoji kongenitální CMV infekce dochází i při reaktivacích latentní infekce těhotné ženy, je prevence v graviditě obtížná. U séronegativních žen jsou doporučována opatření snižující riziko infekce, především časté mytí rukou po kontaktu s malými dětmi, jejich hračkami nebo dalšími předměty (příbory, nádobí, pleny, nočníky, ručníky apod.), které mohou být kontaminované slinami a dalšími tělními tekutinami [21]. Je zcela nezbytné pečlivě hodnotit každou febrilní epizodu v graviditě. U žen s potvrzenou primoinfekcí CMV lze zvážit léčbu p.o. valaciklovirem (off label) ve vysokém dávkování (8 g/den). U prokázané kongenitální infekce plodu vedla uvedená terapie k signifikantnímu zvýšení počtu asymptomatických novorozenců – 82 % oproti 43 % ve skupině neléčených, k rutinnímu doporučování této terapie jsou však nutné další studie [22, 23].
U nezralých novorozenců je potřeba zamezit přenosu viru mateřským mlékem. Neošetřené mateřské mléko by měli dostávat pouze děti nad 32. gestační týden věku a nad 1000 g váhy. U matek CMV IgG pozitivních by se veškeré mateřské mléko pro rizikové novorozence mělo upravovat pasterizací nebo mražením, případně novými technikami, tedy UV-C ozařováním nebo mikrovlnným zářením [24, 25].
V různých stadiích klinických zkoušek jsou nyní CMV vakcíny, které by měly jednak ochránit séronegativní ženy před primoinfekcí, jednak posílit již získanou imunitní odpověď a tím zamezit reaktivaci u séropozitivních těhotných žen [26].
Konflikt zájmu: žádný
Došlo do redakce: 2. 8. 2022
Adresa pro korespondenci:
MUDr. Dita Smíšková, Ph.D.
Klinika infekčních nemocí
FN Bulovka
Budínova 2
180 00 Praha 8
e-mail: dita.smiskova@bulovka.cz
Sources
1. Chiopris G, Veronese P, Cusenza F, et al. Congenital cytomegalovirus infection: update on diagnosis and treatment. Microorganisms 2020; 8(10).
2. Leruez-Ville M, Magny JF, Couderc S, et al. Risk factors for congenital cytomegalovirus infection following primary and non-primary maternal infection: a prospective neonatal screening study using polymerase chain reaction in saliva. Clin Infect Dis 2017; 65(3): 398−404.
3. Kenneson A, Cannon MJ. Review and meta-analysis of the epidemiology of congenital cytomegalovirus (CMV) infection. Rev Med Virol 2007; 17(4): 253−76.
4. Maidji E, Genbacev O, Chang HT, Pereira L. Developmental regulation of human cytomegalovirus receptors in cytotrophoblasts correlates with distinct replication sites in the placenta. J Virol 2007; 81(9): 4701−4712.
5. Longo S, Borghesi A, Tzialla C, et al. IUGR and infections. Early Hum Dev 2014; 90 Suppl 1: S42−44.
6. Barton M, Forrester AM, McDonald J. Update on congenital cytomegalovirus infection: prenatal prevention, newborn diagnosis and management. Paediatr Child Health 2020; 25(6): 395−396.
7. Chatzakis C, Ville Y, Makrydimas G, et al. Timing of primary maternal cytomegalovirus infection and rates of vertical transmission and fetal consequences. American Journal of Obstetrics and Gynecology 2020; 223(6): 870−883.e11.
8. Goderis J, De Leenheer E, Smets K, et al. Hearing loss and congenital CMV infection: a systematic review. Pediatrics 2014; 134(5): 972−982.
9. Britt WJ. Maternal immunity and the natural history of congenital human cytomegalovirus infection. Viruses 2018; 10(8).
10. Cannon MJ, Griffiths PD, Aston V, et al. Universal newborn screening for congenital CMV infection: what is the evidence of potential benefit? Rev Med Virol 2014; 24(5): 291−307.
11. Sampath V, Narendran V, Donovan EF, et al. Nonimmune hydrops fetalis and fulminant fatal disease due to congenital cytomegalovirus infection in a premature infant. J Perinatol 2005; 25(9): 608−611.
12. Lanzieri TM, Chung W, Flores M, et al. Hearing loss in children with asymptomatic congenital cytomegalovirus infection. Pediatrics 2017; 139(3).
13. Kadambari S, Whittaker E, Lyall H. Postnatally acquired cytomegalovirus infection in extremely premature infants: how best to manage? Arch Dis Child Fetal Neonatal 2020; 105(3): 334−339.
14. Rawlinson WD, Boppana SB, Fowler KB, et al. Congenital cytomegalovirus infection in pregnancy and the neonate: consensus recommendations for prevention, diagnosis and therapy. The Lancet Infectious diseases 2017; 17(6): e177−e188.
15. Boppana SB, Ross SA, Novak Z, et al. Dried blood spot real - time polymerase chain reaction assays to screen newborns for congenital cytomegalovirus infection. JAMA 2010; 303(14): 1375−1382.
16. Ross SA, Ahmed A, Palmer AL, et al. Newborn dried blood spot polymerase chain reaction to identify infants with congenital cytomegalovirus - associated sensorineural hearing loss. The Journal of pediatrics 2017; 184 : 57−61.e1.
17. Smiljkovic M, Le Meur JB, Malette B, et al. Blood viral load in the diagnostic workup of congenital cytomegalovirus infection. Journal of clinical virology (the official publication of the Pan American Society for Clinical Virology) 2020; 122 : 104231.
18. Kimberlin DW, Jester PM, Sanchez PJ, et al. Valganciclovir for symptomatic congenital cytomegalovirus disease. N Engl J Med 2015; 372(10): 933−943.
19. Bilavsky E, Shahar-Nissan K, Pardo J, et al. Hearing outcome of infants with congenital cytomegalovirus and hearing impairment. Archives of disease in childhood 2016; 101(5): 433−438.
20. Gwee A, Curtis N, Connell TG, et al. Ganciclovir for the treatment of congenital cytomegalovirus: what are the side effects? Pediatr Infect Dis J 2014; 33(1): 115.
21. Revello MG, Tibaldi C, Masuelli G, et al. Prevention of primary cytomegalovirus infection in pregnancy. EBioMedicine 2015; 2(9): 1205−1210.
22. Khalil A, Jones C, Ville Y. Congenital cytomegalovirus infection: management update. Curr Opin Infect Dis 2017; 30(3): 274−280.
23. Zammarchi L, Lazzarotto T, Andreoni M, et al. Management of cytomegalovirus infection in pregnancy: is it time for valacyclovir? Clin Microbiol Infect 2020; 26(9): 1151−1154.
24. Bardanzellu F, Fanos V, Reali A. Human breast milk-acquired cytomegalovirus infection: certainties, doubts and perspectives. Curr Pediatr Rev 2019; 15(1): 30−41.
25. Garofoli F, Civardi E, Zanette S, et al. Literature review and an italian hospital experience about post-natal CMV infection acquired by breast-feeding in very low and/or extremely low birth weight infants. Nutrients 2021; 13(2).
26. Schleiss MR, Bierle CJ, Swanson EC, et al. Vaccination with a live attenuated cytomegalovirus devoid of a protein kinase r inhibitory gene results in reduced maternal viremia and improved pregnancy outcome in a guinea pig congenital infection model. J Virol 2015; 89(19): 9727−9738.
Labels
Neonatology Neonatal Nurse
Article was published inCzech and Slovak Neonatology

2022 Issue 2-
All articles in this issue
- EDITORIAL
- Streptococcus agalactiae v neonatologii
- Celoplošný screening sluchu novorozenců v České republice – databáze a nová metodika
- Screening novorozenecké glykemie a jeho úskalí
- Vliv léčby matky SSRI/SNRI v graviditě na poporodní adaptaci donošeného novorozence
- Hyperbilirubinemie – čas na změnu?
- Kojení v České republice v roce 2020
- Kongenitální a postnatální cytomegalovirové infekce
- Kongenitální toxoplazmóza jako součást neonatologické problematiky
- Problematika plánovaných domácích porodů z pohledu neonatologa
- Hmotnostní úbytek donošeného fyziologického novorozence
- Adnátní streptokoková infekce jako stále aktuální téma
- Czech and Slovak Neonatology
- Journal archive
- Current issue
- Online only
- About the journal
Most read in this issue- Hyperbilirubinemie – čas na změnu?
- Screening novorozenecké glykemie a jeho úskalí
- Hmotnostní úbytek donošeného fyziologického novorozence
- Streptococcus agalactiae v neonatologii
Login#ADS_BOTTOM_SCRIPTS#Forgotten passwordEnter the email address that you registered with. We will send you instructions on how to set a new password.
- Career

