-
Medical journals
- Career
Metabolizmus vápníku a jeho poruchy: hyperkalcemie a hypokalcemie
Authors: Tenčíková Alexandra
Authors‘ workplace: III. Interní klinika – nefrologická, revmatologická a endokrinologická, LF UP a FN Olomouc
Published in: Clinical Osteology 2023; 28(4): 125-132
Category:
Overview
Vápník (Ca2+) je jeden z nejvýznamnějších iontů v těle. Zajišťuje řadu funkcí, jako je proces kostní mineralizace, hemokoagulace, nervosvalový přenos, svalová kontrakce, přenos intracelulárních dějů a aktivace enzymů. V lidském těle se vyskytuje především extracelulárně a jeho největší zastoupení (přibližně 99%) je v kostech a zubech ve formě hydroxyapatitu. V krvi se nachází ve formě volné (ionizované), vázané na proteiny (především albumin) a vázané v komplexech. Hladina celkového vápníku je tedy závislá na hladině albuminu, proto je při jeho abnormální hladině preferováno stanovení ionizovaného vápníku, nebo korigování koncentrace vápníku dle koncentrace albuminu v séru. Hormonální regulace je zprostředkována parathormonem (PTH) a kalcitriolem. Kalcitonin hraje minoritní roli v metabolizmu vápníku, chrání tělo zejména před náhlým zvýšení kalcemie a na významu nabývá v období gravidity a laktace. Metabolizmus vápníku je úzce propojen s metabolizmem fosfátů a magnezia a je závislý na střevní absorpci, kostní remodelaci a renální reabsorpci. Poruchy metabolizmu vápníku vycházejí z poruch všech těchto regulačních mechanizmů. Přehledový článek shrnuje poznatky o metabolizmu vápníku a zaměřuje se na stavy vedoucí k hyperkalcemii a hypokalcemii.
Metabolizmus vápníku
Vápník je jeden z nejvýznamnějších prvků v lidském těle a podílí se na řadě funkcí, jako je proces kostní mineralizace, nervosvalový přenos, svalová kontrakce, hemokoagulace, přenos intracelulárních dějů a aktivace enzymů. Lidské tělo obsahuje přibližně 1 000–1 300 g vápníku. Vápník je uložen především v kostech a zubech ve formě hydroxyapatitu (99,3 %), v měkkých tkáních (0,6 %) a v extracelulární tekutině (0,1 %). Právě intracelulární hladina vápníku je zásadní pro fungování nervosvalového přenosu, svalovou kontrakci a hemokoagulaci [1,2].
Celkový vápník v séru představuje součet vápníku ionizovaného (48 %), vápníku vázaného na proteiny, především albuminu (45 %) a vápníku vázaného v komplexech (7 %). Hladina celkového vápníku v séru je tedy ovlivněna sérovou hladinou albuminu. V případech, v nichž je hladina albuminu abnormální, je preferováno stanovení ionizovaného vápníku, nebo je potřeba korigovat koncentraci vápníku v séru dle koncentrace albuminu. Při hyperalbuminemii je falešně zvýšená hladina celkového vápníku a frakce ionizovaného vápníku klesá, a naopak při hypoalbuminemii je hladina celkového vápníku falešně snížená, ale hladina ionizovaného vápníku se nemění. I poruchy acidobazické rovnováhy (ABR) ovlivňují vazbu na albumin, a tím mění frakci ionizovaného kalcia. Alkalóza snižuje a acidóza zvyšuje ionizované kalcium [1,2].
Vstřebávání vápníku je zajištěno dvěma procesy. Transcelulární transport představuje aktivní přenos, který je saturovatelný a řízený kalcitriolem. Paracelulární transport je proces pasivní difuze. Aktivní transport se nachází hlavně v duodenu, jejunu, méně v tlustém střevě a chybí v ileu. Pasivní transport se nachází ve všech částech střeva. Pokud přijímáme v potravě málo vápníku, dominuje vstřebávání aktivní, naopak při vysoce kalciové dietě převažuje transport pasivní [3]. Vstřebávání vápníku je ovlivněno několika faktory, které jsou uvedeny v tab. 1. Je třeba připomenout, že již od 12. týdne těhotenství se u matky zdvojnásobuje vstřebávání vápníku, aby byly pokryty potřeby pro plod, avšak po porodu absorpce klesá na původní hodnotu [4]. Vstřebávání kalcia je také zvýšeno v období růstu v dětství a adolescenci [1]. Z denního příjmu vápníku 1 000 mg je vstřebáno 400 mg tenkým střevem, okolo 200 mg je vyloučeno střevní sekrecí, což znamená, že čistá absorpce je 200 mg (zhruba 20 %) a celkově je 800 mg vyloučeno stolicí. Přibližně 500 mg vápníku je denně směněno mezi kostí a extracelulární tekutinou [2].
Ledviny zpětně vstřebávají až 98 % vápníku. I zpětná reabsorpce vápníku ledvinami je ovlivněna několika faktory. Mezi faktory zvyšující vylučování kalcia řadíme kofein, alkohol, glukokortikoidy, metabolickou i respirační acidózu, kličková diuretika, renální tubulární acidózu nebo imobilizaci. Faktory podporující zpětné vstřebávání kalcia jsou tiazidová diuretika, kalcitriol a parathormon [1,2].
Hormonální regulace
Kalcium senzitivní receptor (CaSR) se řadí mezi G-proteiny, nacházející se na povrchu buněk a velmi citlivě detekuje hladinu kalcemie. Reguluje tak sekreci PTH, reabsorpci kalcia v distálním tubulu a ve štítné žláze kontroluje sekreci kalcitoninu [1]. Kalcemie je regulována nejenom hormonální cestou, tedy prostřednictvím PTH, kalcitriolu a kalcitoninu, ale i nehormonální cestou, jež představuje rychle směnitelnou cestu, jak upravit kalcemii, jedná se o vápník vázaný na proteiny a vápník v kostech [5].
PTH je hlavní kalcitropní hormon. Má hyperkalcemizující a fosfaturické účinky. Zvyšuje kalcemii tím, že zvyšuje reabsorpci vápníku v distálním tubulu a zvyšuje aktivitu 1α-hydroxylázy, což vede ke zvýšenému vstřebávání vápníku ve střevě. Jeho kontinuální působení v kostech vede ke zvýšené osteoklastické resorpci, respektive zvyšuje expresi RANKL (Receptor Activator of Nuclear factor Kappa beta/ligand pro receptor aktivující jaderný faktor κB) [1,6].
Kalcitriol ovlivňuje vstřebávání vápníku jednak genomickou cestou, tedy podporuje transkripci genů pro vitamin D receptor (VDR), kalbindin, kalmodulin a jiné proteiny podílející se na transportu kalcia, jednak negenomickou cestou, tedy zvyšuje fluiditu membrány pro kalcium. Mimoto kalcitriol podporuje vstřebávání fosforu i magnezia [7].
Kalcitonin je antagonistou parathormonu a má hypokalcemizující, ale také fosfaturické účinky. Zvyšuje renální exkreci vápníku i fosforu a tlumí vstřebávání vápníku tím, že tlumí sekreci žaludečních šťáv. Kalcitonin má mírné antiresorpční účinky. Jeho receptory se nacházejí na osteoklastech a inhibuje jejich funkci. Kalcitonin se řadí mezi neuropeptidy a mezi jeho účinky patří i analgetický účinek cestou zvýšení hladin β-endorfinů, tohoto účinku se terapeuticky využívalo u stavů spojených s bolestí (například komplexní regionální bolestivý syndrom). Zásadní význam spočívá v ochraně těla před náhlým zvýšením kalcemie. Jeho nedostatek (po totální tyreoidektomii) nevede k hyperkalcemii a chronický nadbytek (např. u medulárního karcinomu štítné žlázy nebo ektopické produkci kalcitoninu u karcinomu plic nebo prsou) nevede k hypokalcemii. Na významu nabývá v období gravidity, laktace a intrauterinního vývoje, v nichž jsou jeho hladiny zvýšeny, a chrání tak kosti před ztrátou vápníku [1].
Považuji za důležité zmínit i fosfaturický hormon neboli fibroblastový růstový faktor 23 (FGF23), dříve nazývaný fosfatonin, protože hraje zásadní roli v kalciofosfátovém metabolizmu. Stimulem pro jeho tvorbu je hyperfosfatemie nebo zvýšení hladiny kalcitriolu. Je syntetizován v osteocytech a osteoblastech a působí především v ledvinách a příštítných tělískách. Jeho vazba na receptor fibroblastového růstového faktoru 1 (Fibroblast Growth Factor Receptor 1 - FGFR1) je slabá a k úplnému účinku potřebuje koreceptor Klotho, který tuto vazbu posílí. FGF 23 snižuje zpětnou reabsorpci fosfátů v proximálním tubulu, snižuje aktivitu 1α-hydroxylázy, a navíc snižuje tvorbu parathormonu, což má za následek pokles fosfatemie. Tito pacienti mívají normální nebo snížené hladiny kalcitriolu a k poklesu kalcemie nedochází. V praxi lze FGF23 využít jako marker mortality u pacientů s chronickým onemocněním ledvin, především hemodialyzovaných. Nadbytek FGF23 působí kardiotoxicky a vede k hypertrofii levé komory.
Table 1. Faktory ovlivňující vstřebávání kalcia střevem 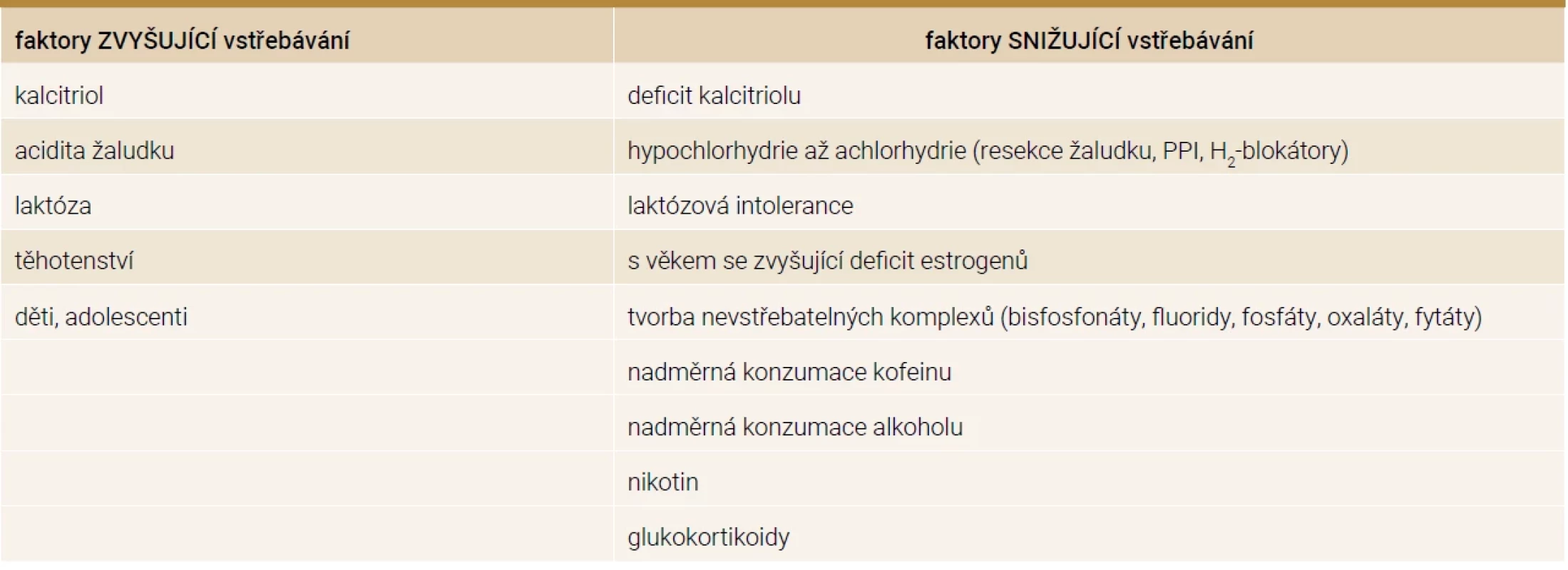
H2-blokátor – blokátor receptoru pro histamin 2. typu PPI – inhibitory protonové pumpy Výčet stavů se zvýšenými hladinami FGF23 je uveden v tab. 2 [8].
Poruchy metabolizmu vápníku a jejich diagnostika
Poruchy metabolizmu vápníku vycházejí především z poruch regulačních mechanizmů, jako jsou poruchy v oblasti trávící soustavy, kostí, příštítných tělísek, dále pak z poruch metabolizmu vitaminu D, kalcitoninu, VDR či CaSR. Poruchy FGF23 nevedou k poruše metabolizmu vápníku, ale poruše metabolizmu fosfátu.
Diagnostika se opírá o stanovení hodnot celkového vápníku a albuminu v séru, v případě abnormálních hodnot albuminu stanovujeme hodnoty ionizovaného vápníku nebo vápníku korigovaného na albumin [9]. Při podezření na poruchu acidobazické rovnováhy stanovujeme pH krve [10]. Současně stanovujeme hladiny magnezia a fosforu v séru. V moči stanovujeme koncentraci a odpady zmíněných iontů. Současně stanovujeme hladiny regulačních hormonů, především parathormonu, kalcidiolu (25OHD), případně kalcitoninu, FGF23 a kalcitriolu (1,25 (OH)2 D) [9]. Základní odběry doplníme o krevní obraz, vyšetření alkalické fosfatázy (ALP) a ledvinné parametry. Další vyšetření indikujeme podle možné etiologie [10].
Table 2. Stavy se zvýšenými hladinami FGF23 
AD – autosomálně dominantní AR – autosomálně recesivní CKD-MBD – Chronic Kidney Disease-Mineral and Bone Disorder/kostní a minerálová porucha při chronických onemocněních ledvin DMP1 – dentin matrix protein 1 PHEX – Phosphate-regulating gene with Homologies to Endopeptidases on the X chromosome Hyperkalcemie a její projevy
Hyperkalcemie je definována jako zvýšená hladina celkového sérového vápníku nad normální hodnotu deklarovanou užitou laboratoří (ve většině případů > 2,65 mmol/l) při normální hladině albuminu [1]. Těžká nebo rychle vzniklá hyperkalcemie je život ohrožující stav.
Hlavní příznaky hyperkalcemie zahrnují anxietu, kognitivní deficit, změny v chování, svalové slabosti a bolesti, obstipaci, zvracení, nauzeu, dehydrataci, polyurii, polydipsii, akutní renální selhání, zkrácení QTc a v nejhorším případě zástavu srdce v systole. Důsledky dlouhotrvající hyperkalcemie jsou kalcifikace cév s rozvojem aterosklerózy a arteriální hypertenze, nefrolitiáza a nefrokalcinóza. Při hyperkalcemii může dojít k rozvoji peptického vředu z důsledku nadměrné aktivace gastrinu a k rozvoji akutní pankreatitidy v důsledku nadprodukce trypsinogenu. Patrný je častější výskyt krystalových artropatií, jako je dna nebo nemoc z ukládání krystalů kalcium pyrofosfát dihydrátu [11,12].
Až 90 % hyperkalcemií je způsobeno buď primární hyperparatyreózou (PHPT) nebo malignitou. Při opakované zvýšené hladině kalcia společně se zvýšenou hladinou parathormonu prvně pomyslíme na primární nebo terciární hyperparatyreózu a vyloučíme familiární hypokalciurickou hyperkalcemii. V těchto případech bývá hyperkalcemie mírnější a častěji asymptomatická oproti maligní hyperkalcemii, u které bývají hodnoty > 3,0 mmol/l a jsou častěji symptomatické. Terciární hyperparatyreóza se objevuje nejčastěji při chronickém onemocnění ledvin [1].
Primární hyperparatyreóza je definována jako konstantní hyperkalcemie s elevací hodnot parathormonu nebo nepřiměřeně normální hladinou parathormonu vzhledem k hyperkalcemii. Patofyziologickým podkladem je autonomní nadprodukce parathormonu s klonální dysregulací růstu paratyreoidey se společně sníženou expresí CaSR [13]. Příčinou nadprodukce parathormonu je adenom v 75–85 % případů, postižení více tělísek (multiglandular parathyroid disease), hyperplazie nebo vícečetné adenomy v 15–20 % případů a v méně než 1 % karcinom paratyreoidey [14]. Genetický podklad PHPT je patrný zhruba v 10 % případů. Řadíme sem mnohočetné endokrinní neoplázie (MEN-1, MEN-2A, MEN-4), syndrom hyperparatyreózy a tumorů čelisti (Hyperparathyroidism-Jaw Tumor – HPT-JT), familiární izolovanou hyperparatyreózu (FIHPT), těžkou neonatální hyperparatyreózu (Neonatal Severe Hyperparathyroidism – NSHPT) a familiární hypokalciurickou hyperkalcemii (FHH) [13]. FHH také nazývaná jako benigní FHH je projevem inaktivační mutace CaSR u heterozygotů. U homozygotů se projevuje jako NSHPT. Jsou popsány 3 subtypy FHH, přičemž většina případů je FHH1. Subtypy se liší postiženou doménou CaSR. FHH se typicky projevuje celoživotní hyperkalcemií ≤ 3,0 mmol/l, nízkou exkrecí kalcia, často hypofosfatemií, ale hodnota parathormonu je normální až v 80 % případů [15]. K odlišení FHH využíváme výpočet frakční exkreci kalcia (FE Ca), u primární hyperparatyreózy by měla být FE Ca > 0,01 [14]. Nicméně někteří pacienti s PHPT se mohou také prezentovat nízkou exkrecí kalcia (např. pacienti s deficitem vitaminu D nebo renální insuficiencí). V těchto případech si můžeme pomoci genetickým testováním na mutace CaSR [16].
S maligní hyperkalcemií se setkáváme u pacientů s pokročilým nálezem onkologického onemocnění ve 20–30 % případů. Nacházíme ji jak u solidních tumorů, tak u hematologických malignit. Maligní hyperkalcemie je asociována s horší prognózou. Existuje několik cest vzniku maligní hyperkalcemie: prostřednictvím nadbytku PTHrP (Parathyroid Hormone-related Peptide/parathormonu podobný peptid, např. Grawitzův tumor, bronchiální tumor), nadbytku PTH (např. karcinom ovaria, tymom), nadbytku kalcitriolu (nádory s vlastní 1α-hydroxylázou, např. Hodgkinův lymfom) a poslední cesta je prostřednictvím nádorových cytokinů vedoucích ke zvýšené expresi RANKL (např. osteolytické metastázy u karcinomu prsou nebo myelom). Za přibližně 80 % maligních hyperkalcemií stojí ektopická produkce PTHrP a za přibližně 20 % stojí osteolytické metastázy, ostatní příčiny jsou velmi vzácné [1,17].
Mezi další příčiny hyperkalcemie řadíme intoxikaci vitaminem D, granulomatózní onemocnění způsobené zvýšenou aktivitou 1α-hydroxylázy (např. sarkoidóza, TBC, syfilis). Hyperkalcemii způsobenou z nadměrného požití mléčných výrobků nebo nadužíváním antacid nazýváme milk-alkali syndrom. Stavy s vyšším kostním obratem, respektive s převahou vyšší kostní resorpce, mohou vést k hyperkalcemii. Mezi takové stavy řadíme hypertyreózu, imobilizaci, intoxikaci vitaminem A, feochromocytom a akromegalii [1,2]. Na tomto místě je důležité připomenout, že konzumace provitaminů vitaminu A rostlinného původu (karotenoidů) je neškodná, ale nadměrné užití aktivního vitaminu A, často ve volně prodejných preparátech, může působit toxicky a způsobit nadměrnou resorpci kosti [18].
U dětí bychom neměli zapomenout na perinatální nebo infantilní formu hypofosfatazie, která může být spojena s hyperkalcemií a sekundární hypoparatyreózou, avšak dominujícím nálezem je nízká hladina ALP [19]. Například v recentní retrospektivní studii Whytea et al 2019 mělo hyperkalcemii 14 z 21 dětí s perinatální a infantilní hypofosfatázií [20]. Projevy zahrnují křivici, hypomineralizaci skeletu, fraktury a předčasnou ztrátu dočasných zubů [21]. Mezi další vzácnější jednotky patří tranzitorní neonatální hyperparatyreóza, idiopatická infantilní hyperkalcemie (IIH), Bartterův syndrom typu 1 (neonatální forma), Jansenova metafyzární chondrodysplazie, Williamsův-Beurenův nebo Downův syndrom, jak je uvedeno v tab. 3 [6].
Table 3. Etiologie hyperkalcemie 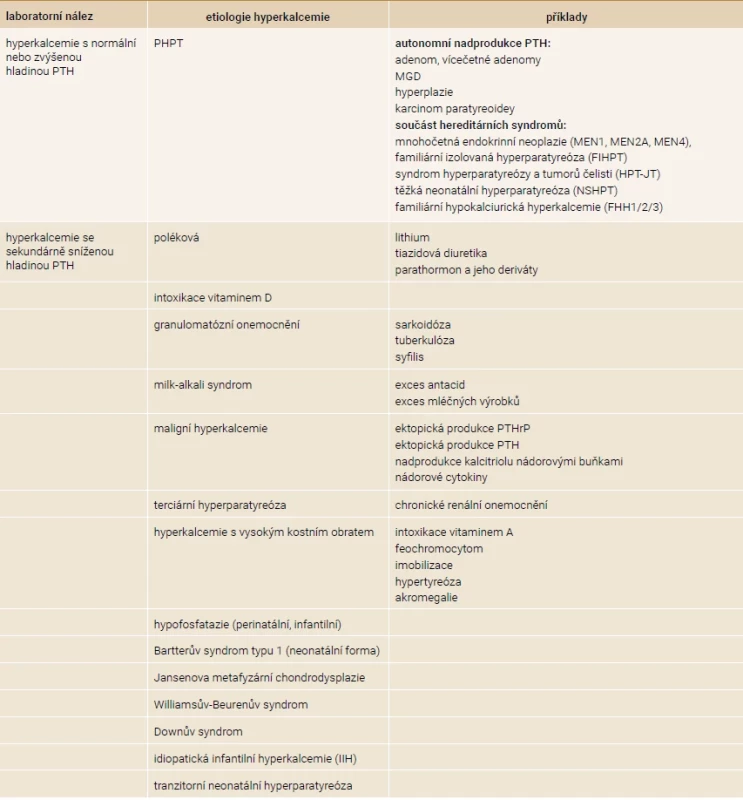
MGD – MultiGlandular parathyroid Disease/postižení více tělísek PTHrP – parathyroid hormone-related peptide/parathormonu podobný peptid PTH – parathormon Table 4. Etiologie hypokalcemie 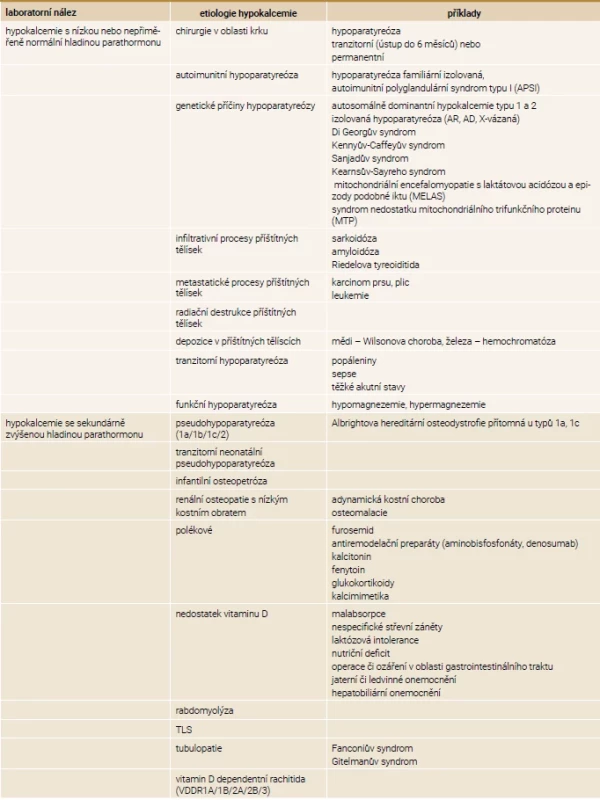
AD – autosomálně dominantní AR – autosomálně recesivní TLS – tumor lysis syndrom/syndrom nádorového rozpadu Hypokalcemie a její projevy
Hypokalcemie je definována jako koncentrace celkového kalcia v séru pod normální referenční mezí, ve většině laboratoří je to hodnota < 2,25 mmol/l při normální hladině albuminu [1].
Klinický obraz akutní hypokalcemie představuje tetanii (pozitivní Chvostkův nebo Trousseaův příznak), jež zahrnuje parestezii, myalgii, svalové křeče, laryngospazmus, brochospazmus a hyperventilační tetanií. Mezi další projevy mohou být prodloužení QTc, AV-blokády, apatie a letargie [10]. Mezi známky chronické hypokalcemie vznikající v důsledku zvýšeného kalciofosfátového součinu řadíme ektopické kalcifikace (např. v bazálních gangliích, kůži a cévách). Může se vyskytovat katarakta nebo zubní abnormality [1]. Vážnou, avšak raritní komplikací hypokalcemie je hypokinetická dilatační kardiomyopatie, která je potenciálně reverzibilní po zajištění adekvátní léčby [22]. Další projevy jsou odvislé od etiologie hypokalcemie.
Prvním krokem při diferenciální diagnostice hypokalcemie je stanovení hladiny PTH. Pokud je nízká, napovídá nám, že jsou postižena příštítná tělíska. Pokud je naopak hladina PTH zvýšená, jedná se o jeho sekundární zvýšení. V prvním případě se nejčastěji jedná o pooperační hypoparatyreózu (až v 75 % případů), a buď dojde k úpravě do 6 měsíců (tranzitorní hypoparatyreóza), nebo nikoli (permanentní hypoparatyreóza) [14].
Další skupinou jsou hypoparatyreózy vznikající na autoimunitním podkladě s tvorbou aktivujících protilátek proti CaSR nebo jako součást autoimunitního polyglandulárního syndromu typu 1 (APS1, společně s kandidózou a Addisonovou chorobou) projevující se již během dětství. Mezi genetické příčiny hypoparatyreózy se řadí aktivační mutace CaSR nazývající se autosomálně dominantní hypokalcemie typu 1 a typu 2 (ADH1/2), jež se liší postiženou doménou CaSR. U ADH vídáme supresi parathormonu s hyperkalciurií, hypokalcemií, hyperfosfatemií a hypomagnezemií. Další genetickou poruchou je Di Georgův syndrom zahrnující hypoparatyreózu s hypokalcemií, hypoplazií až agenezí tymu s imunitním deficitem a vrozenou vývojovou vadou srdce [1,14,23,24].
Při hypokalcemii se sekundárně zvýšenou hladinou parathormonu, a je-li pacientem dítě, velmi pravděpodobně se jedná o pseudohypoparatyreózu (PHP). Toto dědičné onemocnění je charakteristické rezistencí nebo špatnou odpovědí cílových orgánů na parathormon, ale i na jiné hormony, jako je tyreotropní hormon nebo pohlavní hormony. V projevech napodobuje hypoparatyreózu, ale hladina parathormonu je zvýšená. Je popsáno několik typů PHP (1a, 1b, 1c a 2). Mezi typem 1 a 2 je rozdíl v odlišné odpovědi cAMP (cyklický adenozin-monofosfát) na podání parathormonu. U PHP 1 dochází k jeho snížení, oproti tomu u PHP 2 je cAMP v normální hodnotě. Mutace GNAS1 (kódující alfa podjednotku G-proteinu, jež má klíčovou roli v přenosu intracelulárních dějů) je přítomna u typu 1a, 1b a pseudohypoparatyreózy (PPHP). Podtypy 1a, 1c jsou charakterizovány generalizovanou rezistencí hormonů, kdežto u subtypu 1b je rezistence omezená pouze na parathormon v ledvinách. Postižení s typem PHP 1a, 1c a s PPHP mají přítomný typický fenotyp nazývaný Albrightova hereditární osteodystrofie (AHO). Pacienti s PPHP mají normální hladiny vápníku i parathormonu [25,26]. Typickými projevy AHO jsou malá postava, kulatý obličej, obezita, kožní a podkožní kalcifikace, zkrácení IV. nebo V. metakarpů a metatarzů [23]. Tranzitorní neonatální pseudohypoparatyreóza představuje přechodnou rezistenci cílových tkání vůči parathormonu pro nevyzrálost receptoru u nezralých novorozenců [27].
Infantilní „maligní“ osteopetróza je vzácné dědičné onemocnění, autosomálně recesivní, jež je způsobeno mutací chloridového kanálu CLCN7, RANK nebo RANKL vedoucí k neschopnosti osteoklastu resorbovat kost. Kosti jsou hutné, sklerotizované, a dřeňová dutina se tak zmenšuje, což může vést k pancytopenii s rozvojem extramedulární hematopoézy. V důsledku nefungující remodelace se vyvíjí hypokalcemie, která může být závažná, ale může i chybět [23,28,29].
Vitamin D dependentní rachitidy (VDDR) vedou jak k hypokalcemii, tak k hypofosfatemii. VDDR1A je způsobena mutací pro 1α-hydroxylázu a je přítomen deficit kalcitriolu. U VDDR1B je přítomna mutace pro 25-hydroxylázu, chybí tedy jak kalcidiol, tak kalcitriol. VDDR2A je způsobena inaktivační mutací pro VDR, což má za následek rezistenci cílových tkání na vitamin D a přibližně 50 % pacientů má alopecii, která se vyvíjí později po narození v důsledku narušeného cyklu vlasového folikulu. Doposud nebyl objeven gen, který zapříčiňuje VDDR2B, jisté ale je, že v mnoha případech se jedná o poruchu převodních proteinů. U obou variant jsou hladiny kalcidiolu i kalcitriolu normální nebo zvýšené. Pro VDDR3 je typická aktivační mutace CYP3A4, která vede ke zvýšené degradaci vitaminu D. Při laboratorním vyšetření je patrný pokles kacidiolu i kalcitriolu [30]. Další stavy vedoucí k hypokalcemii jsou rabdomyolýza a syndrom nádorového rozpadu vznikající v důsledku zvýšení nabídky fosfátů. Ostatní stavy jsou uvedeny v tab. 4 [2].
Závěr
Lze konstatovat, že výčet stavů, které vedou k rozvratu kalciové homeostázy je poměrně rozsáhlý a je třeba mít na paměti, že stanovení hodnoty celkového vápníku při abnormální hladině albuminu nebo poruše ABR nás může uvést v omyl. V takových případech je nutné zjistit hodnotu ionizovaného vápníku. Homeostáza vápníku je závislá na střevní absorpci, kostní remodelaci a renální reabsorpci. Tyto procesy jsou hormonálně regulovány především parathormonem, kalcitriolem a minoritně kalcitoninem a FGF23. Při podezření na poruchu kalciové homeostázy je nutné současně s vápníkem stanovit hladinu fosforu a magnezia v séru, odpady a koncentrace těchto iontů v moči a současně stanovit hodnotu parathormonu, kalcidiolu, případně kalcitriolu. Mezi nejčastější příčiny hyperkalcemie u dospělých patří nepochybně primární hyperparatyreóza a maligní hyperkalcemie jako projev paraneoplastického syndromu. Hypokalcemii u dospělých zjišťujeme nejčastěji při deficitu vitamin D nebo u hypoparatyreózy, včetně hypomagnezemie. U novorozenců a dětí musíme při diferenciální diagnostice hyperkalcemie a hypokalcemie myslet i na vzácné dědičné jednotky. Rozsah klinických projevů hypokalcemie i hyperkalcemie je individuální a nemusí nutně korelovat s hladinami vápníku. Nadto jsou projevy závislé také na etiologii hyperkalcemie a hypokalcemie.
MUDr. Alexandra Tenčíková | alex.tencikova@gmail.com | www.3ik.fnol.cz
Sources
- Broulík P. Onemocnění způsobená poruchami kalciofosfátového metabolismu. Jessenius. Maxdorf: Praha 2017. ISBN 978–80–7345–523–1.
- Tinawi M. Disorders of Calcium Metabolism: Hypocalcemia and Hypercalcemia. Cureus 2021; 13(1): e12420. Dostupné z DOI: <http://dx.doi.org/10.7759/cureus.12420>.
- Fleet JC. Vitamin D-Mediated Regulation of Intestinal Calcium Absorption. Nutrients 2022; 14(16): 3351. Dostupné z DOI: <http://dx.doi.org/10.3390/nu14163351>.
- Kovacs CS. Calcium and Phosphate Metabolism and Related Disorders During Pregnancy and Lactation. [Updated 2021 Aug 1]. In: Feingold KR, Anawalt B, Blackman MR et al (eds). Endotext [Internet]. South Dartmouth (MA): MDText.com, Inc.; 2000. Dostupné z WWW: <https://www.ncbi.nlm.nih.gov/books/NBK279173/>.
- Goyal A, Anastasopoulou C, Ngu M et al. Hypocalcemia 2023. In: StatPearls [Internet]. Treasure Island (FL): StatPearls Publishing 2023. Dostupné z WWW: <https://www.ncbi.nlm.nih.gov/books/NBK430912/>.
- Stokes VJ, Nielsen MF, Hannan FM et al. Hypercalcemic Disorders in Children. J Bone Miner Res 2017; 32(11): 2157–2170. Dostupné z DOI: <http://dx.doi.org/10.1002/jbmr.3296>.
- Bikle DD. Vitamin D: Production, Metabolism and Mechanisms of Action. [Updated 2021 Dec 31]. In: Feingold KR, Anawalt B, Blackman MR et al. Dostupné z WWW: <https://www.ncbi.nlm.nih.gov/books/NBK278935/>.
- Kurpas A, Supeł K, Idzikowska K et al. FGF23: A Review of Its Role in Mineral Metabolism and Renal and Cardiovascular Disease. Dis Markers 2021; 2021 : 8821292. Dostupné z DOI: <http://dx.doi.org/10.1155/2021/8821292>.
- Jenšovský J, Džupa V (eds). Diagnostika a léčba osteoporózy a dalších onemocnění skeletu. Univerzita Karlova – Nakladatelství Karolinum: Praha 2018. ISBN 978–80–246–3741–9.
- Fong J, Khan A. Hypocalcemia: updates in diagnosis and management for primary care. Can Fam Physician 2012; 58(2): 158–162.
- Žofková I. Osteologie a kalcium-fosfátový metabolizmus: aktuální témata. Grada: Praha 2012. ISBN 978–80–247–3919–9.
- Tonon CR, Silva TAAL, Pereira FWL et al. A Review of Current Clinical Concepts in the Pathophysiology, Etiology, Diagnosis, and Management of Hypercalcemia. Med Sci Monit 2022; 28: e935821. Dostupné z DOI: <http://dx.doi.org/10.12659/MSM.935821>.
- Minisola S, Arnold A, Belaya Z et al. Epidemiology, Pathophysiology, and Genetics of Primary Hyperparathyroidism. J Bone Miner Res 2022; 37(11): 2315–2329. Dostupné z DOI: <http://dx.doi.org/10.1002/jbmr.4665>.
- Kršek M, Čáp J, Šumník Z et al. Doporučený postup České endokrinologické společnosti pro diagnostiku a léčbu primární hyperparathyreózy a hypoparathyreózy. Vnitř Lék 2021; 67(Suppl A).
- Lee JY, Shoback DM. Familial hypocalciuric hypercalcemia and related disorders. Best Pract Res Clin Endocrinol Metab 2018; 32(5): 609–619. Dostupné z DOI: <http://dx.doi.org/10.1016/j.beem.2018.05.004>.
- Gorvin CM. The Importance of Functionally Characterizing Calcium-Sensing Receptor Variants in Individuals With Hypercalcemia. J Endocr Soc 2022; 6(6): bvac052. Dostupné z DOI: <http://dx.doi.org/10.1210/jendso/bvac052>
- Almuradova E, Cicin I. Cancer-related hypercalcemia and potential treatments. Front Endocrinol (Lausanne) 2023;14 : 1039490. Dostupné z DOI: <http://dx.doi.org/10.3389/fendo.2023.1039490>.
- Borgan SM, Khan LZ, Makin V. Hypercalcemia and vitamin A: A vitamin to keep in mind. Cleve Clin J Med 2022; 89(2): 99–105. Dostupné z DOI: <http://dx.doi.org/10.3949/ccjm.89a.21056>.
- Šumník Z, Souček O, Lebl J. Hypofosfatázie: Kdy na ni myslet a jak ji léčit. Pediatr praxi 2016;17(3): 146–149.
- Whyte MP, Leung E, Wilcox WR et al. [Study 011–10 Investigators]. Natural History of Perinatal and Infantile Hypophosphatasia: A Retrospective Study. J Pediatr 2019; 209 : 116–124.e4. Dostupné z DOI <http://dx.doi.org/10.1016/j.jpeds.2019.01.049>.
- Koberová Ivančaková R, Radochová V, Skálová S et al. Hypofosfatázie a X-vázaná hypofosfatemická křivice v dětském věku. LKS 2023; 33(12): 224–229.
- Mutlu U, Cakmak R, Sonsöz MR et al. A rare cause of dilated cardiomyopathy: hypocalcemia. Arch Endocrinol Metab 2022; 66(4): 582–586. Dostupné z DOI: <http://dx.doi.org/10.20945/2359–3997000000474>.
- Lebl J, Al Taji E, Koloušková S et al. Malý atlas dětské endokrinologie. Galén: Praha 2013. ISBN 978–80–7492–065–3.
- Gorvin CM, Stokes VJ, Boon H et al. Activating Mutations of the G-protein Subunit α 1 Interdomain Interface Cause Autosomal Dominant Hypocalcemia Type 2. J Clin Endocrinol Metab 2020; 105(3): 952–963. Dostupné z DOI: <http://dx.doi.org/10.1210/clinem/dgz251>.
- Ucciferro P, Anastasopoulou C. Pseudohypoparathyroidism. [Updated 2023 Sep 4]. In: StatPearls [Internet]. Treasure Island (FL): StatPearls Publishing; 2023. Dostupné z WWW: <https://www.ncbi.nlm.nih.gov/books/NBK547709/>.
- Sarathi V, Wadhwa R. Albright Hereditary Osteodystrophy. [Updated 2023 Jun 26]. In: StatPearls [Internet]. Treasure Island (FL): StatPearls Publishing; 2023. Dostupné z WWW: <https://www.ncbi.nlm.nih.gov/books/NBK559141/>
- Vracovská M, Kutílek Š, Pikner R. Novorozenecká hypokalcémie – tranzitorní neonatální pseudohypoparathyreóza. Čes-Slov Pediat 2017; 72(2): 132–136. Dostupné z DOI: <https://doi.org/10.55095/CSPediatrie2023/044>.
- Sobacchi C, Villa A, Schulz A et al. CLCN7-Related Osteopetrosis 2007. [Updated 2022 Jan 20]. In: Adam MP, Feldman J, Mirzaa GM et al (eds). GeneReviews® [Internet]. Seattle (WA): University of Washington, Seattle: 1993–2023. Dostupné z WWW: <https://www.ncbi.nlm.nih.gov/books/NBK1127/>.
- Kutílek Š, Hála T. Syndrom osteopetrózy – rodina s mramorovými kostmi. Osteol Bull 2015; 20(3): 130–134.
- Levine MA. Diagnosis and Management of Vitamin D Dependent Rickets. Front Pediatr 2020; 8 : 315. Dostupné z DOI: <http://dx.doi.org/10.3389/fped.2020.00315>.
Labels
Clinical biochemistry Paediatric gynaecology Paediatric radiology Paediatric rheumatology Endocrinology Gynaecology and obstetrics Internal medicine Orthopaedics General practitioner for adults Radiodiagnostics Rehabilitation Rheumatology Traumatology Osteology
Article was published inClinical Osteology

2023 Issue 4
Most read in this issue- Calcium metabolism and its disorders: hypercalcemia and hypocalcemia
- Latest research and news in osteology
- Effect of toxic metals on the bone regeneration
- Effects of selected heavy metals on the metabolism and healing processes of craniofacial bones
Login#ADS_BOTTOM_SCRIPTS#Forgotten passwordEnter the email address that you registered with. We will send you instructions on how to set a new password.
- Career

