-
Medical journals
- Career
Úloha PD-1/PD-L1 signalizace v protinádorové imunitní odpovědi
Authors: P. Zatloukalová; M. Pjechová; S. Babčanová; T. R. Hupp; B. Vojtěšek
Authors‘ workplace: Regionální centrum aplikované molekulární onkologie, Masarykův onkologický ústav, Brno
Published in: Klin Onkol 2016; 29(Supplementum 4): 72-77
Category: Review
doi: https://doi.org/10.14735/amko20164S72Overview
Východiska:
Pro správnou funkci imunitního systému je důležitá souhra mezi inhibičními a stimulačními mechanizmy, které jednak chrání organizmus před cizorodými mikroorganizmy a látkami z vnějšího prostředí, ale také brání zdravou tkáň před případnými poškozujícími útoky imunitního systému. Inhibiční mechanizmy jsou tedy nepostradatelnou složkou imunitního systému podílející se na jeho správné funkci. Nádorové buňky však mohou inhibiční mechanizmy zneužít k úniku před imunitní reakcí a tím podpořit vznik a rozvoj nádorového onemocnění. Proto je tedy za jednu z charakteristik nádorových buněk považovaná schopnost vyhnout se imunitnímu dozoru. Imunoterapie je léčebným postupem, v průběhu kterého dochází ke stimulaci imunitního systému. Za efektivní a specifické imunoterapeutické cíle jsou považovány kontrolní body imunitní reakce. V posledních letech je značná pozornost věnována inhibiční dráze PD-1/PD-L1, tj. dráze programované buněčné smrti. Blokádou PD-1/PD-L1 dochází k utlumení inhibičního signálu, k obnovení účinnosti imunitních mechanizmů a ke zvýšení protinádorové aktivity. Protilátky blokující receptor PD-1 a jeho ligand PD-L1 jsou již poměrně úspěšně klinicky využívány. Přesto je stále velmi důležité vést výzkum se zaměřením na objasnění mechanizmu této dráhy, na nalezení faktorů významně ovlivňujících její aktivitu a na popis variability této dráhy vycházející z různorodosti nádorového prostředí. Získané výsledky lze poté využít k dosažení maximálního protinádorového účinku inhibicí osy PD-1/PD-L1.Cíl:
Cílem tohoto článku je shrnout dosavadní poznatky o PD-1/PD-L1 signální dráze a prodiskutovat její úlohu v protinádorové imunitní odpovědi.Klíčová slova:
dráha programované buněčné smrti – únikové mechanizmy nádorů – PD-1 – PD-L1 – CD274Úvod
Imunitní systém zajišťuje integritu organizmu tím, že jej chrání před patogenními organizmy a škodlivými látkami, rozpoznává vlastní tkáně, odstraňuje buňky staré, poškozené a nádorové. Veškeré děje probíhající v organizmu, vč. karcinogeneze, jsou pod neustálým imunitním dohledem. Imunitní systém potlačuje růst nádorových buněk především v počátečních fázích nádorové transformace. S rozvojem nádoru se mechanizmy imunitní reakce postupně vyčerpávají a nádorové buňky nasazují nástroje, kterými imunitní reakci samy účinně omezují. Imunitní systém je navíc ve vztahu k nádorovým buňkám v nevýhodě, a to z důvodu značné podobnosti nádorových buněk s normálními. Imunitní systém má tendenci nádorové buňky tolerovat jako buňky vlastní a tím snižuje svoji účinnost v boji proti nádorům. Pokud je ovšem abnormalita nádorových buněk rozpoznatelná, jsou do reakce zapojeny všechny mechanizmy přirozené (nespecifické) i adaptivní (antigenně specifické) imunity.
Nádorové buňky uplatňují řadu strategií, pomocí nichž se snaží uniknout kontrole imunitního systému. Nádorová buňka se především snaží zamaskovat svůj specifický nádorový antigen rozpoznatelný imunitním systémem. Imunogenicita (schopnost vyvolat imunitní odpověď) nádorových buněk je velmi účinně snižována mutacemi v genech kódujících nádorové antigeny, které mají za následek vznik variant imunitním systémem nerozpoznatelných. U řady nádorových buněk může pro změnu dojít k poklesu, nebo dokonce až ke ztrátě exprese MHC molekul (major histocompatibility complex – hlavní histokompatibilní komplex) nezbytných pro zviditelnění nádorových antigenů pro T lymfocyty a u některých nádorů dochází ke zvýšené produkci glykokalyxových molekul překrývajících nádorové antigeny [1].
Nádorové buňky jsou schopné ve svůj prospěch zneužívat také samotné buněčné složky imunitního systému. T lymfocyty se podílejí na rozpoznání a likvidaci patogenů a nádorových buněk, přičemž jejich aktivita je velmi přísně modulovaná pozitivními (kostimulačními) a negativními (inhibičními) regulačními signály. Aktivace „naivních“ T lymfocytů je zprostředkovaná přes TCR receptor interagující s antigenem navázaným na molekulu MHC v antigen prezentujících buňkách (APC) (obr. 1). Tento signál zajišťuje specificitu imunitní odpovědi, ale sám o sobě není k aktivaci T lymfocytů dostatečný. Druhý, tzv. kostimulační signál, je přenášen prostřednictvím kostimulační molekuly CD28 přítomné na povrchu T lymfocytů, která se váže na receptor B7 přítomný na APC. Kostimulační signál je na antigenu nezávislý, ale k aktivaci T lymfocytů je nezbytný. Nedostatečná síla kostimulačního signálu po setkání T lymfocytu s nádorovou buňkou způsobí „uspání“ neboli funkční inaktivitu, tzv. anergii. Proto jsou také kostimulační molekuly CD80 a CD86 exprimované nádorovými buňkami jen minimálně nebo vůbec [2]. Anergní T lymfocyty nemají schopnost produkovat aktivační cytokiny, což brání jejich dozrávání v buňky efektorové.
Rozsah imunitní reakce je závislý na interakci řady dalších receptorů a ligandů, které zesilují či tlumí procesy aktivace T lymfocytů. Významnou inhibiční dráhou navozující funkční inaktivitu lymfocytů je PD-1/PD-L1, která je považovaná za jeden z kontrolních bodů imunitního systému (checkpoint). Obecně tato dráha chrání organizmus před vznikem autoimunitních onemocnění, ale současně se může podílet na navození nádorové tolerance. Vznik nádorové tolerance je složitý a komplexní proces, který je často provázen dysbalancí mezi inhibičními a kostimulačními signály. Zvýšená aktivita inhibiční PD-1/PD-L1 dráhy může vyvolat funkční postižení efektorových T lymfocytů, a tím způsobit jejich „vyčerpání“ (exhausting). „Vyčerpané“ T lymfocyty nejsou schopné specifické cytotoxické odpovědi a destrukce cílových buněk [3]. K této T lymfocytární dysfunkci může docházet, kromě již zmíněných nádorových onemocnění, také u dlouhodobých infekcí a jejím typickým znakem je zvýšená exprese PD-1.
PD-1 receptor a jeho exprese
PD-1 je transmembránový glykoprotein typu I patřící do velké imunoglobulinové rodiny proteinů CD28/B7. PD-1 je tvořen transmembránovou hydrofobní doménou, na kterou je přes 20 aminokyselin dlouhý linker navázaná extracelulární IgV doména, která vykazuje 21–22% homologii s ostatními receptory rodiny CD28 [4]. Na vnitřní straně membrány se nachází intracelulární doména receptoru se dvěma konzervovanými tyrozinovými motivy – ITIM (immunoreceptor tyrosin-based inhibitory motif) neboli inhibiční motiv receptoru imunitního systému založený na tyrozinu – a ITSM (immunoreceptor tyrosin-based switch motif) neboli „přepínatelný“ motiv receptoru imunitního systému založený na tyrozinu. Inhibiční funkce PD-1 je vázaná především na ITSM motiv (TxYxxV/I) [5] a jeho významnost byla potvrzena nalezením mutace, která potlačila inhibiční schopnost PD-1. Naopak mutace v sekvenci ITIM funkci PD-1 neovlivnila a předpokládá se, že ITIM je pravděpodobně zapojen do jiných regulačních dějů nesouvisejících s aktivací T lymfocytů [5]. PD-1 se v membráně vyskytuje ve formě monomeru, a to z důvodu nepřítomnosti cysteinových zbytků, které by umožnily homodimerizaci.
PD-1 je kódován genem PDCD1 lokalizovaným na chromozomu 2 a obsahujícím pět exonů [6]. Je exprimován především na aktivovaných T a B lymfocytech, monocytech, NK buňkách, dendritických buňkách a na tumor infiltrujících lymfocytech [6]. K expresi PD-1 může také docházet na regulačních T lymfocytech (Treg), a to na membráně i v cytoplazmě [7]. V tomto případě není ovšem jasné, zda cytoplazmatický PD-1 uplatňuje své inhibiční vlastnosti [8]. V klidových imunitních buňkách byla pozorována jen minimální exprese PD-1. Po stimulaci T lymfocytů však byla významná hladina PD-1 detekována již po 2 hod a exprese PD-1 plynule stoupala v průběhu dalších 24 hod [9]. K silné expresi PD-1 dochází na „vyčerpaných“ inaktivních T lymfocytech při chronické virové infekci [3]. Přestože je PD-1 exprimován v celé řadě buněk imunitního systému, pravděpodobně nejdůležitější funkci zaujímá jako inhibiční receptor na T lymfocytech.
Ligandy PD-L1 a PD-L2 a jejich exprese
Mezi ligandy specificky se vázající na PD-1 patří PD-L1 (neboli B7-H1, CD274) a PD-L2 (neboli B7-DC, CD273). Jedná se o transmembránové glykoproteiny imunoglobulinové povahy mající ve své struktuře extracelulární domény IgC a IgV typické pro rodinu proteinů B7. Domény obsahují čtyři cysteinové zbytky, které vytvářejí disulfidické můstky stabilizující molekulu. Cytoplazmatická doména je tvořená řetězcem 30 aminokyselin a pravděpodobně není schopná dále přenášet signál po vazbě ligandu na PD-1.
Inhibiční role PD-L1 v imunitním systému byla objasněna u myší deficientních v PD-L1, u kterých se rozvinulo autoimunitní onemocnění [10]. Později bylo potvrzeno, že PD-1/PD-L1 interakce hraje významnou roli v potlačení imunitní odpovědi v nádorovém mikroprostředí [11,12]. Dalším interakčním partnerem PD-L1 je kostimulační molekula CD80 exprimovaná na aktivovaných T lymfocytech [13]. Jejich vzájemnou interakcí dochází k omezení funkce T lymfocytů a ke snížení produkce cytokinů [13]. Jakou měrou se na omezení imunitní odpovědi podílí interakce PD-L1 s PD-1 či CD80 není dosud známo [14]. Interakčním partnerem PD-L2 je kromě PD-1 také transmembránový receptor RGMb (repulsive guidance molecule b neboli Dragon). Funkce RGMb v rámci imunitního systému není doposud zcela objasněná. Bylo zjištěno, že interakce PD-L2/RGMb zvyšuje toleranci k patogenům, které proniknou do dýchacích cest [15].
Expresní profily PD-L1 a PD-L2 se výrazně liší, proto se předpokládá, že se každý účastní jiných procesů regulace imunitní odpovědi. PD-L2 je obvykle detekován ve velmi nízké hladině a jeho exprese je omezena na makrofágy a dendritické buňky. Předpokládá se, že hlavní funkcí PD-L2 je aktivace a polarizace T lymfocytů [16]. PD-L1 je exprimován zejména na T a B lymfocytech, dendritických buňkách a makrofázích. Exprese PD-L1 však byla zjištěna i v buňkách zdravé tkáně plic, jater, sleziny atd. [6], kde pravděpodobně přispívá k periferní toleranci [6]. Nádorové tkáně často vykazují zvýšenou hladinu PD-L1, který je většinou detekován v lokálně ohraničených oblastech na povrchu buněk [17] a pravděpodobně napomáhá vzniku nádorové tolerance. Zajímavý je příklad Hodgkinova lymfomu, který je charakterizován přítomností buněk Reedové-Sternberga vykazujících specifickou genovou aberaci, a to amplifikaci oblasti chromozomu 9p24.1, která je zodpovědná za zvýšenou produkci ligandů PD-L1 a PD-L2 [18]. Zvýšená hladina PD-L1 koreluje s nepříznivou prognózou onemocnění a exprese PD-L1 zvyšuje agresivitu a invazivitu nádorů [16].
Molekulární mechanizmus PD-1/PD-L1 signalizace
Pro aktivaci T lymfocytů je zásadní interakce TCR receptoru s antigenem navázaným na MHC molekulu APC za vzniku imunologické synapse. Jedná se o supramolekulární strukturu, jejíž součástí jsou kostimulační molekuly jako CD28, CD80/CD86 či CD40, ale i další adhezivní molekuly jako LFA-1 (lymphocyte function-associated antigen-1) či ICAM (intracellular adhesion molecule-1) zajišťující stabilitu komplexu. V případě interakce s inhibiční dráhou PD-1/PD-L1 dochází nejprve k vazbě PD-L1 na PD-1, k připojení k TCR synapsi a k defosforylaci CD3 a ZAP-70 molekuly TCR receptoru podílejících se na TCR signalizaci (obr. 1). Vazbou ligandu na PD-1 dochází současně k fosforylaci tyrozinu na ITSM motivu, čímž se aktivuje tyrozinová fosfatáza SHP-2 (Src homology 2 domain-containing tyrosine phosphatase 2) inhibující PI3K/Akt signální dráhu [6]. Oba výše zmíněné děje aktivují další mechanizmy vedoucí k omezení proliferace a k dysfunkci T lymfocytů.
Image 1. Molekulární mechanizmus PD-1/PD-L1 signalizace. Upraveno podle [34]. ![Molekulární mechanizmus PD-1/PD-L1 signalizace. Upraveno podle [34].](https://www.prolekare.cz/media/cache/resolve/media_object_image_small/media/image/e3ff3d1f0cdfced07d91a23181f8725e.jpg)
PD-1/PD-L1 dráha stimuluje apoptózu T lymfocytů (obr. 1). Za normálních podmínek kostimulační synapse podporuje expresi antiapoptotického Bcl-xL (B-cell lymphoma-extra large), jehož exprese je ale v nádorovém prostředí potlačená aktivitou PD-1/PD-L1. Tento proces byl potvrzen již dříve v rámci studií myších a lidských PD-L1+ buněk, u kterých byla apoptóza T lymfocytů potlačená protilátkou blokující PD-L1 [17,19].
Proliferace T lymfocytů může být dále omezena blokádou buněčného cyklu (obr. 1), kterou navozuje zvýšená aktivita transkripčního faktoru Smad3 (SMAD family member 3) blokujícího buněčný cyklus a degradace Cdc25A (M-phase inducer phosphatase 1), což je pro změnu aktivátor buněčného cyklu. Oba výše zmíněné faktory inhibují proliferaci T lymfocytů a oba jsou indukované PD-1/PD-L1 dráhou [20]. Ras (p21ras) je naopak faktorem stimulujícím buněčný cyklus, jehož exprese je vlivem PD-1/PD-L1 signalizace inhibována [20]. PD-1/PD-L1 dále inhibuje signální dráhu PI3K/Akt, která omezuje degradaci transkripčního faktoru FoxO1, který zpětně přispívá k expresi PD-1 a tím podporuje vznik „vyčerpaných“ T lymfocytů [21].
PD-1/PD-L1 signalizace ovlivňuje také metabolizmus T lymfocytů, a to inhibicí glykolýzy a metabolizmu aminokyselin a současně aktivací dějů vedoucích k oxidaci mastných kyselin [22].
Velmi důležitý je indukující vliv PD-1/PD-L1 dráhy na vývoj Treg, které se obecně podílejí na potlačení imunity tím, že omezují aktivitu efektorových T lymfocytů [23]. Přestože je role Treg v regulačních procesech imunitní odpovědi velmi komplexní a není dosud zcela objasněná, podařilo se inhibicí PD-1/PD-L1 dráhy buněk melanomu obnovit cytotoxické vlastnosti T lymfocytů a naopak potlačit tlumivou aktivitu Treg [24]. Stejný pozitivní účinek na vývoj Treg byl také pozorován u dendritických buněk exprimujících PD-1 [25].
Mechanizmy regulující expresi PD-L1 a PD-L2 v nádorových buňkách
Exprese PD-L1 je regulovaná signálními dráhami MAPK (mitogen-activated protein kinase, rodina serin/threonin kináz) a PI3K/Akt (phosphatidylinositol-3-kinase-Akt) (obr. 2), přičemž především abnormality na úrovni jednotlivých regulačních komponent mohou vést ke karcinogenezi. Podíl obou drah v procesu karcinogeneze se u jednotlivých nádorových onemocnění liší. Jednou z mutací vedoucí k aberantní aktivaci MAPK podílející se na zvýšené proliferaci, ale i rezistenci nádorových buněk, je mutace v genu BRAF kódujícím serin/threonin kinázu. Mutace v genu BRAF ovlivňují aktivitu transkripčních faktorů c-Jun a STAT3. c-Jun přímo zvyšuje de novo expresi PD-L1. Naopak transkripční faktor STAT3 je schopen indukovat expresi PD-L1 u melanomu pouze v kooperaci s c-Jun [26]. Ke zvýšené expresi PD-L1 může také docházet po aktivaci MAPK způsobené mutací v receptoru epidermálního růstového faktoru u nemalobuněčného karcinomu plic (non-small cell lung cancer – NSCLC) [27]. Naopak hyperaktivace PI3K/Akt signální dráhy indukující expresi PD-L1 je často spojená se ztrátou funkce nádorového supresoru PTEN (phosphatase and tensin homologue), jak bylo zjištěno u buněk karcinomu střeva [28] a melanomu [26].
Exprese PD-L1 u nádorových buněk byla indukovaná aktivací MAPK po aplikaci paklitaxelu [29] nebo nízké koncentrace cisplatiny [30]. Aktivovaná MAPK a s ní spojená zvýšená exprese PD-L1 může přispívat k omezení imunitní reakce a tím podporovat nádorovou rezistenci [29].
Exprese PD-L1 je také indukovaná hypoxickým prostředím, které je typické pro nádorové tkáně (obr. 2). Toto prostředí indukuje zvýšenou expresi transkripčního faktoru HIF-1α (hypoxia-inducible factor 1α), který se přímo váže na promotor genu kódujícího PD-L1 a tím reguluje jeho transkripci [31]. Exprese PD-L1 je také modulovaná prostřednictvím mikroRNA (miRNA). Jedná se malé regulační RNA o velikosti 22–24 nukleotidů, které se vážou na částečně komplementární oblasti mRNA a tím řídí inhibici translace, nebo degradaci mRNA. Exprese PD-L1 je indukovaná miR-200, která zároveň podporuje metastazování nádoru [32]. Naopak snížení exprese PD-L1 je zprostředkováno miR-513 [33]. Exprese PD-L1 je indukovaná IFN-γ (interferonem γ), který je produkován cytotoxickými T lymfocyty. IFN-γ uvolněný z aktivovaných T lymfocytů mohou využít nádorové buňky k indukci svého „nádorového“ PD-L1, jehož interakce s PD-1 receptorem na T lymfocytech přispívá k inhibici imunitního systému. Na expresi PD-L1 indukované IFN-γ se podílí transkripční faktor IRF-1 (interferon regulatory factor 1), který se přímo váže na promotor PD-L1 (obr. 2) [34]. Expresi PD-L1 zvyšují také interleukiny signalizací prostřednictvím transkripčního faktoru STAT3 [35].
Image 2. Mechanizmy regulace exprese PD-L1 v nádorových buňkách. 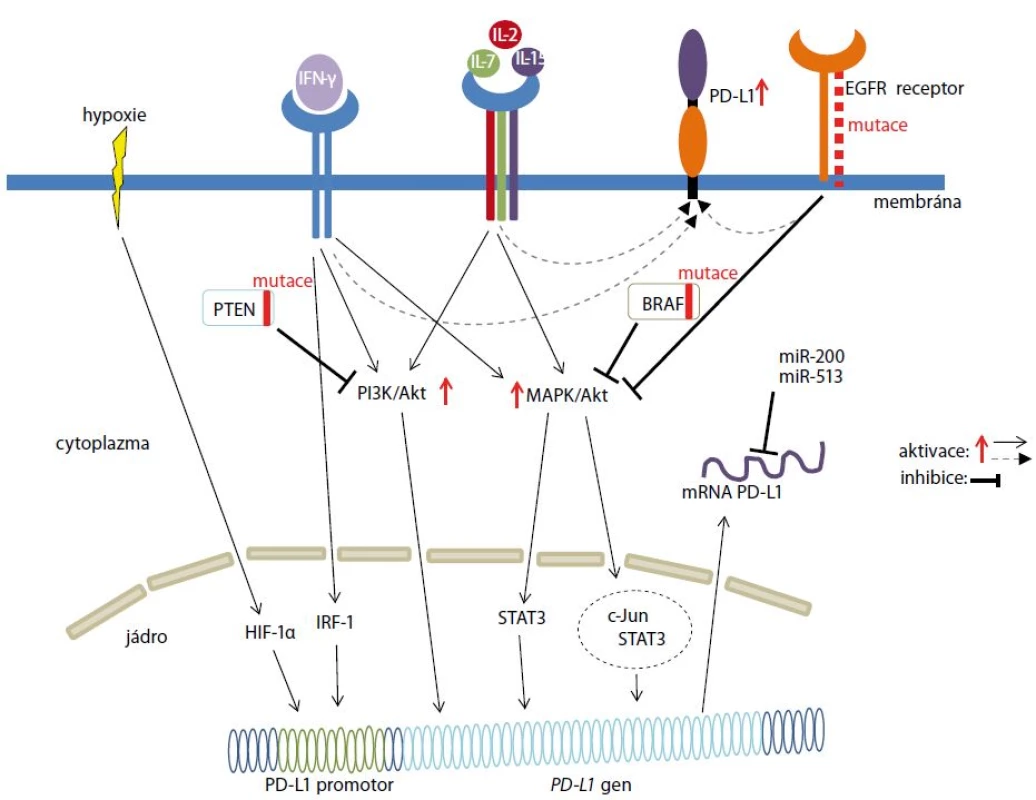
PD-1/PD-L1 a protinádorová terapie
V současné době jsou k dispozici monoklonální protilátky blokující receptor PD-1, ale i ligand PD-L1. První klinické experimenty byly zaměřeny na podání anti-PD-1 protilátek pacientům s metastatickým melanomem. První lék schválený pro klinické využití byl pembrolizumab. Jedná se vysoce selektivní humanizovanou IgG4-κ protilátku proti receptoru PD-1 využívanou k léčbě pacientů s pokročilým melanomem. Klinický přínos pembrolizumabu byl však zjištěn pouze u omezeného počtu léčených pacientů, navíc vyvolané autoimunitní nežádoucí účinky mohou být závažné až život ohrožující. Další IgG4 monoklonální protilátkou proti PD-1 je nivolumab. Byl schválený k léčbě pokročilého metastazujícího melanomu, renálního karcinomu a NSCLC, u kterého byl pozorován výrazný efekt monoterapie s překvapivě nízkými vedlejšími účinky [36]. V nejbližší době se očekává jeho rozšíření na další diagnózy.
Na ligand PD-L1 cílí protilátky atezolizumab, durvalumab a avelumab. Atezolizumab je testován k terapii uroteliálního karcinomu močového měchýře (urinary bladder cancer – UBC), kde celková míra léčebné odpovědi (overall response rate – ORR) dosahovala 50 % u pacientů s metastazujícím karcinomem [37]. Další studie probíhají u pacientů s PD-L1 pozitivním lokálně pokročilým metastazujícím NSCLC. Durvalumab je humanizovaná protilátka procházející klinickými studiemi monoterapie u NSCLC, nádorů hlavy a krku a UBC, kde ORR dosáhly 46 % u PD-L1 pozitivních pacientů [38].
Další možností je kombinovaná léčba blokující současně dva kontrolní body PD-1 a CTLA-4 (cytotoxický T lymfocytární antigen 4). Inhibice CTLA-4 se projevuje převážně v časných stadiích aktivace T lymfocytů, inhibice PD-1 ovlivňuje T lymfocyty zejména v efektorové fázi. Rozdílnost v působení těchto protilátek naznačuje jejich komplementaritu a také výsledky kombinované léčby potvrdily její vyšší účinnost oproti monoterapii anti-CTLA-4 i anti-PD-1. Bohužel vyšší však byla i toxicita kombinované léčby [39].
Závěr
Identifikace kontrolních bodů imunitního systému a zároveň hlubší pochopení vztahu mezi nádorovou progresí a imunitním systémem přináší nové možnosti v léčbě nádorových onemocnění. Léčba založená na využití monoklonálních protilátek ke kontrolním bodům imunitní reakce představuje novou éru moderní imunoterapie. Vyřazení popsaných inhibičních molekul pomocí cílených protilátek napomáhá vyšší aktivitě imunitního systému, neboť blokádou PD-1/PD-L1 je podpořena efektorová složka imunity přímo v nádoru, kde napomáhá přemoci toleranci k nádorové tkáni.
Exprese „nádorového“ PD-L1 je vysoce heterogenní a vychází z různorodostí nádorového mikroprostředí. Inhibiční dráha PD-1/PD-L1 může k prolomení tolerance imunitního systému využít řadu mechanizmů, proto se i strategie úniku nádorových buněk před imunitní reakcí liší a proto také dochází k odpovědi na imunoterapii bez ohledu na míru exprese ligandu PD-L1. PD-L1 je dynamický marker, jehož hladina se v čase mění v závislosti na rozvoji imunitní odpovědi a stále není jasné, zda se testování nádorových buněk na přítomnost PD-L1 bude moci přenést do klinické praxe [40]. Jedním z důležitých úkolů blízké budoucnosti je nalezení prediktivních a prognostických markerů, které by napomohly ohodnotit možnosti a sílu imunitního systému a vybrat populaci pacientů vhodných pro tuto léčbu.
Práce byla podpořena projektem MŠMT – NPU I – LO1413.
Autoři deklarují, že v souvislosti s předmětem studie nemají žádné komerční zájmy.
Redakční rada potvrzuje, že rukopis práce splnil ICMJE kritéria pro publikace zasílané do biomedicínských časopisů.
Mgr. Pavlína Zatloukalová, Ph.D.
Regionální centrum aplikované molekulární onkologie
Masarykův onkologický ústav
Žlutý kopec 7
656 53 Brno
e-mail: pavlina.zatloukalova@mou.cz
Obdrženo: 13. 6. 2016
Přijato: 4. 8. 2016
Sources
1. Šťastný M, Říhová B. Únikové strategie nádorů pozornosti imunitního systému. Klin Onkol 2015; 28 (Suppl 4): 4S28–4S37. doi: 10.14735/amko20154S28.
2. Melichar B, Nash MA, Lenzi R et al. Expression of costimulatory molecules CD80 and CD86 and their receptors CD28, CTLA-4 on malignant ascites CD3+ tumour-infiltrating lymphocytes (TIL) from patients with ovarian and other types of peritoneal carcinomatosis. Clin Exp Immunol 2000; 119 (1): 19–27.
3. Barber DL, Wherry EJ, Masopust D et al. Restoring function in exhausted CD8 T cells during chronic viral infection. Nature 2006; 439 (7077): 682–687.
4. Zhang X, Schwartz JC, Guo X et al. Structural and functional analysis of the costimulatory receptor programmed death-1. Immunity 2004; 20 (3): 337–347.
5. Riley JL. PD-1 signaling in primary T-cells. Immunol Rev 2009; 229 (1): 114–125. doi: 10.1111/j.1600065X.2009.00767.x.
6. Keir ME, Butte MJ, Freeman GJ et al. PD-1 and its ligands in tolerance and immunity. J Annu Rev Immunol 2008; 26 : 677–704. doi: 10.1146/annurev.immunol.26.021607.090331.
7. Francisco LM, Salinas VH, Brown K et al. PD-L1 regulates the development, maintenance, and function of induced regulatory T cells. J Exp Med 2009; 206 (13): 3015–3029. doi: 10.1084/jem.20090847.
8. Raimondi G, Shufesky WJ, Tokita DM et al. Regulated compartmentalization of programmed cell death-1 discriminates CD4+CD25+ rating regulatory T cells from activated T cells. J Immunol 2006; 176 (5): 2808–2816.
9. Chemnitz JM, Parry RV, Nichols KE et al. SHP-1 and SHP-2 associate with immunoreceptor tyrosine-based switch motif of programmed death 1 upon primary human T cell stimulation, but only receptor ligation prevents T cell activation. J Immunol 2004; 173 (2): 945–954.
10. Dong H, Zhu G, Tamada K et al. B7-H1 determines accumulation and deletion of intrahepatic CD8 (+) T lymphocytes. Immunity 2004; 20 (3): 327–336.
11. Chen L. Co-inhibitory molecules of the B7-CD28 family in the control of T-cell immunity. Nat Rev Immunol 2004; 4 (5): 336–347.
12. Zou W, Chen L. Inhibitory B7-family molecules in the tumour microenvironment. Nat Rev Immunol 2008; 8 (6): 467–477. doi: 10.1038/nri2326.
13. Butte MJ, Keir ME, Phamduy TB et al. Programmed death-1 ligand 1 interacts specifically with the B7-1 costimulatory molecule to inhibit T cell responses. Immunity 2007; 27 (1): 111–122.
14. Yang J, Riella LV, Chock S et al. The novel costimulatory programmed death ligand 1/B7.1 pathway is functional in inhibiting alloimmune responses in vivo. J Immunol 2011; 187 (3): 1113–1119. doi: 10.4049/jimmunol.1100056.
15. Xiao Y, Yu S, Zhu B et al. RGMb is a novel binding partner for PD-L2 and its engagement with PD-L2 promotes respiratory tolerance. J Exp Med 2014; 211 (5): 943–959. doi: 10.1084/jem.20130790.
16. He J, Hu Y, Hu M et al. Development of PD-1/PD-L1 pathway in tumor immune microenvironment and treatment for non-small cell lung cancer. Sci Rep 2015; 5 : 13110. doi: 10.1038/srep13110.
17. Dong H, Strome SE, Salomao DR et al. Tumor-associated B7-H1 promotes T-cell apoptosis: a potential mechanism of immune evasion. Nat Med 2002; 8 (8): 793–800.
18. Ansell SM, Lesokhin AM, Borrello I et al. PD-1 Blockade with nivolumab in relapsed or refractory Hodgkin‘s lymphoma. N Engl J Med 2015; 372 (4): 311–319. doi: 10.1056/NEJMoa1411087.
19. Curiel TJ, Wei S, Dong H et al. Blockade of B7-H1 improves myeloid dendritic cell-mediated antitumor immunity. Nat Med 2003; 9 (5): 562–567.
20. Patsoukis N, Sari D, Boussiotis VA. PD-1 inhibits T cell proliferation by upregulating p27 and p15 and suppressing Cdc25A. Cell Cycle 2012; 11 (23): 4305–4309. doi: 10.4161/cc.22135.
21. Staron MM, Gray SM, Marshall HD et al. The transcription factor FoxO1 sustains expression of the inhibitory receptor PD-1 and survival of antiviral CD8+ T cells during chronic infection. Immunity 2014; 41 (5): 802–814. doi: 10.1016/j.immuni.2014.10.013.
22. Patsoukis N, Bardhan K, Chatterjee P et al. PD-1 alters T-cell metabolic reprogramming by inhibiting glycolysis and promoting lipolysis and fatty acid oxidation. Nat Commun 2015; 6 : 6692. doi: 10.1038/ncomms7692.
23. Amarnath S, Mangus CV, Wang JC et al. The PDL1-PD1 axis converts human TH1 cells into regulatory T cells. Sci Transl Med 2011; 3 (111): 111ra120. doi: 10.1126/scitranslmed.3003130.
24. Wang W, Lau R, Yu D et al. PD1 blockade reverses the suppression of melanoma antigen-specific CTL by CD4+ CD25 (Hi) regulatory T cells. Int Immunol 2009; 21 (9): 1065–1077. doi: 10.1093/intimm/dxp072.
25. Rosenblatt J, Glotzbecker B, Mills H et al. PD-1 blockade by CT-011, anti-PD-1 antibody, enhances ex vivo T-cell responses to autologous dendritic cell/myeloma fusion vaccine. J Immunother 2011; 34 (5): 409–418. doi: 10.1097/CJI.0b013e31821ca6ce.
26. Jiang X, Zhou J, Giobbie-Hurder A et al. The activation of MAPK in melanoma cells resistant to BRAF inhibition promotes PD-L1 expression that is reversible by MEK and PI3K inhibition. Clin Cancer Res 2013; 19 (3): 598–609. doi: 10.1158/1078-0432.CCR-12-2731.
27. Akbay EA, Koyama S, Carretero J et al. Activation of the PD-1 pathway contributes to immune escape in EGFR-driven lung tumors. Cancer Discov 2013; 3 (12): 1355–1363. doi: 10.1158/2159-8290.CD-13-0310.
28. Song M, Chen D, Lu B et al. PTEN loss increases PD-L1 protein expression and affects the correlation between PD-L1 expression and clinical parameters in colorectal cancer. PLoS One 2013; 8 (6): e65821. doi: 10.1371/journal.pone.0065821.
29. Gong W, Song Q, Lu X et al. Paclitaxel induced B7-H1 expression in cancer cells via the MAPK pathway. J Chemother 2011; 23 (5): 295–299.
30. Qin X, Liu C, Zhou Y et al. Cisplatin induces programmed death-1-ligand1 (PD-L1) over-expression in hepatoma H22 cells via Erk/MAPK signaling pathway. Cell Mol Biol (Noisy-le-grand) 2010; 56 (Suppl): OL1366–OL1372.
31. Barsoum IB, Smallwood CA, Siemens DR et al. A mechanism of hypoxia-mediated escape from adaptive immunity in cancer cells. Cancer Res 2014; 74 (3): 665–674. doi: 10.1158/0008-5472.CAN-13-0992.
32. Chen L, Gibbons DL, Goswami S et al. Metastasis is regulated via microRNA-200/ZEB1 axis control of tumour cell PD-L1 expression and intratumoral immunosuppression. Nat Commun 2014; 5 : 5241. doi: 10.1038/ncomms6241.
33. Gong AY, Zhou R, Hu G et al. Cryptosporidium parvum induces B7-H1 expressionin cholangiocytes by down-regulating microRNA-513. J Infect Dis 2010; 201 (1): 160–169. doi: 10.1086/648589.
34. Chinai JM, Janakiram M, Chen F et al. New immunotherapies targeting the PD-1 pathway. Trends Pharmacol Sci 2015; 36 (9): 587–595. doi: 10.1016/j.tips.2015.06.005.
35. Wang WB, Yen ML, Liu KJ et al. Interleukin-25 mediates transcriptional control of PD-L1 via STAT3 in multipotent human mesenchymal stromal cells (hMSCs) to suppress Th17 responses. Stem Cell Reports 2015; 5 (3): 392–404. doi: 10.1016/j.stemcr.2015.07.013.
36. Brahmer JR, Horn L, Gandhi L et al. Nivolumab (anti-PD-1, BMS-936558,ONO-4538) in patients (pts) with advanced non-small-cell lung cancer (NSCLC): survival and clinical activity by subgroup analysis. J Clin Oncol 2014; 32 (Suppl): abstr. 8112.
37. Powles T, Eder JP, Fine GD et al. MPDL3280A (anti-PD-L1) treatment leads to clinical activity in metastatic bladder cancer. Nature 2014; 515 (7528): 558–562. doi: 10.1038/nature13904.
38. Massard C, Gordon MS, Sharma S et al. Safety and efficacy of durvalumab (MEDI4736), an anti-programmed cell death ligand-1 immune checkpoint inhibitor, in patients with advanced urothelial bladder cancer. J Clin Oncol 2016; 34 (26): 3119–3129. doi: 10.1200/JCO.2016.67.9761.
39. Larkin J, Chiarion-Sileni V, Gonzales R et al. Combined nivolumab and ipilimumab or monotherapy in untreated melanoma. N Engl J Med 2015; 373 (1): 23–34. doi: 10.1056/NEJMoa1504030.
40. Teixidó C, Karachaliou N, González-Cao M et al. Assays for predicting and monitoring responses to lung cancer immunotherapy. Cancer Biol Med 2015; 12 (2): 87–95. doi: 10.7497/j.issn.2095-3941.2015.0019.
Labels
Paediatric clinical oncology Surgery Clinical oncology
Article was published inClinical Oncology

2016 Issue Supplementum 4-
All articles in this issue
- Chaperony endoplazmatického retikula na povrchu nádorové buňky a v extracelulárním prostředí
- Proteiny Rab, vnitrobuněčný transport a nádorová onemocnění
- Vplyv inhibície HSP90 na viabilitu a bunkový cyklus v závislosti od stavu p53
- Molekulární podstata kancerogeneze epiteliálních ovariálních karcinomů
- Tvorba hmotnostne spektrometrických spektrálnych knižníc nádorových bunečných línií
- Využití metody vodík/deuteriové výměny v biofarmaceutickém průmyslu
- Nové metody studia metylace DNA – MS-HRM analýza a elektrochemie
- Úloha PD-1/PD-L1 signalizace v protinádorové imunitní odpovědi
- Nemalobuněčný karcinom plic – od imunobiologie k imunoterapii
- Nové technologie používané pro in vivo diagnostiku nádorů
- Pokroky ve vývoji PET radiofarmak pro pacienty v České republice
- Nádorové buňky jako dynamický systém – molekulární a fenotypové změny v průběhu vzniku, progrese a šíření nádoru
- Vícestupňový proces vzniku vzdálených metastáz u karcinomů
- Mechanizmy regulace proteinové homeostázy ve vývoji nádorových onemocnění
- Clinical Oncology
- Journal archive
- Current issue
- Online only
- About the journal
Most read in this issue- Úloha PD-1/PD-L1 signalizace v protinádorové imunitní odpovědi
- Nemalobuněčný karcinom plic – od imunobiologie k imunoterapii
- Nádorové buňky jako dynamický systém – molekulární a fenotypové změny v průběhu vzniku, progrese a šíření nádoru
- Nové metody studia metylace DNA – MS-HRM analýza a elektrochemie
Login#ADS_BOTTOM_SCRIPTS#Forgotten passwordEnter the email address that you registered with. We will send you instructions on how to set a new password.
- Career

