-
Medical journals
- Career
Nové technologie používané pro in vivo diagnostiku nádorů
Authors: L. Hernychová 1; D. Coufalová 1; E. Michalová 1; R. Nenutil 2; B. Vojtěšek 1
Authors‘ workplace: Regionální centrum aplikované molekulární onkologie, Masarykův onkologický ústav, Brno 1; Oddělení onkologické patologie, Masarykův onkologický ústav, Brno 2
Published in: Klin Onkol 2016; 29(Supplementum 4): 88-94
Category: Review
doi: https://doi.org/10.14735/amko20164S88Overview
Východiska:
K léčbě onkologických onemocnění se používají kombinace postupů založených nejčastěji na chirurgickém odstranění nádoru, radioterapii, chemoterapii či hormonální terapii, přičemž samotný chirurgický zákrok většinou představuje stěžejní krok pro odstranění nádorové masy. Je ovšem často provázen problémy s určením ohraničení nádoru. Chirurg má před operací k dispozici pouze informace z předoperačních vyšetření, která naznačují lokalizaci a rozsah nádoru, ale neurčí jasné hranice mezi nádorovou a zdravou tkání. Tuto oblast ve většině případů nelze rozeznat zrakem či hmatem, a pokud není nádor zcela odstraněn, musí pacient podstoupit reoperaci.Cíl:
Nové technologie vyvíjené ve výzkumných centrech umožňují operatérovi získat informace o stavu nádorové tkáně v reálném čase přímo na operačním sále v průběhu chirurgického zákroku. Patří mezi ně přístroje MarginProbe, Spectropen a spektroskopický tkáňový skener. Další skupinu tvoří zobrazovací techniky využívající hmotnostní spektrometrii k určování tkáňové specifičnosti. V posledních letech prošla obrovským vývojem technika intraoperativní hmotnostní spektrometrie (REIMS). Využívá elektronický skalpel, kterým chirurg provádí řez tkáně, přičemž vznikající aerosol je odváděn do hmotnostního spektrometru, jenž během několika desetin sekund získá hmotnostní spektra fosfolipidů specifických pro operovanou tkáň (nádorovou či zdravou). V České republice se již tato technologie využívá ve výzkumu k detekci koncentrace léčiva deponovaného v nádorové a zdravé tkáni myší trpících melanomem. Získané výsledky ukazují, že pomocí tohoto přístroje by bylo možné zásadním způsobem ovlivnit léčbu i její účinnost u onkologických onemocnění. O těchto nových technologiích vás v článku budeme podrobněji informovat a seznamovat s jejich principy a využitím.Klíčová slova:
chirurgie – rakovina – nádory – molekulární diagnostika – hmotnostní spektrometrie – databázeÚvod
V současné době je léčba solidních nádorů založena na kombinaci chirurgického zákroku, chemoterapie, radioterapie a biologické léčby. Cílem chirurgické léčby je odstranění celého nádoru nebo alespoň jeho převážné části. Ponechání zbytku nádoru může mít různé důvody, jako je např. velikost, rozložení či umístění v blízkosti orgánů a v neposlední řadě nemožnost rozeznání nádorové tkáně od zdravé. Zbývající nádor je pak eliminován jiným postupem, např. radioterapií či chemoterapií v závislosti na histologickém typu, avšak v některých případech musí být provedena reoperace k jeho odstranění. Při samotné operaci nastává v řadě případů problém s určením hranice nádoru a chirurg je odkázán pouze na své zkušenosti podložené vizuálními nebo hmatovými vjemy. Ohraničení nádoru není často makroskopicky zřetelné, není známo, zda okraje resekátu obsahují nádorové buňky či nikoliv a jestli je třeba odstranit další tkáň a v jakém rozsahu. Závažné rozhodování nastává např. při operacích nádorů mozku, při nichž je radikalita zákroku jedním ze zásadních prognostických faktorů. Základním problémem většiny zhoubných mozkových nádorů je jejich infiltrativní charakter růstu, kdy nádorové buňky prorůstají mezi zdravými a hranice nádoru nejsou ostré. Neurochirurg tak při snaze o co nejradikálnější výkon může odstranit i zdravé buňky, nebo naopak musí ponechat část nádorové tkáně z důvodu jejího umístění v blízkosti důležitých nervových drah, jejichž přerušení by mělo pro pacienta vážné následky. Obdobná situace může nastat při operacích infiltrujících nádorů měkkých tkání nebo pankreatu, případně u některých lézí v prsu, kde je kritické zejména šíření nádorové složky ve vývodech. Chirurg tedy provádí zákrok na základě předoperačních vyšetření a obvykle nemá během operace informace o tom, zda byla odstraněna veškerá nádorová masa. Tyto údaje získá z histopatologického vyšetření celého resekátu a teprve potom se rozhoduje o následné léčbě či případné reoperaci. Histologické vyšetření materiálu z resekční linie je samozřejmě možné provést i pooperačně. Pokud však má být provedeno v přijatelném časovém limitu, má významná omezení ve smyslu malého objemu vyšetřené tkáně a nižší kvality morfologie ve zmrazených řezech. Proto se v poslední době řada výzkumných center začala zabývat touto problematikou a vyvíjet technologie, které by operatérovi daly informace o stavu tkáně v reálném čase přímo na operačním sále a nevyžadovaly odběr ani skladování vzorků.
Technologie používané pro detekci nádorových buněk v průběhu operace
MarginProbe
Mezi nové technologie, které se v současné době vyvíjejí pro urychlení vyšetření tkáně, patří MarginProbe. Vývoj zařízení byl uskutečněn firmou Dune Medical Devices, Izrael (obr. 1) [1] pro in situ detekci invazivního duktálního a lobulárního nádoru prsu. Princip je založen na radiofrekvenční spektroskopii využívající elektromagnetické vlny k rozlišení nádorové a zdravé tkáně. Sterilní jednorázový senzor spojený se sondou vysílá radiofrekvenční signál do tkáně a zachycené zpětné signály odesílá do spektroskopu, kde jsou porovnávány se signály uloženými v databázi. Aplikuje se u lumpektomie [2] a pomáhá chirurgovi se rozhodnout, kolik tkáně má odstranit kolem nádoru (tzv. lem nádoru). Přímo na sále je in situ tkáň z lemu nádoru testována na nepřítomnost nádorových buněk a během krátkého času (3 s) se chirurg podle výsledku rozhodne, jestli má být odstraněna další část tkáně nebo je zákrok dostačující. Využití MarginProbe snížilo o 57 % počet reoperací [1,3], čímž se snížily jak finanční prostředky vynaložené na následnou operaci, tak i emoční stres pacientů. V Německu proběhla prospektivní klinická studie pacientek s nádorem prsu, v rámci níž u jedné skupiny byla během operace MarginProbe technika použita a u druhé nebyla. Následně byl sledován počet provedených reoperací a ukázalo se, že s aplikací MarginProbe techniky jejich počet výrazně klesl [4]. MarginProbe systém byl schválen v roce 2013 americkým Úřadem pro kontrolu potravin a léčiv (FDA). Tato technika je komerčně dostupná a je používána zejména při operacích nádoru prsu [5].
Image 1. MarginProbe System. Převzato z [1]. ![MarginProbe System. Převzato z [1].](https://www.prolekare.cz/media/cache/resolve/media_object_image_small/media/image/f9f223393dac89a963a5d457726dc73e.jpg)
SpectroPen
Dalším nástrojem je SpectroPen nazývaný jako Ramanův skener. Jedná se o ruční sondu vyvinutou vědci z Emory University a Georgia Institute of Technology, USA, používanou k lokalizaci nádorových buněk před i po operaci. Dokáže přesně rozlišit pozitivní nebo negativní okraje nádoru. Sonda má zabudovanou diodu vysílající laser s blízkým infračerveným zářením (near infrared radiation – NIR) do určitého místa v tkáni a je spojena s jednotkou pro excitaci a zachycení záření. Během operace NIR zobrazuje a rozlišuje nádorovou a zdravou tkáň. Technologie kombinuje laser s NIR a detektor fluorescenčního barviva a rozptýleného světla vysílaného částicemi zlata, které byly navrženy tak, aby se zachytily pouze na nádorových buňkách. Tyto částice se skládají z polymerního povlaku obsahujícího zlato, reportérového barviva a protilátky, která zajistí vazbu částice na vnější stranu nádorových buněk. Zlato značně zesiluje signál z reportérového barviva, a tím umožňuje detekci nádorů menších než 1 mm. SpectroPen je připojen optickým kabelem jak k Ramanovu spektroskopu, který zaznamenává vibrační frekvence molekul, tak k detektoru fluorescence. Vazba a detekce těchto nanočástic byla testována v in vitro i ex vivo uspořádáních. V in vivo experimentech byla myším s nádorem podána i.p. suspenze nanočástic a pomocí SpecroPenu byl během operace precizně detekován okraj nádoru – přechod nádorové a zdravé tkáně [6]. V další práci je popisováno využití nanočástic pro předoperační vyšetření magnetickou rezonancí pro zobrazení lokalizace nádoru v mozku u živých myší [7]. Avšak zobrazení výsledku bylo těžkopádné a pro chirurga vykonávajícího operaci nevýhodné. Proto vědci vyvinuli nové uspořádání přístroje, jednoduché na ovládání, schopné zobrazovat výsledky v reálném čase a vyhovující podmínkám umístění na operačním sále. Zdokonalená verze Ramanova skeneru byla použita při operacích nádoru myšího mozku (glioblastom, průměr 2–5 mm). Myším byly před operací injekčně aplikovány zlaté nanočástice, které se nechaly 24 hod cirkulovat v těle za účelem jejich kumulace v nádoru. Následně byly myši rozděleny do skupin, přičemž u jedné skupiny byla provedena operace při bílém osvětlení a u další skupiny byl použit SpectroPen. Následná imunohistochemická vyšetření prokázala, že vizualizace nádoru pomocí zlatých nanočástic umožnila odoperovat i malá rezidua nádoru, která nebyla rozpoznatelná pouhým okem (obr. 2, 3). Zároveň byla provedena rozsáhlá cytotoxická studie testující vlastnosti zlatých nanočástic, která potvrdila jejich inertní chování v organizmu [8]. SpectroPen byl také využit ve studii s jinou zobrazovací technikou nádorové masy. Do této studie bylo začleněno osm psích a pět lidských pacientů, jimž byla plánována operace k odstranění nádoru za použití NIR zobrazování. Pacientům byla 16–24 hod před operací injekčně podána indocyaninová zeleň (FDA schválené specifické preceptorové NIR barvivo hromadící se v hyperpermeabilních nádorových tkáních), která umožnila pomocí SpectroPenu rozlišit nádorovou tkáň od nenádorové u všech pacientů během chirurgické operace. Nevýhodou této technologie je její nefunkčnost u edematózní tkáně či tkáně se zánětem [9].
Image 2. Schematické znázornění zlaté nanočástice. 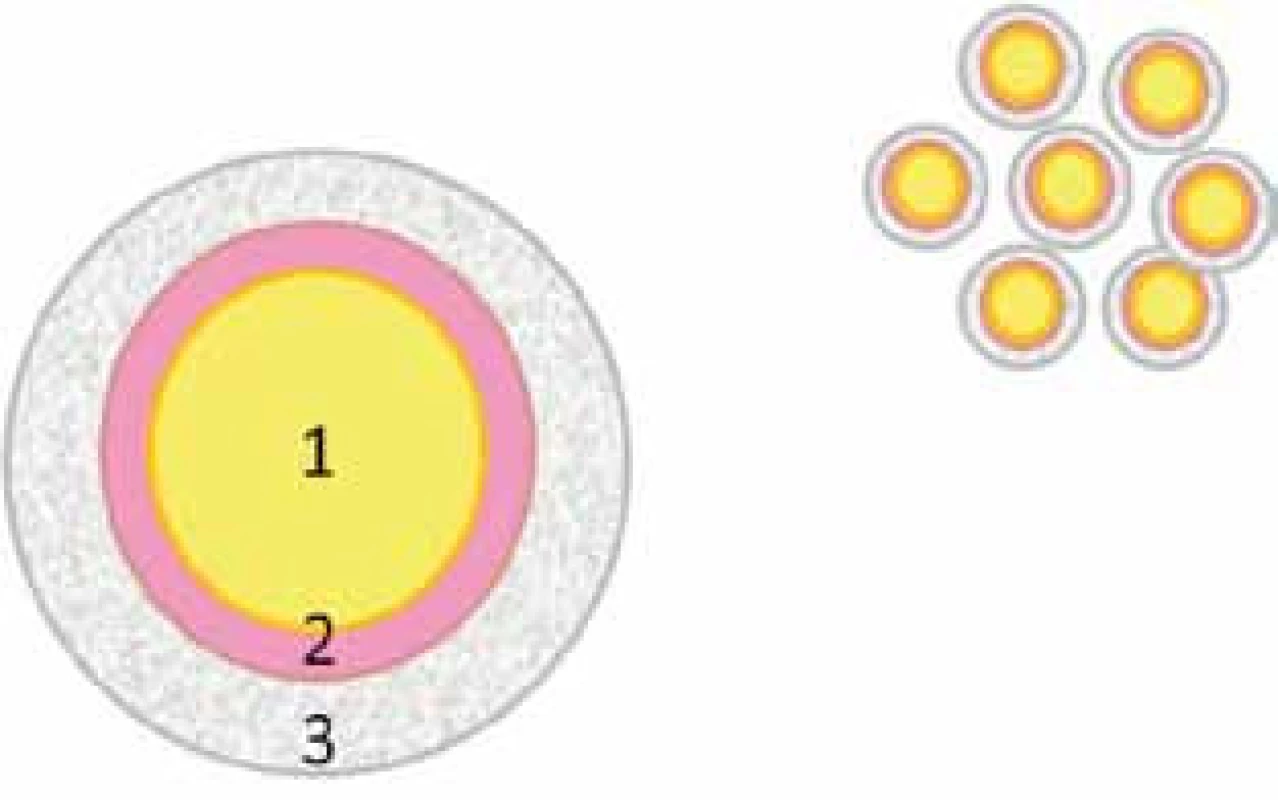
1 – jádro z inertního zlata, 2 – aktivní vrstva pro Ramanovo záření (4,4´-dipyridyl), 3 – křemenný obal Image 3. Detekce nádorových buněk mozku pomocí Ramanova skeneru. Inertní zlaté nanočástice se kumulovaly v mozku v místě nádoru, byly detekovány sondou a zobrazeny v Ramanově spektru. 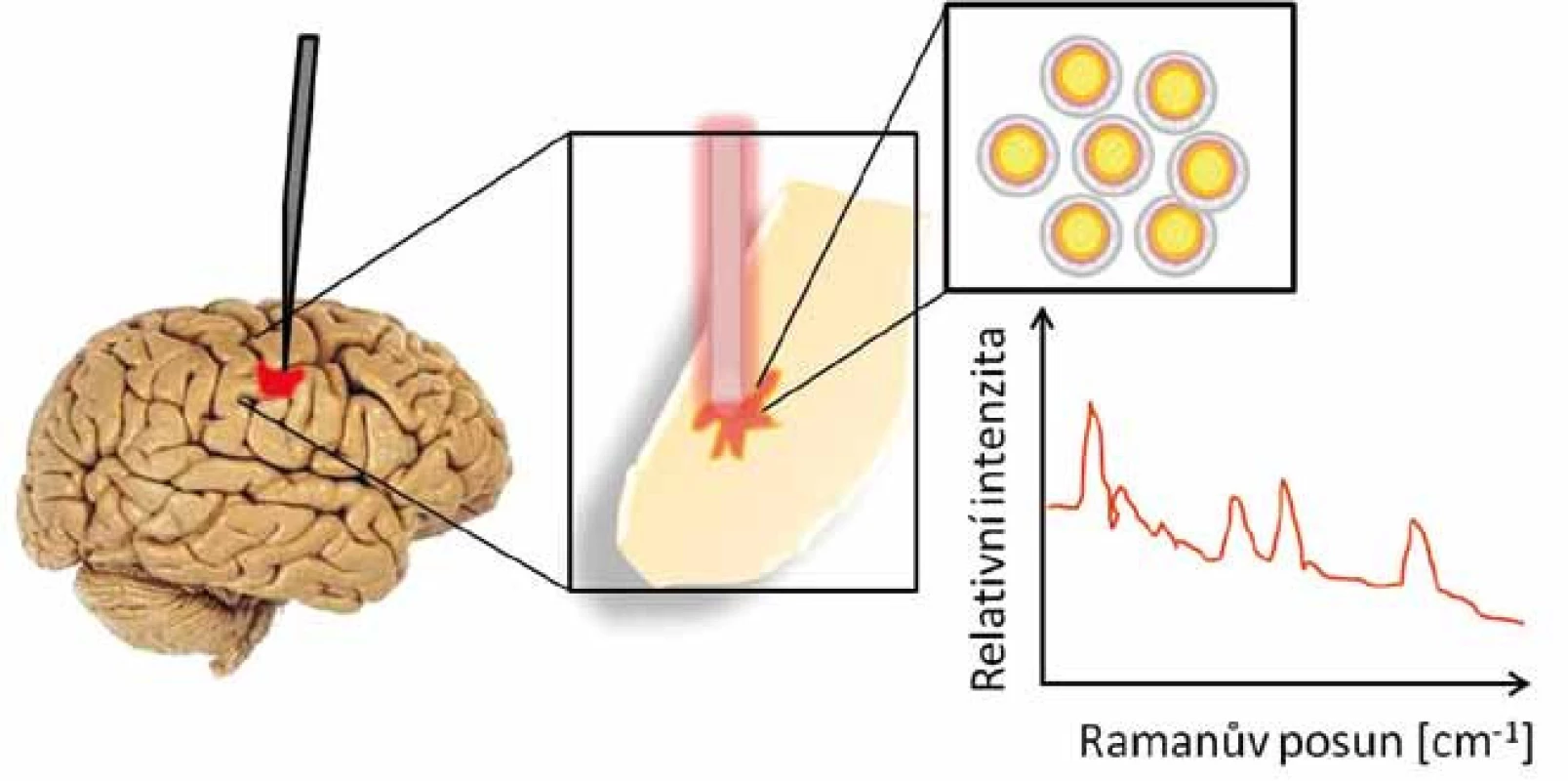
Spektroskopický tkáňový skener
Spektroskopický tkáňový skener detekuje přítomnost nádorových buněk a vyšetřuje vyoperovanou tkáň ex situ. Je umístěný na operačním sále a je schopný podat operatérovi informaci do 20 min. Dokáže skenovat větší plochu tkáně (do rozměru 20 × 20 cm) s vysokým rozlišením (0,25 mm). Pracuje na principech difuzní reflektance (diffuse reflectance infrared fourier transform spectroscopy – DRIFT) a vnitřní fluorescenční spektroskopie. Ty využívají známá fakta používaná při diagnostice nádoru prsu, tedy přirozenou absorpci proteinů hemoglobinu a β-karotenu a fluorescenci NADH a kolagenu přítomných ve vyšších koncentracích v nádorové tkáni oproti zdravé tkáni prsu. Získaná spektra jsou následně zpracována do obrazové formy, která odráží metabolický, biochemický a morfologický stav tkáně. Výhodou této technologie je její jednoduchost, přesnost a získání digitálního obrazu tkáně. Následně tedy není třeba provádět histologické vyšetření. Využití přístroje se plánuje především při operacích solidních nádorů [10].
NIVI
Mezi další nadějné techniky využívající barevného mikroskopického zobrazování tkáně patří NIVI (non-linear interferometric vibrational imaging), která byla vyvinuta týmem doktora Stephena Bopparta z University of Illinois, USA [11]. Její výhodou je, že se na rozdíl od histologického hodnocení nesoustředí jen na buněčnou strukturu vzorku tkáně, ale vyhodnocuje a vytváří obrazy založené na molekulárním složení v reálném čase. Princip techniky je založen na faktu, že každý typ molekuly má ve svých vazbách unikátní vibrační stav energie, který je měřen a převeden na vibrační spektra. Konstruktéři NIVI vycházeli z předpokladu, že nádorové buňky produkují více určitých bílkovin s danou vibrací než tkáň zdravá. Přístroj vysílá laserový svazek na vyšetřovanou tkáň, v níž dojde k excitaci elektronů, které vyzáří Stokesovy fotony, jejichž vlnová délka přímo souvisí s analyzovanou tkání. Na základě posuvu vlnových délek je pak možné rozlišit zdravou tkáň od nádoru či prekancerózní oblasti pomocí barevně kódovaného obrazu analyzované tkáně. Technika byla vyzkoušena na krysích nádorových buňkách i tkáních a umožnila detekovat jasné hranice nádoru s více než 99% spolehlivostí za dobu kratší než 5 min [12].
Zobrazovací techniky využívající hmotnostní spektrometrii
V následujících odstavcích budou detailněji popsány technologie využívající hmotnostní spektrometrii (mass spectrometry – MS) k určování tkáňové specifičnosti.
Historie přímého vyšetření biologické tkáně pomocí MS
Již v roce 1970 byla MS využívána k analýze nativní tkáně, avšak v té době nebyly dostačující technické parametry přístrojů k tomu, aby byly získány uspokojivé informace o chemickém složení testovaných vzorků. První průlom přišel v letech 1985–1988 s desorpčními ionizačními technikami, mezi něž patří ionizace/desorpce za přítomnosti matrice (matrix-assisted laser desorption/ /ionization – MALDI) [13] a MS sekundárních iontů (secondary ion mass spectrometry – SIMS) [14]. Následovala je další ionizační technika, desorpční ionizace elektrosprejem (desorption electrospray ionization – DESI), která jako první umožňovala neinvazivní testování vzorku bez přípravy a bez ohledu na jeho tvar nebo mechanické vlastnosti [15–17]. Pomocí těchto ionizačních metod bylo možné analyzovat složení povrchů pevných anorganických a organických látek, detekovat jejich chemické složení i prvky přítomné v nízkých koncentracích v nanometrových oblastech vyšetřovaných vzorků (např. metodou SIMS bylo možné zjistit 1012–1016 atomů většiny stopových prvků v 1 cm3). MALDI ionizace našla mimo jiné uplatnění v hmotnostně spektrometrickém zobrazování (mass spectrometry imaging – MSI), které bylo poprvé popsáno Spenglerem a jeho kolegy v roce 1994 [18]. Teoreticky lze touto technikou zobrazovat jakékoli sloučeniny, které je možné z povrchu vzorku desorbovat a převést do plynné fáze. MALDI je společně s dalšími typy ionizací (DESI, NALDI a SIMS) stále se rozvíjející technikou.
Hmotnostně spektrometrické zobrazování (MSI)
Koncem roku 1990 se ukázalo, že hmotnostně spektrometrická data v zobrazovacích studiích vykazují vysoký stupeň tkáňové specifičnosti. Pomocí MSI bylo možné získat informace z řezů tkání stejně jako histologickými metodami [13]. Hmotnostně spektrometrická detekce složek buněčných membrán a tkání (např. očních čoček) [19] poukazuje na přítomnost komplexních lipidů, přičemž distribuce lipidů je ve velmi dobré shodě s distribučními vzory získanými imunohistochemickými metodami. Tyto poznatky vedly ke vzniku nové éry studia molekulárního složení biologických vzorků.
Prostorové zobrazení MSI spočívá v kombinaci detekce látek přítomných na povrchu vzorku v daném místě, kdy každý pixel ve MSI představuje patřičné hmotnostní spektrum obsahující ionty přítomných sloučenin. Ke znázornění zastoupení jednotlivých iontů ve studovaném řezu je používaná barevná nebo černobílá stupnice, kdy intenzita barvy vyjadřuje kvantitativní zastoupení daného iontu na povrchu analyzované oblasti. Takto získaný obraz je vícerozměrný, proto jsou ke zpracování experimentálních dat využívány vhodné programy umožňující obrazovou rekonstrukci a statistickou analýzu spolu s archivací dat, prováděnou pomocí velice výkonných počítačů s vysokou paměťovou kapacitou [20–23].
Intraoperativní hmotnostní spektrometrie (REIMS)
Vývoj REIMS techniky
Další zobrazovací technikou, která prošla v posledních letech obrovským vývojem, je technika intraoperativní hmotnostní spektrometrie (rapid evaporative ionization mass spectrometry – REIMS). Poprvé byla popsána v roce 2009 maďarským chemikem Zoltanem Takátsem ze Semmelweis University v Budapešti [24]. Ve svém výzkumu pak pokra - čoval v Imperial College v Londýně a v letech 2010–2012 byla tato technika již testována přímo v nemocnicích. Získaná REIMS data byla použita pro budování databáze hmotnostních spekter, do které bylo zahrnuto 1 624 vzorků nádorové tkáně a 1 309 vzorků zdravé tkáně. Ke všem vzorkům byla k dispozici zdravotní dokumentace vyšetřovaných jedinců a výsledky imunohistologických analýz. Tímto způsobem se podařilo propojit chirurgickou praxi s MS, která je schopná podat online informaci o stavu tkáně [25]. REIMS metoda byla také aplikována na in vivo analýzu nádorů gastrointestinálního traktu s cílem rozeznat zdravou střevní stěnu, nádor a adenomatózní polyp [26]. Mezi další využití metody lze zařadit i detekci metastáz v lymfatických uzlinách během operace hrudníku [27]. Unikátnost celého procesu spočívá v použití elektronického skalpelu, kterým chirurg provádí řez tkáně. Při tom je vytvořený aerosol odváděn pomocí Venturiho trubice do hmotnostního spektrometru, jenž musí konstrukčně vyhovovat podmínkám práce přímo v prostorách operačních sálů. Dr. Takáts očekává, že REIMS metoda bude připravena k reálnému využití již v roce 2016.
Princip REIMS techniky
Látky přítomné v aerosolu jsou většinou intaktní membránové lipidy či fosfolipidy, které se snadno detekují MS a dobře charakterizují daný typ tkáně [24]. Navíc poskytují další důležité informace oproti molekulám metabolomu nebo proteinům používaným při imunohistologické (IHC) detekci. Velkou výhodou je tedy specifičnost údajů získaných z MS a jejich komplementarita s IHC. Zásadním přínosem je však analýza aerosolu v reálném čase, která dává chirurgovi kontinuální informaci o tom, zda operovaná tkáň obsahuje rakovinné buňky či nikoli. Během několika desetin sekund jsou získána hmotnostní spektra fosfolipidů specifických pro operovanou tkáň (nádorovou, či zdravou), což chirurgovi umožňuje se za méně než 2 s rozhodnout o dalším postupu chirurgického zákroku. Analýza získaných spekter probíhá pomocí vyhodnocovacího programu, který průběžně porovnává příchozí data v průběhu chirurgického zákroku, porovnává experimentální data s hmotnostními spektry uloženými v databázi, statisticky hodnotí a v jednoduchém formátu signalizuje výsledek pro chirurga. Informace pro chirurga může být vytvořena i pomocí zvukového signálu [28]. Výrazně se tím zrychluje samotná operace a zvyšuje se záruka na odstranění prakticky všech nádorových buněk.
Popis funkce REIMS techniky
Elektronický skalpel, který drží chirurg v ruce, je navržen tak, aby byl vznikající materiál při řezu tkáně odsáván a veden do hmotnostního spektro - metru. V tomto přístroji jsou přivedené látky ionizovány, děleny podle své hmotnosti a náboje (m/z), detekovány a zobrazovány v počítači ve formě hmotnostního spektra (závislost m/z na intenzitě píků). Tím se v reálném čase získá molekulární informace z místa řezu v tkáni. Chirurg tedy nesleduje složité hmotnostně spektrometrické informace, ale má na monitoru semafor, jenž mění barvy podle typu tkáně. Červená barva signalizuje nádorovou či poškozenou tkáň a zelená barva tkáň zdravou. Přístroj tedy dokáže přesně mapovat histologický stav tkáně v průběhu operace (obr. 4) [29].
Image 4. Schematický nákres intraoperativní hmotnostní spektrometrie (REIMS). Elektronický nůž po dotyku s tkání vytváří aerosol částic, které jsou vysušeny, ionizovány a vedeny do hmotnostního spektrometru, kde jsou analyzovány. Naměřená hmotnostní spektra jsou porovnávána s příslušnou databází a výsledek je signalizován na obrazovce. Pokud se elektronický skalpel pohybuje v oblasti nádoru, svítí na monitoru červené světlo. Když se posune do oblasti zdravé tkáně, signalizace na obrazovce se změní na zelené světlo. Chirurg tak získává informaci v reálném čase, že oblast nádoru je odstraněna. 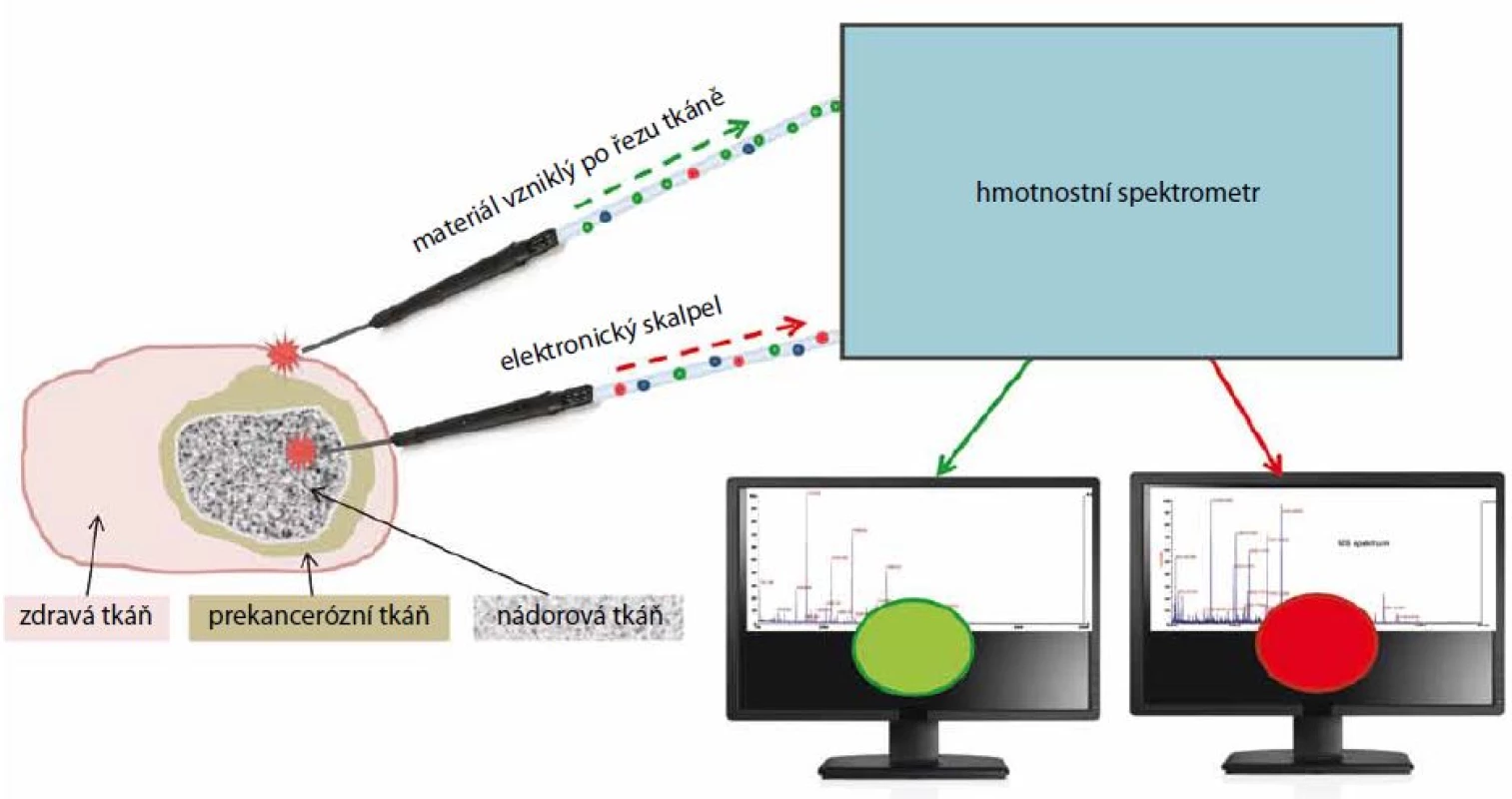
Využití REIMS techniky v ČR
V roce 2016 byl elektronický skalpel spolu s hmotnostním spektrometrem nainstalován a testován v Laboratoři charakterizace molekulární struktury (Mikrobiologický ústav AV ČR, Praha). Průběh představení tohoto systému je uveden v reportáži České televize [30]. ČR je tak v pořadí již čtvrtou zemí na světě, která se zapojila do využívání a testování techniky REIMS. První analýzy provedené pomocí elektronického skalpelu byly součástí výzkumu zabývajícího se detekcí koncentrace léčiva deponovaného v nádorové a zdravé tkáni myší trpících melanomem. Získané informace mohou zcela zásadním způsobem ovlivnit léčbu i její účinnost u onkologických onemocnění.
Výhody REIMS techniky
Technologie nevyžaduje žádnou přípravu vzorků ani in vivo značení nádorové tkáně. Je spojena s konstrukcí unikátní databáze obsahující fingerprinty hmotnostních spekter vzniklých analýzou par tvořících se při řezu elektronickým skalpelem u přesně definovaných tkání a je úzce propojena s následně provedenou histologickou analýzou. Vzniklá data jsou odbornými pracovníky zpracovávána do databázového formátu se statistickou analýzou. Identifikace neznámé tkáně je pak založena na hledání podobnosti hmotnostního spektra vyšetřované tkáně s tkáněmi uloženými v databázi. Tím jsou chirurgovi poskytnuty informace v reálném čase o tom, zda nádorová tkáň byla zcela odstraněna. Cenné jsou tyto informace zejména u nádorů, u nichž nelze pouhým okem nebo hmatem rozeznat okraj nádoru. To vše snižuje riziko reoperace i finanční náklady na léčbu pacientů. Výsledky této techniky lze kombinovat s jinými přístupy schopnými charakterizovat (identifikovat, kvantifikovat atd.) jednotlivé analyzované látky a dosáhnout tak globálního přístupu profilování. Lze také dosáhnout poznání molekulárních markerů odpovědných za rozdíly v nádorové a zdravé tkáni.
Závěr
V posledních letech byly vyvinuty a popsány nové ionizační metody spojené s in situ a in vivo hmotnostní spektrometrií biologických tkáňových vzorků. Technický rozvoj umožnil přenést tyto techniky do praxe a využívat je přímo na operačních sálech. Jsou schopné v reálném čase poskytovat cenné informace o histologickém stavu tkáně, pomáhají k určení a odstranění tkáně obsahující rakovinné buňky, a tím snižují nutnost provádění následných operací.
Elektronický skalpel byl primárně vyvinut pro nádorovou chirurgii. V současné době se jeho uplatnění rozšiřuje i do dalších odvětví, např. potravinářského průmyslu a mikrobiologie [31].
Práce byla podpořena projektem MŠMT – NPU I – LO1413.
Autoři deklarují, že v souvislosti s předmětem studie nemají žádné komerční zájmy.
Redakční rada potvrzuje, že rukopis práce splnil ICMJE kritéria pro publikace zasílané do biomedicínských časopisů.
prof. Ing. Lenka Hernychová, Ph.D.
Regionální centrum aplikované molekulární onkologie
Masarykův onkologický ústav
Žlutý kopec 7
656 53 Brno
e-mail: lenka.hernychova@mou.cz
Obdrženo: 17. 5. 2016
Přijato: 6. 9. 2016
Sources
1. Medgadget.com [online]. MarginProbe FDA cleared to help remove entire breast cancer lumps. Available from: www.medgadget.com/2013/01/marginprobe-fda-cleared-to-help-remove-entire-breast-cancer-lumps.html.
2. Schnabel F, Boolbol SK, Gittleman M et al. A randomized prospective study of lumpectomy margin assessment with use of MarginProbe in patients with nonpalpable breast malignancies. Ann Surg Oncol 2014; 21 (5): 1589–1595. doi: 10.1245/s10434-014-3602-0.
3. Rivera RJ, Holmes DR, Tafra L. Analysis of the impact of intraoperative margin assessment with adjunctive use of MarginProbe versus standard of care on tissue volume removed. Int J Surg Oncol 2012; 2012 : 868623.
4. Blohmer JU, Tanko J, Kueper J et al. MarginProbe© reduces the rate of re-excision following breast conserving surgery for breast cancer. Arch Gynecol Obstet 2016; 294 (2): 361–367. doi: 10.1007/s00404-016-4011-3.
5. MargineProbe [homepage on the Internet]. Breastcancer.org, PA; c2016, [updated 2015 Oct 23; cited 2016 May 30]. Available from: www.breastcancer.org/symptoms/testing/types/marginprobe.
6. Mohs AM, Mancini MC, Singhal S et al. Hand-held spectroscopic device for in vivo and intraoperative tumor detection: contrast enhancement, detection sensitivity, and tissue penetration. Anal Chem 2010; 82 (21): 9058–9065. doi: 10.1021/ac102058k.
7. Kircher MF, de la Zerda A, Jokerst JV et al. A brain tumor molecular imaging strategy using a new triple-modality MRI-photoacoustic-Raman nanoparticle. Nat Med 2012; 18 (5): 829–834. doi: 10.1038/nm.2721.
8. Karabeber H, Huang R, Iacono P et al. Guiding brain tumor resection using surface-enhanced Raman scattering nanoparticles and a hand-held Raman scanner. ACS Nano 2014; 8 (10): 9755–9766.
9. Holt D, Okusanya O, Judy R et al. Intraoperative near-infrared imaging can distinguish cancer from normal tissue but not inflammation. PLoS One 2014; 9 (7): e103342. doi: 10.1371/journal.pone.0103342.
10. Lue N, Kang JW, Yu CC et al. Portable optical fiber probe-based spectroscopic scanner for rapid cancer diagnosis: a new tool for intraoperative margin assessment. PLoS One 2012; 7 (1): e30887. doi: 10.1371/journal.pone.0030887.
11. Chowdary PD, Jiang Z, Chaney EJ et al. Molecular histopathology by spectrally reconstructed nonlinear interferometric vibrational imaging. Cancer Res 2010; 70 (23): 9562–9569. doi: 10.1158/0008-5472.CAN-10 - 1554.
12. Ahlberg L. New imaging technique accurately finds cancer cells. [online]. Illinois.edu. University of Illinois at Urbana-Champaign, IL; c2015 [updated 2010 Nov 24; cited 2016 May 5]. Available from: https://news.illinois.edu/blog/view/6367/205473.
13. Römpp A, Spengler B. Mass spectrometry imaging with high resolution in mass and space. Histochem Cell Biol 2013; 139 (6): 759–783. doi: 10.1007/s00418-013-1097-6.
14. Boxer SG, Kraft ML, Weber PK. Advances in imaging secondary ion mass spectrometry for biological samples. Annu Rev Biophys 2009; 38 : 53–74. doi: 10.1146/annurev.biophys.050708.133634.
15. Pal R, Singh OM, Talwar GP et al. Active immunization of baboons (Papio anubis) with the bovine LH receptor. J Reprod Immunol 1992; 21 (2): 163–174.
16. Takáts Z, Wiseman JM, Gologan B et al. Mass spectrometry sampling under ambient conditions with desorption electrospray ionization. Science 2004; 306 (5695): 471–473.
17. Zimmerman TA, Monroe EB, Tucker KR et al. Chapter 13: imaging of cells and tissues with mass spectrometry: adding chemical information to imaging. Methods Cell Biol 2008; 89 : 361–390. doi: 10.1016/S0091-679X (08) 00613-4.
18. Spengler B, Hubert M, Kaufmann R. MALDI ion imaging and biological ion imaging with a new scanning UV-laser microprobe. Proc 42nd Annu Conf Mass Spectrom Allied Top, Chicago, Illinois, 1994; abstr. 1041.
19. Pol J, Faltyskova H, Krasny L et al. Age-related changes in the lateral lipid distribution in a human lens described by mass spectrometry imaging. Eur J Mass Spectrom (Chichester) 2015; 21 (3): 297–303. doi: 10.1255/ejms. 1350.
20. Barceló-Coblijn G, Fernández JA. Mass spectrometry coupled to imaging techniques: the better the view the greater the challenge. Front Physiol 2015; 6 : 3. doi: 10.3389/fphys.2015.00003.
21. Pól J, Strohalm M, Havlíček V et al. Molecular mass spectrometry imaging in biomedical and life science research. Histochem Cell Biol 2010; 134 (5): 423–443. doi: 10.1007/s00418-010-0753-3.
22. Vidová V, Volný M, Lemr K et al. Surface analysis by imaging mass spectrometry. Collect Czechoslov Chem Commun 2009; 74 : 1101–1116.
23. Svatos A. Mass spectrometric imaging of small molecules. Trends Biotechnol 2010; 28 (8): 425–434. doi: 10.1016/j.tibtech.2010.05.005.
24. Balog J, Szaniszlo T, Schaefer KC et al. Identification of biological tissues by rapid evaporative ionization mass spectrometry. Anal Chem 2010; 82 (17): 7343–7350. doi: 10.1021/ac101283x.
25. Balog J, Sasi-Szabó L, Kinross J et al. Intraoperative tissue identification using rapid evaporative ionization mass spectrometry. Sci Transl Med 2013; 5 (194): 194ra93. doi: 10.1126/scitranslmed.3005623.
26. Balog J, Kumar S, Alexander J et al. In vivo endoscopic tissue identification by rapid evaporative ionization mass spectrometry (REIMS). Angew Chem Int Ed Engl 2015; 54 (38): 11059–11062. doi: 10.1002/anie.201502 770.
27. Enyedi A, Csongor V, Szabó K et al. Real-time detection of metastases in lymph nodes during thoracic surgery. Interact Cardiovasc Thorac Surg 2014; 18 (Suppl 1): S11.
28. Heath N. The intelligent knife that helps surgeons sniff out cancer [online]. CBS Interactive; c2016 [updated 2014 Nov 11; cited 2016 May 30]. Available from: http://www.techrepublic.com/blog/european-technology/the-intelligent-knife-that-helps-surgeons-sniff-out - cancer.
29. Balog J, Sasi-Szabó L, Kinross J et al. Intraoperative tissue identification using rapid evaporative ionization mass spectrometry. Sci Transl Med 2013; 5 (194): 194ra93. doi: 10.1126/scitranslmed.3005623.
30. Čeští lékaři testují chytrý skalpel, který pozná zdravou tkáň od poškozené. TV, ČT24. [aktualizováno 3. dubna 2016; citováno 30. května 2016]. Dostupné z: http://www.ceskatelevize.cz/ct24/domaci/1739080-cesti-lekari-testuji-chytry-skalpel-ktery-pozna-zdravou-tkan-od-poskozen.
31. Strittmatter N, Jones EA, Veselkov KA et al. Analysis of intact bacteria using rapid evaporative ionisation mass spectrometry. Chem Commun 2013; 49 (55): 6188–6190. doi: 10.1039/c3cc42015a.
Labels
Paediatric clinical oncology Surgery Clinical oncology
Article was published inClinical Oncology

2016 Issue Supplementum 4-
All articles in this issue
- Chaperony endoplazmatického retikula na povrchu nádorové buňky a v extracelulárním prostředí
- Proteiny Rab, vnitrobuněčný transport a nádorová onemocnění
- Vplyv inhibície HSP90 na viabilitu a bunkový cyklus v závislosti od stavu p53
- Molekulární podstata kancerogeneze epiteliálních ovariálních karcinomů
- Tvorba hmotnostne spektrometrických spektrálnych knižníc nádorových bunečných línií
- Využití metody vodík/deuteriové výměny v biofarmaceutickém průmyslu
- Nové metody studia metylace DNA – MS-HRM analýza a elektrochemie
- Úloha PD-1/PD-L1 signalizace v protinádorové imunitní odpovědi
- Nemalobuněčný karcinom plic – od imunobiologie k imunoterapii
- Nové technologie používané pro in vivo diagnostiku nádorů
- Pokroky ve vývoji PET radiofarmak pro pacienty v České republice
- Nádorové buňky jako dynamický systém – molekulární a fenotypové změny v průběhu vzniku, progrese a šíření nádoru
- Vícestupňový proces vzniku vzdálených metastáz u karcinomů
- Mechanizmy regulace proteinové homeostázy ve vývoji nádorových onemocnění
- Clinical Oncology
- Journal archive
- Current issue
- Online only
- About the journal
Most read in this issue- Úloha PD-1/PD-L1 signalizace v protinádorové imunitní odpovědi
- Nemalobuněčný karcinom plic – od imunobiologie k imunoterapii
- Nádorové buňky jako dynamický systém – molekulární a fenotypové změny v průběhu vzniku, progrese a šíření nádoru
- Nové metody studia metylace DNA – MS-HRM analýza a elektrochemie
Login#ADS_BOTTOM_SCRIPTS#Forgotten passwordEnter the email address that you registered with. We will send you instructions on how to set a new password.
- Career

