-
Medical journals
- Career
Gynekologická prevence a gynekologické aspekty péče u nosiček mutací genů BRCA1 a BRCA2
Authors: Michal Zikán
Authors‘ workplace: Onkogynekologické centrum, Gynekologicko-porodnická klinika 1. LF UK a VFN v Praze
Published in: Klin Onkol 2016; 29(Supplementum 1): 22-30
Category: Review
doi: https://doi.org/10.14735/amko2016S22Overview
Předkládaná práce shrnuje současné poznatky o gynekologických aspektech péče o ženy s dědičnou dispozicí ke vzniku karcinomu prsu a vaječníků – nosičkách mutací genů BRCA1 a BRCA2 – a předkládá návrh péče o tyto ženy včetně dispenzarizace, doporučení profylaktických operací a preimplantační genetické diagnostiky. Shrnuje rizika vzniku nádorů a závažnost především ovariálního karcinomu pro jeho vysokou mortalitu rezultující z agresivního biologického chování nádoru a omezených možností časné detekce. BRCA pozitivním ženám lze nabídnout program pečlivé dispenzarizace, profylaktické chirurgické zákroky a preimplantační genetickou diagnostiku. Součástí dispenzární péče je gynekologické vyšetření, expertní onkogynekologický ultrazvuk a stanovení markeru CA125 v šestiměsíčních intervalech. Jediným nástrojem efektivně snižujícím mortalitu ovariálního karcinomu je profylaktická operace – adnexektomie (s hysterektomií). Optimální věk pro provedení operace je 35 – 40 let. Profylaktická adnexektomie provedená premenopauzálně snižuje nejen riziko vzniku karcinomu vaječníků, ale také riziko vzniku karcinomu prsu. Příznaky estrogenního deficitu po profylaktické operaci lze potlačit podáním hormonální substituční léčby bez zvýšení rizika vzniku karcinomu prsu. Preimplantační genetická diagnostika představuje možnost, jak zabránit přenosu dědičné dispozice do další generace. Péče o ženy v hereditárním riziku vzniku karcinomu vaječníků by měla být soustředěna do specializovaných center.
Klíčová slova:
hereditární karcinom prsu a vaječníků – ovariální karcinom – gen BRCA1 – gen BRCA2Úvod
Přibližně u 8– 13 % všech žen s ovariálním karcinomem vzniká nádor na základě zděděné predispoziční zárodečné mutace, nejčastěji v genu BRCA1 nebo BRCA2 v rámci syndromu hereditárního karcinomu prsu a vaječníků (hereditary breast and ovarian cancer – HBOC) [1].
Celoživotní riziko onemocnění u nosiček mutací genu BRCA1 dosahuje 40 – 60 %, u nosiček mutací genu BRCA2 je nižší, dosahuje 10 – 30 %. Populační riziko vzniku ovariálního karcinomu v naší populaci je 1,8 %; relativní riziko u nosiček hereditární dispozice tedy dosahuje 10 – 30násobku rizika populačního. Riziko vzniku ovariálního karcinomu začíná u nosiček mutací genu BRCA1 strmě stoupat mezi 35. a 40. rokem života, u nosiček mutací genu BRCA2 po 50. roce života [2].
Medián věku v době diagnózy ovariálního karcinomu je v nezatížené populaci v ČR 57 let. U nosiček mutace genu BRCA1 je medián věku v době diagnózy o 10 let nižší, u nosiček mutací genu BRCA2 nebyl v ČR zaznamenán statisticky signifikantní rozdíl oproti nezatížené populaci [3].
Dominujícím histotypem nádoru u nosiček mutací genů BRCA1 a BRCA2 je high-grade serózní karcinom, který představuje tři čtvrtiny všech ovariálních karcinomů.
Prognóza ovariálního karcinomu je nepříznivá, jedná se o gynekologický nádor s nejvyšší mortalitou. Pětileté celkové přežití (overall survival – OS) bez ohledu na stadium se pohybuje mezi 35 a 40 %. Většina pacientek (75 %) je diagnostikována v pozdních stadiích (III – IV),kdy se pětileté OS pohybuje mezi 5 a 25 %. I v časných stadiích se však pětileté OS u high-grade serózního karcinomu pohybuje pouze mezi 60 a 85 %.
Prognóza pacientek s hereditární mutací genu BRCA1 nebo BRCA2 je zřejmě, vyjádřeno pětiletým OS, mírně příznivější ve srovnání s pacientkami se sporadickým nádorem, případný benefit v 10letém OS je však sporný [4].
Onemocní-li nosička mutace genu BRCA1 nebo BRCA2 karcinomem prsu, má velkou šanci na vyléčení. Onemocní-litaková žena karcinomem vaječníků, má velké riziko, že na tuto nemoc zemře. Na vině je především nemožnost časné detekce nádoru pro chybějící symptomatologii časných stadií, rychlý a agresivní růst a nízká senzitivita vyšetřovacích metod.
Zdravým nosičkám (včetně žen s karcinomem prsu) můžeme nabídnout tři typy opatření:
- dispenzární péči (sledování) (tab. 1),
- profylaktickou operaci (profylaktickou adnexektomii – risk-reducing salpingo-oophorectomy – RRSO, případně s hysterektomií) (tab. 2),
- preimplantační genetickou diagnostiku (tab. 3).
Table 1. Dispenzární péče pro nosičky <em>BRCA1/2</em> mutací. 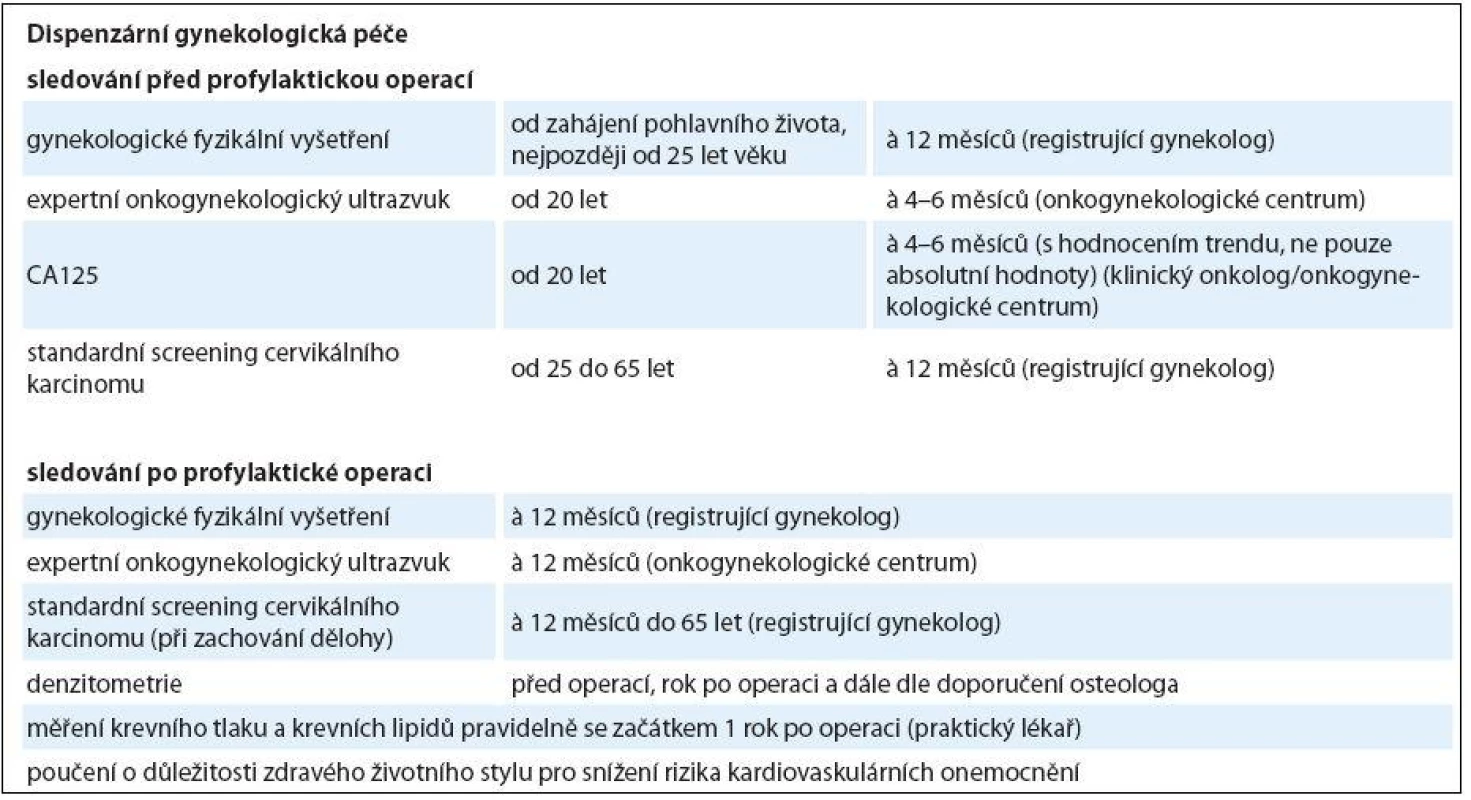
Table 2. Profylaktická operace u nosiček <em>BRCA1/2</em> mutací. 
Table 3. Preimplantační genetická diagnostika u párů s BRCA1/2 mutací. 
PGD – preimplantační genetická diagnostika, IVF – in vitro fertilizace Dispenzární péče – nechirurgické možnosti prevence
Sledování před profylaktickou operací – CA125 a ultrazvuk
Nosičkám mutací genů BRCA1/ 2 bylo dosud doporučováno podstoupit preventivní vyšetření zahrnující vyšetření nádorových markerů (CA125, CA19-9, CEA, CA15-3), gynekologický ultrazvuk a celkové klinické a gynekologické vyšetření v intervalu šest měsíců od 25 let života nebo ve věku o 10 let nižším než věk diagnózy zhoubného nádoru u nejmladšího nemocného v rodině [5].
Cílem této sekundární prevence je vzniklý nádor odhalit v počátečním stadiu s vyšší pravděpodobností vyléčení. Zatímco u karcinomu prsu se objevují data potvrzující downstaging a pozitivní vliv na přežití u intenzivně sledovaných pacientek, účinnost této strategie na časný záchyt ovariálního karcinomu je sporná. V rozsáhlém review [6] zahrnujícím více než 6 000 pacientek v hereditárním riziku onemocnění bylo 63 % ovariálních karcinomů zachyceno ve stadiu IIC nebo vyšším, navíc 40 % všech zachycených karcinomů bylo intervalových. Tento jev souvisí zřejmě s molekulární podstatou onemocnění, kdy ovariální karcinomy vznikající na základě hereditárních mutací genů BRCA1/ 2 jsouřazeny k nádorům tzv. typu II, pro něž je charakteristický rychlý růst bez klinicky detekovatelných prekurzorů (benigních nebo hraničních nádorů) [3].
Dosud nemáme k dispozici screeningový postup, který by byl považován u karcinomu ovaria ve většinové populaci za efektivní. V posledních letech však bylo provedeno několik velkých prospektivních studií v celé populaci zabývajících se touto problematikou a další, především tzv. UKCTOCS (United Kingdom Familial Ovarian Cancer Screening Study), probíhají [7 – 9]. Data popisující efekt screeningových postupů na mortalitu ovariálního karcinomu v neselektované populaci však nebyla dosud publikována. Zveřejnění výstupů dosud největší studie (UKCTOCS) je očekáváno v závěru roku 2015 [10,11].
Dosavadní studie, které se zabývaly možností screeningu ovariálního karcinomu nikoli v celé populaci, ale pouze v rizikových skupinách, přinesly nejednotné výsledky. Rozdíly jsou způsobeny především významnými odlišnostmi v protokolech – volba screeningové metody (CA125, ultrazvukové vyšetření, jejich kombinace), intervaly screeningových vyšetření (12 nebo 6 měsíců), indikace k expertnímu vyšetření (jedna zvýšená hodnota CA125, vzestupný trend CA125, patologický nález na ultrazvuku, přetrvávající patologie na ultrazvuku), celková doba sledování, velikost souboru, pracoviště provádějící screeningové vyšetření (ambulantní gynekolog, onkogynekologické lůžkové oddělení, centra pro preventivní onkologii), kritéria pro zařazení do screeningu, resp. stupeň rizika, metodika zpracování výsledků (vyřazení karcinomů diagnostikovaných při prvním screeningovém, prevalenčním vyšetření).
Většina prací se však shoduje v tom, že žádný ze screeningových přístupů není schopen detekovat ve větší míře časné karcinomy – u této rizikové skupiny se jedná o nádory typu II (high-grade serózní karcinomy) [12,13]. Tento závěr byl potvrzen i ve fázi I velké britské studie UKFOCSS, která pro screening rizikové skupiny využívala jednoroční stanovení CA125 a ultrazvukové vyšetření. Ačkoliv senzitivita byla akceptovatelná (81,3 %), pouze menšina nádorů (30,8 %) byla zachycena v časných stadiích [14]. Ve fázi II UKFOCSS byla změněna screeningová strategie a CA125 byl stanovován každé čtyři měsíce a hodnocen pomocí ROCA algoritmu. Předběžná data prezentovaná na ASCO 2013 uvádějící vysokou senzitivitu pro detekci invazivního ovariálního karcinomu (67 – 100 %) a zároveň nebyl zaznamenán žádný intervalový karcinom. Mezi detekovanými karcinomy bylo 42 % v časném stadiu, 92 % detekovaných nádorů bylo operováno s nulovým makroskopickým reziduem nemoci (ve srovnání s 62 % ve fázi I) [11]. Podobná strategie screeningu byla užita i ve studii Cancer Genetics Network [15] a GOG [16]. Finální data ze všech tří studií by měla být publikována v průběhu letošního roku.
V klinické praxi je pro diferenciální diagnostiku benigních a maligních pánevních tumorů používána i kombinace markeru CA125 a HE4 (human epididymal protein 4) s kalkulací tzv. ROMA (risk of malignancy algorithm) skóre. Význam HE4 nebo jeho kombinace s CA125 ve screeningu však nebyl dosud studován.
Na základě dosud publikovaných dat nelze populační screening ovariálního karcinomu doporučit. U žen v hereditárním riziku je však situace odlišná. Byť jediným bezpečným opatřením zůstává profylaktická adnexektomie, lze v období před jejím provedením doporučit sledování pomocí kombinace CA125 a transvaginálního ultrazvuku. Intervaly vyšetření by neměly být delší než šest měsíců (optimálně v intervalu 4 – 6 měsíců). Při pozitivním screeningovém vyšetření v rizikové skupině nebo při zvýšení markerů v obecné populaci je velmi důležité expertní ultrazvukové vyšetření (vyšetření zkušeným onkogynekologickým sonografistou s patřičným vybavením), které může významně omezit počet prováděných nadbytečných chirurgických intervencí. Expertní onkogynekologický ultrazvuk je nejpřesnější metodou pro stanovení povahy pánevních tumorů [17,18]. Efektem takového sledování nemusí nutně být záchyt časného stadia, ale i časnější záchyt pokročilých stadií, který umožní (dle předběžných výsledků studie UKFOCS) dosáhnout optimálního debulkingu, a zlepšit tak prognózu pacientky. V ČR je ustanovena síť onkogynekologických center (OGC), která mají potřebné vybavení (high-end ultrazvukový přístroj s multifrekvenčními sondami – vaginální transabdominální a lineární – s integrovanou pacientskou databází) a expertní sonografisty. Seznam onkogynekologických center a kontakty lze nalézt na adrese www.onkogynekologie.com.
Jakákoliv strategie screeningu hereditárního ovariálního karcinomu však není (na rozdíl od hereditárního karcinomu prsu) alternativou k profylaktické chirurgii (adnexektomii).
Hormonální antikoncepce
Velmi diskutovaná je otázka možné chemoprevence karcinomu vaječníků u nosiček mutací genů BRCA1/ 2 pomocí kombinované orální kontracepce (combined oral contraception – COC). Většina studií se shoduje (tak jako v nezatížené populaci) na 40 – 50% redukci rizika vzniku ovariálního karcinomu u uživatelek COC [19 – 22]. Otázkou zůstává však vliv COC na riziko karcinomu prsu. Jak největší a nejlépe designovaná studie [23], tak metaanalýza dosud proběhlých studií [24] hodnotí riziko vzniku karcinomu prsu u uživatelek COC jako zvýšené (RR 1,17 – 4,3). V situaci, kdy po většinu fertilního věku BRCA1/ 2 pozitivní ženy dominuje rostoucí riziko vzniku karcinomu prsu nad rizikem vzniku karcinomu vaječníků (riziko karcinomu prsu u nosiček mutace genu BRCA1/ 2 je ve věku 50 let cca 40 %, riziko ovariálního karcinomu je ve stejném věku u nosiček mutací genu BRCA1 cca 20 % u nosiček mutací genu BRCA2 cca 5 %) a ženy mají možnost podstoupit profylaktickou adnexektomii, je otázka možného využití COC v chemoprofylaxi sporná a je třeba s každou pacientkou individuálně zvážit možný přínos a rizika i s ohledem na osobní a rodinnou anamnézu.
V současné době nedoporučujeme hormonální antikoncepci jako metodu prevence karcinomu vaječníků. Pokud si nosička mutace přeje užívat spolehlivou antikoncepci ve formě COC, není důvod k vysazení COC, je třeba však pacientku poučit o možném mírném nárůstu rizika vzniku karcinomu prsu. Nebyl popsán rozdíl v efektu různých preparátů, ani vliv odlišných hladin estrogenů v současné COC obsažených. Volba preparátu je tedy volná v závislosti na toleranci pacientky, případně na žádoucích pozitivních vedlejších efektech. Zároveň bychom vždy měli zvážit jinou možnost spolehlivé antikoncepce, především nitroděložní tělísko, které je dnes již k dispozici i pro nerodivší ženy.
Těhotenství a kojení
Efekt těhotenství a kojení je zřejmě u nosiček mutací genů BRCA1/ 2 obecně stejný jako v běžné populaci. Těhotenství dle většiny studií snižuje riziko vzniku karcinomu prsu u nosiček mutací genu BRCA1 (HR 0,53) i BRCA2 (HR 0,58) [25]. Další práce prokazuje také snížení rizika u nosiček mutací genu BRCA1, u nosiček mutací genu BRCA2 však nachází zvýšení rizika u žen se dvěma a více dětmi (OR 1,53) [26]. Protektivní efekt je popsán u nosiček mutací genu BRCA1 i pro kojení delší než jeden rok (snížení rizika vzniku karcinomu prsu o 32 %), u nosiček mutací genu BRCA2 není statisticky signifikantní [27].
Vyšetření prsů zobrazovacími metodami je možné i v těhotenství a při kojení [28,29], protektivní efekt kojení může, zvláště u nosiček mutací genu BRCA1, převážit případné obavy z onemocnění v době laktace. Při plánování délky laktace je třeba pacientku informovat o významně horší prognóze karcinomu prsu vzniklého v období kojení.
V případě sterility je možné doporučit pacientku do centra asistované reprodukce a použít metody asistované reprodukce včetně kontrolované ovariální hyperstimulace. Dle současných poznatků by tyto metody neměly mít vliv na riziko vzniku karcinomu prsu u nosiček mutací. Metody asistované reprodukce však zvyšují riziko vzniku jak borderline, tak invazivních karcinomů ovaria [30]. I s ohledem na tato data by měla být pacientka podstupující ovariální hyperstimulaci poučena o vhodnosti profylaktické operace co nejdříve po dokončení úspěšného těhotenství a ukončení reprodukčních plánů.
S ohledem na riziko karcinomu ovaria a plánování profylaktické adnexektomie je vhodné podporovat pacientku ve snaze o těhotenství s optimálním dokončením reprodukčních plánů do 40. roku života.
Sledování po profylaktické operaci
Sledování po profylaktické operaci se zaměřuje především na riziko vzniku primárního peritoneálního karcinomu (primary peritoneal serous tumor – PPST) a management projevů předčasné menopauzy. Neexistuje dosud shoda na tom, v jakých intervalech a jakými prostředky by měly být ženy po operaci sledovány. Většina center doporučuje gynekologické vyšetření a expertní onkogynekologický ultrazvuk jednou ročně. Stanovení CA125 v časné detekci PPST je sporné.
Vzhledem k nárůstu rizika osteoporózy po předčasné arteficiální menopauze je doporučováno stanovení denzity kostní tkáně před profylaktickou operací a v odstupu 1 – 2 let po operaci a event. dispenzarizace v osteocentru. Vzhledem ke kardiovaskulárním rizikům je dále doporučováno vyšetření rizikových faktorů kardiovaskulárního onemocnění, tj. především hypercholesterolemie, hypertenze, diabetu a kouření, optimálně v rukou poučeného praktického lékaře. Možnosti hormonální susbstituční léčby jsou uvedeny níže.
Profylaktická operace – chirurgické možnosti prevence
Benefit operace a její časování
V současné době je jediným nástrojem primární prevence u žen v hereditárním riziku onemocnění gynekologickým zhoubným nádorem chirurgické odstranění rizikového orgánu. Při zákrocích ke snížení rizika ovariálního karcinomu je třeba vždy odstranit i vejcovod (tedy provádět adnexektomii, ne pouze ovarektomii), neboť tuba, zřejmě i ovariální epitel, a peritoneum mají stejný embryonální základ a dávají vznik histologicky stejnému zhoubnému nádoru – seróznímu adenokarcinomu [31]. U pokročilých stadií karcinomu je často nemožné rozhodnout o jeho primárním původu – pro terapii nebo prognózu pacientky to však nemá význam. Vzhledem ke společným cestám karcinogeneze (společné nádorové kmenové buňce) jmenovaných tří tkání neznamená profylaktická adnexektomie absolutní eliminaci rizika vzniku nádoru, ponechává reziduální riziko vzniku primárního peritoneálního karcinomu. U nosiček mutací genů BRCA1/ 2 redukuje profylaktická adnexektomie riziko jak karcinomu vaječníků (o 96 %), tak karcinomu prsu (o 53 % u nosiček mutací genu BRCA1, o 72 % u nosiček mutací genu BRCA2) [32,33]. Redukce rizika karcinomu prsu je překvapující u nosiček mutací genu BRCA1, kde je většina nádorů hormonálně independentních; souvisí zřejmě s omezením produkce karcinogenních DNA aduktů s metabolity estrogenů [34]. V letošním roce však byla publikována práce, která protektivní efekt adnexektomie na snížení rizika vzniku karcinomu prsu nenachází [35].
Významné je především to, že profylaktické adnexektomie vedou nejen ke snížení rizika vzniku gynekologického nádoru, ale také, logicky, k 95% redukci mortality na gynekologický nádor, a především k redukci celkové mortality BRCA1/ 2 pozitivních pacientek o 76 % [36].
Na časování profylaktické chirurgie u nosiček mutací genů BRCA1/ 2 panuje obecná shoda. Nejvhodnější je provést operaci mezi 35. a 40. rokem života nebo po dokončení reprodukčního plánu. Argumentace u nosiček mutace genu BRCA1 spočívá jasně ve strmém nárůstu rizika vzniku nádoru právě v tomto věku. U nosiček mutace genu BRCA2 začíná riziko stoupat o cca 10 let později, mezi 45. a 50. rokem života. Nicméně až u 34 % těchto žen vznikne karcinom prsu před 50. rokem života. Proto i tyto pacientky mohou významně profitovat z profylaktické operace provedené mezi 35. a 40. rokem života pro redukci rizika vzniku karcinomu prsu, což dokládá i analýza celkové mortality [2,37,38].
Z chirurgických metod redukujících riziko vzniku karcinomu vaječníků byla také zmiňována ligace vejcovodů. Postupně byla tato metoda pro nedostatek dat o jejím efektu opuštěna. Recentní metaanalýza 13 studií zabývajících se ligací vejcovodů u BRCA pozitivních pacientek však prokázala efekt redukce rizika serózního (RR 0,4) a endometroidního (RR 0,73), nikoli mucinózního karcinomu vaječníků [39].
Hysterektomie jako součást profylaktické operace
U nosiček mutace genu BRCA1/ 2 neexistuje dosud jasný postoj k provádění profylaktické hysterektomie zároveň s adnexektomií. Pro provedení hysterektomie hovoří možnost úplného odstranění tuby včetně jejího intramurálního průběhu, byť vznik karcinomu v intramurální části tuby nebyl dosud u nosiček mutací genů BRCA1/ 2 popsán. Dalším uváděným argumentem je možnost užívání tamoxifenu bez rizika jeho vlivu na endometrium, což může být významné u žen s hormonálně dependentním karcinomem prsu nebo u žen s mutací v genu BRCA2 užívajících tamoxifen jako primární profylaxi. Některé práce uvádějí u nosiček mutací genů BRCA1/ 2 i vyšší riziko vzniku endometriálního karcinomu (typu II – serózního nebo clear-cell nebo karcinosarkomu) [40,41]. Zmiňováno je také nižší ovlivnění prsní žlázy u čistě estrogenní hormonální (hormone replacement therapy – HRT), kterou lze podávat pouze u žen po hysterektomii, ve srovnání s HRT kombinovanou, byť u nosiček mutací po profylaktické operaci nebyl dosud odlišný vliv prokázán.
Proti provedení hysterektomie hovoří delší hospitalizace a morbidita spojená s rozsáhlejším operačním výkonem. Často tradovaný vliv hysterektomie na riziko rozvoje inkontinence moči a negativní vliv na sexuální funkce (bolest při pohlavním styku, snížené libido) nebyly dosud spolehlivě prokázány [42 – 44]. Je však nutné i tyto aspekty s pacientkou diskutovat.
Na základě současných poznatků není hysterektomie ve všech centrech standardní součástí profylaktické operace. Argumenty pro a proti hysterektomii je třeba diskutovat s každou pacientkou a zvážit individuálně prospěch oproti rizikům. U uživatelek tamoxifenu se soudí, že prospěch z provedení hysterektomie převažuje její rizika. Existuje dosud pouze jediná kanadská práce prezentovaná na kongresu IGCS v Bangkoku, která uvádí významnou redukci vzniku primárního peritoneálního karcinomu u nosiček mutací genů BRCA1/ 2 (RR 0,05, tj. reziduální riziko 0,5 % – ve srovnání s reziduálním rizikem 4 % při neprovedení hysterektomie), je-li součástí profylaktické operace i hysterektomie [45].
Provedení hysterektomie jako součást profylaktické operace by mělo být doporučeno každé nosičce mutace. V souhrnu jsou hlavními argumenty pro provedení hysterektomie eliminace výskytu rizikových histotypů karcinomu endometria, eliminace rizika případného vlivu tamoxifenu na endometrium, pravděpodobně nižší riziko ovlivnění prsů při užívání čistě estrogenní hormonální substituce a pravděpodobně další snížení reziduálního rizika vzniku primárního peritoneálního karcinomu.
Profylaktická salpingektomie
Současný pohled na vznik jednotky označované jako ovariální karcinom mění zažitá schémata. Většina high-grade serózních karcinomů (dominantní, ne-li jediný histotyp u BRCA pozitivních žen) vzniká ve vejcovodech (v jejich terminální části) [46]. Na základě tohoto zjištění vznikla široká diskuze, zda by u BRCA pozitivních žen nebylo s ohledem na zachování hormonální produkce vhodné provedení salpingektomie po dokončení reprodukčních plánů s následným provedením (dokončením) ovarektomie mezi 40. a 45. rokem věku. Jakkoliv se tato úvaha jeví logická, nemáme dosud k dispozici data, která by prokázala stejnou míru snížení rizika vzniku karcinomu vaječníků (stejnou bezpečnost) pro profylaktické odstranění vejcovodů jako pro profylaktické odstranění vejcovodu a vaječníku. V únoru 2015 byla publikována velká švédská retrospektivní práce analyzující data více než 200 000 žen (bez znalosti mutačního statutu), které podstoupily operaci na děloze nebo adnexech (hysterektomii, adnexektomii, unilaterální nebo bilaterální salpingektomii, sterilizaci) pro benigní onemocnění ve srovnání s pětimilionovou kontrolní populací. Bilaterální salpingektomie signifikantně snížila riziko vzniku ovariálního karcinomu (HR 0,35). Pro srovnání – redukce rizika byla zaznamenána i u tubární sterilizace (HR 0,72) a hysterektomie bez adnexektomie (HR 0,79). Hysterektomie s bilaterální adnexektomií však znamenala významně vyšší redukci rizika (HR 0,06) [47]. Specifická data pro nosičky mutací genů BRCA1/ 2 však nejsou k dispozici a data získaná na běžné populaci nelze jednoduše vztahovat i na populaci s genetickou dispozicí.
Pokud je s pacientkou jako alternativa profylaktické adnexektomie diskutována možnost dvoudobé operace, je třeba s ní také diskutovat, že pouhé odstranění vejcovodů (salpingektomie) nemá u BRCA pozitivních žen efekt na snížení rizika vzniku karcinomu prsu. Dále je třeba zvážit poměrně vysokou incidenci okultního karcinomu v preparátech po profylaktické adnexektomii u BRCA1/ 2 pozitivních žen (až 10 %), navíc u nosiček mutací genu BRCA1 byly všechny zachycené okultní karcinomy primárně ovariální [48,49]. Standardem tak stále zůstává profylaktická adnexektomie. Salpingektomii bez ovarektomie lze po adekvátním poučení nabídnout BRCA pozitivním ženám, které si přejí zachovat ovariální funkci. V běžné populaci je odstranění vejcovodů vhodné provést jako profylaktický výkon při všech gynekologických operacích pro benigní diagnózu u žen po ukončení reprodukčních plánů.
Menopauzální příznaky a jejich management
Menopauzální příznaky po profylaktické adnexektomii jsou velmi časté, často inverzně korelují se satisfakcí po operaci [50]. Léčba těchto symptomů může být problematická především u pacientek s předešlým karcinomem prsu. U dvou třetin pacientek se jeví jako účinné, především na vazomotorické symptomy, podání selektivních inhibitorů zpětného vychytávání serotoninu. Systémová hormonální substituce je u většiny pacientek s karcinomem prsu kontraindikovaná a musí být zvažována přísně individuálně [51]. Dvě studie, které zkoumaly možnost podání hormonální substituce tibolonem (látkou s kombinovaným estrogenním a gestagenním účinkem, avšak nízkým vlivem na prsní žlázu) u žen po léčbě pro karcinom prsu, byly předčasně ukončeny pro nárůst recidiv [52,53]. Nízkodávkovaná vaginálně aplikovaná estrogenní substituce je mnohými považována za bezpečnou; určité opatrnosti je třeba u uživatelek inhibitorů aromatáz, kde byly pozorovány vyšší systémové hladiny estrogenů i při vaginálním podání.
Existuje zatím jediná studie, která hodnotí krátkodobé podání hormonální substituce (HRT nebo estrogen replacement therapy – ERT) zdravým nosičkám mutací po profylaktické operaci [33] a považuje je za bezpečné za podmínky vysazení HRT ve věku předpokládané menopauzy, tj. kolem 50. roku života. Vzhledem k nedostatku dalších dat poučujeme nosičky o tom, že užívání hormonální substituce po profylaktické operaci je relativně bezpečné, mohlo by však nepatrně snížit benefit redukce rizika karcinomu prsu.
Při ponechání dělohy je třeba, aby byla pacientka substituována kombinovanou léčbou (estrogen + gestagen), event. lze kombinovat i nitroděložní tělísko s obsahem gestagenu a estrogenní substituci. Po hysterektomii je dostatečná čistě estrogenní substituce. Vždy začínáme nejnižší dávkou a případně ji stupňujeme do potlačení příznaků menopauzy. U postmenopauzálních žen bylo popsáno významnější zvýšení rizika vzniku karcinomu prsu u uživatelek kombinované hormonální substituční léčby ve srovnání s uživatelkami čistě estrogenní léčby [54]. Tyto závěry však nelze vztahovat na ženy s arteficiální menopauzou, a navíc nebyl tento efekt u BRCA pozitivních žen užívajících hormonální substituci po profylaktické adnexektomii potvrzen [55].
Vzhledem k nárůstu rizika osteoporózy po předčasné arteficiální menopauze je doporučováno stanovení denzity kostní tkáně před profylaktickou operací a v odstupu 1 – 2 let po operaci a event. dispenzarizace v osteocentru. Vzhledem ke kardiovaskulárním rizikům je dále doporučováno vyšetření rizikových faktorů kardiovaskulárního onemocnění, tj. především hypercholesterolemie, hypertenze, diabetu a kouření, optimálně v rukou poučeného praktického lékaře.
Indikace k profylaktické operaci
Provedení preventivní adnexektomie, event. s hysterektomií, je indikováno u žen s prokázanou hereditární dispozicí ke vzniku karcinomu prsu/ vaječníků (mutace v genu BRCA1/ 2) nebo s klinicko-geneticky jasně patrným extrémně vysokým rizikem vzniku karcinomu vaječníků.
Provedení zákroku musí předcházet podrobný pohovor s pacientkou provedený genetikem, klinickým onkologem a onkogynekologem. V mnoha případech je nutné opakovaným vysvětlením napomoci překonat obavy pacientky z pooperačních změn a možných komplikací. Nejproblematičtější skupinou jsou v tomto případě asymptomatické nosičky mutací.
Před provedením operace je nutné provést aktuální gynekologické a mamologické vyšetření – mamografie, MRI, UZ prsů, UZ břicha (včetně hodnocení kalichopánvičkového systému), tumor marker CA125, expertní gynekologický UZ, případně CT nebo MRI pánve při nejasnostech gynekologického nálezu. Při rozhodování o rozsahu a radikalitě gynekologické operace nutno tedy brát v úvahu řadu významných faktorů a postup individualizovat:
- u závažných genetických poruch potvrzených genetickým testováním, s prokázaným vysokým rizikem vzniku gynekologických malignit se přikláníme k provedení komplexního výkonu (hysterektomie s adnexektomií);
- je nutno rozlišovat, zda se jedná o zdravou nosičku nebo již onkologicky nemocnou ženu (vliv terapie tamoxifenem s rizikem hyperplazie nebo jiná patologie v oblasti endometria); v těchto případech je rovněž vhodnější komplexní výkon (hysterektomie s adnexektomií);
- aktuální gynekologický nález a nálezy, pro něž je dotyčná dlouhodobě sledována (dysplazie čípku, myomatóza, endometrióza, ovariální cysty, polypy endometria, atd.);
- provedení samotné adnexektomie u zdravých nosiček mutace BRCA1/ 2 má význam v prevenci vzniku karcinomu prsu;
- vždy doporučujeme provedení hysterektomie, především u nosiček mutace genu BRCA1.
Rozhodující slovo má pacientka, neboť podmínkou operace je písemný informovaný souhlas s rozsahem a typem výkonu s plnou informací o pooperačních změnách, které po zákroku nastanou, včetně vysvětlení možností jejich řešení (estrogen deficitní syndrom).
Technické provedení
Preferujeme laparoskopické a laparovaginální techniky. Rozhodne-li se pacientka pro hysterektomii, pak totální laparoskopickou hysterektomii nebo laparoskopicky asistovanou vaginální hysterektomii dle velikosti dělohy. Přeje-li si pacientka dělohu zachovat, je třeba resekovat vejcovody co nejblíže rohům děložním. Ligamentum suspensorium ovarii má být přerušeno 1 – 2 cm od okraje ovaria. Součástí operace je laváž dutiny břišní a pečlivá explorace celé dutiny s popisem v operačním protokolu (detailně popsat nález v dutině břišní, vzhled seróz, vaječníků a vejcovodů a povrchu jater a bránice) a event. s odebráním biopsií ze suspektních míst.
Při nepříznivých anatomických podmínkách v dutině břišní (četné adheze, endometrióza) je nutno odstranit veškeré ovariální a tubární tkáně a detailně v protokolu výkonu popsat možnost ponechaného rezidua.
Určité opatrnosti a rozvahy je třeba, pokud pacientka plánuje profylaktickou mastektomii s rekonstrukcí pomocí TRAM nebo DIEP laloků. V takovém případě je při zavádění portů pro laparoskopii třeba pečlivě šetřit hlubokou dolní epigastrickou arterii a perforátory v okruhu 8 cm kolem pupku. V případě nutnosti Pfannenstielova řezu vést incizi co nejníže. Střední laparotomie je pak významnou překážkou pro možnost rekonstrukce prsů vlastní tkání.
Histopatologické vyšetření
Výskyt okultního karcinomu tuby nebo ovaria je uváděn ve 2 – 10 %. Veškerý operační materiál je nutno kvalitně histologicky vyšetřit. Obě tuby musí být vyšetřeny sériovými řezy po 2 – 3 mm dle protokolu SEE-FIM (sectioning and extensively examining the fimbria). Děloha a výplachová cytologie zpracovány standardním způsobem [56].
Preimplantační genetickádiagnostika
Hereditární mutace genů BRCA1 a BRCA2 patří mezi monogenně podmíněné dispozice s neúplnou penetrancí a pozdější manifestací klinických symptomů. V dětském věku nejsou (s výjimkou extrémně vzácné homozygozity pro mutace genu BRCA2) nosiči těchto mutací ohroženi vznikem nádorů. Na současné úrovni poznání a nastavení etických mezí nelze páru nabízet prenatální diagnostiku (tedy vyšetření genotypu plodu v děloze) mutací genů BRCA1 a BRCA2. Nosičkám či nosičům mutací genů BRCA1/ 2 však lze nabídnout preimplantační genetickou diagnostiku (PGD), tedy metodu založenou na selekci in vitro fertilizovaných oocytů, resp. vzniklých embryí, která je obecně eticky akceptována [57]. Indikaci k provedení PGD dává klinický genetik na základě zájmu páru o tuto metodu a poučení páru o možnostech selhání PGD. Klinický genetik zváží mutační analýzu i u druhého partnera, event. zváží nutnost vyloučení jiných dědičných chorob u obou partnerů a odešle pár s indikací PGD do centra asistované reprodukce. Součástí PGD je in vitro fertilizace (IVF) – ženě jsou podány většinou agonisté GnRH (gonadotropine-releasing hormone) ke stimulaci dozrání většího množství folikulů. V krátké celkové anestezii jsou pak folikuly pod ultrazvukovou kontrolou vaginálně odsáty a v laboratorních podmínkách oplodněny spermiemi partnera metodou ICSI (intracytoplasmatic sperm injection), tedy přímým zavedením (injektáží) spermie do vajíčka. Vzniklá embrya jsou kultivována cca 3 – 5 dnů. Ve stadiu 6 – 8 buněk (tři dny po oplození) jsou z embrya odebrány 1 – 2 buňky k provedení vlastní genetické analýzy. Analýza většinou zahrnuje tzv. preimplantační genetickou haplotypizaci, tj. kromě detekce vlastní mutace i stanovení polymorfních mikrosatelitárních markerů k ověření heterozygozity vzorku a vyloučení tzv. allelic drop-out (ADO), tedy ztráty jedné alely při amplifikaci. Přesto se ADO (a tím i falešná negativita vyšetření) může pohybovat v jednotkách procent [58]. Příprava vlastního vyšetření pro konkrétní pár také vyžaduje určitou dobu (zpravidla 6 – 9 měsíců).
Proces IVF může ženě přinést určitá rizika – vznik ovariálního hyperstimulačního syndromu (0,5 – 5 %), riziko ektopické gravidity (0,5 – 3 %) a riziko pelveoperitonitidy po odběru oocytů (0,5 – 1 %) [59]. Pravděpodobnost otěhotnění po vložení embrya do dělohy není absolutní, u zdravých žen podstupujících PGS se pohybuje v rozmezí 40 – 50 % [60]. Rizika pro samotné těhotenství jsou spojena především s rizikem vícečetné gravidity a měla by být pečlivě diskutována s párem v centru asistované reprodukce. Sledování těhotné ženy po PGD se zpravidla neliší od sledování po spontánním otěhotnění.
Závěr
Ženy s hereditární dispozicí ke vzniku gynekologických zhoubných nádorů představují specifickou skupinu, u níž je, na rozdíl od majority, identifikován zásadní rizikový faktor. V posledních 15 letech, kdy se péče o tyto pacientky rozvíjí, bylo shromážděno množství dat, která nám dovolují nastavit preventivní péči, včetně chirurgických preventivních přístupů. Gynekolog a onkogynekolog jsou nedílnou součástí týmu pečujícího o nosičky hereditárních mutací. Organizace onkologické a onkogynekologické péče v ČR dovoluje soustředit většinu pacientek do specializovaných center s patřičným vybavením a především erudicí. Předkládaná práce shrnuje současné znalosti v této oblasti a její autoři doufají, že může sloužit jako podklad utváření standardů pro centra zabývající se péčí o ženy v hereditárním riziku, popř. i otevřít diskuzi o zajištění péče o tyto ženy v ČR.
Autor deklaruje, že v souvislosti s předmětem studie nemá žádné komerční zájmy.
Redakční rada potvrzuje, že rukopis práce splnil ICMJE kritéria pro publikace zasílané do biomedicínských časopisů.
doc. MUDr. Michal Zikán, Ph.D.
Onkogynekologické centrum
Gynekologicko-porodnická klinika
1. LF UK a VFN v Praze
Apolinářská 18
128 00 Praha 2
e-mail: michal.zikan@lf1.cuni.cz
Obdrženo: 14. 7. 2015
Přijato: 3. 9. 2015
Sources
1. Risch HA, McLaughlin JR, Cole DE et al. Prevalence and penetrance of germline BRCA1 and BRCA2 mutations in a population series of 649 women with ovarian cancer. Am J Hum Genet 2001; 68(3): 700 – 710.
2. King MC, Marks JH, Mandell JB. Breast and ovarian cancer risks due to inherited mutations in BRCA1 and BRCA2. Science 2003; 302(5645): 643 – 646.
3. Zikan M. Hereditární syndromy. In: Cibula D, Petruželka L(eds). Onkogynekologie. Praha: Grada 2009 : 614.
4. Bolton KL, Chenevix-Trench G, Goh C et al. Association between BRCA1 and BRCA2 mutations and survival in women with invasive epithelial ovarian cancer. JAMA 2012; 307(4): 382 – 390. doi: 10.1001/ jama.2012.20.
5. Plevova P, Novotny J, Petrakova K et al. Hereditary breast and ovarian cancer syndrome. Klin Onkol 2009; 22 (Suppl): S8 – S11.
6. Hogg R, Friedlander M. Biology of epithelial ovarian cancer: implications for screening women at high genetic risk. J Clin Oncol 2004; 22(7): 1315 – 1327.
7. Buys SS, Partridge E, Black A et al. Effect of screening on ovarian cancer mortality: the Prostate, Lung, Colorectal and Ovarian (PLCO) cancer screening randomized controlled trial. JAMA 2011; 305(22): 2295 – 2303. doi: 10.1001/ jama.2011.766.
8. Buys SS, Partridge E, Greene MH et al. Ovarian cancer screening in the Prostate, Lung, Colorectal and Ovarian (PLCO) cancer screening trial: findings from the initial screen of a randomized trial. Am J Obstet Gynecol 2005; 193(5): 1630 – 1639.
9. Kobayashi H, Yamada Y, Sado T et al. A randomized study of screening for ovarian cancer: a multicenter study in Japan. Int J Gynecol Cancer 2008; 18(3): 414 – 420.
10. Menon U, Gentry-Maharaj A, Hallett R et al. Sensitivity and specificity of multimodal and ultrasound screening for ovarian cancer, and stage distribution of detected cancers: results of the prevalence screen of the UK Collaborative Trial of Ovarian Cancer Screening (UKCTOCS). Lancet Oncol 2009; 10(4): 327 – 340. doi: 10.1016/ S1470-2045(09)70026-9.
11. Menon U, Griffin M, Gentry-Maharaj A. Ovarian cancer screening – current status, future directions. Gynecol Oncol 2014; 132(2): 490 – 495. doi: 10.1016/ j.ygyno.2013.11.030.
12. Hermsen BB, Olivier RI, Verheijen RH et al. No efficacy of annual gynaecological screening in BRCA1/ 2 mutation carriers; an observational follow-up study. Br J Cancer 2007; 96(9): 1335 – 1342.
13. Stirling D, Evans DG, Pichert G et al. Screening for familial ovarian cancer: failure of current protocols to detect ovarian cancer at an early stage according to the international Federation of gynecology and obstetrics system. J Clin Oncol 2005; 23(24): 5588 – 5596.
14. Rosenthal AN, Fraser L, Manchanda R et al. Results of annual screening in phase I of the United Kingdom familial ovarian cancer screening study highlight the need for strict adherence to screening schedule. J Clin Oncol 2013; 31(1): 49 – 57. doi: 10.1200/ JCO.2011.39.7638.
15. Skates SJ, Mai P, Horick NK et al. Large prospective study of ovarian cancer screening in high-risk women: CA125 cut-point defined by menopausal status. Cancer Prev Res 2011; 4(9): 1401 – 1408. doi: 10.1158/ 1940-6207.CAPR-10-0402.
16. Greene MH, Piedmonte M, Alberts D et al. A prospective study of risk-reducing salpingo-oophorectomy and longitudinal CA-125 screening among women at increased genetic risk of ovarian cancer: design and baseline characteristics: a Gynecologic Oncology Group study. Cancer Epidemiol Biomarkers Prev 2008; 17(3): 594 – 604. doi: 10.1158/ 1055-9965.EPI-07-2703.
17. Van Calster B, Timmerman D, Bourne T et al. Discrimination between benign and malignant adnexal masses by specialist ultrasound examination versus serum CA-125.J Natl Cancer Inst 2007; 99(22): 1706 – 1714.
18. Valentin L, Jurkovic D, Van Calster B et al. Adding a single CA 125 measurement to ultrasound imaging performed by an experienced examiner does not improve preoperative discrimination between benign and malignant adnexal masses. Ultrasound Obstet Gynecol 2009; 34(3): 345 – 354. doi: 10.1002/ uog.6415.
19. Antoniou AC, Rookus M, Andrieu N et al. Reproductive and hormonal factors, and ovarian cancer risk for BRCA1 and BRCA2 mutation carriers: results from the International BRCA1/ 2 Carrier Cohort Study. Cancer Epidemiol Biomarkers Prev 2009; 18(2): 601 – 610. doi: 10.1158/ 1055-9965.EPI-08-0546.
20. McLaughlin JR, Risch HA, Lubinski J et al. Reproductive risk factors for ovarian cancer in carriers of BRCA1 or BRCA2 mutations: a case-control study. Lancet Oncol 2007; 8(1): 26 – 34.
21. Modan B, Hartge P, Hirsh-Yechezkel G et al. Parity, oral contraceptives, and the risk of ovarian cancer among carriers and noncarriers of a BRCA1 or BRCA2 mutation. N Engl J Med 2001; 345(4): 235 – 240.
22. Narod SA, Risch H, Moslehi R et al. Oral contraceptives and the risk of hereditary ovarian cancer. Hereditary Ovarian Cancer Clinical Study Group. N Engl J Med 1998; 339(7): 424 – 428.
23. Narod SA, Dube MP, Klijn J et al. Oral contraceptives and the risk of breast cancer in BRCA1 and BRCA2 mutation carriers. J Natl Cancer Inst 2002; 94(23): 1773 – 1779.
24. Cibula D, Zikan M, Dusek L et al. Oral contraceptives and risk of ovarian and breast cancers in BRCA mutation carriers: a meta-analysis. Export Rev Anticancer Ther 2011; 11(8): 1197 – 1207. doi: 10.1586/ era.11.38.
25. Antoniou AC, Shenton A, Maher ER et al. Parity and breast cancer risk among BRCA1 and BRCA2 mutation carriers. Breast Cancer Res 2006; 8(6): R72.
26. Cullinane CA, Lubinski J, Neuhausen SL et al. Effect of pregnancy as a risk factor for breast cancer in BRCA1/ BRCA2 mutation carriers. Int J Cancer 2005; 117(6): 988 – 991.
27. Kotsopoulos J, Lubinski J, Salmena L et al. Breastfeeding and the risk of breast cancer in BRCA1 and BRCA2 mutation carriers. Breast Cancer Res 2012; 14(2): R42.
28. Vashi R, Hooley R, Butler R et al. Breast imaging of the pregnant and lactating patient: physiologic changes and common benign entities. AJR Am J Roentgenol 2013; 200(2): 329 – 336. doi: 10.2214/ AJR.12.9845.
29. Vashi R, Hooley R, Butler R et al. Breast imaging of the pregnant and lactating patient: imaging modalities and pregnancy-associated breast cancer. AJR Am J Roentgenol 2013; 200(2): 321 – 328.
30. Kotsopoulos J, Librach CL, Lubinski J et al. Infertility, treatment of infertility, and the risk of breast cancer among women with BRCA1 and BRCA2 mutations: a case control study. Cancer Causes Control 2008; 19(10): 1111 – 1119. doi: 10.1007/ s10552-008-9175-0.
31. Norquist BM, Garcia RL, Allison KH et al. The molecular pathogenesis of hereditary ovarian carcinoma: alterations in the tubal epithelium of women with BRCA1 and BRCA2 mutations. Cancer 2010; 116(22): 5261 – 5271. doi: 10.1002/ cncr.25439.
32. Kauff ND, Domchek SM, Friebel TM et al. Risk-reducing salpingo-oophorectomy for the prevention of BRCA1 - and BRCA2-associated breast and gynecologic cancer: a multicenter, prospective study. J Clin Oncol 2008; 26(8): 1331 – 1337.
33. Rebbeck TR, Lynch HT, Neuhausen SL et al. Prophylactic oophorectomy in carriers of BRCA1 or BRCA2 mutations. N Engl J Med 2002; 346(21): 1616 – 1622.
34. Mitrunen K, Hirvonen A. Molecular epidemiology of sporadic breast cancer. The role of polymorphic genes involved in oestrogen biosynthesis and metabolism. Mutat Res 2003; 544(1): 9 – 41.
35. Heemskerk-Gerritsen BA, Seynaeve C, van Asperen CJet al. Breast cancer risk after salpingo-oophorectomy in healthy BRCA1/ 2 mutation carriers: revisiting the evidence for risk reduction. J Natl Cancer Inst 2015; 107(9): pii: djv217. doi: 10.1093/ jnci/ djv217.
36. Domchek SM, Friebel TM, Neuhausen SL et al. Mortality after bilateral salpingo-oophorectomy in BRCA1 and BRCA2 mutation carriers: a prospective cohort study. Lancet Oncol 2006; 7(3): 223 – 229.
37. Ford D, Easton DF, Stratton M et al. Genetic heterogeneity and penetrance analysis of the BRCA1 and BRCA2 genes in breast cancer families. The Breast Cancer Linkage Consortium. Am J Hum Genet 1998; 62(3): 676 – 689.
38. Struewing JP, Hartge P, Wacholder S et al. The risk of cancer associated with specific mutations of BRCA1 and BRCA2 among Ashkenazi Jews. N Engl J Med 1997; 336(20): 1401 – 1408.
39. Cibula D, Widschwendter M, Majek O et al. Tubal ligation and the risk of ovarian cancer: review and meta-analysis. Hum Reprod Update 2011; 17(1): 55 – 67. doi: 10.1093/ humupd/ dmq030.
40. Beiner ME, Finch A, Rosen B et al. The risk of endometrial cancer in women with BRCA1 and BRCA2 mutations: a prospective study. Gynecol Oncol 2007; 104(1): 7 – 10.
41. Schorge JO, Modesitt SC, Coleman RL et al. SGO White Paper on ovarian cancer: etiology, screening and surveillance. Gynecol Oncol 2010; 119(1): 7 – 17. doi: 10.1016/ j.ygyno.2010.06.003.
42. Radosa JC, Meyberg-Solomayer G, Kastl C et al. Influences of different hysterectomy techniques on patients’ postoperative sexual function and quality of life. J Sex Med 2014; 11 : 2342 – 2350. doi: 10.1111/ jsm.12623.
43. Pauls RN. Impact of gynecological surgery on female sexual function. Int J Impot Res 2010; 22(2): 105 – 114. doi: 10.1038/ ijir.2009.63.
44. Duru C, Jha S, Lashen H. Urodynamic outcomes after hysterectomy for benign conditions: a systematic review and meta-analysis. Obstet Gynecol Surv 2012; 67(1): 45 – 54. doi: 10.1097/ OGX.0b013e318240aa28.
45. de Jong D, Rosen BF, Finch A et al. Low incidence of ovarian cancer established by prophylactic hysterectomy and BSO in patients with BRCA1 and BRCA2 mutations. IGCS 2008. Bangkok 2008.
46. Kurman RJ, Shih IE M. The origin and pathogenesis of epithelial ovarian cancer: a proposed unifying theory. Am J Surg Pathol 2010; 34(3): 433 – 443. doi: 10.1097/ PAS.0b013e3181cf3d79.
47. Falconer H, Yin L, Gronberg H et al. Ovarian cancer risk after salpingectomy: a nationwide population-based study. J Natl Cancer Inst 2015; 107(2): pii: dju410. doi: 10.1093/ jnci/ dju410.
48. Powell CB, Chen LM, McLennan J et al. Risk-reducing salpingo-oophorectomy (RrSO) in BRCA mutation carriers: experience with a consecutive series of 111 patients using a standardized surgical-pathological protocol. Int J Gynecol Cancer 2011; 21(5): 846 – 851. doi: 10.1097/ IGC.0b013e31821bc7e3.
49. Manchanda R, Abdelraheim A, Johnson M et al. Outcome of risk-reducing salpingo-oophorectomy in BRCA carriers and women of unknown mutation status. BJOG 2011; 118(7): 814 – 824.
50. Madalinska JB, Hollenstein J, Bleiker E et al. Quality-of-life effects of prophylactic salpingo-oophorectomy versus gynecologic screening among women at increased risk of hereditary ovarian cancer. J Clin Oncol 2005; 23(28): 6890 – 6898.
51. Holmberg L, Anderson H. HABITS (hormonal replacement therapy after breast cancer – is it safe?), a randomized comparison: trial stopped. Lancet 2004; 363(9407): 453 – 455.
52. Bundred NJ, Kenemans P, Yip CH et al. Tibolone increases bone mineral density but also relapse in breast cancer survivors: LIBERATE trial bone substudy. Breast Cancer Res 2012; 14(1): R13.
53. Kenemans P, Bundred NJ, Foidart JM et al. Safety and efficacy of tibolone in breast-cancer patients with vasomotor symptoms: a double-blind, randomized, non-inferiority trial. Lancet Oncol 2009; 10(2): 135 – 146. doi: 10.1016/ S1470-2045(08)70341-3.
54. Chlebowski RT, Kuller LH, Prentice RL et al. Breast cancer after use of estrogen plus progestin in postmenopausal women. N Engl J Med 2009; 360(6): 573 – 587. doi: 10.1056/ NEJMoa0807684.
55. Rebbeck TR, Friebel T, Wagner T et al. Effect of short-term hormone replacement therapy on breast cancer risk reduction after bilateral prophylactic oophorectomy in BRCA1 and BRCA2 mutation carriers: the PROSE Study Group. J Clin Oncol 2005; 23(31): 7804 – 7810.
56. Medeiros F, Muto MG, Lee Y et al. The tubal fimbria is a preferred site for early adenocarcinoma in women with familial ovarian cancer syndrome. Am J Surg Pathol 2006; 30(2): 230 – 236.
57. Quinn GP, Vadaparampil ST, Bower B et al. Decisions and ethical issues among BRCA carriers and the use of preimplantation genetic diagnosis. Minerva Med 2009; 100(5): 371 – 383.
58. Hüttelova R, Kleibl Z, Rezatova J et al. Prerequisites for preimplantation genetic diagnosis (PGD) in carriers of mutations responsible for hereditary cancers. Klin Onkol 2009; 22 (Suppl): S69 – S74.
59. Delvigne A, Rozenberg S. Epidemiology and prevention of ovarian hyperstimulation syndrome (OHSs): a review. Hum Reprod Update 2002; 8(6): 559 – 577.
60. McArthur SJ, Leigh D, Marshall JT et al. Pregnancies and live births after trophectoderm biopsy and preimplantation genetic testing of human blastocysts. Fertil Steril 2005; 84(6): 1628 – 1636.
Labels
Paediatric clinical oncology Surgery Clinical oncology
Article was published inClinical Oncology

2016 Issue Supplementum 1-
All articles in this issue
- Editorial
- Doporučení rozšíření indikačních kriterií ke genetickému testování mutací v genech BRCA1 a BRCA2 u hereditárního syndromu nádorů prsu a ovarií
- Syndrom hereditárního karcinomu prsu a ovarií
- Gynekologická prevence a gynekologické aspekty péče u nosiček mutací genů BRCA1 a BRCA2
- PALB2 jako další kandidátní gen pro genetické testování u pacientů s hereditárním karcinomem prsu v České republice
- Retrospektivní NGS studie u vysoce rizikových pacientů s hereditární predispozicí k nádorovému onemocnění v Masarykově onkologickém ústavu
- CZECANCA: CZEch CAncer paNel for Clinical Application – návrh a příprava cíleného sekvenačního panelu pro identifikaci nádorové predispozice u rizikových osob v České republice
- Genetika tumorigenézy nádorov kolorekta (možnosti testovania a screeningovej predikcie dedičnej formy ochorenia – Lynchovho syndrómu)
- Syndromy predisponující k nádorům v dětském věku – zkušenosti Kliniky dětské onkologie FN Brno
- Genetické syndromy predisponující k dětským nádorům centrálního nervového systému
- Hepatoblastom, etiologie, kazuistiky
- Identifikace rodiny s nosičstvím germinální delece genu SUFU na podkladě diagnózy desmoplastického meduloblastomu u batolete
- Fanconiho anémie, komplementační skupina D1 v důsledku bialelické mutace genu BRCA2 – kazuistika
- Clinical Oncology
- Journal archive
- Current issue
- Online only
- About the journal
Most read in this issue- PALB2 jako další kandidátní gen pro genetické testování u pacientů s hereditárním karcinomem prsu v České republice
- Hepatoblastom, etiologie, kazuistiky
- Genetika tumorigenézy nádorov kolorekta (možnosti testovania a screeningovej predikcie dedičnej formy ochorenia – Lynchovho syndrómu)
- Fanconiho anémie, komplementační skupina D1 v důsledku bialelické mutace genu BRCA2 – kazuistika
Login#ADS_BOTTOM_SCRIPTS#Forgotten passwordEnter the email address that you registered with. We will send you instructions on how to set a new password.
- Career

