-
Medical journals
- Career
Prognostické a prediktivní faktory u adenokarcinomu pankreatu
Authors: P. Karásek 1; M. Hermanová 2
Authors‘ workplace: Klinika komplexní onkologické péče, Masarykův onkologický ústav, Brno 1; I. patologicko-anatomický ústav, LF MU a FN u sv. Anny v Brně 2
Published in: Klin Onkol 2016; 29(5): 336-341
Category: Reviews
doi: https://doi.org/http://dx.doi.org/10.14735/amko2016336Overview
Východiska:
Duktální adenokarcinom pankreatu je vysoce agresivní onemocnění s celkovým 5letým přežitím nepřesahujícím 5 %. V ČR má incidence tohoto nádoru vzestupný trend, dle posledních statistik již patříme celosvětově na první místo ve výskytu této malignity. Pro toto onemocnění je typická pozdní diagnostika vzhledem k asymptomatickému průběhu nemoci v časném stadiu.Cíl:
Cílem tohoto článku je podat přehled o nejvýznamnějších faktorech, které dle současných znalostí u adenokarcinomu pankreatu mají prognostický a prediktivní potenciál. Práce popisuje jednak tradiční prognostické faktory, jako je resekabilita nádoru, jeho rozsah a lokalizace, aplikace adjuvantní chemoterapie, mikroskopicky pozitivní resekční okraj, přítomnost metastáz v lymfatických uzlinách, histologický grading, vaskulární a perineurální invaze. Dále uvádí celou řadu různých biologických markerů, které by mohly přispět k včasné detekci nádoru, lepší prognóze a k optimalizaci léčby, např. hENT1 (human equilibrative nucleoside transporter-1), SPARC (secreted protein acidic and rich in cystein), AGR2, Bcl-2, VEGF, Ki-67, COX-2 a další. Zmíněny jsou rovněž genové alterace a význam mikroRNA.Závěr:
I přes velké úsilí, které bylo věnováno výzkumu biologických markerů, zatím jediný klinicky akceptovaný a v klinice používaný zůstává nádorový marker CA 19-9. Jeho využití je především u pacientů s již diagnostikovaným adenokarcinomem pankreatu. Velká pozornost je v poslední době zaměřena na další potenciální biomarkery, jejich zavedení do klinické praxe bude ale ještě vyžadovat další výzkum.Klíčová slova:
karcinom pankreatu duktální − nádorové biomarkery − prognóza − prognostické faktoryÚvod
Duktální adenokarcinom pankreatu patří mezí nádorová onemocnění s nejhorší prognózou. Celosvětově bylo v roce 2012 diagnostikováno kolem 340 000 nových případů, z toho 110 000 v zemích Evropské unie [1]. Mortalita se u tohoto onemocnění téměř rovná incidenci. V ČR má incidence tohoto nádoru vzestupný trend, v roce 2013 bylo hlášeno 19,56 nových případů na 100 000 osob, v absolutním počtu to je 2 056 osob, což oproti datům ze 70. let 20. století představuje více než dvojnásobný vzestup [2]. Dle posledních statistických odhadů zaujímá ČR celosvětově první místo v incidenci této choroby [1].
Jedná se o vysoce agresivní onemocnění s 5letým celkovým přežitím (overall survival – OS) nepřesahujícím 5 %. I přes pokroky v diagnostice a léčbě v posledním desetiletí prognóza tohoto onemocnění zůstává tristní. Typická je pozdní diagnostika vzhledem k asymptomatickému průběhu nemoci v časném stadiu. Jedinou možností vyléčení je radikální resekce, ale vzhledem k časté přítomnosti mikrometastáz dochází velice často k recidivě onemocnění. Resekabilní onemocnění diagnostikujeme pouze u 10 % pacientů, u kterých je medián OS mezi 17 a 23 měsíci, lokálně pokročilé neresekabilní onemocnění je asi v 30 % případů s mediánem OS 8–24 měsíců a metastatické onemocnění je zhruba u 60 % pacientů s OS 4–9 měsíců [3].
V běžné klinické praxi je v současné době u adenokarcinomu pankreatu jediným užívaným onkomarkerem CA 19-9. Tento marker však nevykazuje potřebnou specificitu pro karcinom pankreatu, a proto není dostatečný pro diagnostiku tohoto onemocnění.
Vzhledem k těmto skutečnostem je vysoce žádoucí identifikace nových sérových biomarkerů, které by mohly přispět ke zlepšení léčebných výsledků tohoto zákeřného onemocnění (tab. 1).
Table 1. Souhrn nejvýznamnějších prognostických a prediktivních biomarkerů u karcinomu pankreatu. 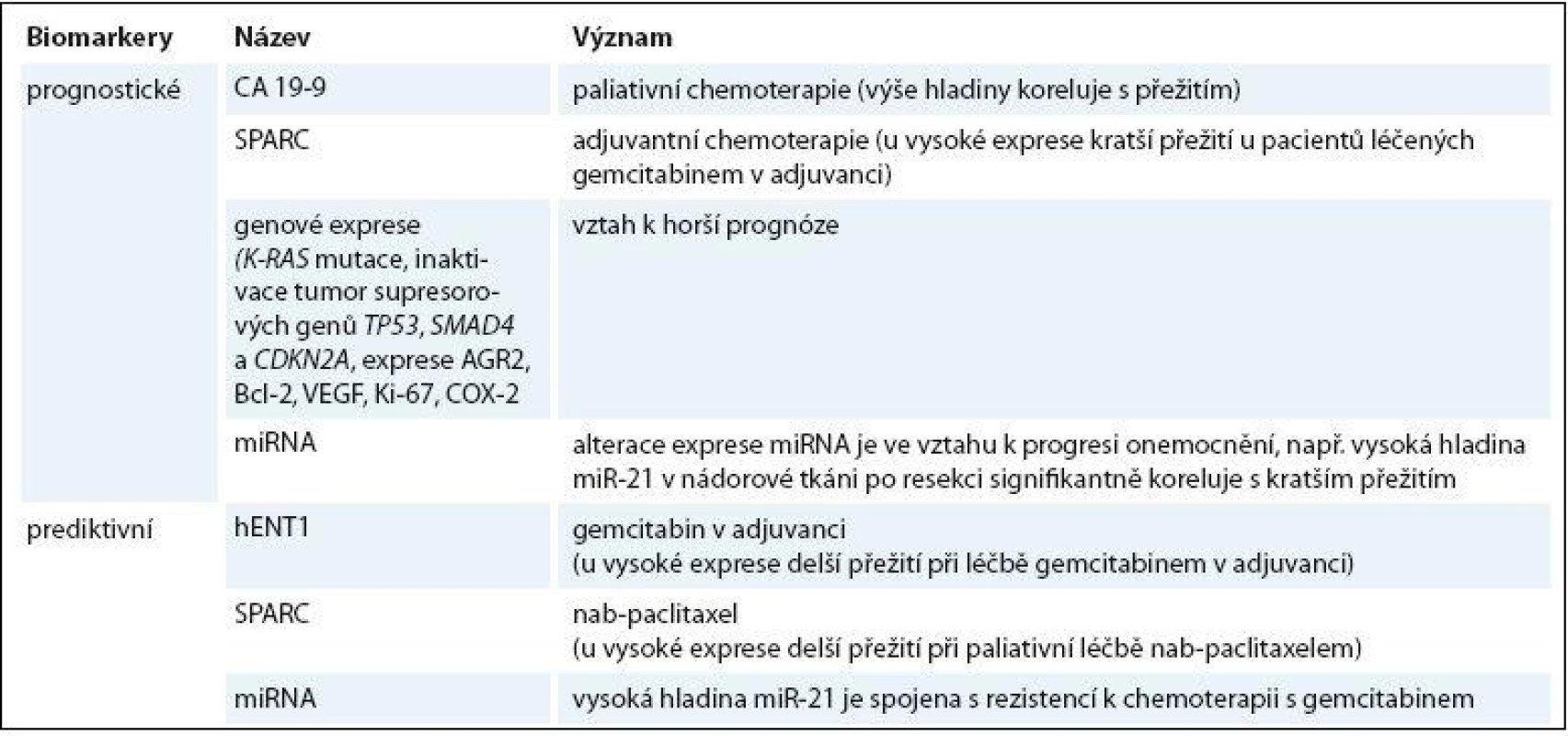
Tradiční prognostické faktory
Pro prognózu onemocnění je nejdůležitější resekabilita nádoru [4]. U pacientů po kurativní resekci se 5leté OS pohybuje mezi 15 a 25 %. Bohužel u 70–90 % těchto nádorů dochází k recidivě do dvou let od operace, a to nejčastěji v lokalizaci lokoregionální a v játrech [5].
Horší prognózu mají karcinomy v těle a kaudě pankreatu, protože bývají diagnostikovány v pozdějším stadiu než nádory v hlavě slinivky [6].
Dalším prognostickým faktorem je rozsah primárního nádorového infiltrátu. Přežití je delší u pacientů s nádorem omezeným na pankreas s velikostí nádoru do průměru 30 mm než u nádorů nad 30 mm a šířící se mimo pankreas [7].
Adjuvantní chemoterapie s gemcitabinem nebo s 5-fluorouracilem (5-FU) prodlužuje medián přežití bez příznaků nemoci (disease-free survival – DFS) a OS [8–10]. Dle randomizované klinické studie CONKO-004 u pacientů léčených adjuvantní chemoterapií s gemcitabinem bylo 5leté OS 20,7 vs. 10,4 % u pacientů bez adjuvantní léčby [11].
Nejednoznačné jsou výsledky studií zkoumajících vliv mikroskopicky pozitivního resekčního okraje (R1 resekce) na OS. Dle studie ESPAC-1 byl medián OS u R1 resekcí 10,9 vs. 16,9 měsíce u R0 resekcí [12]. Podíl R1 resekcí byl v této studii 19 %. V dalších studiích se podíl R1 resekcí pohybuje od 17 do 85 %. Tento velmi široký rozdíl byl pravděpodobně zapříčiněn rozdílnou definicí pozitivity resekčních okrajů a absencí standardizovaného histopatologického protokolu. V roce 2006 Verbeke et al uvedli standardizovaný, tzv. Leedský protokol [13]. Novější studie, které zpracovávaly resekáty dle tohoto protokolu, mají podíl R1 resekcí nad 80 % [14,15]. Dle studie německých autorů z roku 2014 u 125 pacientů po chirurgické resekci adenokarcinomu hlavy pankreatu, kde archivované resekáty byly opětovně vyšetřeny dle Leedského protokolu, se podíl R1 resekcí zvýšil z 13 na 52 %. R1 resekce zde byla definována jako přítomnost nádorové infiltrace méně než 1 mm od jakéhokoliv resekčního okraje. Dle této studie nebyl zjištěn signifikantní rozdíl v OS mezi R0 a R1 resekcí [16].
Prognózu signifikantně zhoršuje přítomnost metastáz v lymfatických uzlinách. U pacientů bez nádorového postižení uzlin byl medián OS 25–27 vs. 15–16 měsíců u stadia N1. Rovněž signifikantním prediktorem pro OS je absolutní počet pozitivních uzlin a poměr počtu pozitivních lymfatických uzlin k celkovému počtu vyšetřených uzlin [17,18]. Mezi další významné prognostické faktory pro přežití patří histologický grading [19], vaskulární invaze a perineurální invaze [20].
CA 19-9
V běžné klinické praxi je v současné době u adenokarcinomu pankreatu jediným užívaným biomarkerem CA 19-9. Jeho zvýšená hladina u pacientů po radikální operaci karcinomu pankreatu upozorňuje na metastatické onemocnění. CA 19-9 je tedy důležitým vstupním kritériem v klinických studiích s adjuvantní a neoadjuvantní léčbou. Před paliativní léčbou byl CA 19-9 potvrzen jako nezávislý prognostický faktor pro přežití – čím je vyšší hodnota tohoto markeru, tím je přežití pacienta kratší. V průběhu chemoterapie je biochemická odpověď na léčbu komplementární k radiologické odpovědi, umožňuje lepší vyhodnocení efektu léčby a rozhodování o další léčbě v klinické praxi [21].
CA 19-9 není specifický pro karcinom pankreatu, a proto není vhodný pro screening a diagnostiku tohoto onemocnění. Značně zvýšené hladiny CA19-9 v séru působí také cholestáza, ale i benigní a zánětlivá onemocnění žaludku, střeva, pankreatu a jater. Osoby, u kterých chybí Lewisův antigen, nemohou tento marker syntetizovat. Jeho senzitivita je udávaná mezi 41 a 86 % a specificita mezi 33 a 100 % [22].
hENT1
Gemcitabin má i nadále důležité místo v paliativní a adjuvantní léčbě adenokarcinomu pankreatu. V této souvislosti jsou studovány možné biomarkery, které by mohly predikovat přežití pacientů léčených gemcitabinem. Významným se jeví hENT1 (human equilibrative nucleoside transporter-1). Gemcitabin, který je hydrofilní, potřebuje k překonání buněčné membrány transportní protein. Je prokázáno, že při nízké hladině hENT1 je menší efekt gemcitabinu pro jeho sníženou buněčnou absorbci. hENT1je považován za hlavního přenašeče gemcitabinu pro jeho vysokou afinitu ke gemcitabinu a jeho transportní kapacitu [23].
Jaký má vliv hladina hENT1 na přežití v adjuvantní léčbě s gemcitabinem a 5-FU, zkoumala studie s použitím klinických dat a nádorové tkáně shromážděné z prospektivní randomizované studie prováděné European Study Group for Pancreatic Cancer (ESPAC) [24]. K analýze bylo vhodných 380 pacientů. Studie prokázala, že nemocní s vysokou expresí hENT1 léčení gemcitabinem mají významně delší OS oproti pacientům s nízkou expresí hENT1 (26,2 vs. 17,1 měsíce). U pacientů léčených 5-FU nebyl významný rozdíl v OS mezi skupinami s vysokou a nízkou expresí hENT1 (21,9 vs. 25,6 měsíce). Multivariantní analýza potvrdila, že hENT1 exprese je prediktivní marker pro adjuvantní léčbu s gemcitabinem a že pacienti s nízkou expresí hENT1 by neměli být gemcitabinem léčeni.
Další randomizovaná prospektivní studie u 358 pacientů byla provedena za účelem zjištění, zda CO-101 zlepšuje přežití oproti gemcitabinu u metastatického karcinomu pankreatu s nízkým hENT1. CO-101 se skládá z molekuly gemcitabinu vázané kovalentní esterovou vazbou na molekulu kyseliny elaidové. Tato nenasycená mastná kyselina umožňuje vstup gemcitabinu do buňky nezávisle na hENT1. Dle výsledků této studie CO-101 neprokázal delší OS oproti gemcitabinu u pacientů s nízkou expresí hENT1. Rovněž ale také nebyl rozdíl v OS u pacientů s vysokou nebo nízkou expresí hENT1, kteří byli léčeni gemcitabinem [25]. Je tedy možné, že význam hENT1 je méně důležitý u metastatického onemocnění než po operaci s předpokládaným mikrometastatickým rozsevem. Nutno ale podotknout, že výsledky uvedených studií mohou být rozdílné i z důvodu použití rozdílných monoklonálních protilátek při imunohistochemickém stanovení exprese hENT1. Před začleněním stanovení hENT1 do klinické praxe tedy bude třeba vyřešit problémy spojené s metodologickými aspekty, a to zejména identifikaci optimální anti-hENT1 protilátky [26].
SPARC
V poslední době se výzkum u karcinomu pankreatu soustředil nejen na vlastní nádorové buňky, ale také na peritumorózní stroma a jeho interakce. SPARC (secreted protein acidic and rich in cystein), také nazýván jako osteonectin, patří do rodiny matricelulárních proteinů, které jsou asociované se strukturálními komponenty extracelulární matrix. U karcinomu pankreatu byla zjištěna jeho overexprese ve srovnání s normální tkání a je spojován s agresivním chováním nádoru [27].
V roce 2014 Sinn et al zkoumali retrospektivně stromální a cytoplazmatickou expresi SPARC a její vliv na prognózu u pacientů, kteří nebyli léčeni adjuvantní chemoterapií ve srovnání s pacienty léčenými gemcitabinem. K tomuto srovnání použili nádorovou tkáň a klinická data z randomizované studie III. fáze CONKO-001, která prokázala pozitivní vliv adjuvantní chemoterapie s gemcitabinem na prodloužení DFS a OS ve srovnání s observací. Vysoká stromální i cytoplazmatická exprese SPARC byla spojena s kratším DFS i kratším OS u pacientů léčených gemcitabinem. U pacientů bez adjuvantní léčby s vysokou či nízkou expresí rozdíl v OS nebyl. Studie tedy potvrdila prognostický význam exprese SPARC u pacientů léčených adjuvantní chemoterapií s gemcitabinem [28].
Ještě více zajímavá je potenciální role SPARC jako prediktivního markeru pro léčbu s nab-paclitaxelem. Nab-paclitaxel díky své vazbě na albumin má nejen nižší toxicitu oproti paclitaxelu, ale také vyšší vazbu na nádorové buňky karcinomu pankreatu při vysoké expresi SPARC. Von Hoff et al zkoumali význam exprese stromálního SPARC u pacientů léčených paliativní chemoterapií kombinací nab-paclitaxel a gemcitabin u 37 pacientů ve studii fáze I/II. V této studii pacienti s vysokou expresí SPARC léčení kombinovanou chemoterapií měli lepší výsledky, s mediánem OS 18 vs. 8 měsíců s nízkou expresí SPARC [29]. Avšak poslední data z klinické studie MPACT fáze III tyto výsledky nepotvrzují [30]. K průkazu, zda exprese SPARC je prediktorem účinnosti paliativní léčby s kombinací gemcitabin a nab-paclitaxel, bude nutný další výzkum.
Genové alterace
Výzkum v posledních desetiletích ukázal, že karcinom pankreatu je v podstatě genetické onemocnění, protože při vzniku a progresi karcinomu pankreatu byla prokázána účast mnohonásobných genových alterací. V poslední době je hlavní pozornost v této oblasti směřována na výzkum genu RAS, resp. KRAS. Při vývoji karcinomu pankreatu je klíčová aktivace onkogenu KRAS, vyskytuje se v 90 % duktálních adenokarcinomů pankreatu [31]. Tyto aktivující bodové mutace jsou první známou genetickou alterací u karcinomu pankreatu. V zdravé tkáni pankreatu se vyskytuje jen sporadicky, v prekurzorových lézích duktálního adenokarcinomu pankreatu procento mutace v onkogenu KRAS koreluje se stupněm dysplazie – mutace KRAS byly detekovány u 36, resp. 44 % PanIN-1A a PanIN-1B lézí, mutovaný KRAS byl identifikován u 87 % PanIN-2 a -3 lézí, u pokročilého karcinomu pankreatu jsou KRAS mutace identifikovatelné u více než 90 % karcinomů [32]. Mnoho klinických studií se zaměřilo na KRAS jako terapeutický cíl, u karcinomu pankreatu ale s malým léčebným úspěchem. Příkladem je inhibice KRAS působením inhibitoru farnesyltransferázy [33].
V nedávné době bylo zjištěno, že onkogen KRAS není samostatně aktivní, ale vyžaduje aktivaci upstream stimulanty, což poskytuje do budoucna zajímavé možnosti prevence [34]. Jelikož se mutace tohoto onkogenu mohou vyskytovat i u zdravých jedinců, intervence s cílem redukce jeho aktivace by mohly být účinné v prevenci vzniku tohoto nádoru.
V patogenezi karcinomu pankreatu je také významná inaktivace tumor supresorových genů TP53, SMAD4 a CDKN2A [35]. Tyto inaktivace nemusí být způsobeny jen mutacemi, ale i delecemi či epigenetickými alteracemi a jsou spojovány s větší agresivitou onemocnění [36].
AGR2
Jako potenciální biomarker adenokarcinomu pankreatu je v poslední době uvažován protein AGR2. Tento protein se obvykle vyskytuje v endoplazmatickém retikulu, dále na povrchu buněk a často dochází k jeho sekreci ven z buněk [37]. Zvýšená exprese tohoto proteinu byla detekována v prekancerózních lézích, nádorových buňkách, buněčných liniích odvozených od karcinomu pankreatu a také v cirkulujících nádorových buňkách [38,39]. Na molekulární úrovni AGR2 stimuluje buněčný růst a proliferaci, podporuje invazivitu a především schopnost přežívání pankreatických nádorových buněk, a významně tak může přispívat k rezistenci na podávanou léčbu [39,40].
Bcl-2
Apoptóza, programovaná smrt buňky, je nezbytná část normálního vývoje, homeostázy a imunoregulace. Během maligního procesu nádorové buňky získávají ke spontánní apoptóze rezistenci. Bcl-2 proteiny regulují apoptózu vlivem na mitochondriální integritu. Dle výsledků některých studií exprese Bcl-2 je nezávislý marker pro delší přežití u duktálního adenokarcinomu pankreatu [41,42]. Příznivý prognostický efekt Bcl-2 by mohl být v souvislosti s jeho non-apoptotickou funkcí, jako je např. kontrola buněčného cyklu nebo porucha v expresi dalších proteinů rodiny Bcl-2. Nicméně role Bcl-2 jako prognostického faktoru u karcinomu pankreatu zůstává nejasná, protože další studie korelaci s přežitím neprokázaly [43,44].
VEGF
K tomu, aby mohl zhoubný nádor při svém růstu přesáhnout velikost 1 mm3, je potřeba neovaskularizace. Angiogeneze je dynamický proces regulovaný jak proangiogenními, tak antiangiogenními molekulami. Vaskulární endotelový růstový faktor (vascular endothelial growth factor – VEGF) je účinný stimulátor angiogeneze. Exprese VEGF je přítomna u více než 90 % adenokarcinomů pankreatu a byla intenzivně zkoumána jako možný prognostický faktor [45]. Doposud jen některé studie potvrzují kratší přežití při expresi VEGF [46], tři studie identifikují VEGF jako nezávislý prognostický marker [47–49].
Ki-67
Ki-67 je nukleární antigen přítomný v proliferujících buňkách v průběhu všech aktivních fází buněčného cyklu (G1, S, G2 a M), ale ne během klidové fáze G0. Některé menší studie identifikovaly proliferační index měřený s Ki-67 jako nezávislý prediktor přežití u karcinomu pankreatu [50,51]. V největší z těchto studií byl prognostický význam indexu Ki-67, p21, p27 a p53 zkoumán u 77 pacientů s duktálním adenokarcinomem pankreatu [52]. Za použití multivariantní analýzy pouze index Ki-67 > 5 % prokazoval prognostickou signifikanci. Ostatní studie u karcinomu pankreatu nenašly žádnou asociaci mezi Ki-67 a přežitím [53,54].
Survivin
Survivin je součástí proteinů, které inhibují apoptózu. Byl původně charakterizován jako inhibitor kaspázy. Poslední studie odhalily jeho další funkce v oblasti řízení buněčného cyklu. Výsledky studií hodnotící expresi survivinu vzhledem k prognóze jsou ale protichůdné [55,56].
S100A4
S100A4 je člen rodiny Ca2+ vázaných proteinů, které mají důležitou úlohu v procesu metastazování, kontrole buněčného cyklu, angiogeneze a chemorezistence. Korelace mezi úrovní exprese S100A4 a metastatickým procesem byla prokázána u několika nádorových onemocnění, např. prsu, jícnu, plic, pankreatu, prostaty a žaludku. Některé studie u karcinomu pankreatu shledaly S100A4 jako nezávislý prognostický marker [57]. Poslední údaje ukazují, že výrazné snížení exprese S100A4 potlačuje buněčnou proliferaci a invazivitu nádorových buněk karcinomu pankreatu [58].
COX-2
Cyclooxygenázy jsou enzymy, které se uplatňují v přeměně kyseliny arachnoidové na prostaglandiny. Dosud byly identifikovány dvě izoformy, COX-1 a COX-2 [59]. COX-1 je exprimována v mnoha tkáních a je zapojena v syntéze prostaglandinů za fyziologických podmínek. COX-2 je exprimována za určitých extracelulárních a intracelulárních podmínek, jako je přítomnost mitogenů, růstových faktorů, proinflamatorních cytokinů, hormonů a infekčních agens, kdy je součástí buněčné odpovědi na zánět [60,61]. COX-2 je nadměrně exprimována v mnoha solidních nádorech vč. karcinomu pankreatu [62]. Vysoká úroveň COX-2 exprese byla zjištěna také u PanIN lézí [63]. Několik studií naznačuje, že COX-2 by mohla u karcinomu pankreatu ovlivnit nádorovou angiogenezi a buněčný růst. Bylo prokázáno, že COX-2 inhibuje apoptózu, podporuje buněčnou proliferaci a indukuje expresi VEGF [64]. COX-2 overexprese je u karcinomu pankreatu udávána v 56–90 % [65]. COX-2 byla navržena jako potenciální cíl v chemoprevenci a terapii karcinomu pankreatu [66,62]. V několika retrospektivních studiích byl prokázán vztah mezí zvýšenou expresí COX-2 a horším přežitím [67]. U karcinomu pankreatu jsou ale výsledky těchto studií protichůdné [68].
MikroRNA
MikroRNA (miRNA) jsou malé nekódující molekuly RNA. Jejich velikost se pohybuje okolo 21–28 nukleotidů (nejčastěji 22). MiRNA jsou kompletně nebo částečně komplementární k jedné či více mRNA a jejich hlavní funkcí je regulace exprese těchto miRNA a tím i jejich produktů. Poprvé existenci miRNA objevili v roce 1993 Lee et al při studiu hlístice C. elegans. MiRNA mohou působit jako onkogeny nebo supresorové geny a hrají důležitou roli v mnoha biologických procesech [69]. Mohou také sloužit jako nové diagnostické a prognostické biomarkery a také jako nadějné terapeutické cíle [70]. Rostoucí počet studií prokazuje, že miRNA regulují celou škálu procesů souvisejících s vývojem, progresí a chemorezistencí karcinomu pankreatu.
Dle dosud provedených studií se jeví u adenokarcinomu pankreatu jako významný biomarker miR-21. Jeho vysoká hladina v nádorové tkáni u pacientů po resekci karcinomu pankreatu signifikantně koreluje s kratším OS a kratší dobou přežití bez progrese, a to nezávisle na dalších klinickopatologických faktorech [71]. Rovněž vysoká hladina miR-21 je spojena s rezistencí k chemoterapii s gemcitabinem, a může tedy sloužit jako prediktor chemosenzitivity [72]. MiRNA lze rovněž stanovit v plazmě. U nemocných s karcinomem pankreatu byla zjištěna významně zvýšená hladina miR-21 a miR-483-p oproti zdravým jedincům. Hladina miR-21 v plazmě koreluje s pokročilostí stadia onemocnění a s kratším přežitím [73].
Závěr
V poslední době je věnováno výzkumu biomarkerů velké úsilí. Zvláště u tak prognosticky závažného onemocnění, jakým je karcinom pankreatu, může mít klinické využití výsledků tohoto výzkumu velký význam. Biomarkery zde svým prognostickým a prediktivním potenciálem mohou vést k optimalizaci léčebného postupu a tím k významnému zlepšení léčebných výsledků.
Autoři deklarují, že v souvislosti s předmětem studie nemají žádné komerční zájmy.
Redakční rada potvrzuje, že rukopis práce splnil ICMJE kritéria pro publikace zasílané do biomedicínských časopisů.
MUDr. Petr Karásek
Klinika komplexní onkologické péče
Masarykův onkologický ústav
Žlutý kopec 7
656 53 Brno
e-mail: karasek@mou.cz
Obdrženo: 16. 2. 2016
Přijato: 17. 2. 2016
Sources
1. GLOBOCAN. European age-standardised rates calculated by the statistical information team at cancer research [online]. UK: 2012. Using data from GLOBOCAN 2012, IARC [cited 2015 Octo 1]. Available at: http: //globocan.iarc.fr.
2. Uzis.cz. Národní onkologický registr, 010_20140101 [online]. ČR: UZIS, 2015 [citováno 1. října 2015]. Dostupné z: www.uzis.cz/registry-nzis/nor.
3. Gillen S, Schuster T, Meyer Zum Büschenfelde C et al. Preoperative/neoadjuvant therapy in pancreatic cancer: a systematic review and metaanalysis of response and resection percentages. PLoS Med 2010; 7 (4): e1000267. doi: 10.1371/journal.pmed.1000267.
4. Kuhlmann KF, de Castro SM, Wesseling JG et al. Surgical treatment of pancreatic adenocarcinoma; actual survival and prognostic factors in 343 patients. Eur J Cancer 2004; 40 (4): 549–558.
5. Van den Broeck A, Sergeant G, Ectors N et al. Patterns of recurrence after curative resection of pancreatic ductal adenocarcinoma. Eur J Surg Oncol 2009; 35 (6): 600–604. doi: 10.1016/j.ejso.2008.12.006.
6. Shimada K, Sakamoto Y, Sano T et al. Prognostic factors after distal pancreatectomy with extended lymphadenectomy for invasive pancreatic adenocarcinoma of the body and tail. Surgery 2006; 139 (3): 288–295.
7. Herman JM, Swartz MJ, Hsu CC et al. Analysis of fluorouracil-based adjuvant chemotherapy and radiation after pancreaticoduodenectomy for ductal adenocarcinoma of the pancreas: results of a large, prospectively collected database at the Johns Hopkins Hospital. J Clin Oncol 2008; 26 (21): 3503–3510. doi: 10.1200/JCO.2007.15. 8469.
8. Oettle H, Post S, Neuhaus P et al. Adjuvant chemotherapy with gemcitabine vs observation in patients undergoing curative-intent resection of pancreatic cancer: a randomized controlled trial. JAMA 2007; 297 (3): 267–277.
9. Neoptolemos JP, Dunn JA, Stocken DD et al. European Study Group for Pancreatic Cancer Adjuvant chemoradiotherapy and chemotherapy in resectable pancreatic cancer: a randomised controlled trial. Lancet 2001; 358 (9293): 1576–1585.
10. Neoptolemos JP, Stocken DD, Bassi C et al. European Study Group for Pancreatic Cancer. Adjuvant chemotherapy with fluorouracil plus folinic acid vs gemcitabine following pancreatic cancer resection: a randomized controlled trial. JAMA 2010; 304 (10): 1073–1081. doi: 10.1001/jama.2010.1275.
11. Oettle H, Neuhaus P, Hochhaus A et al. Adjuvant chemotherapy with gemcitabine and long-term outcomes among patients with resected pancreatic cancer: the CONKO-001 randomized trial. JAMA 2013; 310 (14): 1473–1481. doi: 10.1001/jama.2013.279201.
12. Neoptolemos JP, Stocken DD, Dunn JA et al. Influence of resection margins on survival for patients with pancreatic cancer treated by adjuvant chemoradiation and/or chemotherapy in the ESPAC-1 randomized controlled trial. European Study Group for Pancreatic Cancer. Ann Surg 2001; 234 (6): 758–768.
13. Verbeke CS, Leitch D, Menon KV et al. Redefining the R1resection in pancreatic cancer. Br J Surg 2006; 93 (10): 1232–1237.
14. Verbeke CS, Gladhaug IP. Resection margin involvement and tumour origin in pancreatic head cancer. Br J Surg 2012; 99 (8): 1036–1049. doi: 10.1002/bjs.8734.
15. Esposito I, Kleeff J, Bergmann F et al. Most pancreatic cancer resections are R1 resections. Ann Surg Oncol 2008; 15 (6): 1651–1660. doi: 10.1245/s10434-008-9839-8.
16. Gebauer F, Tachezy M, Vashist YK et al. Resection margin clearance in pancreatic cancer after implementation of the Leeds Pathology Protocol (LEEPP): clinically relevant or just academic? World J Surg 2015; 39 (2): 493–499. doi: 10.1007/s00268-014-2808-4.
17. House MG, Gönen M, Jarnagin WR et al. Prognostic significance of pathologic nodal status in patients with resected pancreatic cancer. J Gastrointest Surg 2007; 11 (11): 1549–1555.
18. Pawlik TM, Gleisner AL, Cameron JL et al. Prognostic relevance of lymph node ratio following pancreaticoduodenectomy for pancreatic cancer. Surgery 2007; 141 (5): 610–618.
19. Lüttges J, Schemm S, Vogel I et al. The grade of pancreatic ductal carcinoma is an independent prognostic factor and is superior to the immunohistochemical assessment of proliferation. J Pathol 2000; 191 (2): 154–161.
20. Nakao A, Harada A, Nonami T et al. Clinical significance of carcinoma invasion of the extrapancreatic nerve plexus in pancreatic cancer. Pancreas 1996; 12 (4): 357–361.
21. Reni M, Cereda S, Balzano G et al. Carbohydrate antigen 19-9 change during chemotherapy for advanced pancreatic adenocarcinoma. Cancer 2009; 115 (12): 2630–2639. doi: 10.1002/cncr.24302.
22. Bunger S, Laubert T, Roblick UJ et al. Serum biomarkers for improved diagnostic of pancreatic cancer: a current overview. J Cancer Res Clin Oncol 2011; 137 (3): 375–389. doi: 10.1007/s00432-010-0965-x.
23. Mackey JR, Mani RS, Selner M et al. Functional nucleoside transporters are required for gemcitabine influx and manifestation of toxicity in cancer cell lines. Cancer Res 1988; 58 (19): 4349–4357.
24. Greenhalf W, Ghaneh P, Neoptolemos JP et al. Pancreatic cancer hENT1 expression and survival from gemcitabine in patients from the ESPAC-3 trial. J Natl Cancer Inst 2014; 106 (1): djt347. doi: 10.1093/jnci/djt347.
25. Poplin E, Wasan H, Rolfe L et al. Randomized, multicenter, phase II study of CO-101 versus gemcitabine in patients with metastatic pancreatic ductal adenocarcinoma: including a prospective evaluation of the role of hENT1 in gemcitabine or CO-101 sensitivity. J Clin Oncol 2013; 31 (35): 4453–4461. doi: 10.1200/JCO.2013.51.0826.
26. Hidalgo M, Cascinu S, Kleeff J et al. Addressing the challenges of pancreatic cancer: future directions for improving outcomes. Pancreatology 2015; 15 (1): 8–18. doi: 10.1016/j.pan.2014.10.001.
27. Guweidhi A, Kleeff J, Adwan H et al. Osteonectin influences growth and invasion of pancreatic cancer cells. Ann Surg 2005; 242 (2): 224–234.
28. Sinn M, Sinn, BV, Striefler JK et al. SPARC expression in resected pancreatic cancer patients treated with gemcitabine: results from the CONKO-001 study. Ann Oncol 2014; 25 (5): 1025–1032. doi: 10.1093/annonc/mdu084.
29. Von Hoff DD, Ramanathan RK, Borad MJ et al. Gemcitabine plus nab-paclitaxel is an active regimen in patients with advanced pancreatic cancer: a phase I/II trial. J Clin Oncol 2011; 29 (34): 4548–4554. doi: 10.1200/ JCO.2011.36.5742.
30. Hidalgo M, Plaza C, Illei P et al. SPARC analysis in the phase III MPACT trial of nab-paclitaxel (nab-P) plus gemcitabine (Gem) vs Gem alone for patients with metastatic pancreatic cancer (PC). Ann Oncol 2013; 25 (Suppl 2): ii105–ii117.
31. Klimstra DS, Longnecker DS. K-ras mutations in pancreatic ductal proliferative lesions. Am J Pathol 1994; 145 (6): 1547–1550.
32. Löhr M, Klöppel G, Maisonneuve P et al. Frequency of Kras mutations in pancreatic intraductal neoplasias associated with pancreatic ductal adenocarcinoma and chronic pancreatitis: a meta-analysis. Neoplasia 2005; 7 (1): 17–23.
33. Van Cutsem E, van de Velde H, Karasek P et al. Phase III trial of gemcitabine plus tipifarnib compared with gemcitabine plus placebo in advanced pancreatic cancer. J Clin Oncol 2004; 22 (8): 1430–1438.
34. Huang H, Daniluk J, Liu Y et al. Oncogenic K-Ras requires activation for enhanced activity. Oncogene 2014; 33 (4): 532–535. doi: 10.1038/onc.2012.619.
35. Biankin AV, Waddell N, Kassahn KS et al. Pancreatic cancer genomes reveal aberrations in axon guidance pathway genes. Nature 2012; 491 (7424): 399–405. doi: 10.1038/nature11547.
36. Iacobuzio-Donahue CA, Fu B, Yachida S et al. DPC4 gene status of the primary carcinoma correlates with patterns of failure in patients with pancreatic cancer. J Clin Oncol 2009; 27 (11): 1806–1813. doi: 10.1200/JCO.2008.17.7188.
37. Tsuji T, Satoyoshi R, Aiba N et al. Agr2 mediates paracrine effects on stromal fibroblasts that promote invasion by gastric signet-ring carcinoma cells. Cancer Res 2015; 75 (2): 356–366. doi: 10.1158/0008-5472.CAN-14-1693.
38. Dumartin L, Whiteman HJ, Weeks ME et al. AGR2 is a novel surface antigen that promotes the dissemination of pancreatic cancer cells through regulation of cathepsins B and D. Cancer Res 2011; 71 (22): 7091–7102. doi: 10.1158/0008-5472.CAN-11-1367.
39. Ramachandran V, Arumugam T, Wang H et al. Anterior gradient 2 is expressed and secreted during the development of pancreatic cancer and promotes cancer cell survival. Cancer Res 2008; 68 (19): 7811–7818. doi: 10.1158/0008-5472.CAN-08-1320.
40. Brychtova V, Hermanova M, Karasek P et al. Anterior gradient 2 and mucin 4 expression mirrors tumor cell differentiation in pancreatic adenocarcinomas, but aberrant anterior gradient 2 expression predicts worse patient outcome in poorly differentiated tumors. Pancreas 2014; 43 (1): 75–81. doi: 10.1097/MPA.0b013e3182a63bc3.
41. Nio Y, Dong M, Iguchi C et al. Expression of Bcl-2 and p53 protein in resectable invasive ductal carcinoma of the pancreas: effects on clinical outcome and efficacy of adjuvant chemotherapy. J Surg Oncol 2001; 76 (3): 188–196.
42. Dong M, Zhou JP, Zhang H et al. Clinicopathological significance of Bcl-2 and Bax protein expression in human pancreatic cancer. World J Gastroenterol 2005; 11 (18): 2744–2747.
43. Campani D, Esposito I, Boggi U et al. Bcl-2 expression in pankreas development and pancreatic cancer progression. J Pathol 2001; 194 (4): 444–450.
44. Bold RJ, Hess KR, Pearson AS et al. Prognostic factors in resectable pancreatic cancer: p53 and bcl-2. J Gastrointest Surg 1999; 3 (3): 263–277.
45. Seo Y, Baba H, Fukuda T et al. High expression of vascular endothelial growth factor is associated with liver metastasis and a poor prognosis for patients with ductal pancreatic adenocarcinoma. Cancer 2000; 88 (10): 2239–2245.
46. Kuwahara K, Sasaki T, Kuwada Y et al. Expressions of angiogenic factors in pancreatic ductal carcinoma: a correlative study with clinicopathologic parameters and patient survival. Pancreas 2003; 26 (4): 344–349.
47. Ikeda N, Adachi M, Taki T et al. Prognostic significance of angiogenesis in human pancreatic cancer. Br J Cancer 1999; 9 (9–10): 1553–1563.
48. Sun HC, Qiu ZJ, Liu J et al. Expression of hypoxia-inducible factor-1 alpha and associated proteins in pancreatic ductal adenocarcinoma and their impact on prognosis. Int J Oncol 2007; 30 (6): 1359–1367.
49. Ai KX, Lu LY, Huang XY et al. Prognostic significance of S100A4 and vascular endothelial growth factor expression in pancreatic cancer. World J Gastroenterol 2008; 14 (12): 1931–1935.
50. Linder S, Parrado C, Falkmer UG et al. Prognostic significance of Ki-67 antigen and p53 protein expression in pancreatic duct carcinoma: a study of the monoclonal antibodies MIB-1 and DO-7 in formalin-fixed paraffin-embedded tumour material. Br J Cancer 1997; 76 (1): 54–59.
51. Karamitopoulou E, Zlobec I, Tornillo L et al. Differential cell cycle and proliferation marker expression in ductal pancreatic adenocarcinoma and pancreatic intraepithelial neoplasia (PanIN). Pathology 2010; 42 (3): 229–234. doi: 10.3109/00313021003631379.
52. Yamamoto S, Tomita Y, Hoshida Y et al. Prognostic significance of activated Akt expression in pancreatic ductal adenocarcinoma. Clin Cancer Res 2004; 10 (8): 2846–2850.
53. Lebe B, Sağol O, Ulukuş C et al. The importance of cyclin D1 and Ki67 expression on the biological behavior of pancreatic adenocarcinomas. Pathol Res Pract 2004; 200 (5): 389–396.
54. Stanton KJ, Sidner RA, Miller GA et al. Analysis of Ki-67 antigen expression, DNA proliferative fraction, and survival in resected cancer of the pancreas. Am J Surg 2003; 186 (5): 486–492.
55. Sarela AI, Verbeke CS, Ramsdale J et al. Expression of survivin, a novel inhibitor of apoptosis and cell cycle regulatory protein, inpancreatic adenocarcinoma. Br J Cancer 2002; 86 (6): 886–892.
56. Sagol O, Yavuzsen T, Oztop I et al. The effect of apoptotic activity, survivin, Ki-67, and P-glycoprotein expression on prognosis in pancreatic carcinoma. Pancreas 2005; 30 (4): 343–348.
57. Oida Y, Yamazaki H, Tobita K et al. Increased S100A4 expression combined with decreased E-cadherin expression predicts a poor outcome of patients with pancreatic cancer. Oncol Rep 2006; 16 (3): 457–463.
58. Tabata T, Tsukamoto N, Fooladi AA et al. RNA interference targeting against S100A4 suppresses cell growth and motility and induces apoptosis in human pancreatic cancer cells. Biochem Biophys Res Commun 2009; 390 (4): 475–480. doi: 10.1016/j.bbrc.2009.09.096.
59. Tanabe T, Tohnai N. Cyclooxygenase isozymes and their gene structures and expression. Prostaglandins Other Lipid Mediat 2002; 68–69 : 95–114.
60. Fosslien E. Biochemistry of cyclooxygenase (COX) -2 inhibitors and molecular pathology of COX-2 in neoplasia. Crit Rev Clin Lab Sci 2000; 37 (5): 431–502.
61. Williams CS, Mann M, DuBois RN. The role of cyclooxygenases in inflammation, cancer, and development. Oncogene 1999; 18 (55): 7908–7916.
62. Kokawa A, Kondo H, Gotoda T et al. Increased expression of cyclooxygenase-2 in human pancreatic neoplasms and potential for chemoprevention by cyclooxygenase inhibitors. Cancer 2001; 91 (2): 333–338.
63. Albazaz R, Verbeke CS, Rahman SH et al. Cyclooxygenase-2 expression associated with severity of PanIN lesions: a possible link between chronic pancreatitis and pancreatic cancer. Pancreatology 2005; 5 (4–5): 361–369.
64. Hermanova M, Trna J, Nenutil R et al. Expression of COX-2 is associated with accumulation of p53 in pancreatic cancer: analysis of COX-2 and p53 expression in premalignant and malignant ductal pancreatic lesions. Eur J Gastroenterol Hepatol 2008; 20 (8): 732–739. doi: 10.1097/MEG.0b013e3282f945fb.
65. Juuti A, Louhimo J, Nordling S et al. Cyclooxygenase-2 expression correlates with poor prognosis in pancreatic cancer. J Clin Pathol 2006; 59 (4): 382–386.
66. Dannenberg AJ, Altorki NK, Boyle JO et al. Cyclo-oxygenase 2: a pharmacological target for the prevention of cancer. Lancet Oncol 2001; 2 (9): 544–551.
67. Shi H, Xu JM, Hu NZ et al. Prognostic significance of expression of cyclooxygenase-2 and vascular endothelial growth factor in human gastric carcinoma. World J Gastroenterol 2003; 9 (7): 1421–1426.
68. Hermanova M, Karasek P, Nenutil R et al. Clinicopathological correlations of cyclooxygenase-2, MDM2, and p53 expressions in surgically resectable pancreatic invasive ductal adenocarcinoma. Pancreas 2009; 38 (5): 565–571. doi: 10.1097/MPA.0b013e31819fef8b.
69. Osada H, Takahashi T. MicroRNAs in biological processes and carcinogenesis. Carcinogenesis 2007; 28 (1): 2–12.
70. Sun T, Kong X, Du Y et al. Aberrant microRNAs in pancreatic cancer: researches and clinical implications. Gastroenterol Res Pract 2014; 2014: ID 386561. doi: 10.1155/2014/386561.
71. Frampton AE, Krell J, Jamieson NB et al. MicroRNAs with prognostic significance in pancreatic ductal adenocarcinoma: a meta-analysis. Eur J Cancer 2015; 51 (11): 1389–1404. doi: 10.1016/j.ejca.2015.04.006.
72. Wang P, Zhuang L, Zhang J. The serum miR-21 level serves as a predictor for the chemosensitivity of advanced pancreatic cancer, and miR-21 expression confers chemoresistance by targeting FasL. Mol Oncol 2013; 7 (3): 334–345. doi: 10.1016/j.molonc.2012.10.011.
73. Abue M, Yokoyama M, Shibuya R. Circulating miR-483-3p and miR-21 is highly expressed in plasma of pancreatic cancer. Int J Oncol 2015; 46 (2): 539–547. doi: 10.3892/ijo.2014.2743.
Labels
Paediatric clinical oncology Surgery Clinical oncology
Article was published inClinical Oncology

2016 Issue 5-
All articles in this issue
- Význam signálnej dráhy MITF pri regulácii proliferácie a invazivity malígneho melanómu
- Exprese ABC transportérů Pgp, MRP1 a MRP3 u maligních a benigních změn vaječníků
- Kombinovaná léčba recidivujícího maligního schwannomu
- Hypertermická izolovaná perfuze končetin v kombinaci s tasonerminem – technika monitorování úniku perfuzátu
- Glycin-N-metyltransferáza a nádorová onemocnění prostaty
- Prognostické a prediktivní faktory u adenokarcinomu pankreatu
- Léčba relabovaného a refrakterního Hodgkinova lymfomu – doporučení české studijní skupiny Hodgkinův lymfom
- Vliv nutriční podpory s vysokým obsahem bílkovin na výsledky léčby a náklady u pacientů s kolorektálním karcinomem
- Malígny mezotelióm tunica vaginalis testis. Klinicko-patologická analýza dvoch prípadov s prehľadom literatúry
- Sentinel Lymph Node in Thin and Thick Melanoma
- Clinical Oncology
- Journal archive
- Current issue
- Online only
- About the journal
Most read in this issue- Vliv nutriční podpory s vysokým obsahem bílkovin na výsledky léčby a náklady u pacientů s kolorektálním karcinomem
- Léčba relabovaného a refrakterního Hodgkinova lymfomu – doporučení české studijní skupiny Hodgkinův lymfom
- Kombinovaná léčba recidivujícího maligního schwannomu
- Malígny mezotelióm tunica vaginalis testis. Klinicko-patologická analýza dvoch prípadov s prehľadom literatúry
Login#ADS_BOTTOM_SCRIPTS#Forgotten passwordEnter the email address that you registered with. We will send you instructions on how to set a new password.
- Career

