-
Medical journals
- Career
Záchranná léčba a role transplantací u lymfomů
Authors: D. Pohlreich; B. Vacková; R. Pytlík; M. Trnková; M. Trněný
Authors‘ workplace: I. interní klinika – klinika hematologie 1. LF UK a VFN v Praze
Published in: Klin Onkol 2015; 28(Supplementum 3): 95-104
doi: https://doi.org/10.14735/amko20153S95Overview
Přestože v terapii lymfomů dosahujeme v posledních letech pokroku, stále zůstává nezanedbatelné procento nemocných s refrakterním nebo relabujícím onemocněním. Záchranná intenzivní chemoterapie s podporou autologní transplantace je léčebný standard u řady těchto pacientů. V intenzivním výzkumu jsou také alogenní transplantace krvetvorných buněk, především po přípravě redukované intenzity. Předkládaný přehledný článek shrnuje současné poznatky a doporučení k záchranné léčbě u pacientů s nejčastěji se vyskytujícími lymfomy.
Klíčová slova:
refrakterní/ relabující lymfom – Hodgkinův lymfom – difuzní velkobuněčný B lymfom – folikulární lymfom – T buněčný non-Hodgkinův lymfom – autologní transplantace krvetvorných buněk – alogenní transplantace krvetvorných kmenových buněkHodgkinův lymfom
Většina pacientů s Hodgkinovým lymfomem (HL) je v současné době vyléčitelná chemoterapií +/ – radioterapií. Až 10 % pacientů s časným stadiem a 30 % s pokročilým stadiem onemocnění nedosáhne remise nebo relabuje po ukončení chemoterapie [1].
Standardem léčby relabujících a refrakterních HL je záchranná chemoterapie následovaná v případě chemosenzitivity vysokodávkovanou terapií (high-dose therapy – HDT) s autologní transplantací krvetvorných buněk (ASCT). V minulosti byly provedeny dvě randomizované studie, které prokazují přesvědčivý benefit transplantačního přístupu ve srovnání s konvenční záchrannou chemoterapií [2,3].
Mezi prognosticky nepříznivé faktory predikující špatnou léčebnou odpověď patří: primárně refrakterní onemocnění (progrese na léčbě nebo relaps < 3 měsíce po ukončení terapie), časný relaps (< 12 měsíců po ukončení léčby), pokročilé klinické stadium III – IV, snížený performance stav (PS), extranodální postižení, věk > 50 a další. Očekávané celkové přežití (overall survival – OS) v pěti letech u primárně refrakterních onemocnění je 26 %, u časného relapsu 46 % a u pozdního relapsu 71 % [4].
Cílem záchranné chemoterapie je umožnit pacientovi dospět k ASCT. Ideální salvage režim splňuje co nejvyšší procento léčebných odpovědí s přijatelnou hematologickou i nehematologickou toxicitou a zároveň významně nesnižuje potenciál mobilizovat periferní kmenové buňky (peripheral blood stem cells – PBSC) před ASCT. Byla studována a publikována celá řada salvage režimů s celkovou léčebnou odpovědí mezi 60 a 85 % bez přesvědčivě prokázané superiority jediného z použitých režimů: dexaBEAM, ICE, ESAP, DHAP, GDP, IVE. S úvahou o dosažení co největšího protinádorového účinku Josling et al publikovali randomizovanou studii srovnávající standardní salvage (2 – 4krát DHAP/ BEAM) s intenzifikovaným režimem (2krát DHAP, cyklofosfamid + sběr PBSC, MTX + etopozid/ BEAM). V této studii nebyl prokázán benefit v dosažení OS při použití intenzifikované léčby [5].
Graph 1. Ukazuje přehledně efekt jednotlivých druhů záchranné léčby [6]. ![Ukazuje přehledně efekt jednotlivých druhů záchranné léčby [6].](https://pl-master.mdcdn.cz/media/image/e9113a787266ebf1cbae9a0336d8c0a8.jpg?version=1537797439)
Dexa-BEAM – dexametazon, BCNU, etopozid, Ara-C, mitoxantron, DHAP – dexametazon, Ara-C – cisplatina, GDP – gemcitabin, dexametazon, cisplatina, GVD – gemcitabin, vinorelbine, doxil (liposomalní doxorubicin), ICE – ifosfamid, carboplatina, etopozid, IEV – ifosfamid, etopozid, vinorelbin, ifosfamide I s přihlédnutím již ke zmíněným prognostickým faktorům, PET/ CT vyšetření před vstupem do ASCT je další významný prediktivní faktor výsledku léčby. Jabbour et al prokázali tříleté OS 58 vs. 87 % u pacientů vstupujících do transplantace s PET pozitivním nebo PET negativním nálezem po ukončení salvage léčby [7]. V další studii demonstrují Moskowitz et al podobný význam pretransplantačního PET vyšetření, nemocní s PET pozitivním nálezem měli pravděpodobnost pětiletého OS 31 %, zatímco PET negativní 75 % [8].
Vysokodávkovaná terapie s ASCT
Režimů vysokodávkované terapie existuje celá řada. Neproběhla žádná randomizovaná studie, která by je srovnávala mezi sebou. Nejčastěji používaný je režim BEAM (karmustin = BCNU, etopozid, Ara ‑ C, melfalan), který považujeme v současné době za zlatý standard s vysokou protinádorovou aktivitou a únosnou toxicitou [2,3]. Dalším často používaným režimem byl v minulosti CVB (cyklofosfamid, etopozid, BCNU) [9]. Nově byl testován i přípravný režim s bendamustinem – BeEAM (bendamustin, etopozid, Ara ‑ C, melfalan) [10].
Table 1. Výběr studií záchranné léčby DLBCL. 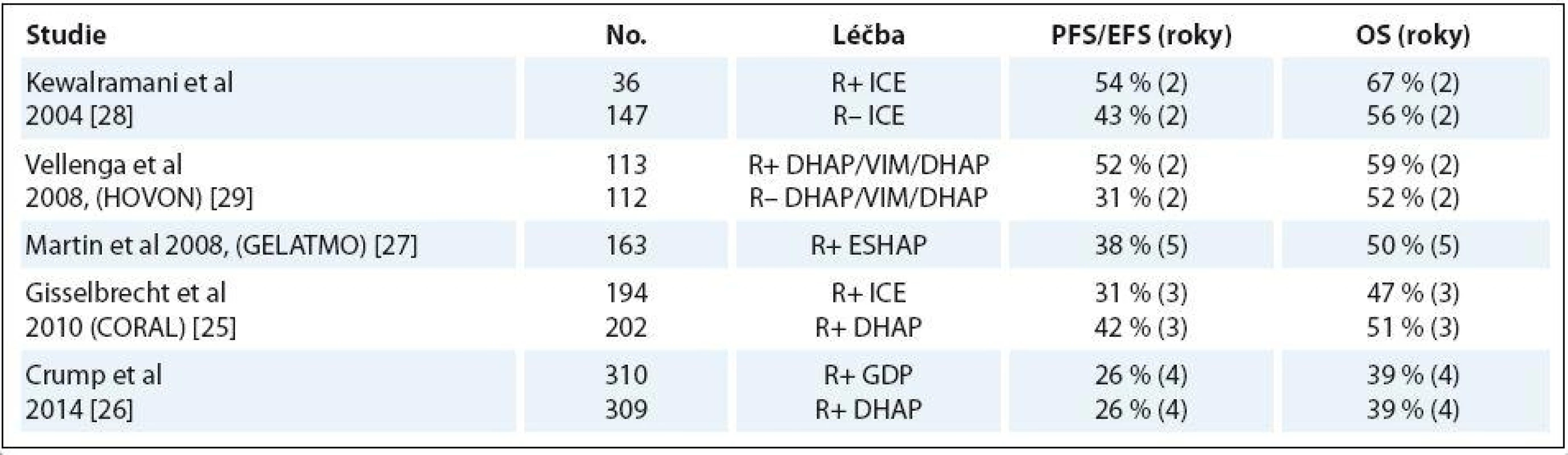
Tandemové ASCT u Hodkinova lymfomu
U pacientů s kritickými rizikovými faktory (např. primárně refrakterní onemocnění, časný relaps) je možné dosáhnout další intenzifikace HDT režimu provedením tandemové ASCT. Multicentrická studie GELA s tandemovou ASCT publikovaná v roce 2007 demonstrovala pětileté OS 54 % s akceptovatelnou peritransplantační mortalitou 6 % [11]. Podobné výsledky publikovali i Morschhauser et al u prognosticky nepříznivých HL s pětiletým OS 57 % [12].
Tandemová transplantace použitá v případě přetrvávající PET pozitivity po záchranné léčbě vedla k signifikantně lepším výsledkům ve srovnání s jednoduchou transplantací s pětiletou pravděpodobností doby do progrese (progression‑free survival – PFS) 43 vs. 0 % [13].
V našem centru bylo v letech 1996 – 2004 tandemově transplantováno 22 pacientů s primárně refrakterním (32 %) nebo s časným relapsem onemocnění. Po salvage chemoterapii vstupovalo do ASCT 32 % chemorefrakterních pacientů. V první fázi tandemové ASCT se HDT skládala z melfalanu a mitoxantronu. S odstupem 30 – 60 dní byla realizována II. fáze po přípravě BEAM.
Nebylo zaznamenáno žádné peri-transplantační úmrtí. Den +100 po tandemové ASCT byla celková léčebná odpověď 81 % (5krát kompletní remise a 13krát parciální remise), chemorefrakterní byli čtyři pacienti. V 10letém sledování je OS nemocných 55 % a PFS 50 % [14]. Pravděpodobnost OS u nemocných s rizikovými faktory transplantovanými tandemově a nemocnými většinou bez rizikových faktorů transplantovaných jednoduchou ASCT ukazuje graf 2.
Graph 2. Celkové přežití (OS) po tandemové a jednoduché ASCT u HL [14]. ![Celkové přežití (OS) po tandemové a jednoduché ASCT u HL [14].](https://pl-master.mdcdn.cz/media/image/c4278849bc02899e9fbd5c52ca95f760.jpg?version=1537796500)
Alogenní transplantace u Hodgkinova lymfomu
Přes předpokládaný graft-versus-lymphoma (GVL) efekt i u HL byly první zkušenosti nepovzbudivé. V roce 1996 byly publikovány dvě analýzy z mezinárodního registru (IBMTR) a evropského registru EBMT ukazující pravděpodobnost tříletého OS jen 21, resp. čtyřletého 25 % [15,16]. Se zavedením redukované přípravy (RIC) a zlepšení podpůrné léčby se zlepšoval osud nemocných.
Jedním z důležitých příspěvků naznačujících směřování alogenní transplantace (alloSCT) u HL byla analýza LWP EBMT (Lymphoma working party of European Bone and Marrow Transplantation) srovnávající alloSCT po myeloablativním režimu s režimem s redukovanou intenzitou (RIC). RIC podstoupilo 97 pacientů, konvenční režim 93 pacientů. Úmrtí z jiné příčiny než z důvodu HL bylo signifikantně nižší u RIC alloSCT a obdobně lepší ve srovnání s myeloablativní transplantací byla i pravděpodobnost OS a PFS/ úmrtí (PFS). Nemocní s chronickou reakcí štěpu proti hostiteli (graft versus host disease – GVHD) měli významně nižší procento relapsů, což naznačuje přítomnost GVL efektu [17].
Výsledky velkého počtu pacientů (n = 285) po RIC ‑ alloSCT byly samostatně analyzovány ve stejném roce. Pacienti v této studii byli významně předléčeni, v průměru předcházely alloSCT čtyři linie chemoterapie a u 77 % nemocných selhala předcházející jedna až dvě ASCT. Při vstupu do transplantace bylo v kompletní remisi 17 % pacientů, 43 % mělo chemosenzitivní a 40 % mělo chemorezistentní onemocnění. Úmrtnost spojená s transplantací (transplant-related mortality – TRM) v jednom roce a ve třech letech byla pozorována ve 20 a 22 %. PFS/ úmrtí (PFS) ve dvou letech byla 29 %. Opět bylo pozorováno, že rozvoj chronické GVHD signifikantně snižovala procento relapsu, nicméně za cenu vyšší TRM [18].
Skupina ze Seattlu uvádí výsledky transplantací u 62 pacientů od příbuzných a nepříbuzných dárců a 28 pacientů po HLA‑haploidentické příbuzenské transplantaci. Přípravný režim byl proveden kombinací celotělového ozařování (TBI, 2 Gy) a fludarabinu (90 mg/ m2). Pacienti byli těžce předléčení (průměr pět linií léčby) a u 92 % selhala předcházející ASCT. Stav onemocnění při vstupu do RIC alloSCT byl 22 pacientů v kompletní remisi, 30 v parciální remisi a 38 refrakterních/ relabovaných. Výsledky studie demonstrují signifikantně nižší riziko TRM a relapsu u pacientů podstupujících haploidentickou transplantaci [19].
Vývoj počtu alloSCT v Evropě podle použitého režimu (myeloablativní nebo s redukovanou intenzitou) a počtu haploidentických transplantací ukazuje graf 3.
Graph 3. Vývoj počtu allo-SCT (A) dle použitého přípravného režimu (myeloablativní – MAC a s redukovanou intenzitou – RIC) a (B) dle zdroje buněk. 
Peggs et al publikovali 76 konsekutivních pacientů s relabovaným/ refrakterním HL použitím in vivo T buněčné deplece (alemtuzumab) u RIC alloSCT a následně eskalované dávky dárcovských lymfocytů (donor lymphocyte infusion – DLI). U 24 pacientů byly DLI použity pro relaps, u 22 pacientů pro smíšený chimerizmus. Odpovědělo 79 % pacientů léčených pomocí DLI pro relaps (14krát kompletní remise, 5krát parciální remise) a 86 % se smíšeným chimerizmem dosáhlo plného dárcovského chimerizmu. OS ve čtyřech letech po transplantaci bylo 64 a 59 % u nemocných léčených DLI pro potransplantační relaps. Tato data demonstrují vysoký potenciál imunoterapie pomocí alogenních DLI s efektem na snížení rizika relapsu a indukci trvalého protinádorového účinku [20]. Doporučení k alloSCT dle EBMT jsou uvedena v tab. 2.
Table 2. Současná transplantační doporučení u lymfomů (upraveno dle [32]). ![Současná transplantační doporučení u lymfomů (upraveno dle [32]).](https://www.prolekare.cz/media/cache/resolve/media_object_image_small/media/image/943f1f8d94d63a3a97ea8b0536390319.jpg)
DLBCL – difuzní velkobuněčný lymfom, MCL – lymfom z plášťových buněk, FL – folikulární lymfom, TCL – T buněčný lymfom, HL – Hodgkinův lymfom, S – léčebný standard, obecně doporučovaná indikace, CO – clinical option (může být provedena po zvážení riziko vs. benefi t), D – developmental (v hodnocení a ve vývoji, jsou nutné další studie), GNR – obecně nedoporučeno váha důkazu: I – výsledky alespoň jedné randomizované studie, II – výsledky z alespoň jedné kvalitní klinické studie bez randomizace, case controlled studie, III – deskriptivní studie, expert opinion Difuzní velkobuněčný B lymfom
Difuzní velkobuněčný lymfom (diffuse large B ‑ cell lymphoma – DLBCL) je nejčastější typ non‑Hodgkinova lymfomu (NHL), v ČR tvoří zhruba 40 % nových případů ze všech NHL. Incidence DLBCL vzrůstá s věkem, celková incidence je 6,9 nových případů/ 100 000, zatímco více než 30/ 100 000 u věku nad 65 let. Dlouhodobě vyléčitelných je 30 – 50 % nemocných, většina relapsů onemocnění se dostavuje časně v 1. – 2. roce po ukončení léčby.
Řada randomizovaných studií prokázala jasné zlepšení léčebných výsledků, zvýšení pravděpodobnosti vyléčení použitím cílené imunochemoterapie. Ta spočívá v přidání rituximabu ke standardní chemoterapii CHOP s dosažením kompletních remisí v 75 – 88 % s pětiletým OS 50 – 80 % [21,22].
Pacienti s primárně refrakterním DLBCL, časně relabujícím nebo dosahujícím pouze parciální odpovědi k iniciální chemoterapii v kombinaci s rituximabem, mívají horší odpověď na záchrannou léčbu a celkově horší prognózu.
PARMA studie publikovaná v roce 1995 srovnávala salvage samotnou chemoterapii DHAP (cisplatina, cytarabin, dexametazon) nebo v kombinaci s ASCT. OS a PFS bylo významně zlepšeno v rameni s ASCT [23].
Na základě těchto výsledků je salvage (záchranná) chemoterapie následovaná vysokodávkovanou chemoterapií s ASCT v současnosti standard léčby. Cílem salvage chemoterapie je snaha dosáhnout maximální odpovědi před ASCT. Volba typu záchranného režimu zvažuje kombinace s co nejvyšším procentem léčebných odpovědí a zároveň s co nejnižší hematologickou a nehematologickou toxicitou a s cílem nelimitovat sběr kmenových buněk. Tyto principy je nutno uvážit ještě v kontextu celkového stavu pacienta a jeho komorbidit. Jsou dvě základní strategie salvage režimů – platinové a neplatinové záchranné režimy. Platinové režimy mají vyšší procento léčebných odpovědí, ale za cenu vyšší toxicity. Tyto režimy jsou proto většinou preferovány u více „fit“ pacientů, kteří jsou kandidáty vysokodávkované chemoterapie s ASCT. Neplatinové salvage režimy jsou častěji indikovány u nemocných neúnosných k ASCT z důvodu věku nebo komorbidit a dále u pacientů s nízkou dřeňovou rezervou, např. po více liniích chemoterapie či relabujících po ASCT. V současné době stále není dosaženo shody, který záchranný režim je nejvhodnější. Protinádorový efekt cisplatiny, karboplatiny nebo oxaliplatiny u B ‑ NHL byl prokázán v mnoha studiích. Platina jako součást salvage režimů (DHAP, EHSAP, GDP, ICE, GIFOX) u pacientů s refrakterním/ relabovaným DLBCL dosahuje léčebné odpovědi u 49 – 82 % a kompletních remisí v 19 – 61 %. Všechny tyto režimy jsou použitelné k mobilizaci periferních kmenových buněk krvetvorby. Jsou zatíženy významnou hematologickou toxicitou a nezanedbatelnou toxicitou nehematologickou. Hematologická toxicita platinových režimů spočívá v neutropenii grade III – IV v 50 – 70 %, v trombocytopenii grade III – IV ve 40 – 90 %, hospitalizace pro febrilní neutropenii se vyskytují v 10 – 20 % případů. Nehematologická toxicita limitující platinové režimy je především renální (platina), kardiotoxicita (ifosfamid), neurotoxicita (ifosfamid) a mozečková toxicita (Ara ‑ C).
Salvage režimů u DLBCL bez použití platiny je také celá řada (MINE, IVE, MiniBEAM …) se srovnatelným protinádorovým efektem jako u platinových režimů. Většina těchto „non‑platin based“ režimů se dnes již nepoužívá s ohledem na kumulaci dávky antracyklinů nebo „poškození“ kmenových buněk alkylačními látkami. V současnosti jsou preferovány pouze neplatinové režimy na bázi gemcitabinu, které jsou obecně lépe tolerovány a mají celkově významně nižší toxicitu.
Prospektivní randomizovaná studie CORAL srovnávala dva záchranné režimy: již zmíněný R ‑ DHAP a R ‑ ICE (rituximab, ifosfamid, etopozid, karboplatina). Randomizováno bylo 396 pacientů: 2/ 3 s relapsem déle než 12 měsíců po ukončení léčby a 1/ 3 pacientů rezistentních nebo s časným relapsem onemocnění. V hodnocení léčebné odpovědi (ORR 62 – 64 %) a schopnosti mobilizovat kmenové buňky nebyl zaznamenán rozdíl mezi oběma použitými režimy. V předem neplánované analýze bylo nicméně režimem DHAP ve srovnání s ICE dosaženo lepší doby do progrese (PFS) ve skupině nemocných s GCB (germinal center B ‑ cell like) podtypem DLBCL [24].
Pouze polovina pacientů v této studii podstoupila ASCT, ostatní k ní nedospěli většinou z důvodu rezistence nebo progrese lymfomu na terapii. OS ve třech letech se nelišilo v obou ramenech podle režimu (47 vs. 51 %) a relaps/ progrese onemocnění byly ovlivněny především: předchozím použitím rituximabu (EFS 21 vs. 47 %), časným relapsem (EFS 20 vs. 45 %) a sekundárním aaIPI (EFS 18 vs. 40 % u aaIPI 0 – 1) [25].
Nemocní byli potransplantačně randomizování do dvou ramen: udržovací rituximab vs. sledování. Zhodnocení efektu po čtyřech letech nezaznamenalo rozdíl v procentu relapsů lymfomu v obou ramenech. Celkově byly ve třech letech po transplantaci zaznamenány relaps/ progrese u 39 % nemocných.
Ve druhé randomizované studii byl srovnáván režim DHAP a GDP (gemcitabin, dexametazon a cisplatina). Ani zde nebyl nalezen signifikantní rozdíl v účinnosti, ale režim GDP byl provázen signifikantně menší toxicitou [26].
Sami na našem pracovišti používáme režim ESHAP (etopozid, cisplatina, Ara ‑ C a metylprednisolon), který má menší renální toxicitu ve srovnání s režimem DHAP.
Studie skupiny GEL/ TAMO (Grupo Espanol de Linfomas/ Transplante Autologo de Medula Osea) hodnotila retrospektivní data u 163 konsekutivních pacientů použitím salvage režimu ESHAP (etopozid, metylprednisolon, vysokodávkované Ara ‑ C, cisplatina) s relabovaným/ refrakterním DLBCL. V 1. linii chemoterapií s rituximabem bylo léčeno 94 a bez rituximabu 69 pacientů. Léčebného efektu (ORR) a kompletní remise bylo dosaženo v 67 a 37 % u pacientů předléčených rituximabem, zatímco u nemocných bez rituximabu v indukci to bylo v 81 a 56 %. V multivariantní analýze bylo jako negativní prognostický faktor prokázáno předchozí použití rituximabu před salvage chemoterapií [27].
Ve studii HOVON 2008 (Dutch ‑ Belgian Hemato ‑ Oncology Cooperative Group) byly publikovány výsledky studie u 225 pacientů po záchranné chemoterapii DHAP/ VIP/ DHAP. Ve dvou ramenech bylo srovnáváno přidání rituximabu a následné ASCT. Kompletních remisí v rameni s rituximabem bylo 75 % ve srovnání s 54 % bez rituximabu. V OS ve dvou letech však nebyl zaznamenán signifikantní rozdíl: 59 vs. 52 % [29].
AlloSCT u DLBCL
Se zavedením alloSCT po redukovaném přípravném režimu (RIC alloSCT) přibývá indikací i u DLBCL. Očekávaného GVL efektu není dosaženo za cenu neakceptovatelné peritransplantační mortality u myeloablativních transplantací a transplantováni mohou být i starší a komorbidní pacienti.
Řada výzkumných týmů v současné době prezentuje slibná data RIC alloSCT u DLBCL relabujících po ASCT [30,31].
Současná transplantační doporučení u lymfomů jsou uvedena v tab. 2 (upraveno dle [32]).
Folikulární lymfom
Folikulární lymfomy (FL) představují asi třetinu všech lymfomů s mediánem věku 59 let při diagnóze. Pro FL je typický indolentní klinický průběh s dlouhým mediánem OS více než 10 let. Mezi hlavní prognostické faktory patří stratifikace rizika onemocnění dle FLIPI (International Follicular Lymphoma Prognostic Index). Přestože je medián OS pacientů s FL dlouhý, úplného vyléčení nebývá zpravidla dosaženo. Z tohoto důvodu řada studií zkoumala efekt použití vysokodávkované chemoterapie (HDT) s ASCT v1. linii léčby. I když bylo dosaženo prodloužení PFS FL, ani jedna ze studií neprokázala zlepšení OS nemocných. Tato data byla potvrzena v metaanalýze autorů Al Khabori et al [33].
Další nezanedbatelnou proměnou je zvýšená incidence sekundárních malignit u mnoho let trvajícího sledování po použití intenzivnějších léčebných protokolů v primoterapii, i když se zdá, že vyšší incidence byla způsobena zejména indukčními režimy založenými na fludarabinu.
V roce 2003 byla publikována randomizovaná multicentrická studie u pacientů s relapsem FL srovnávající HDT/ ASCT s konvenční chemoterapií. Hodnoceno bylo 229 pacientů a bylo dosaženo signifikantně lepších výsledků v rameni s ASCT: OS ve čtyřech letech 71 vs. 46 % a PFS ve dvou letech 56 vs. 28 % [34].
Francouzská skupina hodnotila retrospektivní data u 254 relabovaných FL léčených konvenční chemoterapií s rituximabem nebo bez něho a vysokodávkovanou chemoterapií/ ASCT +/ – rituximab. Přidání rituximabu k chemoterapii přineslo lepší výsledky než HDT bez rituximabu. Nejlepších výsledků bylo dosaženo provedením HDT a ASCT v kombinaci s rituximabem. Touto kombinací – salvage HDT s rituximabem a ASCT bylo dosaženo OS více než 90 % pětiletém sledování [35].
Řada studií fáze II prokazuje v dlouhodobém sledování dosažení plató křivky přežití nemocných po ASCT, naznačující dosažení vyléčení pacientů. Kornacker et al popisují dlouhodobé sledování 241 pacientů po ASCT pro relaps FL. V 10 letech byla pravděpodobnost relapsu 47 %, s mediánem relapsu 20 (2 – 128) měsíců po ASCT. Šest let po ASCT byly zaznamenány pouze tři relapsy. Dynamika relapsů FL po ASCT je dvoufázová: relapsy v prvním roce po ASCT mají agresivnější průběh a celkově horší přežití, do 6. roku po ASCT pacienti relabují „lineárně“ a po 6. roce jsou již relapsy FL zcela raritní. Relaps FL více než jeden rok po ASCT jsou relativně neagresivní s mediánem OS více než 8 let [36].
V roce 2013 byla publikována dvojitě randomizovaná studie u nemocných s FL v relapsu. První randomizace zkoumala efekt přidání rituximabu k záchranné terapii (in vivo purging), druhá randomizace efekt udržovací léčby po ASCT. S dlouhým mediánem sledování (8,3 roku) se ukázalo, že zlepšení PFS v 10 letech nebylo ve skupině nemocných s purgingem statisticky významné. Naproti tomu udržovací terapie rituximabem po dobu dvou let po ASCT signifikantně zlepšila PFS v 10 letech z 37 na 54 %. OS ovlivněno nebylo. Limitujícím faktorem této studie, ostatně jako řady dalších, je, že rituximab nebyl použit v 1. linii [37].
AlloSCT u folikulárního lymfomu
Dlouhý medián OS nemocných s FL při standardní léčbě a relativně vysoká peritransplantační morbidita a mortalita při alloSCT limitují indikaci k alloSCT. Zavedením RIC alloSCT a prokazatelným GVL efektem u FL se otvírají indikace hlavně pro pacienty relabující po předchozí ASCT. AlloSCT u FL je považována za léčebnou modalitu s potenciálem plného vyléčení. Současná doporučení jsou uvedena v tab. 2.
T buněčné non‑Hodgkinovy lymfomy
T buněčné non‑Hodgkinovy lymfomy (T ‑ NHL) jsou vzácnější a heterogenní skupina agresivních onemocnění, která jsou spojena s velmi špatnou prognózou a představují asi 10 % ze všech lymfoproliferativních nádorů. Mezi nejčastější histopatologické typy patří nodální periferní T buněčný lymfom blíže neklasifikovaný (PTCL), anaplastický velkobuněčný lymfom (ALCL) a angioimunoblastický T buněčný lymfom (AITL). Většina pacientů bývá diagnostikována ve vyšším věku a s pokročilým onemocněním s mediánem 60 let při diagnóze s výjimkou ALK pozitivního ALCL s mediánem 33 let. T buněčný fenotyp je sám o sobě špatným prognostickým faktorem ve srovnání s B buněčnými lymfomy a další aplikované skórovací systémy (IPI, PIT, ALK+/ – u ALCL) nám dále stratifikují rizikovost onemocnění.
Historicky jsou T lymfomy léčeny, obdobně jako B lymfomy, režimy obsahujícími antracykliny. V mezinárodní retrospektivní analýze 1 300 pacientů [38] však nebyl prokázán benefit antracyklinového režimu ve srovnání s režimem bez použití antracyklinů. Primárně refrakterních bylo 30 % pacientů s dlouhodobým přežitím pouze 10 – 30 % i při eskalaci nebo intenzifikaci léčby. V roce 2010 publikovaná studie přidává do standardního režimu CHOP etopozid a režim CHOEP (cyklofosfamid, doxorubicin, vinkristin, etopozid, prednizon) naznačuje zlepšení OS hlavně u mladších nemocných s tolerovatelnou toxicitou [39]. Obdobné výsledky demonstrovala i česká lymfomová skupina. Bylo dosaženo statisticky významného rozdílu při srovnání doby do progrese (PFS) ve prospěch režimu CHOEP. Při srovnání nemocných transplantovaných v 1. linii nebyl nalezen rozdíl se skupinou netransplantovanou [40].
Neuspokojivé výsledky standardní léčby T ‑ NHL podněcují použití HDT s ASCT nebo alloSCT. V tuto chvíli nemáme k dispozici randomizované kontrolované studie zabývající se postavením ASCT u T ‑ NHL, existují však již studie srovnávající alloSCT a ASCT.
ASCT v 1. linii
Bylo publikováno několik prospektivních studií fáze II se slibnými výsledky použitím ASCT jako konsolidace 1. linie léčby u nemocných dosahujících alespoň parciální remise po indukční chemoterapii. V jednotlivých studiích byla použita řada indukčních protokolů, následovaných v případě chemosenzitivity pacienta ASCT většinou s přípravným režimem BEAM. Tabulka 3 uvádí výběr studií se základní deskripcí, efektem indukční terapie, procento nemocných, kteří dospěli k ASCT a stav nemoci po ASCT, a proměnnými OS a PFS.
Table 3. Výběr studií ASCT u PTCL. 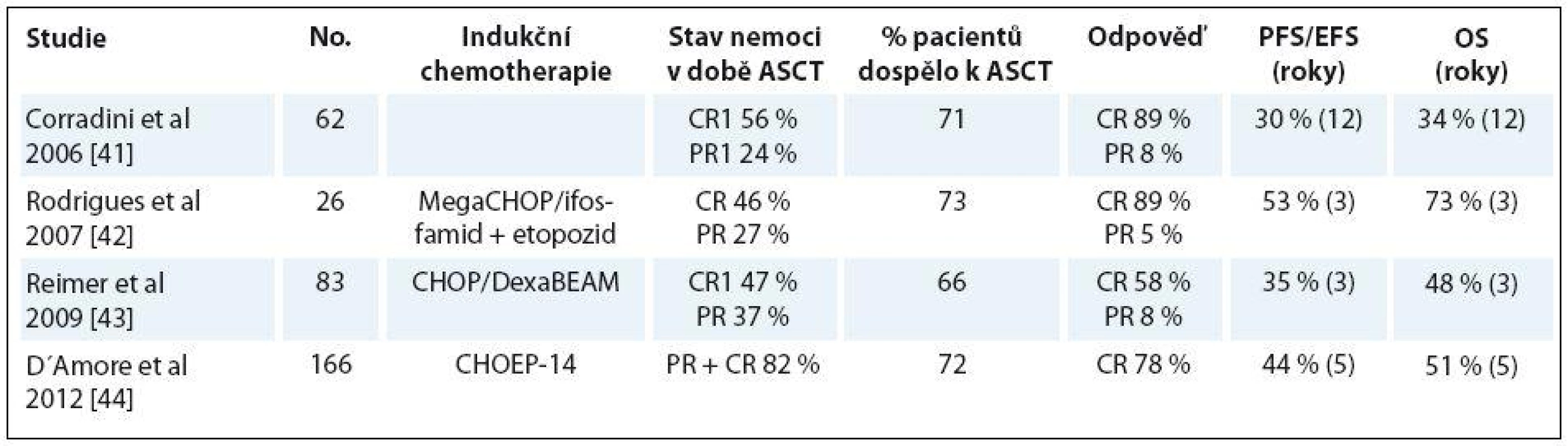
PR – parciální remise, CR – kompletní remise Největším problémem zůstává přibližně 30 – 40 % pacientů, kteří jsou primárně rezistentní nebo časně progredující a nejsou indikováni k transplantaci. Naopak pacienti, kteří jsou chemosenzitivní a únosní podstoupit ASCT, ve srovnání s konvenční chemoterapií z tohoto přístupu profitují. Strategickou výzvou tedy zůstává snížit onu třetinu nemocných, kteří k transplantaci nedospějí.
Role ASCT u chemosenzitivních relabovaných T‑ NHL
Ve dvou největších retrospektivních studiích skupina GEL/ TAMO hodnotila efekt ASCT nejen v 1. parciální remisi/ kompletní remisi, ale také efekt ASCT po salvage chemoterapii provedené ve 2. parciální remisi/ kompletní remisi. V roce 2003 byly publikovány výsledky 115 pacientů, z nichž 32 % bylo v 1. kompletní remisi (CR1) a 24 % bylo ve 2. (CR2) a vyšší kompletní remisi. Pětileté OS v celé kohortě nemocných bylo 56 %. Pokud rozdělíme skupinu dle stavu onemocnění v době transplantace, v pěti letech bylo dosaženo přežití u CR1 80 %, CR2/ CR3 50 % a parciální remisi (PR) v 46 % [45].
V další studii GELTAMO skupina hodnotila kohortu 123 pacientů, kteří v letech 1990 – 2004 podstoupili ASCT v rámci léčby po selhání 1. linie. OS a PFS v pěti letech bylo 45 a 34 %. Nemocní v 2. a vyšší kompletní remisi měli lepší léčebné výsledky než pacienti v 2. a další parciální remisi nebo pacienti s chemorefrakterním onemocněním (při pětiletém sledování: CR 2/ 3 = OS 35 %, PFS 57 %, PR2/ 3 = OS 23 %, PFS 33 %, refrakterní = OS 10 %) [46]. Chen et al publikovali zkušenosti Stanfordské univerzity u 53 pacientů s 60měsíčním sledováním, podstupujících ASCT u chemosenzitivních T ‑ NHL v letech 1989 – 2006. U nemocných v 1. kompletní remisi byl OS 76 % ve srovnání s 48 % pacientů ve 2. kompletní remisi a více [47].
Velká část publikovaných dat je zatížena „chybou“ velké heterogennosti T ‑ NHL a v současnosti je snaha hodnotit léčebné výsledky u jednotlivých subtypů T ‑ NHL. Retrospektivní analýza registru Evropské transplantační společnosti (EBMT) hodnotila výsledky ASCT u AITL lymfomů. Hodnoceno bylo 146 pacientů se čtyřletým sledováním s dosažením OS 59 a PFS 42 %. Lepších výsledků bylo dosaženo u pacientů vstupujících do ASCT v CR ve srovnání s chemorezistentním onemocněním: PFS (4 roky) 56 vs. 23 % [48].
Schéma 1. Rozhodovací algoritmus léčby refrakterního nebo relabovaného T-NHL po ASCT. 
Význam alloSCT v léčbě periferních T lymfomů
Léčba relabovaných a refrakterních T ‑ NHL spočívá v podání chemoterapie a/ nebo imunoterapie, která v principu znamená pouze dosažení kontroly onemocnění a vedení nemocného k alloSCT. Výsledky vlastní alloSCT u PTL se ukazovaly jako slibné, s přítomným GVL efektem, a to zejména ve srovnání s některými dalšími podtypy NHL [49], což potvrzují i česká data [50]. Bohužel pouze menšina nemocných je únosná k alloSCT z důvodů rezistence onemocnění, nedostupnosti vhodného dárce, nízkého performace stavu, orgánových postižení a dalších. Proto se testoval přístup se zařazením alloSCT již do 1. linie. V italské studii dosahovali mladší nemocní, kteří byli transplantováni na podkladě genetické randomizace alogenně nebo autologně, lepších výsledků než starší nemocní léčení jen chemoterapií. Při srovnání PFS mezi alogenně a autologně nemocnými nebyl nalezen rozdíl. Rozdíl, byť na hranici statistické významnosti (p = 0,10), byl pozorován při srovnání pravděpodobnosti OS ve čtyřech letech ve prospěch ASCT (OS 92 %) proti alloSCT (OS 69 %) [51]. Druhá studie randomizovala nemocné na začátku léčby a umožňovala i alloSCT od nepříbuzného dárce. V rámci hodnocení interim analýzy (hodnotitelných 58 nemocných ze 104) byla pravděpodobnost přežití bez události (EFS) identická a při srovnání OS byl pozorován statisticky nevýznamný trend ve prospěch lepšího přežití nemocných transplantovaných autologně [52].
Z chemoterapie používané k záchranné léčbě je nutné se zmínit o gemcitabinu (Gemzar) v monoterapii nebo v kombinaci. Zinzani et al demonstrovali chemosenzitivitu u 51 % pacientů dosažení kompletní remise ve 23 % při monoterapii gemcitabinem s délkou léčebné odpovědi 5 – 60 měsíců. Tato léčba představuje možnost paliativní chemoterapie pro nemocné, kteří nejsou únosní následné alloSCT [53].
Při kombinované chemoterapii gemcitabin s cisplatinou/ oxaliplatinou a dexametazonem je dosahováno léčebné odpovědi 40 – 69 % a kompletní remise v 8 – 19 % s mediánem PFS 4 – 5 měsíců. Gemcitabin v kombinaci je tedy alternativou k dosažení cytoredukce a kontroly onemocnění u pacientů plánovaných k alloSCT [54].
Nadějí k lepší efektivitě záchranné terapie u CD30 pozitivních ALCL a PTL je brentuximab vedontin (Adcetris), což je anti‑CD30 protilátka s navázaným cytostatikem auristatinem [55]. Ve studii fáze II u relabovaného/ refrakterního anaplastického lymfomu (ALCL) vedlo podání brentuximabu u 58 pacientů (15 z nich bylo po ASCT) k dosažení 86 % léčebných odpovědí a 57 % kompletních remisí. Medián délky léčebné odpovědi byl 13,3 měsíce [56].
Závěr
Přestože je u nemocných s refrakterním nebo relabujícím lymfomem celková prognóza přežití zhoršena, dosahujeme v současnosti vysokého počtu léčebných odpovědí u řady pacientů. Použití vysokodávkované chemoterapie s ASCT je standardní léčebná modalitau a u mnoha pacientů je dosaženo plató křivek přežití s pravděpodobným úplným vyléčením. Nicméně stále je řada nemocných, u nichž záchranná terapie selhává. V intenzivním výzkumu je také postavení alloSCT po redukované přípravě i s haploidentickým dárcem, která díky GVL efektu je schopna překonat vysoce riziková onemocnění.
Tato práce byla podpořena výzkumnými projekty NT12193-5/2011, NT11299-6/2010 a NT13072-4/2012.
Autoři deklarují, že v souvislosti s předmětem studie nemají žádné komerční zájmy.
Redakční rada potvrzuje, že rukopis práce splnil ICMJE kritéria pro publikace zasílané do biomedicínských časopisů.
MUDr. David Pohlreich
I. interní klinika – klinika hematologie
1. LF UK a VFN v Praze
U Nemocnice 2
128 08 Praha 2
e-mail: david.pohlreich@vfn.cz
Obdrženo: 27. 9. 2015
Přijato: 29. 9. 2015
Sources
1. Kuruvilla J. Standard therapy of advanced Hodgkin lymphoma. Hematology Am Soc Hematol Educ Program 2009; 497 – 506. doi: 10.1182/ asheducation ‑ 2009.1.497.
2. Schmitz N, Pfistner B, Sextro M et. al. Aggressive conventional chemotherapy compared with high‑dose chemotherapy with autologous haemopoietic stem ‑ cell transplantation for relapsed chemosensitive Hodgkin‘s disease: a randomised trial. Lancet 2002; 359(9323): 2065 – 2071.
3. Linch DC, Winfield D, Goldstone AH et al. Dose intensification with autologous bone ‑ marrow transplantation in relapsed and resistant Hodgkin‘s disease: results of a BNLI randomised trial. Lancet 1993; 341(8852): 1051 – 1054.
4. Josting A, Rueffer U, Franklin J et al. Prognostic factors and treatment outcome in primary progressive Hodgkin lymphoma: a report from the German Hodgkin Lymphoma Study Group. Blood 2000; 96(4): 1280 – 1286.
5. Josting A, Muller H, Brochmann P et al. Dose intensity of chemotherapy in patients with relapsed Hodgkin‘s lymphoma. J Clin Oncol 2010; 28(34): 5074 – 5080. doi: 10.1200/ JCO.2010.30.5771.
6. Kuruvilla J, Keating A, Crump M. How I treat relapsed and refractory Hodgkin lymphoma. Blood 2011; 117(16): 4208 – 4217. doi: 10.1182/ blood ‑ 2010 ‑ 09 ‑ 288373.
7. Jabbour E. Hosing C, Ayers G et al. Pretransplant positive positron emission tomography/ gallium scans predict poor outcome in patients with recurrent/ refractory Hodgkin lymphoma. Cancer 2007; 109(12): 2481 – 2489.
8. Moskowitz AJ, Yahalom J, Kewalramani T et al. Pretransplantation functional imaging predicts outcome following autologous stem cell transplantation for relapsed and refractory Hodgkin lymphoma. Blood 2010; 116(23): 4934 – 4947. doi: 10.1182/ blood ‑ 2010 ‑ 05 ‑ 282756.
9. Reece DE, Barnett MJ, Connors JM et al. Intensive chemotherapy with cyclophosphamide, carmustine, and etoposide followed by autologous bone marrow transplantation for relapsed Hodgkin‘s disease. J Clin Oncol 1991; 9(10): 1871 – 1879.
10. Visani G, MalerbaL, Stefani PM et al. BeEAM (bendamustine, etoposide, cytarabine, melphalan) before autologous stem cell transplantation is safe and effective for resistant/ relapsed lymphoma patients. Blood 2001; 118(12): 3419 – 3425. doi: 10.1182/ blood ‑ 2011 ‑ 04 ‑ 351924.
11. Fung HC, Stiff P, Schriber J et al. Tandem autologous stem cell transplantation for patients with primary refractory or poor risk recurrent Hodgkin lymphoma. Biol Blood Marr Transplant 2007 : 13(5): 594 – 600.
12. Morschhauser F, Brice P, Fermé C et al. Risk‑adapted salvage treatment with single or tandem autologous stem ‑ cell transplantation for first relapse/ refractory Hodgkin‘s lymphoma: results of the prospective multicenter H96 trial by the GELA/ SFGM study group. J Clin Oncol 2008; 26(36): 5980 – 5897. doi: 10.1200/ JCO.2007.15.5887.
13. Devillier R, Coso D, Castagna L et al. Positron emission tomography response at the time of autologous stem cell transplantation predicts outcome of patients with relapsed and/ or refractory Hodgkin‘s lymphoma responding to prior salvage therapy. Haematologica 2012; 97(7): 1073 – 1079. doi: 10.3324/ haematol.2011.056051.
14. Pohlreich D, Vackova B, Trnkova M et al. Fifty percent cure rate in poor risk relapsed/ refractory Hodgkin lymphoma after tandem autologous stem cell transplantation. EBMT 2014: abstr. 2381.
15. Gajewski JL, Phillips GL, Sobocinski KA et al. Bone marrow transplants from HLA‑identical siblings in advanced Hodgkin‘s disease. J Clin Oncol 1996 : 14(2): 572 – 578.
16. Milpied N, Fielding AK, Pearce RM et al. Allogeneic bone marrow transplant is not better than autologous transplant for patients with relapsed Hodgkin‘s disease. European Group for Blood and Bone Marrow Transplantation. J Clin Oncol 1996 : 14(4): 1291 – 1296.
17. Sureda A, Robinson S, Canals C et al. Reduced ‑ intensity conditioning compared with conventional allogeneic stem ‑ cell transplantation in relapsed or refractory Hodgkin’s lymphoma: an analysis from the Lamphoma Working Party of the European Group for Blood and Marrow Transplantation. J Clin Oncol 2008 : 26(3): 455 – 462.
18. Robinson SP, Sureda A, Canals C et al. Reduced intensity allogeneic stem cell transplantation for hodgkin’s lymphoma: Identification of prognostic factors predicting outcome. Haematol 2009; 94(2): 230 – 238. doi: 10.3324/ haematol.13441.
19. Burroughs LM, O’Donnel PV, Sandmaier BM et al. Comparison of outcomes of HLA‑matched related, unrelated, or HLA‑haploidentical related hematopoietic cell transplantation following nonmyeloablative conditioning for relapsed or refractory Hodgkin lymphoma. Biol Blood Marrow Transplantation 2008; 14(11): 1279 – 1287. doi: 10.1016/ j.bbmt.2008.08.014.
20. Peggs KS, Kasvani I, Edwards N et al. Donor lymphocyte infusions modulate relapse risk in mixed chimeras and induce durable salvage in relapsed patients after T ‑ cell ‑ depleted allogeneic transplantation for Hodgkin’s lymfoma. J Clin Oncol 2011 : 29(8): 971 – 978. doi: 10.1200/ JCO.2010.32.1711.
21. Coiffier B, Lepage E, Briere J et al. CHOP like chemotherapy plus rituximabcompared with CHOP alone inelderly patients with diffuse large ‑ B ‑ cell lymphoma. N Engl J Med 2002; 346(4): 235 – 242.
22. Pfreundschuh M, Trümper L, Ostergorg A et al. CHOP‑like chemotherapy plus rituximab versus CHOP‑like chemotherapy alone inyoung patients with good ‑ prognosis diffuse large ‑ B ‑ cell lymphoma: a randomized controlled trial by the MabThera International Trial Group. Lancet Oncol 2006; 7(5): 379 – 391.
23. Philip T, Guglielmi C, Hagenbeek A et al. Autologous bone marrow transplantation as compared with salvage chemotherapy in relapses of chemotherapy ‑ sensitive non‑Hodkin’s lymphoma. N Eng J Med 1995; 333(23): 1540 – 1545.
24. Thieblemont C, Briere J, Mounier N et al. The germinal center/ activated B ‑ cell subclassification has a prognostic impact for response to salvage therapy in relapsed/ refractory diffuse large B ‑ cell lymphoma: a bio ‑ CORAL study. J Clin Oncol 2011; 29(31): 4079 – 4087. doi: 10.1200/ JCO.2011.35.4423.
25. Gisselbrecht C, Glass B, Mounier N et al. Salvage regiments with autologous transplantation for relapsed large B ‑ cell lymphomain the rituximab era. J Clin Oncol 2010; 28(27): 4184 – 4190. doi: 10.1200/ JCO.2010.28.1618.
26. Crump M, Kuruvilla J, Couban S et al. Randomized comparison of gemcitabine, dexamethasone, and cisplatin versus dexamethasone, cytarabine, and cisplatin chemotherapy before autologous stem ‑ cell transplantation for relapsed and refractory aggressive lymphomas: NCIC ‑ CTG LY.12. J Clin Oncol 2014 : 32(31): 3490 – 3496. doi: 10.1200/ JCO.2013.53.9593.
27. Martín A, Conde E, Arnan M et al. R ‑ ESHAP as salvage therapy for patients with relapsed or refractory diffuse large B ‑ cell lymphoma: the influence of prior exposure to rituximab on outcome. A GEL/ TAMO study. Haematologica 2008; 93(12): 1829 – 1836. doi: 10.3324/ haematol.13440.
28. Kewalramani T, Zelenetz AD, Nimer SD et al. Rituximab and ICE as second‑line therapy before autologous stem cell transplantation for relapsed or primary refractory diffuse large B ‑ cell lymphoma. Ann Hematol 2007; 86 : 107 – 115.
29. Vellenga E, van Putten WT, van’t Veer MB et al. Rituximab improves the treatment results of DHAP ‑ VIM ‑ DHAP and ASCTin relapsed/ progressive agressive CD 20+ NHL: a prospective randomised HOVON trial. Blood 2008; 111(2): 537 – 543.
30. Van Kampen RJ, Canals C, Schouten HC et al. Allogeneic stem ‑ cell transplantation as salvage therapy for patients with diffuse large B ‑ cell lymphoma Relapsing after an autologous stem ‑ cell transplantation: an analysis of the Euuropean Group for Blood and Marrow Transplantation registry. J Clin Oncol 2011; 29(10): 1342 – 1348. doi: 10.1200/ JCO.2010.30.2596.
31. Freytes CO, Zhang MJ, Carreras J et al. Outcome of lower ‑ intensity allogeneic transplantation in non‑Hodgkin lymphoma after autologous transplantation failure. Biol Blood Marrow Transplant 2012; 18(8): 1255 – 1264. doi: 10.1016/ j.bbmt.2011.12.581.
32. Sureda A, Bader P, Cesaro S et al. Indications for allo ‑ and auto ‑ SCT for haematological diseases, solid tumours and immune disorders: current practice in Europe, 2015. Bone Marr Transpl 2015 : 50(8): 1037 – 1056. doi: 10.1038/ bmt.2015.6.
33. Al Khabori, de Almeida JR, Guyatt GH et al. Autologous stem cell transplantation in follicular lymphoma: A systematic review and meta‑analysis. J Natl Cancer Inst 2012; 104(1): 18 – 28. doi: 10.1093/ jnci/ djr450.
34. Schouten HC, Qian W, Kvaloy S et al. High‑dose therapy improves progression‑free survival and survival in relapsed follicular non‑Hodgkin‘s lymphoma: results from the randomized European CUP trial. J Clin Oncol 2003; 21(21): 3918 – 3927.
35. Sebban C, Brice P, Delarue R et al. Impact of rituximab and/ or high‑dose therapy with autotransplant at time of relapse in patients with follicular lymphoma: a GELA study. J Clin Oncol 2008; 26(21): 3614 – 3620. doi: 10.1200/ JCO.2007.15.5358.
36. Kornacker M, Stumm J, Pott C et al. Characteristics of relapse after autologous stem ‑ cell transplantation for follicular lymphoma: a long‑term follow‑up. Ann Oncol 2009; 20(4): 722 – 728. doi: 10.1093/ annonc/ mdn691.
37. Pettengell R, Schmitz N, Gisselbrecht C et al. Rituximab purging and/ or maintenance in patients undergoing autologous transplantation for relapsed follicular lymphoma: a prospective randomized trial from the lymphoma working party of the European group for blood and marrow transplantation. J Clin Oncol 2013; 31(13): 1624 – 1630. doi: 10.1200/ JCO.2012.47.1862.
38. Vose J, Armitage J, Weisenburger D et al. International peripheral T ‑ cell and natural killer/ T ‑ cell lymphoma study: pathology findings and clinical outcomes. J Clin Oncol 2008; 26(25): 4124 – 4130. doi: 10.1200/ JCO.2008.16.4558.
39. Schmitz N, Trümper L, Ziepert M et al. Treatment and prognosis of mature T ‑ cell and NK ‑ cell lymphoma: an analysis of patients with T ‑ cell lymphoma treated in studies of the German High‑Grade Non ‑ Hodgkin Lymphoma Study Group. Blood 2010; 116(18): 3418 – 3425. doi: 10.1182/ blood ‑ 2010 ‑ 02 ‑ 270785.
40. Janikova A, Bortlicek Z, et al. CHOEP versus CHOP gives better results in first‑line therapy of t ‑ cell lymphoma. A retrospective analysis from czech lymphoma study group (CLSG) database. Hematological Oncology 2015; 33 (Suppl 1): abstr. 99.
41. Corradini P, Tarella C, Zallio F et al. Long‑term follow‑up of patients with peripheral T ‑ cell lymphomas treated up ‑ front with high dose chemotherapy followed by autologous stem cell transplantaion. Leukemia 2006; 20(9): 1533 – 1538.
42. Rodrigues J, Conde E, Gutiérrez A et al. Frontline autologous stem cell transplantation in high‑risk peripheral T ‑ cell lymphoma: a prospective study from The Gel ‑ Tamo Study Group. Eur J Haematol 2007; 79(1): 32 – 38.
43. Reimer P, Rüdiger T, Geissinger E et al. Autologous stem cell transplantation as first‑line therapy in peripheral T ‑ cell lymphomas: results of a prospective multicenter study. J Clin Oncol 2009; 27(1): 106 – 113. doi: 10.1200/ JCO.2008.17.4870.
44. d‘Amore F, Relander T, Lauritzsen GF et al. Up ‑ front autologous stem ‑ cell transplantation in peripheral T ‑ cell lymphoma: NLG ‑ T ‑ 01. J Clin Oncol 2012; 30(25): 3093 – 3099. doi: 10.1200/ JCO.2011.40.2719.
45. Rodrigues J, Caballero MD, Gutiérrez A et al. High‑dose chemotherapy and autologous stem cell transplantation in peripheral T ‑ cell lymphoma: the GEL ‑ TAMO experience. Ann Oncol 2003; 14(12): 1768 – 1775.
46. Rodrigues J, Conde E, Gutiérrez A et al. The adujusted International Prognostic Index and beta‑2 – microglobulin predict the outcome after autologous stem cell transplantation in relapsing/ refraktory peripheral T ‑ cell lymphoma. Haematologica 2007; 92(8): 1067 – 1074.
47. Chen A, McMillan A, Negrin RS et al. Long‑term results af autologous hematopoietic cell transplantation for peripheral T ‑ cell lymphoma: the Stanford experience. Biol Blood Marrow Transplant 2008; 14(7): 741 – 747. doi: 10.1016/ j.bbmt.2008.04.004.
48. Kyriakou C, Canals C, Goldstone A et al. High‑dose therapy and autologous stem ‑ cell transplantation in angioimunoblaststic lymphoma: complete remission at transplantation is the major determinant of outcome – Lymphoma Working Party of the European Group for Blood and Marrow Transplantation. J Clin Oncol 2008; 26(2): 218 – 224. doi: 10.1200/ JCO.2007.12.6219.
49. Dodero A, Spina F, Narni F et al. Allogeneic transplantation following a reduced intensity conditioning regimen in relapsed/ refractory peripheral T ‑ cell lymphomas: long term remissions and response to donor lymphocyte infusions support the role of a graft versus lymphoma effect. Leukemia 2012; 26(3): 520 – 526. doi: 10.1038/ leu.2011.240.
50. Valkova V, Benesova K, Vitek A et al. The results of allogeneic transplants in patients with malignant lymphoma ‑ a retrospective analysis of data from the Czech National Registry. Neoplasma 2009; 56(1): 76 – 83.
51. Corradini P, Vitolo U, Rambaldi A et al. Intensified chemo ‑ immunotherapy with or without stem cell transplantation in newly diagnosed patients with peripheral T ‑ cell lymphoma. Leukemia 2014; 28(9): 1885 – 1891. doi: 10.1038/ leu.2014.79.
52. Schmitz N, Nickelsen M, Altmann B et al. Allogeneic or autologous transplantation as first‑line therapy for younger patients with peripheral T ‑ cell lymphoma: results of the interim analysis of the AATT trial. J Clin Oncol ASCO Meeting Abstracts 2015; 33 (15 Suppl): 8507.
Labels
Paediatric clinical oncology Surgery Clinical oncology
Article was published inClinical Oncology

2015 Issue Supplementum 3-
All articles in this issue
- Molekulární prognostické markery chronické lymfocytární leukemie a jejich klinický význam
- Význam minimální zbytkové nemoci u chronické lymfocytární leukemie
- Monoklonální protilátky v léčbě chronické lymfocytární leukemie v roce 2015
- Léčebné možnosti pro nemocné s chronickou lymfocytární leukemií a významnými přidruženými chorobami
- Léčba chronické lymfocytární leukemie s aberací TP53
- Malé molekuly v léčbě chronické lymfocytární leukemie v roce 2015 a v blízké budoucnosti
- Aktuality v podpůrné léčbě chronické lymfocytární leukemie
- Maligní lymfomy − minulost, současnost a budoucnost
- Difuzní velkobuněčný B lymfom – moderní způsoby diagnostiky a molekulárně cílené léčby
- Folikulární lymfom
- Lymfom z plášťových buněk – současný stav poznání a možnosti léčby
- Hodgkinův lymfom – vývoj léčebných přístupů a současné trendy
- Záchranná léčba a role transplantací u lymfomů
- Současné možnosti imunoterapie nádorových onemocnění
- Clinical Oncology
- Journal archive
- Current issue
- Online only
- About the journal
Most read in this issue- Difuzní velkobuněčný B lymfom – moderní způsoby diagnostiky a molekulárně cílené léčby
- Folikulární lymfom
- Lymfom z plášťových buněk – současný stav poznání a možnosti léčby
- Hodgkinův lymfom – vývoj léčebných přístupů a současné trendy
Login#ADS_BOTTOM_SCRIPTS#Forgotten passwordEnter the email address that you registered with. We will send you instructions on how to set a new password.
- Career

