-
Medical journals
- Career
Monoklonální protilátky v léčbě chronické lymfocytární leukemie v roce 2015
Authors: P. Obrtlíková 1; R. Urbanová 2
Authors‘ workplace: I. interní klinika – klinika hematologie 1. LF UK a VFN v Praze 1; Hemato‑ onkologická klinika LF UP a FN Olomouc 2
Published in: Klin Onkol 2015; 28(Supplementum 3): 22-29
doi: https://doi.org/10.14735/amko20153S22Overview
Kombinace chemoterapie s monoklonálními protilátkami je nyní základ v léčbě chronické lymfocytární leukemie. Rituximab, nejrozšířenější anti‑CD20 protilátka užívaná v běžné klinické praxi, vedla v kombinaci s fludarabinem a cyklofosfamidem u dosud neléčených pacientů v dobrém celkovém stavu nejen k zlepšení přežití bez progrese, ale i ke zlepšení celkového přežití. Tento režim se stal standardem léčby nemocných v dobrém fyzickém stavu. Rituximab i nejnovější anti‑CD20 protilátka obinutuzumab v kombinaci s chlorambucilem prodloužily celkové přežití ve srovnání s monoterapií chlorambucilem u dosud neléčených pacientů s významnými přidruženými onemocněními. Kombinace anti‑CD20 protilátky s chlorambucilem se tak stala standardním režimem v této skupině pacientů. Alemtuzumab a ofatumumab zlepšily výsledky léčby u refrakterní chronické lymfocytární leukemie. Cílená léčba pomocí kombinace chemoterapie a monoklonálních protilátek u nemocných s chronickou lymfocytární leukemií představuje významný pokrok v léčbě tohoto onemocnění.
Klíčová slova:
monoklonální protilátka – rituximab – ofatumumab – alemtuzumab – obinutuzumabÚvod
Terapeutický přístup k chronické lymfocytární leukemii (CLL) prošel v posledním desetiletí zásadními změnami. Zavedení monoklonálních protilátek do léčby CLL vedlo ke značnému zlepšení léčebných výsledků a jejich užití u pacientů s CLL se stále více rozšiřuje.
Monoklonální protilátky působí cíleně na nádorovou buňku, mají schopnost vázat se na epitopy konkrétních povrchových nádorových antigenů či solubilních proteinů a dovedou mechanizmy odlišnými od účinku cytostatik indukovat jejich zánik. Navíc mohou zvyšovat senzitivitu nádorových buněk ke konvenční chemoterapii, a proto se často používají jako součást kombinovaných imunochemoterapeutických schémat. Na základě řady in vitro experimentů byly definovány tři základní mechanizmy jejich působení. Patří mezi ně komplementem zprostředkovaná cytotoxicita (complement ‑ dependent cellular cytotoxicity – CDC), cytotoxicita závislá na protilátkách (antibody ‑ dependent cellular cytotoxicity – ADCC) a přímá indukce apoptózy (direct cell death – DCD) [1]. Syntéza monoklonálních protilátek prošla vývojem od čistě myších (jejich nevýhodou byla tvorba protilátek proti myší komponentě – tzv. human anti-mouse antibodies – HAMA), přes chimérické až po humanizované nebo čistě humánní.
Uplynulo již 18 let od doby, kdy byl schválen pro klinickou onkologickou praxi rituximab, první chimérická monoklonální protilátka zaměřená proti antigenu CD20. Za tuto dobu významně přibylo klinických zkušeností s jejím použitím a její úspěch podnítil prudký rozvoj imunoterapie. V preklinických studiích jsou testovány desítky monoklonálních protilátek proti různým antigenům, nejčastěji se však stále využívá antigen CD20 [2,3]. Přelomovým momentem ve vývoji protilátek se bezpochyby stala syntéza obinutuzumabu, anti‑CD20 humanizované protilátky nové generace, protilátky II. typu s unikátním mechanizmem účinku, molekuly upravené metodou glycoengineeringu.
V tomto přehledovém článku představujeme čtyři základní protilátky testované v léčbě CLL: rituximab, ofatumumab, alemtuzumab a nejnovější protilátku obinutuzumab.
Rituximab
Rituximab – charakteristika a mechanizmus účinku
Rituximab je chimérická myší‑lidská monoklonální protilátka zaměřená proti antigenu CD20. Rituximab byl v roce 1997 historicky první monoklonální protilátka schválená pro léčbu hematologických malignit a v současné době je to nejrozšířenější protilátka užívaná v léčbě CLL. Mechanizmus účinku rituximabu je komplexní a zahrnuje přímý cytotoxický účinek, aktivaci komplementu a buněčnou cytotoxicitu závislou na protilátce. Ačkoli v monoterapii je méně efektivní ve srovnání s léčbou lymfomů díky nižší denzitě antigenu CD20 na leukemických lymfocytech a rychlému odstranění rituximabu z oběhu solubilním CD20 antigenem, v rámci kombinovaných imunochemoterapeutických schémat přispěl díky synergickému účinku s řadou cytostatik významně ke zlepšení výsledků léčby, a přitom nevedl k podstatnému zvýšení toxicity léčby [4].
Rituximab – klinické studie
Kombinace rituximabu s fludarabinem a cyklofosfamidem (režim FCR), vyvinutá v MD Anderson Cancer Center v texaském Houstonu, je nyní vysoce účinný standard iniciální terapie pro nemocné s CLL v dobré kondici bez závažných komorbidit. Dle výsledků publikovaných studií je pomocí tohoto režimu v léčbě 1. linie dosahováno až 95 % léčebných odpovědí a kompletní remise (complete remission – CR) byla zaznamenána v 52 %, resp. v jedné ze studií až v 72 % případů [5]. V prospektivní randomizované studii CLL8 fáze III bylo poprvé prokázáno, že přidání rituximabu k chemoterapeutické kombinaci fludarabinu s cyklofosfamidem (FC) prodlužuje nejen dobu do progrese onemocnění (progression‑free survival – PFS), ale vede v rámci léčby 1. linie i k prodloužení celkového přežití (overall survival – OS). PFS ve třech letech bylo 65 % v rameni s rituximabem (FCR) vs. 45 % v rameni s FC (p < 0,0001), OS ve třech letech bylo 87 vs. 83 % (p = 0,01) [6]. Přidání rituximabu k režimu FC vedlo k vyššímu výskytu neutropenie stupně 3 a 4 (34 vs. 21 %;p < 0,0001), který se však nepromítl do vyššího procenta infekčních komplikací. Také v léčbě relapsů byla prokázána vyšší účinnost chemoimunoterapie FCR vůči FC. V prospektivní, randomizované studii REACH fáze III vedlo užití kombinace FCR u pacientů s relabovanou CLL k signifikantnímu prodloužení PFS ve srovnání s FC režimem (medián PFS 30,6 vs. 20,6 měsíce; p < 0,001), avšak bez prodloužení OS [7]. Limitací této studie bylo, že pouze 18, resp. 17 % pacientů bylo léčeno v rámci 1. linie fludarabinovým režimem, který je nyní v primoterapii často užíván. Přidání rituximabu vedlo k častější neutropenii stupně 3 a 4 (89 vs. 84 %), závažné infekce však v rameni s FCR kombinací ve srovnání s FC režimem zvýšeny nebyly. Přesto je hematologická toxicita hlavní problém tohoto režimu.
Vzhledem k tomu, že pacienti s CLL jsou často staršího věku s dalšími přidruženými onemocněními, byla snaha navrhnout protokol se srovnatelnou účinností a menší toxicitou. FCR‑lite režimy s redukovanou dávkou fludarabinu a cyklofosfamidu se zdají být slibnou alternativou s dobrými výsledky léčby a zejména přijatelnou toxicitou [8]. V ČR probíhal projekt Q ‑ Lite České skupiny pro CLL zaměřený na léčbu starších či komorbidních nemocných s CLL s využitím nízkodávkovaného protokolu FCR a výsledky byly také velmi dobré a s akceptovatelnou toxicitou [9].
Další testovanou chemoimunoterapeutickou kombinací je kombinace rituximabu s bendamustinem (BR režim). Ve studii s relabovanými pacienty byla u tohoto režimu zaznamenána celková léčebná odpověď (overall response rate – ORR) 59 %, z toho 9 % CR [10]. V jiné studii pro dosud neléčené pacienty bylo dosaženo ještě lepších výsledků (ORR 88 %, CR 23 %) a přitom s přijatelnou toxicitou [11]. Nejčastějším nežádoucím účinkem byla myelosuprese (zejména neutropenie stupně 3 a 4 u 19,7 % pacientů). Německá randomizovaná studie CLL10 fáze III následně porovnávala účinnost a toxicitu BR režimu ve srovnání s kombinací FCR v léčbě 1. linie u pacientů v celkově dobrém stavu s nízkým skóre komorbidit (Cumulative Illness Rating Scale – CIRS ≤ 6). ORR byla v obou ramenech srovnatelná (97,8 %), ale v rameni s FCR bylo dosaženo více CR (40,7 vs. 31,5 %; p = 0,026), také více pacientů dosáhlo negativity minimální reziduální nemoci (MRN): 74,1 %, a PFS bylo také signifikantně delší při léčbě FCR (medián PFS 53,7 vs. 43,2 měsíce; p = 0,001). Vyšší účinnost FCR režimu byla však provázena signifikantně vyšší toxicitou. V rameni s FCR režimem byly častěji pozorovány neutropenie stupně 3 a 4 (87,7 vs. 67,8 %; p < 0,001) i závažné infekční komplikace (39,8 vs. 25,4 %; p = 0,001) [12]. V retrospektivní analýze podskupin nebyl v této studii zaznamenán rozdíl v PFS ve skupině pacientů ≥ 65 let s CIRS 4 – 6 a s více než jednou přidruženou chorobou. FCR režim tedy zůstává standardem pro fit pacienty v léčbě 1. linie. Výsledky však naznačují, že pro starší pacienty bez významných komorbidit může být režim BR přijatelnou alternativou, ale tyto závěry bude nutné potvrdit ještě v dalších studiích.
Rituximab byl testován i s další monoklonální protilátkou alemtuzumabem v kombinaci s fludarabinem a cyklofosfamidem (režim CFAR). V léčbě 1. linie u vysoce rizikových pacientů byla velmi dobrá léčebná odpověď (ORR 92 % se 70 % CR), problémem tohoto režimu však byla výrazná hematologická toxicita [13]. Na skupinu starších komorbidních pacientů s CLL se zaměřila studie CLL11 porovnávající kombinaci rituximabu s chlorambucilem ve srovnání se sólo chlorambucilem a kombinací s novou monoklonální protilátkou obinutuzumabem (viz níže) [14]. Další léčebné režimy kombinující rituximab s cytostatiky byly a jsou testovány a používají se zejména v dalších liniích terapie a nebo ve specifických situacích, jako je přítomnost autoimunitních komplikací. Kromě cytostatik je možné kombinovat rituximab i s vysokodávkovanými kortikosteroidy, zde však musíme počítat s vysokým rizikem infekčních komplikací včetně invazivních mykóz [15]. V současné době se řeší i otázka využití rituximabu v udržovací terapii u CLL. Z interim analýzy prospektivní, randomizované studie Mabtenance fáze III pro pacienty po 1. či 2. linii léčby, kteří dosáhli minimálně parciální remise (partial remission – PR), se ukazuje, že rituximab aplikovaný v tříměsíčních intervalech vede k prodloužení PFS (85,2 vs. 75,9 % při observaci; p = 0,0085), nebyl však prokázán vliv na OS. V rameni s rituximabem byl navíc vyšší výskyt neutropenie stupně 3 a 4 (17,9 vs. 9,3 %; p = 0,049) a četnější infekční komplikace (51,5 vs. 38,8 %; p = 0,047) (data odeslána k publikaci).
Rituximab – nežádoucí účinky
Asi u 40 % pacientů dochází zejména během první infuze rituximabu k infuzní reakci, která je podmíněna pravděpodobně lýzou cirkulujících B lymfoidních buněk s následným uvolněním celé řady cytokinů (TNF‑α, IL‑6, IL‑8 a další) a vede k příznakům, jako je horečka, třes, hypotenze nebo dušnost. Z tohoto důvodu je nezbytná zejména při první infuzi pomalá aplikace rituximabu s postupným navyšováním rychlosti podávání a před aplikací se používá premedikace, která obvykle zahrnuje kombinaci antihistaminika, antipyretika a kortikosteroidu. Hematologická toxicita samotného rituximabu je nízká, nejčastější bývá neutropenie, která je obvykle nízkého stupně. Mezi nejzávažnější komplikace léčby s rituximabem patří riziko reaktivace hepatitidy B nebo C, která může vést až k jaternímu selhání, proto se před zahájením léčby vyšetřuje sérologie hepatitid B, C [16]. V současné době se u CLL v rámci studie SAWYER testuje i rituximab určený k podkožní aplikaci, který by měl zajistit rychlejší a pohodlnější aplikaci tohoto léku. V předběžné analýze byla potvrzena srovnatelná účinnost a bezpečnost obou cest podání rituximabu [17].
Ofatumumab
Ofatumumab – charakteristika a mechanizmus účinku
Ofatumumab je plně lidská IgG1 monoklonální protilátka anti‑CD20, která se váže na odlišný epitop antigenu CD20 než rituximab. Ve srovnání s rituximabem indukuje více cytotoxicitu závislou na komplementu a cytotoxicitu závislou na protilátce, a to i u buněk s nízkou expresí CD20 antigenu. Ofatumumab prokázal v in vitro testech velmi slibný účinek i na leukemické buňky CLL rezistentní na rituximab [18,19].
Ofatumumab – klinické studie
V publikované studii fáze I/ II s ofatumumabem podávaným u relabovaných či refrakterních nemocných bylo dosaženo 50 % léčebných odpovědí s velmi dobrou snášenlivostí [20]. Další studie fáze III pak probíhala u CLL pacientů refrakterních na fludarabin a zároveň alemtuzumab (FA ‑ refrakterní) či nevhodných na léčbu alemtuzumabem pro masivní lymfadenopatii (> 5 cm). Výsledky byly slibné i u takto prognosticky nepříznivé skupiny nemocných: ORR byla 58 % v FA ‑ refrakterní skupině a 47 % ve skupině s bulky lymfadenopatií s mediánem PFS 5,7, resp. 5,9 měsíce a mediánem OS 13,7, resp. 15,4 měsíce [21,22]. Tolerance léčby byla dobrá a na základě těchto výsledků byl ofatumumab schválen v roce 2009 pro léčbu nemocných s CLL refrakterních na fludarabin i alemtuzumab. V retrospektivní analýze byla prokázána účinnost ofatumumabu i u pacientů rezistentních na rituximab (ORR 44 %, medián PFS 5,5 měsíce) [23]. Ofatumumab byl následně testován i v kombinacích s chemoterapií. V britské studii COMPLEMENT ‑ 1 fáze III byl ofatumumab podávaný v kombinaci s chlorambucilem srovnáván s terapií samotným chlorambucilem u nemocných s dosud neléčenou CLL. Přidání ofatumumabu vedlo k významně lepší ORR (82 vs. 69 %; p = 0,001) a k signifikantnímu prodloužení PFS (22,4 vs. 13,1 měsíce; p < 0,001). Toxicita léčby byla přijatelná s dominující neutropenií (stupně 3 a 4 v 26 %) [24]. V prospektivní studii OMB115991 fáze II pro pacienty dosud neléčené, nevhodné pro léčbu fludarabinem a pacienty s relapsy CLL, byla testována kombinace ofatumumab + bendamustin. Z předběžných výsledků máme k dispozici ORR, která dosahovala 95 % v primoterapii a 74 % v léčbě relapsu, toxicita léčby byla opět přijatelná, nejčastěji se vyskytovala neutropenie (stupně 3 a 4 : 36, resp. 55 %) [25]. Definitivní závěry této studie ještě nejsou k dispozici. Ofatumumab lze stejně jako rituximab kombinovat také s vysokodávkovanými kortikoidy [26].
Na podkladě výsledků klinických studií je tedy ofatumumab schválen k léčbě CLL refrakterní na fludarabin a alemtuzumab a v kombinaci s chlorambucilem nebo bendamustinem je schválen k léčbě pacientů s CLL bez předchozí léčby, kteří nemohou být léčeni terapií založenou na fludarabinu.
Ofatumumab – nežádoucí účinky
Toxicita ofatumumabu je velmi obdobná rituximabu. Dominují infuzní reakce při 1. nebo 2. aplikaci. Jsou způsobeny nejspíše uvolněním cytokinů a vedou k příznakům, jako je pruritus, dušnost, pocení nebo horečka. Cytopenie po ofatumumabu bývají mírného stupně, nejčastěji opět neutropenie.
Alemtuzumab
Alemtuzumab – charakteristika a mechanizmus účinku
Alemtuzumab je rekombinantní humanizovaná monoklonální protilátka IgG1 namířená specificky proti povrchovému glykoproteinu CD52, který je exprimován na povrchu maligních i normálních T a B lymfocytů, ale i monocytů, makrofágů a v malé míře také granulocytů. Mechanizmus indukce apoptózy lymfocytů je zde zprostředkováván pomocí aktivace komplementu a díky cytotoxicitě závislé na protilátce [27]. Jde o protilátku, kterou je možné aplikovat jak nitrožilně, tak podkožně se srovnatelnou účinností. Alemtuzumab je možno použít jak v primoterapii u pacientů s CLL, pro něž není vhodná chemoterapie s fludarabinem, tak v léčbě relabované či refrakterní CLL.
Alemtuzumab – klinické studie
Alemtuzumab byl nejprve testován v monoterapii u pacientů s refrakterní či relabovanou CLL a léčebná odpověď se zde pohybovala mezi 33 a 53 %, OS bylo 19 – 35 měsíců u pacientů, kteří odpověděli na terapii [28 – 30]. Následně byl alemtuzumab v prospektivní, randomizované studii porovnáván s chlorambucilem v léčbě 1. linie, zde dosáhl významně lepších výsledků (ORR 83 vs. 56 %; p < 0,0001) a na podkladě této studie byl následně schválen i do léčby 1. linie [31]. Ve shodě se studiemi s refrakterními/ relabovanými pacienty bylo dosaženo lepších výsledků u pacientů s minimální či žádnou lymfadenopatií, naopak u pacientů s bulky postižením, tj. s uzlinami > 5 cm, byla jeho účinnost velmi nízká. Alemtuzumab byl dále testován i jako součást kombinované léčby s cytostatiky, event. s jinými protilátkami (rituximab). Synergická aktivita fludarabinu s alemtuzumabem (režim FA) byla potvrzena v několika klinických studiích. ORR u pacientů s relabovanou či refrakterní chorobou při užití režimu FA dosahovala v jedné ze studií 83 % s 30 % CR, přičemž léčba byla poměrně dobře tolerována [32]. V jiné randomizované studii fáze III porovnávající kombinaci FA s monoterapií fludarabinem byly také prokázány jasně lepší výsledky kombinační léčby (PFS 23,7 vs. 16,5 měsíce; p = 0,0003), ale za cenu vyšší incidence závažných nežádoucích účinků (33 vs. 25 %), které však nevedly ke zvýšení mortality [33]. Po přidání cyklofosfamidu do této léčebné kombinace (režim FCA) se při porovnání s léčbou FCR v 1. linii ukázalo, že toxicita této léčby je příliš vysoká, navíc terapeutický efekt kombinace FCR byl jasně lepší [34]. Tato studie musela být kvůli toxicitě předčasně ukončena.
Vzhledem k tomu, že alemtuzumab vykazuje účinnost i u nemocných s poruchou dráhy p53, je vhodnou alternativou léčby zejména pro vysoce rizikové CLL s delecí části chromozomu 17 (del(17p)) a nebo mutací genu TP53, kde dosahuje lepších výsledků ve srovnání s konvenčními cytostatiky [35]. V současné době se však na poli léčby CLL objevily nové, účinnější molekuly, jako je ibrutinib nebo idelalisib, a alemtuzumab tak nyní ustupuje v léčbě CLL spíše do pozadí. V roce 2012 byl alemtuzumab deregistrován v hematologické indikaci vzhledem k registraci pro léčbu roztroušené sklerózy. Nyní je alemtuzumab pro pacienty s CLL dostupný v ČR díky specifickému léčebnému programu.
Alemtuzumab – nežádoucí účinky
Léčba alemtuzumabem je spojena s dlouhodobou, výraznou deplecí zdravých B a T lymfocytů a v důsledku toho i se zvýšeným rizikem oportunních infekcí a dále rizikem reaktivace cytomegaloviru (CMV). Z tohoto důvodu je nutné, aby nemocní léčení alemtuzumabem užívali antimikrobiání profylaxi (sulfametoxazol/ trimetoprim, aciklovir nebo analoga) a dále je doporučována pravidelná monitorace CMV pomocí polymerázové řetězové reakce (PCR). Mezi další nežádoucí účinky patří hematologická toxicita. Vyskytují se i reakce na protilátku obdobné reakcím na rituximab či ofatumumab (horečky, třesavky, zimnice, hypotenze), a to zejména při nitrožilním podání. Proto je preferována podkožní aplikace, po které vídáme často lokální kožní reakce v místě vpichu, jež však nebývají závažné.
Obinutuzumab (GA101)
Obinutuzumab (GA101) – charakteristika a mechanizmus účinku
Obinutuzumab (GA101) je humanizovaná protilátka třídy IgG1 proti antigenu CD20, protilátka typu II s unikátním mechanizmem účinku, která vykazuje významné odlišnosti ve srovnání s rituximabem a ofatumumabem, protilátkami typu I. Molekula obinutuzumabu, její Fc oblast je cíleně změněna glykosylací metodou glycoengineeringu. Protilátka má silnější efekt ADCC, na protilátkách závislou cytotoxicitu. Toho bylo dosaženo právě díky vyšší afinitě Fc fragmentu imunoglobulinu k efektorovým cytotoxickým buňkám. Je uváděn až 100krát silnější ADCC efekt ve srovnání s rituximabem [36 – 38]. Dále protilátka vykazuje silnější indukci přímé buněčné smrti nádorové buňky DCD [39]. Jedním z možných mechanizmů DCD je neapoptotická, lysozomy zprostředkovaná buněčná smrt [40]. Cytotoxicita závislá na komplementu je u obinutuzumabu menší ve srovnání s rituximabem a ofatumumabem [36]. Stejně tak na protilátce závislá buněčná fagocytóza (antibody ‑ dependent cellular phagocytosis – ADCP) byla u obinutuzumabu slabší [41]. Obinutuzumab vede změnou struktury molekuly Ig (záměna leucinu za valin na pozici 11 v myší části polypeptidové sekvence imunoglobulinu) k rozevření vazebného místa pro antigen CD20 a změně polohy molekuly protilátky při vazbě na tento antigen. To umožní vazbu ramen Fab na jeden tetramer CD20 antigenu, čímž je zabráněno internalizaci komplexu protilátka typu II a antigen a jeho intracelulární degradaci, což vedlo u protilátek typu I ke snížení jejich účinku [42]. Rituximab se na rozdíl od obinutuzumabu váže v místech lipidových raftů. Tato schopnost souvisí s aktivací komplementu a komplementem zprostředkovanou cytotoxicitou [43]. Obinutuzumab tvoří vazbu s antigenem v místech intercelulárních kontaktů cílových buněk, čímž dochází k tzv. homotypické agregaci cílových buněk [42]. Je popsána celá řada odlišností v mechanizmu účinku protilátek typu I a II, které demonstruje tab. 1 [36,40,42,44 – 46].
Table 1. Srovnání mechanizmu účinku monoklonálních protilátek typu I a II. 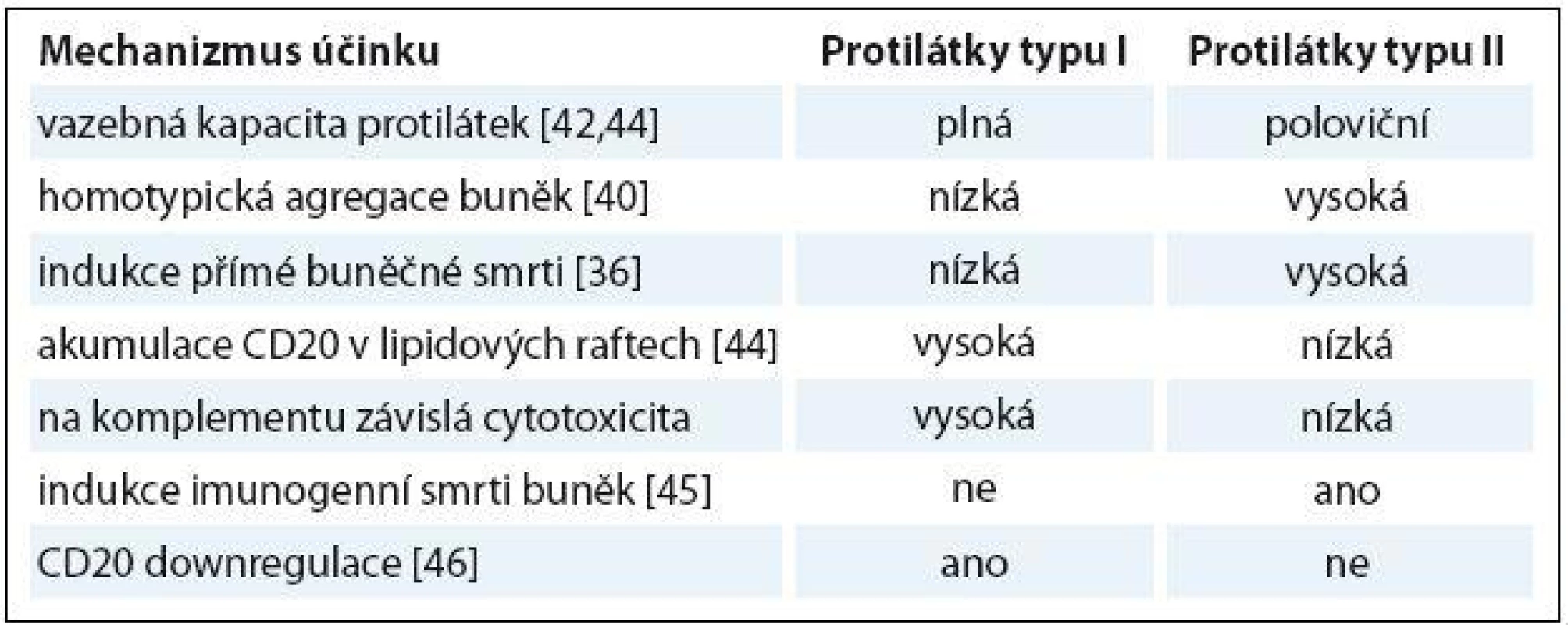
Obinutuzumab – preklinické a klinické studie fáze I a II
Preklinické studie na myších modelech lymfomu prokázaly vysokou účinnost a také vyšší efektivitu při podání vyšší dávky GA101 [36]. Ve studii GAUGUIN byl testován účinek obinutuzumabu v monoterapii u nemocných s relabující nebo refrakterní CLL. Ve fázi I dostávalo 13 nemocných dávku od 400 do 1 200 mg (den 1 a 8 cyklu 1 a den 1 cyklu 2 – 8). Ve fázi II pak dostávalo 20 nemocných fixní dávku 1 000 mg (den 1, 8 a 15 cyklu 1 a den 1 cyklu 2 – 8). Jednalo se o 33 významně předléčených nemocných s mediánem podaných cyklů terapie 3. Bylo dosaženo 62 % ORR ve fázi I a 30 % ve fázi II, kde byla horší odpověď ovlivněna větší masou tumoru při menší dávce léku v této podskupině. Byly však dosahovány pouze PR. Ve fázi I a II bylo 82 a 73 % nežádoucích reakcí, přičemž nejběžnější byly reakce vázané na podání infuze (infusion‑related reactions – IRR) stupně 1 a 2. Ve fázi II byl medián PFS 10,7 měsíce a medián trvání léčebné odpovědi 8,9 měsíce. Studie prokázala jako optimální aplikaci jednotné dávky 1 000 mg ve dnech 1, 8 a 15 cyklu 1 a dále byl podán průkaz tolerovatelné toxicity léku. IRR byly během první infuze častější ve srovnání s reakcemi po podání rituximabu. Závěrem studie GAUGUIN bylo, že obinutuzumab v monoterapii je aktivní lék u významně předléčených nemocných s relabující a refrakterní CLL [47]. Ve studii fáze I GAUSS, studii bezpečnosti, snášenlivosti, farmakokinetiky a efektivity byl obinutuzumab podáván 22 nemocným s relabujícími CD20 pozitivními non‑Hodgkinskými lymfomy (NHL) nebo CLL/ SLL (small lymphocytic lymphoma, lymfom z malých lymfocytů), celkem pěti nemocným s CLL a dvěma nemocným se SLL. Obinutuzumab byl podáván v dávce 200 – 2 000 mg každý týden po čtyři týdny, a pokud nemocní dosáhli léčebné odpovědi nebo klinického efektu terapie, pokračovali v udržovací léčbě každé tři měsíce, celkem v osmi dávkách udržovací léčby. Po indukci celkem pět nemocných (23 %) dosáhlo PR a 12 nemocných (54 %) mělo obraz stabilní nemoci. Osm nemocných dostávalo léčbu udržovací a nejlepší léčebná odpověď byla dosažena ve 32 %. Jeden ze dvou nemocných se SLL dosáhl léčebné odpovědi, ale žádný z pěti nemocných s CLL kritéria odpovědi nesplnil. Všech pět zařazených nemocných s CLL bylo refrakterních na fludarabin. Studie prokázala, že obinutuzumab v indukční a udržovací terapii byl dobře tolerován u heterogenní skupiny vysoce předléčených nemocných s CD 20 pozitivními NHL [48]. Studie fáze II GAGE porovnávala efekt monoterapie s obinutuzumabem u 80 neléčených nemocných s CLL, kterým byla podávána dávka 1 000 nebo 2 000 mg v celkem osmi cyklech po 21 dnech. ORR ve skupině nemocných léčených nižší dávkou byla 49 % a ve druhé skupině léčených vyšší dávkou byla ORR 67 % (p = 0,08) [49]. V multicentrické studii fáze Ib GALTON byla studována bezpečnost a předběžná účinnost terapie na dvou paralelních skupinách nemocných s CLL léčených v primoléčbě obinutuzumabem a bendamustinem (G ‑ B) (20 nemocných) a obinutuzumabem, fludarabinem a cyklofosfamidem (G ‑ FC) (21 nemocných). ORR pro G ‑ B byla 90 % s 20 % CR a ORR u G ‑ FC byly 62 % s 10 % CR při mediánu sledování 23,5 a 20,7 měsíce. Výskyt IRR byl 88 %, stupeň 3 a 4 celkem IRR 20 %. Nejběžnějším nežádoucím účinkem byly neutropenie, v 55 % nemocných léčených G ‑ B a v 48 % léčených G ‑ FC stupně 3 a 4. Studie prokázala nadějnou účinnost těchto kombinovaných režimů s obinutuzumabem v iniciálně léčbě, kdy k ukončení sledování ve studii nebyla zaznamenána žádná recidiva onemocnění [50].
Obinutuzumab – klinická studie fáze III
Ve studii fáze III, otevřené prospektivní randomizované mezinárodní studii CLL11, byli nemocní randomizováni do tří ramen. Byli léčeni šesti cykly obinutuzumabu v kombinaci s chlorambucilem (G ‑ Clb), šesti cykly rituximabu v kombinaci s chlorambucilem (R ‑ Clb) a v monoterapií chlorambucilem (Clb). Jednalo se o celkem 780 dosud neléčených nemocných s mediánem věku 73 let, s CIRS skóre > 6 a nebo s clearence kreatininu 30 – 69 ml/ min. Medián CIRS skóre byl 8, 61 % nemocných mělo nemutovaný stav IGHV, 8 % del(17p) a 16 % del(11q). Chlorambucil byl podáván v dávce 0,5 mg/ kg/ den den 1a 15 cyklu, bylo podáno celkem šest cyklů po 28 dnech. Obinutuzumab byl podáván v dávce 100 mg den 1, 900 mg den 2 a 1 000 mg den 8 a den 15 v 1. cyklu a den 1 v 2. – 6. cyklu terapie po 28 dnech. Rituximab byl podáván v dávce 375 mg/ m2/ den 1 cyklu 1 a 500 mg/ m2/ den 1 v 2. – 6. cyklu po 28 dnech. Nemocní, kteří progredovali na terapii chlorambucilem, měli možnost přeřazení („crossover“) do ramene s obinu-tuzumabem. Ve skupinách G ‑ Clb a R ‑ Clb bylo dosaženo 20,7 vs. 7 % CR, negativita minimální reziduální nemoci (MRN)v periferní krvi byla dosažena v 37,7 vs. 3,3 % a negativita MRN v kostní dřeni v podskupinách v 19,5 vs. 2,6 %. PFS byl delší ve skupině léčené G ‑ Clb ve srovnání se skupinou R ‑ Clb, 29,2 vs. 15,4 měsíce (p < 0,001), také doba do další antileukemické terapie byla delší, 42,7 vs. 32,7 měsíce (p < 0,001). Nebyl prokázán statisticky signifikantní rozdíl v OS v podskupinách R ‑ Clb a G ‑ Clb, ale výsledky nejsou zralé vzhledem k malému počtu událostí v podskupinách. Byl ale prokázán rozdíl v OS nemocných léčených v rameni G ‑ Clb a R ‑ Clb oproti nemocným léčeným v rameni s Clb. Kombinovaná terapie G ‑ Clb a R ‑ Clb statisticky signifikantně prodloužila PFS ve srovnání s Clb (29,2 a 15,4 vs. 11,1 měsíce) a také byl prokázán statisticky významný rozdíl v PFS u G ‑ Clb vs R ‑ Clb. Studie CLL11 ukázala, že kombinace protilátky obinutuzumabu nebo rituximabu s chlorambucilem v 1. linii u starších a komorbidních nemocných prodloužila OS ve srovnání s monoterapii chlorambucilem a že medián PFS nemocných léčených G ‑ Clb se téměř zdvojnásobil na 30 měsíců oproti PFS nemocných léčených kombinací R ‑ Clb [14,51]. Delší sledování by pak mělo prokázat, zda podání obinutuzumabu namísto rituximabu nebude mít vliv na prodloužení OS.
Obinutuzumab – nežádoucí účinky
U nemocných léčených ve studii CLL11 kombinovanou terapií G ‑ Clb vs. R ‑ Clb byl výskyt neutropenie stupně ≥ 3 ve 33 vs. 28 % a trombocytopenie stupně ≥ 3 v 10 vs. 3 %, ale nedošlo ke zvýšení rizika infekčních komplikací stupně ≥ 3 v podskupinách 12 vs. 14 % [51]. Jedná se o akceptovatelnou toxicitu režimu. Přestože jde o starší a komorbidní nemocné, byl výskyt uvedených komplikací relativně nízký ve srovnání s toxicitou režimů FCR a BR (viz výše) ve studii CLL10. Vzhledem k četnosti a závažnosti výskytu IRR u nemocných léčených v rameni G ‑ Clb ve studii CLL11 je vhodné se jim věnovat na tomto místě podrobněji. Protinádorová léčba obecně včetně léčby monoklonálními protilátkami infuzní reakce vyvolává. Jedná se o reakce imunitního systému alergické, zprostředkované IgE. U monoklonálních protilátek byly ale popsány zejména reakce nealergické, vyvolané uvolněním cytokinů. Bezpochyby jsou však vyvolávající mechanizmy složitější [52]. Ve studii CLL11 ale nebyly zaznamenány fatální IRR a většina nemocných léčbu dokončila. IRR probíhají po obrazem nevolnosti, zimnice, horečky, hypotenze, zvracení, dušnosti, pocitů horka, hypertenze, průjmu, tachykardie nebo bolesti hlavy. Mohou být přítomny příznaky respirační či kardiální, bronchospazmus, sípání, otok hrtanu nebo fibrilace síní. Příznaky jsou většinou mírné až středně závažné a jsou léčebně dobře ovlivnitelné. V některých případech (reakce stupně 4 nebo opakování IRR stupně 3) však mohou vést k ukončení léčby. Incidence jejich výskytu ve studii CLL11 v rameni G ‑ Clb byla 66 %, ve 20 % stupně 3 a 4, přičemž výskyt v rameni s R ‑ Clb byl výrazně menší, 38 % léčených a 4 % stupně 3 a 4. V rameni s G ‑ Clb se reakce stupně 3 a 4 vyskytovaly během první infuze léku, v průběhu dalších infuzí léku byly hlášeny pouze reakce stupně 1 a 2. Nejčastější byl výskyt IRR u nemocných zařazených v I. fázi studie, kde nebyla podávána premedikace. Se zahájením jejího podávání u nemocných s počty lymfocytů > 25 × 109/ l a následně u všech nemocných, po vysazení antihypertenzní terapie před podáním infuze, podáním pomalé infuze a rozdělením první dávky léku do dvou dnů se počet všech IRR snížil na 53 %, ale reakce stupně 3 a 4 se stále vyskytovaly v 17 %. Byla snaha identifikovat rizikové faktory pro výskyt IRR. Počet lymfocytů, velikost nádorové masy, exprese antigenu CD20 a další však nemohou výskyt IRR predikovat s dostatečnou spolehlivostí. Některé jiné faktory mohou zvyšovat riziko výskytu IRR, ale nejsou běžně vyšetřovány, např. polymorfizmy genů (Fc gamma receptor IIIa). Vyšší výskyt IRR bývá také u nemocných s anamnézou atopie, astmatu, autoimunitních onemocnění, kardiální nebo pneumologickou anamnézou, nemocných v terapii β‑blokátory [53]. Význam preventivních opatření IRR hodnotila studie GREEN. V případě první infuze byla podávána 60 min před podáním i.v. kortikoterapie (dexametazon 20 mg i.v. nebo metylprednizolon 80 mg i.v.), jako neúčinné se naopak jeví podávání hydrokortizonu i.v.,dále 30 min před podáním léku byla doporučena analgetika/ antipyretika a antihistaminika. Během druhého a dalších podání léku byla doporučena pouze analgetika/ antipyretika, u nemocných s lehkým stupněm IRR navíc antihistaminika a u nemocných s výskytem IRR 3, s počty lymfocytů > 25 × 109/ l byla doporučena premedikace kortikosteroidy. První infuzi obinutuzumabu (1 000 mg látky v podobě sterilního roztoku o koncentraci 25 mg/ ml rozředit ve 250 ml fyziologického roztoku) bylo doporučeno aplikovat v dávce 100 mg i.v. první den a 900 mg i.v. první nebo druhý den. Je doporučeno podat prvních 100 mg v infuzi během 4 hod. Pokud podání proběhlo bez reakce, lze podat 900 mg týž den rychlostí 50 mg/ hod, se zvyšováním rychlosti o 50 mg/ hod po 30 min do max. rychlosti 400 mg/ hod. V prevenci syndromu lýzy tumoru u nemocných s velkou masou nádoru se doporučuje 1 – 2 dny před zahájením terapie prevence v podobě dostatečné hydratace min. 3 l tekutin denně, tři dny před podáním zahájit podávání alopurinou. Tato opatření jsou vhodná před první a každou další infuzí do poklesu počtu lymfocytů < 25 × 109/ l. V průběhu prvního cyklu terapie byly pozorovány fatální krvácivé příhody, vždy v souvislosti s léčbou antikoagulační nebo antiagregační, dále u nemocných s trombocytopenií nebo s anamnézou pádu. Proto je doporučeno v průběhu léčby monitorování počtu trombocytů a v případě závažné trombocytopenie jejich substituce [14,51,54]. V souhrnu údajů o přípravku (SPC) je stejně jako pro prevenci vypracováno doporučení pro léčbu IRR [55].
Obinutuzumab – výsledky metaanalýzy klinických studií
Ladyzynski et al publikovali v roce 2014 metaanalýzu, která srovnávala celkem devět kvalitních randomizovaných kontrolovaných studií se sledováním PFS a šest studií se sledováním OS u mladých nemocných léčených režimy chlorambucilem, fludarabinem (F), alemtuzumabem, fludarabinem s cyklofosfamidem (FC), bendamustinem a kombinovaným režimem (FCR) a u nemocných starších léčených v 1. linii režimy chlorambucilem, fludarabinem, chlorambucilem s ofatumumabem (O ‑ Clb) nebo s rituximabem (R ‑ Clb) nebo obinutuzumabem (G ‑ Clb). Režim FCR měl největší potenciál u mladých nemocných v prevenci progrese CLL. U starších nemocných terapie G ‑ Clb demonstruje nejdelší vypočítaný PFS (60 měsíců) ve srovnání s ostatními léčebnými režimy a největší potenciál k prodloužení OS [56].
Obinutuzumab – perspektivy léčby
Kromě studií, které testují kombinaci obinutuzumabu s chemoterapií bendamustinem nebo s fludarabinem a cyklofosfamidem u nemocných dosud neléčených stejně jako relabujících, byly publikovány první výsledky preklinického testování, jež naznačují možnosti kombinace cílené protinádorové léčby (např. selektivního BCL ‑ 2 inhibitoru venetoclaxu nebo inhibitoru proteozomu bortezomidu) s obinutuzumabem, kde lze očekávat synergický efekt terapie. Byla pozorována taktéž minimální interference idelalisibu a ibrutinibu s imunitní efektorovou funkcí obinutuzumabu ve srovnání s rituximabem, s největší pravděpodobností v důsledku indukce přímé buněčné smrti a silnější Fc signalizací, což podporuje klinické testování těchto kombinací [50,54,57].
Závěr
Monklonální protilátky jsou dnes v rámci kombinovaných imunochemoterapeutických schémat základem v léčbě CLL. Rituximab je součástí režimu FCR, který je standardem v léčbě 1. linie u pacientů s CLL v dobrém celkovém stavu. Vzhledem k nižší toxicitě kombinace rituximabu s bendamustinem se zdá, že tento režim může být vhodnou alternativou pro starší nemocné bez významných komorbidit. U dosud neléčených pacientů s významnými přidruženými onemocněními je nyní standardem kombinace chlorambucilu s anti‑CD20 protilátkou. Přidání jak rituximabu, tak ofatumumabu i obinutuzumabu k chlorambucilu vedlo ke zvýšení účinnosti léčby a v případě rituximabu a obinutuzumabu též k prodloužení OS v této obtížně léčitelné populaci nemocných. Ve srovnání s ostatními anti‑CD20 protilátkami jsou u obinutuzumabu pozorovány častější infuzní reakce, které mohou být závažné, a proto je nutno dbát opatrnosti zejména při první infuzi a přísně dodržovat doporučená preventivní opatření. Léčba CLL prochází v současné době i díky dalším novým lékům, jako je idelalisib či ibrutinib, dramatickými změnami. Testují se nové léčebné kombinace a lze očekávat další pokrok v léčbě CLL. Avšak až výsledky klinických studií, porovnávání výsledků léčby s dosavadními standardy a každodenní praxe nám odpoví na řadu otázek, které si dnes s příchodem nových léčiv včetně protilátky obinutuzumabu klademe.
Práce byla realizována za podpory programem PRVOUK P27/LF1/1 a grantu IGA-LF-2015-001.
Autoři deklarují, že v souvislosti s předmětem studie nemají žádné komerční zájmy.
Redakční rada potvrzuje, že rukopis práce splnil ICMJE kritéria pro publikace zasílané do biomedicínských časopisů.
MUDr. Petra Obrtlíková, Ph.D.
I. interní klinika – klinika hematologie
1. LF UK a VFN v Praze
U Nemocnice 2
128 08 Praha
e-mail: petra.obrtlikova@seznam.cz
Obdrženo: 28. 7. 2015
Přijato: 2. 8. 2015
Sources
1. Glennie MJ, French RR, Cragg MS et al. Mechanisms of killing by anti‑CD20 monoclonal antibodies. Mol Immunol 2007; 44(16): 3823 – 3337.
2. Cragg MS, Walshe CA, Ivanov AO et al. The biology of CD20 and its potential as a target for mAb therapy. Curr Dir Autoimmun 2005; 8 : 140 – 174.
3. Beers SA, Chan CH, French RR et al. CD20 as a target for therapeutic type I and II monoclonal antibodies. Sem Hematol 2010; 47(2): 107 – 114.
4. Cheson BD. Monoclonal antibody therapy of chronic lymphocytic leukemia. Cancer Immunol Immunother 2006; 55(2): 188 – 196.
5. Tam CS, O‘Brien S, Wierda W et al. Long‑term results of the fludarabine, cyclophosphamide, and rituximab regimen as initial therapy of chronic lymphocytic leukemia. Blood 2008; 112(4): 975 – 980. doi: 10.1182/ blood ‑ 2008 ‑ 02 ‑ 140582.
6. Hallek M, Fischer K, Fingerle ‑ Rowson G et al. Addition of rituximab to fludarabine and cyclophosphamide in patients with chronic lymphocytic leukaemia: a randomised, open ‑ label, phase 3 trial. Lancet 2010; 376(9747): 1164 – 1174. doi: 10.1016/ S0140 ‑ 6736(10)61381 ‑ 5.
7. Robak T, Dmoszynska A, Solal ‑ Celigny P et al. Rituximab plus fludarabine and cyclophosphamide prolongs progression‑free survival compared with fludarabine and cyclophosphamide alone in previously treated chronic lymphocytic leukemia. J Clin Oncol 2010; 28(10): 1756 – 1765. doi: 10.1200/ JCO.2009.26.4556.
8. Foon KA, Boyiadzis M, Land SR et al. Chemoimmunotherapy with low‑dose fludarabine and cyclophosphamide and high dose rituximab in previously untreated patients with chronic lymphocytic leukemia. J Clin Oncol 2009; 27(4): 498 – 503. doi: 10.1200/ JCO.2008.17.2619.
9. Smolej L, Brychtova Y, Doubek M at al. Low‑dose FCR is a safe and effective treatment option for elderly/ comorbid patients with chronic lymphocytic leukemia/ small lymphocytic lymphoma. Updated results of project Q ‑ Lite by Czech CLL Study Group. 56th ASH Annual Meeting and Exposition 2014: abstr. 4760.
10. Fischer K, Cramer P, Busch R et al. Bendamustine combined with rituximab in patients with relapsed and/ or refractory chronic lymphocytic leukemia: a multicenter phase II trial of the German Chronic Lymphocytic Leukemia Study Group. J Clin Oncol 2011; 29(26): 3559 – 3566. doi: 10.1200/ JCO.2010.33.8061.
11. Fischer K, Cramer P, Busch R et al. Bendamustine in combination with rituximab for previously untreated patients with chronic lymphocytic leukemia: a multicenter phase II trial of the German Chronic Lymphocytic Leukemia Study Group. J Clin Oncol 2012; 30(26): 3209 – 3216. doi: 10.1200/ JCO.2011.39.2688.
12. Eichhorst B, Fink AM, Busch R et al. Frontline chemoimmunotherapy with fludarabine (F), cyclophosphamide (C), and Rituximab (R) (FCR) shows superior efficacy in comparison to bendamustine (B) and Rituximab (BR) in previously untreated and physically fit patients (pts) with advanced chronic leukemia (CLL): final analysis of an International, randomized study of the German CLL Study Group (GCLLSG) (CLL10 Study). Blood (ASH Annual Meeting Abstracts) 2014; 124(21): 19.
13. Parikh SA, Keating MJ, O‘Brien S et al. Frontline chemoimmunotherapy with fludarabine, cyclophosphamide, alemtuzumab, and rituximab for high‑risk chronic lymphocytic leukemia. Blood 2011; 118(8): 2062 – 2068. doi: 10.1182/ blood ‑ 2011 ‑ 01 ‑ 329177.
14. Goede V, Fischer K, Busch R et al. Obinutuzumab plus chlorambucil in patients with CLL and coexisting conditions. N Engl J Med 2014; 370(12): 1101 – 1110. doi: 10.1056/ NEJMoa1313984.
15. Smolej L, Doubek M, Panovska A et al. Rituximab in combination with high‑dose dexamethasone for the treatment of relapsed/ refractory chronic lymphocytic leukemia. Leuk Res 2012; 36(10): 1278 – 1282. doi: 10.1016/ j.leukres.2012.07.005.
16. Dervite I, Hober D, Morel P. Acute hepatitis B in a patient with antibodies to hepatitis B surface antigen who was receiving rituximab. N Engl J Med 2001; 344(1): 68 – 69.
17. Assouline S, Buchcheri V, Delmer A. et al. Non ‑ inferior pharmacokinetics with comparable safety and response rates for subcutaneous, compared with intravenous, rituximab in combination with fludarabine and cyclophosphamide in patients with untreated chronic lymphocytic leukemia: part 2 of the phase Ib SAWYER study (BO25341). 56th ASH Annual Meeting and Exposition 2014: abstr. 1995.
18. Teeling JL, French RR, Cragg MS et al. Characterization of new human CD20 monoclonal antibodies with potent cytolytic activity against non‑Hodgkin lymphomas. Blood 2004; 104(6): 1793 – 1800.
19. Beum PV, Lindorfer MA, Beurskens F et al. Complement activation on B lymphocytes opsonized with rituximab or ofatumumab produces substantial changes in membrane structure preceding cell lysis. J Immunol 2008; 181(1): 822 – 832.
20. Coiffier B, Lepretre S, Pedersen LM et al. Safety and efficacy of ofatumumab, a fully human monoclonal anti‑CD20 antibody, in patients with relapsed or refractory B ‑ cell chronic lymphocytic leukemia: a phase 1 – 2 study. Blood 2008; 111(3): 1094 – 1100.
21. Osterborg A. Ofatumumab, a human anti‑CD20 monoclonal antibody. Expert Opin Biol Ther 2010; 10(3): 439 – 449. doi: 10.1517/ 14712590903586239.
22. Wierda WG, Kipps TJ, Mayer J et al. Ofatumumab as single‑agent CD20 immunotherapy in fludarabine ‑ refractory chronic lymphocytic leukemia. J Clin Oncol 2010; 28(10): 1749 – 1755. doi: 10.1200/ JCO.2009.25.3187.
23. Wierda WG, Padmanabhan S, Chan GW et al. Ofatumumab is active in patients with fludarabine ‑ refractory CLL irrespective of prior rituximab: results from the phase 2 international study. Blood 2011; 118(19): 5126 – 5129. doi: 10.1182/ blood ‑ 2011 ‑ 04 ‑ 348656.
24. Hillmen P, Robak T, Janssens A et al. Ofatumumab + chlorambucil versus chlorambucil alone in patients with untreated chronic lymphocytic leukemia (CLL): results of the phase III Study Complement 1 (OMB110911). 55th ASH Annual Meeting and Exposition 2013: abstr. 528.
25. Offner FP, Afanasyev B et al. Ofatumumab and bendamustine combination therapy in patients with untreated and relapsed chronic lymphocytic leukemia: initial results of the phase II study OMB115991. iwCLL 2013: abstr. 429.
26. Doubek M, Brychtova Y, Panovska A et al. Ofatumumab added to dexamethasone in patients with relapsed or refractory chronic lymphocytic leukemia: results from a phase II study. Am J Hematol 2015; 90(5): 417 – 421. doi: 10.1002/ ajh.23964.
27. Flynn JM, Byrd JC. Campath ‑ 1H monoclonal antibody therapy. Curr Opin Oncol 2000; 12(6): 574 – 581.
28. Osterborg A, Dyer MJ, Bunjes D et al. Phase II multicenter study of human CD52 antibody in previously treated chronic lymphocytic leukemia. European Study Group of CAMPATH ‑ 1H Treatment in Chronic Lymphocytic Leukemia. J Clin Oncol 1997; 15(4): 1567 – 1574.
29. Keating MJ, Flinn I, Jain V et al. Therapeutic role of alemtuzumab (Campath ‑ 1H) in patients who have failed fludarabine: results of a large international study. Blood 2002; 99(10): 3554 – 3561.
30. Rai KR, Freter CE, Mercier RJ et al. Alemtuzumab in previously treated chronic lymphocytic leukemia patients who also had received fludarabine. J Clin Oncol 2002; 20(18): 3891 – 3897.
31. Hillmen P, Skotnicki AB, Robak T et al. Alemtuzumab compared with chlorambucil as first‑line therapy for chronic lymphocytic leukemia. J Clin Oncol 2007; 25(35): 5616 – 5623.
32. Elter T, Borchmann P, Schulz H et al. Fludarabine in combination with alemtuzumab is effective and feasible in patients with relapsed or refractory B ‑ cell chronic lymphocytic leukemia: results of a phase II trial. J Clin Oncol 2005; 23(28): 7024 – 7031.
33. Elter T, Gercheva ‑ Kyuchukova L, Pylylpenko H et al. Fludarabine plus alemtuzumab versus fludarabine alone in patients with previously treated chronic lymphocytic leukaemia: a randomised phase 3 trial. Lancet Oncol 2011; 12(13): 1204 – 1213. doi: 10.1016/ S1470 ‑ 2045(11)70242 ‑ X.
34. Lepretre S, Aurran T, Mahe B et al. Excess mortality after treatment with fludarabine and cyclophosphamide in combination with alemtuzumab in previously untreated patients with chronic lymphocytic leukemia in a randomized phase 3 trial. Blood 2012; 119(22): 5104 – 5110. doi: 10.1182/ blood ‑ 2011 ‑ 07 ‑ 365437.
35. Stilgenbauer S, Döhner H. Campath ‑ 1H‑induced complete remission of chronic lymphocytic leukemia despite p53 gene mutation and resistance to chemotherapy. N Engl J Med 2002; 347(6): 452 – 453.
36. Mossner E, Brunker P, Moser S et al. Increasing the efficacy of CD20 antibody therapy through the engineering of a new type II anti‑CD20 antibody with enhanced direct and immune effector cell ‑ mediated B ‑ cell cytotoxicity. Blood 2010; 115(22): 4393 – 4402. doi: 10.1182/ blood ‑ 2009 ‑ 06 ‑ 225979.
37. Ferrara C, Brunker P, Suter T et al. Modulation of therapeutic antibody effector functions by glycosylation engineering: influence of Golgi enzyme localization domain and co ‑ expression of heterologous beta1, 4 - N ‑ acetylglucosaminyltransferase III and Golgi alpha ‑ mannosidase II. Biotechnol Bioeng 2006; 93(5): 851 – 861.
38. Herter S, Herting F, Mundigl O et al. Preclinical activity of the type II CD20 antibody GA101 (obinutuzumab) compared with rituximab and ofatumumab in vitro and in xenograft models. Mol Cancer Ther 2013; 12(10): 2031 – 2042. doi: 10.1158/ 1535 ‑ 7163.MCT ‑ 12 ‑ 1182.
39. Dalle S, Reslan L, Besseyre de Horts T et al. Preclinical studies on the mechanism of action and the anti‑lymphoma activity of the novel anti‑CD20 antibody GA101. Mol Cancer Ther 2011; 10(1): 178 – 185. doi: 10.1158/ 1535 ‑ 7163.MCT ‑ 10 ‑ 0385.
40. Alduaij W, Ivanov A, Honeychurch J et al. Novel type II anti‑CD20 monoclonal antibody (GA101) evokes homotypic adhesion and actin‑dependent, lysosome ‑ mediated cell death in B ‑ cell malignancies. Blood 2011; 117(17): 4519 – 4529. doi: 10.1182/ blood ‑ 2010 ‑ 07 ‑ 296913.
41. Rafiq S, Butchar JP, Cheney C et al. Comparative assessment of clinically utilized CD20 - directed antibodies in chronic lymphocytic leukemia cells reveals divergent NK cell, monocyte, and macrophage properties. J Immunol 2013; 190(6): 2702 – 2711. doi: 10.4049/ jimmunol.1202588.
42. Niederfellner G, Lammens A, Mundigl O et al. Epitope characterization and crystal structure of GA101 provide insights into the molecular basis for type I/ II distinction of CD20 antibodies. Blood 2011; 118(2): 358 – 367. doi: 10.1182/ blood ‑ 2010 ‑ 09 ‑ 305847.
43. Kern DJ, James BR, Blackwell S et al. GA101 induces NK ‑ cell activation and antibody ‑ dependent cellular cytotoxicity more effectively than rituximab when complement is present. Leuk Lymphoma 2013; 54(11): 2500 – 2505. doi: 10.3109/ 10428194.2013.781169.
44. Cragg MS. CD20 antibodies: doing the time warp. Blood 2011; 118(2): 219 – 220. doi: 10.1182/ blood ‑ 2011 ‑ 04 ‑ 346700.
45. Cheadle EJ, Sidon L, Dovedi SJ et al. The induction of immunogenic cell death by type II anti‑CD20 monoclonal antibodies has mechanistic differences compared with type I rituximab. Br J Haematol 2013; 162(6): 842 – 845. doi: 10.1111/ bjh.12427.
46. Klein C, Lammens A, Schafer W et al. Response to: monoclonal antibodies targeting CD20. MAbs 2013; 5(3): 337 – 338. doi: 10.4161/ mabs.24108.
47. Cartron G, de Guibert S, Dilhuydy MS et al. Obinutuzumab (GA101) in relapsed/ refractory chronic lymphocytic leukemia: final data from the phase 1/ 2 GAUGUIN study. Blood 2014; 124(14): 2196 – 2202. doi: 10.1182/ blood ‑ 2014 ‑ 07 ‑ 586610.
48. Sehn LH, Assouline SE, Stewart DA et al. A phase 1 study of obinutuzumab induction followed by 2 years of maintenance in patients with relapsed CD20 - positive B ‑ cell malignancies. Blood 2012; 119(22): 5118 – 5125. doi: 10.1182/ blood ‑ 2012 ‑ 02 ‑ 408773.
49. Flynn JM, Kipps TJ, Boxer M et al. Obinutuzumab (GA101) 1000 mg vs 2000 mg in patients with chronic lymphocytic leukemia (CLL) results of the phase 2 GAGE (GAO4768g) trial. J Clin Oncol 2014; 32 (Suppl): abstr. 7083.
50. Brown JR, O‘Brien S, Kingsley CD et al. Obinutuzumab plus fludarabine/ cyclophosphamide or bendamustine in the initial therapy of CLL patients: the phase 1b GALTON trial. Blood 2015; 125(18): 2779 – 2785. doi: 10.1182/ blood ‑ 2014 ‑ 12 ‑ 613570.
51. Goede V, Fischer K, Engelke A et al. Obinutuzumab as frontline treatment of chronic lymphocytic leukemia: updated results of the CLL11 study. Leukemia 2015; 29(7): 1602 – 1604. doi: 10.1038/ leu.2015.14.
52. Byrd JC, Murphy T, Howard RS et al. Rituximab using a thrice weekly dosing schedule in B ‑ cell chronic lymphocytic leukemia and small lymphocytic lymphoma demonstrates clinical activity and acceptable toxicity. J Clin Oncol 2001; 19(8): 2153 – 2164.
53. Vogel WH. Infusion reactions: diagnosis, assessment, and management. Clin J Oncol Nurs 2010; 14(2): E10 – E21. doi: 10.1188/ 10.CJON.E10 ‑ E21.
54. Goede V, Klein C, Stilgenbauer S. Obinutuzumab (GA101) for the treatment of chronic lymphocytic leukemia and other B ‑ cell non‑hodgkin‘s lymphomas: a glycoengineered type II CD20 antibody. Oncol Res Treat 2015; 38(4): 185 – 192. doi: 10.1159/ 000381524.
55. Obinutuzumab (Gazyvaro) [homepage on the Internet]. Summary of product characteristics. 2014. Available from: http:/ / www.ema.europa.eu/ docs/ en_GB/ document_library/ EPAR_ – _Public_assessment_report/ human/ 002799/ WC500171596.pdf.
56. Ladyzynski P, Molik M, Foltynski P. A network meta‑analysis of progression free survival and overall survival in first‑line treatment of chronic lymphocytic leukemia. Cancer Treat Rev 2015; 41(2): 77 – 93. doi: 10.1016/ j.ctrv.2014.11.004.
57. Jak M, van Bochove GG, Reits EA et al. CD40 stimulation sensitizes CLL cells to lysosomal cell death induction by type II anti‑CD20 mAb GA101. Blood 2011; 118(19): 5178 – 5188. doi: 10.1182/blood ‑ 2011 ‑ 01 ‑ 331702.
Labels
Paediatric clinical oncology Surgery Clinical oncology
Article was published inClinical Oncology

2015 Issue Supplementum 3-
All articles in this issue
- Molekulární prognostické markery chronické lymfocytární leukemie a jejich klinický význam
- Význam minimální zbytkové nemoci u chronické lymfocytární leukemie
- Monoklonální protilátky v léčbě chronické lymfocytární leukemie v roce 2015
- Léčebné možnosti pro nemocné s chronickou lymfocytární leukemií a významnými přidruženými chorobami
- Léčba chronické lymfocytární leukemie s aberací TP53
- Malé molekuly v léčbě chronické lymfocytární leukemie v roce 2015 a v blízké budoucnosti
- Aktuality v podpůrné léčbě chronické lymfocytární leukemie
- Maligní lymfomy − minulost, současnost a budoucnost
- Difuzní velkobuněčný B lymfom – moderní způsoby diagnostiky a molekulárně cílené léčby
- Folikulární lymfom
- Lymfom z plášťových buněk – současný stav poznání a možnosti léčby
- Hodgkinův lymfom – vývoj léčebných přístupů a současné trendy
- Záchranná léčba a role transplantací u lymfomů
- Současné možnosti imunoterapie nádorových onemocnění
- Clinical Oncology
- Journal archive
- Current issue
- Online only
- About the journal
Most read in this issue- Difuzní velkobuněčný B lymfom – moderní způsoby diagnostiky a molekulárně cílené léčby
- Folikulární lymfom
- Lymfom z plášťových buněk – současný stav poznání a možnosti léčby
- Hodgkinův lymfom – vývoj léčebných přístupů a současné trendy
Login#ADS_BOTTOM_SCRIPTS#Forgotten passwordEnter the email address that you registered with. We will send you instructions on how to set a new password.
- Career

