-
Medical journals
- Career
Molekulární podstata Waldenströmovy makroglobulinemie
Authors: S. Ševčíková; L. Novák; L. Kubiczková; E. Dementyeva; L. Říhová; R. Hájek
Authors‘ workplace: Babákova myelomová skupina, Ústav patologické fyziologie, LF MU Brno
Published in: Klin Onkol 2012; 25(6): 413-420
Category: Reviews
Tato práce byla podpořena výzkumnými projekty: Ministerstva školství, mládeže a tělovýchovy MSM0021622434, G rantové agentury ČR GAP304/10/1395 a Interní grantové agentury Ministerstva zdravotnictví NT11154, NT12130 a NT13190.
Autoři deklarují, že v souvislosti s předmětem studie nemají žádné komerční zájmy.
Redakční rada potvrzuje, že rukopis práce splnil ICMJE kritéria pro publikace zasílané do bi omedicínských časopisů.
Obdrženo: 29. 8. 2012
Přijato: 7. 10. 2012Overview
Waldenströmova makroglobulinemie je raritní lymfoproliferativní onemocnění ze skupiny lymfomů vyskytující se s četností asi tří případů na milion osob. Podíl na všech krevních nádorových onemocněních je 1 až 2 %. Toto onemocnění je charakterizováno infiltrací kostní dřeně klonálními B lymfocyty a přítomností monoklonálního imunoglobulinu třídy IgM v séru. Waldenströmova makroglobulinemie stále zůstává nevyléčitelným onemocněním s mediánem přežití 5 let. Molekulární podstata onemocnění je neobjasněná, i když delece 6q, trizomie chromozomů 4 a 8, delece 13q a zvýšená exprese IL-6 se zdají být typické pro toto onemocnění. Nejvýznamnějšími změnami na úrovni mikroRNA se zdají být zvýšená exprese miR-155 a snížená exprese miR-9*. Souhrn současných znalostí o molekulární podstatě WM je předmětem této práce.
Klíčová slova:
Waldenströmova makroglobulinemie – IL-6 – SDF-1 – BLyS – PI3K/Akt – NF-κB – JAK/STATÚvod
V roce 1944 švédský profesor Jan Gosta Waldenström popsal případy dvou pacientů s krvácením z dutiny ústní a nosní, zvětšenými mízními uzlinami, sníženým počtem červených krvinek a krevních destiček, zvýšeným stupněm sedimentace červených krvinek, vysokou viskozitou séra a zvýšeným počtem lymfoidních buněk v kostní dřeni [1]. Dále si všiml, že pacienti nepociťují bolest v kostech a ani kardiograf neobsahuje žádný nález, který je charakteristický pro mnohočetný myelom. Vysokou viskozitu krve připsal abnormální hladině vysokomolekulárních sérových proteinů. Toto prvotní pozorování položilo základy výzkumu onemocnění, jež nese jeho jméno – Waldenströmova makroglobulinemie (WM).
WM je lymfoproliferativní onemocnění lymfoplazmatických buněk charakterizované zvýšenou expresí imunoglobulinu IgM [2]. Jedná se o raritní onemocnění, které svojí četností zaujímá 1–2 % krevních nádorových onemocnění. Tato nemoc se nejčastěji vyskytuje mezi 63. a 68. rokem života a její incidence s rostoucím věkem stoupá [3]. Zvyšující se podíl nových případů u starších osob lze interpretovat jako výsledek postupné poruchy imunitního systému.
Mezi klinické příznaky této nemoci patří chronická únava, krvácení z dutiny ústní a nosní, bolesti hlavy, kožní purpura a neuropatie. V současné době je WM stále nevyléčitelné onemocnění s mediánem přežití 5 let. Z tohoto důvodu se léčba zaměřuje hlavně na potlačení příznaků s minimálním poškozením vnitřních orgánů [2].
Doposud bylo vydáno mnoho publikací popisujících klinické výsledky léčby WM, stále přibývá aplikací molekulárně--biologických přístupů, které by mohly blíže objasnit biologickou podstatu a progresi nemoci, nicméně kompletní pochopení genetického základu a aktivity klíčových signálních drah u WM stále chybí. V tomto článku shrnujeme současné znalosti o molekulární podstatě onemocnění.
Genetické abnormality
Nízký proliferační index buněk WM byl historicky největším problémem při studiu genetické podstaty onemocnění. První nahlédnutí do genomu WM umožnily přístupy klasické cytogenetiky, které však byly často neúspěšné z důvodu nízké rozlišovací schopnosti a požadavku na dělící se buňky [4,5]. Teprve nástup nových technik umožňujících analýzu buněk v interfázi (I-FISH) nebo celogenomový přístup jako GEP, a-CGH nebo sekvenování dovolily provádět pokusy bez nutnosti dělení buněk. Srovnávací celogenomové přístupy umožňují kompletní testování na úrovni DNA, RNA a mikroRNA (miRNA). Mezi nalezené abnormality u WM patří jak cytogenetické změny, tak změny postihující expresi kódujících genů nebo nekódujících RNA, jako jsou mikroRNA.
Cytogenetické aberace
Delece dlouhého raménka chromozomu 6 byla pomocí metody FISH v různých studiích pozorována jako nejčastější strukturální aberace u WM. Pacienti s bezpříznakovou formou makroglobulinemie mající deleci 6q rychleji přecházejí do symptomatické formy nemoci [6]. V další práci bylo zjištěno, že tato delece není přítomna u MGUS typu IgM, zatímco se vyskytovala u 55 % případů WM. Přítomnost delece 6q tedy může odlišit WM od IgM MGUS [7].
Trizomie dlouhých ramének chromozomů 4 a 8 se zdají být specifickými chomozomálními aberacemi WM. Byly identifikovány u 12 %, respektive 10 % pacientů s WM, zatímco u ostatních příbuzných lymfoproliferativních onemocnění tyto aberace pozorovány nebyly. Trizomie chromozomu 4 byla identifikována nezávisle na stavu 6q chromozomu. Bohužel zatím na 4q a 8q nebyly nalezeny žádné potenciálně důležité geny pro patofyziologii WM [8].
Mezi další nalezené abnormality patří delece 13q detekované u osob s pokročilou chorobou a výskyt trizomie chromozomu 5 v méně než 10 % případů [7]. Ostatní aberace typické pro příbuzná lymfoproliferativní onemocnění, jako např. ztráta RB1 nebo přesmyk lokusu pro těžký řetězec imunoglobulinu IgM, byly detekovány vzácně v 9–16 %, resp. 3–14 % [7,9].
Deregulace genů a proteinů u WM
Komplexní vyšetření základních molekulárních změn u WM bylo umožněno zavedením analýzy genové exprese. Zatím bylo publikováno málo prací, které by se zabývaly změnami genové exprese, které by odlišily WM od ostatních onemocnění. V jedné z těchto prací bylo popsáno celkem 73 genů, jejichž exprese se lišila ve srovnání se zdravými kontrolami, ale i CLL a MM. Z těchto 73 genů mělo 48 genů zvýšenou a 25 sníženou expresi. Výrazně nejvyšší expresi měl gen pro cytokin IL-6 [10]. Klonální buňky B lymfocytů u pacientů s WM spontánně diferencují in vitro na plazmatické buňky právě pomocí IL-6. Tento objev vede k přesvědčení, že hladina IL-6 může být markerem odrážejícím postižení a odpověď na léčbu WM [11]. Nicméně vzhledem k posttranslačním úpravám neodpovídá profil genové exprese vždy změnám na úrovni hladin proteinů [12].
Nově bylo metodou celogenomového sekvenování vzorků 30 pacientů s WM zjištěno, že až 26 případů mělo mutaci v genu MYD88, která vede k záměně leucinu za prolin v kodonu 265 (L265P). Mutace v MYD88 genu by mohla být potenciálním markerem odlišujícím WM od jiných lymfoproliferativních onemocnění [13,14].
Pomocí proteomické analýzy bylo nalezeno celkem 185 polypeptidů, které mají zvýšenou (111/185) nebo sníženou (74/185) hladinu. Mezi těmito deregulovanými proteiny se nacházely polypeptidy zapojené do regulace buněčného cyklu (CDK2), histon deacetylázy (HDAC3) a modulátory apoptózy [15].
Z různých genů lokalizovaných na 6q21 je BLIMP-1 považován za důležitý ve vývoji WM. Je to nádorový supresor, hlavní regulátor proliferace a diferenciace B lymfocytů. Usnadňuje přechod ze zralého B lymfocytu do buňky plazmatické. Částečná nebo úplná ztráta tohoto genu vede k predispozici k lymfoproliferativním onemocněním, jako například WM [16–18].
Mezi další geny umístěné na 6q patří TNFAIP3, který kóduje A20, což je protein se strukturou zinkového prstu, který působí jako negativní regulátor signální dráhy NF-κB [8]. Svojí činností negativně reguluje některé proteiny, jako např. TRAF6 nebo IKKγ, které aktivují IκB kinázu [19,20]. Bialelické delece nebo inaktivující mutace tohoto negativního regulátoru mají za následek aktivaci NF-κB [8].
Dalším genem ovlivňujícím NF-κB signální dráhu je TRAF3. Ten kóduje ubiquitin ligázu, která hraje důležitou roli v negativní regulaci nekanonické dráhy NF-κB [21]. Ztráta TRAF3 vede k akumulaci serin/treonin proteinkinázy NIK, což aktivuje nekanonickou dráhu NF-κB [22].
MikroRNA s pozměněnou expresí u WM
MikroRNA (miRNA) jsou krátké nekódující řetězce RNA dlouhé 21–25 nukleotidů, které se podílejí jak na regulaci proliferace, diferenciace a apoptózy [23], tak na iniciaci a progresi nádorů [24]. U pacientů s WM byla zjištěna deregulovaná exprese některých miRNA, a to především zvýšená exprese miR-363*, miR-206, miR-494, miR-155, miR-184, miR-542-3p a snížená exprese miR-9* [25]. Významnou roli hraje miR-155. Její onkogenní funkce přispívá ke zvýšení exprese inhibitorů cyklin-dependentních kináz (p18, p19, p21, p27), snížení exprese cyklin-dependentních kináz CDK-2, CDK-4, CDK-6 a cyklinů D1, D2, D3 a E a nakonec zvýšení exprese p53 a snížení exprese jeho negativního regulátoru Mdm2 [26]. Snížením hladiny miR-155 byla u WM redukována adheze, migrace i proliferace nádorových buněk. Dále bylo zjištěno, že zvýšená exprese miR-206 a snížená exprese miR-9* ovlivňují transkripci genů zodpovědných za modifikaci histonů. Obnovení hladiny miR-9* pomocí transfekce prekurzorů miRNA do buněk WM vedlo k indukci cytotoxicity u buněk WM. Tato zjištění by se dala v budoucnu potenciálně využít pro výrobu syntetických miRNA jako nové varianty léčby pacientů s WM [25,27].
Signální dráhy dysregulované u WM
Interakce buněk WM s kostní dření vede k aktivaci signálních drah, jako jsou PI3K/Akt, NF-κB a JAK/STAT. Tyto dráhy jsou rozhodující pro buněčnou proliferaci, buněčný cyklus, rezistenci na léky, stejně tak jako pro šíření a migraci buněk [28–31].
PI3K/Akt signální dráha
U pacientů s WM byla pozorována zvýšená hladina proteinů PI3K/Akt signální dráhy (obr. 1) [15]. Mezi nejvýznamnější substráty serin/treonin kinázy Akt patří kináza mTOR. Jedním z mechanizmů, kterým může Akt přispívat k rozvoji nádorových buněk, je vliv na progresi buněčného cyklu ve spojení s jeho možnou antiapoptotickou aktivitou [32]. Buněčnou progresi řídí zvýšením exprese mRNA, které kódují pozitivní regulátory buněčného cyklu, jako jsou např. cyklin D1 a c-Myc, nebo naopak snížením exprese negativních regulátorů, jako jsou např. inhibitory cyklin-dependentních kináz [33].
Image 1. Pl3K/Akt signální dráha. Aktivace této dráhy je zahájena na cytoplazmatické membráně, kde PI3K fosforyluje PIP2 na PIP3. Ten následně naváže kinázu Akt k membráně, kde dochází k její fosforylaci pomocí PDK1. Po těchto dvou fosforylacích Akt zaujme aktivní konformaci a pokračuje ve fosforylování proteinů, které jsou zapojené v různých buněčných procesech, jako jsou stimulace proliferace nebo inhibice apoptózy. 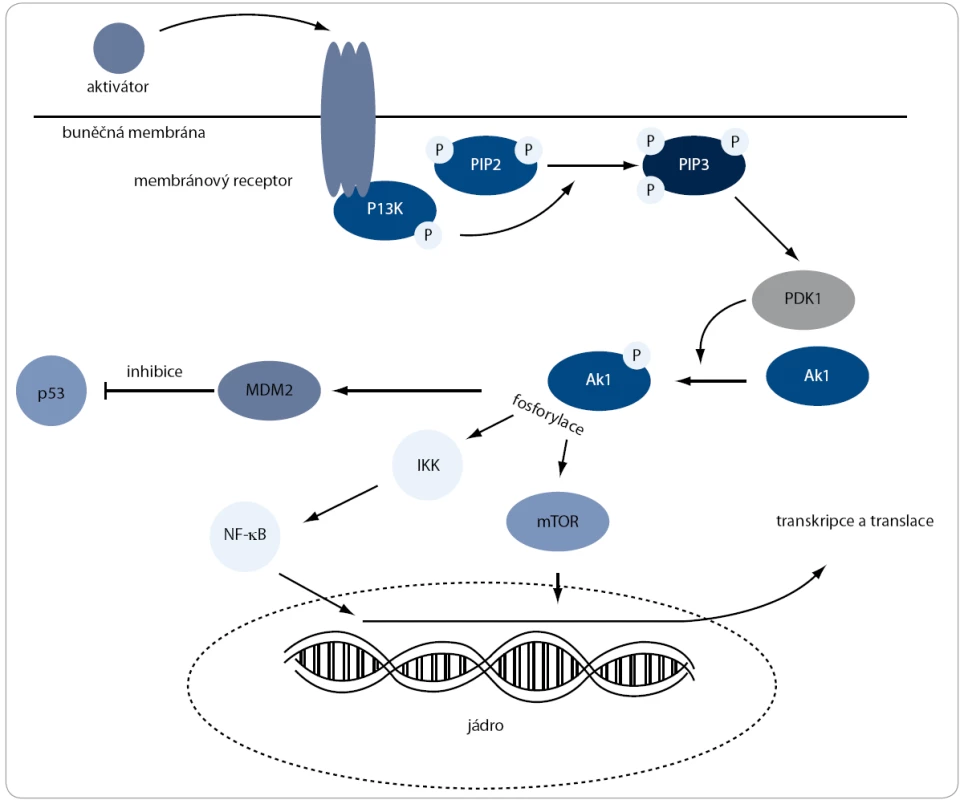
Kináza Akt mimo jiné fosforyluje také Mdm2, což je hlavní inhibitor transkripčního faktoru p53 [34]. Protein p53 transkripčně aktivuje expresi p21, který inhibuje cyklin-dependentní kinázy [35]. To má za následek sníženou fosforylaci pRb (retinoblastoma protein), který inhibuje transkripční faktor E2F. Tím je znemožněna exprese genů, které jsou nutné pro vstup do S-fáze buněčného cyklu [36]. Kromě zastavení buněčného cyklu může p53 také indukovat tvorbu proteinů, které dokážou uvolnit apoptické signály z mitochondrií do cytoplazmy. Poté následuje kaskáda dějů vedoucích k buněčné smrti [37]. V tomto případě PI3K/Akt signální dráha inhibuje aktivitu p53 transkripčního faktoru, což má za následek umlčení apoptických signálů [38].
NF-κB signální dráha
Signální dráha NF-κB (obr. 2) zahrnuje skupinu transkripčních faktorů, které regulují transkripci stovek genů ovlivňujících záněty, vrozenou imunitu, růst buněk a apoptózu [39]. Přestože data o jeho působení u WM jsou omezená, existují důkazy, že NF-κB signální dráha je v buňkách WM aktivována [40,41].
Image 2. Kanonická a nekanonická signální dráha NF-κB. V regulaci NF-κB komplexů jsou zahrnuty dvě signální dráhy (kanonická a nekanonická), které jsou zodpovědné za aktivaci p50 a p52 z jejich inaktivních prekurzorů p105 a p100. Ústředním inhibitorem u obou drah je IKKα. Její fosforylace vede k degradaci inhibitoru a tím i aktivaci komplexů transkripčních faktorů, které mohou následně putovat do jádra a řídit transkripci některých genů. 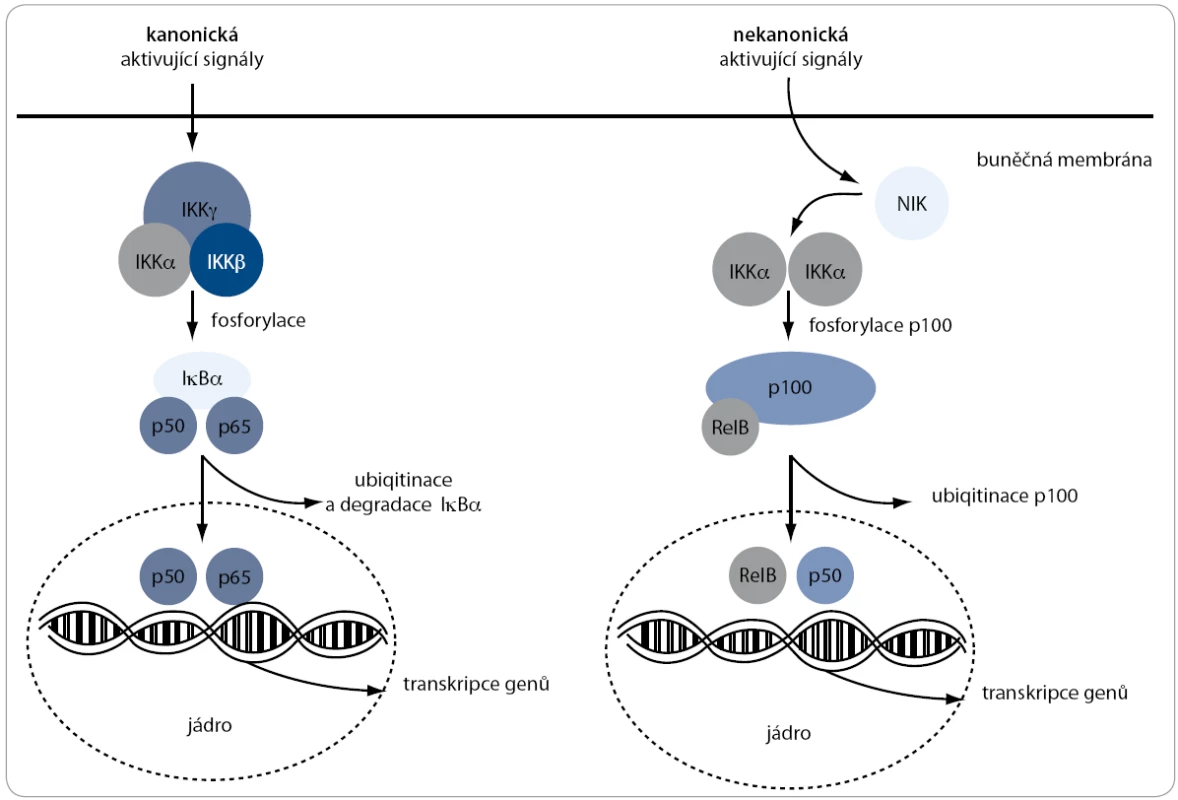
Důležitým aktivátorem této dráhy je proteinkináza Akt, která nepřímo aktivuje NF-κB pomocí fosforylace IκB kinázy alfa (IKKα), čímž způsobí degradaci inhibitoru IκBα, který je ubiquitován a degradován protazomem [42,43].
Transkripčními faktory dráhy NF-κB jsou homo a heterodimery z rodiny Rel proteinů: NF-κB1 (p50), NF-κB2 (p52), RelA (p65), RelB a c-Rel. V regulaci NF-κB komplexů jsou zahrnuty dvě signální dráhy (kanonická a nekanonická), které jsou zodpovědné za aktivaci p50 a p52 z jejich inaktivních prekurzorů p105 a p100 [44,45]. Aktivace těchto drah má za následek translokaci p50/RelA a p52/RelB komplexů do jádra a následnou transkripční aktivaci cílových genů, které mimo jiné zvyšují přežití buňky, inhibují apoptózu a omezují činnost proteinů z proapoptické rodiny BCL-2 [46–48].
JAK/STAT signální dráha
Hatjiharissi et al (2007) ve své studii zjistili zvýšené množství proteinů JAK a STAT u WM ve srovnání se zdravými kontrolami [15]. Svojí aktivitou tato signální dráha navozuje expresi genů podílejících se na potlačení apoptózy, progresi buněčného cyklu a rezistenci na chemoterapeutické látky [49,50]. Některé studie nasvědčují tomu, že stimulace této dráhy může taktéž hrát důležitou roli ve zvýšené produkci IgM u WM [51].
JAK/STAT signální dráha (obr. 3) může být aktivována cytokiny produkovanými jak samotnými nádorovými buňkami, tak i zdravými buňkami nádorového mikroprostředí [52]. Mechanizmus aktivace této dráhy je asi nejlépe popsaný pomocí cytokinu IL-6 [53]. Po navázání IL-6 na buněčný receptor gp130 je pomocí JAK fosforylace aktivován transkripční faktor STAT, který v jádře zprostředkovává expresi mnoha genů. Trvale fosforylovaný STAT mimo jiné interaguje s cytosolovými proteiny, což aktivuje některé další signální dráhy, které jsou aktivní u krevních nádorových onemocnění, jako jsou např. Pl3K/Akt či MAPK/ERK [54–56].
Image 3. JAK/STAT3 signální dráha. Po navázání aktivátoru na buněčný receptor gp130 je aktivována JAK, která následně fosforyluje transkripční faktor STAT. Ten je translokován do jádra, kde zprostředkovává expresi genů, které inhibují apoptózu, podporují buněčný cyklus a zvyšují rezistenci na chemoterapeutické látky. 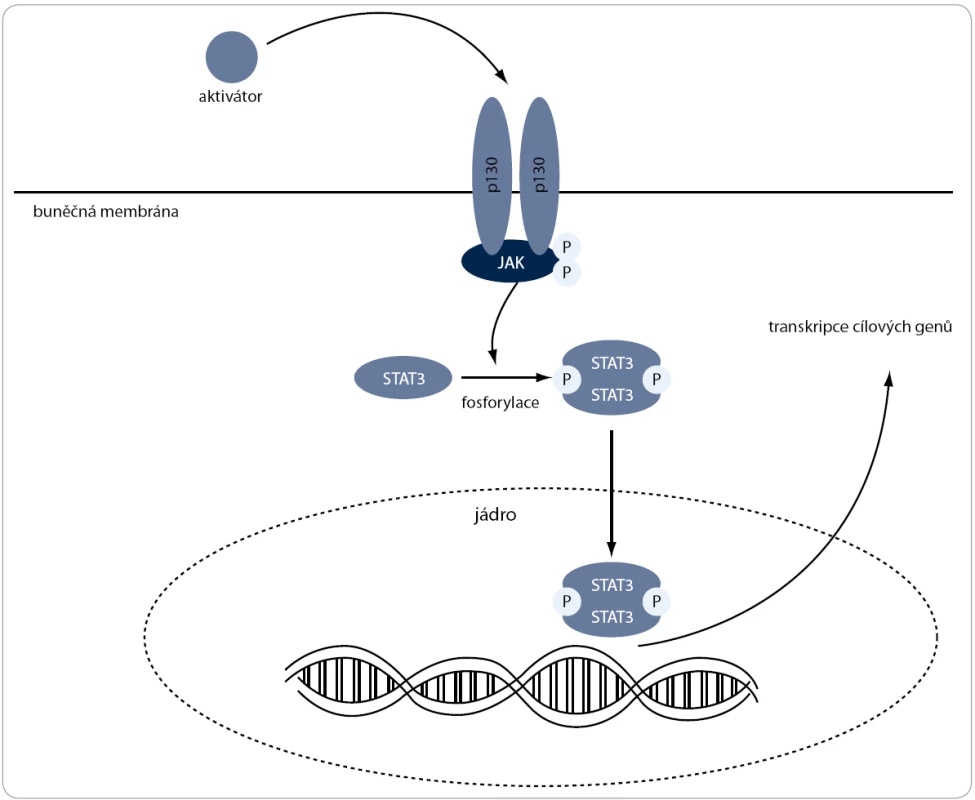
Pouze intenzivní výzkum v této oblasti může v budoucnosti potvrdit a upřesnit vliv JAK/STAT signální dráhy na patogenezi WM, a to zejména efekt jejich cytokinů na zvýšenou sekreci IgM [51].
Mikroprostředí kostní dřeně u WM
Adhezivní molekuly
Mezi hlavní skupiny adhezivních molekul jsou řazeny adheziny patřící do rodiny imunoglobulinů, integriny, kadheriny a selektiny [57–59]. Ukázalo se, že integriny jako např. VLA-4 a LFA-1 mají u WM zvýšenou expresi. Adheze buněk WM k fibronektinu a dále k endoteliálním a stromálním buňkám je regulována právě integrinem VLA-4. Ten mimo jiné interaguje s CXCR4, což naznačuje spojitost mezi adhezí a migrací. Navázání protilátky na VLA-4 vedlo k inhibici adheze k fibronektinu, stromálním a endoteliálním buňkám in vitro [60]. Potenciální klinické využití interakcí CXCR4 a VLA-4 u WM ještě nebylo dostatečně prozkoumáno [61].
Cytokiny
U WM bylo popsáno celkem 13 chemokinových receptorů CXC a CC. Nejvyšší exprese byla stanovena u CXCR4, jehož inhibice vedla ke značnému snížení migrace a adheze buněk WM. Ligand tohoto receptoru SDF-1 (označovaný i jako CXCL12) má vyšší expresi jak v kostní dřeni, tak v periferní krvi pacientů WM ve srovnání se zdravými kontrolami. SDF-1 je primárně produkován stromálními buňkami. Interakce SDF-1 s CXCR4 na povrchu buněk WM vede k migraci a adhezi těchto buněk do mikroprostředí kostní dřeně [60,62].
Makrofágový zánětlivý protein (MIP-1α) je členem CC chemokinové rodiny. Je produkován všemi hematopoetickými a stromálními buňkami. MIP-1α je jedním z nejsilnějších aktivátorů osteoklastů a podílí se na patogenezi mnohočetného myelomu (MM) [63]. Právě osteoklasty jsou zodpovědné za tvorbu lytických lézí u MM. Naopak u WM byly lytické léze pozorovány jen vzácně, i přesto, že je hladina MIP-1α u nemocných zvýšená [64,65]. Ojediněle byly pozorovány mikroskopické léze, které byly způsobeny abnormální remodelací kosti v blízkosti nádorových buněk WM [66]. Bylo prokázáno, že u MM je navíc zvýšená produkce DKK-1, což je protein produkovaný nádorovými plazmatickými buňkami, který potlačuje aktivitu osteoblastů [67]. Tato zjištění podporují představu, že nadměrná resorpce kosti je u WM přítomná ve stejném rozsahu jako u MM, ale díky normální tvorbě kostní tkáně nedochází k tvorbě lytických lézí [66].
Další oblast zájmu u WM zaujímá stimulátor B lymfocytů (BLyS), také známý jako B buněčný aktivující faktor z rodiny TNF [68]. Tento cytokin je exprimován na povrchu monocytů a je rozhodující pro udržování normálního vývoje B lymfocytů a homeostázy [69,70]. Elsawa et al (2006) zjistili, že hladina BLyS v séru je značně vyšší u pacientů s WM než u zdravých kontrol. Ať už samotný, nebo v kombinaci s některými cytokiny, svojí aktivitou podporuje sekreci IgM u nádorových buněk WM. Jeho inhibice má terapeutický potenciál a další výzkumy mohou potvrdit její léčebnou účinnost u pacientů s WM [71].
Enzymy
Src tyrozin kináza se účastní různých buněčných pochodů, jako proliferace, adheze, migrace, invazivita a usídlení buněk. Src je aktivována receptory růstových faktorů, cytokinovými receptory a fokální adhezivní kinázou (FAK) [72]. Src interaguje se sítí intracelulárních drah, včetně PI3K/Akt a JAK/STAT signalizace [73]. Ngo et al (2009) dokázali, že Src tyrozin kináza má u WM zvýšenou expresi, stejně jako je tomu u velkého počtu lidských nádorů. Navíc tato studie naznačuje, že Src tyrozin kináza řídí adhezi a migraci buněk WM [60].
Abnormální exprese hyaluronan syntázy (HAS) je uváděna jako možný patogenetický faktor u WM [74]. Hyaluronan se podílí na migraci a metastazování nádorových buněk. U 3 HAS izoenzymů detekovaných u člověka Adamia et al (2003) zjistili, že nadprodukce HAS1 a HAS3 hyaluronanového matrixu okolo WM buněk zamezuje jejich eliminaci imunitním systémem, a tím podporuje šíření onemocnění. Další práce dokládá, že jednonukleotidový polymorfizmus v genu HAS1 zvyšuje riziko vývoje WM [75].
Původ a imunofenotyp nádorových buněk WM
Imunofenotypový profil v kombinaci s přítomností somatické hypermutace genu pro těžký řetězec imunoglobulinu IgM, ale bez intraklonální diverzity nejvíce napovídá tomu, že nádorové buňky WM pocházejí z buněk posledního stadia diferenciace zralého B lymfocytu do plazmatické buňky [76]. K tomuto názoru se přiklánějí i Walsh et al (2005), kteří ve své práci popsali, že klonální populace nádorových buněk WM je odvozena z B lymfocytů, které jsou zachyceny v germinálním centru těsně po somatické hypermutaci, ale ještě před terminální diferenciací do plazmatické buňky [77]. Klonální populace, dle stanovení povrchové a cytoplazmatické exprese lehkých Ig řetězců, je tvořena nejčastěji směsí zralých B lymfocytů diferencujících do lymfoplazmocytoidních buněk a méně zralých plazmocytů, přičemž zastoupení jednotlivých subpopulací se mezi jednotlivými pacienty liší. Klonální B lymfocyty, které u WM převažují, jsou charakteristické expresí povrchového imunoglobulinu IgM a dále exprimují typické pan-B znaky: CD19, CD20, CD22 a CD79a, u kterých může docházet ke snížení intenzity exprese. Exprese znaku CD27 i ostatních dále zmiňovaných markerů je v rámci jednotlivých pacientů heterogenní. Na rozdíl od jiných B lymfoproliferací WM B lymfocyty obvykle neexprimují CD5, CD10, CD11c a CD23 [78]. Dalšími často se vyskytujícími znaky jsou CD25, CD27, FMC7 a CD52, nicméně exprese znaků CD103 a CD138 je vzácná [79]. Pro lymfoplazmocytoidní buňky je charakteristická silná exprese CD38 a častá pozitivita na CD20, zatímco CD138 chybí. Plazmocytární komponenta exprimuje znak CD138 s nižší intenzitou než normální PC, ale zachovává si expresi CD19 i CD27 a chybí CD56. Přestože se tedy jedná o klonální buňky, jejich fenotypový profil je obdobný jako u normálních PC.
Izolace jednotlivých subpopulací pomocí fluorescencí aktivovaného buněčného třídění (FACS) a jejich další studium může napomoci výzkumu molekulární podstaty onemocnění.
Závěr
Dnes je Waldenströmova makroglobulinemie definována pomocí WHO klasifikace jako lymfoplazmocytární lymfom infiltrující kostní dřeň, který produkuje monoklonální gamaglobulin typu IgM. Ke vzniku nádorových buněk zřejmě dochází během diferenciace posledního stadia B lymfocytu na plazmatickou buňku. Napovídá tomu jak imunofenotyp, tak i přítomnost somatické hypermutace genu pro těžký řetězec, které chybí intraklonální diverzita. Výzkum molekulární podstaty onemocnění v posledním desetiletí pomohl objasnit některé změny nádorových buněk, přesto doposud nebyla nalezena změna, která by jednoznačně definovala tuto chorobu. Nejčastější chromozomovou aberací je delece 6q. Právě v této oblasti leží nádorový supresor BLIMP-1, který hraje důležitou roli při přechodu zralého B lymfocytu do plazmatické buňky. Dalšími důležitými geny v patofyziologii WM jsou TRAF3 a TNFAIP3. Delece těchto dvou genů způsobuje aktivaci NF-κB signální dráhy, což má za následek inhibici apoptózy u nádorových buněk WM. Nejvýznamnějšími změnami na úrovni miRNA se zdají být zvýšená exprese miR-155 a snížená exprese miR-9*. V dnešní době je největší výzvou najít nové strategie pro léčbu WM a právě signální dráhy zahrnující MYD88, NF-κB a Akt-mTOR se zdají být slibnou cestou pro nalezení nových terapeutických cílů. Faktem zůstává, že další in vitro a in vivo pokusy jsou nutné k plnému porozumění patogeneze tohoto značně heterogenního onemocnění.
Mgr. Sabina Ševčíková, Ph.D.
Babákova myelomová skupina
Ústav patologické fyziologie
LF MU Brno
Kamenice 5, A3
625 00 Brno
e-mail: sevcik@med.muni.cz
Obdrženo: 29. 8. 2012
Přijato: 7. 10. 2012
Sources
1. Waldenström JG. Incipient myelomatosis or ‘essential‘ hyperglobulinemia with fibrinogenopenia: a new syndrome? Acta Med Scand 1944; 117 : 216–222.
2. Adam Z, Šmardová J, Ščudla V. Waldenströmova makroglobulinemie: klinické projevy a diferenciální diagnostika a prognóza nemoci. Vnitř Lék 2007; 53(12): 1325–1337.
3. Groves FD, Travis LB, Devesa SS et al. Waldenström’s macroglobulinemia: incidence patterns in the United States, 1988–1994. Cancer 1998; 82(6): 1078–1081.
4. Schop RF, Kuehl WM, Van Wier SA et al. Waldenström macroglobulinemia neoplastic cells lack immunoglobulin heavy chain locus translocations but have frequent 6q deletions. Blood 2002; 100(8): 2996–3001.
5. Mansoor A, Medeiros LJ, Weber DM et al. Cytogenetic findings in lymphoplasmacytic lymphoma/Waldenström macroglobulinemia. Chromosomal abnormalities are associated with the polymorphous subtype and an aggressive clinical course. Am J Clin Pathol 2001; 116(4): 543–549.
6. Dimopoulos M, Gika D, Zervas K et al. The international staging system for multiple myeloma is applicable in symptomatic Waldenström’s macroglobulinemia. Leuk Lymphoma 2004; 45 : 1809–1813.
7. Schop RF, Jalal SM, Van Wier SA et al. Deletions of 17p13.1 and 13q14 are uncommon in Waldenström macroglobulinemia clonal cells and mostly seen at the time of disease progression. Cancer Genet Cytogenet 2002; 132(1): 55–60.
8. Braggio E, Keats JJ, Leleu X et al. High-resolution genomic analysis in Waldenström‘s macroglobulinemia identifies disease-specific and common abnormalities with marginal zone lymphomas. Clin Lymphoma Myeloma 2009; 9(1): 39–42.
9. Chang H, Samiee S, Li D et al. Analysis of IgH translocations, chromosome 13q14 and 17p13.1(p53) deletions by fluorescence in situ hybridization in Waldenström’s macroglobulinemia: a single center study of 22 cases. Leukemia 2004; 18(6): 1160–1162.
10. Chng WJ, Schop RF, Price-Troska T et al. Gene-expression profiling of Waldenstrom macroglobulinemia reveals a phenotype more similar to chronic lymphocytic leukemia than multiple myeloma. Blood 2006; 108(8): 2755–2763.
11. Hatzimichael EC, Christou L, Bai M et al. Serum levels of IL-6 and its soluble receptor (sIL-6R) in Waldenström’s macroglobulinemia. Eur J Haematol 2001; 66(1): 1–6.
12. Chen G, Gharib TG, Huang CC et al. Discordant protein and mRNA expression in lung adenocarcinomas. Mol Cell Proteomics 2002; 1(4): 304–313.
13. Hunter Z, Xu L, Zhou Y et al. Whole-Genome Sequencing Results From 30 Patients with Waldenström’s Macroglobulinemia. Blood 2011; 118: Abstract 434.
14. Xu L, Sohani AR, Arcaini L et al. A Somatic Variant in MYD88 (L265P) Revealed by Whole Genome Sequencing Differentiates Lymphoplasmacytic Lymphoma From Marginal Zone Lymphomas. Blood 2011; 118: Abstract 261.
15. Hatjiharissi E, Ngo H, Leontovich AA et al. Proteomic analysis of waldenström macroglobulinemia. Cancer Res 2007; 67(8): 3777–3784.
16. Turner CA Jr, Mack DH, Davis MM. Blimp-1, a novel zinc finger-containing protein that can drive the maturation of B lymphocytes into immunoglobulin-secreting cells. Cell 1994; 77(2): 297–306.
17. Schebesta M, Heavey B, Busslinger M. Transcriptional control of B-cell development. Curr Opin Immunol 2002; 14(2): 216–223.
18. Calame KL. Plasma cells: finding new light at the end of B cell development. Nat Immunol 2001; 2(12): 1103–1108.
19. Boone DL, Turer EE, Lee EG et al. The ubiquitin-modifying enzyme A20 is required for termination of Toll-like receptor responses. Nat Immunol 2004; 5(10): 1052–1060.
20. Wang YY, Li L, Han KJ et al. A20 is a potent inhibitor of TLR3 - and Sendai virus-induced activation of NF-kappaB and ISRE and IFN-beta promoter. FEBS Lett 2004; 576(1–2): 86–90.
21. Hauer J, Püschner S, Ramakrishnan P et al. TNF receptor (TNFR)-associated factor (TRAF) 3 serves as an inhibitor of TRAF2/5-mediated activation of the noncanonical NF-kappaB pathway by TRAF-binding TNFRs. Proc Natl Acad Sci U S A 2005; 102(8): 2874–2879.
22. He JQ, Zarnegar B, Oganesyan G et al. Rescue of TRAF3-null mice by p100 NF-kappa B deficiency. J Exp Med 2006; 203(11): 2413–2418.
23. Esquela-Kerscher A, Slack FJ. Oncomirs-microRNAs with a role in cancer. Nat Rev Cancer 2006; 6(4): 259–269.
24. Hunter MP, Ismail N, Zhang X et al. Detection of microRNA expression in human peripheral blood microvesicles. PLoS One 2008; 3(11): e3694.
25. Roccaro AM, Sacco A, Chen C et al. MicroRNA expression in the biology, prognosis and therapy of Waldenström Macroglobulinemia. Blood 2009; 113(18): 4391–4402.
26. Tam W, Dahlberg JE. miR-155/BIC as an oncogenic microRNA. Genes Chromosomes Cancer 2006; 45(2): 211–212.
27. Roccaro AM, Sacco A, Jia X et al. microRNA-dependent modulation of histone acetylation in Waldenström macroglobulinemia. Blood 2010; 116(9): 1506–1514.
28. Damiano JS, Dalton WS. Integrin-mediated drug resistance in multiple myeloma. Leuk Lymphoma 2000; 38(1–2): 71–81.
29. Pagnucco G, Cardinale G, Gervasi F. Targeting multiple myeloma cells and their bone marrow microenvironment. Ann N Y Acad Sci 2004; 1028 : 390–399.
30. Hideshima T, Chauhan D, Richardson P et al. NF-kappa B as a therapeutic target in multiple myeloma. J Biol Chem 2002; 277(19): 16639–16647.
31. Anderson KC. Novel biologically based therapies for myeloma. Cancer J 2001; 7 (Suppl 1): S19–S23.
32. Hay N, Sonenberg N. Upstream and downstream of mTOR. Genes Dev 2004; 18(16): 1926–1945.
33. Gera JF, Mellinghoff IK, Shi Y et al. AKT activity determines sensitivity to mammalian target of rapamycin (mTOR) inhibitors by regulating cyclin D1 and c-myc expression. J Biol Chem 2004; 279(4): 2737–2746.
34. Momand J, Zambetti GP, Olson DC et al. The mdm-2 oncogene product forms a complex with the p53 protein and inhibits p53-mediated transactivation. Cell 1992; 69(7): 1237–1245.
35. El-Deiry WS, Harper JW, O’Connor PM et al. WAF1/CIP1 is induced in p53-mediated G1 arrest and apoptosis. Cancer Rese 1994; 54(5): 1169–1174.
36. Chellappan SP, Hiebert S, Mudryj M et al. The E2F transcription factor is a cellular target for the RB protein. Cell 1991; 65(6): 1053–1061.
37. Villunger A, Michalak EM, Coultas L et al. p53 - and drug-induced apoptotic responses mediated by BH3-only proteins puma and noxa. Science 2003; 302(5647): 1036–1038.
38. Ogawara Y, Kishishita S, Obata T et al. Akt enhances Mdm2-mediated ubiquitination and degradation of p53. J Biol Chem 2002; 277(24): 21843–21850.
39. Hayden MS, Ghosh S. Signaling to NF-κB. Genes Dev 2004; 18(18): 2195–2224.
40. Leitch D, Barrans SL, Jack AS et al. Dysregulation of apoptosis in Waldenström’s macroglobulinemia does not involve nuclear factor kappa B activation. Semin Oncol 2003; 30(2): 161–164.
41. Merzianu M, Jiang L, Lin P et al. Nuclear BCL-10 expression is common in lymphoplasmacytic lymphoma/Waldenström macroglobulinemia and does not correlate with p65 NF-kappaB activation. Mod Pathol 2006; 19(7): 891–898.
42. Mitsiades N, Mitsiades CS, Poulaki V et al. Biologic sequelae of nuclear factor-kappaB blockade in multiple myeloma: therapeutic applications. Blood 2002; 99(11): 4079–4086.
43. Hideshima T, Nakamura N, Chauhan D et al. Biologic sequelae of Interleukin-6 induced PI3-K/Akt signaling in multiple myeloma. Oncogene 2001; 20(42): 5991–6000.
44. Ghosh S, Karin M. Missing pieces in the NF-κB puzzle. Cell 2002; 109 (Suppl): S81–S96.
45. Senfteleben U, Cao Y, Xiao G et al. Activation by IKKalpha of a second, evolutionary conserved, NF-kappa B signaling pathway. Science 2001; 293(5534): 1495–1499.
46. Karin M, Cao Y, Greten FR et al. NF-kappa B in cancer: from innocent bystander to major culprit. Nat Rev Cancer 2002; 2(4): 301–310.
47. Bassères DS, Baldwin AS. Nuclear factor-kappaB and inhibitor of kappaB kinase pathways in oncogenic initiation and progression. Oncogene 2006; 25(51): 6817–6830.
48. Courtois G, Gilmore TD. Mutations in the NF-kappaB signaling pathway: implications for human disease. Oncogene 2006; 25(51): 6831–6843.
49. Catlett-Falcone R, Landowski TH, Oshiro MM et al. Constitutive activation of Stat3 signaling confers resistance to apoptosis in human U266 myeloma cells. Immunity 1999; 10(1): 105–115.
50. Epling-Burnette PK, Liu JH, Catlett-Falcone R et al. Inhibition of STAT3 signaling leads to apoptosis of leukemic large granular lymphocytes and decreased Mcl-1 expression. J Clin Invest 2001; 107(3): 351–362.
51. Hodge LS, Ansell SM. Jak/Stat pathway in Waldenström’s macroglobulinemia. Clin Lymphoma Myeloma Leuk 2011; 11(1): 112–114.
52. Yeh HH, Lai WW, Chen HH et al. Autocrine IL-6-induced Stat3 activation contributes to the pathogenesis of lung adenocarcinoma and malignant pleural effusion. Oncogene 2006; 25(31): 4300–4309.
53. Azevedo A, Cunha V, Teixeira AL et al. IL-6/IL-6R as a potential key signaling pathway in prostate cancer development. World J Clin Oncol 2011; 2(12): 384–396.
54. Harir N, Pecquet C, Kerenyi M et al. Constitutive activation of Stat5 promotes its cytoplasmic localization and association with PI3-kinase in myeloid leukemias. Blood 2007; 109(4): 1678–1686.
55. Kotecha N, Flores NJ, Irish JM et al. Single-cell profiling identifies aberrant STAT5 activation in myeloid malignancies with specific clinical and biologic correlates. Cancer Cell 2008; 14(4): 335–343.
56. Tawara K, Oxford JT, Jorcyk CL. Clinical significance of interleukin (IL)-6 in cancer metastasis to bone: potential of anti-IL-6 therapies. Cancer Manag Res 2011; 3 : 177–189.
57. Poulain S, Ertault M, Leleu X et al. SDF1/CXCL12 (-801GA) polymorphism is a prognostic factor after treatment initiation in Waldenström macroglobulinemia. Leuk Res 2009; 33(9): 1204–1207.
58. Petit I, Goichberg P, Spiegel A et al. Atypical PKC-zeta regulates SDF-1-mediated migration and development of human CD34+ progenitor cells. J Clin Invest 2005; 115(1): 168–176.
59. Zhang XF, Wang JF, Matczak E et al. Janus kinase 2 is involved in stromal cell-derived factor-1alpha-induced tyrosine phosphorylation of focal adhesion proteins and migration of hematopoietic progenitor cells. Blood 2001; 97(11): 3342–3348.
60. Ngo HT, Azab AK, Farag M et al. Src tyrosine kinase regulates adhesion and chemotaxis in Waldenström macroglobulinemia. Clin Cancer Res 2009; 15(19): 6035–6041.
61. Ghobrial IM, Maiso P, Azab A et al. The bone marrow microenvironment in Waldenstrom macroglobulinemia. Ther Adv Hematol 2011; 2(4): 267–272.
62. Ngo HT, Leleu X, Lee J et al. SDF-1/CXCR4 and VLA-4 interaction regulates homing in Waldenström macroglobulinemia. Blood 2008; 112(1): 150–158.
63. Oyajobi BO, Franchin G, Williams PJ et al. Dual effects of macrophage inflammatory protein-1alpha on osteolysis and tumor burden in the murine 5TGM1 model of myeloma bone disease. Blood 2003; 102(1): 311–319.
64. Terpos E, Anagnostopoulos A, Kastritis E et al. Abnormal bone remodelling and increased levels of macrophage inflammatory protein-1 alpha (MIP-1alpha) in Waldenström macroglobulinaemia. Br J Haematol 2006; 133(3): 301–304.
65. Rothschild BM, Ruhli F, Rothschild C. Skeletal clues apparently distinguishing Waldenström’s macroglobulinemia from multiple myeloma and leukaemia. Am J Hum Biol 2002; 14(4): 532–537.
66. Marcelli C, Chappard D, Rossi JF et al. Histologic evidence of an abnormal bone remodeling in B-cell malignancies other than multiple myeloma. Cancer 1988; 62(6): 1163–1170.
67. Tian E, Zhan F, Walker R et al. The role of the Wnt-signaling antagonist DKK1 in the development of osteolytic lesions in multiple myeloma. N Engl J Med 2003; 349(26): 2483–2494.
68. Schneider P, MacKay F, Steiner V et al. BAFF, a novel ligand of the tumor necrosis factor family, stimulates B cell growth. J Exp Med 1999; 189(11): 1747–1756.
69. Locksley RM, Killeen N, Lenardo MJ. The TNF and TNF receptor superfamilies: integrating mammalian biology. Cell 2001; 104(4): 487–501.
70. Mackay F, Schneider P, Rennert P et al. BAFF AND APRIL: a tutorial on B cell survival. Annu Rev Immunol 2003; 21 : 231–264.
71. Elsawa SF, Novak AJ, Grote DM et al. B-lymphocyte stimulator (BlyS) stimulates immunoglobulin production and malignant B-cell growth in Waldenström macroglobulinemia. Blood 2006; 107(7): 2882–2888.
72. Ram PT, Iyengar R. G protein coupled receptor signaling through the Src and Stat3 pathway: role in proliferation and transformation. Oncogene 2001; 20(13): 1601–1606.
73. Parsons SJ, Parsons JT. Src family kinases, key regulators of signal transduction. Oncogene 2004; 23(48): 7906–7909.
74. Adamia S, Crainie M, Kriangkum J et al. Abnormal expression of hyaluronan synthases in patients with Waldenström’s macroglobulinemia. Semin Oncol 2003; 30(2): 165–168.
75. Adamia S, Treon SP, Reiman T et al. Potential impact of a single nucleotide polymorphism in the hyaluronan synthase 1 gene in Waldenström’s macroglobulinemia. Clin Lymphoma 2005; 5(4): 253–256.
76. Sahota SS, Forconi F, Ottensmeier CH et al. Origins of the malignant clone in typical Waldenström’s macroglobulinemia. Semin Oncol 2003; 30(2): 136–141.
77. Walsh SH, Laurell A, Sundström G et al. Lymphoplasmacytic lymphoma/Waldenström’s macroglobulinemia derives from an extensively hypermutated B cell that lacks ongoing somatic hypermutation. Leuk Res 2005; 29(7): 729–734.
78. Owen RG, Treon SP, Al-Katib A et al. Clinicopathological definition of Waldenström’s macroglobulinemia: consensus panel recommendations from the Second International Workshop on Waldenström’s Macroglobulinemia. Semin Oncol 2003; 30(2): 110–115.
79. San Miguel JF, Vidriales MB, Ocio E et al. Immunophenotypic analysis of Waldenström’s macroglobulinemia. Semin Oncol 2003; 30(2): 187–195.
Labels
Paediatric clinical oncology Surgery Clinical oncology
Article was published inClinical Oncology

2012 Issue 6-
All articles in this issue
- Hodnocení jaterní funkce v onkologické praxi
- EML4-ALK fúzní gen u pacientů s plicním karcinomem: biologie, diagnostika a cílená terapie
- Porovnání nákladů u režimů XELOX a FOLFOX-4 v léčbě kolorektálního karcinomu
- Výsledky léčby mozkových tumorů stereotaktickou radioterapií a radiochirurgií
- Proteiny rezistence a chemorezistence u pacientek s karcinomem ovaria
- Kazuistika: Podpůrná léčba u pacientky s rozsáhlým tumorem ovaria
- Paraneoplastický neurologický syndrom u 64letého pacienta s malobuněčným karcinomem plic – kazuistika
- Molekulární podstata Waldenströmovy makroglobulinemie
- Prečo sú mitochondrie vhodné ciele pre liečbu rakoviny
- Profil pacientů s nádory léčených na pohotovosti referenčního střediska nádorové péče v jižní Brazílii
- Bílé subkapsulární jaterní uzly objevené náhodně během laparoskopické operace: žlučové hamartomy a peribiliární žlázový hamartom
- Clinical Oncology
- Journal archive
- Current issue
- Online only
- About the journal
Most read in this issue- Hodnocení jaterní funkce v onkologické praxi
- Porovnání nákladů u režimů XELOX a FOLFOX-4 v léčbě kolorektálního karcinomu
- Bílé subkapsulární jaterní uzly objevené náhodně během laparoskopické operace: žlučové hamartomy a peribiliární žlázový hamartom
- Kazuistika: Podpůrná léčba u pacientky s rozsáhlým tumorem ovaria
Login#ADS_BOTTOM_SCRIPTS#Forgotten passwordEnter the email address that you registered with. We will send you instructions on how to set a new password.
- Career

