-
Medical journals
- Career
Mutace BRAF: nový přístup k cílené léčbě melanomu
Authors: M. Arenbergerová 1; I. Puzanov 2
Authors‘ workplace: Dermatovenerologická klinika 3. LF UK a FNKV, Praha 1; Vanderbilt-Ingram Cancer Center, Nashville, USA 2
Published in: Klin Onkol 2012; 25(5): 323-328
Category: Reviews
Overview
I přes narůstající preventivní opatření a povědomí o maligním melanomu incidence tohoto onemocnění celosvětově stoupá. Raná stadia se s dobrým efektem léčí chirurgicky, ale ve fázi generalizace se melanom řadí mezi nejobtížněji léčitelné diagnózy. Tento tradiční pohled se s přibývajícími znalostmi o patogenezi melanomu na molekulárně biologické úrovni začíná měnit příznivým směrem. Nyní je zřejmé, že melanom není homogenní choroba s jednotnou sadou genetických změn. V rámci personalizované medicíny lze dnes pacientům s C-KIT mutací v režimu klinického zkoušení nabídnout inhibitor kinázy C-KIT (imatinib) nebo inhibitor kinázy BRAF u pacientů se specifickou mutací BRAFV600E (vemurafenib). Vemurafenib byl schválen FDA v srpnu 2011 a v únoru 2012 lékovou agenturou EMA pro léčbu první i dalších linií pacientů s neresekovatelným nebo metastatickým melanomem s pozitivní mutací genu BRAF. V roce 2011 schválila americká FDA a následně evropská EMA pro léčbu metastazujícího melanomu použití ipilimumabu, tedy protilátky proti cytotoxickému T lymfocytárnímu antigenu 4 (CTLA-4). Ten je klíčovým negativním regulátorem imunitní odpovědi. Terapie ipilimumabem ovlivňuje přirozenou funkci imunitního systému, protože podporuje protinádorovou aktivitu T lymfocytů. Je účinný i u pacientů rezistentních k C-KIT a BRAF inhibitorům a představuje nového perspektivního hráče na poli imunomodulační léčby.
Klíčová slova:
melanom – cílená léčba – BRAF kináza – vemurafenib – imunoterapie – metastázy nádoruÚvod
Biologická léčba melanomu v sobě zahrnuje tři hlavní podskupiny – léčbu imunomodulační zaměřenou na aktivaci T lymfocytů (a celého imunitního systému) nespecifickým způsobem; cílenou léčbu zaměřenou na blokaci mutace genu v melanomu a vývoj specifických melanomových vakcín.
Nespecifická imunomodulační léčba byla vyvíjena několik desítek let a úsilí kulminovalo v roce 1992, kdy byla v USA Food and Drug Administration (FDA) schválena terapie vysokými dávkami interleukinu-2. Nejednalo se tu o obvyklé schválení na základě klinické studie III. fáze (kontrolované placebem či jiným standardem), ale posuzovala se celková léčebná odpověď u 15 % nemocných a dlouhodobá trvalá kompletní odpověď u 5–8 % pacientů léčených vysokými dávkami interleukinu-2 [1,2]. Další pokusy byly neúspěšné až do doby nedávné, kdy protilátka blokující receptor CTLA-4 ipilimumab (Yervoy) prokázala zlepšení mediánu přežití u pacientů s melanomem. Ipilimumab je plně humánní monoklonální protilátka IgG1, která se selektivně váže na antigen CTLA-4, čímž ovlivňuje přirozenou funkci imunitního systému ve smyslu podpory protinádorové aktivity T lymfocyty. Hlavním výsledkem multicentrické, randomizované, dvojitě zaslepené klinické studie fáze III bylo přežívání 46 % pacientů 1 rok a zhruba 25 % pacientů více než 2 až 3 roky (v porovnání s 10 % léčených chemoterapií) [3]. Do studie byli zařazeni pacienti s pokročilým metastazujícím maligním melanomem po absolvování léčby 1. linie. Preparát pod názvem Yervoy byl americkou FDA v roce 2011 schválen pro léčbu metastazujícího melanomu v 2. a následně i v 1. linii léčby a European Medicines Agency (EMA) pro 2. linii.
Z druhé kategorie cílených terapií blokujících aktivaci genu pro BRAF a dalších lze jmenovat multikinázový inhibitor sorafenib a selektivní inhibitor BRAF kinázy PLX4032 s nynějším názvem vemurafenib. Vemurafenib (Zelboraf™, Plexxikon//Roche) je cílený preparát ovlivňující signální cestu MAPK. Vedl k prodloužení celkového přežití u pacientů s BRAF--mutovaným melanomem. Zelboraf byl schválen FDA v srpnu 2011 a v únoru 2012 lékovou agenturou EMA pro léčbu první i dalších linií pacientů s neresekovatelným nebo metastatickým melanomem s pozitivní mutací genu BRAF. Součástí schválení léku byl poprvé i připojený diagnostický test na průkaz mutace genu BRAF. V současné době se výzkum tohoto léku rozšiřuje i na další typy nádorů nesoucích tuto mutaci. Jedná se o 8 % všech solidních nádorů. Mutace BRAF se dále najde u 10 % ovariálních nádorů, 8 % karcinomů prostaty, 3 % plic, 2 % mammy, 15 % choledochu, 25 % mediastinálních nádorů ze zárodečných buněk, 10 % kolorektálních tumorů a 40 % nádorů štítné žlázy. Mutace C-KIT je oproti BRAF mutacím extrémně vzácná a bývá přítomna zejména u slizničních a akrálních melanomů nebo u některých melanomů na chronicky UV-exponované kůži [4].
Inhibice BRAF
BRAF je jednou ze serin-treoninových kináz v signální cestě MAPK. Mutace BRAF je nejčastější mutací lidských nádorů [5] a vyskytuje se u 50–60 % případů melanomu [6]. Statisticky signifikantní počet BRAF mutací byl objeven u melanomů na intermitentně UV-exponované kůži na trupu, u melanomů povrchově se šířících nebo nodulárních u mladších jedinců [7]. Doposud bylo identifikováno více než 50 různých typů mutací genu BRAF. Devadesát procent z nich je způsobeno záměnou glutamátu za valin na pozici 600 (V600E mutace) a má za následek 138násobné zvýšení aktivity BRAF kinázy oproti nemutované molekule. Tato mutace vede ke konstitutivní aktivaci signální cesty MAPK a následnému nekontrolovanému buněčnému růstu. Ovlivnění mutace BRAFV600E má obrovský význam v boji proti malignímu melanomu. Původní inhibitor BRAF, sorafenib (Nexavar®, Onyx, CA, USA), nepřinesl uspokojivé výsledky samostatně, ani v kombinaci s tradičními chemoterapeutickými režimy. Hauschild et al [8] srovnávali paklitaxel a karboplatinu v kombinaci se sorafenibem nebo bez něho u předléčených pacientů s neresekovatelným melanomem ve stadiu III nebo metastatickým melanomem. Medián přežití do progrese byl 17,9 týdne v rameni s chemoterapií a 17,4 týdne v rameni s chemoterapií a sorafenibem (poměr rizik 0,91; 99 % CI, 0,63–1,31; p = 0,49). Četnost odpovědí byla 11 % u chemoterapie versus 12 % u kombinace sorafenibu s chemoterapií. Sorafenib je multikinázový inhibitor se širokým spektrem aktivity proti wild-type i mutovanému genu BRAFV600E, což zřejmě přispělo k nepříznivému bezpečnostnímu profilu a neuspokojivým léčebným výsledkům v této studii.
Vemurafenib v klinických studiích
Vemurafenib (Zelboraf) je novější a více specifický inhibitor mutace BRAFV600E. Studie fáze I s eskalací dávky byla provedena u pacientů s různými solidními nádory, i když na základě preklinických dat jich většina měla melanom s BRAF mutací. Analýza této fáze stanovila maximální tolerovatelnou dávku vemurafenibu dvakrát denně 960 mg p.o. Do extenzní kohorty studie fáze I byl již výběr pacientů omezen pouze na pacienty s BRAF mutovaným metastatickým melanomem. Ze 32 pacientů léčených v extenzní kohortě mělo 26 (82 %) pacientů příznivou léčebnou odpověď. U 24 pacientů byla odpověď částečná, u 2 pacientů byla úplná [9]. Vemurafenib vedl velmi rychle, obvykle za 1–2 týdny od začátku léčby k ústupu symptomů (např. bolesti). Lék byl poměrně dobře tolerován, nejčastěji se vyskytovaly artralgie, únava, kožní spinaliomy a keratoakantomy.
BRIM2 byla jednoramenná studie fáze II hodnotící vemurafenib u předléčených pacientů s metastatickým melanomem nesoucím mutaci BRAFV600E [10]. Do studie bylo zařazeno 132 předléčených pacientů s melanomem s prokázanou mutací BRAFV600E. Přibližně 60 % pacientů mělo rozsáhlé metastatické viscerální postižení při zahájení léčby. Asi 50 % pacientů absolvovalo 1 linii, 27 % pacientů mělo 2 linie a 22 % mělo 3 a více linií předchozí léčby. Předchozí léčba u 39 % pacientů obsahovala interleukin-2 a 5 % pacientů bylo léčeno ipilimumabem (tab. 1). Pacienti byli léčeni 960 mg p.o. vemurafenibu dvakrát denně. Primárním cílem studie byla četnost odpovědí. Léčebná odpověď byla hodnocena nezávislou komisí podle RECIST kritérií. Ta u 53 % pacientů potvrdila objektivní odpověď na léčbu, tedy parciální i úplnou odpověď. U dalších 29 % pacientů vedla léčba ke stabilizaci onemocnění (obr. 1).
Image 1. Objektivní léčebná odpověď ve studii BRIM2. Volně podle [23]. ![Objektivní léčebná odpověď ve studii BRIM2. Volně podle [23].](https://www.prolekare.cz/media/cache/resolve/media_object_image_small/media/image/2f410ad709a0758df9d371d766371ea0.png)
Table 1. Vstupní charakteristiky pacientů ve studii BRIM2. 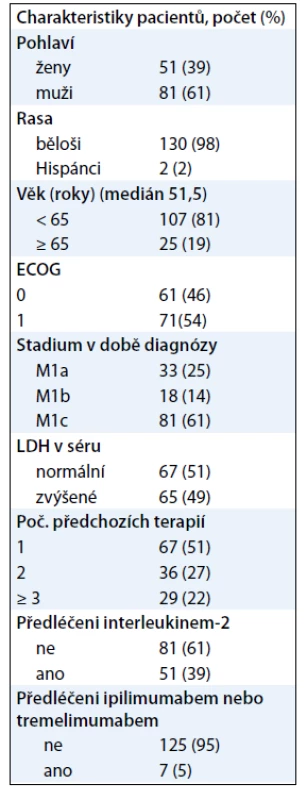
Medián období do progrese onemocnění (PFS) byl 6,8 měsíce [10]. Medián celkového přežití byl 15,9 měsíce, což představuje bezprecedentní prodloužení ve srovnání s 8–10 měsíci dosaženými v minulosti. Výskyt celkového přežití v 6 měsících byl 77 % a ve 12 měsících 58 %. Profil nežádoucích účinků byl podobný studii fáze I (tab. 2).
Table 2. Nejčastější nežádoucí účinky ve studii BRIM2 (vyskytující se u > 25 % pacientů). 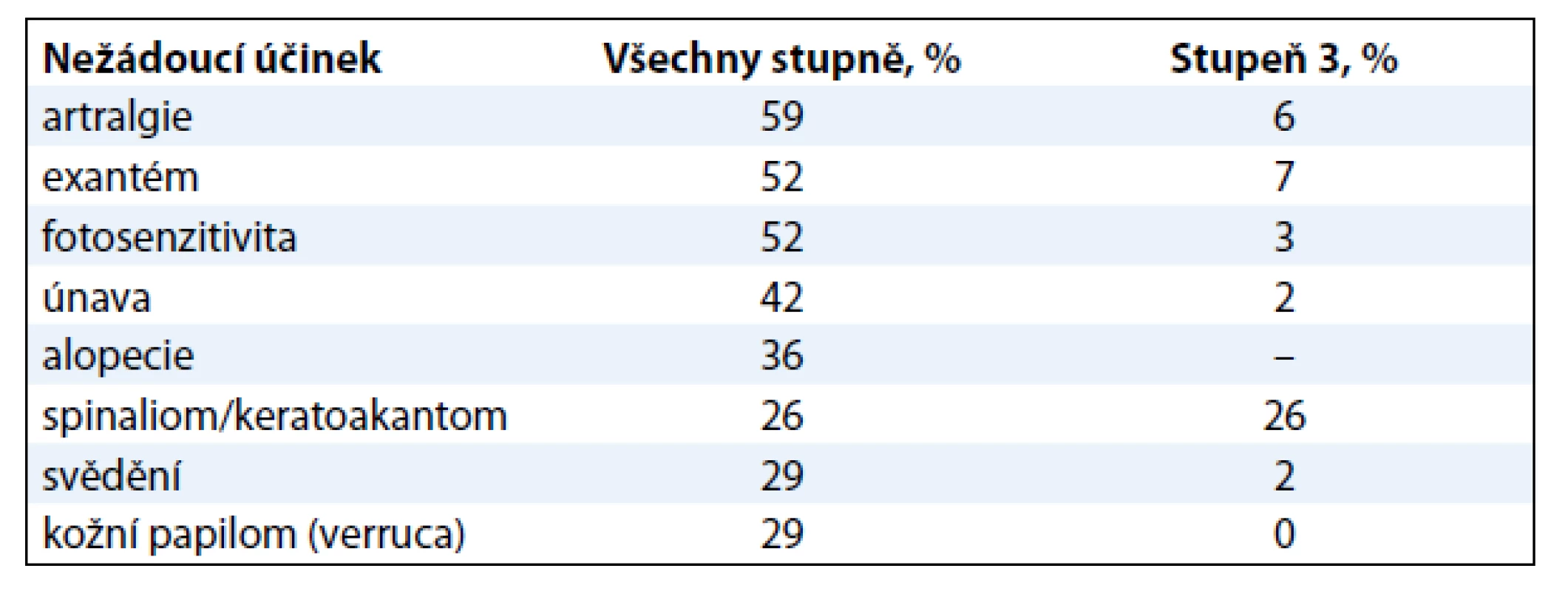
Nejvíce překvapivým nežádoucím účinkem byl vývoj spinaliomů a keratoakantomů u 20–25 % pacientů léčených vemurafenibem s nízkým invazivním potenciálem [11]. Su et al provedli molekulární a histologickou analýzu spinaliomů vzniklých u těchto pacientů, protože chtěli zjistit, zda inhibice wild-type BRAF vede k paradoxní aktivaci MEK a ERK [12]. U většiny těchto pacientů byly v kožních buňkách nalezeny preexistující mutace HRAS/NRAS. V takovém případě vede inhibice wild-type BRAF k paradoxní aktivaci MEK a ERK a výsledné buněčné proliferaci. Tento mechanizmus účinku vysvětluje situaci, kdy je vemurafenib prospěšný pro léčbu nádorů s V600 mutovaným BRAF a zároveň může potencovat růst buněk obsahujících mutaci genu HRAS/NRAS. Tato aktivace je potlačena kombinací vemurafenibu s inhibitorem MEK či inhibitoru BRAF druhé generace (paradox breakers) [12].
BRIM3 je studie fáze III hodnotící vemurafenib versus dakarbazin. Je to globální, randomizovaná, otevřená, kontrolovaná multicentrická studie u pacientů s nepředléčeným metastatickým melanomem s prokázanou mutací BRAFV600E. Od ledna 2010 do prosince 2010 podstoupilo 2 107 pacientů screening ve 104 centrech ze 12 zemí celého světa. Nejčastější příčinou nezařazení pacienta do studie byl negativní test mutace V600. Celkem 675 pacientů bylo náhodně zařazeno v poměru 1 : 1 do ramene s vemurafenibem 960 mg p.o. dvakrát denně nebo intravenózním dakarbazinem 1 000 mg/m2 každé 3 týdny. Stratifikace pacientů byla provedena na základě stadia nemoci (IIIC, M1a, M1b nebo M1c), stavu výkonnosti ECOG (0–1), geografického regionu (Severní Amerika, západní Evropa, Austrálie a Nový Zéland nebo jiný region) a hladiny laktátdehydrogenázy (tab. 3).
Table 3. Vstupní charakteristiky pacientů ve studii BRIM-3. 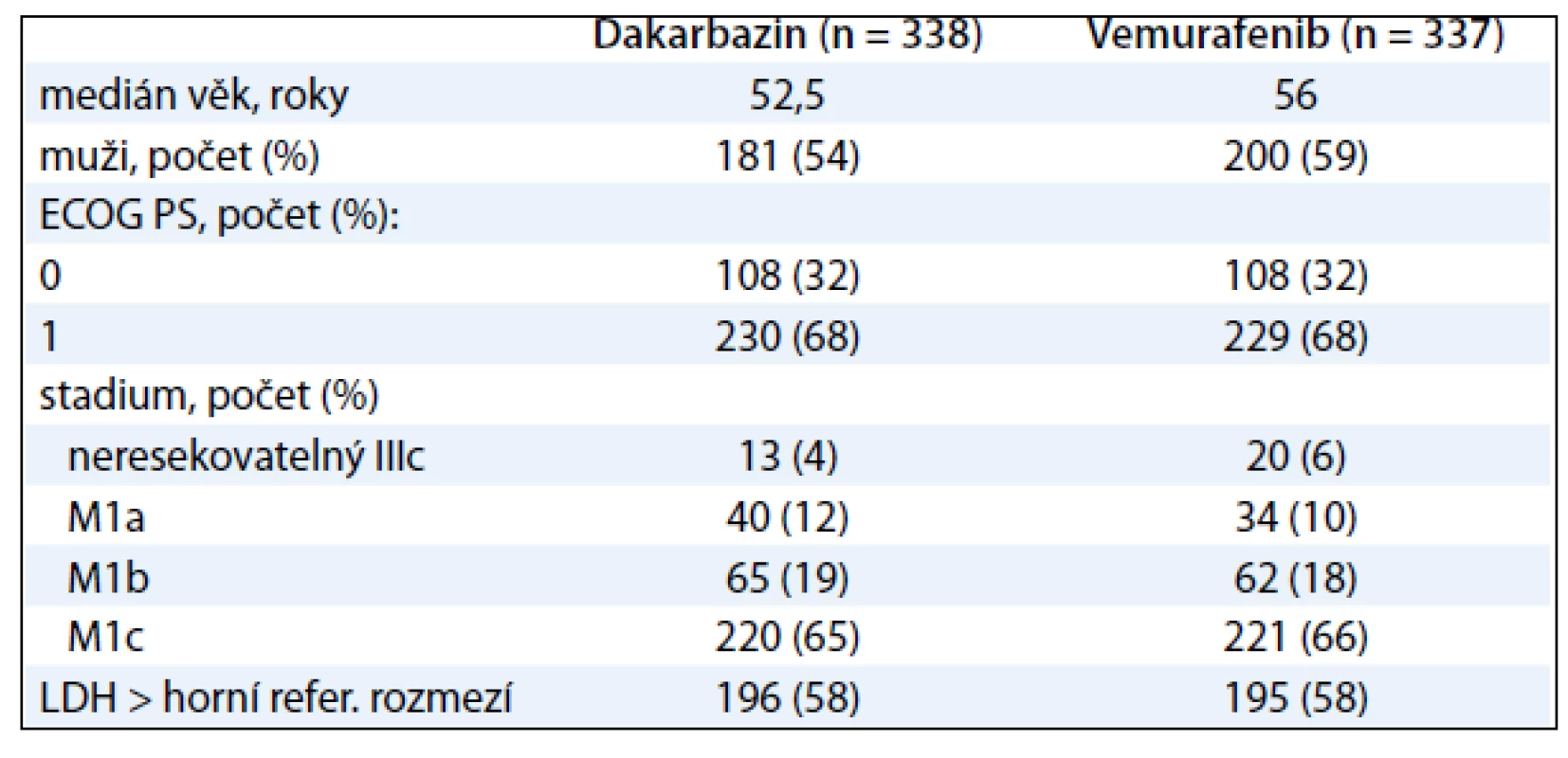
V interim analýze k 30. prosinci 2010 bylo statisticky významné zlepšení (p < 0,0001) pozorováno jak u parametru celkového přežití, tak u doby přežití bez progrese. Podle doporučení DSMB (Data Safety Monitoring Board), jehož výsledky byly uveřejněny v lednu 2011, byla studie modifikována a pacientům užívajícím dakarbazin bylo umožněno přejít na léčbu vemurafenibem. Poté byly provedeny post-hoc analýzy přežití, kde vemurafenib statisticky signifikantně prodloužil dobu přežití [13]. Medián celkového přežití v rameni s vemurafenibem byl 13,2 měsíce vs 9,6 měsíce u ramene s dakarbazinem (obr. 2).
Image 2. Kaplan-Meierovy křivky celkového přežití ze studie BRIM3 – dříve neléčení pacienti (ukončení sběru údajů ke dni 3. října 2011). 
Celkem 19 z 220 pacientů ve studii BRIM3, u kterých byly tumory analyzovány pomocí retrospektivního sekvencování, mělo melanom s pozitivní mutací V600K genu BRAF. Ačkoli analýzy účinnosti mezi těmito pacienty s V600K pozitivními tumory byly limitovány nízkým počtem pacientů, naznačovaly prospěch léčby vemurafenibem, pokud jde o celkové přežití, dobu přežití bez progrese a potvrzenou nejlepší celkovou odpověď na léčbu. Pro pacienty s jinou mutací V600 genu BRAF než V600E a V600K nejsou k dispozici žádné údaje.
Z 65 % hodnotitelných pacientů byla četnost odpovědí 48,4 % u pacientů léčených vemurafenibem proti 5,5 % pacientů léčených dakarbazinem [14]. Nejčastějšími nežádoucími účinky v souvislosti s vemurafenibem byly podobně jako v dřívějších fázích vývoje vemurafenibu artralgie, kožní exantém, únava, alopecie, keratoakantom (obr. 3) nebo spinaliom (18 %), fotosenzitivita, nauzea a průjem. U 38 % pacientů bylo třeba upravit dávky kvůli toxicitě [14]. Na základě těchto pozitivních výsledků byl pacientům v kontrolním rameni umožněn crossover k léčbě vemurafenibem. V srpnu 2011 FDA schválila vemurafenib pro léčbu neresekovatelného a metastazujícího melanomu u pacientů, jejichž nádor nese mutaci V600E. Vemurafenib tak představuje příklad personalizované terapie vyžadující selekci pacientů, u nichž se očekává dobrý léčebný efekt. Ten můžeme dokumentovat na našich pacientech z Fakultní nemocnice na Královských Vinohradech, kde vidíme zpravidla rychlou regresi metastáz i v pokročilých stadiích onemocnění (obr. 4).
Image 3. Keratoakantom a bulózní dermatitida jako kožní nežádoucí účinek terapie vemurafenibem. 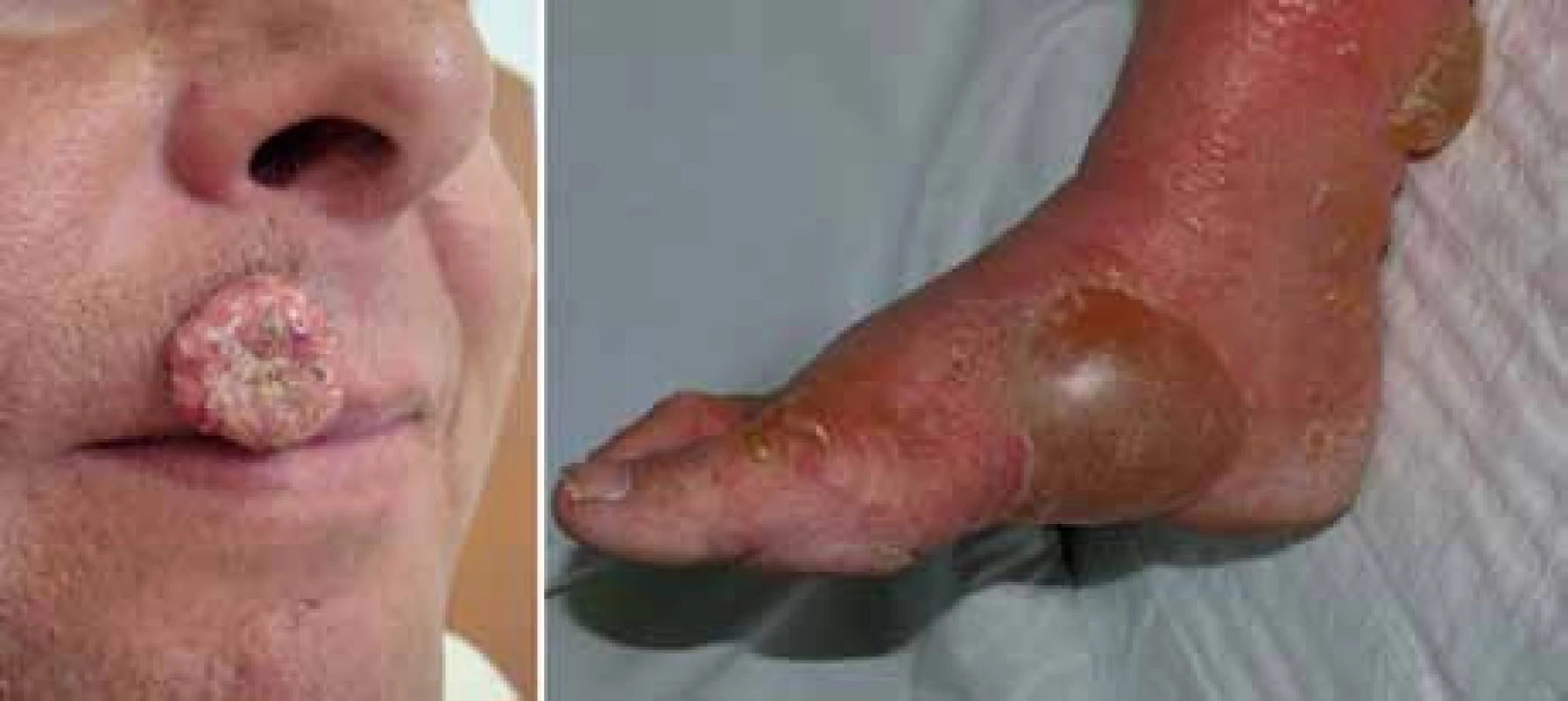
Image 4. Regrese metastáz jater a kůže u pacientky po 28 dnech terapie 960 mg p.o. vemurafenibu dvakrát denně. 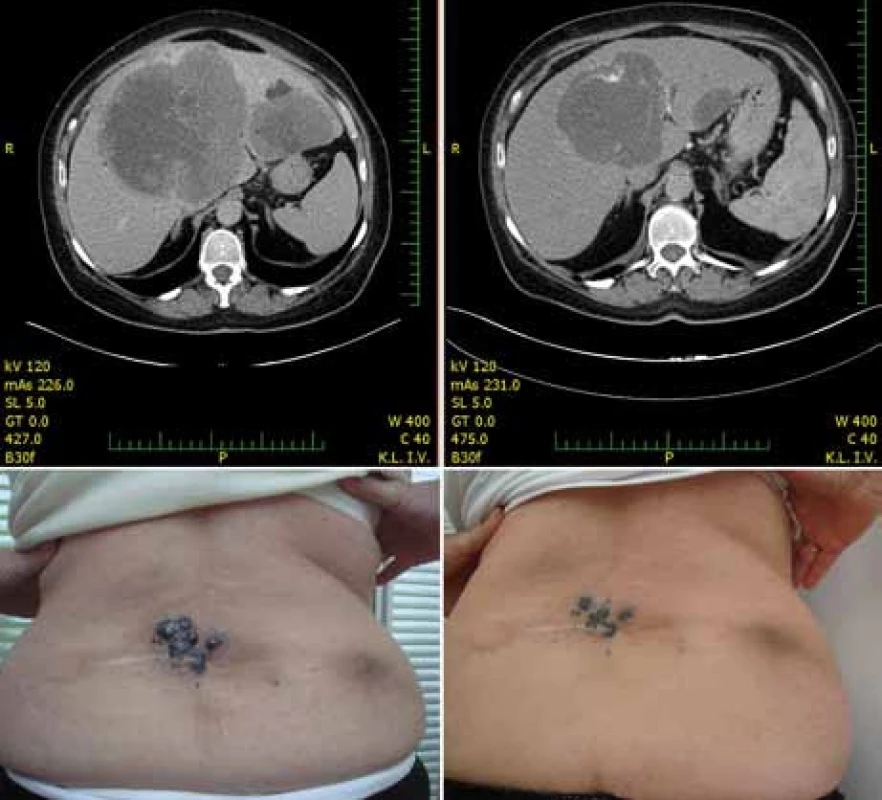
Rezistence k BRAF inhibitoru
Navzdory vysoké četnosti odpovědí na inhibitory BRAF existuje populace pacientů s primární lékovou rezistencí a populace pacientů, u kterých se po příznivé iniciální odpovědi rozvine sekundární rezistence [9]. Studie naznačují, že rezistence na BRAF inhibitory nevzniká sekundární mutací BRAF proteinu zhoršující vazbu léku, jak ji známe u jiných nádorových onemocnění [15]. Jednou z možností je obejití BRAF inhibice pomocí zvýšení signalizace CRAF, alternativní RAF kinázy, která umožní buněčný růst signální dráhou s onkogenními následky [16]. Mechanizmus získané rezistence není uniformní, jak dokazují výsledky studií z poslední doby. Nazarian et al objevili u některých pacientů rezistenci závislou na preexistujících či nově vzniklých mutacích NRAS nebo na zvýšené signalizaci receptoru pro PDGFR beta [17]. Johanessen et al vysvětlují fenomén reaktivace MAPK dráhy u jiných nemocných kinázou COT/TpI2 (MAP3K8) [18]. Tato reaktivace pak vedla k rezistenci na vemurafenib.
Poulikakos et al objevili, že u 6 z 19 studovaných pacientů s maligním melanomem léčených vemurafenibem se vyvinula rezistence na základě „alternativního splicingu“ BRAF [19]. Takto vzniklý protein [p61BRAF(V600E)] ztrácí aminokyseliny kódované exony 4–8, a tím i vazebné místo pro RAS. To vede k jeho zvýšené dimerizaci v buňkách melanomu a následně k aktivitě ERK a rezistenci na vemurafenib. Tento fenomén je závislý na nízké aktivitě RAS-GTP typické pro melanom, která neumožňuje dimerizaci BRAF za normálních podmínek, a činí tak BRAF(V600E) mutovaný melanom velmi senzitivní na léčbu vemurafenibem.
Stejná senzitivita se neprokázala u pacientů s kolorektálním karcinomem obsahujícím BRAF(V600E), kterých je 8–10 %. Léčba cílená na BRAF (vemurafenib) vedla k objektivní odpovědi jen u 5 % takto nemocných. Skutečným průlomem zde může být studie Prahallada et al, která prokazuje synergii kombinace inhibitoru BRAF (vemurafenib) s inhibitorem EGFR (erlotinib, gefitinib, cetuximab) [20]. Tato kombinace vedla, zatím pouze na modelech in vitro a in vivo, k objektivním odpovědím řádově srovnatelným s aktivitou vemurafenibu u melanomů s mutací BRAF.
Závěr
Nedávné schválení ipilimumabu a vemurafenibu v léčbě pokročilého melanomu představuje od roku 1998 první léčbu, která u metastazujícího melanomu vedla k prodloužení celkového přežití.
Kombinovaná terapie zahrnující více signálních drah typických pro vznik melanomu bude pravděpodobně schopná ještě efektivněji ovlivnit nádorový růst. Například signální dráha PI3K–Akt–mTOR je paralelní cestou s již zmíněnou drahou MAPK. Nadměrná aktivita dráhy PI3K hraje významnou roli v patogenezi melanomu a její aktivace podporuje růst melanomových buněk [21]. Slibných výsledků v časných fázích výzkumu je dosahováno i při cílené léčbě ovlivňující signální dráhu MAPK s použitím inhibitorů BRAF a MEK [22]. Probíhají také studie zkoumající mechanizmus rezistence a nové kombinační možnosti nabízející synergizmus jednotlivých léků, jako např. BRAF inhibitor s imunomodulační molekulou.
U pokročilého melanomu se v posledních desetiletích léčba téměř neměnila a terapeutické výsledky nebyly uspokojivé. Nové léky schválené pro terapii pokročilého melanomu ale celou situaci mění a nabízejí nové možnosti léčby. Tento pokrok ale není bez rizika, protože s novými biologickými preparáty se objevují například nové imunitně podmíněné nežádoucí účinky nebo vznikají epiteliální nádory. Jakmile se podaří zmapovat další neoplastické principy u melanomu, povede to k významnému klinickému pokroku v léčbě tohoto onemocnění.
Autoři deklarují, že v souvislosti s předmětem studie nemají žádné komerční zájmy.
Redakční rada potvrzuje, že rukopis práce splnil ICMJE kritéria pro publikace zasílané do bi omedicínských časopisů.
MUDr. Monika Arenbergerová, Ph.D.
Dermatovenerologická klinika 3. LF UK a FNKV
Šrobárova 50
100 34 Praha 10
e-mail: ma@avemedica.cz
Obdrženo: 2. 3. 2012
Přijato: 11. 4. 2012
Sources
1. Atkins MB, Lotze MT, Dutcher JP et al. High-dose recombinant interleukin 2 therapy for patients with metastatic melanoma: analysis of 270 patients treated between 1985 and 1993. J Clin Oncol 1999; 17(7): 2105–2116.
2. Smith FO, Downey SG, Klapper JA et al. Treatment of metastatic melanoma using interleukin-2 alone or in conjunction with vaccines. Clin Cancer Res 2008; 14(17): 5610–5618.
3. Hodi FS, O’Day SJ, McDermott DF et al. Improved survival with ipilimumab in patients with metastatic melanoma. N Engl J Med 2010; 363(8): 711–723.
4. Greenman C, Stephens P, Smith R et al. Patterns of somatic mutation in human cancer genomes. Nature 2007; 446(7132): 153–158.
5. Davies H, Bignell GR, Cox C et al. Mutations of the BRAF gene in human cancer. Nature 2002; 417(6892): 949–954.
6. Curtin JA, Busam K, Pinkel D et al. Somatic activation of KIT in distinct subtypes of melanoma. J Clin Oncol 2006; 24(26): 4340–4346.
7. Maldonado JL, Fridlyand J, Patel H et al. Determinants of BRAF mutations in primary melanomas. J Natl Cancer Inst 2003; 95(24): 1878–1890.
8. Hauschild A, Agarwala SS, Trefzer U et al. Results of a phase III, randomized, placebo-controlled study of sorafenib in combination with carboplatin and paclitaxel as second-line treatment in patients with unresectable stage III or stage IV melanoma. J Clin Oncol 2009; 27(17): 2823–2830.
9. Flaherty KT, Puzanov I, Kim KB et al. Inhibition of mutated, activated BRAF in metastatic melanoma. N Engl J Med 2010; 363(9): 809–819.
10. Sosman JA, Kim KB, Schuchter L et al. Survival in BRAF V600-mutant advanced melanoma treated with vemurafenib (BRIM2). N Engl J Med 2012; 366(8): 707–714.
11. Oberholzer P, Kee D, Dziunycz P et al. RAS mutations are associated with the development of cutaneous squamous cell tumors in patients treated with RAF inhibitors. J Clin Oncol 2012; 30(3): 316–321.
12. Su F, Viros A, Milagre C et al. RAS mutations in cutaneous squamous-cell carcinomas in patients treated with BRAF inhibitors. N Engl J Med 2012; 366(3): 207–215.
13. Ema.europa.eu [online]. European Medicine Agency. Zelboraf – Souhrn údajů o přípravku [aktualizováno 19. března 2012; citováno 19. března 2012]. Dostupný z: http://www.ema.europa.eu/docs/cs_CZ/document_library/EPAR_Product_Information/human/002409/WC500124317.pdf.
14. Chapman PB, Hauschild A, Robert C et al. Improved survival with vemurafenib in melanoma with BRAF V600E mutation. N Engl J Med 2011; 364(26): 2507–2516.
15. Kobayashi S, Boggon TJ, Dayaram T et al. EGFR mutation and resistance of non-small-cell lung cancer to gefitinib. N Engl J Med 2005; 352(8): 786–792.
16. Montagut C, Sharma SV, Shioda T et al. Elevated CRAF as a potential mechanism of acquired resistance to BRAF inhibition in melanoma. Cancer Res 2008; 68(12): 4853–4861.
17. Nazarian R, Shi H, Wang Q et al. Melanomas acquire resistance to B-RAF(V600E) inhibition by RTK or N-RAS upregulation. Nature 2010; 468(7326): 973–977.
18. Johannessen CM, Boehm JS, Kim SY et al. COT drives resistance to RAF inhibition through MAP kinase pathway reactivation. Nature 2010; 468(7326): 968–972.
19. Poulikakos PI, Persaud Y, Janakiraman M et al. RAF inhibitor resistance is mediated by dimerization of aberrantly spliced BRAF(V600E). Nature 2011; 480(7377): 387–390.
20. Prahallad A, Sun C, Huang S et al. Unresponsiveness of colon cancer to BRAF(V600E) inhibition through feedback activation of EGFR. Nature 2012; 483(7387): 100–103.
21. Wymann MP, Marone R. Phosphoinositide 3-kinase in disease: timing, location, and scaffolding. Curr Opin Cell Biol 2005; 17(2): 141–149.
22. Heneberg P. Advances in clinical treatment of malignant melanoma: B-RAF kinase inhibition. Klin Onkol 2011; 24(4): 256–264.
23. Ribas A, Kim KB, Schuchter LM et al. BRIM-2: an open label multicenter phase 2 study of vemurafenib in previously treated patients with BRAF V600E mutation-positive metastatic melanoma. Abstract 8509. J Clin Oncol 2011; 29 : 15S.
Labels
Paediatric clinical oncology Surgery Clinical oncology
Article was published inClinical Oncology

2012 Issue 5-
All articles in this issue
- Prognostické faktory konvenčního osteosarkomu dospělých pacientů
- Neoplastické účinky indometacínu v N-metyl-N-nitrozoureou indukovanej mamárnej karcinogenéze u samíc potkanov
- Význam stanovovania expresie DNA reparačných mechanizmov u nemalobunkového karcinómu pľúc
- Septické komplikace intravenózních portových systémů – kazuistiky a přehled literatury
- Další pozitivní studie u karcinomu ovaria
- Mutace BRAF: nový přístup k cílené léčbě melanomu
- Hmotná podstata genetických informací – nukleové kyseliny
- Dabrafenib: nový inhibitor hyperaktivní kinázy B-RAF
- Sarkómy maternice – prehľad
- Predoperačná rádioterapia lokálne pokročilého karcinómu rekta: klinické výsledky krátkodobej a dlhodobej liečby s alebo bez konkomitantnej chemoterapie
- Clinical Oncology
- Journal archive
- Current issue
- Online only
- About the journal
Most read in this issue- Prognostické faktory konvenčního osteosarkomu dospělých pacientů
- Sarkómy maternice – prehľad
- Septické komplikace intravenózních portových systémů – kazuistiky a přehled literatury
- Mutace BRAF: nový přístup k cílené léčbě melanomu
Login#ADS_BOTTOM_SCRIPTS#Forgotten passwordEnter the email address that you registered with. We will send you instructions on how to set a new password.
- Career

