-
Medical journals
- Career
Použití lenalidomidu v léčbě mnohočetného myelomu
Authors: M. Holánek; R. Hájek
Authors‘ workplace: Interní hematoonkologická klinika, FN Brno
Published in: Klin Onkol 2010; 23(2): 67-72
Category: Reviews
Overview
Lenalidomid je nový perspektivní lék v léčbě pacientů s mnohočetným myelomem. Tento analog thalidomidu vznikl s úmyslem zlepšení protinádorového působení, imunomodulačních vlastností, ale též snížení toxicity preparátu. Mechanizmem protinádorového působení preparátu se zdá být působení na buněčné složky, mikroprostředí tumoru a zejména regulace produkce cytokininů. Proběhlé klinické studie fáze I a II prokázaly účinnost u pacientů s relabovaným mnohočetným myelomem. Následně velké randomizované studie prokázaly výhodnost terapie u relaxovaných/ refrakterních pacientů s mnohočetným myelomem kombinací lenalidomidu s dexametazonem oproti léčbě dexametazonem v monoterapii. Pacienti léčení kombinací lenalidomidu s dexametazonem měli významně vyšší léčebnou odpověď i celkové přežití než pacienti léčení samotným dexametazonem. Zásadní toxicitou se zdá být myelosupresivní vliv lenalidomidu. Práce přináší shrnutí dostupných informací o lenalidomidu v léčbě mnohočetného myelomu.
Klíčová slova:
lenalidomid – thalidomid – mnohočetný myelom – autologní transplantace periferních kmenových buněkÚvod
Lenalidomid je lék, který spolu s thalidomidem patří do skupiny imunomodulačních látek označovaných v literatuře jako IMiDs (ImmunoModulatory DrugS). Jedná se o léky s pozoruhodnou protinádorovou aktivitou především u mnohočetného myelomu (MM), ale i řady dalších nádorových onemocnění [1]. Mimořádná účinnost u MM prvního z nich, thalidomidu, byla objevena náhodně u nemocných podstupujících alogenní transplantaci, kde byl thalidomid používaný k tlumení reakce štěpu proti hostiteli. Thalidomid je dnes celosvětově používán u nemocných s MM [2]. Klinické zkušenosti s thalidomidem vedly k zahájení výzkumu jeho dalších derivátů s cílem vyvinout látku s vylepšeným toxickým profilem a ještě lepší účinností. Mezi analogy thalidomidu, které prošly sítem preklinických studií, patří lenalidomid a pomalidomid. Lenalidomid je jedním z nejperspektivnějších léků v léčbě MM, což je dáno jeho mimořádnou účinností, akceptovatelným toxickým profilem a snadnou aplikací u nemocných, neboť jde o perorální lék [3]. Cílem tohoto souhrnného článku je představit stávající znalosti o tomto moderním léku u MM.
Mechanizmus účinku lenalidomidu
Druhá generace IMiDů, tedy lenalidomid a pomalidomid, vznikla modifikací struktury thalidomidu k optimalizaci protinádorového působení a imunomodulačních vlastností.
I přes nezpochybnitelnou klinickou účinnost této látky u mnoha onkologických onemocnění není mechanizmus účinku zcela objasněn, stejně jako je tomu u thalidomidu.
Důležitou vlastností lenalidomidu je schopnost ovlivňovat produkci cytokinů nádorovou populací buněk, konkrétně se jedná o snižování produkce cytokinů, jako je tumor necrosis faktor alfa, interleukin 6, interleukin 8 a vaskulární endoteliální růstový faktor (vascular endothelial growth factor – VEGF), které účinkují ve smyslu zvýšení proliferační aktivity buněk, jakož i ve smyslu zvýšení jejich rezistence k podávané chemoterapii [4]. Zdá se také, že lenalidomid je schopen ovlivňovat jiné složky mikroprostředí tumoru včetně imunitních buněčných komponent, konkrétně se jedná o schopnost aktivace imunitních buněk NK a T lymfocytů [5]. T lymfocyty jsou lenalidomidem stimulovány k zvýšené proliferaci a produkci interleukinu 2 a interferonu gama díky aktivaci buněčných receptorů T-lymfocytů. Dále byla též zaznamenána aktivace NK buněk vlivem lenalidomidu. Mimo výše uvedených nepřímých protinádorových účinků má lék i schopnost přímého působení na myelomové buňky.
Preklinické testování lenalidomidu in vitro, in vivo
Mutagenita preparátu byla testována v preklinických studiích in vitro (bakterie, lidské lymfocyty, embryo syrského křečka) a taktéž in vivo (krysí mikronukleus), v obou případech bez průkazu lékem způsobených mutací, ať už na chromozomální či genové úrovni. Ovlivnění embryofetálního vývoje lékem bylo studováno na opičích modelech s cílem zjistit případnou teratogenitu léku. Lenalidomid byl podáván opičím modelům v dávce 4mg/kg/den a bohužel předběžné výsledky probíhajících studií prokázaly končetinové malformace podobné těm, které se v minulosti vyskytovaly při podávání thalidomidu [6]. Pokud jde o akutní toxicitu, bylo preklinicky prokázáno, že lenalidomid má potenciální akutní toxicitu s minimální letální dávkou (stanoveno při perorálním podávání) více než 2 000mg/kg/den. Chronická toxicita byla testována na opičích modelech. Opicím byla podávána dávka 4–5mg/kg/den po dobu 20 týdnů, což mělo za následek zvýšení morbidity i mortality u testovaných zvířat (snížení počtu červených i bílých krvinek stejně jako krevních destiček, mnohočetná orgánová krvácení, záněty gastrointestinálního traktu a další).
Použití lenalidomidu v monoterapii u pacientů s relabovaným/refrakterním mnohočetným myelomem
Richardson et al testovali ve studii fáze I lenalidomid v monoterapii v dávkách 5–50mg/den u pacientů s refrakterním mnohočetným myelomem [7]. Celková léčebná odpověď (PR + CR) v této studii činila 29% s největším počtem léčebných odpovědí při podávaných dávkách 25mg a 50mg. Doba do dosažení léčebné odpovědi v této studii byla dva měsíce (medián) a trvání léčebné odpovědi šest měsíců (medián). Na základě této studie byla stanovena maximální tolerovaná dávka (MTD) 25mg denně.
V následující fázi II studie, které se zúčastnilo 102 pacientů, byl podáván lenalidomid, a to v jedné nebo dvou dávkách denně. Porovnáváno bylo dávkovací schéma obsahující 30mg podávaných jednou denně se schématem rozdělujícím toto množství do dvou stejných, dvakrát denně podávaných dávek [8]. Jelikož u pacientů zařazených do větve s dávkováním 15mg dvakrát denně byl pozorován výrazně vyšší výskyt těžké myelosuprese, bylo toto rameno předčasně ukončeno. Podrobnosti týkající se této studie ukazuje tab. 1.
Table 1. Přehled klinických studií s lenalidomidem. 
L, Len – lenalidomid, D, Dex – dexametazon, A – doxorubicin, PLD – pegylovaný lipozomální doxorubicin, V – vinkristin, Cy – cyklofosfi mid, Bor – bortezomib, M – melphalan, P – prednison, Bi – biaxin (claritromycin), d – den, DC – délka cyklu, ORR – celková léčebná odpověď, PR – parciální odpověď, CR – kompletní odpověď, ND – není dostupno. Do studie fáze II uskutečněné Richardsonem bylo zahrnuto 222 pacientů, kteří obdrželi dávku 25mg lenalidomidu denně. Lék byl podáván ve dny 1–21 28denního cyklu s následně prokázanou celkovou odpovědí 25% a časem do progrese činícím 5,1 měsíců [9]. Pro dobrou léčebnou odpověď a dobrou toleranci byl tento způsob dávkování lenalidomidu určen jako standardní.
Výše zmíněné skutečnosti poskytly podklady pro dávkovací schémata použitá v následně uvedených studiích, v nichž byl již lenalidomid kombinován s jinými účinnými léky.
Použití lenalidomidu v kombinovaných režimech u pacientů s relabovaným/refrakterním mnohočetným myelomem
Jako registrační studie pro užití lenalidomidu u pacientů s relabovaným mnohočetným myelomem proběhly dvě dvojitě zaslepené, placebem kontrolované studie fáze III. První z těchto studií proběhla v Severní Americe (MM 009) a druhá v Evropě, Izraeli a Austrálii (MM 010) [10]. Do těchto studií bylo zahrnuto 705 pacientů s relabovaným mnohočetným myelomem, kteří obdrželi buď kombinaci dexametazonu s lenalidomidem, či kombinaci obsahující placebo a dexametazon. Dávkovací schéma obsahovalo lenalidomid ve dny 1–21 28denního cyklu spolu s dexametazonem podávaným ve dny 1–4, 9–12 a 17–20. Celková léčebná odpověď (objective response rate – ORR) byla signifikantně vyšší ve prospěch kombinace len + dex (60% vs 20%, p < 0,001) a obdobně tomu bylo v případě dosažených kompletních remisí (15% vs 2%, p < 0,001). Dle smíšených dat z obou studií je zřejmé, že medián času do progrese (time to progession – TTP) byl opět signifikantně delší u kombinace len + dex (13,4 vs 4,6 měsíců, p < 0,001). Také porovnání doby celkového přežívání pacientů mluví jednoznačně ve prospěch lenalidomidu (38,0 vs 31,6 měsíců, p = 0,045 ) s folow up rovným 48 měsícům (medián), a to i navzdory faktu, že po progresi choroby či odslepení studie bylo celých 47,6% pacientů přeřazeno ze skupiny léčené placebem do větve obsahujicí kortikoid s účinnou látkou.
V další studii Baz et al hodnotili účinnost kombinace lenalidomidu v kombinaci s vinkristinem, dexametazonem a pegylovaným lipozomálním doxorubicinem [11]. Do této studie fáze I/II bylo zahrnuto 53 pacientů, kteří obdrželi doxorubicin, vincristin, dexametazon a lenalidomid v dávkách uvedených v tab. 1. Maximální tolerovaná dávka (MTD) lenalidomidu zde byla stanovena na 10mg/den a limitující toxicitou se zde ukázala být převážně myelotoxicita. Parciální odpovědi (partial response – PR) bylo dosaženo u 60% pacientů a kompletní remise (complete remision – CR) u 15% pacientů. TTP byl v této studii stanoven na 12 měsíců. Tato studie, ve které bylo dosaženo léčebných odpovědí u více než dvou třetin pacientů, tedy opět potvrdila účinnost lenalidomidu.
Po dřívějším úspěchu kombinovaného režimu obsahujícího thalidomid, dexametazon a cyklofosfamid u předléčených pacientů byla snaha vyzkoušet tuto kombinaci léků s lenalidomidem nahrazujícím thalidomid.
Tato kombinace byla použita u těžce předléčených pacientů a režim obsahoval cyklofosfamid, dexametazon, lenalidomid, podávané dle schématu uvedeného v tab. 1 [12]. Z 20 hodnocených pacientů dosáhlo parciální remise 60% a kompletní remise 5%. Tato léčba si vyžádala použití růstových faktorů u většiny pacientů a byla provázena poměrně vysokým počtem infekčních komplikací v souvislosti s léčbou indukovanou neutropenií.
Ve studii fáze I/II provedené Richardsonem et al byla podávána kombinace lenalidomidu s bortezomibem u 38 pacientů s relabovaným/refrakterním mnohočetným myelomem, a to v dávkování uvedeném v tab. 1. Pokud došlo při této léčbě k progresi nemoci, byl přidán do kombinace ještě dexametazon 40mg ve dny podávání bortezomibu a den poté [13]. Přes počáteční optimistické výsledky reprezentované dosaženou parciální remisí u 77% pacientů, tato klesla po zhodnocení všech skupin pacientů na 34%. Paradoxně vyšší procento léčebných odpovědí bylo zaznamenáno u pacientů s nízce dávkovaným lenalidomidem.
Z výše uvedeného plyne, že kombinované režimy vykazují vyšší procento léčebné odpovědi než režimy obsahující pouze lenalidomid v monoterapii, a je též zřejmé, že v kombinovaných režimech je tedy možné snížení dávky lenalidomidu s následným snížením toxicity.
Podrobný popis všech studií, které proběhly s použitím lenalidomidu, je přehledně shrnut v první části tab. 1.
Lenalidomid u nově diagnostikovaného mnohočetného myelomu
Po průkazu klinické účinnosti lenalidomidu u pacientů s relabovaným mnohočetným myelomem bylo odstartováno několik studií, jejichž cílem bylo ověřit účinnost látky u pacientů v primoléčbě.
Ve studii fáze II, do které bylo zahrnuto 68 pacientů, byl podáván lenalidomid v kombinaci s dexametazonem v dávkovacím schématu popsaném v tab. 1. Po vyhodnocení dat z této studie bylo zřejmé, že u 91% pacientů bylo dosaženo celkové léčebné odpovědi (PR + CR), z čehož kompletní remise dosáhlo 18% pacientů [14]. Po dvou letech hodnocený čas bez progrese (progression-free survival – PFS) a celkové přežívání (overall survival – OS) činili 74% a 91%. Toto lze bezesporu hodnotit jako mimořádné výsledky, nicméně nutno dodat, že ve studii byla pozorována dvě časná úmrtí a i počet nežádoucích účinků byl relativně vysoký.
Ve snaze snížit výskyt nežádoucích účinků u režimů kombinujících lenalidomid a kortikoidy vznikla studie fáze III, do které bylo zahrnuto 445 pacientů. Studie si kladla za cíl porovnat léčebnou odpověď a výskyt nežádoucích účinků u kombinace lenalidomidu s nízce a vysoce dávkovaným dexametazonem (detaily dávkování v tab. 1).
Tato studie ukázala, že jednoleté přežívání je signifikantně vyšší u pacientů s dexametazonem nízce dávkovaným (96,5% vs 86%), a to i přesto, že počet léčebných odpovědí byl vyšší ve skupině s vyšší dávkou dexametazonu. Z toho plyne, že toxicita vysoce dávkovaného dexametazonu má za následek přerušování léčby pro nežádoucí účinky, a tedy nevyužití plného potenciálu nového léčiva.
Následující studie navazovala na dobré zkušenosti s režimy obsahujícími Biaxin (clarithromycin), dexametazon a nízce dávkovaný thalidomid. Při použití kombinace s lenalidomidem nahrazujícím thalidomid mezi 40 hodnocenými pacienty činila celková odpověď 90%, z čehož 39% pacientů dosáhlo CR. Tyto výsledky jsou tedy ještě lepší než výsledky dříve dosažené v uvedené kombinaci s thalidomidem, a to zejména pokud jde o podíl dosažených kompletních remisí v celkovém množství pacientů (detaily v tab. 1) [15].
Další ze skupiny dříve vyzkoušených kombinací podněcujících k otestování režimu s obměnou lenalidomidu za thalidomid byla MPT, tedy kombinace thalidomidu, melphalanu a prednisonu.
V rámci R MP bylo 54 pacientů zařazených do studie rozděleno do 4 skupin s rozdílnými dávkovacími schématy [16]. Pacientům byl podáván lenalidomid, melphalan a prednison, jak ukazuje tab. 1., a cyklus byl opakován v 4–6týdenním intervalu. Při mediánu sedmi podaných cyklů bylo celkové ORR dosaženo u 81% pacientů, z toho CR u 13% pacientů. Již po prvním cyklu byla léčebná odpověď vyšší než po šesti režimech MP (retrospektivní srovnání), což ukazuje na velice rychlý nástup účinku této kombinace.
Myelosuprese včetně neutropenie st. 3–4 u 52% nemocných byla nejčastější toxicitou, febrilní neutropenie se vyskytla u 9,5% nemocných a trombembolická komplikace u 4,8% nemocných při profylaxi aspirinem.
Ve snaze optimalizovat použití lenalidomidu u pacientů s nově diagnostikovaným mnohočetným myelomem vznikla multicentrická studie fáze III, v níž se účastní 82 center v Evropě, Izraeli a Austrálii. Do studie MM 015 bylo zařazeno celkem 459 pacientů ve věku nad 65 let s nově diagnostikovaným mnohočetným myelomem, kteří byli následně randomizováni do tří ramen studie, jak podrobně ukazuje tab. 1. Pacienti zařazení do první skupiny obdrželi kombinaci lenalidomidu, melphalanu a prednisonu s následnou dlouhodobou podporou lenalidomidem, pacienti v druhé skupině obdrželi tutéž kombinaci bez udržovací léčby lenalidomidem a pacienti ve skupině číslo tři pak byli léčeni kombinací obsahující pouze melphalan a prednison. Přestože cílem studie je porovnat vzájemně všechny tři terapeutické kombinace, předběžně prezentovaná data se soustředí především na porovnání RMP R vs MP. ORR dosažená v této studii mluví jednoznačně ve prospěch režimů obsahujících lenalidomid, konkrétně RMP R vs RMP vs MP (77% vs 67% vs 49%, p < 0,001 pro RMP R vs MP) a podobně rychlost nástupu léčebné odpovědi je vyšší u režimů obsahujících lenalidomid. Porovnání PFS s kombinací RMP R vs MP pak ukazuje snížení rizika progrese nemoci o 50% ve prospěch RMP R, PFS je 13,0 měsíců pro skupinu léčenou režimem MP a nebyl ještě dosažen pro RMP R. Nežádoucí účinky vedoucí k přerušení léčby se vyskytly s vyšší incidencí ve skupině léčené lenalidomidem (16% vs 7%), ze závažných komplikací st. 3 a 4 se jednalo především o anemii, trombocytopenii, neutropenii a hlubokou žilní trombózu. Na základě výše uvedeného se zdá, že kombinace RMP s následnou udržovací léčbou lenalidomidem by opravdu mohla představovat nový standard léčby pro pacienty nad 65 let věku s nově diagnostikovaným mnohočetným myelomem [17].
Farmakokinetika
Po perorálním podání dosahuje lenalidomid u zdravých dobrovolníků maximální plazmatické koncentrace po 0,6–1,5 hod a podávání jídla spolu s léčivem u pacientů s mnohočetným myelomem neovlivňuje celkové vstřebané množství léku, jen je díky zpomalené absorpci ovlivněna maximální dosažená koncentrace látky v plazmě, a to o 36% [18]. Jelikož má lenalidomid lineární kinetiku, navýšení množství podané dávky má za následek zvýšení plazmatické koncentrace léku a zvětšení plochy pod křivkou koncentrace čas (AUC). Pokud jde o kompetici o plazmatické bílkoviny séra s jinými látkami, je třeba zmínit, že množství vázané na bílkoviny plazmy není nikterak vysoké a činí přibližně 30%. Rovnovážné plazmatické koncentrace léku bývá dosahováno po čtyřech dnech [19].
Table 2. Nejčastější nežádoucí účinky lenalidomidu ve studiích MM009 a MM010. 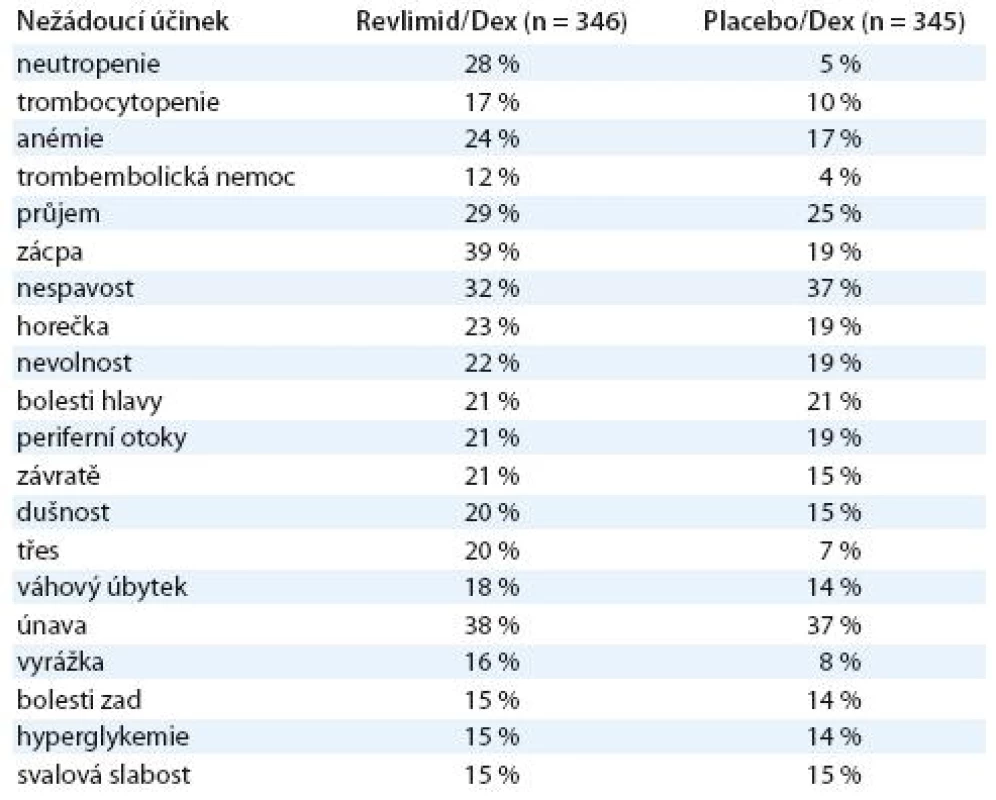
Zkoumání provedená in vitro a na zvířecích modelech pak neprokázala jakékoli ovlivnění cytochromu P 450 a z toho plynoucí ovlivňování farmakokinetiky látek metabolizovaných za pomoci tohoto enzymu. Zdraví dobrovolníci vyloučili přibližně 67% látky v nezměněné formě močí během 24 hod, a je tedy nasnadě, že je třeba zvýšené opatrnosti při užívání látky pacienty s poškozenými ledvinnými funkcemi [20].
Sběr periferních kmenových buněk po předchozí terapii lenalidomidem
Autologní transplantace kmenových buněk představuje vysoce účinnou terapii pacientů s mnohočetným myelomem, a nelze tedy v této souvislosti nezmínit již dříve popisovaný vliv podávání lenalidomidu na úspěšnost následně prováděných sběrů periferních kmenových buněk. Kumar et al podrobili analýze poměrně velkou skupinu pacientů léčených iniciálně kombinací lenalidomidu a dexametazonu s následným sběrem periferních kmenových buněk [21]. Kritériím umožňujícím zařazení do studie vyhovělo 106 pacientů ve věku 27–75 let (medián 60 let), jimž bylo následně podáno 1–13 cyklů chemoterapie (medián počtu cyklů 4). V případě 92 pacientů (87%) byly k mobilizaci kmenových buněk použity samotné růstové faktory (G CSF), u 11 pacientů (10%) pak stimulace cyklofosfamidem v kombinaci s G CSF a v případě 3 pacientů blokátor stromálního receptoru AMD3100. Výsledky analýzy následně ukázaly, že zhoršená schopnost mobilizace kmenových buněk jasně koreluje s rostoucím věkem pacientů a také počtem podaných chemoterapeutických cyklů obsahujících lenalidomid. Dále bylo prokázáno, že u většiny pacientů, u kterých se nezdařila stimulace podáním samotných růstových faktorů, lze dosáhnout úspěchu kombinací cyklofosfamidu a následně podávaných G-CSF, a pokud po podávání G CSF nedojde k dostatečné mobilizaci PBSC, lze toto časně zachytit flowcytometricky a následně zvolit záchranou strategii s podáním AMD3100.
Tato data týkající se vyšší úspěšnosti mobilizace kmenových buněk při použití cyklofosfamidu v kombinaci s G CSF oproti použití G CSF samotných byla posléze potvrzena retrospektivní analýzou provedenou Gertzem et al v souboru obsahujícím 716 pacientů [22].
Na základě těchto dat bylo stanoveno doporučení stimulovat pacienty po více než čtyřech cyklech chemoterapie a nad 70 let věku vždy nejlépe kombinací cyklofosfamidu a růstových faktorů.
Nežádoucí účinky
Ve studiích fáze III (MM 009 a MM 010) byl lenalidomid podáván pacientům s relabovaným mnohočetným myelomem v kombinaci dexametazonem [23]. Při zhodnocení dat z těchto studií je zřejmé, že přerušení léčby pro nežádoucí účinky bylo nutné mnohem častěji ve skupině léčené len + dex (45%) oproti skupině léčené pouze dexametazonem (21%). Nejvýraznějším vedlejším účinkem při podávání lenalidomidu je neutropenie, následovaná trombocytopenií a trombembolickou nemocí. Neutropenie je těžká, vyžaduje často použití růstových faktorů a je s ní spojené vyšší riziko závažných infekčních komplikací. Incidence trombembolické nemoci byla stanovena na 15% (MM 009) a 8,5% (MM 010), nicméně s dobrou ovlivnitelností antikagulancií typu LMWH. Jak bylo zmíněno výše, zásadním problémem se dále zdají být infekční komplikace. Incidence infekčních komplikací stupně II, a tedy nezbytnost léčby ATB terapií u pacientů, činí celých 30%.
Ostatní vedlejší účinky jsou klinicky zpravidla nezávažné. Téměř se nevyskytují nežádoucí účinky typické pro thalidomid (ospalost, třes, zácpa, neuropatie, kožní alergická reakce) a nejcennější skutečností je fakt, že lenalidomid nezpůsobuje polyneuropatii vídanou pravidelně u thalidomidu a bortezomibu. V kontrastu k tomu je zklamáním, že lenalidomid stejně jako jeho mateřská sloučenina thalidomid má teratogenní vlastnosti, a je tedy nezbytné dodržování bezpečnostního programu stanoveného regulačními autoritami v EU i ČR.
Závěr
Lenalidomid je imunomodulační látkou, která patří v současnosti mezi tři nejúčinnější léčiva používaná v léčbě MM. Jeho mimořádná účinnost byla potvrzena výsledky dvou velkých randomizovaných klinických studií fáze III, které byly základem pro schválení jeho použití u nemocných s relapsem MM. Kombinované režimy na bázi lenalidomidu jsou vysoce účinné a probíhají registrační studie pro jejich schválení v primoléčbě MM. Mezi hlavní přednosti lenalidomidu patří vysoká účinnost, akceptovatelný toxický profil s možností dlouhodobého podávání, absence vedlejšího účinku neuropatie a možnost perorálního podávání. V současnosti probíhá optimalizace používaní tohoto léku v terapii mnohočetného myelomu. Cílem je stanovení nejúčinnější kombinace s jinými léky s maximálním léčebným efektem a minimální toxicitou režimu. V klinických studiích je nyní ověřována koncepce dlouhodobé udržovací léčby pomocí tohoto léku. Lenalidomid je lékem, který jako jediný ze stávajících vysoce účinných léků lze používat dlouhodobě po řadu let, neboť jeho toxický profil je velmi příznivý a pacienty je jeho užívání dobře snášeno.
Autoři deklarují, že v souvislosti s předmětem studie nemají žádné komerční zájmy.
The authors declare they have no potential conflicts of interest concerning drugs, pruducts, or services used in the study.Redakční rada potvrzuje, že rukopis práce splnil ICMJE kritéria pro publikace zasílané do biomedicínských časopisů.
The Editorial Board declares that the manuscript met the ICMJE “uniform requirements” for biomedical papers.MUDr. Michal Holánek
Interní hematoonkologická klinika
Fakultní nemocnice Brno
Jihlavská 20
625 00 Brno
e-mail: Erian@email.cz
Sources
1. Bartlett JB, Dredge K, Dalgleish AG. The evolution of thalidomide and its IMiD derivatives as anticancer agents. Nat Rev Cancer 2004; 4(4): 314 – 322.
2. Singhal S, Mehta J, Desikan R et al. Antitumor activity of thalidomide in refractory multiple myeloma. N Engl J Med 1999; 341(21): 1565 – 1571.
3. Knight R. IMiDs: A novel class of immunomodulators. Semin Oncol 2005; 32 (4 Suppl 5): S24 – S30.
4. Marriot JB, Dredge K, Dalgleish AG. Thalidomide derived immunomodulatory drugs (IMids) as potential therapeutic agents. Curr Drug Targets Immune Endocr Metab Disord 2003; 3(3): 181 – 186.
5. Anderson KC. Lenalidomide and Thalidomide: Mechanisms of action – similarities and differences. Semin Hematom 2005; 42 (4 Suppl 4): S3 – S8.
5. Corral LG, Haslett PA, Müller GW et al. Differential cytokine modulation and T ‑ cell activation by two distinct classes of thalidomide analogues that are potent inhibitors of TNF‑alpha. J Immunol 1999; 163(1): 380 – 386.
6. Zeldis JB, Williams BA, Thomas SD et al. S.T.E.P.S.: a comprehensive program for controling and monitoring access to thalidomide. Clin Ther 1999; 21(2): 319 – 330.
7. Richardson PG, Schlossman RL, Keller E et al. Immunomodulatory drug CC ‑ 5013 overcomes drugs resistance and is well tolerated in patients with relapsed multiple myeloma. Blood 2002; 100(9): 3063 – 3067.
8. Richardson PG, Blood E, Mitsiades CS et al. A randomized phase II study of lenalidomide therapy for patients with relapsed or relapsed and refractory multiple myeloma. Blood 2006; 108(10): 3458 – 3464.
9. Richardson PG, Barlogie B, Berenson J et al. SUMMIT Investigators. Clinical factors predictive of outcome with bortezomib in patients with relapsed, refractory multiple myeloma. Blood 2005; 106(9): 2977 – 2981.
10. Weber DM, Chen C, Niesvizky R et al. Multiple Myeloma (009) Study Investigators. Lenalidomide plus dexamethasone for relapsed multiple myeloma in North America. N Engl J Med 2007; 357(21): 2133 – 2142.
11. Baz R, Walker E, Karam MA et al. Lenalidomide and pegylated liposomal doxorubicin‑based chemotherapy for relapsed or refractory multiple myeloma: safety and efficacy. Ann Oncol 2006; 17(12): 1766 – 1771.
12. Morgan GJ, Schey SA, Wu P et al. Lenalidomide (Revlimid), in combination with cyclophosphamide and dexamethasone (RCD), is an effective and tolerated regimen for myeloma patients. Br J Haematol 2007; 137(3): 268 – 269.
13. Richardson PG, Jagannath S, Avigan D et al. Lenalidomide plus Bortezomib (Rev ‑ Vel) in relapsed/ refractory multile myeloma: Final results of a multicenter phase I trial. Proc Am Soc Hematol 2006 (abstr 405).
14. Lacy MQ, Gertz MA, Dispenzieri A et al. Long‑term results of response to therapy, time to progression, and survival with lenalidomide plus dexamethasone in newly diagnosed myeloma. Mayo Clin Proc 2007; 82(10): 1179 – 1184.
15. Niesvizky R, Jayabalan DS, Christos PJ at al. BiRD (Biaxin [clarithromycin]/ Revlimid [lenalidomide]/ dexamethasone) combination therapy results in high complete ‑ and overall‑response rates in treatment ‑ naive symptomatic multiple myeloma. Blood 2008; 111(3): 1101 – 1109.
16. Palumbo A, Falco P, Corradini P et al. GIMEMA ‑ Italian Multiple Myeloma Network. Melphalan, Prednisone and Lenalidomide treatment for newly diagnose myeloma: A report from GIMEMA ‑ Italian Multiple Myeloma Network. J Clin Oncol 2007; 25(28): 4459 – 4465.
17. Palumbo A, Dimopoulos MA, Delforge M et al. A phase III study to determine the efficacy and safety of lenalidomide in combination with melphalan and prednisone (MPR) in elderly patients with newly diagnosed multiple myeloma. Program and abstracts of the 51st American Society of Hematology Annual Meeting and Exposition. Louisiana 2009: Abstract 613.
18. Kastritis E, Dimopoulos MA. The evolving role of lenalidomide in the treatment of hematologic malignancies. Expert Opin Pharmacother 2007; 8(4): 497 – 509.
19. Richardson PG, Schlossman RL, Weller E et al. Immunomodulatory drug CC ‑ 5013 overcomes drugs resistence and is well tolerated in patients with relapsed multiple myeloma. Blood 2002; 100(9): 3063 – 3067.
20. Weber DM, Spenser A, Wang M et al. The efficacy and safety of lenalidomide plus dexamethasone in relapsed or refractory multiple myeloma patients with impaired renal function. J Clin Oncol 2008; 26: Abstr. 8542.
21. Gertz MA, Kumar SK, Lacy MQ et al. Comparison of high‑dose CY and growth factor with growth factor alone for mobilization of stem cells for transplantation in patients with multiple myeloma. Bone Marrow Transplant 2009; 43(8): 619 – 25.
22. Kumar S, Lacy MQ, Dispenzieri A et al. Stem cell mobilization folowing initial therapy with lenalidomide and dexamethasone in patiens with newly diagnosed multiple myeloma. Blood 2008; 112 : 3467 (ASH Annual Meeting Abstracts).
23. Dimopoulos M, Spencer A, Attal M et al. Lenalidomide plus dexamethasone for relapsed or refractory multiple myeloma. N Engl J Med 2007; 357(21): 2123 – 2132.
Labels
Paediatric clinical oncology Surgery Clinical oncology
Article was published inClinical Oncology

2010 Issue 2-
All articles in this issue
- Soudobý pohled na léčbu jaterních metastáz kolorektálního karcinomu
- Radioterapie lůžka prostaty – kdy a co léčit?
- Detekce sentinelové uzliny u pacientek s karcinomem endometria s využitím hysteroskopie
- Použití lenalidomidu v léčbě mnohočetného myelomu
- Monitorace efektivity chirurgické léčby maligních pleurálních výpotků
- Nízkodávková rádioterapia v liečbe plantárnej fasciitídy
- Naše skúsenosti s analýzou génu PTEN u pacientov s podozrením na Cowdenovej syndróm
- Liečba rekurentného karcinómu ovária – retrospektívna analýza
- Vakcinace proti lidskému papillomaviru v ČR
- Cirkulujúce nádorové bunky u rakoviny prsníka – prehľad
- Clinical Oncology
- Journal archive
- Current issue
- Online only
- About the journal
Most read in this issue- Nízkodávková rádioterapia v liečbe plantárnej fasciitídy
- Radioterapie lůžka prostaty – kdy a co léčit?
- Detekce sentinelové uzliny u pacientek s karcinomem endometria s využitím hysteroskopie
- Naše skúsenosti s analýzou génu PTEN u pacientov s podozrením na Cowdenovej syndróm
Login#ADS_BOTTOM_SCRIPTS#Forgotten passwordEnter the email address that you registered with. We will send you instructions on how to set a new password.
- Career

