-
Medical journals
- Career
Nízkodávková rádioterapia v liečbe plantárnej fasciitídy
: E. Hajtmanová 1; I. Kinclová 1; Ľ. Kostková 1; Hajtman Andrej 2; M. Péč 3
: Onkologické centrum, Martinská fakultná nemocnica, Martin, Slovenská republika 1; Súdno‑ lekárske pracovisko Úradu pre dohľad nad zdravotnou starostlivosťou, pobočka Martin, Slovenská republika 2; Ústav lekárskej biológie JLF UK Martin, Slovenská republika 3
: Klin Onkol 2010; 23(2): 104-110
: Original Articles
Cieľ:
Vyhodnotenie analgetického efektu nízkodávkovej rádioterapie v liečbe plantárnej fasciitídy. Analýza prognostických faktorov liečby. Metódy: V retrospektívnej analýze bolo sledovaných 273 pacientov. Hodnotili sme analgetický efekt I. a II. série liečby s režimom celkovej dávky žiarenia 4,0 Gy, s dávkou na frakciu 1,0 Gy, aplikovanú 2 – 3krát za týždeň. Interval sledovania liečebnej odpovede bol 3 mesiace. Súčasne sme v 323 prípadoch plantárnej fasciitídy hodnotili prognostické faktory: vek, pohlavie pacientov a trvanie bolesti pred liečbou.Výsledky:
Analgetický efekt celkovej dávky 4,0 Gy bol po I. sérii liečby 55,7 % a po II. sérii liečby 74,8 %. Výsledky boli porovnateľné s publikovanými údajmi. Z hodnotených prognostických faktorov malo signifikantný vplyv na liečbu trvanie bolesti kratšie ako 6 mesiacov. Vplyv veku bol tiež signifikantný, s benefitom vo vekovej skupine pacientov mladších ako 50 rokov.Záver:
Získané výsledky potvrdzujú dobrý analgetický efekt dávkového režimu aplikovaného v našej skupine 273 pacientov. Z analýzy hodnotenia prognostických faktorov vyplýva vyšší benefit liečby v akútnom štádiu plantárnej fasciitídy. U mladých pacientov je však nutné zvažovať potenciálne riziká rádioterapie oproti iným liečebným alternatívam.Kľúčové slová:
plantárna fasciitída – nízkodávková rádioterapia – prognostické faktoryÚvod
Plantárna fasciitída je jednou z najčastejších príčin bolestí v oblasti pätnej kosti. Bolestivý syndróm pätnej kosti popísal už v roku 1900 nemecký chirurg Plettner. Ako prvý použil anatomický termín „Kalkaneussporn“. Vo svojej rádio ‑ morfologickej štúdii opísal exostózu pätnej kosti v plantárnej oblasti a označil ju ako plantárna pätná ostroha – „plantar heel spur“ [1]. Pre synonymicky používané pojmy – plantárna ostroha alebo syndróm ostrohy pätnej kosti, „heel spur syndrom“ (HSS) – bol v anglo ‑ amerických krajinách zaužívaný termín plantárna fasciitída – „plantar fasciitis“ [2].
Bolesť pätnej kosti – kalkaneodýnia – sa objavuje asi od 8. roku života až do neskorého veku. Maximum výskytu je v strednom veku, u pacientov nad 40 rokov. Bolesti sa prejavujú na rôznych miestach päty a môžu byť spôsobené príčinami zápalovými, metabolickými, neurogénnymi, útlakovými alebo degeneratívnymi. V detskom veku vznikajú spontánne v súvislosti s rastovým vývojom spojivového tkaniva. V dospelom veku sa vyskytujú prevažne ako dôsledok degeneratívnych zmien [3].
Najčastejšou príčinou bolesti pätnej kosti u dospelých je plantárna fasciitída, tendinitída Achillovej šľachy a retrokalkaneálna burzitída. Ďalšími príčinami môžu byť syndróm tarzálneho tunela, atrofia tukového vankúšika pod pätnou kosťou, únavová zlomenina pätnej kosti, zlomenina spôsobená kostnou cystou, primárnym zhubným nádorom pätnej kosti alebo metastázou. Menej častou príčinou kalkaneodýnie je osteomyelitída pätnej kosti, systémové zápalové ochorenia kĺbov, séronegatívna spondylartropatia, ankylozujúca spondylitída, psoriatická artritída, reaktívna artritída a artritída pri nešpecifickom črevnom zápale. Reumatoidná artritída môže postihovať pätnú kosť a priľahlé štruktúry, ale izolovaná bolesť päty je v tomto prípade neobvyklá, lebo postihnutie chodidla je už prejavom pokročilej choroby [4].
Plantárna fasciitída je najčastejšou príčinou kalkaneodýnie dospelých. Je spôsobená opakovaným neúmerným zaťažovaním alebo náhlym preťažením inzercie plantárnej fascie na pätnú kosť [5]. Napriek tomu, že termín fasciitída označuje zápal, najnovší výskum ukázal, že sa jedná o nezápalový degeneratívny proces, myxoidnú degeneráciu a fragmentáciu plantárnej fascie. Vhodnejším označením by malo byť „plantárna fascióza“ [6]. Typickým prejavom plantárnej fasciitídy je postupný vznik bolesti v plantárnej oblasti, ktorá sa zhoršuje pri prvých krokoch typicky ráno, alebo po dlhšom sedení. Vo väčšine prípadov je bolesť spojená s patologickou exostózou v oblasti proximálnej plantárnej fascie, označovanou ako ostroha pätnej kosti – calcar calcanei [7]. Exostózy pätnej kosti boli zistené aj u asymptomatických osôb, sú nešpecifické, a preto sa nemôžu považovať za jednoznačnú príčinu bolestí pätnej kosti [8]. Dôležitú úlohu v patogenéze exostózy hrá chronické poškodenie alebo kontinuálna mikrotrauma v oblasti inzercie plantárnej aponeurózy. Chronické poškodenie spôsobuje zníženie elasticity chrupavky v mieste inzercie, jej trhliny s inváziou mezenchymálnych buniek a tvorbu jazvovitého tkaniva s následnou osifikáciou [1]. Za hlavnú príčinu stimulácie rastu exostózy sa považuje kombinácia tlaku telesnej váhy a trakčných mechanizmov [9]. Z uvedeného vyplýva, že bolesť pätnej kosti je spôsobená kombináciou viacerých klinických entít. Pre zmätok v terminológii bol navrhnutý Bartoldom [10] v roku 2003, podobne ako v minulosti Plettnerom, názov „plantar heel pain syndrome“ (PHPS).
Plantárna fasciitída patrí medzi bolestivé stavy pohybového aparátu, ktoré dokážu postihnutého nadlho vyradiť z bežných fyzických aktivít. V prípade neúspešnej liečby prebieha často pod obrazom syndrómu chronickej nepotlačiteľnej bolesti s ďalekosiahlymi psychosociálnymi dopadmi. V liečbe plantárnej fasciitídy sa uplatňujú rôzne liečebné postupy. Okrem redukcie telesnej hmotnosti v prípadoch obezity sú to ortézy, individuálne vytvarované vložky do topánok, rôzne typy fyzioterapie a elektrofyzikálnej liečby, lokálna infiltrácia steroidmi alebo anestetikami, perorálne nesteroidné antireumatiká, iontoforéza, laser a ultrazvuková terapia. V poslednej dobe sú to extrakorporálne nárazové Machove vlny (extracorporeal shock wave therapy – ESWT). Chirurgická intervencia indikovaná pri refraktérnych stavoch so syndrómom chronickej bolesti je však zaťažená vysokým rizikom komplikácií. Napriek širokej škále uplatňovaných liečebných metód však žiadna z nich nepriniesla presvedčivé výsledky [11].
Nenádorová nízkodávková rádioterapia je liečbou voľby plantárnej fasciitídy. Početné retrospektívne štúdie potvrdili analgetický efekt nízkych dávok rádioterapie u 65–90 % pacientov [12]. V indikovaných prípadoch je nízkodávková rádioterapia efektívnou liečebnou metódou s nízkym rizikom vedľajších účinkov. Je tiež ekonomicky relatívne výhodná.
Základné zásady nenádorovej rádioterapie sú: aplikovať čo najmenšiu a zároveň najefektívnejšiu jednotlivú a celkovú dávku žiarenia, zvažovať indikáciu ožiarenia veľkými poľami, použiť jednoduché techniky ožarovania, orientovať zväzok žiarenia smerom od trupu pacienta a od rádiosenzitívnych orgánov (štítna žľaza, gonády, očná šošovka), v prípade potreby používať individuálnu úpravu tvaru ožarovaných polí, používať ochranné prostriedky (hlavne u RTG terapie, napr. olovené krytie testes, olovený límec na oblasť krku, olovenú zásteru na oblasť panvy), vek pacienta by mal byť vyšší ako 40 rokov [13]. U mladých pacientov je nutné zvážiť riziká nežiaducich účinkov žiarenia oproti iným liečebným alternatívam [14].
Nenádorovú rádioterapiu odporúča odborník iného odboru, v prípade plantárnej fasciitídy napríklad ortopéd, rehabilitačný lekár alebo reumatológ. Indikáciu však potvrdzuje radiačný onkológ, ktorý berie do úvahy absolútne i relatívne kontraindikácie liečby ionizujúcim žiarením [13].
Absolútne kontraindikácie nenádorovej rádioterapie sú: nejasná a neoverená diagnóza, kožné zmeny v ožarovanom polispôsobené aplikáciou dráždivých látok alebo poškodením kože (poleptanie, popálenie, omrzliny), miestna infiltrácia kortikoidmi menej ako 4 týždne pred rádioterapiou, ožarovanie imobilných pacientov v oblasti ohrozenej vznikom dekubitov, predchádzajúca rádioterapia v rovnakej lokalizácii, ak nie sú spoľahlivé údaje o spôsobe ožarovania a dávke žiarenia, tehotenstvo, hematologické ochorenia, ožarovanie detí a mladistvých.
Relatívne kontraindikácie nenádorovej rádioterapie sú: ožarovanie osôb pracujúcich s ionizujúcim žiarením, ožiarenie po predchádzajúcej nenádorovej rádioterapii na inom pracovisku [15].
Každý pacient je plne informovaný o spôsobe aplikovanej liečby, o prípadných možných akútnych a neskorých nežiaducich účinkoch nízkodávkovej rádioterapie a podpisuje informovaný súhlas s liečbou.
Materiál a metódy
Nenádorová rádioterapia má v Martinskej fakultnej nemocnici dlhoročnú tradíciu. Prvé záznamy o využití röntgenového žiarenia na liečbu neonkologických ochorení sú z 20. rokov minulého storočia. Do roku 2009 bolo podľa archivovaných záznamov liečených 62 056 pacientov, ktorí absolvovali 184 163 liečebných sérií.
Sledovaní pacienti boli v Onkologickom centre Martinskej fakultnej nemocnice (OC MFN) liečení nízkodávkovou rádioterapiou v čase od februára do novembra 2007. Z celkového počtu 273 liečených pacientov bolo 60 mužov a 213 žien. Priemerný vek liečených bol 56 rokov (od 38 do 92 rokov) (graf 1). Pacientom odporučil liečbu žiarením najčastejšie ortopéd, rehabilitačný lekár, reumatológ, chirurg a obvodný lekár.
Celkove bol analyzovaný súbor 323 prípadov plantárnej fasciitídy, z toho 158 vpravo a 165 vľavo. U 50 pacientov boli liečené obe päty súčasne.
Priemerné trvanie bolestí pred nenádorovou rádioterapiou bolo 7 mesiacov (od 1 mesiaca do 2 rokov). 168 pacientov udávalo trvanie bolestí ≤ 6 mesiacov a 105 viac ako 6 mesiacov.
Z celkového počtu len 4 % pacientovnedostali pred ožarovaním žiadnu liečbu.Ostatní pacienti absolvovali jednu alebo viac liečebných metód: obstrek lokálnym anestetikom/ steroidom, magnetoterapiu, iontoforézu, elektroliečbu, laserterapiu, rázové vlny, p.o. antiflogistiká, lok. gély a maste.
Kritériom indikácie nízkodávkovej rádioterapie bolo fyzikálne vyšetrenie, röntgenové vyšetrenie chodidla a dodržanie absolútnych kontraindikácií liečby. Pacienti boli informovaní o charaktere, spôsobe liečby a jej možných vedľajších účinkoch, čo potvrdili podpisom informovaného súhlasu. Zvláštna pozornosť bola venovaná ženám vo fertilnom veku. Každá pacientka bola poučená o dôležitosti presného určenia dňa jej menštruačného cyklu (ako prvý deň cyklu sa počíta prvý deň menštruačného krvácania) v čase začatia liečby žiarením. Po 10. dni pravidelného menštruačného cyklu alebo v prípadoch nepravidelného menštruačného cyklu bola poučená o tom, že nie je možné vylúčiť tehotenstvo, a teda i riziko radiačného poškodenia plodu. V uvedených prípadoch súhlasila väčšina z poučených so zmenou termínu liečby. Ostatné pacientky podpísali súhlas, že vedome absolvujú liečbu aj napriek tomuto riziku.
Interval zhodnotenia analgetického účinku liečby bol 3 mesiace. V prípade pretrvávania bolesti bola indikovaná II. séria nenádorovej rádioterapie za dodržania tých istých podmienok liečby. V torpídnych prípadoch bola u pacientov po ďalšom trojmesačnom intervale aplikovaná III. séria liečby. Nenádorová rádioterapia bola obmedzená celkove na tri ožarovacie série na tú istú oblasť.
Zdrojom žiarenia bol ožarovací prístroj Cesiotherax 3N, ktorý využíva izotop cézia – 137Cs. Pacienti boli ožarovaní v stabilizovanej polohe na boku. Olovené tienenie bolo umiestnené na oblasť štítnej žľazy a oblasť malej panvy – gonád. Ožarovanie bolo realizované jedným priamym poľom bez simulácie, vzdialenosť SSD (vzdialenosť od zdroja po povrch kože) bola 40 cm. Ožarovaný objem bol ohraničený na plantárnu oblasť pätnej kosti s úponom plantárnej fascie a dorzálnu oblasť pätnej kosti s úponom Achillovej šľachy (obr. 1). Rozmer ožarovacieho poľa bol v priemere 10 × 8 cm, ožarovaný objem bol priemerne 480 cm3. Celková dávka žiarenia počítaná do stredu pätnej kosti (2,5 – 3,5 cm od povrchu kože) bola 4,0 Gy s dávkou na frakciu 1,0 Gy, aplikovanou 2 – 3krát v týždni.
Štatistická analýza
Analgetický účinok liečby bol vypočítaný pomocou Kaplan ‑ Meierovej metódy ako krivka času do vzniku udalosti (za udalosť sa považuje pretrvávanie, resp. návrat bolesti). Vplyv prognostických faktorov na úspešnosť liečby bol vyhodnotený pomocou Mantel ‑ Coxovho log‑rank testu. Všetky p ‑ hodnoty boli výsledkom týchto štatistických testov, za štatisticky významné boli považované hodnoty p < 0,05. Na spracovanie a štatistickú analýzu všetkých údajov bola využitá aplikácia SPSS/ PC Software package, verzia 17.0.
Výsledky
Úspešnosť liečby
Z celkového počtu 323 prípadov plantárnej fasciitídy bol po prvej sérii liečby nízkodávkovou rádioterapiou dosiahnutý analgetický účinok u 180 prípadov. Úspešnosť liečby po troch mesiacoch od podania prvej série bola podľa Kaplan ‑ Meierovej analýzy 55,7 %.
V prípade pretrvávania bolesti bola v súbore 143 sledovaných prípadov podaná II. séria nízkodávkovej rádioterapie. Úspešnosť liečby v tomto súbore bola po 3 mesiacoch od podania II. série 74,8 %. Porovnanie I. a II. série pomocou log‑rank testu ukázalo, že II. séria bola úspešnejšia (p < 0,001).
Analýza prognostických faktorov
Zhodnotenie prognostických faktorov, ktoré mali vplyv na analgetický účinok, bolo uskutočnené po troch mesiacoch od podania prvej série ožarovania. Sledované boli prognostické faktory – dĺžka trvania bolesti, vek a pohlavie pacientov (tab. 1). Dĺžka trvania bolestí pred liečbou bola významným prognostickým faktorom úspešnosti liečby. Pri anamnéze bolesti dlhšej ako šesť mesiacov bola úspešnosť 33,6 % prípadov fasciitídy v porovnaní s 70,8 % pri anamnéze bolesti ≤ 6 mesiacov (p < 0,001). U pacientov mladších ako 50 rokov bola úspešnosť 69,4 % prípadov porovnaní s 51,8 % úspešnosťou u starších pacientov (≥ 50 - roční) (p = 0,008). Pohlavie pacientov nemalo signifikantný vplyv na analgetický efekt (p = 0,142).
1. Analýza prognostických faktorov. 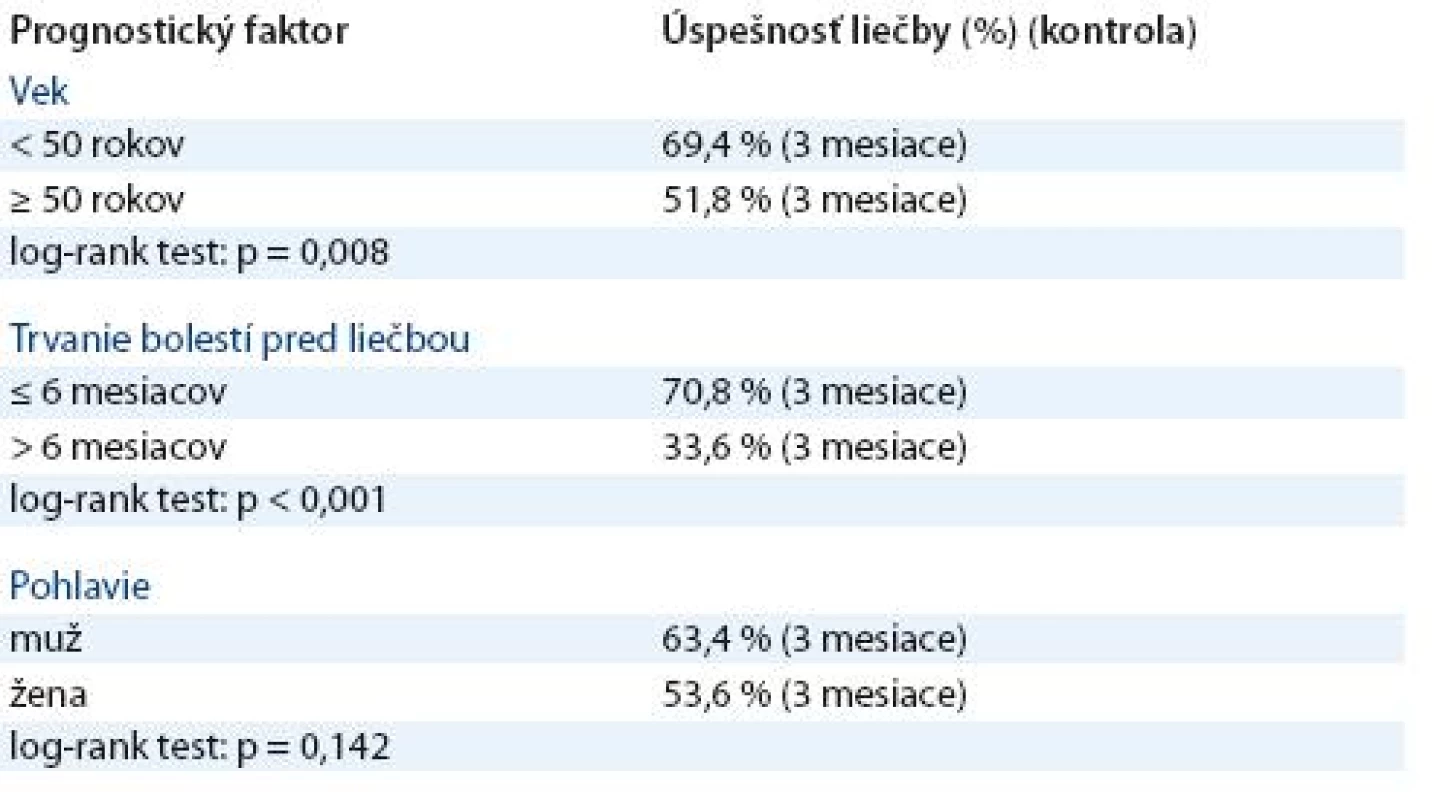
Pacienti ≥ 50 rokov
V súvislosti s nižšou pravdepodobnosťou neskorých vedľajších účinkov sme hodnotili súbor prípadov plantárnej fasciitídy u pacientov ≥ 50 rokov. V súbore 251 prípadov s kratším trvaním bolesti ako šesť mesiacov bola po troch mesiacoch od I. série úspešnosť 66,0 % oproti 31,7 % u pacientov s chronickou bolesťou (viac ako šesť mesiacov) (p < 0,001).
Diskusia
Nízkodávková rádioterapia je efektívnou liečbou syndrómu bolestivej päty. Využíva sa hlavne v Nemecku, kde má asi 100 - ročnú tradíciu, a v štátoch strednej a východnej Európy. V severnej Európe a anglo ‑ amerických krajinách je však spojená so značným skepticizmom [16]. Dôvodom je skutočnosť, že aj napriek dobrým liečebným výsledkom dlhodobo chýbajú prospektívne klinické štúdie s významnou úrovňou dôkazu a obava z vedľajších účinkov liečby, zvlášť u mladých pacientov [17]. V roku 1995 bola v Nemecku spolu so spoločnosťou German Radiation Oncology Society založená pracovná skupina German Working Group on Radiotherapy of Benign Diseases, ktorej cieľom bolo vypracovať liečebné odporúčania nenádorovej rádioterapie [18]. V roku 1999 boli pre jednotlivé diagnózy stanovené úrovne dôkazu a stupne odporúčania liečby vychádzajúce z medzinárodnej škály „evidence based medicine“ [19 – 20]. Na ESTRO konferencii v Nice z roku 2005, venovanej rádioterapii nenádorových ochorení, došlo k zhode v rozdelení jednotlivých diagnóz do troch kategórií:
- A – dostatočný dôkaz, akceptácia indikácie na obvyklom základe,
- B – dôkaz je nejednoznačný, indikácia je len v súvise s klinickým dôkazom,
- C – dôkaz je nedostatočný, indikácia je neprijateľná na obvyklom základe.
Do kategórie A bola zaradená nízkodávková rádioterapia plantárnej fasciitídy len pre pacientov vo vyššom veku ( > 50 rokov ), v prípadoch zlyhania iných liečebných metód. Pre mladších pacientov bola nenádorová rádioterapia plantárnej fasciitídy zaradená do kategórie B. Dôvodom bolo nedostatočné porovnanie analgetickej liečby lokálnymi steroidnými obstrekmi a nízkodávkovej rádioterapie [21].
Plantárna fasciitída patrí medzi najčastejšie diagnózy liečené v Onkologickom centre Martinskej fakultnej nemocnice nenádorovou rádioterapiou. Analgetický efekt nízkodávkovej rádioterapie po prvej sérii liečby bol v našej skupine porovnateľný s výsledkom skupiny Miszczyka et al [22], ktorí hodnotili ústup bolesti u 52 % prípadov. Opačný efekt liečby ako v našej skupine publikovali Mücke et al [1]. Analgetický efekt I./ II. série liečby bol 69,7 %/ 32,2 % prípadov. Vysvetľujú to pravdepodobne nevhodným výberom pacientov sledovanej skupiny. Analgetický efekt bol hodnotený v tejto retrospektívnej štúdii až 103 mesiacov po liečbe žiarením. Početné publikované údaje retrospektívnych štúdií v rozmedzí 60–90 % úspešnosti liečby sú ťažko porovnateľné pre rôzne časové intervaly hodnotenia analgetického efektu od ukončenia liečby [5]. Zdrojmi žiarenia používanými v týchto štúdiách boli ortovoltové terapeutické röntgeny, megavoltové lineárne urýchľovače, kobaltové a céziové ožarovacie prístroje, podobne ako na našom pracovisku. Rádioizotopové zdroje žiarenia sa však už používajú obmedzene a sú nahrádzané röntgenovými terapeutickými prístrojmi. Výmenu céziového prístroja plánujeme aj na našom pracovisku. Dôvodom je ekonomická záťaž pri likvidácii izotopu. Hodnotenia účinnosti liečby v súvislosti s použitím rôznych ožarovacích prístrojov sú nejednoznačné. Mücke et al [1] hodnotí použitie megavoltovej techniky v ich multicentrickej štúdii ako priaznivý prognostický faktor. Benefit vysvetľujú homogénnejším rozložením dávky megavoltového žiarenia v porovnaní s ortovoltovou terapiou. Problémom však môže byť ekonomická náročnosť liečby. Naproti tomu Schlöcker et al [23] sledovaním analgetického efektu v skupine 289 pacientov, z toho 137 liečených ortovoltovou – 200 kV terapiou a 152 lineárnym urýchľovačom – 6 MV s celkovou dávkou 5 – 6 Gy, nezistili rozdiely medzi oboma skupinami liečených. V tab. 2 uvádzame prehľad literárnych údajov efektivity nízkodávkovej rádioterapie v liečbe plantárnej fasciitídy. Problémom porovnateľnosti výsledkov je nejednotná charakteristika hodnotených skupín.
2. Prehľad literárnych údajov efektivity nízkodávkovej rádioterapie (upravené podľa Mücke R et al [1]). ![Prehľad literárnych údajov efektivity nízkodávkovej rádioterapie (upravené podľa Mücke R et al [1]).](https://www.prolekare.cz/media/cache/resolve/media_object_image_small/media/image/b861b9bda3b97e230ea49042cbaa4ce2.jpg)
Analgetický efekt celkovej dávky žiarenia 4 Gy aplikovanej v našej skupine pacientov bol podľa Kaplan ‑ Meierovej analýzy 55,7%. V prospektívnej štúdii Seegenschmiedt et al [24] hodnotili tri dávkové režimy. V 72 prípadoch bola aplikovaná celková dávka 12 Gy v dvoch sériách po 6 × 1 Gy počas dvoch týždňov, 50 pacientov dostávalo 10 × 0,3 Gy a v 48 prípadoch bola použitá schéma 10 × 0,5 Gy. Najlepšie odpovede boli dosiahnuté v poslednej skupine s celkovou dávkou 5 Gy. Potvrdila to aj retrospektívna štúdia Mückeho et al [1] z roku 2007, ktorá hodnotila prognostické faktory v skupine 502 pacientov. Počas 5 - ročného sledovania bol analgetický efekt zaznamenaný u 86,2 % pacientov. Celková dávka 12 Gy nepriniesla lepšie výsledky. V dlhodobom horizonte sledovania mala aplikácia celkovej dávky 5 Gy a 12 Gy lepšie výsledky ako celková dávka 3 Gy, s dávkou na frakciu 0,3 Gy. Jednorazová dávka 0,3 Gy sa neodporúčala, pretože je považovaná za prahovú dávku pre tkanivovú alkalózu, ktorá je podľa viacerých autorov hlavnou príčinou úľavy bolesti. Väčšina autorov odporúča jednotlivé dávky na frakciu v rozmedzí 0,3–0,5 Gy do celkovej dávky 3–6 Gy. Efekt vyšších jednotlivých a celkových dávok žiarenia je zatiaľ nejednoznačný [1]. Dôležitú úlohu má okrem dávok žiarenia aj časový odstup aplikácie jednotlivých frakcií. Arenas et al [25] sledovali dynamiku protizápalového efektu nízkodávkovej rádioterapie v experimentálnej in vivo štúdii. Hodnotili časový priebeh poklesu adhézie leukocytov na bunky endotelu a vzostup produkcie rastového faktoru TGF‑b1 ako potenciálneho mediátora. Na základe výsledkov doporučili ako najoptimálnejší frakcionačný režim s 3 frakciami za týždeň.
Celková dávka žiarenia 4,0 Gy, dlhodobo aplikovaná na našom pracovisku, patrí k najnižším odporučeným dávkam [26]. Pomerne široké rozmedzie odporučených dávok žiarenia [13] nám dáva priestor na využitie iných dávkových režimov. Na vyhodnotenie efektu jednotlivých liečebných režimov považujeme za vhodnú schému Calcaneodynia ‑ Score, vypracovanú German Cooperative Group (GCG) [27] s vizuálnou analógovou škálou bolesti (VAS).
Prognostické faktory – vek, pohlavie pacientov a anamnéza bolesti pred liečbou, na ktoré sme sa zamerali v našej skupine pacientov, boli hodnotené v mnohých publikovaných prácach. V retrospektívnej štúdii Mücke et al [1] zaznamenali výrazne lepšie výsledky u pacientov starších ako 58 rokov – 81,3 % oproti 47,9 % s intervalom sledovania 103 mesiacov. Podľa autorov môže ísť pravdepodobne o zmenu nocicepcie vo vyššom veku a z pohľadu rádiobiológov o narušenie oxidatívnych procesov v súvislosti s vekom. Benefit nízkodávkovej rádioterapie u pacientov starších ako 50 rokov zaznamenali v prospektívnej štúdii aj Schneider et al [26], čo sme potvrdili aj v našej skupine pacientov.
Trvanie bolesti do 6 mesiacov pred liečbou bolo v mnohých prácach hodnotené ako priaznivý prognostický faktor nízkodávkovej rádioterapie plantárnej fasciitídy [1,8,11,23,24,28]. Benefit liečby v akútnom štádiu bol jednoznačný aj v našej skupine pacientov. Aj na základe benefitu prognostických faktorov – veku a trvania bolesti pred liečbou – je nízkodávková rádioterapia optimálnou liečbou prvej voľby u starších pacientov.
Rádiobiologický výskum v posledných rokoch potvrdil, že analgetický a protizápalový účinok nízkych dávok žiarenia je výsledkom komplexných interakcií rôznych efektov. Staršie teórie popisovali vplyv nízkych dávok žiarenia na vaskulárny endotel, deštrukciu zápalových elementov, hlavne lymfocytov, za pôsobenia cytokínov a proteolytických enzýmov, vplyv na zvýšenie membránovej permeability a zmenu pH ožarovaného tkaniva. Novšie teórie vysvetľujú účinok nízkodávkovej rádioterapie na molekulárnej a celulárnej úrovni ako ovplyvnenie molekulárnej adhézie, apoptózy, expresie cytokínov a zápalových kaskád [11,29]. Niektorí autori zaznamenali zvýraznenie bolesti počas ožarovania, čo sme zistili u viac ako 50 % našich pacientov. Zdôvodnením je pravdepodobne prechodné zvýšenie acidózy v ožarovanej oblasti [1].
Obavy z miestnych nežiaducich účinkov nízkodávkovej rádioterapie aplikovanej na oblasť pätných kostí sú podľa publikovaných údajov nadhodnotené [12,21,30]. Na našom pracovisku, s dlhoročnou tradíciou nenádorovej rádioterapie, sme doteraz nezaznamenali žiadne nežiaduce účinky liečby alebo podozrenia z poškodenia plodu u žien v súvislosti s nízkodávkovou rádioterapiou, resp. z vzniku sekundárnej malignity v ožarovanej oblasti. Micke et al [11] napríklad nezaznamenali žiadne sekundárne malignity po dobu sledovanosti 28 rokov. Doteraz nebola publikovaná žiadna lokálna toxicita ani indukcia zhubnej nádorovej choroby po celkových dávkach v rozmedzí 3 – 12 Gy. Dávka žiarenia na oblasť pohlavných žliaz bola porovnateľná s dávkou pri rádiodiagnostických vyšetreniach [8]. Podľa koncepcie efektívnej dávky žiarenia, definovanej Medzinárodnou komisiou pre rádiologickú ochranu – Internal Commision on Radiological Protection (ICRP) – sa riziko kancerogenézy u starších pacientov ešte znižuje faktorom 3 [31]. Napriek intenzívnemu výskumu v posledných rokoch však stále nie je známa presná kvantifikácia rizika sekundárnych malignít [32 – 34].
Záver
Výsledky našej retrospektívnej analýzy potvrdzujú dobrý analgetický efekt nízkodávkovej rádioterapie plantárnej fasciitídy. Vzhľadom na výraznejší efekt v akútnom štádiu fasciitídy je indikácia liečby najoptimálnejšia počas prvých 6 mesiacov trvania bolesti. U starších pacientov by preto nízkodávková rádioterapia nemala byť považovaná za poslednú možnosť liečby. Pomerne široké dávkové rozmedzie s možnosťou rôznych frakcionačných režimov je však nutné zhodnotiť v prospektívnych štúdiách. U mladých pacientov je potrebné zvažovať potenciálne riziká rádioterapie oproti iným liečebným alternatívam.
Autoři deklarují, že v souvislosti s předmětem studie nemají žádné komerční zájmy.
The authors declare they have no potential conflicts of interest concerning drugs, pruducts, or services used in the study.Redakční rada potvrzuje, že rukopis práce splnil ICMJE kritéria pro publikace zasílané do bi omedicínských časopisů.
The Editorial Board declares that the manuscript met the ICMJE “uniform requirements” for biomedical papers.MUDr. Eva Hajtmanová, PhD.
Onkologické centrum MFN
Martinská fakultná nemocnica
Kollárova 2
036 59 Martin Slovenská republika
e-mail: hajtmanova@mfn.sk
Sources
1. Mücke R, Micke O, Reichl B et al. Demographic, clinical and treatment related predictors for event‑freee probability following low dose radiotherapy for painful heel spurs – a retrospective multicenter study of 502 patients. Acta Oncol 2007; 46(2): 239 – 246.
2. Furey JG. Plantar fasciitis (The painful heel syndrome). J Bone Joint Surg A 1975; 57 : 672 – 673.
3. Borrosch D, Berning W, Micke O. On the diagnostic Imaging of heel spurs. Benign News 2001; 2(2): 27 – 28.
4. Tracy A. Diagnostika bolestí paty u dospelých. Medicína po promoci 2004; 5(6): 19 – 23. Dostupné z: https:/ / www.zdravcentra.sk/ cps/ rde/ xbcr/ zcsk/ 6 – 2004_04_SI.pdf.
5. Miszczyk L, Jochymek B, Wozniak G. Retrospective evaluation of radioherapy in plantar fasciitis. Brit J Radiol 2007; 80 : 829 – 834.
6. Lemont H, Ammirati KM, Usen N. Plantar fasciitis a degenerative (fasciosis) without inflammation. J Am Podiatr Med Assoc 2003; 93(3): 234 – 237.
7. Brown C. A review of subcalcaneal heel pain and plantar fasciitis. Aust Fam Physician 1996; 25(6): 875 – 881.
8. Niewald M, Seegenschmiedt MH, Micke O et al. Randomized multicenter trial on the effect of radiotherapy for plantar fasciitis (painful heel spur) using very low doses – a study protocol. Phys Oncol 2008; 3 : 27 – 32.
9. Smith S, Tinley S, Gilheany M et al. The inferior calcaneal spur – anatomical and histological considerations. The Foot 2007; 17(1): 25 – 31.
10. Bartold SJ. The plantar fascia as source of pain – biomechanics, presentation and treatment. J BodyWork Mov Ther 2004; 8(3): 214 – 226.
11. Micke O, Seegenschmiedt MH. German Cooperative Group on Radiotherapy for Benign Diseases. Radiotherapy in painful heel spurs (plantar fasciitis) – results of a national patterns of care study. Int J Radiat Oncol Biol Phys 2004; 58(3): 828 – 843.
12. Schäfer U, Micke O, Glashorsters M et al. The radiotherapy treatment of painful calcaneal spurs. Strahlenther Oncol 1995; 171(4): 202 – 206.
13. Národní radiologické standardy – radiační onkologie/ radioterapie. Návrh k 6. 11. 2007 : 59 – 60. Dostupné z: http:/ / www.srobf.cz/ dokumenty/ standard_RT_11_2007.doc.
14. Šlampa P a kol. Radiační onkologie v praxi. 2. vyd. Brno: Masarykův onkologický ústav 2007 : 238 – 242.
15. Kvech J, Růžičková J, Šlampa P et al. Nenádorová rádioterapie. In: Šlampa P, Petera J et al. Radiační onkologie. Praha: Galén 2007 : 391 – 396.
16. Leer JW, van Houtte P, Davelaar J. Indications and treatment schedules for irradiation of benign diseases, a survey. Radiother Oncol 1998; 48(3): 249 – 257.
17. Seegenschmiedt MH, Katalinic A, Makoski HB et al. Radiotherapy of benign diseases: a pattern of care study in Germany. Strahlenther Oncol 1999; 175 : 541 – 547.
18. Micke O, Seegenschmiedt MH. German Working Group on Radiotherapy of Benign Diseases. Consensus guidelines for radiation therapy of benign diseases: a multicenter approach in Germany. Int J Radiat Oncol Biol Phys 2002; 52(2): 496 – 513.
19. Cook DL, Guyatt GH, Laupacis A et al. Rules of evidence and clinical recommendations on the use of antithrombotic agens. Chest 1989; 102 (Suppl 2): 305S – 311S.
20. Sackett DL. Rules of evidence and clinical recommendations on the use of anti‑thrombotic agens. Chest 1989; 102 (Suppl 2): 2S – 4S.
21. Leer J, van Houtte P, Seegenschmiedt MH. Radiotherapy of non‑malignant disorders: Where do we stand? Radiother Oncol 2007; 83(2): 175 – 177.
22. Miszczyk L, Wozniak G, Jochymek B et al. Evaluation of the effectiveness of the calcaneal spurs radiotherapy. Chir Narzadow Ruchu Ortop Pol 2003; 68(3): 191 – 195.
23. Schlöckner I, Lilienthal A, Oehler W. Painful calcaneal spur: is there any influence of radiation quality (ortovoltage vs. high voltage) on pain relief after radiotherapy? Radiother Oncol 2004; 73 (Suppl 1): S233 – S234.
24. Seegenschmiedt MH, Keilholz L, Katalinic A et al. Heel spur: radiation therapy for refractory pain – results with three treatment concepts. Radiology 1996; 200 : 271 – 276.
25. Arenas M, Gil F, Gironella M et al. Time course of anti‑inflammatory effect of low‑dose radiotherapy: Correlation with TGF‑b1 expression. Radiother Oncol 2008; 86(3): 399 – 406.
26. Schneider O, Stückle CA, Bosch E et al. Effectiveness and prognostic factors of radiotherapy for painful plantar heel spurs. Benign News 2002; 3(1): 3 – 5.
27. Calcaneodynia – Score of the GCG - BP. Benign News 2001; 2(2): 23 – 24.
28. Schneider O, Stückle CA, Bosch E et al. Effectiveness and prognostic factors of radiotherapy for painful plantar heel spurs. Benign News 2002; 3(1): 3 – 5.
29. Mücke R, Schönekaes K, Micke O et al. Low‑dose radiotherapy for painful heel spur. Retrospective study of 117 patients. Strahlenther Oncol 2003; 179(11): 774 – 778.
30. Rödel F, Hofmann D, Auer J et al. The anti‑inflammatory effect of low‑dose radiation therapy involves a dimnished CCL20 chemokine expression and granulocyte/ endotelial cell adhesion. Strahlenther Oncol 2008; 184(1): 41 – 47.
31. Surenkok S, Dirican B, Beyzadeoglu M et al. Heel spur radiotherapy and radiation carcinogenesis risk estimation. Radiat Med 2006; 24(8): 573 – 576.
32. Broerse JJ, Jansen JTM, Seegenschmiedt MH. Carcinogenic risks in radiotherapy of benign diseases from head to heel. Radiother Oncol 2004; 71 (Suppl 1): 1S.
33. Trott KR. Can we reduce the incidence of second primary malignancies occuring after radiotherapy? Radiother Oncol 2009; 91(1): 1 – 3.
34. Tubiana M. Can we reduce the incidence of second primary malignancies after radio therapy? A critical review. Radiother Oncol 2009; 91(1): 4 – 15.
Labels
Paediatric clinical oncology Surgery Clinical oncology
Article was published inClinical Oncology

2010 Issue 2-
All articles in this issue
- Treatment of Colorectal Liver Metastases: a Current View
- Prostate Bed Radiotherapy – When and What?
- Sentinel Lymph Node Identification Using Hysteroscopy in Patients with Endometrial Cancer
- The Use of Lenalidomide in the Treatment of Multiple Myeloma
- Monitoring the Effectiveness of Surgical Treatment of Malignant Pleural Effusions
- Low‑ Dose Radiotherapy in the Treatment of Plantar Fasciitis
- Our Experience with Analysis of the PTEN Gene in Patients Suspected of Having Cowden Syndrome
- Treatment of Recurrent Ovarian Cancer – a Retrospective Study
- Vaccination Against Human Papillomavirus in the Czech Republic
- Circulating Tumour Cells in Breast Cancer – Review
- Clinical Oncology
- Journal archive
- Current issue
- Online only
- About the journal
Most read in this issue- Low‑ Dose Radiotherapy in the Treatment of Plantar Fasciitis
- Prostate Bed Radiotherapy – When and What?
- Sentinel Lymph Node Identification Using Hysteroscopy in Patients with Endometrial Cancer
- Our Experience with Analysis of the PTEN Gene in Patients Suspected of Having Cowden Syndrome
Login#ADS_BOTTOM_SCRIPTS#Forgotten passwordEnter the email address that you registered with. We will send you instructions on how to set a new password.
- Career

