-
Medical journals
- Career
Co je nového v doporučených postupech pro kardiovaskulární prevenci?
Authors: Kvapil T.
Authors‘ workplace: I. interní klinika – kardiologická LF UP a FN Olomouc
Published in: Kardiol Rev Int Med 2020, 22(2): 82-85
Overview
Kardiovaskulární (KV) onemocnění jsou hlavní příčinou úmrtí a hlavní příčinou zdravotní újmy v západních zemích. KV prevence je definována jako koordinovaný soubor opatření na úrovni populace nebo zaměřených na jednotlivce, jejichž cílem je eliminovat nebo minimalizovat dopad KV chorob a jejich souvisejících následků. Současné doporučené postupy podporují posouzení celkového KV rizika, protože ateroskleróza je obvykle produktem více vzájemně se ovlivňujících rizikových faktorů. Celoživotní přístup ke KV riziku je důležitý, protože KV riziko i prevence jsou dynamické a kontinuální během stárnutí pacienta. Ve srovnání s předchozími kladou nové doporučené postupy větší důraz na populační přístup.
Klíčová slova:
kardiovaskulární prevence – kardiovaskulární onemocnění – prevence kouření – hypolipidemika – obezita – metabolický syndrom
Úvod
Prevence kardiovaskulárních onemocnění (KVO) je definována jako koordinovaný soubor opatření cílených na celou populaci nebo jednotlivé osoby, zaměřený na omezení výskytu KVO a jejich nežádoucích dopadů. V roce 2009 činily náklady spojené s KVO 810 miliard EUR, což představuje 9 % celkových výdajů na zdravotní péči v celé Evropské unii [1]. Proto KVO představuje pro společnost značnou ekonomickou zátěž a je nezbytné zavádět účinná preventivní opatření.
V čem spočívá kardiovaskulární prevence?
Současné doporučení pro prevenci KVO zdůrazňují důležitost posouzení celkového rizika KVO, protože ateroskleróza je obvykle důsledkem působení řady rizikových faktorů. Preventivní snahy by měly být přizpůsobeny celkovému KV riziku pacienta – čím vyšší je riziko, tím intenzivnější by měly být opatření. Celkové KV riziko lze odhadnout systémy jako je SCORE, které popisuje 10leté riziko rozvoje fatální KV příhody. Systematické hodnocení KV rizika vypočtením SCORE lze zvážit u dospělých mužů ve věku > 40 let a u žen ve věku > 50 let nebo v postmenopauzálním období i přes absenci KV rizikových faktorů. Hodnocení rizik není jednorázovou událostí; mělo by se opakovat např. každých 5 let. Zjištěná hodnota SCORE může pomoci při rozhodování o logickém řízení léčby a může pomoci zabránit nedostatečným nebo nadměrným preventivním opatřením. V současné době je ČR řazena mezi země s vysokým základním rizikem a příslušné SCORE tabulky jsou publikovány v nejnovějších doporučených postupech pro léčbu dyslipidemie z roku 2019 (obr. 1).
Image 1. SCORE tabulky publikované v nejnovějších doporučených postupech pro léčbu dyslipidemie z roku 2019. 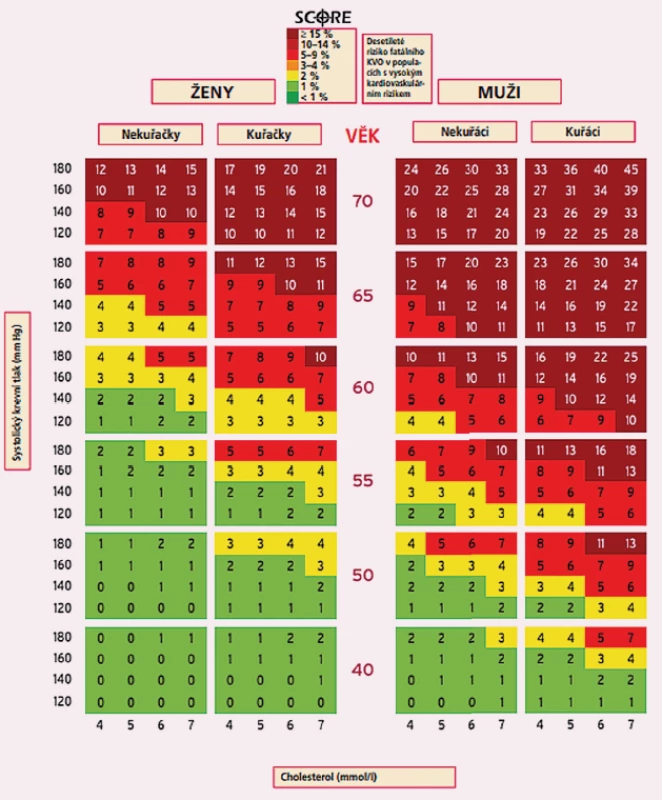
Kouření
Kouření je život ohrožující návyk a zanechání kouření je nákladově nejefektivnější strategií pro KV prevence. Celoživotní kuřák má 50% pravděpodobnost úmrtí v důsledku kouření a v průměru ztratí 10 let života [2], v kontrastu s < 3 lety u těžké hypertenze a < 1 rokem u mírné hypertenze [3]. Po selhání nefarmakologických opatření by měla být nabídnuta substituce nikotinu, vareniklin nebo bupropion [4]. Všechny formy substituce nikotinu (žvýkačky, transdermální nikotinové náplasti, nosní sprej, inhalátor, sublingvální tablety) jsou účinné, jejich užití zvyšuje míru zanechání kouření o 50–70 % [5]. Antidepresivum bupropion napomáhá dlouhodobému odvykání kouření s podobnou účinností jako léčba substitucí nikotinu [6]. Celkově, substituce nikotinu a bupropion pomohlo přestat kouřit o 80 % více lidem než placebo; to znamená, že na každých 10 lidí, kteří přestali kouřit s placebem, by šlo očekávat zanechání kouření u 18 osob při použití substituce nikotinu nebo bupropionu. Parciální agonista nikotinového receptoru vareniklin zvyšuje ve standardní dávce pravděpodobnost zanechání kouření více než 2násobně ve srovnání s placebem (14 studií, 6 166 pacientů) [7]
Pohyb
Pravidelná fyzická aktivita je základem KV prevence, protože snižuje úmrtnost ze všech příčin a KV úmrtnost. Množství času stráveného sedavým způsobem života by mělo být minimalizováno aktivním cestováním (na kole nebo pěšky) a přestávkami při delším sezení u TV. Krátká cvičení jsou nákladově efektivnější než cvičení v tělocvičně nebo chůze pod dohledem instruktora. Aerobní fyzická aktivita je považována za nejprozkoumanější a doporučenou variantu, s prospěšným účinkem závislým na míře pohybu. Fyzická aktivita by měla být prováděna nejméně 3–5× týdně, ale nejlépe každý den. Doporučuje se, aby byl člověk aktivní alespoň 30 min denně, 5 dní v týdnu (tj. 150 min/ týden) se střední intenzitou nebo 15 min denně, 5 dní v týdnu s vysokou intenzitou (75 min/ týden). [8]
Výživa
Strava je silný determinant obezity, arteriální hypertenze, dyslipidemie, diabetes mellitus (DM) a KV zdraví. O vztahu stravovacích návyků a KV rizika máme nejvíce důkazů založených na observačních studiích; randomizované klinické studie věnující se vlivu stravy na KV riziko jsou vzácné. Nutrienty, které nás zajímají nejvíce s ohledem na KVO jsou mastné kyseliny, ovlivňující hlavně hladinu lipoproteinů, minerály, které ovlivňují hlavně tlak krve (TK), vitamíny a vláknina. Obecně platí, že při dodržování pravidel zdravé výživy není nutné doporučovat žádný doplněk stravy.
Mastné kyseliny
Pro prevenci KVO jsou typy konzumovaných mastných kyselin důležitější než celkový obsah přijatého tuku nebo cholesterolu. Trans nenasycené mastné kyseliny ze zpracovaných potravin by neměly být součástí stravy vůbec. Nasycené mastné kyseliny by měly představovat < 10 % celkového příjmu energie a měly by být nahrazeny polynenasycenými mastnými kyselinami [9]. Riziko ischemické choroby srdeční (ICHS) se sníží o 2–3 %, když je 1 % z příjmu energie z nasycených mastných kyselin nahrazeno polynenasycenými mastnými kyselinami [10].
Minerály
Přestože vztah mezi příjmem soli a TK zůstává kontroverzní, zatím dostupné důkazy předpokládají redukci příjmu soli jako důležitého opatření, v prevenci ICHS a cévní mozkové příhody (CMP). Dle metaanalýzy došlo po redukci denního příjmu sodíku o 1 g ke snížení systolického TK u pacientů s arteriální hypertenzí o 3,1 mm Hg a u normotenzních pacientů o 1,6 mm Hg [11]. Ve většině západních zemí je příjem soli vysoký (9–10 g/ den), i když doporučený maximální příjem je 5 g/ den. Naopak draslík má příznivé účinky na TK a jeho hlavními zdroji jsou ovoce a zelenina [12].
Vláknina
Máme data z prospektivních kohortových studií, které ukazují, že zvýšení příjmu vlákniny o 7 g je spojeno s 9% snížením rizika ICHS [13]. Dle těchto studií je zvýšení příjmu vlákniny navíc spojeno se snížením rizika CMP a rozvoje DM 2. typu (DM2) [14]. Ačkoli mechanizmus nebyl zcela objasněn, předpokládá se, že vysoký příjem vlákniny snižuje postprandiální nárůst glykemie a snižuje hladinu celkového cholesterolu a LDL cholesterou (LDL-c).
Specifické potraviny
Existují určité skupiny potravin, kde byl v prospektivních studiích ukázán efekt na redukci KV rizika. Mezi tyto potraviny patří ořechy, kdy konzumací 30 g ořechů snížíme KV riziko o 30 % [15]. Při doporučování obohacení stravy o ořechy bychom ale měli brát v potaz jejich energetickou bohatost a vyhnout se ořechům soleným. Preventivní účinek konzumace ryb je připisován tomu, že ryby obsahují n-3 mastné kyseliny. Dle prospektivních kohortových studií vede konzumace ryb alespoň 1× týdně k 16% snížení rizika ICHS, benefit byl pozorován i u vlivu na riziko CMP [16,17]. Podobné účinky nebyly pozorovány při suplementaci rybím olejem. Prospektivní kohortové studie prokázaly prospěšnost konzumace ovoce a zeleniny, kdy maximální redukce KV rizika nastala při konzumaci asi 400 g ovoce a zeleniny [18]. Co se týče alkoholu, tak dříve udávaný benefit střídmého pití alkoholu se ve světle nových studií jeví přinejmenším jako sporný [19]. Jakýkoli příznivý účinek i mírné konzumace alkoholu byl zpochybněn v randomizované studii zahrnující analýzu z 59 epidemiologických studií [20]. Zdá se, že nejnižší KV riziko je u abstinentů, a jakékoliv množství alkoholu je spojeno se zvýšeným TK a BMI, a tím i KV rizikem. Příjem jednoduchých sacharidů představuje také KV rizikový faktor. Doporučení WHO hovoří o maximálním příjmu 10 % energie z cukrů (mono - a disacharidů), kde jsou zahrnuty přidané cukry i cukry přítomné v ovoci a ovocných šťávách [21]. Pravidelná konzumace nealkoholických slazených nápojů byla spojena s nadváhou, metabolickým syndromem a DM2.
Hmotnost
Preventivní opatření vedly v mnoha zemích k příznivému trendu u hlavních rizikových faktorů, jako je hladina cholesterolu, TK a prevalence kouření, což se projevuje sníženou KV úmrtností. Nicméně BMI má ve všech zemích v posledních desetiletích výrazně rostoucí tendenci, což vede k současnému zvýšení prevalence DM2. K objektivizaci nadváhy je možné využít BMI i obvod pasu s jejich rostoucí hodnotou kontinuálně roste i KV riziko a DM2 [22]. BMI i obvod pasu jsou podobně silné ukazatele, proto lze BMI považovat v běžné praxi za dostačující.
Některé studie ukázaly na existenci podskupiny obézních jedinců, u kterých se neprojevují metabolické komplikace, jako je arteriální hypertenze a inzulinová rezistence, ale při dlouhodobém sledování těchto osob se „metabolicky zdravá obezita“ jeví jako přechodná fáze směřující k metabolickým abnormalitám [23].
Příjem energie by měl být omezen na množství energie potřebné k udržení (nebo získání) zdravé hmotnosti, tj. BMI 20–25 kg/ m2. Další redukci hmotnosti nelze považovat za ochrannou proti KVO. Dietní opatření s pohybovou aktivitou jsou hlavními intervencemi v řešení nadváhy a obezity. Bohužel jsou často samostatně v dlouhodobém hledisku neúspěšné. V takovém případě představuje farmakoterapie orlistatem nebo bariatrická chirurgie další možnost. Pacienti po výkonu bariatrické chirurgie mají snížené riziko infarktu myokardu, CMP, KV události a mortality ve srovnání s nechirurgickými kontrolami [24].
Lipidy
Zásadní úloha dyslipidemie, zejména hypercholesterolemie, ve vývoji KVO je zdokumentována velkými studiemi. Kontinuální asociace mezi hladinou celkového i LDL-c a KV rizikem je pozorovatelná v širokém rozmezí plazmatických koncentrací cholesterolu [25]. Tato asociace se vztahuje na muže i ženy, na osoby bez KVO i se známým KVO. Každé snížení LDL-c o 1,0 mmol/ l je spojeno s 20–25% snížením KV mortality a nefatálních infarktů myokardu [26]. V současné době je hladina LDL-c používána v diagnostice dyslipidemie jako parametr při monitoraci léčby a zároveň nám dává cíle léčby. Cílové hodnoty LDL publikované v posledních doporučených postupech ESC jsou snížené oproti předchozím doporučením a je pravděpodobné, že tento trend snižování cílových hodnot bude pokračovat, protože KV riziko kontinuálně klesá i při hodnotách LDL-c pod současně doporučenými cílovými hodnotami LDL-c. Aktuální data k léčbě dyslipidemie jsou popsány v posledních doporučených postupech ESC k léčbě dyslipidemií z roku 2019. Zlatým standardem zůstávají statiny, ke kterým se při nedosažení cílové hodnoty přidává ezetimib. Silnější pozici dle posledních doporučeních získávají PCSK9 inhibitory, jejichž použití je v našich podmínkách spíše omezeno úhradovými podmínkami pojišťovny.
Závěr
KVO jsou i navzdory zlepšení léčby stále hlavní příčinou morbidity a mortality. V současnosti je v mnoha zemích Evropy míra ICHS méně než poloviční ve srovnání se stavem na počátku 80. let 20. století. Jedná se o důsledek preventivních opatření, která zahrnují i úspěšnou změnu kuřácké legislativy. Rozdíly mezi zeměmi však přetrvávají a prevalence mnoha rizikových faktorů, zejména obezity a DM se výrazně zvyšuje. Závěrem můžeme říci, že prevence KVO je účinná, odstranění rizikových návyků by umožnilo předejít alespoň 80 % KVO a dokonce 40 % nádorových onemocnění.
Doručeno do redakce: 15. 4. 2020
Přijato po recenzi: 29. 4. 2020
MU Dr. Tomáš Kvapil
Sources
1. Nichols M, Townsend N, Scarborough P et al. European Cardiovascular Disease Statistics 2012. European Heart Network and European Society of Cardiology 2012 : 14–17.
2. Doll R, Peto R, Boreham J et al. Mortality in relation to smoking: 50 years' observations on male British doctors. BMJ 2004; 328(7455): 1519. doi: 10.1136/ bmj.38142.554479.AE.
3. Kiiskinen U, Vartiainen E, Puska P et al. Long-term cost and life-expectancy consequences of hypertension. J Hypertens 1998; 16(8): 1103–1112. doi: 10.1097/ 00004872-199816080-00004.
4. Cahill K, Lindson-Hawley N, Thomas KH et al. Nicotine receptor partial agonists for smoking cessation. Cochrane Database Syst Rev 2016; 5: CD006103. doi: 10.1002/ 14651858.CD006103.pub7.
5. Stead LF, Perera R, Bullen CH et al. Nicotine replacement therapy for smoking cessation. Cochrane Databse Syst Rev 2012; 11: CD000146. doi: 10.1002/ 14651858.CD000146.pub4.
6. Hughes JR, Stead LF, Hartmann-Boyce J et al. Antidepressants for smoking cessation. Cochrane Database Syst Rev 2014; 1: CD000031. doi: 10.1002/ 14651858.CD000031.pub4.
7. Cahill K, Stevens S, Perera R et al. Pharmacological interventions for smoking cessation: an overview and network meta-analysis. Cochrane Database Syst Rev 2013; 5: CD009329. doi: 10.1002/ 14651858.CD009329.pub2.
8. Garrett S, Elley CR, Rose SB et al. Are physical activity interventions in primary care and the community cost-effective? A systematic review of the evidence. Br J Gen Pract 2011; 61(584): e125–e133. doi: 10.3399/ bjgp11X561249.
9. Mozaffarinan D, Katan MB, Ascherio A et al. Trans fatty acids and cardiovascular disease. N Engl J Med 2006; 354(15): 1601–1613. doi: 10.1056/ NEJMra054035.
10. Astrup A, Dyerberg J, Elwood P et al. The role of reducing intakes of saturated fat in the prevention of cardiovascular disease: where does the evidence stand in 2010? Am J Clin Nutr 2011; 93(4): 684–688. doi: 10.3945/ ajcn.110.004622.
11. He FJ, MacGregor GA. Effect of modest salt reduction on blood pressure: a meta-analysis of randomized trials. Implications for public health. J Hum Hypertens 2002; 16(11): 761–770. doi: 10.1038/ sj.jhh.1001459.
12. Aburto NJ, Hanson S, Gutierrez H et al. Effect of increased potassium intake on cardiovascular risk factors and disease: systematic review and meta-analyses. BMJ 2013; 346: f1378. doi: 10.1136/ bmj.f1378.
13. Threapleton DE, Greenwood DC, Evans CE et al. Dietary fibre intake and risk of cardiovascular disease: systematic review and meta-analysis. BMJ 2013; 347: f6879. doi: 10.1136/ bmj.f6879.
14. Zhang Z, Xu G, Liu D et al. Dietary fiber consumption and risk of stroke. Eur J Epidemiol 2013; 28(2): 119–130. doi: 10.1007/ s10654-013-9783-1.
15. Luo CH, Zhang Y, Ding Y et al. Nut consumption and risk of type 2 diabetes, cardiovascular disease, and all-cause mortality: a systematic review and meta-analysis. Am J Clin Nutr 2014; 100(1): 256–269. doi: 10.3945/ ajcn.113.076109.
16. Zheng J, Huang T, Xu Y et al. Fish consumption and CHD mortality: an updated meta-analysis of seventeen cohort studies. Public Health Nutr 2012; 15(4): 725–737. doi: 10.1017/ S1368980011002254.
17. Chowdhury R, Kunutsor S, Vitezova A et al. Vitamin D and risk of cause specific death: systematic review and meta-analysis of observational cohort and randomised intervention studies. BMJ 2014; 348: g1903. doi: 10.1136/ bmj.g1903.
18. Wang X, Ouyang Y, Liu J et al. Fruit and vegetable consumption and mortality from all causes, cardiovascular disease, and cancer: systematic review and dose-response meta-analysis of prospective cohort studies. BMJ 2014; 349: g4490. doi: 10.1136/ bmj.g4490.
19. Holmes MV, Dale CE, Zuccolo L et al. Association between alcohol and cardiovascular disease: Mendelian randomisation analysis based on individual participant data. BMJ 2014; 349: g4164. doi: 10.1136/ bmj.g4164.
20. Ronksley PE, Brien SE, Turner BJ et al. Association of alcohol consumption with selected cardiovascular disease outcomes: a systematic review and meta-analysis. BMJ 2011; 342: d671. doi: 10.1136/ bmj.d671.
21. World Health Organization. Guideline: Sugars intake for adults and children. Geneva: Health Organization 2015.
22. Wormser D, Kaptoge S, Di Angelantonio E et al. Emerging Risk Factors Collaboration. Separate and combined associations of body-mass index and abdominal adiposity with cardiovascular disease: collaborative analysis of 58 prospective studies. Lancet 2011; 377(9771): 1085–1095. doi: 10.1016/ S0140-6736(11)60105-0.
23. Bell JA, Sabia S, Hammer M et al. The natural course of healthy obesity over 20 years. J Am Coll Cardiol 2015; 65(1): 101–102. doi: 10.1016/ j.jacc.2014.09.077.
24. Kwok CS, Pradan A, Khan MA et al. Bariatric surgery and its impact on cardiovascular disease and mortality: a systematic review and meta-analysis. Int J Cardiol 2014; 173(1): 20–28. doi: 10.1016/ j.ijcard.2014.02.026.
25. Neaton JD, Blackburn H, Jacobs D et al. Serum cholesterol level and mortality findings for men screened in the Multiple Risk Factor Intervention Trial Research Group. Arch Int Med 1992; 152(7): 1490–1500.
26. Mihaylova B, Emberson J, Blackwell L et al. The effects of lowering LDL cholesterol with statin therapy in people at low risk of vascular disease: meta-analysis of individual data from 27 randomised trials. Lancet 2012; 380(9841): 581–590. doi: 10.1016/ S0140-6736(12)60367-5.
Labels
Paediatric cardiology Internal medicine Cardiac surgery Cardiology
Article was published inCardiology Review

2020 Issue 2-
All articles in this issue
- K životnímu jubileu prof. MU Dr. Jindřicha Špinara, CSc., FESC
- Registr FAR NHL a humorální aktivace
- Preskripce a dávkování diuretik u pacientů s chronickým srdečním selháním v registru FAR NHL
- Nepřerušovaná antikoagulační léčba u katetrizační ablace fibrilace síní
- Urapidil – antihypertenzivum s duálním mechanizmem účinku
- Odlišnosti zmien krvného tlaku medzi mužmi a ženami pri dlhodobom sledovaní
- Význam liečby artériovej hypertenzie v primárnej a sekundárnej prevencii cievnych mozgových príhod
- Stanovisko Angiologickej sekcie Slovenskej lekárskej komory (AS SLK) k užívaniu antagonistov renín–angiotenzín–aldosterónového systému (ACE inhibítorov; blokátorov receptora angiotenzínu II – ARB, sartanov; kombinácie ARB s inhibítorom neprilyzínu – ARNI) počas pandémie spôsobenej SARS-CoV-2 (Koronavírusová choroba 2019; Covid-19)
- Má sakubitril-valsartan u pacientů se srdečním selháním antiarytmický nebo proarytmický efekt?
- Co je nového v doporučených postupech pro kardiovaskulární prevenci?
- Modifikovaný Valsalvův manévr v přednemocniční péči – kazuistika
- Klinická zkušenost s používáním infuzní fixní kombinace Neodolpasse (diklofenak/ orfenadrin) v pooperačním období u kardiochirurgických nemocných
- Cardiology Review
- Journal archive
- Current issue
- Online only
- About the journal
Most read in this issue- Modifikovaný Valsalvův manévr v přednemocniční péči – kazuistika
- Urapidil – antihypertenzivum s duálním mechanizmem účinku
- Klinická zkušenost s používáním infuzní fixní kombinace Neodolpasse (diklofenak/ orfenadrin) v pooperačním období u kardiochirurgických nemocných
- Co je nového v doporučených postupech pro kardiovaskulární prevenci?
Login#ADS_BOTTOM_SCRIPTS#Forgotten passwordEnter the email address that you registered with. We will send you instructions on how to set a new password.
- Career

