-
Medical journals
- Career
Kardiorehabilitace v klinické praxi
Authors: Husár R.
Authors‘ workplace: Odborný léčebný ústav pro kardiorehabilitaci, Lázně Teplice nad Bečvou
Published in: Kardiol Rev Int Med 2020, 22(1): 8-12
Overview
Význam kardiorehabilitace se poslední dobou zvyšuje a kardiorehabilitace se stává nedílnou součástí sekundární a de facto i primární prevence heterogenní populace pacientů s vysokým kardiovaskulárním rizikem. Pojem kardiorehabilitace v sobě zahrnuje časnou kardiorehabilitaci, která navazuje na kardiochirurgický výkon, dále kardiorehabilitaci pacientů po prodělaném infarktu myokardu a pacientů s chronickým srdečním selháním. Kardiorehabilitace představuje významný ekonomický benefit ve smyslu snížení rizika rehospitalizace rizikových pacientů a významnou měrou přispívá k redukci kardiovaskulární mortality, zejména v sekundární prevenci.
Klíčová slova:
kardiorehabilitace – infarkt myokardu – srdeční selhání
Úvod
Kardiovaskulární onemocnění (KVO) představují z populačního hlediska značnou ekonomikou zátěž. V souvislosti s aktuálním demografickým trendem se jeví jako nezbytné vypracovaní nových aktivních postupů k prevenci KVO. Efektivní přístup k prevenci těchto onemocnění se jeví jako aditivní i v prevenci nádorových onemocnění, což z populačního hlediska může vést v širším měřítku i k nižší finanční náročnosti léčby daných onemocnění.
Dle údajů Ústavu zdravotnických informací a statistky ČR bylo v roce 2016 v ČR celkem 2,37 milionu ukončených případů hospitalizace a meziroční pokles činil 13,8 tisíc případů (0,6 %). Vzhledem k výraznému poklesu průměrné ošetřovací doby – téměř o polovinu z 11,8 dne v roce 1992 až na současných 6,2 dne – se celkový objem poskytované lůžkové péče v nemocnicích z hlediska počtu ošetřovacích dní snížil v průběhu celého období již více než o třetinu [1].
Nejvíce hospitalizací (17,2 %) proběhlo na interních odděleních s průměrnou ošetřovací dobou 6,3 dne. Z hlediska objemu poskytované péče v počtu ošetřovacích dní, nejvýznamnějším a počtem případů druhým nejčetnějším důvodem pro hospitalizaci byly nemoci oběhové s průměrnou ošetřovací dobou 7,6 dne. Pacienti byli především hospitalizováni pro ischemickou chorobu srdeční (ICHS) (19,1 %), z toho 7,8 % činil infarkt myokardu (IM), dále jiné choroby srdeční (35,5 %), cévní nemoci mozku (16,7 %), ateroskleróza (8,4 %), žilní městky dolních končetin (5,0 %) a arteriální hypertenzi (4,7 %). Nejčastěji končily úmrtím hospitalizace pro cévní nemoci mozku, a to v 9,7 % případů. Cévní nemoci mozku se zároveň vyznačovaly výrazně nadprůměrnou ošetřovací dobou 12,9 dne. Z celkového počtu hospitalizovaných pro nemoci oběhové soustavy bylo operováno 14,7 % pacientů a 5,3 % zemřelo [1].
Výše zmíněná fakta by měla v klinické praxi vést v aktivním přístupu preventivní medicíny k pacientům, s nimiž se každodenně setkáváme v našich ordinacích.
Metodika provádění kardiorehabilitace
U nemocných po prodělané KV příhodě na podkladě aterosklerózy pracujeme s faktem vysoké pravděpodobnosti recidivy další KV příhody, tedy s faktem nutnosti akcentace sekundární prevence, resp. modifikace životního stylu s farmakologickou intervencí dle současných doporučení. Nicméně i u jedinců, kteří zatím neprodělali žádnou KV příhodu a nemají žádné příznaky, ani subklinicky probíhající aterosklerózy, pracujeme s konceptem predikce KV rizika [2]. Přístup k prevenci KVO by měl být kontinuální, celoživotně vnímaný proces, především z pozice populačního modelu prevence těchto onemocnění [2].
V našem Odborném léčebném ústavu pro kardiorehabilitaci v Teplicích nad Bečvou jsou pacienti stratifikováni většinou v populaci s velmi vysokým KV rizikem společně s populací ve vysokém KV riziku. Jedná se o populaci pacientů, kde je již nutná prakticky vždy farmakologická terapie hyperlipoproteinemie, která je rizikovým faktorem ICHS a dalších nemocí. Struktura populace našich pacientů v závislosti na pohlaví potvrzuje výsledky zahraničních autorů, kteří dokumentují cca třetinový podíl žen a dvoutřetinový podíl mužské populace, která participuje na kardiorehabilitaci v časném pooperačním období [3].
Při daném demografickém vývoji populace samozřejmě evidujeme i seniory ve vyšším věku nad 80 let, kde musíme přísně individualizovat cíle kardiorehabilitace, které jsou limitovány hlavně biologickým stavem pacientů.
Ve světle medicíny založené na důkazech (evidence-based medicine – EBM) je často právě vysoký věk vyřazovacím kritériem mnohých klinických studií. Farmakoterapie v této skupině populace pacientů nemá tak robustní data z velkých klinických studií jako jiné populace pacientů. Přes tento fakt naprostá většina populace umírá na komplikace KVO a výjimkou nejsou ani senioři ve vyšším věku nad 80 let s recidivujícimi IM, resp. opakovanou kardiochirurgickou operaci i ve vyšším věku [4].
Kardiorehabilitace s akcentací pohybové aktivity je bezpečná pro pacienty za podmínek zachování možnosti časné defibrilace na pracovišti [5]. Skupiny pacientů, kteří nejvíc profitují z kardiorehabilitace, se kumulují hlavně ze skupin pacientů po kardiochirurgických výkonech, po koronárních angioplastikách, dále s arteriální hypertenzí, po transplantaci srdce, po implantaci trvalé kardiostimulace s možností resynchronizační terapie, event. defibrilace, resp. u pacientů s kombinovanými KV riziky [6]. Některé práce benefitní efekt kardiorehabilitace ve smyslu redukce mortality relativizují v populaci pacientů po prodělaném IM. Limitací této práce je právě vyloučení starších fragilních pacientů a pacientů se závažnými komorbiditami, kteří daný výsledek mohly ovlivnit [7].
Jedním z příznivých efektů balneologických procedur během kardiorehabilitace je využití unikátního přírodního minerálního zdroje formou celkové vodní uhličité lázně, která využívá vazodilatační účinek oxidu uhličitého indukující vytvoření vazodilatačního kožního erytému a pokles periferního odporu (rozšíření arteriol, přesunutí krve na periferii, zvýšení svalového prokrvení), který má za následek pokles jak systolického, tak i diastolického krevního tlaku (TK) se zvýšením minutového srdečního výdeje o cca 30 – 50 %. Jako další benefitní účinek se jeví zvýšení natriurézy, pokles sérové hladiny adrenalinu a noradrenalinu s poklesem plazmatické hladiny reninu a inhibicí systému renin aldosteron [8].
U pacientů, kteří se snaží přestat kouřit, indikujeme opakovanou intervenci stran odvykání kouření. V rámci snahy o zvýšení adherence pacienta k režimovým opatřením jsou pro pacienty organizovány edukační přednášky o hlavních zásadách sekundární prevence ICHS, dále o hlavních zásadách stravování i pohybové aktivit. Na závěr pobytu, v rámci zvýšení adherence k terapii je pacient vybaven i písemným rozpisem medikace s poučením o medikaci, což zvyšuje šanci na lepší spolupráci pacientav ambulantním režimu klinických kontrol.
Od 1. 1. 2015 došlo ke změně indikačního seznamu pro lázeňskou péči pro dospělé, kde dochází k omezení péče pro pacienty zejména v sekundární prevenci po prodělaném IM indikace II/ 2, resp. indikace II/ 1 symptomatická ICHS, bez možnosti opakování kardiorehabilitačního pobytu na danou indikaci.
Především u rizikové populace pacientů po prodělané perkutánní koronární angioplastice (indikace II/ 7) je zaznamenán výrazný pokles v meziročním srovnání od 1. 1. 2013 do současnosti (tab. 1).
Table 1. Srovnání odléčených pacientů v OLÚ a KLP v jednotlivých indikacích. 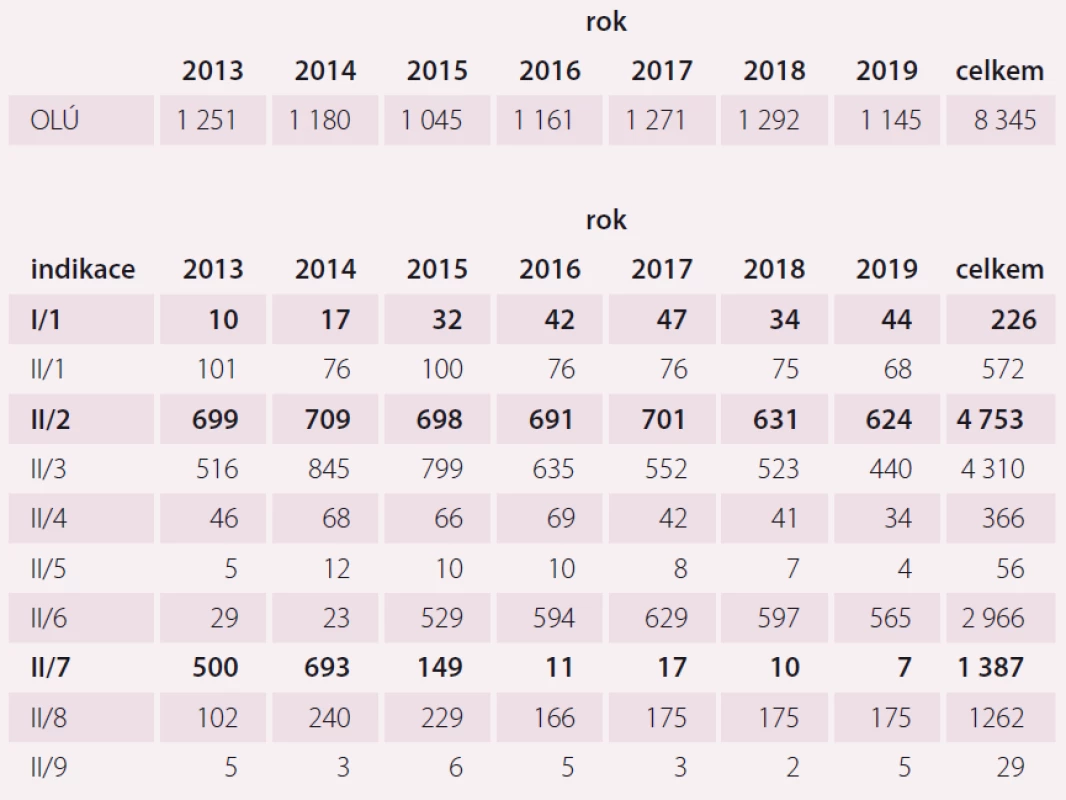
OLÚ – Odborný léčebný ústav pro kardiorehabilitaci, Lázně Teplice nad Bečvou;
KLP – pacient v režimu komplexní lázeňské léčbyAdherence k rehabilitaci
Ovlivnění chování populace nemocných pacientů stran změny životního stylu je proces s omezenou efektivitou. Např. v americké populaci u skupiny pacientů s dokumentovanou intervencí bylo jen 5 % populačního vzorku schopno změnit tři životní návyky současně, tj. kouření, dietní a pohybový režim. Jako možný příklad inovativního přístupu ke změně životních návyků pacientů je nabídnout pacientovi modul parciální změny, který má lepší výsledky [9]. Jako další důležitý fakt se jeví pokles adherence k léčbě hypertenze v časovém rámci 2 let na 50 %, což může znamenat alarmující fakt, že naši pacienti v průběhu času přestávají příznivě adherovat k medikaci a dostávají se do skupin populace pacientů s vyšším KV rizikem [10], což de facto potvrzuje i práce srbských autorů, kteří srovnávali benefit v období kardiorehabilitace v ambulantním režimu. Dokumentovali zlepšení funkčních parametrů během kardiorehabilitace, nicméně v delším časovém rozmezí docházelo postupně ke zvyšování hladiny glykemií a sérového LDL cholesterolu jako dalšího robustního markeru stratifikace KV rizika pacienta [11].
Výsledky kardiorehabilitace ve smyslu zlepšení dlouhodobé prognózy potvrzuje i práce amerických autorů v jejich retrospektivní analýze pacientů po prodělaném aortokoronárním bypassu (celkem 846 osob). Tato práce dokumentuje redukci relativního rizika celkové mortality o 46 % a redukce absolutního rizika mortality o 12,7 % bez závislosti na věku [12].
Časná kardiorehabilitace u pacientů po akutním IM
Z kardiorehabilitace profituje prakticky každý pacient. Existují skupiny nemocných, kteří z ní mají zisk největší. Jedná se zejména o pacienty po akutním IM, po přestálém akutním koronárním syndromu, po revaskularizaci myokardu ať už katetrizační (PCI) nebo kardiochirurgické (CABG), po výkonech na srdečních chlopních nebo na hrudní aortě. Mezi další nemocné patří osoby s arteriální hypertenzí, se stabilizovanými formami chronického srdečního selhání (SS) (do stupně NYHA III), rovněž pacienti po transplantaci srdce [13]. Časnou posthospitalizační fázi po prodělaném IM chápeme jako ambulantně řízený trénink v kombinaci s individuálním domácím tréninkem a lázeňskou léčbou v délce 28 dní. Mělo by se jednat o aditivní efekt kardiorehabilitace v sekundární prevenci nemocných pacientů.
Pro ambulantní trénink jsou pacienti rozděleni do tří skupin – pacienti s nízkým, středním a vysokým rizikem. Mezi hodnotící parametry patří funkce levé komory (LK) (stanoveno jako ejekční frakce – EF) a kategorizace rizika pacienta [14] (tab. 2).
Table 2. Stanovení rizika u nemocných po IM. 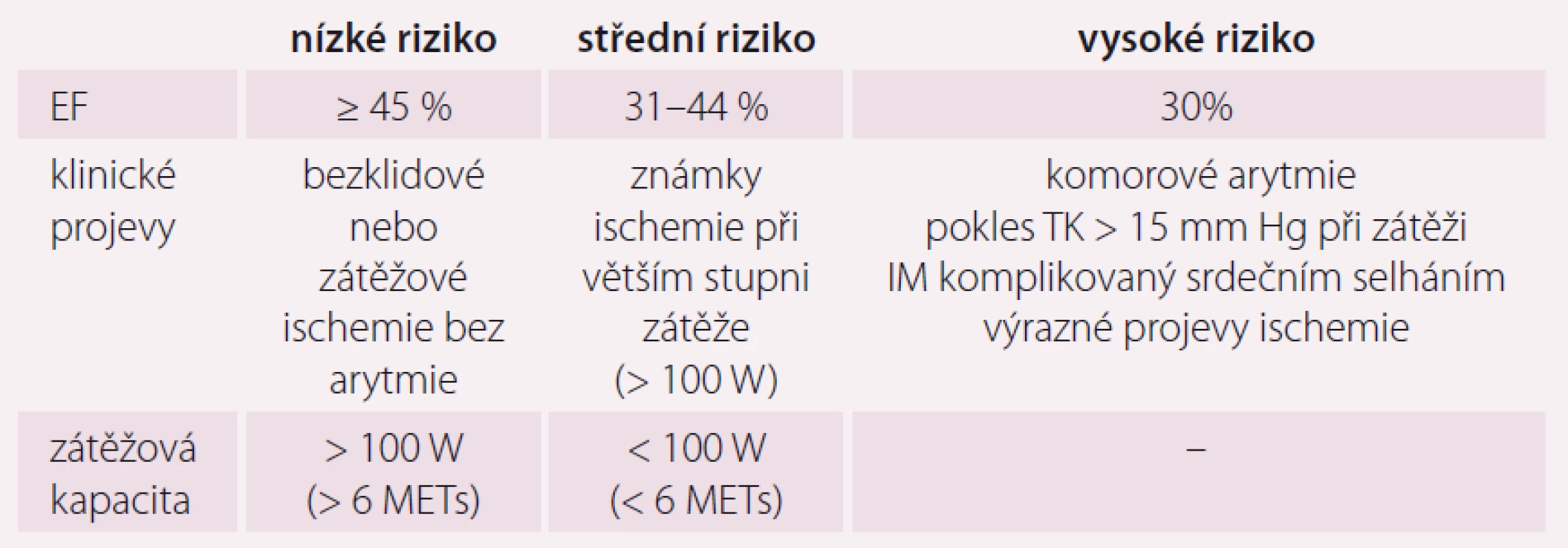
IM – infarkt myokardu; EF – ejekční frakce levé komory; TK – krevní tlak; MET – metabolické ekvivalenty Intenzita zátěže musí být pro požadovaný efekt tréninku dostatečná, nesmí pacienta ohrožovat a měla by se blížit anaerobnímu prahu. Pro stanovení optimální intenzity zátěže používáme tréninkovou tepovou frekvenci, jejíž hodnotu můžeme určit:
- z procenta maximální spotřeby kyslíku – stanovuje se spiroergometricky (na základě relativně lineární závislosti spotřeby kyslíku a tepové frekvence – TF)
- z procenta tepové rezervy – ve výpočtu figuruje maximální TF (TFmax) a klidová TF (KTF). Vztah na výpočet tréninkové tepové frekvence (TTF):
TTF = (TFmax – KTF) × 0,7(0,8) + KTF(procenta tepové rezervy jsou zvýrazněna).
Rozdělení tréninkové jednotky
Tréninková jednotka se dělí na 3 (nebo 4) části. Zahřívací (warm-up) část, aerobní trénink, relaxační (cool-down) část a silový trénink. Celkové trvání jedné tréninkové jednotky se pohybuje v časovém horizontu 60 – 90 min. Záleží samozřejmě na individualitě pacienta. U pacientů s klidovou dušností (NYHA IV), u kterých je fyzická aktivita obecně problematická se iniciálně jedná spíše o komplex dechových cvičení a nácviku zvládání běžných denních činností.
Před začátkem fyzické aktivity je nutno změřit TK a TF a všímat si klinického stavu pacienta a jeho subjektivní reakci na fyzickou zátěž. Měření TK a TF se provádí i během aerobní části cvičební jednotky a bezprostředně po ní, u rizikovějších pacientů je možnost napojení pro stálou kontrolu na monitor.
Charakteristika jednotlivých částí cvičební jednotky
- Zahřívací část – obsahuje cvičení menší intenzity o délce trvání 10 – 15 min; má význam v prevenci KV i muskuloskeletálních poškození – zlepšuje prokrvení a tonus kosterních svalů, zvyšuje metabolizmus potřebný k následné anaerobní aktivitě, také zlepšuje přechod z klidu do plného zatížení; vhodnými aktivitami jsou dynamická rozcvička, strečink, pomalejší chůze, cviky udržující potřebný rozsah pohybů v kloubech apod.
- Aerobní trénink – tvoří stěžejní část cvičební jednotky, pacienti většinou využívají k cvičení rotoped nebo běžící pás (u těchto strojů je často funkce kontroly zátěže, TK a TF), může se cvičit kontinuálně nebo i intervalově; jinou možností je kruhový trénink, při kterém se mohou využít i jiné typy trenažéru, např. kolo, steeper, vesla atd. – tady pacient střídá trenažéry po 10 – 15 min a trénuje vytrvalost i sílu.
- Relaxační část – obsahuje strečinkové cviky či pomalou chůzi na správné vyladění organizmu po zátěži (pozvolný návrat TK a TF ke klidovým hodnotám tak brání hypotenzi a kolapsovým stavům, též zlepšuje odvod přebytečného tepla, urychluje odbourávání laktátu z krevní plazmy i nebezpečí škodlivých účinků pozátěžového vzestupu katecholaminů v plazmě).
- Silový trénink – je vhodný v rámci prevence svalové atrofie, zařazuje se po 14 dnech aerobního tréninku, zařazuje se aspoň 2× týdně po 3 cvicích; silová cvičení mají svá specifika – pacient cvičí pomalu, plynule, nezadržuje dech, čas cvičení střídá čas odpočinku (po 30 s), pacient necvičí s maximálním úsilím apod. (kontrola TK a TF zůstává).
V konečném důsledku kardiorehabilitace po prodělaném IM dokumentuje zlepšení funkčních parametru ve smyslu zlepšení EF LK, snížení rizika rekurence anginy pectoris, zlepšení i funkční klasifikace NYHA. Po fyzickém tréninku bylo pozorováno snížení anginózních obtíží, a to s větším efektem, než při léčbě betablokátory [15]. To jistě souvisí i s pozorováním zlepšené perfuze myokardu prokázané při thaliové scintigrafii [16]. Snížení TK po pravidelné zátěži je známo již delší dobu a je opětovně prokazováno. U pacientů, kteří podstoupili kardiorehabilitaci, byl popsán menší výskyt ektopických komorových aktivit než u těch, kteří netrénovali [17]. Příznivý metabolický efekt byl již rovněž prokázán v mnoha oblastech. Dochází ke zlepšení lipidového spektra se vzestupem HDL cholesterolu, k poklesu celkového a zejména LDL cholesterolu
Časná kardiorehabilitace u pacientů po kardiochirurgickém výkonu
V této skupině nemocných je výraznou limitací hojení jizvy stereotomie, resp. jizev po odběrech žilních štěpů, zvláště ve vyšším věku, kde dochází k progresi dekondice, zvláště u fragilních seniorů. Iniciálně je nutná úprava a individualizace kardiorehabilitace pod dohledem zkušeného fyzioterapeuta. Rehabilitace se zaměřuje na nácvik mobilizace pacientů s dopomocí a prevencí komplikujícícho pádu. Jako přínosné hodnotíme miniinvazivní přístupy kardiochirurgických výkonů u seniorské populace, které umožňují akcentovat a urychlit kvalitu prováděné kardiorehabilitace např. u pacientů po náhradě aortální chlopně z ministernotomie, po katetrizačně implantované aortální chlopni (TAVI), event. arteriální revaskularizaci myokardu, po endoskopicky provedenému odběru žilních štěpů z dolních končetin, které umožňují rychlejší zahájení balneologických procedur a kardiorehabilitace.
Pooperační komplikace časné kardiorehabilitace
V období časné kardiorehabilitace jsou registrovány relativně nejčastěji komplikace ve smyslu registrace paroxysmální fibrilace/ flutteru síní (cca 30 % našich pacientů). Jako etiopatogenetický podklad se zvažuje oxidativní stres v síních, systémová zánětlivá reakce po kardiochirurgickém výkonu, vysoký tonus sympatiku jako reakce organizmu na kardiochirurgický výkon [18], často s nutností eskalace antiarytmické terapie a zhodnocení dalšího benefitu antiagregační, resp. antikoagulační terapie se zvážením individuálního krvácivého rizika jednotlivého pacienta.
Klinický stav pacientů po kardiochirurgickém výkonu je charakterizován nutností častějších echokardiografických kontrol v souvislosti s časnou diagnostikou komplikujícího rozvoje postkardiotomického syndromu, dále možností recidivujících pleurálních výpotků, event. komplikujícího krvácení s nutností časné diagnosticky a odeslání daného pacienta na kardiochirurgické pracoviště.
Dalším faktorem zůstává časná diagnostika a ovlivnění časných komplikací jako jsou např. zánětlivé komplikace ve smyslu infektu dýchacích cest/ akutní exacerbace chronické obstrukční bronchitidy u pacientů s plicním postižením, dále diagnostika lokálních komplikací po invazivních vstupech (jako je např. diagnostika AV fistuly, pseudoaneuryzma po TAVI, žilní trombóza dolních končetin atd.)
Kardiorehabilitace pacientů s chronickým srdečním selháním
V současné době se pacienti se základní diagnózou chronického SS (CHSS) stávají dominantní skupinou populace pacientů na našem pracovišti i vzhledem k narůstající incidenci této nemoci v naší populaci. Odhaduje se, že incidence SS v ČR je kolem 0,4 %, což prakticky znamená cca 40 000 nových případu ročně. Navzdory pokroku v léčbě a diagnostice je prognóza tohoto onemocnění nepříznivá. Z hlediska lázeňské léčby je důležitý fakt komplexního přístupu k této rizikové populaci nemocných s uplatněním kombinace nefarmakologických a farmakologických přístupů a uplatněním personalizovaného přístupu k terapii.
Metaanalýza studií zabývajících se tréninkem u pacientů s CHSS a systolickou dysfunkcí LK s EF < 35 % (ExTraMATCH), zahrnula 801 pacientů. Aerobním tréninkem se snížilo riziko mortality pacientů o 35 % (p < 0,05) a kombinovaný cíl rizika mortality nebo hospitalizací o 28 % (p < 0,05). Jako klíčový prvek k dosažení pozitivního efektu tréninku je vnímaná adherence pacientů [19].
Na trh se postupně dostávají nové léky s příznivými morbidními a mortalitními daty, které se snažíme rovněž uplatňovat u těchto pacientů. V praxi se však setkáváme s heterogenní skupinou pacientů v různém stadiu fyzické výkonnosti, která je limitována nejenom sníženou systolickou nebo diastolickou funkcí LK, ale rovněž taky stavem pohybového aparátu a výraznou dekondicí. Iniciálně během časného období kardiorehabilitace se snažíme individualizovat přístup u takové skupiny nemocných s akcentem na stratifikaci výkonnosti daného pacienta a sledování základních hemodynamických parametrů během kardiorehabilitace. Samozřejmostí je echokardiografické vyšetřeni, vyšetření zátěžovým testem, event. spiroergometrií se stanovením základních funkčních parametrů. Během pobytu opakovaně titrujeme terapii CHSS, arteriální hypertenze, hyperlipoproteinemie do maximalizovaných dávek pro pacienta. Cílem pohybové terapie pacientů po kardiochirurgických výkonech je zvýšení kardiopulmonálních rezerv pacienta [20]. Během kardiorehabilitace je pacientovi monitorována TF před i po zátěži, dále pravidelně absolvuje monitorovanou ergometrii limitovanou doporučenou TF a doporučenou zátěži, dle výsledku zátěžového testu. U pacientů po prodělané recentní perioperační cévní mozkové příhodě je nastavována individuální rehabilitace v kombinaci s intervencí ergoterapeuta dle klinické potřeby pacienta.
Závěr
Kardiorehabilitace zůstává důležitou součásti prevence i léčby populace u pacientů s vysokým KV rizikem bez závislosti na věku. Je nedílnou součástí nefarmakologické léčby pacientů s ICHS, po cévní mozkové příhodě, po IM s kardiometabololickým syndromem, zvláště u opakovaných pobytů. Kardiorehabilitace musí probíhat dlouhodobě s cílem maximalizování benefitního efektu kardiorehabilitace u této rizikové populace. Nadále nám však chybí další randomizované studie, které by dále lépe stratifikovaly definovanou heterogenní populaci pacientů s cílem zlepšit jejich prognózu zejména v delším časovém horizontu.
Doručeno do redakce: 10. 12. 2019
Přijato po recenzi: 6. 1. 2020
MU Dr. Roman Husár
Sources
1. ÚZIS. Hospitalizace v nemocnicích ČR v roce 2016. Dostupné na: https:/ / www.uzis.cz/ sites/ default/ files/ knihovna/ hospit2016_text.pdf.
2. Rosolová H a kol. Preventivní kardiologie v kostce. Praha: Axonite CZ 2013 : 38.
3. Feola M, Garnero S, Daniele B et al. Gender differences in the eficacy od cardovascular rehabilitation in patients after cardiac surgery procedures. J Geriatr Cardiol 2015; 12(5): 575 – 579. doi: 10.11909/ j.issn.1671-5411.2015.05.015.
4. Rosengren A. Better treatment and improved prognosis in elderly patients with AMI: but do registers tell the whole truth? Eur Heart J 2012; 33(5): 562 – 563. doi: 10.1093/ eurheartj/ ehr364.
5. Van Camp SP, Peterson RA. Cardiovascular complications of outpatient cardiac rehabilitation programmes. JAMA 1986; 256(9): 1160 – 1163. doi: 10.1001/ jama.256.9.1160.
6. Lavie CJ, Milani RV, Littman AB. Benefits of cardiac rehabilitation and exercise training in secondary coronary prevention in the elderly. J Am Coll Cardiol 1993; 22(3): 678 – 683. doi: 10.1016/ 0735-1097(93)90176-2.
7. West RR, Jones DA, Henderson AH. Rehabilitation after myocardial infarction trial (RAMIT): multi-centre randomised controlled trial of comprehensive cardiac rehabilitation in patients following acute myocardial infarction. Heart 2012; 98(8): 637 – 644. doi: 10.1136/ heartjnl-2011-300302.
8. Jandová D. Balneologie. Praha: Grada 2009 : 15.
9. Miller RR, Sales AE, Kopjar B et al. Adherence to heart-healthy behaviors in a sample of the U.S. population. Prev Chronic Dis 2005; 2(2): A18.
10. Cramer JA, Roy A, Burrell A et al. Medication compliance and persistence: terminology and definitions. Value Health 2008; 11(1): 44 – 47. doi: 10.1111/ j.1524-4733.2007.00213.x.
11. Spiroski D, Andjić M, Stojanović O et al. Very short/ short-term benefit of inpatient/ outpatient cardiac rehabilitation programs after coronary artery bypass grafting surgery. Clin Cardiol 2017; 40(5): 281 – 286. doi: 10.1002/ clc.22656.
12. Pack QR, Goel K, Lahr BD et al. Participation in cardiac rehabilitation and survival after coronary artery bypass graft surgery: a community-based study. Circulation 2013; 128(6): 590 – 597. doi: 10.1161/ CIRCULATIONAHA.112.001365.
13. Stewart KJ. Role of exercise training on cardiovascular disease in persons who have type 2 diabetes and hypertension. Cardiol Clin 2004; 22(4): 569 – 586. doi: 10.1016/ j.ccl.2004.06.007.
14. Chaloupka V, Siegelová J, Špinarová L et al. Rehabilitace u nemocných s kardiovaskulárním onemocněním. Cor Vasa 2006; 48(7 – 8): K127 – K145.
15. Todd I, Ballantyne D. Antianginal efficacy of exercise training: a comparison with betablockade. Br Heart J 1990; 64(1): 14 – 19. doi: 10.1136/ hrt.64.1.14.
16. Schuler G, Hambrecht R, Schlierf G et al. Myocardial perfusion and regression of coronary artery disease in patients on a regime of intensive physical exercise and low fat diet. J Am Coll Cardiol 1992; 19(1): 34 – 42. doi: 10.1016/ 0735-1097(92)90048-r.
17. Liu Z, Gu H, Dai Q et al. Exercise exerts its beneficial effects on acute coronary syndrome: clinical evidence. Adv Exp Med Biol 2017; 1000 : 9 – 29. doi: 10.1007/ 978-981-10-4304-8_2.
18. Čihák R, Haman L, Táborský M et al. 2016 ESC Guidelines for the management of atrial fibrillation developed in collaboration with EACTS. Summary of the document prepared by the Czech Society of Cardiology. Cor Vasa 2016; 58: e636 – e683.
19. Piepoli MF, Davos C, Francis DP et al. Exercise training meta-analysis of trials in patiens with chronic heart failure (ExTraMATCH). BMJ 2004; 328(7433): 189 – 196. doi: 10.1136/ bmj.37938.645220.EE.
20. Kolář P et al. Rehabilitace v klinické praxi. Praha: Galén 2009 : 574.
Labels
Paediatric cardiology Internal medicine Cardiac surgery Cardiology
Article was published inCardiology Review

2020 Issue 1-
All articles in this issue
- Doba kardiokoronarovirová – jak moc v tom lítáme?
- Co je to komplexní kardiovaskulární rehabilitace?
- Kardiorehabilitace v klinické praxi
- Vliv pohybové aktivity na snížení hodnot krevního tlaku u pacientů s arteriální hypertenzí
- Možnosti kardiovaskulární prevence v nutričním kontextu
- Kardiovaskulární rehabilitace pacientů po chirurgické korekci chlopenních a vrozených srdečních vad
- Nové vzorce pro výpočet maximální spotřeby kyslíku při zátěžových testech podle registru FRIEND
- Nikotin, kouření a kardiovaskulární rizika – základní pojmy
- Novinky ve farmakoterapii srdečního selhání se zachovalou ejekční frakcí
- EKG diagnostika prvního kontaktu v osmi krocích
- Doporučená očkování pro osoby s kardiovaskulárním onemocněním
- Doporučená vyšetření v infekční sérologii u pacientů s kardiovaskulárním onemocněním
- Cardiology Review
- Journal archive
- Current issue
- Online only
- About the journal
Most read in this issue- EKG diagnostika prvního kontaktu v osmi krocích
- Nikotin, kouření a kardiovaskulární rizika – základní pojmy
- Doporučená vyšetření v infekční sérologii u pacientů s kardiovaskulárním onemocněním
- Vliv pohybové aktivity na snížení hodnot krevního tlaku u pacientů s arteriální hypertenzí
Login#ADS_BOTTOM_SCRIPTS#Forgotten passwordEnter the email address that you registered with. We will send you instructions on how to set a new password.
- Career

