-
Medical journals
- Career
Balónková kontrapulzace, ECMO a transplantace srdce v průběhu 24 hodin u pacienta v kardiogenním šoku
Authors: Trčková A. 1; Špinarová L. 1; Krejčí J. 1; Novák M. 1; Rezek M. 1; Pavlík P. 2; Ondrášek J. 2; Němec P. 2; Horváth V. 2
Authors‘ workplace: I. interní kardioangiologická klinika LF MU a FN u sv. Anny v Brně 1; Centrum kardiovaskulární a transplantační chirurgie, Brno 2
Published in: Kardiol Rev Int Med 2019, 21(4): 225-228
Overview
Představujeme zajímavý případ 42letého muže s dilatační kardiomyopatií po pravděpodobně prodělané myokarditidě s ejekční frakcí levé komory původně 25 %, přechodně zlepšené na 35 %, poté opět s poklesem na 15–20 %. Za poslední hospitalizace došlo k dramatickému zhoršení klinického stavu, a proto byly v průběhu 24 hod použity tři nefarmakologické postupy pro léčbu kardiogenního šoku – balónková kontrapulzace, veno-arteriální extrakorporální membránová oxygenace a následně úspěšná transplantace srdce.
Klíčová slova:
balónková kontrapulzace – ECMO – transplantace srdce – kardiogenní šok
Úvod
Srdeční selhání (SS) je syndromem, jehož příčinou je dysfunkce srdce jako pumpy, kde není do tkání přiváděn dostatek krve k pokrytí všech metabolických nároků. Mezi klasické symptomy patří dušnost, snížená výkonnost až nemožnost fyzické aktivity a únava. Mezi klasické známky řadíme otoky dolních končetin a jaterní kongesci při převážně pravostranném SS a městnání v plicích až plicní edém při převážně levostranném SS. Fyzická limitace je mezinárodně hodnocena dle tzv. NYHA klasifikace (New York Heart Association), kdy pacient v NYHA I má sice strukturální změny srdce, ale je bez symptomů. Naopak kategorie NYHA IV značí významné omezení fyzické aktivity a symptomy se projevují již i v klidu. Mimo jiné lze SS dělit z časového hlediska. Jako pokročilé SS popisujeme takový stav pacienta, kdy i přes veškerou zavedenou péči je pacient ve funkční skupině NYHA III až IV. V této chvíli, pokud nejsou kontraindikace, zvažujeme transplantaci srdce (OTS).
Stav pacienta může vygradovat až do kardiogenního šoku – to je akutně život ohrožující stav, kdy srdce selže jako pumpa, není dostatečný srdeční výdej, dochází k hypotenzi. Jakožto obranný mechanizmus nastává centralizace oběhu k udržení prokrvení srdce, mozku a plic na úkor periferie, kde dochází až k ischemii tkání.
Kazuistika
Jedná se o 42letého muže, bez rizikových faktorů (bez ischemické choroby srdeční, hypertenze, obezity, diabetes mellitus, bez pozitivní rodinné anamnézy, abúzu alkoholu) a bez komorbidit.
Základní diagnózou je dilatační kardiomyopatie pravděpodobně po prodělané myokarditidě v roce 2009, od té doby byl sledován na naší klinice. Vstupně byla ejekční frakce levé komory (EF LK) 25 %, poté došlo ke zlepšení a v říjnu 2012 dosahovala EF LK 35 %. V lednu 2013 byl však pacient hospitalizován v místě bydliště pro dekompenzaci stavu vedoucí do kardiogenního šoku s nutností ionotropní podpory. Ve stabilizovaném stavu byl k nám přeložen k došetření, EF LK tehdy dosahovala 20 %, nově byla také přítomna významná mitrální regurgitace 2.–3. stupně, středně významná trikuspidální insuficience s projevy těžké plicní hypertenze (PH), což odpovídalo i provedené pravostranné katetrizaci. Pacient byl ve funkční třídě NYHA II–III. Na EKG byl blok levého Tawarova raménka a dle EKG Holtera opakovaně běhy nesetrvalých komorových tachyarytmií. Za hospitalizace byla u pacienta z důvodu primární prevence provedena implantace biventrikulárního kardioverter defibrilátoru (BiV-ICD).
Od roku 2013 byl pacient opakovaně hospitalizován pro kardiální dekompenzaci či plánovaně k diagnostické hospitalizaci (na naší klinice celkem 10×, z toho 3× pro kardiální dekompenzaci a 7× k diagnostické plánované hospitalizaci) a většina hospitalizací proběhla právě na naší klinice, která je specifická svým zaměřením. Plánovaně přijímáme pacienty k došetření před zařazením na čekací listinu k OTS a hospitalizujeme také pacienty na urgentní čekací listině, jejichž stav nedovoluje ambulantní péči. Tak to bylo i v případě našeho pacienta. V roce 2016 byl zařazen na čekací listinu k OTS.
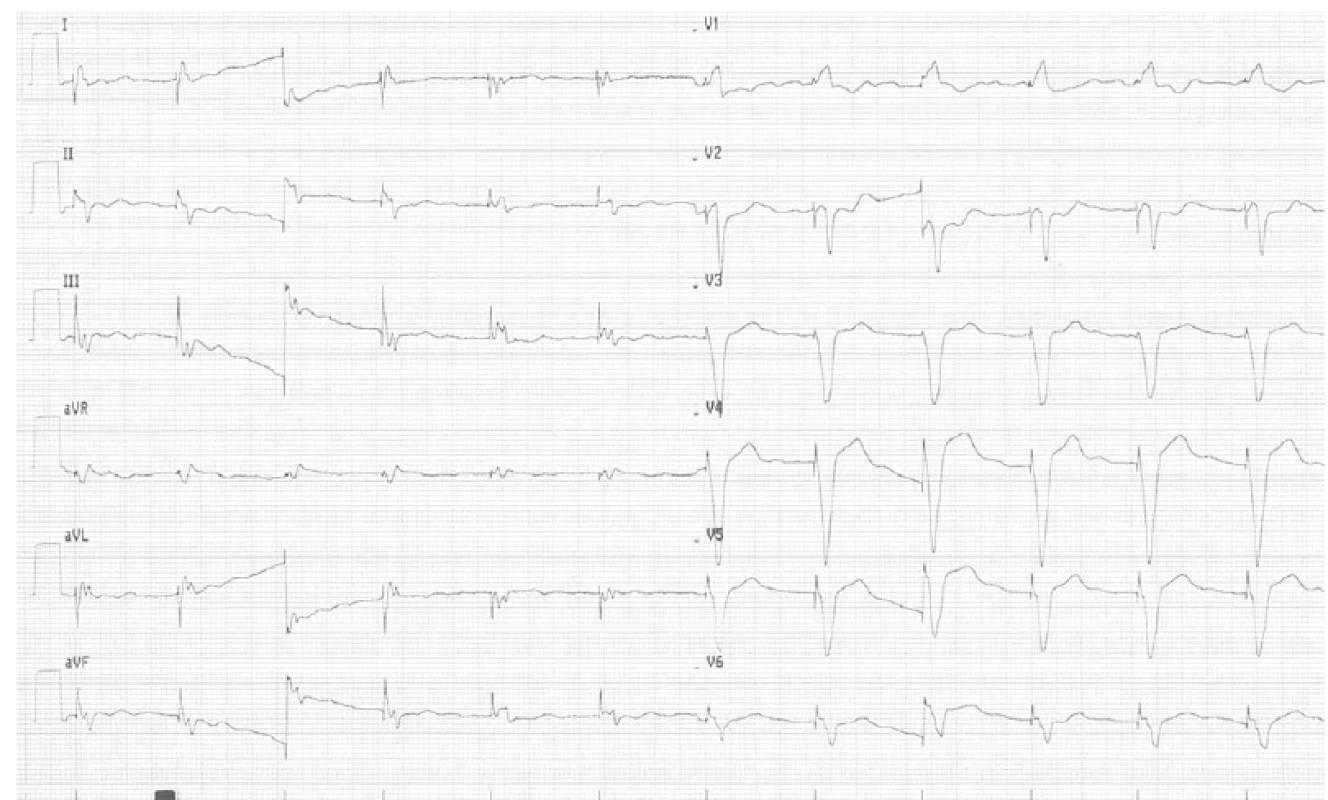
V dubnu roku 2018 (tedy již desátá hospitalizace na I. interní kardioangiologické klinice LF MU a FN u sv. Anny v Brně od roku 2013) však došlo k progresi klinického stavu pacienta, který byl výrazně limitován dušností při zátěži, funkčně NYHA III. Patrný byl i značný váhový přírůstek, hmatná játra, avšak bez otoků dolních končetin. Při této poslední hospitalizaci před OTS (18. 4. 2018 – 17. 5. 2018) byly vstupní laboratorní vyšetření následující: draslík 4,8 mmol/ l, chloridy 99 mmol/ l, urea 6,9 mmol/ l, kreatinin 147 µmol/ l, glomerulární filtrace 0,84 ml/ s/ 1,73m2, NT pro-BNP 2 614 ng/ l, AST 0,41 µkat/ l, ALT 0,46 µkat/ l, ALP 1,60 µkat/ l, GGT 7,6 µkat/ l, CRP 8,8 mg/ l, leukocyty 11,3 109/ l, hemoglobin 163 g/ l, bilirubin celkový 32,8 µmol/ l, bilirubin přímý 18,0 µmol/ l. Na EKG byla patrna síněmi spouštěná stimulace komor 70/ min (obr. 1).
Dle echokardiografického nálezu byla zjištěna výrazná dilatace všech srdečních oddílů, těžká porucha kontraktility levé komory s EF LK kolem 15 %, významná porucha diastolické funkce s restrikčním typem plnění LK, trikuspidální regurgitace 3+, mitrální regurgitace 2+, se známkami PH (obr. 2). Nález koreloval s výsledkem pravostranné srdeční katetrizace, kde byla středně těžká postkapilární PH (MPAP 39 mm Hg, PCWP 29 mm Hg, TPG 10 mm Hg, CO 3,1 l, CI 1,3 l/ m2,CVP 11 mm Hg, PVR 3,3 W.j.). U pacienta byla zavedena parenterální diuretika a inotropní podpora dobutaminem, byla provedena kanylace v. basilica dx., což však bylo komplikováno vznikem flebitidy a flegmóny s hemoragickou purulentní sekrecí a s nutností antibiotické terapie, a také chirurgické revize.
Image 2. ECHO pacienta – apikální čtyřdutinová projekce. 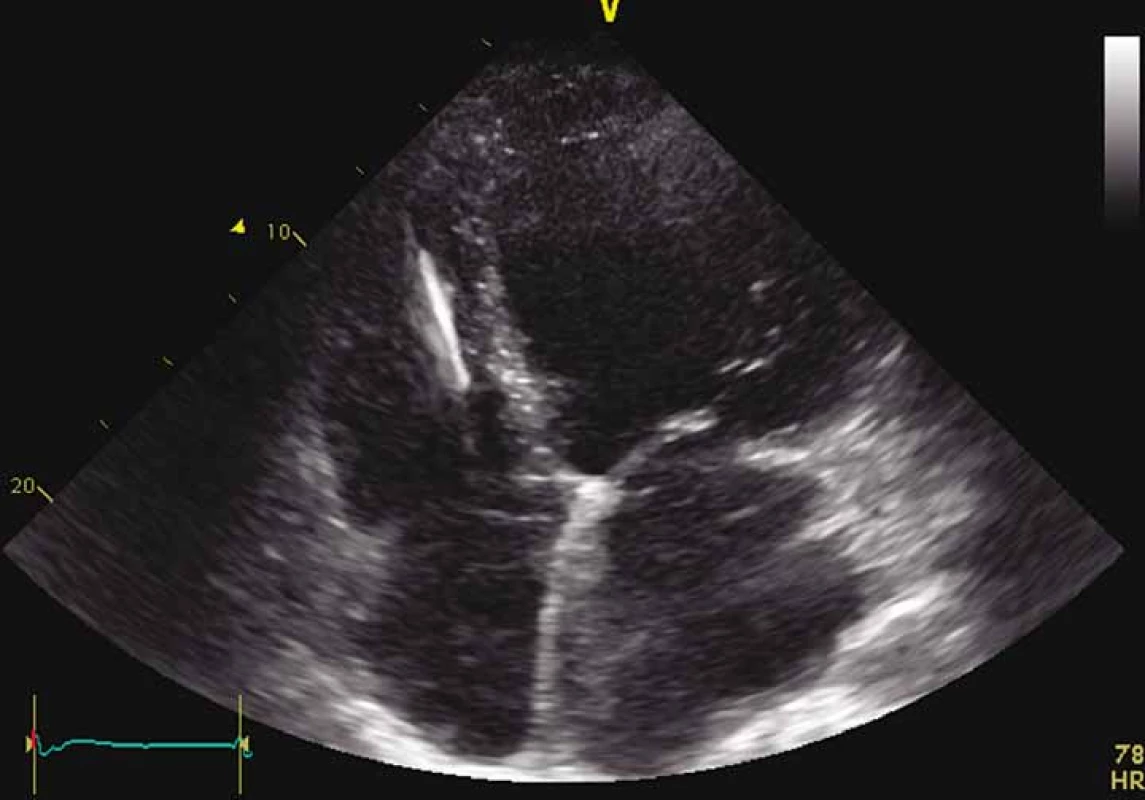
Pro příznivý klinický vývoj kardiálního stavu byl proveden pokus o vysazení dobutaminu. Dne 17. 5. 2018 dochází k rozvoji břišního dyskomfortu. Při ranních odběrech se zvýšila urea na 8,1 mmol/ l, kreatinin na 153 µmol/ l, byla mírná elevace jaterních enzymů a CRP: AST 0,95 µkat/ l, ALT 1,03 µkat/ l, GGT 4,39 µkat/ l, CRP 22,5 mg/ l. Avšak při večerních odběrech došlo k dramatickému nárůstu jaterních testů i CRP: AST 36,28 µkat/ l, ALT 28,53 µkat/ l, GGT 4,11 µkat/ l, CRP 51,4 mg/ l. Chirurgem byla vyloučena náhlá příhoda břišní. Hodnoty krevního tlaku se snižovaly ze 107/ 76 mm Hg na 97/ 72 mm Hg, naopak tepová frekvence (TF) narůstala z 112/ min na 125/ min a dále na 140/ min. Následně byl do medikace vrácen dobutamin, stav však progredoval do šoku s centralizací oběhu.
Pacient byl svezen na naši koronární jednotku, kdy byly nasazeny vasopresory, při kterých byl nadále systolický TK pod 90 mm Hg, dechová frekvence více než 30/ min, saturace pod 90 %. Byl kontaktován kardiochirurg ohledně překladu k zavedení veno-arteriální mimotělní membránové oxygenace (V-A ECMO) (obr. 3). Byl zaveden vstup do arteria brachialis lat. dx., provedena sedace, následně orotracheální intubace a nastavena umělá plicní ventilace (OTI/ UPV), dále kanylace v. jugularis interna lat. dx.
Image 3. Schéma veno-arteriální mimotělní membránové oxygenace (V-A ECMO). Převzato z [4]. ![Schéma veno-arteriální mimotělní membránové oxygenace (V-A ECMO). Převzato z [4].](https://www.prolekare.cz/media/cache/resolve/media_object_image_small/media/image_pdf/4a67f3bd2e411bf24b40d7c2ca12cf2e.png)
Po intubaci však došlo k progresi oběhové nestability, bylo pokračováno v podávání dobutaminu, noradrenalin navyšován až na dávku 70 ml/ hod, byl přidán milrinone v dávce 1,5 ml/ hod, adrenalin v navyšující se dávce až do 10 ml/ hod a zavedena intraaortální balonková kontrapulzace (IABP) v režimu 1 : 1 před překladem na kardiochirurgii, kde již bylo k dispozici ECMO.
Ten den byl pacient přeložen na kardiochirurgii k implantaci V-A ECMO a v ten stejný den byla provedena OTS bikavální technikou.
Pro hypokontraktilitu obou komor transplantovaného srdce a při nutnosti vysoké katecholaminové podpory (adrenalin, dobutamin, noradrenalin, milrinone), bylo V-A ECMO z počátku ponecháno. Stav se postupně lepšil a pacient byl extubován po 42 hod. Do domácí péče byl propuštěn 25. potransplantační den.
V podstatě jedinou komplikací byla lymforea z pravého třísla, vytvořilo se prosáknutí okolo operační rány v třísle po zapojení intraaortální balonková kontrapulzace (intraaortic baloon pumping – IABP). O měsíc později už byla zjištěna lymfokéla. Vzhledem k rozsahu byla indikována chirurgická revize, která však proběhla bez komplikací.
Pacient byl dále bez potíží, biopticky opakovaně bez známek rejekce štěpu. Nadále je dispenzarizován na naší klinice, kam přichází k pravidelným kontrolním biopsiím a k úpravě imunosuprese. Dle poslední echokardiografie je EF LK kolem 60 %.
Diskuze
Na tomto případu je unikátní použití IABP, V-A ECMO a uskutečnění samotné OTS v tak krátkém časovém úseku a bez větších komplikací.
Na pracovišti I. interní kardioangiologické kliniky LF MU a FN u sv. Anny je k dispozici IABP. Principem IABP je inflace balónku v diastole a deflace v rané systole. Inflace způsobí vypuzení krve uvnitř aorty, což vede k nárůstu průtoku krve koronárními tepnami a zlepšení orgánové perfuze. Stav pacienta natolik progredoval, že IABP bylo použito k udržení oběhu při překladu pacienta na kardiochirurgii, kde již byla dostupná V-A ECMO a je mnohdy život zachraňující metodou v léčbě kardiogenního šoku. Celý systém může být napojen velmi rychle, a dát tak prostor k rozhodování o další terapii. V případě našeho pacienta se vlastně jednalo o jedinou možnost udržení cirkulace před OTS. Oba typy extrakorporální podpory nesou také riziko komplikací, které narůstá s dobou zapojení systému. Jedná se převážně o vaskulární, krvácivé či tromboembolické příhody, lokální komplikace v místě zavedení kanyl nebo infekce. Pro našeho pacienta se však našel vhodný dárce velmi brzy a samotná OTS proběhla do 24 hod od vzniku šokového stavu.
OTS přináší pacientům zlepšení prognózy a kvality života. Jsou schopni tolerovat fyzickou zátěž, netrpí dušností pro městnání v plicích, nepřibírají na váze pro retenci tekutin, přestanou mít potíže s otoky dolních končetin, přítomností ascitu či kongescí ve splanchniku. Podmínkou kvalitního potransplantačního života je samozřejmě naprostá compliance pacienta, tedy pravidelné užívání medikace a pravidelné kontroly lékařem.
Případ našeho pacienta také ukazuje vzájemnou spolupráci dvou pracovišť, a to jak naší kardiologické kliniky, tak kardiochirurgické. Obě pracoviště se nachází v jednom nemocničním areálu a úzce spolupracují, proto i v případě našeho pacienta nedošlo k časovým prodlevám mezi jednotlivými léčebnými kroky, které by mohly být fatální. Za poslední 3 roky bylo v Brně odtransplantováno 90 pacientů. Pacienti jsou po OTS nadále dispenzarizováni na naší klinice, a můžeme tak pozorovat změnu kvality života po OTS, nebo včas řešit případné komplikace.
Doručeno do redakce: 9. 9. 2019
Přijato po recenzi: 7. 10. 2019
MU Dr. Alžběta Trčková
Sources
1. Ponikowski P, Voors AA, Anker SD et al. 2016 ESC Guidelines for the diagnosis and treatment of acute and chronic heart failure The Task Force for the diagnosis and treatment of acute and chronic heart failure of the European Society of Cardiology (ESC). Developed with the special contribution of the Heart Failure Association (HFA) of the ESC. Eur Heart J 2016; 37(27): 2129–2200. doi: 10.1093/ eurheartj/ ehw128.
2. Ošťádal P., Bělohlávek J. ECMO Extrakorporální membránová oxygenace Praha: Maxdorf (2. vyd.) 2018.
3. Špinarová L, Špinar J, Vítovec J. Transplantace srdce. Vnitř Lék 2018; 64(9): 862–866.
4. Brodie D, Bacchetta M. Extracorporeal membrane oxygenation for ARDS in adults. N Engl J Med 2011; 365 : 1905–1914. doi: 10.1056/ NEJMct1103720.
Labels
Paediatric cardiology Internal medicine Cardiac surgery Cardiology
Article was published inCardiology Review

2019 Issue 4-
All articles in this issue
- Novinky v léčbě dyslipidemie
- Studie CAROLINA a její dopad pro klinickou praxi
- Management pacientů s asymptomatickými arytmiemi – zkrácený a komentovaný konsenzus Evropské asociace pro srdeční rytmus (EHRA)
- Indapamid není jen diuretikum
- Nitrendipin – moderní blokátor vápníkových kanálů
- Propafenon
- SGLT2 aneb když metformin nestačí – kazuistika
- Balónková kontrapulzace, ECMO a transplantace srdce v průběhu 24 hodin u pacienta v kardiogenním šoku
- Vzpomínka na prof. MU Dr. Vladislava Krutu, DrSc. dlouholetého přednostu Fyziologického ústavu MU Brno
- Cardiology Review
- Journal archive
- Current issue
- Online only
- About the journal
Most read in this issue- Indapamid není jen diuretikum
- Propafenon
- Novinky v léčbě dyslipidemie
- Management pacientů s asymptomatickými arytmiemi – zkrácený a komentovaný konsenzus Evropské asociace pro srdeční rytmus (EHRA)
Login#ADS_BOTTOM_SCRIPTS#Forgotten passwordEnter the email address that you registered with. We will send you instructions on how to set a new password.
- Career